一种干细胞外泌体及其在促进生发中的应用的制作方法
1.本发明属于干细胞技术领域,具体涉及一种干细胞外泌体及其在促进生发中的应用。
背景技术:
2.脱发是一种常见的且令人困扰的问题,它是由包括基因、激素、外伤和医源性事件等一系列复杂的原因造成的。在国际医学界,对脱发的原因有多种的解释,包括西方医学以及中国的中医理论,不论何种病因,其结果是一样的,那就是毛囊的萎缩与退化,萎缩退化的毛囊不参与机体循环,无法吸收周围头皮养分,毛发自然不再生长。
3.目前,对于脱发的彻底治疗普遍采用移植法,有以下3种类型:(1)异体干细胞移植;(2)自体干细胞移植;(3)原位组织再生。异体干细胞移植需要长期服用排异药物,自体干细胞移植难以规模培养并分化,原位组织再生是指采用药物存在于该患者损伤器官或组织原位的干细胞,和/或患者的血液来源或者骨髓来源干细胞,而不在体外培养诱导干细胞的增长或/和分化。研究发现,脱发患者的脱发区域的毛囊干细胞数量上没有损失,只是相比正常人来说,脱发区域的毛囊祖细胞数量表现的更为稀少,因此脱发的原因也可以解释为身体因素导致毛囊干细胞想毛囊祖细胞分化过程出现障碍,导致毛囊干细胞不能正常的分化为毛囊祖细胞,以至于毛囊重建受到抑制,从而导致脱发,如果能够刺激毛囊干细胞进行分化,那么就可以在脱发区域生出头发来。
4.专利cn 110184235 a公开了一种adsc外泌体及其制备方法与应用。所述adsc外泌体由人腹部脂肪组织提取的细胞经传代培养,提取其分泌的外泌体得到。虽然由脂肪组织提取的细胞制备的间充质干细胞对于激活毛囊细胞具有一定的作用,但由于脂肪来源的间充质干细胞带有脂肪细胞的多种特意分泌物,有些分泌物对于毛囊生发具有阻碍作用,虽然整体上是促进作用,但促进作用不大,远远达不到治疗脱发的效果。
技术实现要素:
5.本发明的目的在于提供一种干细胞外泌体及其在促进生发中的应用。
6.一种干细胞外泌体,所述干细胞外泌体由人脐带间充质干细胞经传代培养,提取其分泌的外泌体得到。
7.一种干细胞外泌体的制备方法,按照如下步骤进行:
8.(1)将人脐带间充质干细胞置于培养箱中,用dmem/f12培养液进行培养,直到细胞达65-75%融合时,改用无血清的饥饿培养液,培养10-15h;
9.(2)将无血清的饥饿培养液换为含有黄芪提取物的dmem/f12培养液,培养至细胞处于对数生长期,收集细胞培养上清液;
10.(3)将细胞培养上清液梯度离心,将离心所得的上清液用滤器过滤,得到人脐带间充质干细胞外泌体提取液。
11.所述黄芪提取物占dmem/f12培养液质量的的1-6%。
12.所述黄芪提取物的提取方法为:取黄芪剪碎,烘干,使含水量为10-20%;将烘干后的黄芪装入co2超临界萃取料罐中,加入携带剂,进行co2超临界萃取,萃取压力为15-30mpa,温度为50-70℃,co2的流量为20-30kg/h,提取制得黄芪提取物。
13.所述携带剂为乙醇、异丙醇或者石油醚。
14.人脐带间充质干细胞是以脐带组织块为原代,以dmem/f12培养基为基础,按原代培养密度1:(2-4)的比例进行传代培养,选择p2-p5代的人脐带间充质干细胞。
15.所述干细胞外泌体在治疗脱发中的应用,干细胞外泌体作为外涂抹液,涂抹脱发处。
16.所述干细胞外泌体在治疗脱发中的应用,干细胞外泌体植入患者体内。
17.所述植入方法为定点注射。
18.本发明的有益效果:本发明采用人脐带间充质干细胞制备干细胞外泌体,在培养过程中加入黄芪提取物,促进毛囊的生成,刺激毛囊干细胞进行分化,从而促进毛发的原位再生。
具体实施方式
19.下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进,这些都属于本发明的保护范围。
20.实施例1
21.干细胞外泌体的制备方法,按照如下步骤进行:
22.1)在无菌条件下取一根脐带,转移入50ml离心管中用生理盐水冲洗6遍,在无菌的培养皿中,去除被膜、血管,再用生理盐水冲洗去除血液和杂质,用虹膜剪将组织分离为0.5cm长的组织块,转移至1.5ml ep管内,用虹膜剪将ep管内的组织剪碎至糊状,加入等量dmem/f12基础培养基,直接将ep管内的糊状组织接种于培养瓶中,培养瓶中加入10ml已调整好ph值的含10%fbs的完全dmem/f12培养液,放入5%co2、37℃、饱和湿度的培养箱中静置于贴壁培养;脐带组织块培养后2周,待细胞长满瓶底,达到80%以上融合,吸除培养基,加入适量0.25%的胰酶,充分摇晃均匀,置于37℃培养箱中放置5分钟,发现细胞收缩,摇晃培养瓶有片状细胞脱落时,立即加入含10%血清的培养液12ml终止反应,用吸管吹打使细胞完全脱落,然后将细胞悬液移入离心管中,400
×
g离心10分钟,再加入生理盐水10ml,离心洗涤,反复3次后,计数活细胞,用完全培养基稀释,收集细胞进行冻存或继续传代培养。
23.2)传代培养通常采用专用细胞培养瓶,以dmem/f12培养基为基础,按原代培养密度1:3的比例进行传代培养。
24.3)将得到的p2-p5代的人脐带间充质干细胞置于37℃培养箱中,用dmem/f12培养液进行培养,直到细胞达70%融合时,改用无血清的饥饿培养液,培养14h,将无血清的饥饿培养液换为dmem/f12培养液,培养至细胞处于对数生长期,收集细胞培养上清液300g、10000g梯度离心80min,将离心所得上清液用0.22μm滤器过滤,得到人脐带间充质干细胞外泌体提取液。
25.实施例2
26.干细胞外泌体的制备方法,按照如下步骤进行:
27.1)在无菌条件下取一根脐带,转移入50ml离心管中用生理盐水冲洗6遍,在无菌的培养皿中,去除被膜、血管,再用生理盐水冲洗去除血液和杂质,用虹膜剪将组织分离为0.5cm长的组织块,转移至1.5ml ep管内,用虹膜剪将ep管内的组织剪碎至糊状,加入等量dmem/f12基础培养基,直接将ep管内的糊状组织接种于培养瓶中,培养瓶中加入10ml已调整好ph值的含10%fbs的完全dmem/f12培养液,放入5%co2、37℃、饱和湿度的培养箱中静置于贴壁培养;脐带组织块培养后2周,待细胞长满瓶底,达到80%以上融合,吸除培养基,加入适量0.25%的胰酶,充分摇晃均匀,置于37℃培养箱中放置5分钟,发现细胞收缩,摇晃培养瓶有片状细胞脱落时,立即加入含10%血清的培养液12ml终止反应,用吸管吹打使细胞完全脱落,然后将细胞悬液移入离心管中,400
×
g离心10分钟,再加入生理盐水10ml,离心洗涤,反复3次后,计数活细胞,用完全培养基稀释,收集细胞进行冻存或继续传代培养。
28.2)传代培养通常采用专用细胞培养瓶,以dmem/f12培养基为基础,按原代培养密度1:3的比例进行传代培养。
29.3)将得到的p2-p5代的人脐带间充质干细胞置于37℃培养箱中,用dmem/f12培养液进行培养,直到细胞达70%融合时,改用含有黄芪提取物的dmem/f12培养液,培养14h,将无血清的饥饿培养液换为dmem/f12培养液,培养至细胞处于对数生长期,收集细胞培养上清液300g、10000g梯度离心80min,将离心所得上清液用0.22μm滤器过滤,得到人脐带间充质干细胞外泌体提取液;所述黄芪提取物占dmem/f12培养液质量的的3%;所述黄芪提取物的提取方法为:取黄芪剪碎,烘干,使含水量为15%;将烘干后的黄芪装入co2超临界萃取料罐中,加入携带剂乙醇,进行co2超临界萃取,萃取压力为20mpa,温度为60℃,co2的流量为25kg/h,提取制得黄芪提取物。
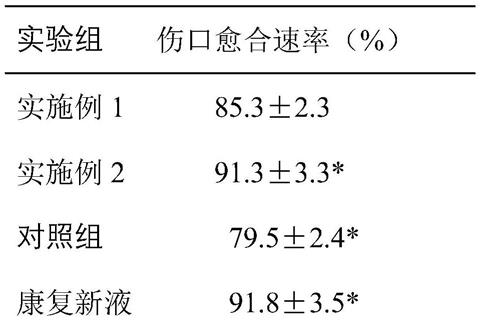
30.实验例1
31.参照专利cn 110184235 a公开的实验方法,实验小鼠选取昆明种雄性小鼠,首先建立皮肤全层皮肤损伤模型:称重,腹腔注射水合氯醛350mg/kg,使小鼠麻醉;小鼠背部毛发用剪毛剪去掉,露出裸露皮肤;在背部剪一个直径为1cm的圆形缺口损伤至皮肤真皮部位;手术后的小鼠皮下注射0.5ml糖生理盐水补充能量;将术后的小鼠置于取暖灯下保温。
32.在伤口分别涂抹等体积的康复新液,实施例1和实施例2制备的人脐带间充质干细胞外泌体提取液,生理盐水,用塑料透明软膜轻贴于伤口处,用马克笔画出伤口部位,用1cm(100格)计算当前的伤口面积。在0、3、7、14、21天拍照记录伤口愈合状态以及皮下血管生成情况。
33.按照下列公示计算伤口愈合速率:
34.伤口愈合速率(%)=(原伤口面积-现在伤口面积)/原伤口面积*100
35.实验结果见表1:
36.表1
[0037][0038]
注:*代表与实施例1组比较p《0.05。
[0039]
实验例2
[0040]
参照专利cn 110184235 a公开的实验方法,采用组织学he染色观察毛囊数量:
[0041]
(1)4%多聚甲醛溶液的配制
[0042]
4g多聚甲醛(em级)溶于100mlpbs,加入数滴氢氧化钠,水浴锅60℃加热使之溶解,冷却至室温,调整ph为7.4。
[0043]
(2)固定液的配置如表2:
[0044]
表2固定液的配置
[0045][0046]
(3)石蜡切片
[0047]
第12天先取5只小广口瓶分别标号空白对照组、实施例1处理组、实施例2处理组,加入适量的固定液。将3组小鼠分别取3只脱颈处死,用剪毛剪子剪去多余的毛,手术剪取损伤部位的皮肤,大约取面积为1平方厘米大小的皮肤组织,细致小心的处理多余的毛发。
[0048]
用大头针将皮肤固定在橡皮胶塞上,防止皮肤打卷。将处理之后的胶塞放入已经标号的对应的广口瓶中,进行固定,约24h,尽可能保持原有形态。
[0049]
洗去渗入组织内部的固定液,以防对以后染色造成干扰。冲洗液为70%的乙醇,直到组织去掉发黄为止。
[0050]
(约1天半)完全除去组织块的水分,适当的增强组织块的硬度。其步骤如下:70%乙醇、80%乙醇(35min)、95%乙醇ⅰ(20min)、95%乙醇ⅱ(20min)、无水乙醇(10min)、无水乙醇ⅱ(10min)
[0051]
乙醇和石蜡不能混合,需要经透明剂处理。过程如下:1:1无水乙醇与二甲苯(30min)、二甲苯ⅰ(30min)、二甲苯ⅱ(30min)
[0052]
去除组织中的透明剂,以便石蜡浸入整个组织。浸蜡依次为蜡杯ⅰ、蜡杯ⅱ、蜡杯ⅲ,时间为3h。
[0053]
把上一步的材料包埋到石蜡中,待石蜡的温度与皮肤温度差不多时即可以拿出蜡
块。
[0054]
将蜡块经过仔细修理后在切片机上,冠状切片,将其切成4μm的薄片,然后用毛笔尖轻轻托取蜡带,放在纸上备用。
[0055]
取一滴蛋白甘油滴在干净的载玻片上,用手指肚均匀用力涂抹,再滴几滴蒸馏水,然后把蜡带放在水上展开,此过程在展片台上进行,温度50℃。待完全展开后放入恒温箱烘干。
[0056]
(4)he染色
[0057]
脱蜡:
①
二甲苯ⅰ脱蜡10min;
②
二甲苯ⅱ脱蜡10min;
③
无水乙醇ⅰ洗去二甲苯5min;
④
无水乙醇ⅱ洗去二甲苯5min;
⑤
95%酒精5min;
⑥
85%酒精5min;
⑦
自来水洗片刻。
[0058]
染色:
①
苏木素染色20min左右;
②
自来水洗片刻;
③
.1%盐酸水分化3~5s;
④
氨水蓝化片刻;
⑤
伊红酒精染液浸染20min。
[0059]
脱水、透明、封固:
①
85%的酒精脱水5min;
②
95%的酒精5min;
③
无水乙醇ⅰ染5min;
④
无水乙醇ⅱ染色5min;
⑤
二甲苯ⅰ浸10min;
⑥
二甲苯ⅱ浸10min;
⑦
中性树胶封片。
[0060]
观察小鼠1平方厘米内毛囊数量,测试结果见表3。
[0061]
表3
[0062][0063]
注:*代表与实施例1组比较p《0.05。
[0064]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1