基于ICT和FRET机制的次氯酸荧光化学传感器及其合成方法和应用
基于ict和fret机制的次氯酸荧光化学传感器及其合成方法和应用
技术领域
1.本发明涉及化学传感器技术领域,具体涉及基于ict和fret机制的次氯酸荧光化学传感器及其合成方法和应用。
背景技术:
2.荧光分析技术已成为小分子检测的重要工具,但是实现特定目标的荧光分析很容易受到生物媒体中复杂微环境(例如,ph值的变化,盐的浓度,背景信号等)的干扰。因此,脱靶效应经常发生。此外,在测定系统中普遍存在的大量离子(如na
+
、zn
2+
、f-等)对测试体系也常常产生干扰作用,而传感和成像是通过探针-靶被动相互作用实现的,在时间和空间上精度都很差。
3.次氯酸盐(ocl-)作为家用漂白剂、游泳池和饮用水的消毒剂,在我们的日常生活中被广泛使用,作为一种强氧化性的活性氧(ros)物种,通常由骨髓过氧化物酶催化过氧化氢与氯离子生成,能维持细胞正常功能,在病理和生理过程中起着重要作用。然而,过量或错位的hclo会对组织造成严重损伤,导致各种疾病,如心血管疾病、神经元退行性病变、类风湿性关节炎,甚至癌症。此外,由于hclo在生物环境中具有反应性强、寿命短等特点,很难从其他浓度低、氧化能力强的ros中特异性检测到。因此,为了进一步研究hclo的作用,非常需要运用化学工具来合成一种能够高灵敏和高选择性的检测次氯酸的荧光传感器。此外,人们普遍认为,打开型荧光传感器优于关闭型传感器,因为后者更容易受到背景荧光的干扰,导致灵敏度和可靠性较低,而基于荧光共振能量转移(fret)机理的传感器由于其显著的特异性和荧光团选择的灵活而被广泛应用于比率或打开型荧光传感器的设计中。而fret的效率主要取决于能量受体的吸收光谱和能量供体的荧光发射光谱之间的重叠程度,这也是决定检测该类传感器灵敏度的一个重要因素。但是fret机理的传感器也存在一些缺陷,比如:荧光团强的自荧光和荧光团意外的共激发,这些缺陷都有可能会降低自身检测的灵敏度和可靠性。因此,需要继续探索新的能量供体和受体对,设计合成新型结构以提高fret机理传感器的检测性能。
4.目前,罗丹明b和萘酰亚胺衍生物因为良好的生物兼容性和良好的光稳定性,已成为构建新型荧光传感器的首选。设计合成罗丹明与萘酰亚胺的组合体,深入研究其分子结构与传感机理之间的关系,对于设计合成性能优异的传感器对于实际环境中次氯酸的检测具有重要意义。
技术实现要素:
5.基于上述技术问题,本发明将fret和ict机理相结合,萘酰亚胺(能量受体)和罗丹明b(能量供体)通过一个柔性的乙二胺间隔连接起来,以硼酸酯为hclo反应位点,利用硼酸酯的ict效应和fret过程协同作用的优点,从而实现对hclo的高灵敏检测。目的是提供基于ict和fret机制的次氯酸荧光化学传感器及其合成方法和应用。
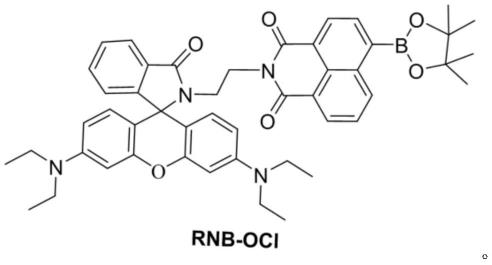
6.本发明保护基于ict和fret机制的次氯酸荧光化学传感器,其中,命名为rnb-ocl,其化学结构式如下所示:
[0007][0008]
本发明还保护基于ict和fret机制的次氯酸荧光化学传感器的合成方法,具体包括如下步骤:
[0009]
步骤1,化合物2的合成,将1mmol的罗丹明b溶解于10ml乙醇中,将0.5ml乙二胺逐滴添加到上述溶液中,并回流15h,直到溶液失去红色,旋蒸除去溶剂,向产物中加入20ml水并每次用10ml ch2cl2萃取,共萃取3次,合并有机层,水洗涤两次并用无水硫酸钠干燥,蒸除ch2cl2并真空中干燥,得白色固体为n-(罗丹明b)内酰胺基-乙二胺,产率68%,化合物2的m.p.224-225℃;1h nmr(600mhz,chloroform-d)δ7.89(s,1h),7.43(d,j=8.8hz,2h),7.08(s,1h),6.41(dd,j=8.9,1.2hz,2h),6.36(d,j=2.4hz,2h),6.26(d,j=8.9hz,2h),3.31(q,j=7.2hz,8h),3.17(t,j=6.7hz,2h),2.39(t,j=6.7hz,2h),1.15(t,j=7.1hz,12h);
13
c nmr(151mhz,chloroform-d)δ168.54,153.25,148.77,132.32,131.24,128.66,127.98,123.78,122.70,108.11,97.70,76.82,64.86,44.31,43.93,40.83,12.57;
[0010]
步骤2,化合物4的合成,将0.5mmol的4-溴-1,8-萘二酸酐,1.0mmol的双频哪醇硼酸酯,0.05mmol的pd(dppf)cl2和1.5mmol的无水醋酸钾加入到干燥的schlenk管中,用注射器加入5ml干燥的二氧六环,反应混合物在氩气保护下100℃反应8h;反应结束后冷却至室温后,将反应液倒入到20ml饱和食盐水中,然后用二氯甲烷萃取,蒸馏水洗涤,无水硫酸钠干燥,粗产品经硅胶柱层析分离得到黄色固体为4-频哪醇硼酸酯基-1,8-萘二酸酐,产率75.0%;
[0011]
步骤3,荧光化学传感器rnb-ocl的合成;将0.1mmol的化合物2和0.1mmol的化合物4加入到干燥的schlenk管中,用注射器加入5ml乙二醇单甲醚,反应混合物在氩气保护下搅拌回流18h;将混合物冷却至室温,加入20ml饱和食盐水,用ch2cl2萃取三次,有机层用无水硫酸镁mg2so4干燥,悬蒸出溶剂,粗产物经硅胶柱层析分离得到金黄色固体为荧光化学传感器rnb-ocl,产率62%。
[0012]
进一步的,所述步骤2和3硅胶柱层析分离中,二氯甲烷:石油醚=10:1,v/v。
[0013]
进一步的,所述化合物4的m.p.191-192℃;1h nmr(600mhz,chloroform-d)δ9.17(d,j=8.4hz,1h),8.52(d,j=25.4hz,2h),8.29(s,1h),7.81-7.76(m,1h),1.42(s,12h);
13
c nmr(151mhz,chloroform-d)δ160.6,160.5,136.4,136.0,135.3,132.9,131.8,129.8,127.5,120.6,118.5,84.8,83.4,25.0。
[0014]
进一步的,基于ict和fret机制的次氯酸荧光化学传感器的合成方法,具体包括如下步骤:
[0015]
步骤1,化合物2的合成,将1mmol的罗丹明b溶解于10ml乙醇中,将0.5ml乙二胺逐
滴添加到上述溶液中,并回流15h,直到溶液失去红色,旋蒸除去溶剂,向产物中加入20ml水并每次用10ml ch2cl2萃取,共萃取3次,合并有机层,水洗涤两次并用无水硫酸钠干燥,蒸除ch2cl2并真空中干燥,得白色固体为n-(罗丹明b)内酰胺基-乙二胺,产率68%;
[0016]
步骤2,化合物5的合成,将1.0mmol的化合物2和1mmol的罗丹明b溶解于15ml乙醇中;将混合物氮气保护下回流30h,并旋蒸除去乙醇,粗产品经硅胶柱层析纯化分离,得到橙黄色固体n-(罗丹明b)内酰胺基-n
’‑
(4-频哪醇硼酸酯-1,8-萘二酸酐基)乙二胺,产率79.2%;所述化合物5的m.p.278-280℃;1h nmr(600mhz,dmso-d6)δ8.48(d,j=8.3hz,1h),8.41(d,j=7.1hz,1h),8.19-8.12(m,2h),7.92(t,j=7.9hz,1h),7.82-7.78(m,1h),7.52-7.44(m,2h),6.91(dd,j=6.9,1.5hz,1h),6.16(dd,j=5.8,3.1hz,4h),5.81(dd,j=8.9,2.5hz,2h),4.18(t,j=5.6hz,2h),3.30(t,j=5.6hz,2h),3.08-2.96(m,8h),0.95(t,j=7.0hz,12h);
13
c nmr(151mhz,dmso-d6)δ168.21,163.41,163.29,153.74,153.07,148.25,133.05,132.70,131.63,131.59,131.23,130.97,130.13,129.26,129.05,128.83,128.68,128.49,124.23,122.64,108.15,105.30,97.45,43.86,12.85;
[0017]
步骤3,荧光化学传感器rnb-ocl的合成,将1.0mmol的化合物5;1.5mmol的双频哪醇硼酸酯;0.01mmol的pd(dppf)cl2和3.0mmol的无水醋酸钾溶解在25ml二氧六环中,反应混合物在氩气保护下回流36h,反应结束后,冷却至室温后,将反应液倒入到100ml饱和食盐水中,用二氯甲烷萃取3次,有机相用无水硫酸钠干燥,粗产品经硅胶柱层析分离得到金黄色固体为荧光化学传感器rnb-ocl,产率31%。
[0018]
进一步的,所述步骤2硅胶柱层析中,二氯甲烷:甲醇=40:1,v/v;所述步骤3硅胶柱层析分离中,二氯甲烷:石油醚=5:1,v/v。
[0019]
进一步的,所述荧光化学传感器rnb-ocl的m.p.155-157℃;1h nmr(600mhz,chloroform-d)δ9.03(d,j=9.4hz,1h),8.44(d,j=7.2hz,1h),8.40(d,j=7.2hz,1h),8.21(d,j=7.4hz,1h),7.94(d,j=7.6hz,1h),7.70-7.66(m,1h),7.43-7.35(m,2h),6.98(d,j=7.4hz,1h),6.37(d,j=9.0hz,2h),6.25(d,j=2.6hz,2h),5.80(dd,j=9.0,2.6hz,2h),4.33(t,j=5.8hz,2h),3.52(t,j=5.8hz,2h),3.10-3.02(m,8h),1.44(s,12h),1.04(t,j=7.2hz,12h);
13
cnmr(151mhz,chloroform-d)δ168.8,164.0,163.9,153.4,148.3,135.6,134.3,133.3,132.1,130.7,130.4,129.2,128.8,128.7,127.8,126.8,126.7,125.1,123.8,123.0,122.9,107.8,105.7,97.7,97.7,44.1,39.4,38.9,29.7,25.0,12.6。
[0020]
本发明还保护基于ict和fret机制的次氯酸荧光化学传感器的应用,上述荧光化学传感器rnb-ocl用于对hclo的识别。
[0021]
进一步的,所述荧光化学传感器rnb-ocl对hclo的识别,hclo浓度为1~20μm,检出限为1.36nm。
[0022]
相比于现有的技术,本发明具有如下有益效果:
[0023]
本发明的荧光化学传感器rnb-ocl对hclo的检测,具有荧光背景低、灵敏度高和特异性好等优点。硼酸酯通过ict过程,有效地抑制了rnb-ocl荧光发射,在hclo存在下选择性地恢复,实现对hclo的检测。此外,由于“ict+fret”协同作用,rnb-ocl对hclo的识别具有很高的灵敏度。在1~20μm范围内,rnb-ocl荧光强度与hclo浓度呈良好的线性关系(r2=0.99647),检出限为1.36nm。基于双重机理协同作用设计传感器的方法,为构建高灵敏荧光传感器提供了更广阔的平台。
附图说明
[0024]
图1为本发明荧光化学传感器rnb-ocl的化学结构式;
[0025]
图2为本发明荧光化学传感器rnb-ocl合成流程图;
[0026]
图3为本发明荧光化学传感器rnb-ocl对hclo可能的识别机理;
[0027]
图4为rnb-ocl和rnb-oh优化后基态和激发态的能量和分子轨道;
[0028]
图5为rnb-ocl和hclo混合物的高分辨质谱图;
[0029]
图6为rnb-ocl在dmso/h2o体系中的紫外吸收光谱和加入hclo后紫外吸收光谱;
[0030]
图7为rnb-clo在dmso/h2o体系(a),加入h2o2(b),hclo(c)和在(b)中加入hclo(d)的荧光光谱;
[0031]
图8为rnb-ocl在dmso/h2o体系中未加入和加入5倍当量hclo的荧光强度随时间的变化关系图;
[0032]
图9为rnb-ocl对不同分析物的选择性荧光响应图;
[0033]
图10为rnb-ocl分别加入不同分析物后的荧光强度,以及在干扰物存在条件下加入hclo后体系的荧光强度图;
[0034]
图11为rnb-ocl中加入在不同浓度的naclo的荧光光谱;
[0035]
图12为rnb-ocl在553nm处荧光强度随hclo浓度变化的线性关系;
[0036]
图13为化合物21h nmr谱(cdcl3);
[0037]
图14为化合物2
13
c nmr谱(cdcl3);
[0038]
图15为化合物41h nmr谱(cdcl3);
[0039]
图16为化合物4
13
c nmr谱(cdcl3);
[0040]
图17为化合物51h nmr谱(dmso-d6);
[0041]
图18为化合物5
13
c nmr谱(dmso-d6);
[0042]
图19为rnb-ocl1h nmr谱(cdcl3);
[0043]
图20为rnb-ocl
13
c nmr谱(cdcl3);
[0044]
图21为rnb-ocl的hrms谱。
[0045]
其中,附图6中插图为为rnb-clo和加入hclo后溶液的颜色;附图7中插图为插入的图片为365nm紫外灯下rnb-clo和加入hclo后溶液的颜色。
具体实施方式
[0046]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0047]
实施例1
[0048]
基于ict和fret机制的次氯酸荧光化学传感器,其中,命名为rnb-ocl,其化学结构式(详见附图1):
[0049]
上述基于ict和fret机制的次氯酸荧光化学传感器的合成方法,具体包括如下步骤:
[0050]
步骤1,化合物2的合成,将0.48g,1mmol的罗丹明b溶解于10ml乙醇中,将0.5ml乙
二胺逐滴添加到上述溶液中,并回流15h,直到溶液失去红色,旋蒸除去溶剂,向产物中加入20ml水并每次用10ml ch2cl2萃取,共萃取3次,合并有机层,水洗涤两次并用无水硫酸钠干燥,蒸除ch2cl2并真空中干燥,得白色固体为n-(罗丹明b)内酰胺基-乙二胺,产率68%,其中,化合物2的m.p.224-225℃;1h nmr(600mhz,chloroform-d)δ7.89(s,1h),7.43(d,j=8.8hz,2h),7.08(s,1h),6.41(dd,j=8.9,1.2hz,2h),6.36(d,j=2.4hz,2h),6.26(d,j=8.9hz,2h),3.31(q,j=7.2hz,8h),3.17(t,j=6.7hz,2h),2.39(t,j=6.7hz,2h),1.15(t,j=7.1hz,12h);
13
c nmr(151mhz,chloroform-d)δ168.54,153.25,148.77,132.32,131.24,128.66,127.98,123.78,122.70,108.11,97.70,76.82,64.86,44.31,43.93,40.83,12.57;
[0051]
步骤2,化合物4的合成,将138mg,0.5mmol的4-溴-1,8-萘二酸酐,254mg,1.0mmol的双频哪醇硼酸酯,36mg,0.05mmol的pd(dppf)cl2和1.5mmol的无水醋酸钾加入到干燥的schlenk管中,用注射器加入5ml干燥的二氧六环,反应混合物在氩气保护下100℃反应8h;反应结束后冷却至室温后,将反应液倒入到20ml饱和食盐水中,然后用二氯甲烷萃取,蒸馏水洗涤,无水硫酸钠干燥,粗产品经硅胶柱层析分离(二氯甲烷:石油醚=10:1,v/v)得到黄色固体为4-频哪醇硼酸酯基-1,8-萘二酸酐,产率75.0%;其中,化合物4的m.p.191-192℃;1h nmr(600mhz,chloroform-d)δ9.17(d,j=8.4hz,1h),8.52(d,j=25.4hz,2h),8.29(s,1h),7.81-7.76(m,1h),1.42(s,12h);
13
c nmr(151mhz,chloroform-d)δ160.6,160.5,136.4,136.0,135.3,132.9,131.8,129.8,127.5,120.6,118.5,84.8,83.4,25.0;
[0052]
步骤3,荧光化学传感器rnb-ocl的合成;将0.1mmol的化合物2和0.1mmol的化合物4加入到干燥的schlenk管中,用注射器加入5ml乙二醇单甲醚,反应混合物在氩气保护下搅拌回流18h;将混合物冷却至室温,加入20ml饱和食盐水,用ch2cl2萃取三次,有机层用无水硫酸镁mg2so4干燥,悬蒸出溶剂,粗产物经硅胶柱层析分离(二氯甲烷:石油醚=10:1,v/v)得到金黄色固体为荧光化学传感器rnb-ocl,产率62%;其中,所述荧光化学传感器rnb-ocl的m.p.155-157℃;1h nmr(600mhz,chloroform-d)δ9.03(d,j=9.4hz,1h),8.44(d,j=7.2hz,1h),8.40(d,j=7.2hz,1h),8.21(d,j=7.4hz,1h),7.94(d,j=7.6hz,1h),7.70-7.66(m,1h),7.43-7.35(m,2h),6.98(d,j=7.4hz,1h),6.37(d,j=9.0hz,2h),6.25(d,j=2.6hz,2h),5.80(dd,j=9.0,2.6hz,2h),4.33(t,j=5.8hz,2h),3.52(t,j=5.8hz,2h),3.10-3.02(m,8h),1.44(s,12h),1.04(t,j=7.2hz,12h).
13
cnmr(151mhz,chloroform-d)δ168.8,164.0,163.9,153.4,148.3,135.6,134.3,133.3,132.1,130.7,130.4,129.2,128.8,128.7,127.8,126.8,126.7,125.1,123.8,123.0,122.9,107.8,105.7,97.7,97.7,44.1,39.4,38.9,29.7,25.0,12.6。
[0053]
基于ict和fret机制的次氯酸荧光化学传感器的应用,上述荧光化学传感器rnb-ocl用于对hclo的识别。其中,hclo浓度为1~20μm,检出限为1.36nm。
[0054]
实施例2
[0055]
基于ict和fret机制的次氯酸荧光化学传感器,其中,命名为rnb-ocl,其化学结构式(详见附图1):
[0056]
上述基于ict和fret机制的次氯酸荧光化学传感器的合成方法,具体包括如下步骤:
[0057]
步骤1,化合物2的合成,将0.48g,1mmol的罗丹明b溶解于10ml乙醇中,将0.5ml乙二胺逐滴添加到上述溶液中,并回流15h,直到溶液失去红色,旋蒸除去溶剂,向产物中加入
20ml水并每次用10ml ch2cl2萃取,共萃取3次,合并有机层,水洗涤两次并用无水硫酸钠干燥,蒸除ch2cl2并真空中干燥,得白色固体为n-(罗丹明b)内酰胺基-乙二胺,产率68%;其中,化合物2的m.p.224-225℃;1h nmr(600mhz,chloroform-d)δ7.89(s,1h),7.43(d,j=8.8hz,2h),7.08(s,1h),6.41(dd,j=8.9,1.2hz,2h),6.36(d,j=2.4hz,2h),6.26(d,j=8.9hz,2h),3.31(q,j=7.2hz,8h),3.17(t,j=6.7hz,2h),2.39(t,j=6.7hz,2h),1.15(t,j=7.1hz,12h);
13
c nmr(151mhz,chloroform-d)δ168.54,153.25,148.77,132.32,131.24,128.66,127.98,123.78,122.70,108.11,97.70,76.82,64.86,44.31,43.93,40.83,12.57;
[0058]
步骤2,化合物5的合成,将276mg,1.0mmol的化合物2和486mg,1mmol的罗丹明b溶解于15ml乙醇中;将混合物氮气保护下回流30h,并旋蒸除去乙醇,粗产品经硅胶柱层析纯化分离(二氯甲烷:甲醇=40:1,v/v),得到橙黄色固体n-(罗丹明b)内酰胺基-n
’‑
(4-频哪醇硼酸酯-1,8-萘二酸酐基)乙二胺,产率79.2%;所述化合物5的m.p.278-280℃;1h nmr(600mhz,dmso-d6)δ8.48(d,j=8.3hz,1h),8.41(d,j=7.1hz,1h),8.19-8.12(m,2h),7.92(t,j=7.9hz,1h),7.82-7.78(m,1h),7.52-7.44(m,2h),6.91(dd,j=6.9,1.5hz,1h),6.16(dd,j=5.8,3.1hz,4h),5.81(dd,j=8.9,2.5hz,2h),4.18(t,j=5.6hz,2h),3.30(t,j=5.6hz,2h),3.08-2.96(m,8h),0.95(t,j=7.0hz,12h);
13
c nmr(151mhz,dmso-d6)δ168.21,163.41,163.29,153.74,153.07,148.25,133.05,132.70,131.63,131.59,131.23,130.97,130.13,129.26,129.05,128.83,128.68,128.49,124.23,122.64,108.15,105.30,97.45,43.86,12.85;
[0059]
步骤3,荧光化学传感器rnb-ocl的合成,将742mg,1.0mmol的化合物5;381mg,1.5mmol的双频哪醇硼酸酯;74mg,0.01mmol的pd(dppf)cl2和294mg,3.0mmol的无水醋酸钾溶解在25ml二氧六环中,反应混合物在氩气保护下回流36h,反应结束后,冷却至室温后,将反应液倒入到100ml饱和食盐水中,用二氯甲烷萃取3次,有机相用无水硫酸钠干燥,粗产品经硅胶柱层析分离(二氯甲烷:石油醚=5:1,v/v)得到245.0mg金黄色固体为荧光化学传感器rnb-ocl,产率31%;其中,所述荧光化学传感器rnb-ocl的m.p.155-157℃;1h nmr(600mhz,chloroform-d)δ9.03(d,j=9.4hz,1h),8.44(d,j=7.2hz,1h),8.40(d,j=7.2hz,1h),8.21(d,j=7.4hz,1h),7.94(d,j=7.6hz,1h),7.70-7.66(m,1h),7.43-7.35(m,2h),6.98(d,j=7.4hz,1h),6.37(d,j=9.0hz,2h),6.25(d,j=2.6hz,2h),5.80(dd,j=9.0,2.6hz,2h),4.33(t,j=5.8hz,2h),3.52(t,j=5.8hz,2h),3.10-3.02(m,8h),1.44(s,12h),1.04(t,j=7.2hz,12h);
13
cnmr(151mhz,chloroform-d)δ168.8,164.0,163.9,153.4,148.3,135.6,134.3,133.3,132.1,130.7,130.4,129.2,128.8,128.7,127.8,126.8,126.7,125.1,123.8,123.0,122.9,107.8,105.7,97.7,97.7,44.1,39.4,38.9,29.7,25.0,12.6。
[0060]
基于ict和fret机制的次氯酸荧光化学传感器的应用,上述荧光化学传感器rnb-ocl用于对hclo的识别。其中,hclo浓度为1~20μm,检出限为1.36nm。
[0061]
实施例3
[0062]
1.前期准备
[0063]
(1)实验仪器
[0064]
核磁共振仪:varian mercury plus-600cdcl3,dmso-d6,作为溶剂,tms做内标。
[0065]
高分辨质谱:thermo scientific q exactive,赛默飞世尔公司。
[0066]
紫外可见分光光度计:tu-1901,北京普析通用仪器有限责任公司。
[0067]
荧光分光光度计:horiba fluoromax-4。
[0068]
熔点测定仪:xt-4显微熔点仪,使用前温度未校正。
[0069]
ph酸度计:上海雷磁phs-3c ph酸度计。
[0070]
(2)实验试剂
[0071]
罗丹明b和4-溴-1,8-萘二甲酸酐购自安耐吉试剂公司,双联频哪醇硼酸酯购于北京伊诺凯试剂公司。次氯酸钠五水合物购于上海韶远试剂有限公司。
[0072]
二甲亚砜(dmso)为色谱纯,购于百灵威试剂公司。
[0073]
其它溶剂和试剂均为分析纯,未纯化直接使用。
[0074]
蒸馏水通过实验室仪器离子交换色谱法自制。
[0075]
(3)各种测试溶液的准备
[0076]
在dmso中制备rnb-ocl(2.0
×
10-3
m)储备液。所有的光谱测量都在室温下,在dmso/h2o(4/1,v/v)溶剂体系中进行测试。
[0077]
不同种类的ros溶液:叔丁基自由基(
·
otbu)由tbhp和fe
2+
反应得到;h2o2(1.0
×
10-2
m)溶液由30%h2o2浓溶液稀释得到;250μm的fe
2+
和2.5μm h2o2反应产生羟基自由基
·
oh;单线态氧(1o2)由clo-和h2o2反应制备;将ko2溶解在dmso溶液中制备过氧化物离子(o
2-);过氧化亚硝酸根(onoo-);通过nano2(0.6m)、h2o2(0.7m,1.5ml)、hcl(0.6m,1.5ml)和naoh(1.5m,3.0ml)在室温下反应来制备;其他各种离子(1.0
×
10-2
m)(f-,cl-,br-,i-,ch3coo-,po
43-,hpo
42-,s2o
32-,so
32-,co
32-,hco
3-,no
3-,no
2-,so
42-,s
2-,scn-,hso
3-,clo
4-,clo
3-)均在二次蒸馏水中配制,实验过程中的hclo由naclo提供。
[0078]
(4)理论计算
[0079]
rnb-ocl和rnb-oh的所有的计算都使用高斯09程序完成,计算过程中采用b3lyp/6-311g
+
(d,p)基组,通过密度泛函理论(dft)分别对rnb-ocl和rnb-oh的基态结构进行频率分析,以确保优化得到的结构是一个真正的最小值。用同样的基组和方法,采用含时密度泛函理论(td-dft)在优化的基态结构基础上进行激发态计算,研究了他们的能量最小的几何构型、激发能、振子强度。以dmso为溶剂,采用可极化连续介质模型(pcm)模拟溶剂效应。
[0080]
2.荧光化学传感器rnb-ocl的合成动机及可能传感机理
[0081]
2.1荧光化学传感器rnb-ocl的合成动机
[0082]
目前,可用于传感器的荧光团种类繁多,我们选择萘酰亚胺荧光团作为能量受体。由于其量子产率高,光稳定性好,分子的ict效应可以通过4号位取代基轻松改变。此外,考虑到萘二酰亚胺母核结构具有高的荧光量子效率和广泛的发光范围,可以有效的抑制能量供体的荧光发射。罗丹明b被选为能量供体,基于罗丹明b特殊的性质。首先,它的荧光发射光谱与萘酰亚胺的吸收光谱能够很好的匹配。其次,其优异的光物理性质,已成为新型荧光传感器设计的首选。基于以上考虑,我们将fret和ict机理相结合,设计了一种新型的传感器rnb-ocl。我们将两个高量子产率的荧光团结合,以期得到的分子电子供体和电子受体分别在最高占据分子轨道(homo)和最低未占据分子轨道(lumo),利用fret机理降低传感器的背景荧光进而提高其检测灵敏度。同时,利用硼酸酯的“ict”效应“关闭”传感器rnb-ocl的荧光发射。当rnb-ocl和hclo作用后,分子内的ict过程打开,rnb-ocl的荧光发射恢复,从而实现对hclo的检测。
[0083]
2.2荧光化学传感器rnb-ocl的可能传感机理
[0084]
为了阐明附图3所提出的传感机理,传感器homo和lumo轨道的性质很难通过实验测量,而dft和td-dft计算能够提供很好的精度。因此,采用基于b3lyp/6-311g(d,p)水平的密度泛函理论(dft)方法对rnb-ocl的分子结构进行了优化。在基态优化结构的基础上,利用含时密度泛函理论(td-dft)方法对激发态进行了计算。优化的几何结构中,homo和lumo轨道电子分布及对应的能级如附图4所示,传感器rnb-ocl与hclo反应前后,homo-1和lumo轨道上的电子在基态主要分布在供体罗丹明b上,激发态主要分布在受体萘酰亚胺上。计算结果证实了罗丹明b和萘酰亚胺两个荧光团之间存在弱的能量转移过程。这种弱的fret过程能够减小传感器的背景荧光,在提高检测灵敏度中起着关键作用。传感器rnb-ocl被激发后,一个电子从homo轨道跃迁至lumo轨道上。从表1可知,轨道的主要贡献主要来自s4→
s0,振子强度f=0.2974,轨道贡献率为97.4%。跃迁能(3.71ev)和基态(6.48ev)相比有大幅度的减小,说明频哪醇硼酸酯部分被羟基取代后,分子内的ict过程打开。传感器rnb-ocl由原来的无荧光转变为强荧光,主要来自萘二酰亚胺内部的ict(homo-3
→
lumo)过程。该过程受罗丹明b的fret作用影响较小。
[0085]
表1rnb-ocl和rnb-oh理论计算的跃迁能量、激发态电荷转移轨道及其轨道贡献率、振子强度(f)和理论紫外吸收波长(nm)
[0086]
[0087][0088]
2.3荧光化学传感器rnb-ocl的可能传感机理结果分析
[0089]
罗丹明b内酰胺和硼酸酯都可作为hclo的响应位点。若以罗丹明b内酰胺为识别位点,将发生典型的氧化水解反应过程。反应后内酰胺环将打开或者酰胺键断裂,在此情况下都会观察到罗丹明b的特征吸收峰(553nm左右)和发射峰(580nm左右)。从选择性实验结果分析,rnb-ocl的溶液并未观察到罗丹明b发射峰,溶液也没有出现紫色,说明传感器rnb-ocl的识别发生在萘二酰亚胺部分。因此,推测rnb-ocl对hclo的识别机理可能如附图3,为了证实推测,将rnb-ocl和hclo的混合物用hrms进行了分析。结果如附图5所示,在hclo存在条件下,存在预期产物rnb-oh[m+h]
+
(m/z 681.3064)峰。上述实验结果说明我们推测的hclo识别机理是合理的。
[0090]
3.rnb-ocl性能研究实验
[0091]
3.1荧光化学传感器rnb-ocl的光谱性质
[0092]
附图6所示,荧光传感器rnb-ocl(10μm)在dmso/h2o(4/1,v/v)体系中的紫外吸收光谱和加入hclo(50μm)后紫外吸收光谱,插入的图片为rnb-clo和加入hclo后溶液的颜色;rnb-ocl的紫外吸收峰在325nm左右,这是由于罗丹明b酰肼螺环处于关闭状态。当萘二酰亚胺部分的硼酸酯被hclo氧化-水解成为羟基后,325nm左右吸收峰减弱,ict过程打开,在
470nm处出现一个新的吸收峰。553nm处荧光发射强度也明显增强。说明传感器rnb-ocl可以“off-on”检测hclo。加入h2o2后荧光强度有微弱的增强,说明硼酸酯和h2o2反应很缓慢。继续加入hclo,荧光强度和直接加入hclo时接近,说明h2o2的存在并不影响rnb-ocl对hclo的检测(详见附图7)。在365nm手持紫外灯照射下,由附图7的插图可以看出,溶液的颜色由浅黄色变成亮黄色;图中,荧光传感器rnb-clo(10μm)在dmso/h2o(4/1,v/v)体系(a),加入h2o2(150μm)(b),hclo(50μm)(c)和在(b)中加入hclo(50μm)(d)的荧光光谱,插入的图片为365nm紫外灯下rnb-clo和加入hclo后溶液的颜色。
[0093]
3.2荧光化学传感器rnb-ocl对hclo的识别性能研究
[0094]
室温下,在dmso/h2o(4/1,v/v)测试体系中考察了传感器rnb-ocl(10μm)的光稳定性及加入hclo(50μm)后的动力学。如附图8所示,在0~5分钟内,rnb-ocl的荧光强度基本保持不变,说明传感器rnb-ocl具有高的光稳定性。加入naclo后,荧光强度逐渐增强,在10min内基本达到峰值。实验过程中为了使传感器rnb-ocl和hclo完全作用,所有测试都在室温放置15分钟后进行,其中,λex=470nm,λem=553nm,狭缝ex/em=2.5/2.0nm。
[0095]
为评价rnb-ocl传感器对hclo的分析性能,探讨了其在dmso/h2o(v/v,4/1)溶液中的对hclo特异性。如附图9所示,图中,荧光化学传感器rnb-ocl(10μm)对不同分析物(1.0
×
10-2
m)(f-,cl-,br-,i-,ch3coo-,po
43-,hpo
42-,s2o
32-,so
32-,co
32-,hco
3-,no
3-,no
2-,so
42-,s
2-,scn-,hso
3-,clo
4-,clo
3-)的选择性荧光响应(λex=470nm,狭缝ex/em=2.5/2.0nm),只有加入hclo的溶液荧光增强。553nm处的荧光强度(f/f0)增加了约273倍,而其他生物相关阴离子(f-、i-、no
3-、no
2-等)和活性氧物种(onoo-、h2o2、
·
oh、
·
otbu等)均未产生明显的光谱响应。结果表明,传感器rnb-ocl对hclo具有高的选择性;附图10中,荧光化学传感器rnb-ocl(10μm)分别加入不同分析物(100μm)后的荧光强度,以及在干扰物存在条件下加入hclo(50μm)后体系的荧光强度,λex=470nm,λem=553nm,狭缝ex/em=2.5/2.0nm。
[0096]
此外,抗干扰性能是衡量一个优秀传感器的另外一个重要指标,因此,在含5倍当量naclo的rnb-ocl溶液中加入10倍当量的其它相关分析物,然后测试553nm处的比荧光强度(f/f0)。详见附图11的结果说明,rnb-ocl对hclo的响应不受其它相关分析物的干扰,特别是能与芳基硼酸酯发生反应的分析物(如:h2o2和onoo-等)不会对hclo的检测产生明显的干扰作用。说明rnb-ocl对hclo的识别具有高度的特异性;λex=470nm,λem=553nm,狭缝ex/em=2.5/2.0nm。
[0097]
在优化的条件下,评价传感器rnb-ocl对hclo定量分析的性能。如附图12所示,在0~25μm范围内,随着hclo浓度的增加,rnb-ocl的荧光发射在550nm处逐渐增强。在1~20μm范围内,rnb-ocl荧光强度与hclo浓度呈良好的线性关系(r2=0.99647),根据检测限(lod)计算公式:lod=3σ/k(其中σ为未添加hclo时rnb-ocl的荧光强度变化的标准偏差,k为直线斜率),计算得到rnb-ocl对hclo的检出限为1.36nm,可用于实际样品中低浓度hclo的定量检测。总之,利用“fret+ict”复合机理的协同作用设计传感器的方法对提高hclo的检测灵敏度有很好的帮助。
[0098]
3.3荧光化学传感器rnb-ocl用于实际水样中hclo的检测
[0099]
为了进一步验证该传感器的实用性,我们以黄河水、实验室自来水和84种消毒剂(超市购买)进行了加标次氯酸盐回收试验,评价了荧光分析方法的精密度和准确度。黄河水在检测前经过滤纸过滤处理。在三种水样中加入一定体积的次氯酸钠溶液,用上述荧光
分析方法测定水样中次氯酸钠浓度。结果如表2所示,次氯酸钠的回收率在98.2~101.1%的范围内,说明传感器rnb-ocl可以成功地检测复杂样品中的次氯酸的浓度。
[0100]
表2在实际水样加标测试hclo(n=3)
[0101][0102]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1