一种生产β-胡萝卜素的菌株及其应用的制作方法
一种生产
β-胡萝卜素的菌株及其应用
技术领域
1.本发明涉及生物技术领域,尤其涉及一种生产β-胡萝卜素的菌株及其应用。
背景技术:
2.β-胡萝卜素有各种顺反不同的立体构型。顺式异构体有抗癌和抗衰老生物学特征,其含量越高功效就越强,化学合成β-胡萝卜素时由于缺乏像生物合成形成异构体的种种机制而均为全反式构型。所以天然β-胡萝卜素具有更高的营养保健价值和安全性,而从植物中提取的β-胡萝卜素,会受到产品原料、气候,运输条件的制约,成本高,产量较低。因此,为满足市场对bc 日益增长的需求,同时解决工业生产对环境造成的压力,利用合成生物学结合代谢工程、发酵工程等交叉学科为bc的环境友好型、高效合成提供新思路。王瑞钊等(高产β-胡萝卜素酿酒酵母菌株的设计与构建)通过在delta 位点整合红法夫酵母来源的β-胡萝卜素合成基因(crte、crti、crtyb),构建β-胡萝卜素生产菌库,以其中β-胡萝卜素产量最高的菌为出发菌,敲除该菌株内源基因ypl062w的同时,在此位点过表达thmg1和bts1-erg20融合蛋白以增加前体供应,最终使β-胡萝卜素的产量提高1.65倍,达到 162.1mg/l;张祺珮(高产类胡萝卜素巴斯德毕赤酵母表达宿主菌的构建) 通过构建ppiczαa-idi-crte-crtyb-crti和ppiczαa-idi-crte-crtyb-crti-crts-crt 重组载体并转化到gs115菌株中,分别筛选得到一株能够在细胞内高效合成β-胡萝卜素的重组菌gs115-caro(培养72h后其β-胡萝卜素产量为 28mg/g细胞干重)和一株产虾青素的菌株;中国专利cn103865817a提供了一种产β-胡萝卜素的重组菌的构建方法,将来源于红法夫酵母的crte、 crti和crtyb,来源于酿酒酵母的上述基因上游的启动子,以及来源于酿酒酵母的上述基因下游的终止子共转化至酿酒酵母中,产量达到6mg/gdcw。
3.采用酿酒酵母生产类胡萝卜素面临的主要瓶颈是异戊二烯类化合物的前体异戊烯焦磷酸酯的天然合成途径,限制β-胡萝卜素产量的提高。鉴于上述原因,本发明人积极加以研究创新,以期通过生物合成方法构建高效生产β-胡萝卜素的菌株,使其更具有产业上的利用价值,为生物合成类胡萝卜素产业提供理论与实践参考。
技术实现要素:
4.为解决上述技术问题,本发明提供了一种生产β-胡萝卜素的菌株,以酿酒酵母cen.pk102为出发菌株,构建了β-胡萝卜合成途径,过表达酿酒酵母内源维生素a合成前体异戊二烯焦磷酸的甲羟戊酸(mva)途径,以此提高β-胡萝卜素的产量。
5.本发明的第一个目的是提供一种生产β-胡萝卜素的菌株,该菌株表达β
ꢀ‑
胡萝卜素合成基因,过表达甲羟戊酸途径相关基因,以及敲除乙酰辅酶a 代谢相关基因;
6.β-胡萝卜素合成基因为编码香叶基香叶基二磷酸合酶的基因crte、编码八氢番茄红素合酶的基因crtb、编码八氢番茄红素去饱和酶的基因crti和编码番茄红素环化酶的基因crtyb;
7.甲羟戊酸途径相关基因为编码3-羟基-3-甲基戊二酰辅酶a还原酶的基因thmg1、
编码异戊烯基焦磷酸异构酶的基因idi和编码法尼基焦磷酸合酶的基因erg20;
8.乙酰辅酶a代谢相关基因为编码苹果酸合酶的基因mls1。
9.进一步地,上述生产β-胡萝卜素的菌株还下调角鲨烯合成途径相关基因的表达,角鲨烯合成途径相关基因为编码角鲨烯合酶的基因erg9。
10.进一步地,上述生产β-胡萝卜素的菌株还过表达内质网大小调节因子相关基因ino2、编码脂肪酸去饱和酶的基因ole1。
11.进一步地,上述生产β-胡萝卜素的菌株还过表达编码香叶基香叶基二磷酸合酶的基因crte、编码八氢番茄红素去饱和酶的基因crti和编码番茄红素环化酶的基因crtyb,具体地,多拷贝表达crte、crti和crtyb。
12.上文提到,采用酿酒酵母生产类胡萝卜素面临的主要瓶颈是异戊二烯类化合物的前体异戊烯焦磷酸酯的天然合成途径,即甲羟戊酸(mva)途径受到严格的代谢调控、外源类胡萝卜素合成途径相关限速酶表达量低以及酿酒酵母自身对脂类物质的储存能力有限。本发明通过:
13.(1)引入外源基因香叶基香叶基二磷酸合酶(ggpp合酶,crte)、八氢番茄红素合酶(crtb)、八氢番茄红素去饱和酶(crti)、番茄红素环化酶(crtyb),在酵母细胞中构建β-胡萝卜合成途径,摇瓶发酵产量达到74.05mg/l;
14.(2)有效强化萜类合成的前体物质供给,平衡内源前体物质合成路径与异源路径通量,上调酿酒酵母内源mva路径关键基因thmg1、idi、erg20,提高五碳前体ipp和dmapp到ggpp的代谢通量;敲除mls1基因,通过敲除乙醛酸循环中参与乙酰辅酶a的关键基因,减少乙酰辅酶a的消耗,从而增加mva途径中底物乙酰辅酶a的合成,摇瓶发酵产量达到 530.67mg/l;
15.(3)强化内质网大小调节因子相关基因ino2、脂肪酸去饱和酶ole1,最大程度在酿酒酵母中积累亲脂性产物β-胡萝卜素;下调erg9,弱化内源 fpp竞争途径,减少角鲨烯合成途径对前体物质的分流,摇瓶发酵产量达到 900.77mg/l;
16.(4)多拷贝外源类胡萝卜素合成途径限速酶crte、crti、crtyb提高目的产物β-胡萝卜素的合成与积累,摇瓶发酵产量达到1535.35mg/l。
17.进一步地,上述生产β-胡萝卜素的菌株以酿酒酵母cen.pk102为宿主,以py26-cre为表达载体。酿酒酵母cen.pk102可适应不同的环境条件,成本较低,且具有较快的生长速度,在工业规模上可以减少生产时间;酵母为单细胞生物,发酵容易控制,菌体无毒,常作为多种化学品、功能营养品的生产菌株。
18.进一步地,编码香叶基香叶基二磷酸合酶的基因crte来源于曼地亚红豆杉,编码八氢番茄红素合酶的基因crtb来源于成团泛菌,编码八氢番茄红素去饱和酶的基因crti来源于三孢布拉氏霉菌,编码番茄红素环化酶的基因crtyb来源于红法夫酵母。
19.进一步地,编码香叶基香叶基二磷酸合酶的基因crte的核苷酸序列如 seq id no.1所示。
20.进一步地,编码八氢番茄红素合酶的基因crtb的核苷酸序列如seq idno.2所示。
21.进一步地,编码八氢番茄红素去饱和酶的基因crti的核苷酸序列如seqid no.3所示。
22.进一步地,编码番茄红素环化酶的基因crtyb的核苷酸序列如seq idno.4所示。
23.进一步地,编码3-羟基-3-甲基戊二酰辅酶a还原酶的基因thmg1的核苷酸序列如seq id no.5所示。
24.进一步地,编码异戊烯基焦磷酸异构酶的基因idi的核苷酸序列如seqid no.6所示。
25.进一步地,编码法尼基焦磷酸合酶的基因erg20的核苷酸序列如seqid no.7所示。
26.进一步地,编码苹果酸合酶的基因mls1的核苷酸序列如seq id no.8 所示。
27.进一步地,编码角鲨烯合酶的基因erg9的核苷酸序列如seq id no.9 所示。
28.进一步地,编码内质网大小调节因子相关基因ino2的核苷酸序列如 seq id no.10所示。
29.进一步地,编码脂肪酸去饱和酶的基因ole1的核苷酸序列如seq idno.11所示。
30.本发明的第二个目的是提供上述生产β-胡萝卜素的菌株的构建方法,包括以下步骤:
31.构建crte和crti的融合基因、crtb和crtyb的融合基因、thmg1和idi 和融合基因、thmg1和erg20的融合基因、ino2和ole1的融合基因,多拷贝表达crte、crti和crtyb,将上述融合基因和多拷贝基因插入py26-cre 载体,转化入敲低erg9和敲除mls1的酿酒酵母cen.pk102中,构建得到上述生产β-胡萝卜素的菌株。
32.上述菌株的构建方法具体包括以下步骤:
33.s1、在上述菌株中构建β-胡萝卜合成途径:
34.构建融合基因106a-u-t
adh1-crte-p
gal10-crti-t
aoxi-106a-d,插入 py26-cre表达载体中,得到重组质粒δ106a-t
adh1-crte-p
gal10-crti-t
aoxi
;
35.构建融合基因805a-u-p
gal7-crtb-t
aox1-p
gal1-crtyb-t
cyc1-805a-d,插入py26-cre表达载体中,得到重组质粒δ805a-p
gal7-crtb-t
aox1-p
gal1
‑ꢀ
crtyb-t
cyc1
;
36.将上述重组质粒δ106a-t
adh1-crte-p
gal10-crti-t
aoxi
和重组质粒δ805a
‑ꢀ
p
gal7-crtb-t
aox1-p
gal1-crtyb-t
cyc1
转化入宿主中;
37.s2、过表达维生素a合成前体异戊二烯焦磷酸的甲羟戊酸(mva)途径并敲除乙酰辅酶a代谢相关基因:
38.构建融合基因mls1-u-p
gpd-thmg1-t
adh1-p
tef1-idi-t
aox1-mls1-d,插入py26-cre表达载体中,得到重组质粒δmls1-p
gpd-thmg1-t
adh1
‑ꢀ
p
tef1-idi-t
aox1
;
39.构建融合基因1622b-u-p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1-1622b
ꢀ‑
d,插入py26-cre表达载体中,得到重组质粒δ1622b
‑ꢀ
p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1
;
40.将上述重组质粒δmls1-p
gpd-thmg1-t
adh1-p
tef1-idi-t
aox1
和重组质粒δ1622b-p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1
转入宿主中,得到生产β
‑ꢀ
胡萝卜素的菌株。
41.进一步地,上述构建方法中,在步骤s2之前或之后还包括以下至少一个步骤:
42.(1)构建融合基因208a-u-p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1-208a-d,插入py26-cre表达载体中,得到重组质粒δ208a-p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1
,转入宿主中;
43.(2)构建融合基因erg9-u-phxt
1-erg9-t
aox1-erg9-d,插入 py26-cre表达载体中,得到重组质粒δerg9-u-phxt
1-erg9-t
aox1
,转入宿主中;
44.(3)构建融合基因416d-u-t
adh1-crte-p
gal10-crti-t
cyc1-416d-d,插入 py26-cre表
达载体中,得到重组质粒416d-u-t
adh1-crte-p
gal10-crti-t
cyc1
‑ꢀ
416d-d;
45.构建融合基因720a-u-p
gal7-crtyb-t
aox1-720a-d,插入py26-cre表达载体中,得到重组质粒720a-u-p
gal7-crtyb-t
aox1-720a-d;
46.将重组质粒416d-u-t
adh1-crte-p
gal10-crti-t
cyc1-416d-d和重组质粒 720a-u-p
gal7-crtyb-t
aox1-720a-d转入宿主中。
47.本发明的第三个目的是提供一种生产β-胡萝卜素的方法,采用上述菌株发酵生产β-胡萝卜素。
48.进一步地,以乙酰辅酶a为底物。
49.进一步地,发酵的条件为30-35℃,200-220rpm,接种量为1-5%,发酵时间为12-120h。
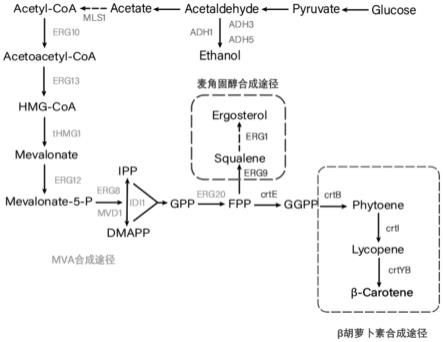
50.本发明提供的生产β-胡萝卜素的菌株在生物、制药、食品或化工领域内的应用均有巨大潜力,如用于制备β-胡萝卜素或含有β-胡萝卜素的产品、制备目的蛋白等。
51.借由上述方案,本发明至少具有以下优点:
52.本发明以酿酒酵母cen.pk102为出发菌株,通过构建并强化外源mva 途径,使得产量提高了6.17倍,达到530.67mg/l;通过提高酿酒酵母对脂类物质的储存能力、弱化内源fpp竞争途径,减少角鲨烯合成途径对前体物质的分流,使产量提高了0.7倍,达到900.77mg/l;通过过表达外源类胡萝卜素关键基因,使得产量提高了0.7倍,达到1535.35mg/l。解决了合成β-胡萝卜途径中前体异戊烯焦磷酸酯受到严格的代谢调控导致前体匮乏以及外源类胡萝卜素合成途径相关限速酶表达量低的问题。
53.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
54.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
55.图1为β-胡萝卜素的生产路径示意图;
56.图2为摇瓶发酵中不同重组菌β胡萝卜素产量变化图。
具体实施方式
57.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
58.下述实施例中所涉及的材料与方法如下:
59.(1)培养基:
60.种子培养基的成分包括:10g/l酵母膏、20g/l蛋白胨和20g/l葡萄糖。
61.发酵培养基的成分包括:25g/l葡萄糖、25g/l甘油、50g/l大豆蛋白胨、0.6g/l磷酸氢二钾、25g/l蔗糖,另外在发酵培养基中还需要加入十二烷,其中发酵培养基与十二烷的比例是1:1。
62.sdtrp平板:ynb培养基6.7g/l,葡萄糖20g/l,l-亮氨酸50mg/l, l-组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
63.sdleu平板:ynb培养基6.7g/l,葡萄糖20g/l,l-色氨酸50mg/l, l-组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
64.sdtrpleu平板:ynb培养基6.7g/l,葡萄糖20g/l,l-组氨酸50mg/l,尿嘧啶50mg/l,琼脂粉20g/l。
65.ypd固体平板:1%酵母粉,2%蛋白胨,2%葡萄糖,1.5%琼脂粉。
66.(2)β-胡萝卜素萃取剂:使用乙酸乙酯进行胞内产物的萃取,使用十二烷进行胞外产物的萃取。
67.(3)发酵液处理:将发酵96h的酿酒酵母菌液在12000r/min条件下离心10min,吸取上清十二烷过膜后装于液相瓶进行胞外产物的测定;离心后收集菌体,用与发酵液同体积的灭菌超纯水水洗两次,吸取600ul水洗后的重悬菌液和600ul的乙酸乙酯加入到含有玻璃珠放入破碎管中,使用破壁机进行酵母细胞的破碎,涡旋振荡提取15min后,此时胞内产物基本溶于乙酸乙酯中,12000r/min离心10min,吸取上清过膜后装于液相瓶中,进行胞内产物的测定。
68.(4)hplc检测β-胡萝卜产量:采用agilent zorbax eclipsexdb-c18 分离柱(5μm,250
×
4.6mm),检测的温度在40℃,流动相使用乙腈:甲醇:异丙醇=5:3:2,流速为1ml/min,检测波长450nm,进样量10μl。
69.(5)菌株生长情况检测:使用紫外-可见分光光度计定时测定发酵液的吸光光度值od600。
70.实施例1重组菌c1的构建
71.基于酿酒酵母表达的偏好性,人工合成基因片段香叶基香叶基二磷酸合酶(ggpp合酶,crte)、八氢番茄红素合酶(crtb)、八氢番茄红素去饱和酶(crti)、番茄红素环化酶(crtyb)和β-胡萝卜素15,15
′‑
单加氧酶(bcmo),其中来源于曼地亚红豆杉(taxus x media)的crte,来源于成团泛菌(pantoeaagglomerans)的crtb,来源于三孢布拉氏霉菌(blakeslea trispora)的crti,来源于红法夫酵母(xanthophyllomyces dendrorhous)的crtyb在酿酒酵母中表达量较高,更利于合成β-胡萝卜素。
72.具体构建过程如下:
73.(1)人工合成基因片段t
adh1-crte-p
gal10-crti—t
aoxi
,以酿酒酵母 by4741基因组为模板,采用引物106a-u-f、106a-u-r扩增得到基因106a-u,采用引物106a-d-f、106a-d-r扩增得到基因106a-d,以pmhylp-trp质粒为模板,使用引物loxt-1f、loxt-1r扩增得到loxt-1基因片段。
74.(2)将步骤(1)中获得的三个基因片段t
adh1-crte-p
gal10-crti
‑‑
t
aoxi
、 106a-u和106a-d进行重叠延伸pcr,pcr条件为98℃,5min预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段106a-u
ꢀ‑
t
adh1-crte-p
gal10-crti
‑‑
t
aoxi-106a-d基因片段。
75.(3)制备酿酒酵母工程菌感受态,并将构建好的融合基因片段106a-u
ꢀ‑
t
adh1-crte-p
gal10-crti
‑‑
t
aoxi-106a-d转化进入酿酒酵母cen.pk102菌株的感受态中,涂布在sdtrp平板上,30℃培养2-3天,使用引物v-ei-1f、 v-ei-1r进行菌落pcr验证得到菌株。
76.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,
于30℃培养2-3天。将长出的单菌落分别在sdura、sdtrp、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ106a-t
adh1-crte-p
gal10
‑ꢀ
crti
‑‑
t
aoxi
,命名为酿酒酵母重组菌c1。
77.引物序列:
78.106a-u-f:aagagggtctgtccagcgaata
79.106a-u-r:cccggatcgtcggttgtgccttcgagcgtcccaaacct
80.106a-d-f:cactggccgtcgttttacaatggtcaaacttcagaactaaaaaaataataaggaagaaaaa
81.106a-d-r:tccaagtgatttcctttccttcccat
82.loxt-1f:aggtatagcatgaggtcgctccaggaaacagctatgaccatgattacgc
83.loxt-1r:gcactggccgtcgttttacaacttcagaactaaaaaaataataaggaagaaaaa
84.v-ei-1f:cagagcatgtagtatgggac
85.v-ei-1r:caagaagtacggtgctgaat
86.实施例2重组菌c2的构建
87.具体构建过程如下:
88.(1)人工合成基因片段p
gal7-crtb-t
aox1-p
gal1-crtyb-t
cyc1
。以酿酒酵母by4741基因组为模板,采用引物805a-u-f、805a-u-r扩增得到基因 805a-u,采用引物805a-d-f、805a-d-r扩增得到基因805a-d,以 pmhylp-his质粒为模板,使用引物loxh-1f、loxh-1r扩增得到loxh-1基因片段。
89.(2)将步骤(1)中获得的三个基因片段p
gal7-crtb-t
aox1-p
gal1
‑ꢀ
crtyb-t
cyc1
、805a-u和805a-d进行重叠延伸pcr,pcr条件为98℃,5min 预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30 个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段805a-u-p
gal7-crtb-t
aox1-p
gal1-crtyb-t
cyc1-805a-d基因片段。
90.(3)制备酿酒酵母工程菌感受态,并将构建好的融合基因片段805a-u
ꢀ‑
p
gal7-crtb-t
aox1-p
gal1-crtyb-t
cyc1-805a-d转化进入到实施例1中酿酒酵母c1;菌株的感受态中,涂布在sdhis平板上,30℃培养2-3天,使用引物v-byb-1f、v-byb-1r进行菌落pcr验证得到菌株。
91.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdhis、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ805a-p
gal7-crtb-t
aox1-p
gal1
‑ꢀ
crtyb-t
cyc1
,命名为酿酒酵母重组菌c2。
92.引物序列:
93.805a-u-f:acgtccagccactggact
94.805a-u-r:atcttaagggtgaagacaaatatgtgaggtccttttggaaagctatacttcgga
95.805ad-f:aggctttaatttgcggcctggatataatcactaaataaagtagattttccttgggt
96.805a-d-r:ttagttttgctggggtggtaattaaattcaag
97.loxh-1f:aggctttaatttgcggcccaggaaacagctatgaccatgattacgc
98.loxh-1r:ggcactggccgtcgttttattagttttgctggggtg
99.v-byb-1f:ggtgaagacagcttctttttccactat
100.v-byb-1r:aagacaatctacttctactccta
101.实施例3重组菌c3的构建
102.具体构建过程如下:
103.(1)人工合成基因片段p
gpd-thmg1-t
adh1-p
tef1-idi-t
aox1
,以酿酒酵母by4741基因组为模板,采用引物mls1-u-f、mls1-u-r扩增得到基因片段mls1-u,采用引物mls1-d-f、mls1-d-r扩增得到基因片段mls1-d,以质粒pmhylp-leu为模板,使用引物loxl-1f、loxl-1r扩增得到loxl-1 片段。
104.(2)将步骤(1)中的四个片段p
gpd-thmg1-t
adh1-p
tef1-idi-t
aox1
、 mls1-u、mls1-d、loxl-1进行重叠延伸pcr,pcr条件为98℃,5min 预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30 个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段mls1-u-p
gpd-thmg1-t
adh1-p
tef1-idi-t
aox1-mls1-d基因片段。
105.(3)将步骤(2)中得到的融合基因片段mls1-u-p
gpd-thmg1-t
adh1
‑ p
tef1-idi-t
aox1-mls1-d转化入实施例2制备得到的c2菌株的感受态中,涂布在sdleu平板上于30℃培养2-3天,使用引物v-ti-1f、v-ti-1r进行单菌落pcr验证得到菌株。
106.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdleu、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δmls1-p
gpd-thmg1-t
adh1
‑ p
tef1-idi-t
aox1
,命名为酿酒酵母重组菌c3。
107.引物序列:
108.mls1-u-f:ttccattgggccgatgaagttagtc
109.mls1-u-r:ttttgaactaaacaaagtagtaaaagcacataaaagaattaagaaa
110.mls1-d-f:cactggccgtcgttttaatctcccttgccccagtgt
111.mls1-d-r:ggtatcagttcgtttttgaataccttcggaa
112.loxl-1f:caggaaacagctatgaccatgattacgc
113.loxl-1r:taaaacgacggccagtgcctaatctcccttgccccagtgt
114.v-ti-1f:caaagcaatattatttagac
115.v-ti-1r:catctgctctgctcatggta
116.实施例4重组菌c4的构建
117.具体构建过程如下:
118.(1)人工合成基因片段p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1
,以酿酒酵母by4741基因组为模板,采用引物1622b-u-f、1622b-u-r扩增得到基因片段1622b-u,采用引物1622b-d-f、1622b-d-r扩增得到基因片段 1622b-d,以质粒pmhylp-trp为模板,使用引物loxt-2f、loxt-2r扩增得到loxt-2片段。
119.(2)将步骤(1)中的四个片段p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1
、1622b-u、1622b-d、loxt-2进行重叠延伸pcr,pcr条件为98℃,5min 预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30 个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段1622b-u-p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1-1622b-d基因片段。
120.(3)将步骤(2)中得到的融合基因片段1622b-u
‑ꢀ
p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1-1622b-d转化入实施例3制备得到的 c3菌株的感受态中,涂布在sdtrp平板上于30℃培养2-3天,使用引物 v-te-1f、v-te-1r进行单菌落pcr验证得到菌株。
121.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdtrp、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ1622b
‑ꢀ
p
gpd-thmg1-t
adh1-p
tef1-erg20-t
cyc1
,命名为酿酒酵母重组菌c4。
122.引物序列:
123.1622b-u-f:tgtcatttatagatacattgacaaggtaaataaagacatt
124.1622b-u-r:cagaaggtaacagcaaaaacaaatagttcac
125.1622b-d-f:tggaactttatgtcgcctggc
126.1622b-d-r:gatagaaataccatatctgtgttttaaattaaatttcatggaaataa
127.loxt-2f:caggaaacagctatgaccatgattacgc
128.loxt-2r:gcactggccgtcgttttacaatggaactttatg
129.v-te-1f:taaataaagtattggacataaa
130.v-te-1r:catctgatcgtactggtaatgtg
131.实施例5重组菌c5的构建
132.具体构建过程如下:
133.(1)人工合成基因片段p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1
,以酿酒酵母by4741基因组为模板,采用引物208a-u-f、208a-u-r扩增得到基因片段208a-u,采用引物208a-d-f、208a-d-r扩增得到基因片段208a-d,以质粒pmhylp-his为模板,使用引物loxh-2f、loxh-2r扩增得到loxh-2片段。
134.(2)将步骤(1)中的四个p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1
、208a-u、 208a-d、loxh-2进行重叠延伸pcr,pcr条件为98℃,5min预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段208a-u
‑ꢀ
p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1-208a-d基因片段。
135.(3)将步骤(2)中得到的融合基因片段208a-u
‑ꢀ
p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1-208a-d转化入实施例4制备得到的c4 菌株的感受态中,涂布在sdhis平板上于30℃培养2-3天,使用引物v-io-1f、 v-io-1r进行单菌落pcr验证得到菌株。
136.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdhis、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ208a-p
gpd-ino2-t
adh1-p
tef1-ole1-t
cyc1
,命名为酿酒酵母重组菌c5。
137.引物序列:
138.208a-u-f:tggcattttttatatattgtaacattagggttctgttac
139.208a-u-r:tgccaatagggaccatacacac
140.208a-d-f:tgggcattttctaaacttgtagtttatgtgc
141.208ab-d-r:ccaacaggttggcaaaccagaatg
142.loxh-2f:ttaagtggactacctttgacgccaggaaacagctatgaccatgattacgc
143.loxh-2r:cactggccgtcgttttacaaaacgacggccagtgcca
144.v-io-1f:tctttgaaagaattgctactg
145.v-io-1r:cgttgggtagatacgttgacac
146.实施例6重组菌c6的构建
147.具体构建过程如下:
148.(1)人工合成基因片段phxt
1-erg9-t
aox1
,以酿酒酵母by4741基因组为模板,采用引物erg9-u-f、erg9-u-r扩增得到基因片段erg9-u,采用引物erg9-d-f、erg9-d-r扩增得到基因片段erg9-d,以质粒 pmhylp-leu为模板,使用引物loxl-2f、loxl-2r扩增得到loxl-2片段。
149.(2)将步骤(1)中的四个片段phxt
1-erg9-t
aox1
、erg9-u、erg9-r、 loxl-2进行重叠延伸pcr,pcr条件为98℃,5min预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段erg9-u
‑ꢀ
phxt
1-erg9-t
aox1-erg9-d基因片段。
150.(3)将步骤(2)中得到的融合基因片段erg9-u-phxt
1-erg9-t
aox1
‑ꢀ
erg9-d转化入实施例5制备得到的c5菌株的感受态中,涂布在sdleu 平板上于30℃培养2-3天,使用引物v-e9-1f、v-e9-1r进行单菌落pcr 验证得到菌株。
151.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdleu、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δerg9-u-phxt
1-erg9-t
aox1
,命名为酿酒酵母重组菌c6。
152.引物序列:
153.erg9-u-f:aaaagtgcagctcagagccc
154.erg9-u-r:acgtcacatatcacacacacacagtaaatgtccacttaa
155.erg9-d-f:tgctttctcaggtaagtctgcgccaaataacataaacaaacaa
156.erg9-d-r:ttgggctgaatgatagtgataattcttttttctatca
157.loxl-2f:gcagtggtagtagcattagtgccaggaaacagctatgaccatgattacgc
158.loxl-2r:taaaacgacggccagtgccacggccaactca
159.v-e9-1f:tggcactagcgttggtatttt
160.v-e9-1f:ccaagccatgttgtctcttac
161.实施例7重组菌c7的构建
162.具体构建过程如下:
163.(1)人工合成基因片段t
adh1-crte-p
gal10-crti
‑‑
t
cyc1
。以酿酒酵母by4741基因组为模板,采用引物416d-u-f、416d-u-r扩增得到基因416d-u,采用引物416d-d-f、416d-d-r扩增得到基因416d-d,以pmhylp-trp质粒为模板,使用引物loxt-3f、loxt-3r扩增得到loxt-3基因片段。
164.(2)将步骤(1)中获得的三个基因片段t
adh1-crte-p
gal10-crti
‑‑
t
cyc1
、 416d-u和
416d-d进行重叠延伸pcr,pcr条件为98℃,5min预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段416d-u
‑ꢀ
t
adh1-crte-p
gal10-crti
‑‑
t
cyc1-416d-d基因片段。
165.(3)制备酿酒酵母工程菌感受态,并将构建好的融合基因片段416d-u
ꢀ‑
t
adh1-crte-p
gal10-crti
‑‑
t
cyc1-416d-d转化进入到实施例6中酿酒酵母c6 菌株的感受态中,涂布在sdtrp平板上,30℃培养2-3天,使用引物v-ei-2f、 v-ei-2r进行菌落pcr验证得到菌株。
166.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdtrp、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ416d-t
adh1-crte-p
gal10
‑ꢀ
crti
‑‑
t
cyc1
,命名为酿酒酵母重组菌c7。
167.引物序列
168.416d-u-f:gtaaagataatgctaaatcatttggctttttgattgat
169.416d-u-r:gagatccgtttaaccggaccccttcgagcgtcccaaaaccttc
170.416d-d-f:gacggccagtgccggtccactgtgtgcc
171.416d-d-r:atgtggatatgctttgcgcagtt
172.loxt-3f:caggaaacagctatgaccatgattacgc
173.loxt-3r:ttgtaaaacgacggccagtgc
174.v-ei-2f:ttctgactgggttggaaggcaa
175.v-ei-2r:gtattttttttgagaatcttgcaac
176.实施例8重组菌c8的构建
177.具体构建过程如下:
178.(1)人工合成基因片段p
gal7-crtyb-t
aox1
,以酿酒酵母by4741基因组为模板,采用引物720a-u-f、720a-u-r扩增得到基因720a-u,采用引物720a-d-f、720a-d-r扩增得到基因720a-d,以pmhylp-leu质粒为模板,使用引物loxl-3f、loxl-3r扩增得到loxl-3基因片段。
179.(2)将步骤(1)中获得的三个基因片段p
gal7-crtyb-t
aox1
、720a-u 和720a-d进行重叠延伸pcr,pcr条件为98℃,5min预变性,然后98℃,变性10s,55℃,退火5s,7℃,延伸2min,共计30个循环,1%的琼脂糖凝胶电泳验证正确后,切胶回收片段,得到融合基因片段720a-u-p
gal7
‑ꢀ
crtyb-t
aox1-720a-d基因片段。
180.(3)将步骤(2)中得到的融合基因片段720a-u-p
gal7-crtyb-t
aox1
‑ꢀ
720a-d转化入实施例7制备得到的c7菌株的感受态中,涂布在sdleu平板上于30℃培养2-3天,使用引物v-yb-2f、v-yb-2r进行单菌落pcr验证得到菌株。
181.(4)将步骤(3)得到的菌株制备成感受态,转化入py26-cre质粒,在sdura平板上于30℃培养2-3天,取单菌落接入ypd培养基内培养15-24 h,划线于含有5-foa的ypd平板上,于30℃培养2-3天。将长出的单菌落分别在sdura、sdleu、ypd固体平板上进行点板验证,仅在ypd培养基上生长的单菌落为正确的酿酒酵母菌株δ720a-p
gal7-crtyb-t
aox1
,命名为酿酒酵母重组菌c8。
182.引物序列:
183.720a-u-f:taaacaaatgttgaaaacttcttcgaacgtaaat
184.720a-u-r:tgttactgttgattgttcgtttatttgtataattgagtttaca
185.720a-d-f:tgggtaattagggccaagagagt
186.720a-d-r:tatcaatgtctttttctttacttatttgtctttgctc
187.loxl-3f:aggtatagcatgaggtcgctccaggaaacagctatgaccatgattacgc
188.loxl-3r:taaaacgacggccagtgcctggaactttatgtcgcctggtgggtaatt
189.v-yb-2f:ttactcgagtaccattatgacg
190.v-yb-2r:aaaattttgtcttctccatt
191.实施例9摇瓶发酵
192.具体步骤如下:
193.(1)培养基的配制
194.种子培养基的成分包括:10g/l酵母膏、20g/l蛋白胨和20g/l葡萄糖。
195.发酵培养基的成分包括:25g/l葡萄糖、25g/l甘油、50g/l大豆蛋白胨、0.6g/l磷酸氢二钾、25g/l蔗糖,另外在发酵培养基中还需要加入十二烷,其中发酵培养基与十二烷的比例是1:10。
196.(2)菌株发酵参数
197.分别将上述重组酿酒酵母菌株在30℃,220rpm条件下培养16~24h,制备得到种子液,将制备得到的种子液按2%(v/v)的接种量接种于装有25 ml发酵培养基和25ml十二烷的250ml锥形瓶,在30℃,220rpm条件下培养96h,制备得到发酵液。
198.(3)计算重组菌β-胡萝卜素的产量:
199.重组菌株的产量包括两部分,一部分是细胞内含有产物的产量,另一部分是分泌到细胞外的产物含量,对于脂溶性的β-胡萝卜素来说,绝大部分产物在存在于胞内,一少部分产物会萃取到上层有机相十二烷中。
200.将发酵96h的酿酒酵母菌液在12000r/min条件下离心10min,吸取上清十二烷过膜后装于液相瓶进行胞外产物的测定;离心后收集菌体,用与发酵液同体积的灭菌超纯水水洗两次,吸取600ul水洗后的重悬菌液和600ul 的乙酸乙酯加入到含有玻璃珠放入破碎管中,使用破壁机进行酵母细胞的破碎,涡旋振荡提取15min后,此时胞内产物基本溶于乙酸乙酯中,12000r/min 离心10min,吸取上清过膜后装于液相瓶中,进行胞内产物的测定。通过与β-胡萝卜素标品峰面积进行换算得出工程菌株的发酵产量。将吸净十二烷的发酵液重悬,吸取发酵液稀释100倍后使用紫外分光光度计测量od
600
。
201.结果如表1所示,过表达thmg1、idi、erg20、ino2、ole1、crte、 crti、crtyb基因,敲除mls1基因,下调erg9基因,菌株β-胡萝卜素的产量达到1535.35mg/l,od
600
达到107.75。
202.表1不同重组菌的产量及od
600
[0203][0204][0205]
对比例1替换crti来源
[0206]
将来源于blakeslea trispora的crti基因,替换为pantoea.agglomerans来源,替换后c2重组菌的β-胡萝卜素产量从74.05mg/l降至41.74mg/l。
[0207]
表2不同来源的c2重组菌的β-胡萝卜素产量及od
600
[0208][0209]
由上述数据可以看出,采用blakeslea trispora来源的crti基因菌体量和产量有所增加,更有利于酿酒酵母合成类胡萝卜素。
[0210]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1