四氢异喹啉类化合物的制作方法
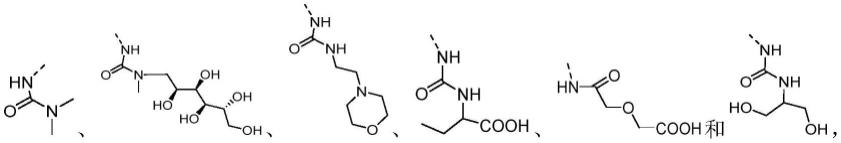
1.本发明属于药物化学领域,具体地,本发明涉及式(ⅰ)所示化合物及其药效上可接受的盐。
背景技术:
2.磷酸盐是一种调节信号转导、能量产生、矿物质代谢等多种代谢过程的重要矿物质,主要在小肠中被吸收,并经肾脏过滤,随后经肾小管被重吸收或排泄。因此,尽管每日磷酸盐摄入量存在差异,血清磷酸盐浓度仍维持在一个生理范围内。慢性肾病(chronic kidney disease,ckd)晚期的患者,肾脏代谢磷功能基本丧失,导致出现高磷血症。据研究表明,高磷血症与ckd患者的多个不良临床结局相关,其中包括:诱导血管钙化,增加心血管疾病的发生率和死亡风险,继发性甲状旁腺功能亢进症,肾性骨营养不良导致代谢骨病、异位钙化,促进肾功能衰竭和心血管疾病的进展。
3.目前,高磷血症的主要治疗措施是低磷酸盐饮食、血液透析治疗和随餐服用磷酸盐结合剂类药物。临床经验表明,通过饮食控制磷酸盐摄入量,难度较大;血液透析的效率有限;所以使用磷酸盐结合剂类药物是当前降血磷的重要治疗手段。目前,临床常用的磷酸盐结合剂类药物主要有两类:含金属离子(钙/镁/铁/镧)的磷酸盐结合剂和离子交换树脂型结合剂(司维拉姆或碳酸司维拉姆)。前者含金属离子的磷酸盐结合剂,患者需加强对药物中金属离子的管理,且药物受ph影响磷结合效果较弱,易致腹泻,患者不耐受。后者通过离子交换结合磷,不被胃肠道吸收,减少积蓄,副作用比前者较少。但两者药物使用剂量大,价格高,患者依从性差。
4.目前已知,肠道对磷酸盐的吸收方式主要有两种:被动的细胞旁路运输和依赖转运蛋白的主动运输,而被动的细胞旁路的磷酸盐转运被认为是人体吸收磷酸盐的主要原因。细胞旁路的磷酸盐转运主要是由磷酸盐的浓度梯度驱动,由细胞间形成的紧密连接合物吸收,有文献表明,这种紧密连接的复合物经信号传导的调控对特定的离子具有渗透特异性。钠-氢质子交换器(sodium
–
hydrogen antiporter 3,nhe3/slc9a3)是一种胃肠道转运蛋白,表达在肠上皮细胞顶端,主要负责维持钠离子的平衡,通过抑制肠道的nhe3活性可以影响肠道的钠吸收,从而改变肠上皮细胞氢离子的浓度进而影响局部ph的变化;降低细胞间形成的紧密连接的复合物对磷酸盐的通透性,减少细胞旁路对磷酸盐的吸收。临床实践中,对于ckd晚期患者的血磷控的需求尚未满足,有必要进一步开发具有不同机制的降血磷药物。
5.我国上市的药物中,针对ckd患者高磷血症的诊断手段较为单一,因此,有必要进一步研发更有疗效和更加安全的降血清磷水平的药物。
技术实现要素:
6.在本发明的第一方面,本发明提出了式(i)所示化合物、其光学异构体及其药效上可接受的盐,
[0007][0008]
其中,r1选自h、c
1-6
烷基、c
3-6
环烷基和4-7元杂环烷基,所述c
1-6
烷基、c
3-6
环烷基或4-7元杂环烷基任选被1、2或3个r取代;
[0009]
r2、r3、r4、r5、r6分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基和c
1-6
杂烷基,所述c
1-6
烷基或c
1-6
杂烷基任选被1、2或3个r取代;
[0010]
t选自n和ch;
[0011]
环a选自5-6元杂芳基和5-6元杂芳基并5-6元杂环基,所述5-6元杂芳基或5-6元杂芳基并5-6元杂环基任选被1、2或3个r取代;
[0012]
n选自2和3;
[0013]
l1选自单键、-nh-、-n(ch3)
1-6-、3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-和3-6元杂环基-nh-,所述3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-或3-6元杂环基-nh-任选被1、2或3个r取代;
[0014]
l2选自所述任选被1、2或3个r取代;
[0015]
l3选自单键和所述任选被1、2或3个r取代;
[0016]
l4选自所述所述任选被1、2或3个r取代;
[0017]
x选自单键、o、n、nh、c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基和c
1-6
烷基-o-c
1-6
烷基,所述c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基或c
1-6
烷基-o-c
1-6
烷基任选被1、2、3或4个r取代;
[0018]
r分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基、c
1-6
烷氧基、c
1-6
烷硫基、c
1-6
烷氨基、-nhc(=o)nh(c
1-6
烷基)、-nhc(=o)n(c
1-6
烷基)(c
1-6
烷基)、-nhc(=o)(c
1-6
烷基)o(c
1-6
烷基)和5-6元杂环烷基,所述c
1-6
烷基、c
1-6
烷氧基、c
1-6
烷硫基、c
1-6
烷氨基、-nhc(=o)
nh(c
1-6
烷基)、-nhc(=o)n(c
1-6
烷基)(c
1-6
烷基)、-nhc(=o)(c
1-6
烷基)o(c
1-6
烷基)或5-6元杂环烷基任选被1、2、3、4或5个r’取代;r’选自f、cl、br、i、oh、nh2、c
1-6
烷基、cooh和5-6元杂环烷基;
[0019]
所述5-10元杂环烷基、4-7元杂环烷基、c
1-6
杂烷基、5-6元杂芳基、5-12元杂芳基、3-6元杂环基、5-10元杂螺环基或5-10元杂并环基包含1、2或3个独立选自o、nh、s、c(=o)、c(=o)o、s(=o)、s(=o)2和n的杂原子或杂原子团。
[0020]
在本发明的第二方面,本发明提出了式(ii)所示化合物、其光学异构体及其药效上可接受的盐,
[0021][0022]
其中,r1选自h、c
1-6
烷基、c
3-6
环烷基和4-7元杂环烷基,所述c
1-6
烷基、c
3-6
环烷基或4-7元杂环烷基任选被1、2或3个r取代;
[0023]
r2、r3、r4、r5、r6分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基和c
1-6
杂烷基,所述c
1-6
烷基或c
1-6
杂烷基任选被1、2或3个r取代;
[0024]
t选自n和ch;
[0025]
环a选自5-6元杂芳基和5-6元杂芳基并5-6元杂环基,所述5-6元杂芳基或5-6元杂芳基并5-6元杂环基任选被1、2或3个r取代;
[0026]
n选自2和3;
[0027]
l1选自单键、-nh-、-n(ch3)
1-6-、3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-和3-6元杂环基-nh-,所述3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-或3-6元杂环基-nh-任选被1、2或3个r取代;
[0028]
l2选自所述任选被1、2或3个r取代;
[0029]
l3选自单键和所述任选被1、2或3个r取代;
[0030]
l4选自所述所述任选被1、2或3个r取代;
[0031]
x选自单键、o、n、nh、c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基和c
1-6
烷基-o-c
1-6
烷基,所述c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基或c
1-6
烷基-o-c
1-6
烷基任选被1、2、3或4个r取代;
[0032]
r分别独立地选自h、卤素、c
1-6
烷基、c
1-6
杂烷基、oh、nh2、cn、、cn、所述c
1-6
烷基、c
1-6
杂烷基任选被1、2、3或4个r’取代;
[0033]
r’选自f、cl、br、i、oh、nh2、c
1-6
烷基、cooh和5-6元杂环烷基;
[0034]
所述5-10元杂环烷基、4-7元杂环烷基、c
1-6
杂烷基、5-6元杂芳基、5-12元杂芳基、3-6元杂环基、5-10元杂螺环基或5-10元杂并环基包含1、2或3个独立选自o、nh、s、c(=o)、c(=o)o、s(=o)、s(=o)2和n的杂原子或杂原子团。
[0035]
在本发明的另一方面,本发明提出了式(i)所示化合物、其光学异构体及其药效上可接受的盐,
[0036][0037]
其中,r1选自h、c
1-6
烷基、c
3-6
环烷基和4-7元杂环烷基,所述c
1-6
烷基、c
3-6
环烷基或4-7元杂环烷基任选被1、2或3个ra取代;
[0038]
r2、r3、r4、r5、r6分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基和c
1-6
杂烷基,所述c
1-6
烷基或c
1-6
杂烷基任选被1、2或3个rb取代;
[0039]
t选自n和ch;
[0040]
环a选自5-6元杂芳基和5-6元杂芳基并5-6元杂环基,所述5-6元杂芳基或5-6元杂芳基并5-6元杂环基任选被1、2或3个rc取代;
[0041]
n选自2和3;
[0042]
l1选自单键、-nh-、-n(ch3)
1-6-、3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-和3-6元杂环基-nh-,所述3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-或3-6元杂环基-nh-任选被1、2或3个r
l1
取代;
[0043]
l2选自所述任选被1、2
或3个r
l2
取代;
[0044]
l3选自单键和所述任选被1、2或3个r
l3
取代;
[0045]
l4选自所述所述任选被1、2或3个r
l4
取代;
[0046]
x选自单键、o、n、nh、c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基,所述c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基或5-12元杂芳基任选被1、2、3或4个r取代;
[0047]
ra、rb、rc、r
l1
、r
l2
、r
l3
、r
l4
、r分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基、c
1-6
烷氧基、c
1-6
烷硫基、c
1-6
烷氨基、-nhc(=o)nh(c
1-6
烷基)、-nhc(=o)n(c
1-6
烷基)(c
1-6
烷基)、-nhc(=o)(c
1-6
烷基)o(c
1-6
烷基)和5-6元杂环烷基,所述c
1-6
烷基、c
1-6
烷氧基、c
1-6
烷硫基、c
1-6
烷氨基、-nhc(=o)nh(c
1-6
烷基)、-nhc(=o)n(c
1-6
烷基)(c
1-6
烷基)、-nhc(=o)(c
1-6
烷基)o(c
1-6
烷基)或5-6元杂环烷基任选被1、2、3、4或5个r’取代;
[0048]
r’分别独立地选自f、cl、br、i、oh、nh2、c
1-6
烷基、cooh和5-6元杂环烷基;
[0049]
所述5-10元杂环烷基、4-7元杂环烷基、c
1-6
杂烷基、5-6元杂芳基、5-12元杂芳基或3-6元杂环基、5-10元杂螺环基或5-10元杂并环基包含1、2或3个独立选自o、nh、s、c(=o)、c(=o)o、s(=o)、s(=o)2和n的杂原子或杂原子团。
[0050]
在本发明的另一方面,本发明提出了式(ii)所示化合物、其光学异构体及其药效上可接受的盐,
[0051][0052]
其中,r1选自h、c
1-6
烷基、c
3-6
环烷基和4-7元杂环烷基,所述c
1-6
烷基、c
3-6
环烷基或4-7元杂环烷基任选被1、2或3个ra取代;
[0053]
r2、r3、r4、r5、r6分别独立地选自h、卤素、oh、nh2、cn、c
1-6
烷基和c
1-6
杂烷基,所述c
1-6
烷基或c
1-6
杂烷基任选被1、2或3个rb取代;
[0054]
t选自n和ch;
[0055]
环a选自5-6元杂芳基和5-6元杂芳基并5-6元杂环基,所述5-6元杂芳基或5-6元杂芳基并5-6元杂环基任选被1、2或3个rc取代;
[0056]
n选自2和3;
[0057]
l1选自单键、-nh-、-n(ch3)
1-6-、3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-和3-6元杂环基-nh-,所述3-6元杂环基、5-6元杂芳基、3-6元杂环基-n(ch3)-或3-6元杂环基-nh-任选被1、2或3个r
l1
取代;
[0058]
l2选自所述任选被1、2或3个r
l2
取代;
[0059]
l3选自单键和所述任选被1、2或3个r
l3
取代;
[0060]
l4选自所述所述任选被1、2或3个r
l4
取代;
[0061]
x选自单键、o、n、nh、c
1-6
杂烷基、c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基、5-12元杂芳基,所述c
3-8
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
螺环基、5-10杂螺环基、c
5-10
并环基、5-10元杂并环基、c
5-10
芳基或5-12元杂芳基任选被1、2、3或4个r取代;
[0062]
ra、rb、rc、r
l1
、r
l2
、r
l3
、r
l4
、r分别独立地选自h、卤素、c
1-6
烷基、c
1-6
杂烷基、oh、nh2、cn、
[0063][0063]
所述c
1-6
烷基或c
1-6
杂烷基任选被1、2、3或4个r’取代;
[0064]
r’分别独立地选自f、cl、br、i、oh、nh2、c
1-6
烷基、cooh和5-6元杂环烷基;
[0065]
所述5-10元杂环烷基、4-7元杂环烷基、c
1-6
杂烷基、5-6元杂芳基、5-12元杂芳基、3-6元杂环基、5-10元杂螺环基或5-10元杂并环基包含1、2或3个独立选自o、nh、s、c(=o)、c(=o)o、s(=o)、s(=o)2和n的杂原子或杂原子团。
[0066]
在本发明的一些方案中,上述ra、rb、rc、r
l1
、r
l2
、r
l3
、r
l4
、r选自h、f、cl、br、i、oh、nh2、me、cf3、、其余变量如本发明所
定义。
[0067]
在本发明的一些方案中,上述r1选自h、ch3、四氢吡咯基和哌啶基,所述ch3、四氢吡咯基或哌啶基任选被1、2或3个r或ra取代,其余变量如本发明所定义。
[0068]
在本发明的一些方案中,上述r1选自h、ch3、、其余变量如本发明所定义。
[0069]
在本发明的一些方案中,上述r2、r3、r4、r5、r6分别独立地选自h、f、cl、br、oh、nh2、cn、ch3、其余变量如本发明所定义。
[0070]
在本发明的一些方案中,上述结构单元选自1h-1,2,3-三唑基、吡啶基、嘧啶基、4,5,6,7-四氢-[1,2,3]三唑[1,5-a]吡嗪基、4,5,6,7-四氢-2h-吡唑并[4,3-c]吡啶基、4,5,6,7-四氢-1h-吡唑并[4,3-c]吡啶基、4,5,6,7-四氢-2h-吡唑并[3,4-c]吡啶基、4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶基、4,5,6,7-四氢-1h-咪唑并[4,5-c]吡啶基、4,5,6,7-四氢-3h-咪唑并[4,5-c]吡啶基、6,7-二氢-5h-吡咯并[3,4-d]嘧啶基、4,5,6,7-四氢-[1,2,3]三唑并[1,5-a]吡啶基、5,6-二氢-4h-吡咯并[1,2-c][1,2,3]三唑基、2,4,5,6-四氢吡咯并[3,4-c]吡唑基、1,4,5,6-四氢吡咯并[3,4-c]吡唑基、4,5,6,7-四氢-1h-[1,2,3]三唑并[4,5-c]吡啶基、4,5,6,7-四氢-3h-[1,2,3]三唑并[4,5-c]吡啶基、4,5,6,7-四氢-2h-[1,2,3]三唑并[4,5-c]吡啶基和5,6,7,8-四氢咪唑并[1,5-a]吡嗪基、4,6-二氢-5λ
2-吡咯并[3,4-d]恶唑基,所述1h-1,2,3-三唑基、嘧啶基、4,5,6,7-四氢-[1,2,3]三唑[1,5-a]吡嗪基、4,5,6,7-四氢-2h-吡唑并[4,3-c]吡啶基、4,5,6,7-四氢-1h-吡唑并[4,3-c]吡啶基、4,5,6,7-四氢-2h-吡唑并[3,4-c]吡啶基、4,5,6,7-四氢-1h-吡唑并[3,4-c]吡啶基、4,5,6,7-四氢-1h-咪唑并[4,5-c]吡啶基、4,5,6,7-四氢-3h-咪唑并[4,5-c]吡啶基、6,7-二氢-5h-吡咯并[3,4-d]嘧啶基、4,5,6,7-四氢-[1,2,3]三唑并[1,5-a]吡啶基、5,6-二氢-4h-吡咯并[1,2-c][1,2,3]三唑基、2,4,5,6-四氢吡咯并[3,4-c]吡唑基、1,4,5,6-四氢吡咯并[3,4-c]吡唑基、4,5,6,7-四氢-1h-[1,2,3]三唑并[4,5-c]吡啶基、4,5,6,7-四氢-3h-[1,2,3]三唑并[4,5-c]吡啶基、4,5,6,7-四氢-2h-[1,2,3]三唑并[4,5-c]吡啶基或5,6,7,8-四氢咪唑并[1,5-a]吡嗪基任选被1、2或3个r或rc取代,其余变量如本发明所定义。
[0071]
在本发明的一些方案中,上述结构单元选自
10元杂环烷基、c
1-6
烷基、c
5-10
芳基、5-12元杂芳基和c
1-6
烷基-o-c
1-6
烷基,所述c
1-6
杂烷基、c
3-10
环烷基、5-10元杂环烷基、c
1-6
烷基、c
5-10
芳基、5-12元杂芳基或c
1-6
烷基-o-c
1-6
烷基任选被1、2、3或4个r取代,其余变量如本发明所定义。在本发明的一些方案中,上述x选自单键、o、n、nh、o、n、nh、o、n、nh、其余变量如本发明所定义。
[0078]
在本发明的再一方面,本发明还提出了下式化合物、其光学异构体及其药效上可接受的盐,其选自
[0079]
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095][0096]
在本发明的再一方面,本发明还提出了前面所述的化合物、其光学异构体及其药效上可接受的盐在制备用于抑制nhe-介导的钠离子或氢离子的反向转运的药物的用途。
[0097]
在本发明的再一方面,本发明还提出了前面所述的化合物、其光学异构体及其药效上可接受的盐在制备用于治疗过敏性肠综合征、心力衰竭、慢性肾病、终末期肾病或肝病的药物的用途。
[0098]
定义和说明
[0099]
除非另有说明,本文所用的下列术语和短语旨在具有下列含义。一个特定的术语或短语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
[0100]
这里所采用的术语“药效上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
[0101]
术语“药效上可接受的盐”是指本发明化合物的盐,由本发明发现的具有特定取代基的化合物与相对无毒的酸或碱制备。当本发明的化合物中含有相对酸性的功能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的碱与这类化合物的中性形式接触的方式获得碱加成盐。药效上可接受的碱加成盐包括钠、钾、钙、铵、有机胺或镁盐或类似的盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在溶液或合适的惰性溶剂中用足够量的酸与这类化合物的中性形式接触的方式获得酸加成盐。药效上可接受的酸加成盐的实例包括无机酸盐,所述无机酸包括例如盐酸、氢溴酸、硝酸、碳酸,碳酸氢根,磷酸、磷酸一
氢根、磷酸二氢根、硫酸、硫酸氢根、氢碘酸、亚磷酸等;以及有机酸盐,所述有机酸包括如乙酸、丙酸、异丁酸、三氟乙酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸和甲磺酸等类似的酸;还包括氨基酸(如精氨酸等)的盐,以及如葡糖醛酸等有机酸的盐。本发明的某些特定的化合物含有碱性和酸性的官能团,从而可以被转换成任一碱或酸加成盐。
[0102]
本发明的药效上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
[0103]
本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本发明的范围之内。
[0104]
本发明的化合物可以存在特定的。除非另有说明,术语“互变异构体”或“互变异构体形式”是指在室温下,不同官能团异构体处于动态平衡,并能很快的相互转化。若互变异构体是可能的(如在溶液中),则可以达到互变异构体的化学平衡。例如,质子互变异构体(proton tautomer)(也称质子转移互变异构体(prototropic tautomer))包括通过质子迁移来进行的互相转化,如酮-烯醇异构化和亚胺-烯胺异构化。价键异构体(valence tautomer)包括一些成键电子的重组来进行的相互转化。其中酮-烯醇互变异构化的具体实例是戊烷-2,4-二酮与4-羟基戊-3-烯-2-酮两个互变异构体之间的互变。
[0105]
本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(3h),碘-125(
125
i)或c-14(
14
c)。又例如,可用重氢取代氢形成氘代药物,氘与碳构成的键比普通氢与碳构成的键更坚固,相比于未氘化药物,氘代药物有降低毒副作用、增加药物稳定性、增强疗效、延长药物生物半衰期等优势。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。“任选”或“任选地”指的是随后描述的事件或状况可能但不是必需出现的,并且该描述包括其中所述事件或状况发生的情况以及所述事件或状况不发生的情况。
[0106]
术语“被
…
取代”是指特定原子上的任意一个或多个氢原子被取代基取代,可以包括重氢和氢的变体,只要特定原子的价态是正常的并且取代后的化合物是稳定的。术语“任选被
…
取代”是指可以被取代,也可以不被取代,除非另有规定,取代基的种类和数目在化学上可以实现的基础上可以是任意的。
[0107]
当任何变量(例如r)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被0-2个r所取代,则所述基团可以任选地至多被两个r所取代,并且每种情况下的r都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。例如,可以选自自
[0108]
不在两个字母或符号之间的短横(
“‑”
)表示取代基的连接位点。例如,c
1-6
烷基羰基-指通过羰基与分子的其余部分连接的c
1-6
烷基。然而,当取代基的连接位点对本领域技术人员来说是显而易见的时候,例如,卤素取代基,
“‑”
可以被省略。
[0109]
除非另有说明,当基团价键上带有虚线时,例如在中,虚线表示该基团与分子其它部分的连接点。
[0110]
当其中一个变量选自单键时,表示其连接的两个基团直接相连,比如中l1代表单键时表示该结构实际上是
[0111]
当所列举的取代基中没有指明其通过哪一个原子连接到被取代的基团上时,这种取代基可以通过其任何原子相键合,例如,吡啶基作为取代基可以通过吡啶环上任意一个碳原子连接到被取代的基团上。
[0112]
当所列举的连接基团没有指明其连接方向,其连接方向是任意的,例如,中连接基团l为此时既可以按与从左往右的读取顺序相同的方向连接苯基和环戊基构成也可以按照与从左往右的读取顺序相反的方向连接苯基和环戊基构成所述连接基团、取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
[0113]
除非另有规定,环上原子的数目通常被定义为环的元数,例如,“4-6元环”是指环绕排列4-6个原子的“环”。
[0114]
除非另有规定,术语“c
1-6
烷基”用于表示直链或支链的由1至6个碳原子组成的饱和碳氢基团。所述c
1-6
烷基包括c
1-5
、c
1-4
、c
2-6
烷基等;其可以是一价(如甲基)、二价(如亚甲基)或者多价(如次甲基)。c
1-5
烷基的实例包括但不限于甲基(“me”)、乙基(“et”)、丙基如正丙基(“n-pr”)或异丙基(“i-pr”)、丁基如正丁基(“n-bu”)、异丁基(“i-bu”)、仲丁基(“s-bu”)或叔丁基(“t-bu”)、戊基、己基等。
[0115]
除非另有规定,术语“c
1-3
烷基”用于表示直链或支链的由1至3个碳原子组成的饱和碳氢基团。所述c
1-3
烷基包括c
1-2
和c
2-3
烷基等;其可以是一价(如甲基)、二价(如亚甲基)或者多价(如次甲基)。c
1-3
烷基的实例包括但不限于甲基(me)、乙基(et)、丙基(包括n-丙基和异丙基)等。
[0116]
除非另有规定,“c
2-6
烯基”用于表示直链或支链的包含至少一个碳-碳双键的由2至6个碳原子组成的碳氢基团,碳-碳双键可以位于该基团的任何位置上。所述c
2-6
烯基包括c
2-4
、c
2-3
、c4、c3和c2烯基等;其可以是一价、二价或者多价。c
2-6
烯基的实例包括但不限于乙烯基、丙烯基、丁烯基、戊烯基、己烯基、丁间二烯基、戊间二烯基、己间二烯基等。
[0117]
除非另有规定,“c
2-3
烯基”用于表示直链或支链的包含至少一个碳-碳双键的由2至3个碳原子组成的碳氢基团,碳-碳双键可以位于该基团的任何位置上。所述c
2-3
烯基包括
c3和c2烯基;所述c
2-3
烯基可以是一价、二价或者多价。c
2-3
烯基的实例包括但不限于乙烯基、丙烯基等。
[0118]
术语“杂烷基”本身或者与另一术语联合,表示由一定数目碳原子和至少一个杂原子或杂原子团组成的,稳定的直链或支链的烷基原子团或其组合物。在一些实施方案中,杂原子选自b、o、n和s,其中氮和硫原子任选地被氧化,氮杂原子任选地被季铵化。在另一些实施方案中,杂原子团选自-c(=o)o-、-c(=o)-、-c(=s)-、-s(=o)、-s(=o)
2-、-c(=o)n(h)-、-n(h)-、-c(=nh)-、-s(=o)2n(h)-和-s(=o)n(h)-。在一些实施方案中,所述杂烷基为c
1-6
杂烷基;在另一些实施方案中,所述杂烷基为c
1-3
杂烷基。杂原子或杂原子团可以位于杂烷基的任何内部位置,包括该烷基与分子其余部分的连接位置,但术语“烷氧基”属于惯用表达,是指通过一个氧原子连接到分子的其余部分的那些烷基基团。杂烷基的实例包括但不限于-och3、-och2ch3、-och2ch2ch3、-och2(ch3)2、-ch
2-ch
2-o-ch3、-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)(ch2ch3)、-ch
2-ch
2-nh-ch3、-ch
2-ch
2-n(ch3)-ch3、-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2、-ch
2-s-ch
2-ch3、-ch
2-ch2、-s(=o)-ch3、-ch
2-ch
2-s(=o)
2-ch3、和至多两个杂原子可以是连续的,例如-ch
2-nh-och3。
[0119]
除非另有规定,术语“c
1-6
烷氧基”表示通过一个氧原子连接到分子的其余部分的那些包含1至6个碳原子的烷基基团。所述c
1-6
烷氧基包括c
1-4
、c
1-3
、c
1-2
、c
2-6
、c
2-4
、c6、c5、c4和c3烷氧基等。c
1-6
烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(包括正丙氧基和异丙氧基)、丁氧基(包括n-丁氧基、异丁氧基、s-丁氧基和t-丁氧基)、戊氧基(包括n-戊氧基、异戊氧基和新戊氧基)、己氧基等。
[0120]
除非另有规定,术语“c
1-4
烷氧基”表示通过一个氧原子连接到分子的其余部分的那些包含1至4个碳原子的烷基基团。所述c
1-4
烷氧基包括c
1-3
、c
1-2
、c
2-4
、c4和c3烷氧基等。c
1-6
烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(包括正丙氧基和异丙氧基)、丁氧基(包括n-丁氧基、异丁氧基、s-丁氧基和t-丁氧基)、戊氧基(包括n-戊氧基、异戊氧基和新戊氧基)、己氧基等。
[0121]
除非另有规定,术语“c
1-3
烷氧基”表示通过一个氧原子连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c
1-3
烷氧基包括c
1-2
、c
2-3
、c3和c2烷氧基等。c
1-3
烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基(包括正丙氧基和异丙氧基)等。
[0122]
除非另有规定,术语“c
1-6
烷氨基”表示通过氨基连接到分子的其余部分的那些包含1至6个碳原子的烷基基团。所述c
1-6
烷氨基包括c
1-4
、c
1-3
、c
1-2
、c
2-6
、c
2-4
、c6、c5、c4、c3和c2烷氨基等。c
1-6
烷氨基的实例包括但不限于-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)ch2ch3、-n(ch2ch3)(ch2ch3)、-nhch2ch2ch3、-nhch2(ch3)2、-nhch2ch2ch2ch3等。
[0123]
除非另有规定,术语“c
1-4
烷氨基”表示通过氨基连接到分子的其余部分的那些包含1至4个碳原子的烷基基团。所述c
1-4
烷氨基包括c
1-3
、c
1-2
、c
2-4
、c4、c3和c2烷氨基等。c
1-4
烷氨基的实例包括但不限于-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)ch2ch3、-n(ch2ch3)(ch2ch3)、-nhch2ch2ch3、-nhch2(ch3)2、-nhch2ch2ch2ch3等。
[0124]
除非另有规定,术语“c
1-3
烷氨基”表示通过氨基连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c
1-3
烷氨基包括c
1-2
、c3和c2烷氨基等。c
1-3
烷氨基的实例包括但不限于-nhch3、-n(ch3)2、-nhch2ch3、-n(ch3)ch2ch3、-nhch2ch2ch3、-nhch2(ch3)2等。
[0125]
除非另有规定,术语“c
1-6
烷硫基”表示通过硫原子连接到分子的其余部分的那些
包含1至6个碳原子的烷基基团。所述c
1-6
烷硫基包括c
1-4
、c
1-3
、c
1-2
、c
2-6
、c
2-4
、c6、c5、c4、c3和c2烷硫基等。c
1-6
烷硫基的实例包括但不限于-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2等等。
[0126]
除非另有规定,术语“c
1-4
烷硫基”表示通过硫原子连接到分子的其余部分的那些包含1至4个碳原子的烷基基团。所述c
1-4
烷硫基包括c
1-3
、c
1-2
、c
2-4
、c4、c3和c2烷硫基等。c
1-4
烷硫基的实例包括但不限于-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2等等。
[0127]
除非另有规定,术语“c
1-3
烷硫基”表示通过硫原子连接到分子的其余部分的那些包含1至3个碳原子的烷基基团。所述c
1-3
烷硫基包括c
1-3
、c
1-2
和c3烷硫基等。c
1-3
烷硫基的实例包括但不限于-sch3、-sch2ch3、-sch2ch2ch3、-sch2(ch3)2等。
[0128]
除非另有规定,术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至12个碳原子(可以是具体的点,也可以是任选两点组成的区间,例如3、4、5、6个环原子、4至11个环原子、6至12个环原子等),更优选包含3至8个碳原子,最优选包含3至6个(例如3、4、5或6)碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等,优选环烷基;多环环烷基包括螺环、稠环和桥环的环烷基。
[0129]
除非另有规定,“c
3-9
环烷基”指具有3-9个环碳原子、例如具有3-8个环碳原子、例如具有3-6个环碳原子、例如3-4个环碳原子的饱和一价单环或二环烃基。例如,“c
3-9
环烷基”表示具有3-9个环碳原子的环烷基。类似地,“c
3-8
环烷基”表示具有3-8个环碳原子的环烷基;“c
3-6
环烷基”表示具有3-6个环碳原子的环烷基;“c
3-4
环烷基”表示具有3-4个环碳原子的环烷基。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、环庚基和环辛基等。
[0130]
除非另有规定,“c
4-6
环烷基”表示由4至6个碳原子组成的饱和环状碳氢基团,其为单环和双环体系,所述c
4-6
环烷基包括c
4-5
、c
5-6
、c4、c5和c6环烷基等;其可以是一价、二价或者多价。c
4-6
环烷基的实例包括,但不限于,环丁基、环戊基、环己基等。
[0131]
除非另有规定,术语“c
5-10
螺环基”指5至10元的单环之间共用一个碳原子(称螺原子)的多环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。优选为7至10元。根据环与环之间共用螺原子的数目将螺环烷基分为单螺环烷基、双螺环烷基或多螺环烷基,优选为单螺环烷基和双螺环烷基。更优选为4元/4元、4元/5元、4元/6元、5元/5元或5元/6元单螺环烷基。螺环烷基的非限制性实例包括:
[0132]
除非另有规定,术语“c
5-10
并环基”指5至10元,任意两个环共用两个不直接连接的碳原子的全碳多环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环桥环烷基,优选为双环、三环或四环,更优选为双环或三环。“c
5-10
并环”的非限制性实例包括:
[0133]
除非另有规定,术语“桥环烷基”指5至10元,任意两个环共用两个不直接连接的碳原子的全碳多环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。优选为6至10元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环桥环烷基,优选为双环、三环或四环,更优选为双环或三环。桥环烷基的非限制性实例包括:
[0134]
除非另有规定,术语“杂环烷基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,但不包括-o-o-、-o-s-或-s-s-的环部分,其余环原子为碳。优选包含3至12个环原子(可以是具体的点,也可以是任选两点组成的区间,例如3、4、5、6个环原子、4至11个环原子、6至12个环原子等),其中1~4个是杂原子;优选包含3至8个环原子,其中1~3个是杂原子;更优选包含3至6个环原子,其中1~3个是杂原子。单环杂环基的非限制性实例包括氮杂环丁基、吡咯烷基、咪唑烷基、四氢呋喃基、四氢吡喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等,优选四氢吡喃基、哌啶基、吡咯烷基。多环杂环基包括螺环、稠环和桥环的杂环基。
[0135]
除非另有规定,术语“4-7元杂环烷基”本身或者与其他术语联合分别表示由4至7个环原子组成的饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)
p
,p是1或2)。其包括单环和双环体系,其中双环体系包括螺环、并环和桥环。此外,就该“4-7元杂环烷基”而言,杂原子可以占据杂环烷基与分子其余部分的连接位置。所述4-7元杂环烷基包括5-6元、4元、5元、6元、7元杂环烷基等。4-7元杂环烷基的实例包括但不限于氮杂环丁基、氧杂环丁基、硫杂环丁基、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基或高哌啶基等。
[0136]
除非另有规定,术语“3-6元杂环烷基”本身或者与其他术语联合分别表示由3至6个环原子组成的饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)
p
,p是1或2)。其包括单环和双环体系,其中双环体系包括螺环、并环和桥环。此外,就该“3-6元杂环烷基”而言,杂原子可以占据杂环烷基与分子其余部分的连接位置。所述3-6元杂环烷基包括5-6元、4元、5元和6元杂环烷基等。3-6元杂环烷基的实例包括但不限于氮杂环丁基、氧杂环丁基、硫杂环丁基、吡咯烷基、吡唑烷基、咪唑烷基、四氢噻吩基(包括四氢噻吩-2-基和四氢噻吩-3-基等)、四氢呋喃基(包括四氢呋喃-2-基等)、四氢吡喃基、哌啶基(包括1-哌啶基、2-哌啶基和3-哌啶基等)、哌嗪基(包括1-哌嗪基和2-哌嗪基等)、吗啉基(包括3-吗啉基和4-吗啉基等)、二噁烷基、二噻烷基、异噁唑烷基、异噻唑烷基、1,2-噁嗪基、1,2-噻嗪基、六氢哒嗪基、高哌嗪基或高哌啶基等。
[0137]
除非另有规定,术语“5-10杂螺环基”指5至10元的单环之间共用一个原子(称螺原子)的多环杂环基团,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,其余环原子为碳。其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统。优选为7至10元。根据环与环之间共用螺原子的数目将螺杂环基分为单螺杂环基、双螺杂环基或多螺杂环基,优选为单螺杂环基和双螺杂环基。更优选为4元/4元、4元/5元、4元/6元、5元/5元或5元/6元单螺杂环基。螺杂环基的非限制性实例包括:
[0138]
除非另有规定,术语“5-10元杂并环”指5至10元,系统中的每个环与体系中的其他环共享毗邻的一对原子的多环杂环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,其余环原子为碳。优选为6至10元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环杂并环基,优选为双环或三环,更优选为5元/5元或5元/6元双环稠杂环基。稠杂环基的非限制性实例包括:
[0139]
除非另有规定,术语“桥杂环基”指5至10元,任意两个环共用两个不直接连接的原子的多环杂环基团,其可以含有一个或多个双键,但没有一个环具有完全共轭的π电子系统,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,其余环原子为碳。优选为6至10元,更优选为7至10元。根据组成环的数目可以分为双环、三环、四环或多环桥杂环基,优选为双环、三环或四环,更有选为双环或三环。桥杂环基的非限制性实例包括:
[0140]
除非另有规定,本发明术语“环烯基”是指环状烯基。“c
3-7
环烯基”包括c3、c4、c5、c6和c7环烯基。环烯基的实例包括但不限于环丁烯基、环戊烯基和环己烯基。
[0141]
除非另有规定,本发明术语“杂环烯基”是指包含若干个杂原子的环状烯基。“5-6元杂环烯基”本身或者与其他术语联合分别表示由5至6个环原子组成的不饱和环状基团,其1、2、3或4个环原子为独立选自o、s和n的杂原子,其余为碳原子,其中氮原子任选地被季铵化,氮和硫杂原子可任选被氧化(即no和s(o)
p
,p是1或2)。杂环烯基的实例包括但不限于
[0142]
除非另有规定,c
n-n+m
或c
n-c
n+m
包括n至n+m个碳的任何一种具体情况,例如c
1-12
包括c1、c2、c3、c4、c5、c6、c7、c8、c9、c
10
、c
11
、和c
12
,也包括n至n+m中的任何一个范围,例如c
1-12
包括c
1-3
、c
1-6
、c
1-9
、c
3-6
、c
3-9
、c
3-12
、c
6-9
、c
6-12
、和c
9-12
等;同理,n元至n+m元表示环上原子数为n至n+m个,例如3-12元环包括3元环、4元环、5元环、6元环、7元环、8元环、9元环、10元环、11元环、和12元环,也包括n至n+m中的任何一个范围,例如3-12元环包括3-6元环、3-9元环、5-6元环、5-7元环、6-7元环、6-8元环、和6-10元环等。
[0143]
除非另有规定,术语“杂芳基”指包含1至4个杂原子、5至20个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为5至10元,含1至3个杂原子;更优选为5元或6元,含1至3个杂原子;非限制性实例如吡唑基、咪唑基、呋喃基、噻吩基、噻唑基、噁唑基、吡咯基、三唑基、四唑基、吡啶基、嘧啶基、噻二唑、吡嗪基等。所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环,其非限制性实例包括:
[0144]
杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以
下基团,其独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、巯基、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基和杂环烷硫基中的一个或多个取代基所取代。
[0145]
除非另有规定,术语“5-6元杂芳基并5-6元杂环基”指5-6元杂芳基与5-6元杂环基通过化学键稠合在一起,两个基团之间有共同使用的一个或多个化学键,杂芳基的定义同前面所定义,杂环基包括饱和的杂环烷基和不饱和的杂环基,杂环烷基的定义同前面所定义,“5-6元杂芳基并5-6元杂环基”包括但不限于
[0146]
本领域技术人员应当理解的是,一些式(i)化合物可以包含一个或多个手性中心,因此存在两个或更多个立体异构体。因此,本发明的化合物可以以单个立体异构体(例如对映异构体、非对映异构体)及其任意比例的混合物例如外消旋物的形式存在,以及在适当的情况下,可以以其互变异构体和几何异构体的形式存在。
[0147]
本文所用的术语“立体异构体”指具有相同化学构成、但在原子或基团的空间排列方面不同的化合物。立体异构体包括对映异构体、非对映异构体和构象异构体等。
[0148]
本文所用的术语“对映异构体”指化合物的彼此是不可重叠的镜像的两种立体异构体。
[0149]
本文所用的术语“非对映异构体”指具有两个或更多个手性中心并且其分子彼此不是镜像的立体异构体。非对映异构体具有不同的物理性质,例如熔点、沸点、光谱性质或生物活性。非对映异构体的混合物可以用高分辨率分析方法例如电泳和色谱例如hplc分离。
[0150]
立体化学定义和惯例可遵循s.p.parker编辑,mcgraw-hill dictionary of chemical terms(1984)mcgraw-hill book company,new york;和eliel,e.和wilen,s.,“stereochemistry of organic compounds”,john wiley&sons,inc.,new york,1994。许多有机化合物以光学活性形式存在,即,它们具有旋转平面偏振光的平面的能力。在描述光学活性化合物时,前缀d和l或者r和s用于表示分子关于其手性中心的绝对构型。前缀d和l或者(+)和(-)用于表示化合物旋转平面偏振光的符号,其中(-)或l表示该化合物是左旋的。带有(+)或d的前缀的化合物是右旋的。对于给定的化学结构,除了它们彼此互为镜像之外,这些立体异构体是相同的。特定的立体异构体也可以称为对映异构体,这类异构体的混合物通常称为对映异构体混合物。对映异构体的50:50混合物被称为外消旋混合物或外消旋物,其可以出现在化学反应或方法中没有立体选择性或立体特异性的情况中。术语“外消旋混合物”和“外消旋物”指不具有光学活性的两种对映异构体的等摩尔混合物。
[0151]
外消旋混合物可以以其本身的形式使用或者拆分成单个异构体使用。通过拆分可以得到立体化学上的纯的化合物或者富集一种或多种异构体的混合物。分离异构体的方法是众所周知的(参见allinger n.l.和eliel e.l.,"topics in stereochemistry",第6卷,wiley interscience,1971),包括物理方法,例如使用手性吸附剂的色谱法。可以由手性前体制备得到手性形式的单个异构体。或者,可以通过与手性酸(例如10-樟脑磺酸、樟脑酸、α-溴樟脑酸、酒石酸、二乙酰基酒石酸、苹果酸、吡咯烷酮-5-羧酸等的单个对映异构体)形成非对映异构体盐而由混合物化学分离得到单个异构体,将所述的盐分级结晶,然后游离出拆分的碱中的一个或两个,任选地重复这一过程,从而得到一个或两个基本上不包含另
一种异构体的异构体,即光学纯度以重量计为例如至少91%、92%、93%、94%、95%、96%、97%、98%、99%或99.5%的所需的立体异构体。或者,如本领域技术人员所熟知的,可以将外消旋物共价连接到手性化合物(辅助物)上,得到非对映异构体。
[0152]
本文所用的术语“互变异构体”或“互变异构形式”指经由低能量障碍可相互转化的不同能量的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括通过质子迁移进行的相互转化,例如酮-烯醇和亚胺-烯胺异构化。价键互变异构体包括通过一些键合电子的重组进行的相互转化。
[0153]
本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
[0154]
本文所用的未具体定义的技术和科学术语具有本发明所属领域的技术人员通常理解的含义。
具体实施方式
[0155]
下面通过实施例对本技术进行详细描述,但并不意味着存在对本技术而言任何不利的限制。本文已经详细地描述了本技术,其中也公开了其具体实施例方式,对本领域的技术人员而言,在不脱离本技术精神和范围的情况下针对本技术具体实施方式进行各种变化和改进将是显而易见的。
[0156]
本发明所使用的原料如无特殊说明,均来自市售。
[0157]
实施例a1的合成
[0158][0159]
步骤1:化合物a1-2的制备
[0160]
将化合物a1-1(1g,4.46mmol)溶于乙腈(15ml)中,冰浴下向其中加入n-溴代丁二酰亚胺(700mg),加毕,将体系于0℃搅拌1h,然后缓慢升温至室温搅拌16h。将体系直接浓缩得粗品,粗品经硅胶柱层析纯化(乙酸乙酯/石油醚(v/v)=0~60%;流速:40ml/min),得到目标化合物a1-2。
[0161]
ms(esi)m/z:(m+h)
+
=303.0。
[0162]
步骤2:化合物(s)-a1-3的制备
[0163]
将化合物a1-3(20g,53.89mmol)溶于乙醇(1.9l),向其中加入d-(+)-二苯甲酰酒石酸(19.00g,53.03mmol)及水(158ml)。加毕,将体系升温至65℃搅拌2h。将反应液过滤,收集滤饼,将滤饼溶于饱和碳酸钾(ph》10),用二氯甲烷(50ml x 3)萃取,合并有机相,水洗(50ml x 3)后,经无水硫酸钠干燥,过滤,滤液浓缩得化合物(s)-a1-3,不经进一步纯化直接用于下一步反应。
[0164]
ms(esi)m/z(m+h)
+
=369.9.
[0165]1h nmr(400mhz,chloroform-d)δ7.40(d,j=7.9hz,1h),7.34(s,1h),7.25(d,j=
1.8hz,1h),7.19(t,j=7.7hz,1h),7.09(d,j=7.7hz,1h),6.78(s,1h),4.17(br t,j=6.4hz,1h),3.78-3.70(m,1h),3.60-3.52(m,1h),2.95(dd,j=5.3,11.5hz,1h),2.58(dd,j=7.7,11.7hz,1h),2.47(s,3h).
[0166]
sfc 100%ee.保留时间4.213min。
[0167]
分离条件:色谱柱:chiralpak ad-3 150
×
4.6mm i.d.,3μm;柱温:35℃;流动相:co
2-乙醇(0.05%dea),乙醇:5%-40%5min,40%-5%0.5min,5%1.5min;流速:2.5ml/min.
[0168]
步骤3:化合物a1-4的制备
[0169]
将化合物(s)-a1-3(2g,5.4mmol),联硼酸频那醇酯(2.06g,8.1mmol),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(394mg,0.54mmol)和乙酸钾(1.58g,16.2mmol)溶于1,4-二氧六环(20ml),氮气氛围下,将体系升温至100℃搅拌6h。将体系直接浓缩得粗品,粗品经硅胶柱层析纯化(乙酸乙酯/石油醚(v/v)=0~80%;流速:40ml/min),得到目标化合物a1-4。
[0170]
ms(esi)m/z:(m+h)
+
=418.0.
[0171]
步骤4:化合物a1-5的制备
[0172]
将化合物a1-2(600mg,1.98mmol),化合物a1-4(1g,2.3mmol),四(三苯基膦)钯(231.2mg,0.2mmol)和碳酸钾(828mg,2.0mmol)溶于1,4-二氧六环(10ml)和水(2.5ml)的混合溶剂中,氮气氛围下,将体系升温至100℃搅拌6h。将体系直接浓缩得粗品,粗品经硅胶柱层析纯化(乙酸乙酯/石油醚(v/v)=0~80%;流速:40ml/min),得到目标化合物a1-5。
[0173]
ms(esi)m/z:(m+h)
+
=514.0.
[0174]
步骤5:化合物a1-6的制备
[0175]
将化合物a1-5(1g,1.95mmol)溶于二氯甲烷(10ml)中,冰浴下向其中加入三氟乙酸(3ml),加毕,将体系升温至室温搅拌3h。将体系直接浓缩得粗品,粗品经反相硅胶柱层析纯化(流动相:[水(10mm碳酸氢铵)-乙腈];乙腈:5%-95%,流速:45ml/min),得到目标化合物a1-6。
[0176]
ms(esi)m/z:(m+h)
+
=414.0.
[0177]
步骤6:化合物a1-8的制备
[0178]
将化合物a1-6(256mg,0.62mmol),a1-7(198mg,0.74mmol),碳酸钾(255mg,1.85mmol)和碘化钾(200mg,1.20mmol)溶于n,n-二甲基乙酰胺(5ml)中,将体系升温至100℃搅拌6h。将反应液冷却至室温,过滤,滤液经反相硅胶柱层析纯化(流动相:[水(10mm碳酸氢铵)-乙腈];乙腈:5%-95%,流速:45ml/min),得到目标化合物a1-8。
[0179]
ms(esi)m/z(m+h)
+
=601.2.
[0180]
步骤7:化合物a1-9的制备
[0181]
将化合物a1-8(144mg,0.24mmol)溶于二氯甲烷(4ml)中,冰浴下向其中加入三氟乙酸(1ml),加毕,将体系升温至室温搅拌3h。将体系直接浓缩得粗品,粗品加入二氯甲烷(20ml)溶解,加入碳酸氢钠溶液调节ph至8-10,二氯甲烷萃取(50ml*3),有机相用无水硫酸钠干燥,过滤,滤液浓缩得到目标化合物a1-9。
[0182]
ms(esi)m/z:(m+h)+=501.2.
[0183]
步骤8:化合物a1的制备
[0184]
将化合物a1-9(107mg,0.214mmol)溶于n,n-二甲基甲酰胺(2ml)中,冰浴下向其中
加入a1-10(1,4-二异氰酸酯丁烷)(11.2mg,0.08mmol)和三乙胺(64.8mg,0.642mmol),加毕,将体系于室温(25℃)搅拌2h。反应液经高效制备液相纯化(分离条件:色谱柱agilent 10prep-c18 250
×
21.2mm;柱温:25℃;流动相:水(10mm/l nh4hco3)-乙腈;乙腈:55%-85%12min,流速:30ml/min)得化合物a1。
[0185]1h nmr(400mhz,dmso-d6)δ7.58
–
7.46(m,6h),7.39(t,j=7.7hz,2h),7.19(dt,j=7.6,1.4hz,2h),6.91(d,j=2.0hz,2h),5.90(t,j=5.7hz,2h),5.79(t,j=5.7hz,2h),4.43
–
4.35(m,4h),4.33(t,j=5.5hz,2h),4.00
–
3.89(m,4h),3.68(d,j=16.1hz,2h),3.59(t,j=5.6hz,4h),3.50(d,j=16.1hz,2h),3.39(d,j=5.7hz,4h),3.13(q,j=5.7hz,4h),3.08
–
3.00(m,4h),2.92(q,j=5.7hz,4h),2.87(dd,j=11.5,5.2hz,2h),2.80(t,j=5.6hz,4h),2.69(dd,j=11.6,6.0hz,2h),2.38(s,6h),1.32
–
1.25(m,4h).
[0186]
ms(esi)m/z(m+h)
+
=1143.20。
[0187]
hplc 100%纯度;保留时间7.426min。
[0188]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min.
[0189]
实施例a2的合成
[0190][0191]
步骤1:化合物a2-2的制备
[0192]
将化合物a2-1(1g,8.1mmol),二碳酸二叔丁酯(4ml,17.8mmol)及n,n-二异丙基乙胺(5.6ml,32.4mmol)溶于甲醇(20ml)中,将体系于50℃下搅拌1h。将体系降至室温(25℃)后,向其中滴加2n naoh水溶液(16ml)并继续搅拌1h,反应液浓缩除去甲醇后用乙酸乙酯萃取,有机相经饱和食盐水洗涤后,用无水硫酸钠干燥,过滤,滤液浓缩得化合物a2-2,不经进一步纯化直接用于下一步反应。
[0193]
ms(esi)m/z(m+h)
+
=224.0.
[0194]
步骤2:化合物a2-3的制备
[0195]
将化合物a2-2(220mg,1mmol)溶于四氢呋喃(3ml)中,室温(25℃)条件下,向其中加入n-碘代丁二酰亚胺(224mg,1mmol)。加毕,将体系于室温(25℃)搅拌1h。反应液经乙酸乙酯(100ml)稀释,用饱和食盐水洗涤,合并有机相,浓缩得化合物a2-3,不经进一步纯化直接用于下一步反应。
[0196]
ms(esi)m/z(m+h)
+
=349.8.
[0197]
步骤3:化合物a2-4及a2-4’的制备
[0198]
将化合物a2-3(110mg,0.32mmol)溶于无水四氢呋喃(1ml),氮气氛围下,向其中加入60%nah(14mg,0.35mmol),将体系于室温(25℃)搅拌20min,向其中加入2-(三甲硅烷基)乙氧甲基氯(58mg,0.35mmol),将体系于室温(25℃)搅拌1h。反应液经甲醇(1ml)淬灭,乙酸乙酯(50ml)稀释后,水洗,合并有机相,浓缩得粗品,粗品经硅胶柱层析纯化(乙酸乙酯/石油醚(v/v)=0~10%),得化合物a2-4及a2-4’的混合物。
[0199]
ms(esi)m/z(m+h)
+
=480.2.
[0200]
步骤4:化合物a2-5及a2-5’的制备
[0201]
将a2-4及a2-4’的混合物(150mg,0.31mmol),化合物a1-4(129mg,0.31mmol)及碳酸钾(86mg,0.62mmol)溶于n,n-二甲基甲酰胺(1ml)及水(0.1ml)的混合溶剂中,氮气氛围下,向其中加入四三苯基膦钯(36mg,0.03mmol)。将反应升温至100℃搅拌2h。反应液经乙酸乙酯(100ml)稀释后,硅藻土过滤,水洗,合并有机相,浓缩得化合物a2-5及a2-5’的混合物,不经进一步纯化直接用于下一步反应。
[0202]
ms(esi)m/z(m+h)
+
=643.0.
[0203]
步骤5:化合物a2-6的制备
[0204]
将化合物a2-5及a2-5’的混合物(199mg,0.31mmol)溶于二氯甲烷(2ml)中,室温条件下(25℃)向其中滴加三氟乙酸(2ml),反应于室温(25℃)搅拌16h。将体系浓缩得粗品,粗品溶于1n盐酸水溶液中,用乙酸乙酯萃取,水相用1n氢氧化钠溶液碱化至ph大于14,再用乙酸乙酯萃取,有机相经无水硫酸钠干燥,过滤,滤液浓缩,得到化合物a2-6,不经进一步纯化直接用于下一步反应。
[0205]
ms(esi)m/z(m+h)
+
=413.0.
[0206]
类似于实施例a1的合成,合成实施例a2-a4,如下表1所示:
[0207]
表1:实施例a2-a4结构式及其分析数据
[0208][0209]
[0210]
实施例b1的合成
[0211][0212]
步骤1:化合物b1-2-p1及b1-2-p2的制备
[0213]
将化合物a1-3(1.32g,3.5mmol),化合物b1-1(800mg,3.5mmol),碘化亚铜(260mg,1.37mmol),磷酸钾(1.8g,1.37mmol)和(1r,2r)-(-)-n,n'-二甲基-1,2-环己二胺(194mg,13.7mmol)溶于n,n-二甲基乙酰胺(10ml)中,氮气氛围下,将体系升温至110℃搅拌16h。将反应液冷却到室温(25℃),用硅藻土过滤,滤液真空浓缩得到粗品,粗品经c18反相硅胶柱层析纯化后再经sfc拆分(分离条件:色谱柱:chiralpak ad,250
×
30mm i.d.,10μm流动相:[co
2-乙醇(0.1%氨水)];乙醇%:40%;流速:70ml/min;8min柱温:35℃)得到化合物b1-2-p1及b1-2-p2。
[0214]
化合物b1-2-p1:
[0215]
ms(esi)m/z(m+h)
+
=513.2。
[0216]
sfc100%ee保留时间:3.188min。
[0217]
分离条件:色谱柱:chiralpak ad,150
×
4.6mm i.d.,3μm,柱温:35℃,流动相:[co
2-乙醇(0.05%dea)];乙醇%:40%;流速:2.5ml/min.
[0218]
化合物b1-2-p2:
[0219]
ms(esi)m/z(m+h)
+
=513.2。
[0220]
sfc100%ee保留时间:2.598min。
[0221]
分离条件:色谱柱:chiralpak ad,150
×
4.6mm i.d.,3μm,柱温:35℃,流动相:[co
2-乙醇(0.05%dea)];乙醇%:40%;流速:2.5ml/min.
[0222]
步骤2:化合物b1-3的制备
[0223]
将化合物b1-2-p1(265mg,0.517mmol)溶于二氯甲烷(10ml)中,冰浴下加入三氟乙酸(3ml),加毕,将体系升温至室温(25℃)搅拌3h。将体系直接浓缩得粗品,粗品用二氯甲烷(50ml)溶解,向其中加入水(50ml),用饱和碳酸氢钠水溶液调节ph值至9,分液,水相用二氯甲烷(50ml x 3)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩得到化合物b1-3,不经进一步纯化直接用于下一步反应。
[0224]
ms(esi)m/z:(m+h)+=413.0。
[0225]
类似于实施例a1的合成,从中间体b1-3合成实施例b1:
[0226]1h nmr(400mhz,dmso-d6)δ8.14(s,2h),7.67
–
7.58(m,4h),7.48(d,j=2.0hz,2h),7.37(t,j=7.8hz,2h),7.08(dt,j=7.6,1.2hz,2h),6.85(d,j=2.0hz,2h),5.91(t,j=5.7hz,2h),5.80(t,j=5.7hz,2h),4.33(t,j=5.8hz,2h),3.66
–
3.50(m,12h),3.38(t,j=5.7hz,4h),3.14(q,j=5.6hz,4h),2.91(dq,j=24.0,5.5hz,6h),2.76(t,j=5.9hz,4h),2.68(q,j=4.3,3.0hz,10h),2.38(s,6h),1.33
–
1.21(m,4h).
[0227]
ms(esi)m/z(m+h)
+
=1141.40。
[0228]
hplc 100%纯度;保留时间9.768min。
[0229]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min.
[0230]
类似于实施例b1的合成,合成实施例b2~b9,如下表2所示:
[0231]
表2:实施例b2~b9结构式及其分析数据
[0232]
[0233]
[0234]
[0235][0236]
实施例b9盐酸盐的合成
[0237][0238]
将b9(20mg,0.0167mmol)溶于甲醇(1ml)和水(1ml)的混合溶剂中,室温条件(25℃)下向其中加入浓盐酸(0.1ml),将体系于室温超声30min。体系浓缩后冻干得化合物b9盐酸盐。
[0239]
ms(esi)m/z(m/2+h)
+
=615.2。
[0240]
hplc 100%纯度;保留时间7.195min。
[0241]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min.
[0242]
实施例c1的合成
[0243][0244]
步骤1:化合物c1-2的制备
[0245]
将化合物a1-6(160mg,0.38mmol),c1-1(180mg,0.58mmol),磷酸钾(246mg,1.16mmol)和碘化钾(128mg,0.77mmol)溶于n,n-二甲基乙酰胺(6ml)中,将体系升温至100℃搅拌16h。将反应液冷却至室温,过滤,滤液经反相硅胶柱层析纯化(流动相:[水(10mm碳酸氢铵)-乙腈];乙腈:5%-95%,流速:45ml/min),得到化合物c1-2。
[0246]
ms(esi)m/z(m+h)
+
=645.0。
[0247]
步骤2:化合物c1-3的制备
[0248]
将化合物c1-2(200mg,0.48mmol)溶于二氯甲烷(4ml)中,冰浴下加入三氟乙酸(1ml),加毕,将体系升温至室温搅拌3h。将体系直接浓缩得粗品,粗品加入二氯甲烷(20ml)溶解,加入碳酸氢钠溶液调节ph至8-10,二氯甲烷萃取(50ml*3),有机相用无水硫酸钠干燥,过滤,浓缩得到化合物c1-3。
[0249]
ms(esi)m/z:(m+h)
+
=545.0。
[0250]
步骤3:化合物c1的制备
[0251]
将化合物c1-4(12mg,0.214mmol)溶于n,n-二甲基甲酰胺(2ml)中,向其中加入n,n'-二琥珀酰亚胺基碳酸酯(46.8mg,0.183mmol)和三乙胺(55.4mg,0.549mmol),加毕,将体系于室温(25℃)搅拌3h。将化合物c1-3(100mg,0.183mmol)的n,n-二甲基甲酰胺(2ml)溶液加入反应液中,加毕,将体系于60℃下搅拌16h,反应液经高效制备液相纯化(分离条件:色谱柱agilent 10prep-c18 250
×
21.2mm;柱温:25℃;流动相:水(10mm/l碳酸氢铵)-乙腈;乙腈:62%-95%12min,流速:30ml/min)得化合物c1。
[0252]1h nmr(400mhz,methanol-d4)δ7.49
–
7.42(m,4h),7.37(t,j=7.9hz,2h),7.32(d,j=2.1hz,2h),7.13(dt,j=7.7,1.5hz,2h),6.78(dd,j=2.1,1.0hz,2h),4.50
–
4.45(m,2h),4.38(dt,j=10.9,5.7hz,6h),4.10(d,j=16.0hz,2h),3.98
–
3.88(m,4h),3.88
–
3.74(m,4h),3.61(t,j=5.1hz,4h),3.58
–
3.47(m,10h),3.37(t,j=5.4hz,4h),3.32
–
3.25(m,2h),3.23
–
3.22(m,2h),3.11
–
3.03(m,8h),2.95(t,j=10.8hz,2h),2.80(t,j=5.1hz,4h),2.65(s,6h)。
[0253]
ms(esi)m/z(m+h)
+
=1289.40。
[0254]
hplc 100%纯度;保留时间8.012min。
[0255]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%+8min;流速:1.2ml/min。
[0256]
类似于实施例c1的合成,合成实施例c2,如下表3所示。
[0257]
表3:实施例c2结构式及其分析数据
[0258][0259]
实施例d1-p1的合成
[0260][0261]
步骤1:化合物d1-1的制备
[0262]
将化合物(s)-a1-3(2.00g,5.43mmol),1-戊炔酸甲酯(0.80g,7.06mmol),碘化亚铜(206mg,1.08mmol),二氯二三苯基膦钯(380mg,0.54mmol),三乙胺(1.65g,16.3mmol)溶于n,n-二甲基甲酰胺(20.0ml)。加毕,将体系在氮气保护下升温至100℃搅拌2h。将体系冷却至室温后,加入水(100ml)淬灭反应,用乙酸乙酯(20ml*3)萃取。合并有机相用饱和食盐水洗涤后,经无水硫酸钠干燥,过滤,滤液浓缩得粗品,粗品经中压柱层析纯化(乙酸乙酯/石油醚(v/v)=0~20%)得到化合物d1-1。
[0263]
ms(esi)m/z:(m+h)
+
=402.0。
[0264]
步骤2:化合物d1-2的制备
[0265]
将化合物d1-1(400mg,0.99mmol),氢氧化锂(84.0mg,2mmol)溶于甲醇(2ml),四氢呋喃(2ml)和水(2ml)的混合溶剂中,加毕,氮气氛围下,将体系于室温(25℃)搅拌2h。用盐酸(3n)调ph值至6,再用乙酸乙酯(10ml*3)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩得化合物d1-2,不经进一步纯化直接用于下一步反应。
[0266]
ms(esi)m/z:(m+h)
+
=388.0。
[0267]
步骤3:化合物d1-3的制备
[0268]
在室温将化合物d1-2(400mg)溶于二氯甲烷(5.0ml)中,向其中加入草酰氯(1.0g),加毕,将体系升温至55℃搅拌4h。将体系直接浓缩得化合物d1-3,不经进一步纯化直接用于下一步反应。
[0269]
步骤4:化合物d1-5的制备
[0270]
在室温将化合物d1-3(200mg,0.49mmol)溶于乙腈(3.0ml),向其中加入三甲基硅重氮甲烷的己烷溶液(0.98mmol,0.49ml,2n),加毕,将体系于室温(25℃)搅拌30min。向其中加入盐酸的二氧六环溶液(4n,0.5ml),加毕,将体系于室温(25℃)搅拌30min,将体系直接浓缩得粗品d1-4,将化合物d1-4溶解于甲醇和四氢呋喃的混合溶液中(4ml,1:1),室温(25℃)条件下,向其中加入硼氢化钠(50mg),将体系于室温(25℃)搅拌30min,用水(10ml)淬灭反应后,用乙酸乙酯(5ml*3)萃取,合并有机相经无水硫酸钠干燥,过滤,滤液浓缩得粗品。粗品经中压柱层析纯化(乙酸乙酯/石油醚(v/v)=0~25%)得到化合物d1-5。
[0271]
ms(esi)m/z:(m+h)
+
=422.0。
[0272]
步骤5:化合物d1-6的制备
[0273]
将化合物d1-5(180mg,0.43mmol),叠氮钠(83mg,1.28mmol),碘化钠(64mg,0.43mmol)溶于n,n-二甲基甲酰胺中(3.0ml)。加毕,将体系在氮气保护下升温至100℃搅拌4h。冷却至室温后,加入水(10ml)淬灭反应,用二氯甲烷(5ml*3)萃取。合并有机相,用饱和食盐水洗涤后,加入乙醇(15ml),在30℃浓缩至无二氯甲烷流出,得到化合物d1-6的乙醇溶液(5ml),不经进一步纯化直接用于下一步反应。
[0274]
ms(esi)m/z:(m+h)
+
=429.0。
[0275]
步骤6:化合物d1-7的制备
[0276]
将化合物d1-6的乙醇溶液(5ml),水(1.5ml),无水硫酸铜(68.0mg,0.43mmol),维生素c(85.0mg,0.43mmol),三乙胺(130mg,1.29mmol)混合。加毕,将体系在氮气保护下升温至100℃搅拌24h。将体系冷却至室温(25℃)后,向其中加入甲醇(10ml),体系经硅藻土过滤后,将滤液浓缩得粗品,粗品经高效制备液相纯化(分离条件:色谱柱:c18 21.2x250mm;柱温:25℃;流动相:水(10mm/l nh4hco3)-乙腈;乙腈:60%-90%12min;流速30ml/min),得化合物d1-7。
[0277]
ms(esi)m/z:(m+h)
+
=429.0。
[0278]1h nmr(400mhz,dmso-d6)δ7.69
–
7.57(m,2h),7.50(s,1h),7.40(td,j=7.6,3.1hz,1h),7.18(d,j=7.4hz,1h),6.90(s,1h),5.36(d,j=3.8hz,1h),4.51
–
4.15(m,4h),3.80
–
3.50(m,2h),3.09
–
2.74(m,4h),2.44(s,3h),2.05
–
1.77(m,2h).
[0279]
步骤7:化合物d1-8-p1及d1-8-p2的制备
[0280]
0℃条件下,将化合物d1-7(530mg,1.24mmol)溶于四氢呋喃(6ml),向其中加入氢
化钠(99mg),加毕,将体系于0℃下搅拌5min。0℃条件下,向其中加入化合物a1-7(663mg,2.48mmol),加毕,将体系于0℃搅拌10min,将体系升温至50℃搅拌2h,将反应冷却至0℃,向其中加入氢化钠(99mg),加毕,将体系于0℃搅拌5min。0℃条件下,继续将化合物a1-7(663mg,2.48mmol)加入体系中,将体系升温至50℃搅拌2h。将体系冷却至室温后,向其中加水(15ml)淬灭反应,用乙酸乙酯(5ml x 3)萃取,合并有机相经,经无水硫酸钠干燥,过滤,滤液浓缩得粗品,粗品用中压柱层析纯化(甲醇/二氯甲烷(v/v)=0~10%)后再经sfc纯化(chiralpak ad,250
×
30mm i.d.,10μm;流动相:[co
2-乙醇];乙醇%:40%;流速:70ml/min;柱温:38℃)得化合物d1-8-p1及d1-8-p2。
[0281]
化合物d1-8-p1:
[0282]
sfc保留时间6.735min。
[0283]
分离条件:色谱柱:chiralpak ad-3,150
×
4.6mm i.d.,3μm;流动相:[co
2-乙醇(0.05%dea)];乙醇%:40%;流速:2.5ml/min;柱温:35℃。
[0284]
ms(esi)m/z:(m+h)
+
=616.2
[0285]
化合物d1-8-p2:
[0286]
sfc保留时间8.133min。
[0287]
分离条件:色谱柱:chiralpak ad-3,150
×
4.6mm i.d.,3μm;流动相:[co
2-乙醇(0.05%dea)];乙醇%:40%;流速:2.5ml/min;柱温:35℃。
[0288]
ms(esi)m/z:(m+h)
+
=616.2。
[0289]
步骤8:化合物d1-p1及d1-p2的制备
[0290]
类似于实施例d2-p1的合成,分别从化合物d1-8-p1及d1-8-p2合成实施例d1-p1及d1-p2,如下表4所示。
[0291]
实施例d2-p1的合成
[0292][0293]
步骤1:化合物d2-1的制备
[0294]
将化合物(s)-a1-3(1.0g,2.7mmol),三甲基硅乙炔(035g,3.5mmol),碘化亚铜(102mg,0.54mmol),二氯二三苯基膦钯(0.19g,0.27mmol),三乙胺(0.81g,8.1mmol)溶于n,n-二甲基甲酰胺(10.0ml)。加毕,将体系升温至100℃搅拌1h。将体系冷却至室温(25℃),用水(50ml)淬灭反应后,用乙酸乙酯(10ml*3)萃取。合并有机相,经饱和食盐水洗涤后,用无水硫酸钠干燥,过滤,滤液浓缩得粗品,粗品经中压柱层析纯化(乙酸乙酯/石油醚(v/v)=0~20%)得到化合物d2-1。
[0295]
ms(esi)m/z:(m+h)
+
=388.0.
[0296]
步骤2:化合物d2-2的制备
[0297]
室温条件(25℃)下,将化合物d2-1(800mg,2.06mmol),碳酸钾(570.0mg,4.12mmol)溶于甲醇(10ml)。加毕,将体系于室温(25℃)搅拌1h。向体系中加水(30ml)淬灭,用乙酸乙酯(10ml*3)萃取,合并有机相,经饱和食盐水洗涤后,用无水硫酸钠干燥,过滤,滤液浓缩得化合物d2-2,不经进一步纯化直接用于下一步反应。
[0298]
ms(esi)m/z:(m+h)
+
=316.0。
[0299]
步骤3:化合物d2-3的制备
[0300]
将化合物d2-2(500mg,1.58mmol)溶于四氢呋喃(6ml)中,将反应体系冷却至-78℃后,向其中滴加正丁基锂(0.79ml,1.58mmol,2n)。滴加完毕后,将反应于-78℃搅拌15min。向体系中滴加三氟化硼乙醚(224mg,1.58mmol),将体系于-78℃继续搅拌10min后,向其中滴加氯代环氧丙烷(147mg,1.58mmol),将体系于-78℃搅拌1h,向其中加入饱和氯化铵溶液(10ml)淬灭反应,用乙酸乙酯(10ml*2)萃取,合并有机相,经饱和食盐水洗涤后,用无水硫酸钠干燥,过滤,滤液浓缩得粗品,粗品经中压柱层析纯化(乙酸乙酯/石油醚(v/v)=0~25%)得到化合物d2-3。
[0301]
步骤4:化合物d2-4的制备
[0302]
将化合物d2-3(100mg,0.24mmol),叠氮钠(48mg,0.74mmol),碘化钠(37mg,0.24mmol)溶于n,n-二甲基甲酰胺中(2.0ml)。加毕,将体系在氮气保护下升温至100℃搅拌4h。冷却至室温后,加入水(10ml)淬灭反应,用二氯甲烷(5ml*3)萃取。合并有机相,用饱和食盐水洗涤后,加入乙醇(10ml),在30℃浓缩至无二氯甲烷流出,得到化合物d2-4的乙醇溶液(3ml),不经进一步纯化直接用于下一步反应。
[0303]
ms(esi)m/z:(m+h)
+
=415.1。
[0304]
步骤5:化合物d2-5的制备
[0305]
将化合物d2-4的乙醇溶液(3ml),水(1ml),无水硫酸铜(39.0mg,0.24mmol),维生素c(48.0mg,0.24mmol),三乙胺(73mg,0.72mmol)混合于10ml微波反应瓶中。加毕,将体系在氮气保护下升温至130℃搅拌3h。将体系冷却至室温(25℃)后,向其中加入甲醇(10ml),体系经硅藻土过滤后,将滤液浓缩得粗品,粗品经高效制备液相纯化(分离条件:色谱柱:c18 21.2x250mm;柱温:25℃;流动相:水(10mm/l nh4hco3)-乙腈;乙腈:40%-70%12min;流速30ml/min),得化合物d2-5。
[0306]1h nmr(400mhz,dmso-d6)δ7.60
–
7.53(m,1h),7.53
–
7.47(m,1h),7.46
–
7.37(m,1h),7.31(t,j=7.7hz,1h),7.10(d,j=7.4hz,1h),6.82(s,1h),5.74(d,j=5.0hz,1h),5.05
–
4.87(m,1h),4.52
–
4.32(m,1h),4.33
–
4.19(m,1h),4.18
–
3.94(m,1h),3.60(d,j=16.3hz,1h),3.54
–
3.40(m,1h),3.37
–
3.30(m,1h),2.87
–
2.74(m,2h),2.66
–
2.56(m,1h),2.32(s,3h).
[0307]
ms(esi)m/z:(m+h)
+
=429.0。
[0308]
hplc保留时间4.531min。
[0309]
分离条件:色谱柱:waters xselect csh c18 4.6*100mm,3.5um;柱温:40℃;流动相:水(0.01%三氟乙酸)-乙腈(0.01%三氟乙酸);乙腈:5%-95%7min;流速:1.2ml/min。
[0310]
步骤6:化合物d2-6-p1及d2-6-p2的制备
[0311]
0℃条件下将化合物d2-5(83mg,0.2mmol)溶于四氢呋喃(3ml),向其中加入氢化钠(16mg),加毕,将体系于0℃搅拌5min。0℃条件下,向其中加入化合物a1-7(108mg,0.4mmol),加毕,将体系于0℃搅拌10min后,将体系升温至50℃搅拌2h。将反应冷却至0℃,向其中加入氢化钠(16mg),加毕,将体系在0℃下搅拌5min。0℃条件下,向其中加入化合物a1-7(108mg,0.4mmol),将体系升温至50℃搅拌2h。将体系冷却至室温后,用水(10ml)淬灭反应,用乙酸乙酯(5ml*3)萃取,合并有机相,经无水硫酸钠干燥后,过滤,滤液浓缩得粗品。粗品经硅胶柱层析纯化(甲醇/二氯甲烷(v/v)=0~10%)得化合物d2-6,化合物d2-6经sfc
拆分(分离条件:色谱柱:chiralpak ad(250mm*50mm i.d.,10um);流动相:[co
2-乙醇(0.1%氨水)];乙醇%:45%-45%)得到化合物d2-6-p1及d2-6-p2。
[0312]
ms(esi)m/z:(m+h)
+
=602.2。
[0313]
化合物d2-6-p1:
[0314]
sfc 100%ee.保留时间2.815min。
[0315]
分离条件:色谱柱:chiralpak ad-3 150
×
4.6mm i.d.,3um;柱温:35℃;流动相:co
2-乙醇(0.05%dea),乙醇:40%-40%;流速:2.5ml/min.
[0316]
化合物d2-6-p2:
[0317]
sfc 100%ee.保留时间4.134min。
[0318]
分离条件:色谱柱:chiralpak ad-3 150
×
4.6mm i.d.,3um;柱温:35℃;流动相:co
2-乙醇(0.05%dea),乙醇:40%-40%;流速:2.5ml/min.
[0319]
步骤7:化合物d2-7-p1的制备
[0320]
0℃条件下,将化合物d2-6-p1(31mg)溶于二氯甲烷(3ml),向其中加入三氟乙酸(1ml),加毕,将体系在0℃下搅拌15min。体系浓缩得粗品,将粗品溶于乙酸乙酯(5ml)中,用饱和碳酸氢钠溶液(10ml)洗涤,合并有机相,经无水硫酸钠干燥后,过滤,滤液浓缩得化合物d2-7-p1,不经进一步纯化直接用于下一步反应。
[0321]
ms(esi)m/z:(m+h)
+
=502.2。
[0322]
步骤8:化合物d2-p1的制备
[0323]
室温下将化合物d2-7-p1(25mg)溶于n,n-二甲基甲酰胺中(2ml),向其中加入丁二异氰酸酯(2.83mg,0.02mmol,0.4eq),加毕,将体系于室温(25℃)搅拌1h。体系浓缩得粗品,粗品经高效制备液相纯化(分离条件:色谱柱:c18 21.2x250mm;柱温:25℃;流动相:水(10mm/l碳酸氢铵)-乙腈;乙腈:60%-90%12min;流速30ml/min),得化合物d2-p1。
[0324]
ms(esi)m/z:(m+h)
+
=1143.4。
[0325]
hplc保留时间:7.752min。
[0326]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min。
[0327]1h nmr(400mhz,dmso-d6)δ7.66(s,2h),7.64-7.54(m,2h),7.48(s,2h),7.42
–
7.33(m,2h),7.18-7.13(d,j=7.6hz,2h),6.89(s,2h),5.89(t,j=5.6hz,2h),5.79(t,j=5.6hz,2h),4.98-4.91(m,2h),4.64-4.51(m,2h),4.44
–
4.28(m,4h),3.72
–
3.61(m,6h),3.59
–
3.48(m,6h),3.47
–
3.39(m,6h),3.19
–
3.06(m,6h),3.00
–
2.84(m,6h),2.70-2.64(m,2h),2.39(s,6h),1.33
–
1.22(m,4h)。
[0328]
类似于实施例d2-p1的合成,合成实施例d1-p1、d1-p2和d2-p2,如下表4所示:
[0329]
表4:实施例d1-p1、d1-p2和d2-p2结构式及其分析数据
[0330][0331][0332]
实施例e1的合成
[0333]
步骤1:化合物e1-1的制备
[0334]
将化合物a1-3(3.71g,10.0mmol),碘化亚铜(1.91g,10.0mmol),碘化钠(3g,20.0mmol),(1r,2r)-(-)-n,n'-二甲基-1,2-环己二胺(2.84g,20.0mmol)溶于1,4-二氧六环(50ml)溶液中,氮气氛围下,将体系升温至110℃搅拌16h。将反应液冷却到室温(25℃),用硅藻土过滤,滤液真空浓缩得到粗品,粗品经c18反相硅胶柱层析纯化(乙腈/0.1%碳酸氢铵水溶液(v/v)=5~95%)得到化合物e1-1。
[0335]
ms(esi)m/z(m+h)
+
=417.8.
[0336]
步骤2:化合物e1-3-p1及e1-3-p2的制备
[0337]
将化合物e1-1(4.2g,10mmol),化合物e1-2(2.67g,12.0mmol),碘化亚铜(1.50g,8.0mmol),碳酸铯(9.75g,30.0mmol),(1r,2r)-(-)-n,n'-二甲基-1,2-环己二胺(2.27g,16.0mmol)溶于n,n-二甲基甲酰胺(50ml)中,氮气氛围下,将体系升温至140℃搅拌10h。将反应液冷却到室温(25℃),用硅藻土过滤,滤液真空浓缩得到粗品,粗品经c18反相硅胶柱层析纯化(乙腈/0.1%碳酸氢铵水溶液(v/v)=5~95%)后得化合物e1-3-p1及e1-3-p2的混合物。
[0338]
ms(esi)m/z(m+h)
+
=513.2。
[0339]
步骤3:化合物e1-4-p1及e1-4-p2的制备
[0340]
将化合物e1-3-p1及e1-3-p2的混合物溶于无水甲醇(30ml)中,向其中加入浓盐酸(20ml),加毕,将体系于室温(25℃)搅拌1h。反应液真空浓缩得到粗品,用二氯甲烷(200ml)溶解,向其中加入水(200ml),用饱和碳酸氢钠水溶液调节ph值至9,分液,水相用二氯甲烷(100ml x 2)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩得到粗品,粗品经sfc拆分(分离条件:色谱柱:phenomenex-cellulose-2(250mm*30mm,10um);流动相:[co
2-异丙醇(0.1%氨水)];异丙醇%:50%-50%)得到化合物e1-4-p1及e1-4-p2。
[0341]
化合物e1-4-p1:
[0342]1h nmr(400mhz,dmso-d6)δ7.79(s,1h),7.48(d,j=2.1hz,1h),7.47
–
7.41(m,1h),7.34
–
7.26(m,3h),6.98
–
6.94(m,1h),4.35(t,j=5.4hz,1h),3.75
–
3.62(m,3h),3.47(d,j=16.1hz,1h),2.94
–
2.82(m,3h),2.72(dd,j=11.6,5.8hz,1h),2.48(d,j=16.0hz,2h),2.38(s,3h).
[0343]
ms(esi)m/z(m+h)
+
=413.0。
[0344]
hplc 95.2%纯度;保留时间6.019min。
[0345]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min。
[0346]
化合物e1-4-p2:
[0347]1h nmr(400mhz,dmso-d6)δ7.79(s,1h),7.49(d,j=2.1hz,1h),7.44(t,j=7.8hz,1h),7.33
–
7.24(m,3h),6.94(d,j=2.1hz,1h),4.34(t,j=5.4hz,1h),3.77
–
3.62(m,3h),3.48(d,j=16.2hz,1h),2.93(t,j=5.7hz,2h),2.85(dd,j=11.6,5.1hz,1h),2.72(dd,j=11.6,5.9hz,1h),2.48(s,2h),2.39(s,3h)
[0348]
ms(esi)m/z(m+h)
+
=413.0。
[0349]
hplc 99.5%纯度;保留时间5.744min。
[0350]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5μm;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min,95%8min;流速:1.2ml/min。
[0351]
类似于实施例a1的合成,合成实施例e1~e2,如下表5所示:
[0352]
表5:实施例e1~e2结构式及其分析数据
[0353][0354]
实施例f1的合成
[0355]
[0356]
步骤1:化合物f1-1的制备
[0357]
将化合物(s)-a1-3(3.71g,10.0mmol),三甲基硅乙炔(1.17g,12mmol),双(三苯基膦)二氯化钯(350mg,0.5mmol),碘化亚铜(190mg,1mmol)及三乙胺(20ml)溶于乙腈(20ml),氮气氛围下,将体系升温至100℃搅拌3h。将反应液冷却到室温(25℃),用硅藻土过滤,滤液真空浓缩得化合物f1-1,不经进一步纯化直接用于下一步反应。
[0358]
(esi)m/z(m+h)
+
=388.0
[0359]
步骤2:化合物f1-2的制备
[0360]
将步骤1中化合物f1-1,碳酸钾(2.76g,20mmol)溶于甲醇(40ml)。加毕,将体系于室温(25℃)搅拌2h。向其中加入水(200ml),用二氯甲烷(100ml x 3)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩。将浓缩后得到的残留物,将残留物溶于二氧六环(10ml)中,向其中加入4n盐酸二氧六环溶液(5ml),体系析出固体。过滤,滤饼干燥得到化合物f1-2,不经进一步纯化直接用于下一步反应。
[0361]
ms(esi)m/z(m+h)
+
=315.8
[0362]
步骤3:化合物f1-4的制备
[0363]
将化合物f1-2(705mg,2mmol)溶于乙醇(12ml),依次向其中加入n,n-二异丙基乙胺(300mg,2.32mmol),化合物f1-3(396mg,2mmol),硫酸铜(28mg,0.17mmol),l-抗坏血酸钠(84mg,0.42mmol)和水(4ml)。加毕,氮气氛围下,将体系于室温(25℃)搅拌1h。反应液经硅藻土过滤,滤液加水(100ml)稀释,用二氯甲烷(100ml x 2)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩得到化合物f1-4,不经进一步纯化直接用于下一步反应。
[0364]
ms(esi)m/z(m+h)
+
=514.0
[0365]
步骤4:化合物f1-5的制备
[0366]
将化合物f1-4(920mg,1.78mmol)溶于无水甲醇(4ml)中,向其中加入浓盐酸(4ml),加毕,将体系于室温(25℃)搅拌1h。反应液真空浓缩得到粗品,用二氯甲烷(20ml)溶解,向其中加入水(20ml),用饱和碳酸氢钠水溶液调节ph值至9,分液,水相用二氯甲烷(20ml x 2)萃取,合并有机相,经无水硫酸钠干燥,过滤,滤液浓缩得到化合物f1-5,不经进一步纯化直接用于下一步反应。
[0367]
ms(esi)m/z(m+h)
+
=414.0.
[0368]
步骤5:化合物f1的制备
[0369]
类似于实施例a1的合成,合成实施例f1:
[0370]1h nmr(400mhz,methanol-d4)δ8.44(s,2h),7.66(dt,j=7.7,1.4hz,2h),7.58(s,2h),7.32(t,j=7.7hz,2h),7.21(d,j=2.0hz,2h),7.14
–
7.06(m,2h),6.69(t,j=1.5hz,2h),5.30
–
5.16(m,2h),4.25(dd,j=9.1,5.8hz,2h),3.90
–
3.77(m,6h),3.64(dd,j=8.7,6.5hz,4h),3.49
–
3.40(m,6h),3.36(t,j=5.3hz,4h),3.18(t,j=5.3hz,4h),3.02
–
2.93(m,6h),2.73(t,j=5.1hz,4h),2.56(dd,j=11.7,9.2hz,2h),2.39(s,6h),1.32(t,j=3.1hz,4h).
[0371]
ms(esi)m/z(m+h)
+
=1143.40.
[0372]
hplc 98.8%纯度;保留时间7.171min。
[0373]
分离条件:色谱柱:waters xbridge 4.6*100mm,3.5um;柱温:40℃;流动相:水(10mm nh4hco3)-乙腈;乙腈:5%-95%7min;95%8min流速:1.2ml/min.
[0374]
实例1在瞬时和持久性条件下的基于细胞的nhe3活性分析
[0375]
负鼠肾细胞(opossum kindney,ok)是从atcc获得,并根据其说明进行培养扩增。通过慢病毒感染的方法构建表达rat nhe3(基因库登记号:m85300)蛋白的ok单克隆稳转细胞株和human nhe3基因库登记号:nm_004174.1)蛋白的ok单克隆稳转细胞株。
[0376]
在瞬时条件(瞬时抑制)下在基于细胞的nhe3活性实验大致流程基于最初由钱(tisen)(美国国家科学院院刊(proc.natl.acad.sci.usa)(1984)81(23):7436-7440)所报道的ph敏感性染料法的改编方法,测量大鼠nhe3介导的na+依赖性h+反向转运,并根据molecular devices公布的说明书《measuring intracellular ph with the flipr and flipr 384fluorometric imaging plate reader systems》进行了优化。具体方法是:将rat nhe3 ok单克隆细胞或human nhe3 ok单克隆细胞接种到384孔板中并且生长过夜。从孔抽吸培养基,细胞用flipr缓冲液(hank’s bss 1x,20mm hepes,1%bsa)洗涤两次,接着在室温下用含有5mm bcecf-am(invitrogen)的flipr缓冲液(hank’s bss 1x,20mm hepes,1%bsa)培育45min。随后加入5ml的200mm nh4cl-hepes缓冲液(hank’s bss 1x,20mm hepes,200mm nh4cl)在室温下孵育15-20分钟。细胞用20mm nh4cl-hepes缓冲液(hank’s bss 1x,20mm hepes,20mm nh4cl)洗涤两次。通过添加含0.4mm阿米洛利(eipa)和0-30mm测试化合物或na-hepes缓冲液(100mm nacl,50mm hepes,10mm glucose,5mm kcl,2mm cacl2,1mm mgcl2,ph 7.4),并且分别监测由λex440nm和λex 490nm激发bcecf-am荧光在λem 535nm的荧光来标准化细胞中nhe3介导的ph的敏感性化。设ratio=荧光值(λex490nm)/荧光值(λex440nm),计算复孔间终止时间和起始时间的ratio差值的平均值,对该平均值和化合物的浓度值进行绘图,使用graphpad prism软件估算ic
50
值,结果如表6。
[0377]
在持久条件(持久抑制)下在基于细胞的nhe3活性实验大致流程为:将rat nhe3 ok单克隆细胞或human nhe3 ok单克隆细胞接种到384孔板中并且生长过夜。从孔抽吸培养基,细胞用flipr缓冲液(hank’s bss 1x,20mm hepes,1%bsa)洗涤两次,接着添加含有0-30mm测试化合物的na-hepes缓冲液(100mm nacl,50mm hepes,10mm glucose,5mm kcl,2mm cacl2,1mm mgcl2,ph 7.4)室温孵育60分钟。从孔抽吸化合物,在室温下用含有5mm bcecf-am(invitrogen)的flipr缓冲液(hank’s bss 1x,20mm hepes,1%bsa)培育45min。随后加入5ml的200mm nh4cl-hepes缓冲液(hank
‘
s bss 1x,20mm hepes,200mm nh4cl)在室温下孵育15-20分钟。细胞用20mm nh4cl-hepes缓冲液(hank’s bss1x,20mm hepes,20mm nh4cl)洗涤两次。通过添加含0.4mm阿米洛利(eipa,不抑制nhe3的nhe-1活性的选择性拮抗剂)的na-hepes缓冲液(100mm nacl,50mm hepes,10mm glucose,5mm kcl,2mm cacl2,1mm mgcl2,ph 7.4),并且分别监测由λex440nm和λex 490nm激发bcecf荧光在λem 535nm的荧光来标准化细胞中nhe3介导的ph的敏感性化。设ratio=荧光值(λex490nm)/荧光值(λex440nm),计算复孔间终止时间和起始时间的ratio差值的平均值,对该平均值和化合物的浓度值进行绘图,使用剂量-响应-抑制(四参数)等式通过graphpadprism计算ic50,结果如表6。
[0378]
表6:化合物在瞬时和持久条件下的基于负鼠肾细胞的nhe3抑制活性
[0379][0380]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1