油菜BnLAC2基因在提高抗寒早花中的应用
油菜bnlac2基因在提高抗寒早花中的应用
技术领域
1.本发明属于生物技术领域,具体涉及油菜bnlac2基因在提高抗寒早花中的应用。
背景技术:
2.油菜是中国第二大油料作物,仅次于大豆。它肩负着我国植物油供给的重任,所产菜籽油占国产油料作物产油的57%以上。目前中国油料作物自给率不足40%,每年仍需从国外进口大量油菜籽,因此油菜发展不仅对中国农业生产和国民经济有重要影响,而且对国家油料供应安全也具有重要意义。
3.我国冬油菜区油菜面积占全国油菜总面积90%以上,主要种植在长江流域,该地区以水稻种植为生产中心,实行稻油轮作的耕作制度。直播油菜适宜播期为 10月中上旬,适期播种能保证油菜幼苗充分利用冬前温光资源达到较大的生物量,为越冬以后各生育期奠定基础。因此生长温度是影响油菜苗期生长、光合效率、产量的重要因素。目前由于优质稻生育期的延长,油菜的播种期推迟,导致越冬前油菜生长的有效积温下降,植株生长缓慢,容易遭受低温伤害。极端温度胁迫包括冷害(0-15℃)和寒害(《0℃)胁迫,可导致作物光合作用减弱、生物量积累减缓、产量下降。为应对生产上播期推迟引起的不量影响,油菜抗寒性、早熟性已经成为育种家们关注的重点。
4.油菜是喜凉作物,但抗寒基因挖掘及分子机制研究相对较少,缺少关键的分子标记,油菜抗寒改良也迫切需要丰富的基因资源。漆酶是一类参与生物木质素代谢的酶类,遗传和生化研究发现该基因的表达可以激活一系列抗逆反应。突变该蛋白并进行功能性研究,为油菜早花抗寒性改良提供突变体资源。
技术实现要素:
5.本发明的目的在于提供了油菜bnlac2基因在提高油菜抗寒早花中的应用,利用crispr/cas9技术靶向编辑油菜bnlac2基因可以有效提高寒害处理后油菜的生物量并提前两周开花。
6.为了实现上述目的,本发明采取以下技术方案:
7.一种提高油菜抗寒早花的方法,所述方法是利用crispr/cas9技术靶向编辑油菜bnlac2基因,所述bnlac2基因的cdna序列如seq id no.1所示。
8.进一步地,提高油菜抗寒早花的方法,包括以下步骤:
9.设计两条特异性靶向油菜bnlac2基因的sgrna,将其构建到含有cas9的基因编辑骨架上,将基因编辑骨架构建到遗传转化载体上,通过农杆菌介导的遗传转化技术导入到甘蓝型油菜下胚轴的愈伤组织中,通过组织培养获得再生苗。 cas9核酸酶在两条sgrna的引导下对bnlac2的基因组序列进行编辑,通过对再生苗中bnlac2基因序列测序,在两条sgrna内部均发现碱基的插入突变。后续表型检测结果表明,纯合突变株系寒害处理后相比野生型油菜的生物量显著提高,开花期相比野生型油菜提前两周。
10.本发明与现有技术相比,具有以下优点和效果:
11.本发明首次从油菜中克隆到一个新的与开花期抗寒性相关的基因,将本发明所提供的基因在油菜中定点编辑后,抗寒鉴定结果表明bnlac2的突变系在寒害处理下,生物量积累显著高于野生型。同时在正常条件下提早开花。本发明中 bnlac2突变体系的获得为早花抗寒品种的培育提供了珍贵的基因资源,对解析植物早花抗寒分子机制有重要意义。
附图说明
12.图1为bnlac2基因的两个靶标位点。
13.图2为基因编辑载体pylcrispr/cas9-mh(b)的示意图。
14.图3为bnlac2-cas9 t0代突变单株的核苷酸序列。
15.图4为bnlac2-cas9 t0代突变单株的测序峰图。
16.图5为bnlac2突变株系在人工模拟寒害胁迫下的生长状态示意图。wt为油菜野生型,lac2-7、lac2-8为两个独立的油菜突变纯合株系。
17.图6为野生型植株和突变植株在寒害胁迫后的生物量比较。wt为油菜野生型,lac2-7、lac2-8为两个独立的油菜突变纯合株系。
18.图7为野生型植株和突变植株的开花期表型。wt为油菜野生型,lac2-7、 lac2-8为两个独立的油菜突变纯合株系。
19.图8为野生型植株和突变植株的开花期比较。wt为油菜野生型,lac2-7、 lac2-8为两个独立的油菜突变纯合株系。
具体实施方式
20.下面结合具体实施例对本发明作进一步说明,但本发明并不限于以下实施例。
21.实施例1甘蓝型油菜bnlac2基因crispr-cas9的sgrna设计与载体 bnlac2-cas9的构建
22.(1)sgrna序列确定
23.甘蓝型油菜为四倍体作物,bnlac2基因在这两套基因组中各有一个拷贝,bnlac2基因的cdna的核苷酸序列如seq id no.1所示。将这两个拷贝进行序列比对,在保守区域寻找pam(proto ad ja cent motif)基序(ngg)。本发明设计了两条sgrna,其序列如seq id no.2和seq id no.3所示,且均位于第一外显子中,靶标位点如图1所示。
24.(2)oligo dna单链的合成
25.up oligo:5
’‑
attg+sgrna序列-3’26.low oligo:5
’‑
aaac+sgrna反向互补序列-3’27.本发明的两对oligo dna单链序列如seq id no.4、seq id no.5和seqid no.6、seq id no.7所示,由武汉擎科生物科技有限公司合成。
28.(3)制备oligo二聚体
29.将合成的两对靶位点引物加水溶解至10μm,各取10μl加入80μl双蒸水中,混合后,使用pcr仪95℃加热3分钟,然后以约0.2℃/秒的速度缓慢降至 25℃。
30.(4)bnlac2基因crispr-cas9载体的构建
31.第一轮pcr
32.配制10μl 1
×
bsai酶切连接反应液,用两个靶序列分别做两个反应体系,分别命
名为lac2-k1、lac2-k2。
[0033][0034][0035]
用变温循环仪(或pcr仪)循环反应5循环:37℃5min,20℃5min。取 1μl连接产物(k1和k2)为模板,使用引物u_f+接头反向引物(反应1),和接头正向引物+grna_r(反应2),各0.2μm。不要使用能在产物3’附加a 碱基的taq酶,此a碱基使产物在第二轮pcr中不与互补链配对而不能延伸补平。
[0036] 引物组合命名为反应1u_f+lac2-k1rt11反应2grna_r+lac2-k1ft12反应1u_f+lac2-k2rt21反应2grna_r+lac2-k2ft22
[0037]
u_f:ctccgttttacctgtggaatcg
[0038]
grna_r:cggaggaaaattccatccac
[0039]
lac2-k1f:attgtagctcgtactgttgatagg
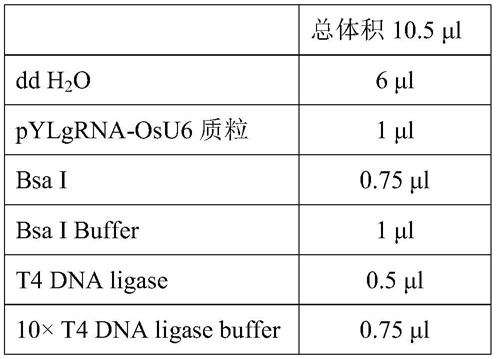
[0040]
lac2-k1r:aaaccctatcaacagtacgagcta
[0041]
lac2-k2f:attgaggtcttgctagcatgtaga
[0042]
lac2-k2r:aaactctacatgctagcaagacct
[0043]
反应体系按照下表配置:
[0044][0045]
对扩增产物(t11、t12、t21、t22)取4μl+2μl 10
×
dna loading电泳检测。随后进行
第二轮pcr,包含两个反应,取第一轮pcr反应1、2产物1μl用h2o 稀释10倍,各取1μl混合为模板,反应结束将t1和t2产物一起进行胶回收,体系如下:
[0046][0047][0048]
pps-r:ttcagaggtctctctcgactagtatggaatcggcagcaaagg
[0049]
pgs-2:agcgtgggtctcgtcagggtccatccactccaagctc
[0050]
pps-2:ttcagaggtctctctgacactggaatcggcagcaaagg
[0051]
pgs-l:agcgtgggtctcgaccgacgcgtatccatccactccaagctc
[0052]
(5)靶位点连接到crispr终载体
[0053]
按照下面的反应体系对pylcrispr/cas9-mh(b)(图2)载体进行酶切,在 pcr仪中37℃酶切10min。
[0054] 15μlpylcrispr/cas9-mh(b)质粒1μlbsai0.5μlbsa i buffer1.5μl胶回收的pcr产物(t1+t2)4μldd h2o8μl
[0055]
之后加入0.5μl t4 dna ligase和0.3μl t4 dna ligase buffer,用pcr仪酶切连接约10-15循环(37℃2min,10℃3min,20℃5min),最后37℃,2min。
[0056]
(6)大肠杆菌的转化
[0057]
冰上解冻50μl感受态细胞dh5α,取5μl上述重组产物加入其中,轻弹混匀,冰上静止25min。42℃水浴热激45s,立即置于冰上2min。加入500μl无抗生素的液体lb培养液,倾斜置于37℃摇床上,180rpm,培养1h。吸取200 μl菌液均匀涂抹于kan抗性平板上,于37℃培养箱过夜培养(12h~16h)。在抗性板上将长出的菌斑送往武汉擎科生物科技有限公司进行测序。
[0058]
实施例2:bnlac2-cas9载体转化农杆菌gv3101
[0059]
分别将1μl的bnlac2-cas9加入到100μl的gv3101农杆菌感受态细胞中,混匀后冰浴5分钟,液氮冷冻1分钟后,37℃水浴5分钟,加入500μl液体lb 培养基,28℃,200rpm摇床复苏1小时。取100μl菌液涂布于含有50mg/l卡那霉素、50mg/l庆大霉素和50mg/l利福平的lb固体培养皿上;28℃培养2 天,挑取单克隆,接种于含有50mg/l卡那霉素、50mg/l庆大霉素和50mg/l 利福平的lb液体培养基,在28℃200rpm摇床培养过夜,然后用载体上引物进行pcr鉴定。随后将农杆菌菌液与50%甘油混合,存于-80℃超低温冰箱。
[0060]
实施例3:bnlac2-cas9农杆菌转化甘蓝型油菜下胚轴
[0061]
1、播种
[0062]
用适量的75%的酒精浸泡油菜种子1min,倒掉酒精用无菌水清洗一遍,倒掉水,再用50%的84消毒液(无菌水:商用84液=1:1)灭菌10分钟,消毒后将消毒液倒进废液缸,对污染较重的种子,灭菌时间可延长到20min。然后用适量无菌水洗涤种子5次。用无菌镊子将处理过的种子播种到m0培养基,每皿播种 20-25粒,然后将培养皿放进无菌培养盒中,置黑暗条件下24℃培养5-6天。
[0063]
2、农杆菌的活化和制备
[0064]
(1)浸染前一天,将灭菌处理过的100ml液体lb培养基中加入抗生素,农杆菌菌种接入,于280℃、200rpm摇床中振荡培养过夜。测菌的od值(lb 中0.8左右较好,一般16小时即可)。
[0065]
(2)将培养好的菌液平分倒入两个50ml无菌离心管中,3000rpm离心20 min,拿到超净工作台倒掉上清液,用1ml dm(已加as)轻轻洗涤一下菌体,然后倒掉,加入1ml的dm吸打混匀。浸染菌液配置好后放在冰上活化。
[0066]
(3)同时用无菌镊子和解剖刀垂直切取上述暗培养下幼苗的下胚轴,在dm 液体中切取,外植体最适长度为0.8-1.0cm,将切好的外植体放入配制好浓度的含有目的菌液的皿中浸染15min,每皿中外植体的数量以150个左右为宜,隔断时间摇晃4-5次。
[0067]
(4)浸染之后用无菌镊子将外植体轻轻夹出,放置无菌滤纸上去掉表面多余菌液,再用无菌镊子将外植体摆放到m1培养基上,黑暗条件下24℃共培养 48h。
[0068]
3、选择培养
[0069]
共培养之后,将外植体转移到m2培养基上进行选择培养15-20天,培养条件为24℃光培养,白天16小时/晚上8小时。
[0070]
4、分化培养
[0071]
将选择培养之后的外植体转移到m3培养基上进行分化培养,每隔20天左右继代一次,直至出芽。培养条件为24℃光培养,白天16小时/晚上8小时。
[0072]
5、生根培养及移栽
[0073]
待分化出芽至能看到明显的生长点后,用无菌镊子和解剖刀将芽小心翼翼地从愈伤组织上切下,避免连带多余的愈伤组织,同时避免碰伤生长点,然后转移到m4培养基上生根。玻璃化的幼芽要经历一段时间的培养后才能转为正常,继而生根获得转化苗。
[0074]
转化培养基的配制方法:
[0075]
(1)播种培养基m0:1l培养基中加ms 2.22g,琼脂(agar)8g,ph调整到5.8-5.9;
[0076]
(2)菌液活化培养基dm:1l培养基中加ms 4.43g,蔗糖(sucrose)30g, ph调整到
5.8-5.9,灭菌后加as 1ml(100mmol/ml),2,4-d 2ml(0.5mg/ml), kt 1.5ml(0.2mg/ml);
[0077]
(3)共培养培养基m1:1l培养基中加ms 4.43g,蔗糖(sucrose)30g,甘露醇(manitol)18g,2,4-d 2ml(0.5mg/ml),kt 1.5ml(0.2mg/ml),ph 调整到5.8-5.9,灭菌后加as 1ml;
[0078]
(4)选择培养基m2:1l培养基中加ms 4.43g,蔗糖(sucrose)30g,甘露醇(manitol)18g,2,4-d 2ml(0.5mg/ml),kt 1.5ml(0.2mg/ml),ph调整到5.8-5.9,灭菌后加agno
3 213μl(20mm/l),timentin 1ml(300mg/ml), 500μl卡那霉素(50mg/ml);
[0079]
(5)分化培养基m3:1l培养基中加ms 4.43g,葡萄糖(glucose)10g,木糖(xylose)0.25g,mes 0.6g,ph调整到5.8-5.9,灭菌后加zt(0.5mg/ml)4 ml,iaa 200μl(0.5mg/ml),timentin 1ml(300mg/ml),500μl卡那霉素(50mg/ml);
[0080]
(6)生根培养基m4:1l培养基中加ms 2.22g,蔗糖(sucrose)10g,iba 5 ml(0.1mg/ml),琼脂(agar)8g,灭菌后加timentin 500μl(300mg/ml);
[0081]
(7)液体lb培养基:1l培养基中加氯化钠10g,蛋白胨10g,酵母5g;
[0082]
(8)固体lb培养基:1l培养基中加氯化钠10g,蛋白胨10g,酵母5g,琼脂8g。
[0083]
实施例4:转基因植株突变检测
[0084]
1、转化植株筛选与检测
[0085]
取15株bnlac2-cas9转化苗的叶片,利用ctab方法提取植株dna,利用引物nptiif68:5
’‑
actgggacaacagacaatcg-3’,nptiir356:5
‑ꢀ
gcatcagccatgatggatacttt-3’进行扩增,产物为289bp。扩增出条带的为转基因阳性植株。
[0086]
2、bnlac2基因(bnaa05g13050d)的1个同源拷贝在c亚基因组第四染色体上(bnac04g54790d),因此在序列保守区设计1对测序引物lac2seqf:5
’ꢀ‑
atgctgcactcgatgatgaactc-3’、lac2seqr:5
’‑ꢀ
cgatttttggaacgtttgccggg-3’,pcr产物回收纯化后进行测序,与 bnlac2及其拷贝的参考序列进行比对。测序结果显示bnlac2-cas9阳性转化植株中有2株在bnlac2的两个靶位点有纯合插入突变,在bnac04g54790d基因内未检测到突变,位点核苷酸序列图3所示,测序峰图如图4所示。
[0087]
实施例5:转基因t1代植株的表型观察
[0088]
1、bnlac2-7和bnlac2-8在靶位点均发生了纯合的单碱基插入,将t0 代收种后,继续播种种植t1代。使用lac2seqf与lac2seqr引物进行pcr检测,结果显示,t1代为纯合突变,与t0代突变一致,bnlac2被敲除,其拷贝未被敲除。将t1代油菜突变植株和野生型同时播种于培养基质(蛭石:营养土为1: 1体积比混合),22℃培养一个月;
[0089]
2、选取长势一致的幼苗放入4℃培养箱处理3周;随后将幼苗取出,转移至正常生长条件恢复3天。结果如图5所示,突变体在寒害处理后,长势明显强于野生型。图6中的生物量统计分析表明,突变体油菜的生物量积累明显高于野生型材料,可以用于植物抗寒性育种。
[0090]
3、一直在正常生长条件下的突变体油菜开花时,野生型油菜还未抽薹(图 7),统计结果表明bnlac2-7和bnlac2-8两个突变体系的开花时间明显早于野生型(图8)。
[0091]
根据以上数据,可以看出,相对于其受体亲本,bnlac2-cas9突变株系对低温的适应性增强,开花时间提前。为早熟抗寒油菜的品种改良提供了优秀的种质资源和理论技术支持。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1