用于治疗CDKL5缺陷障碍的基因疗法的制作方法
用于治疗cdkl5缺陷障碍的基因疗法
1.相关申请的交叉引用
2.本技术要求于2020年2月14日提交的美国临时专利申请号62/976,483;以及于2020年10月12日提交的美国临时专利申请号63/090,492的权益和优先权,出于所有目的,其披露内容通过引用以其全文特此并入。
3.序列表
4.本技术包含序列表,该序列表已以ascii格式电子提交,并通过引用以其全文特此并入。所述ascii副本创建于2021年2月8日,名为ulp-007wo_sl.txt,大小为80,765字节。
技术领域
5.本披露总体上涉及重组腺相关病毒载体、重组腺相关病毒、及其在用于治疗cdkl5缺陷障碍的基因疗法中使用的方法。
背景技术:
6.cdkl5缺陷障碍(cdd)是由cdkl5基因突变引起的罕见神经发育性疾病,该神经发育性疾病可以表现为广泛的临床症状,严重程度差异较大。cdd的标志包括婴儿期发病难治性癫痫、发育延迟、智力残疾、视力损伤、语言缺乏、肌张力低下、运动功能障碍、睡眠紊乱、胃肠功能障碍和呼吸困难。虽然罕见,但据信发生率为40,000-60,000名活产婴儿中大约1名,从而使其成为遗传性癫痫中最常见的形式之一。
7.cdkl5基因编码对正常大脑发育和功能必不可少的细胞周期蛋白依赖性激酶样5(cdkl5)蛋白。cdkl5蛋白参与大脑中神经元的形成、生长和迁移。其在大脑中广泛表达,主要存在于神经元和树突中,在细胞增殖、神经元迁移、轴突生长、树突状形态发生和突触发育中发挥作用。
8.cdd由cdkl5基因中的病原性变体引起,这些病原性变体包括缺失、截短、剪接变体和错义突变。参见olson等人,2019,pediatric neurology[小儿神经病学]97:18-25。这些变体可以减少功能性cdkl5蛋白的量和/或降低其在神经元中的活性。已发现超过150种cdkl5基因突变可引起cdd。参见del rosso等人,2017,the eurobiotech journal[欧洲生物技术杂志]1(2):122-127。
[0009]
迄今为止,没有解决cdd(即cdkl5缺陷)的根本原因的治疗。目前,由于严重的运动和智力残疾,cdd患者通常需要24/7护理。此外,cdd患者经历的癫痫发作通常无法用现有的抗癫痫药物得到良好控制。因此,迫切需要解决疾病(功能性cdkl5缺陷)的根本原因的治疗方法。
[0010]
本发明经由形成腺相关病毒载体来解决这一需要,这些载体介导编码功能性cdkl5的基因向患有cdd的患者的转移。本发明还描述了将编码功能性cdkl5的基因递送至患有cdd的患者的重组腺相关病毒(raav)的形成。
技术实现要素:
[0011]
本发明提供了组合物及其用于基因疗法的方法。更特别地,本文提供了重组腺相关病毒(raav),其包含腺相关病毒(aav)衣壳和包装在其中的用于治疗cdd的载体基因组。
[0012]
在一方面,本披露提供了重组腺相关病毒(raav),其包含aav衣壳、和包装在其中的载体基因组,其中所述载体基因组包含:(a)启动子序列和(b)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列。
[0013]
在另一方面,本披露提供了重组腺相关病毒(raav),其包含aav衣壳、和包装在其中的载体基因组,其中所述载体基因组包含:(a)5
’‑
末端反向重复序列(5
’‑
itr)序列;(b)启动子序列;(c)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列;和(d)3
’‑
末端反向重复序列(3
’‑
itr)序列。
[0014]
在又另一方面,本披露提供了raav,其包含aav衣壳、和包装在其中的载体基因组,其中所述载体基因组包含:(a)5
’‑
itr序列;(b)启动子序列;(c)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列;(d)聚腺苷酸化信号序列;和(e)3
’‑
itr序列。
[0015]
在又另一方面,本披露提供了raav,其包含aav衣壳、和包装在其中的载体基因组,其中所述载体基因组包含:(a)5
’‑
itr序列;(b)增强子序列;(c)启动子序列;(d)内含子序列;(e)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列;(f)聚腺苷酸化信号序列;和(g)3
’‑
itr序列。
[0016]
在一个实施方案中,cdkl5的部分或完全编码序列是野生型编码序列。在替代实施方案中,cdkl5的部分或完全编码序列是密码子优化的编码序列。在一个示例性实施方案中,cdkl5的部分或完全编码序列经密码子优化以在人中表达。在一些实施方案中,cdkl5的部分或完全编码序列包含与选自seq id no:1-8的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性的序列。
[0017]
在一些实施方案中,本披露提供了raav,其包含aav衣壳和包装在其中的载体基因组,其中所述载体基因组包含:(a)启动子序列和(b)cdkl5的编码序列,该编码序列包含与选自seq id no:1、2、3、4、5、6、7和8的序列具有至少95%同一性的序列。
[0018]
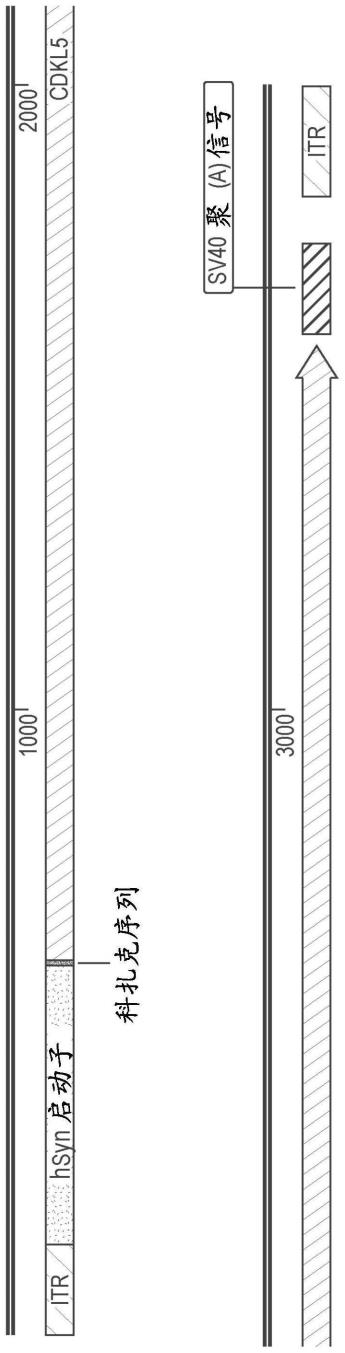
在一些实施方案中,cdkl5由seq id no:1所示的野生型编码序列编码。在另一个实施方案中,可以使用比如seq id no:2所示的编码序列等编码序列表达cdkl5的变体或替代性天然同种型。在某些实施方案中,cdkl5由密码子优化的编码序列编码。在一些实施方案中,cdkl5由与seq id no:1或seq id no:2所示的野生型编码序列具有小于80%同一性的密码子优化的编码序列编码。在一些示例性实施方案中,cdkl5由选自seq id no:3-8的密码子优化的编码序列编码。在一些实施方案中,cdkl5由与选自seq id no:3-8的序列具有至少80%同一性的密码子优化的编码序列编码。在一些实施方案中,cdkl5由与选自seq id no:3-8的序列具有至少90%同一性的密码子优化的编码序列编码。在一些实施方案中,cdkl5由与选自seq id no:3-8的序列具有至少95%同一性的密码子优化的编码序列编码。在一些实施方案中,cdkl5的编码序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。在一些实施方案中,表达的cdkl5蛋白包含seq id no:9的氨基酸序列或由其组成。在一些实施方案中,表达的cdkl5蛋白包含seq id no:10的氨基酸序列或由其组成。
[0019]
在一些实施方案中,启动子是神经元特异性启动子。在一个实施方案中,神经元特异性启动子选自人突触蛋白1(syn1)启动子、小鼠钙/钙调蛋白依赖性蛋白激酶ii(camkii)启动子、大鼠微管蛋白αi(ta1)启动子、大鼠神经元特异性烯醇化酶(nse)启动子、人神经元特异性烯醇化酶(eno2)启动子、人血小板源性生长因子β链(pdgf)启动子、人bm88启动子、和神经元烟碱受体β2(chrnb2)启动子。
[0020]
在示例性实施方案中,神经元特异性启动子是syn1启动子(例如,人syn1启动子)。在一个实施方案中,syn1启动子(例如,人syn1启动子)具有包含seq id no:12或由其组成的核酸序列。
[0021]
在一些实施方案中,启动子选自鸡β-肌动蛋白(cba)启动子、巨细胞病毒(cmv)即早期基因启动子、甲状腺素转运蛋白(ttr)启动子、甲状腺素结合球蛋白(tbg)启动子、和α-1抗胰蛋白酶(a1at)启动子。
[0022]
在示例性实施方案中,启动子是cba启动子。在一个实施方案中,cba启动子具有包含seq id no:13或由其组成的核酸序列。
[0023]
在一些实施方案中,启动子示基因特异性内源性启动子。在一个实施方案中,启动子包含天然基因启动子元件。在示例性实施方案中,启动子是cdkl5基因特异性内源性启动子,该cdkl5基因特异性内源性启动子包含至少15个连续核苷酸的核苷酸序列,该核苷酸序列与seq id no:14的相等长度区域具有至少95%同一性。
[0024]
在一些实施方案中,经包装的载体基因组包含5
’‑
itr序列和/或3
’‑
itr序列。在某些实施方案中,5
’‑
itr序列来自aav2。在一些实施方案中,3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。在其他实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自非aav2来源。
[0025]
在一些实施方案中,经包装的载体基因组包含聚腺苷酸化信号序列。在一个实施方案中,聚腺苷酸化信号序列选自sv40聚腺苷酸化信号序列、牛生长激素(bgh)聚腺苷酸化信号序列和兔β珠蛋白聚腺苷酸化信号序列。在示例性实施方案中,聚腺苷酸化信号序列是sv40聚腺苷酸化信号序列。在一个实施方案中,sv40聚腺苷酸化信号序列包含seq id no:15或由其组成。
[0026]
在一些实施方案中,经包装的载体基因组包含共有科扎克(kozak)序列。在一个实施方案中,共有科扎克序列是gccgccacc(seq id no:16)。在某些实施方案中,共有科扎克序列位于cdkl5的编码序列的上游。
[0027]
在一些实施方案中,经包装的载体基因组包含一个或多个增强子序列。在一个实施方案中,增强子选自巨细胞病毒(cmv)即早期基因增强子、甲状腺素转运蛋白增强子(enttr)、鸡β-肌动蛋白(cba)增强子、en34增强子、和载脂蛋白e(apoe)增强子。在示例性实施方案中,增强子是cmv增强子(例如,cmv即早期基因增强子)。在一个实施方案中,cmv增强子(例如,cmv即早期基因增强子)具有包含seq id no:17或由其组成的序列。在某些实施方案中,增强子位于启动子序列的上游。
[0028]
在一些实施方案中,经包装的载体基因组包含一个或多个内含子序列。在一个实施方案中,内含子选自sv40小t内含子、兔血红蛋白亚基β(rhbb)内含子、人β珠蛋白ivs2内含子、β-珠蛋白/igg嵌合内含子、和hfix内含子。在一个示例性实施方案中,内含子是sv40
小t内含子。在一个实施方案中,sv40小t内含子序列包含seq id no:18或由其组成。
[0029]
在一些实施方案中,aav衣壳来自血清型1、2、3、4、5、6、7、8、9、10、11、12、rh10、hu37的aav(即,aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav9、aav10、aav11、aav12、aavrh10、aavhu37),或其工程化的变体。在示例性实施方案中,aav衣壳是aav血清型9(aav9)衣壳、aav9变体衣壳、aav血清型8(aav8)衣壳、aav8变体衣壳、或aav血清型hu37(aavhu37)衣壳。
[0030]
在一些方面,本披露提供了编码cdkl5的新颖密码子优化的核酸序列。在一个实施方案中,编码cdkl5的密码子优化的核酸序列与seq id no:1或seq id no:2所示的野生型编码序列具有小于80%同一性。在一些实施方案中,编码cdkl5的密码子优化的核酸序列与选自seq id no:3-8的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在一些实施方案中,本披露提供了核酸序列,这些核酸序列与seq id no:1或seq id no:2所示的野生型编码序列具有小于80%同一性,并且与选自seq id no:3-8的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在示例性实施方案中,本披露提供了编码cdkl5的核酸序列,其选自选自seq id no:3-8的序列。进一步提供了seq id no:3-8所示的核酸序列的片段,这些片段编码具有功能性cdkl5活性的多肽。在一些实施方案中,编码cdkl5的核酸序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。
[0031]
在一些方面,本披露提供了用于治疗cdd的新颖载体基因组构建体。在一些实施方案中,本披露提供了编码cdkl5的载体基因组构建体(即,多核苷酸),该载体基因组构建体与选自seq id no:19-20的核酸序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在一个实施方案中,本披露提供了多核苷酸,其包含与seq id no:19具有至少95%同一性的核酸序列。在一个实施方案中,本披露提供了多核苷酸,该多核苷酸的核酸序列包含seq id no:19或由其组成。在一个实施方案中,本披露提供了多核苷酸,其包含与seq id no:20具有至少95%同一性的核酸序列。在另一个实施方案中,本披露提供了多核苷酸,该多核苷酸的核酸序列包含seq id no:20或由其组成。
[0032]
在某些实施方案中,本披露提供了重组腺相关病毒(raav),其可用作治疗cdd的基因疗法的药剂,其中所述raav包含aav衣壳和包装在其中的如本文所述的载体基因组。在一些实施方案中,aav衣壳来自血清型1、2、3、4、5、6、7、8、9、10、11、12、rh10、hu37的aav(即,aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav9、aav10、aav11、aav12、aavrh10、aavhu37),或其工程化的变体。在示例性实施方案中,aav衣壳是aav血清型9(aav9)衣壳、aav9变体衣壳、aav血清型8(aav8)衣壳、aav8变体衣壳、或aav血清型hu37(aavhu37)衣壳。
[0033]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中所述raav包含aav衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)启动子序列和(b)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,cdkl5的编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列。
[0034]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中
所述raav包含aav衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)5
’‑
itr序列;(b)启动子序列;(c)cdkl5的编码序列,该编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列;(d)聚腺苷酸化信号序列;和(e)3
’‑
itr序列。
[0035]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中所述raav包含aav9衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)5
’‑
itr序列;(b)启动子序列;(c)cdkl5的编码序列,该编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列;(d)聚腺苷酸化信号序列;和(e)3
’‑
itr序列。
[0036]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中所述raav包含aav9衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)aav2 5
’‑
itr序列;(b)syn1启动子序列(例如,人syn1启动子序列);(c)cdkl5的编码序列,该编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列;(d)sv40聚腺苷酸化信号序列;和(e)aav23
’‑
itr序列。在示例性实施方案中,cdkl5的编码序列包含seq id no:1或由其组成。
[0037]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中所述raav包含aav9衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)5
’‑
itr序列;(b)增强子序列;(c)启动子序列;(d)内含子序列;(e)cdkl5的编码序列,该编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列;(f)聚腺苷酸化信号序列;和(g)3
’‑
itr序列。
[0038]
在某些实施方案中,本披露提供了可用于治疗cdkl5缺陷障碍(cdd)的raav,其中所述raav包含aav9衣壳和包装在其中的载体基因组,并且其中所述载体基因组包含:(a)aav2 5
’‑
itr序列;(b)cmv增强子序列(例如,cmv即早期基因序列);(c)cba启动子序列;(d)sv40小t内含子序列;(e)cdkl5的编码序列,该编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列;(f)sv40聚腺苷酸化信号序列;和(g)aav2 3
’‑
itr序列。在示例性实施方案中,cdkl5的编码序列包含seq id no:1或由其组成。
[0039]
在一些方面,本披露提供了本文披露的raav用于治疗cdd的用途,其中该raav包括aav衣壳和包装在其中的载体基因组。在一些实施方案中,raav含有经包装的基因组,该经包装的基因组包含以下作为可操作地连接的组分:5
’‑
itr、启动子序列、cdkl5或其同种型或其功能性片段或功能性变体的部分或完全编码序列、和3
’‑
itr。在一些实施方案中,经包装的基因组还包含以下元件中的至少一种:(a)启动子序列上游的增强子序列、(b)启动子下游的内含子、和(c)3
’‑
itr上游的聚腺苷酸化序列。在一个示例性实施方案中,raav含有经包装的基因组,该经包装的基因组包含以下作为可操作地连接的组分:aav2 5
’‑
itr序列、syn1启动子(例如,人syn1启动子)、cdkl5的编码序列、sv40聚腺苷酸化信号序列、和aav2 3
’‑
itr。在一些实施方案中,cdkl5的编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列。在一些实施方案中,衣壳是aav9衣壳。
[0040]
本披露进一步涉及包含本文披露的raav的药物组合物。在一些实施方案中,药物组合物包含药学上可接受的载剂或赋形剂。在一些实施方案中,包含raav的药物组合物被配制用于皮下、肌内、皮内、腹膜内、鞘内、脑室内、或静脉内施用。在示例性实施方案中,药物组合物被配制用于鞘内施用。
[0041]
在又另一方面,本披露提供了在人受试者中治疗cdd的方法,该方法包括向该人受
试者施用治疗有效量的本文披露的至少一种raav。在一个实施方案中,本披露提供了治疗cdd的方法,该方法包括施用包括aav衣壳和包装在其中的载体基因组的raav,其中该载体基因组包含cdkl5或其同种型或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,该方法可进一步包括在施用raav之前施用igg降解蛋白酶(例如,酿脓链球菌(streptococcus pyogenes)ides或马链球菌(streptococcus equi)idez)。在一些实施方案中,本披露提供了在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括施用治疗有效量的本文披露的至少一种raav,其中已经向该人受试者施用了igg降解蛋白酶。
[0042]
在又另一方面,本披露提供了在人受试者中治疗cns障碍的方法,该方法包括首先向该受试者施用皮质类固醇,随后施用治疗有效量的经设计用于治疗所述cns障碍的至少一种raav,其中将该raav通过鞘内、脑室内、或经由大脑池内递送施用。在一些实施方案中,本披露提供了在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括向人受试者施用治疗有效量的重组腺相关病毒(raav),其中所述raav包含aav衣壳和包装在其中的载体基因组,其中所述载体基因组包含启动子序列和cdkl5的编码序列,并且其中已经向该人受试者施用了皮质类固醇。在一个实施方案中,皮质类固醇选自泼尼松龙、泼尼松、地塞米松、氢化可的松、曲安西龙、甲泼尼龙、布地奈德、倍他米松、和地夫可特。在示例性实施方案中,皮质类固醇是泼尼松龙。在一个实施方案中,cns障碍选自cdd、快乐木偶综合征(angelman syndrome)、巴滕病(batten disease)、克拉伯病(krabbe disease)、帕金森病、阿尔茨海默病、脊髓性肌萎缩(sma)i、ii、iii、和iv型、x连锁肌小管肌病、弗里德希氏共济失调(friedrich’s ataxia)、卡纳万病(canavan’s)、肌萎缩侧索硬化(als)、肾上腺脑白质营养不良、亨廷顿病、雷特综合征、和脊髓小脑性共济失调。在示例性实施方案中,cns障碍是cdd,并且raav包含可用于治疗本文所述的cdd的raav。
[0043]
在某些实施方案中,本披露提供了在人受试者中治疗cdd的方法,该方法包括向经诊断具有至少一种cdkl5突变的人受试者施用治疗有效量的本文披露的至少一种raav。在一个实施方案中,本披露提供了在经诊断具有至少一种cdkl5突变的人受试者中治疗cdd的方法,该方法包括施用包括aav衣壳和包装在其中的载体基因组的raav,其中该载体基因组包含cdkl5或其同种型或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,cdkl5的编码序列选自seq id no:1-8。在一些实施方案中,衣壳是aav9衣壳。
[0044]
在一些实施方案中,将raav通过皮下、肌内、皮内、腹膜内、鞘内、脑室内、静脉内、或经由大脑池内递送施用。在示例性实施方案中,将raav通过鞘内施用。在另一个示例性实施方案中,将raav通过经由大脑池施用。在一些实施方案中,将raav以约1x10
11
至约1x10
14
个基因组拷贝(gc)/kg的剂量施用。在进一步的实施方案中,将raav以约1x10
12
至约1x10
13
个基因组拷贝(gc)/kg的剂量施用。在一些实施方案中,施用单剂量的raav。在其他实施方案中,施用多剂量的raav。
[0045]
在一些方面,本文提供了包含本文披露的重组核酸分子、aav载体、或raav的宿主细胞。在特定的实施方案中,宿主细胞可以适合aav的繁殖。在某些实施方案中,宿主细胞选自hela、cos-7、hek293、a549、bhk、vero、rd、ht-1080、arpe-19、和mrc-5细胞。
[0046]
本披露的以下部分描述了本发明的这些和其他方面和特征。
附图说明
[0047]
参考以下附图可以更全面地理解本发明。
[0048]
图1是显示在syn启动子的控制下包含cdkl5的编码序列的第一示例性经包装的载体基因组构建体的示意图。图中使用的缩写:itr-末端反向重复;hsyn-人突触蛋白1启动子;sv40聚(a)信号-sv40聚腺苷酸化信号。
[0049]
图2是显示在鸡β-肌动蛋白(cba)启动子的控制下包含cdkl5的编码序列的第二示例性经包装的载体基因组构建体的示意图。图中使用的缩写:itr-末端反向重复;cmv-巨细胞病毒;sv40聚(a)信号-sv40聚腺苷酸化信号。
[0050]
图3是显示在用质粒dna转染neuro2a细胞后人cdkl5过表达时的磷酸-eb2(peb2)水平变化的图像。当人cdkl5在这些细胞中过表达时,cdkl5的下游靶标eb2显示增加的磷酸化。左侧两个分图代表未处理的细胞。右侧两个分图代表在cba启动子的控制下用人cdkl5转染的细胞。
[0051]
图4是显示脑室内给药raav9-cba-egfp(左侧分图)或raav9-syn-egfp(右侧分图)的cdkl5缺陷小鼠中增强型绿色荧光蛋白(egfp)的分布的图像。两种载体在海马区和纹状体区都产生了高水平egfp,并且在皮层和小脑中都产生了较少数量的egfp阳性细胞。
[0052]
图5是显示使用内源性cdkl5启动子以及cba和syn启动子在neuro2a细胞中表达绿色荧光蛋白(gfp)和hcdkl5质粒的图像。内源性cdkl5启动子驱动hcdkl5以介于cba和syn启动子中间的水平在这些细胞中表达。图像从左到右(顶部四个分图)显示如下:未转染、用cba-gfp转染、用syn-gfp转染、以及用内源性cdkl5启动子和egfp(endo-egfp)转染。关于底部四个分图,这些图像从左到右显示如下:未转染、用cba-hcdkl5转染、用syn-hcdkl5转染、以及用内源性cdkl5启动子和hcdkl5(endo-hcdkl5)转染。
[0053]
图6a分图是显示如通过荧光rnascope检测到的hcdkl5 mrna在经由脑室内途径给药raav9-cba-hcdkl5(图6a的左侧分图图像)或raav9-syn-hcdkl5(图6a的右侧分图图像)的cdkl5缺陷小鼠中的分布的图像。图6b分图是来自rnascope原位杂交的代表性图像,该图像显示了如通过荧光rnascope检测到的hcdkl5 mrna在经由脑室内途径给药raav9-cba-hcdkl5(方块5和6)或raav9-syn-hcdkl5(方块7和8)的cdkl5缺陷小鼠中的分布。经由脑室内途径给药媒介物的cdkl5敲除(ko)小鼠显示在方块3和4中。未给药任何媒介物或任一载体(初始)的cdkl5野生型(wt)小鼠显示在方块1和2中。
[0054]
图7是蛋白质印迹,显示在单次脑室内注射raav9-syn-hcdkl5或raav9-cba-hcdkl5(1.6e12载体基因组(vg))给药后2周,从cdkl5敲除小鼠额叶皮层分离的cdkl5蛋白和磷酸化eb2(peb2)的水平。与媒介物治疗的对照相比,经治疗的小鼠显示出增加的cdkl5水平。cdkl5下游靶标eb2的磷酸化证实了cdkl5充当功能性激酶。
[0055]
图8是条形图,显示了在非人灵长类动物(nhp)受试者通过腰椎鞘内注射施用raav9-cba-egfp(cba-egfp)或raav9-syn-egfp(syn-egfp)后2周,其cns和外周组织中每μg的组织dna中载体基因组拷贝数的定量。两种载体在每个组织中产生相似数量的载体基因组。在每组条形图中,cba-egfp显示为左侧条形图(或在髓质的情况下为中间条形图),而syn-egfp显示为右侧条形图。
[0056]
图9是显示在nhp受试者通过腰椎鞘内注射施用raav9-cba-egfp(左侧3个分图)或raav9-syn-egfp(右侧3个分图)后2周,对egfp免疫染色的大脑组织的代表性明视野显微镜
图像的图像。来自给药raav9-cba-egfp的受试者的egfp阳性细胞具有星形细胞/胶质细胞形态(底部左侧分图),而来自给药raav9-syn-egfp的受试者的egfp阳性细胞具有神经元形态(底部右侧分图)。
[0057]
图10a-10c显示了展示在给药后大约3个月在cdkl5缺陷小鼠大脑的不同区域(额叶皮层:图10a;海马:图10b;和脑干:图10c)中使用蛋白质印迹定量的cdkl5的量的图。给药后3个月,观察到经治疗的小鼠大脑中的人cdkl5蛋白的适度持续增加(额叶皮层和脑干中20%-30%的wt水平,海马中为35%-70%)。
[0058]
图11a-11d显示了表明与媒介物治疗的对照同窝小鼠(cdd-pbs)相比,raav9-syn-hcdkl5治疗的小鼠(syn-hcdkl5)在学习、记忆和运动功能任务上表现更好的图。在焦虑样行为(图11a)、运动功能(图11b)、协调(图11c)、以及学习和记忆的正常化(图11d)方面看到了改善。
[0059]
图12是条形图,表明了在头低足高位(trendelenburg position)鞘内(it)递送(ux055-18-0001)8.06x10
13
个载体基因组(vg)或大脑池内(cm)递送(ux055-19-0002)7.76x10
13
个raav9-syn-egfp的vg后两周,1-2岁雌性非人灵长类动物(nhp)中cns中每μg的dna的基因组拷贝(gc)。该图表明大脑池内递送导致各种大脑组织(包括顶叶(10x)、纹状体(10x)和丘脑(8x))中nhp cns中的载体基因组的量增加。收集本图中提供的数据作为两项独立研究的一部分。
[0060]
图13a是条形图,表明了在第-4天至第28天施用与不施用1mg/kg泼尼松龙(通过经口管饲)的情况下,在头低足高位大脑池内(cm)递送(ux055-19-003)7.92x10
13
个raav9-syn-cdkl5的vg后四周,1岁雌性非人灵长类动物(nhp)中cns中每μg的dna的基因组拷贝(gc)。该图表明,增加数目的载体基因组(通过qpcr测量)存在于施用泼尼松龙的nhp中的各种大脑组织中,包括在纹状体(20x)、海马(5x)、髓质(6x)、和小脑(5x)中的增加。图13b显示了来自相同nhp的含有枕叶皮层的大脑和小脑的较大切片,这些切片通过针对载体的探针使用basescope分析(原位杂交)检查。分图1和3代表来自未施用泼尼松龙的nhp的切片,而分图2和4代表来自施用泼尼松龙的nhp的切片。从每个nhp的一个完整半冠状切片中计算具有至少一个载体基因组的细胞的数量,并在图像中添加箭头以标记每个阳性细胞来辅助可视化。图13c是显示与没有用泼尼松龙治疗的那些nhp相比,在用泼尼松龙治疗的nhp中含有至少一个载体基因组的细胞数目的图。总体而言,与没有用泼尼松龙治疗的nhp相比,用泼尼松龙治疗的nhp中含有至少一个载体基因组的细胞数目有增加的趋势,但是,动物与动物之间存在显著差异。在非泼尼松龙组中注意到一个具有极高载体基因组阳性细胞数目的异常nhp。
具体实施方案
[0061]
本发明提供了一系列用于治疗应用的新颖药剂和组合物。本发明的核酸序列、载体、重组病毒和相关组合物可用于改善、预防或治疗如本文所述的cdkl5缺陷障碍(cdd)。
[0062]
除非另有说明,技术术语均按惯例使用。分子生物学中常用术语的定义可以在以下中找到:benjamin lewin,genes v[基因v],由oxford university press[牛津大学出版社]出版,1994(isbn 0-19-854287-9);kendrew等人(编辑.),the encyclopedia of molecular biology[分子生物学百科全书],由blackwell science ltd.[布莱克威尔科学
公司]出版,1994(isbn 0-632-02182-9);和robert a.meyers(编辑),molecular biology and biotechnology:a comprehensive desk reference[分子生物学和生物技术:综合案头参考],由vch publishers[vch出版公司]出版,1995(isbn 1-56081-569-8)。
[0063]
为便于查阅本披露的各个实施方案,提供以下对特定术语的解释:
[0064]
腺相关病毒(aav):一种小的、复制缺陷的、无包膜的病毒,可感染人和其他一些灵长类动物。aav已知不会引起疾病并引发非常温和的免疫应答。利用aav的基因疗法载体可以感染分裂细胞和休眠细胞,并且能以染色体外状态持续存在而不整合到宿主细胞的基因组中。这些特征使aav成为一种有吸引力的基因疗法病毒载体。目前有12种公认的aav血清型(aav1-12)。
[0065]
施用(administration/administer):通过任何有效途径向受试者提供或给予比如治疗剂(例如,重组aav)等药剂。示例性的施用途径包括但不限于注射(比如皮下、肌内、皮内、腹膜内、鞘内、脑室内、或静脉内施用)、口服、胆管腔内、舌下、直肠、透皮、鼻内、阴道和吸入途径。
[0066]
编码序列:
″
编码序列
″
意指当可操作地连接到适当的调节序列时在体外或体内编码多肽的核苷酸序列。编码序列可包括或可不包括在编码区之前和之后的区,例如5’非翻译(5’utr)和3’非翻译(3’utr)序列,以及单个编码区段(外显子)之间的间插序列(内含子)。
[0067]
密码子优化的:
″
密码子优化的
″
核酸是指已被改变的核酸序列,使得密码子对于在特定系统(比如特定物种或物种组)中的表达是最佳的。例如,可以优化核酸序列以在哺乳动物细胞或特定哺乳动物物种(比如人细胞)中表达。密码子优化不会改变编码蛋白质的氨基酸序列。
[0068]
增强子:通过增加启动子的活性来增加转录速率的核酸序列。
[0069]
内含子:基因中不包含蛋白质编码信息的一段dna。内含子在信使rna翻译之前去除。
[0070]
末端反向重复(itr):有效复制所需的腺相关病毒基因组中的对称核酸序列。itr序列位于aav dna基因组的每一端。itr充当病毒dna合成的复制起点,并且是用于产生aav整合载体的必需顺式组分。
[0071]
分离的:
″
分离的
″
生物组分(比如核酸分子、蛋白质、病毒或细胞)已与生物体的细胞或组织中的其他生物组分或生物体本身(其中组分天然地存在,如其他染色体和染色体外dna和rna、蛋白质和细胞)基本分离或纯化。已
″
分离
″
的核酸分子和蛋白质包括通过标准纯化方法纯化的那些。此术语还包括通过在宿主细胞中重组表达制备的核酸分子和蛋白质以及化学合成的核酸分子和蛋白质。
[0072]
可操作地连接:当第一核酸序列被放置成与第二核酸序列有功能关系时,该第一核酸序列与该第二核酸序列可操作地连接。例如,如果启动子影响编码序列的转录或表达,则该启动子与该编码序列可操作地连接。通常,可操作地连接的dna序列是连续的,并且在需要连接两个蛋白质编码区时,在同一阅读框中。
[0073]
药学上可接受的载剂:可用于本披露的药学上可接受的载剂(媒介物)是常规的。remington
′
s pharmaceutical sciences[雷明顿制药科学](e.w.martin,mack publishing co.[麦克出版公司],easton,pa.[宾夕法尼亚州伊斯顿],第15版(1975))描述
了适用于一种或多种治疗性化合物、分子或药剂的药物递送的组合物和配制剂。
[0074]
一般而言,载剂的性质将取决于所采用的特定施用方式。例如,肠胃外配制剂通常包含可注射流体,其包括药学上和生理学上可接受的流体,比如水、生理盐水、平衡盐溶液、葡萄糖水溶液、甘油等作为媒介物。对于固体组合物,例如粉末、丸剂、片剂或胶囊形式),常规的无毒固体载剂可以包括例如药物级的甘露醇、乳糖、淀粉或硬脂酸镁。除了生物中性载剂之外,要施用的药物组合物可含有少量无毒辅助物质,比如润湿剂或乳化剂、防腐剂和ph缓冲剂等,例如乙酸钠或脱水山梨糖醇单月桂酸酯。
[0075]
预防、治疗或改善疾病:
″
预防
″
疾病(比如cdd)是指抑制疾病的全面发展。
″
治疗
″
是指在疾病或病理病症(比如cdd)开始发展后改善其体征或症状的治疗性干预。
″
改善
″
是指疾病(比如cdd)体征或症状的数量或严重程度的降低。
[0076]
启动子:指导/启动核酸(例如基因)转录的dna区域。启动子包括靠近转录起始位点的必要核酸序列。许多启动子序列是本领域技术人员已知的,并且甚至人工核酸分子中不同启动子序列的组合也是可能的。如本文所用,基因特异性内源性启动子是指调节内源性目的基因表达的天然启动子元件。在一个实施方案中,cdkl5基因特异性内源性启动子调节cdkl5基因的表达。
[0077]
纯化的:术语
″
纯化的
″
并不要求绝对纯度;相反,它旨在作为一个相对术语。因此,例如,纯化的肽、蛋白质、病毒或其他活性化合物是从天然相关蛋白质和其他污染物中完全或部分分离的肽、蛋白质、病毒或其他活性化合物。在某些实施方案中,术语
″
基本上纯化的
″
是指已从细胞、细胞培养基或其他粗制剂中分离并进行分级以除去初始制剂的各种组分(比如蛋白质、细胞碎片和其他组分)的肽、蛋白质、病毒或其他活性化合物。
[0078]
重组:重组核酸分子是一种具有非天然存在的序列或具有通过人工组合两个在其他情况下分离的序列片段而制成的序列的核酸分子。这种人工组合可以通过化学合成或通过核酸分子的分离片段的人工操作(比如通过基因工程技术)来实现。
[0079]
类似地,重组病毒是包含非天然存在的或通过至少两个不同来源的序列的人工组合制成的序列(比如基因组序列)的病毒。术语
″
重组
″
还包括仅通过添加、取代或缺失天然核酸分子、蛋白质或病毒的一部分而改变的核酸、蛋白质和病毒。如本文所用,
″
重组aav
″
是指其中包装了比如编码cdkl5的重组核酸分子的重组核酸分子的aav颗粒。
[0080]
序列同一性:两个或更多个核酸序列或两个或更多个氨基酸序列之间的同一性或相似性以序列之间的同一性或相似性表示。序列同一性可以用同一性百分比来衡量;百分比越高,序列越相同。序列相似性可以用百分比相似性来衡量(考虑到保守的氨基酸取代);百分比越高,序列越相似。当使用标准方法比对时,核酸或氨基酸序列的同源物或直系同源物具有相对高程度的序列同一性/相似性。当直系同源蛋白质或cdna衍生自更密切相关的物种(比如人和小鼠序列)时,与亲缘关系更远的物种(比如人和线虫序列)相比,这种同源性更显著。
[0081]
用于比较的序列比对方法是本领域熟知的。各种程序和对准算法描述于:smith和waterman,adv.appl.math.[应用数学进展]2:482,1981;needleman和wunsch,j.mol.biol.[分子生物学杂志]48:443,1970;pearson和lipman,proc.natl.acad.sci.usa[美国科学院院刊]85:2444,1988;higgins和sharp,gene[基因],73:237-44,1988;higgins和sharp,cabios5:151-3,1989;corpet等人,nuc.acids res.[核酸研究]16:10881-90,1988;huang
等人computer appls.in the biosciences[计算机在生物科学中的应用]8,155-65,1992;以及pearson等人,meth.mol.rio.[数学分子比]24:307-31,1994;altschul等人,j.mol.biol.[分子生物学杂志]215:403-10,1990给出了序列比对方法和同源性计算的详细考虑。
[0082]
ncbi基本局部比对搜索工具(blast)(altschul等人,j.mol.biol.[分子生物学杂志]215:403-10,1990)可从几个来源获得,包括美国国家生物信息中心(ncbi)和互联网上,用于与序列分析程序blastp、blasm、blastx、tblastn和tblastx结合使用。更多信息可以在ncbi网站上找到。
[0083]
血清型:一组密切相关的微生物(比如病毒),以特征抗原组来区分。
[0084]
填充序列:指包含在较大核酸分子(比如载体)中的核苷酸序列,通常用于在两个核酸特征之间(比如启动子和编码序列之间)产生所需的间距,或延长核酸分子,使其具有所期望的长度。填充序列不包含蛋白质编码信息并且可以是未知/合成来源和/或与较大核酸分子内的其他核酸序列无关。
[0085]
受试者:活的多细胞脊椎动物生物体,这一类别包括人和非人哺乳动物。在一些实施方案中,受试者是人。在一个实施方案中,人受试者是成人受试者,即大于18岁的人受试者。在一个实施方案中,人受试者是小儿受试者,即年龄在0-18岁(含)之间的人受试者。在一些实施方案中,已经向受试者(例如,人受试者)施用了皮质类固醇。在一些实施方案中,已经向受试者(例如,人受试者)施用了igg降解蛋白酶。在一些实施方案中,已经向受试者(例如,人受试者)施用了皮质类固醇,并且也已经施用了igg降解蛋白酶。
[0086]
合成的:在实验室中通过人工方式产生,例如合成的核酸可以在实验室中化学合成。
[0087]
非翻译区(utr):典型的mrna在编码区的上游和下游分别含有5
′
非翻译区(5
′
utr)和3
′
非翻译区(3
′
utr)(参见mignone f.等人,(2002)genome biol[基因组生物学]3:reviews0004)。
[0088]
治疗有效量:一定量的特定药物或治疗剂(例如,重组aav)足以在用药剂治疗的受试者或细胞中实现所期望的效果。药剂的有效量将取决于几个因素,包括但不限于被治疗的受试者或细胞,以及治疗性组合物的施用方式。
[0089]
载体:载体是允许插入外源核酸而不破坏载体在宿主细胞中复制和/或整合的能力的核酸分子。载体可包括允许其在宿主细胞中复制的核酸序列,比如复制起点。载体还可包括一种或多种选择标记基因和其他遗传元件。表达载体是包含必要的调控序列以允许插入的一个或多个基因的转录和翻译的载体。在本文的一些实施方案中,载体是aav载体。
[0090]
除非另外解释,本文所用的全部技术术语和科学术语具有与本披露所属领域的普通技术人员通常所理解的相同意义。除非上下文另外清楚指出,单数术语
″
一个(a)
″
、
″
一种(an)
″
、
″
该(the)
″
包含复数指代。
″
包含a或b
″
意指包括a或b、或a和b。进一步应理解,对于核酸或多肽给出的所有碱基大小或氨基酸大小以及所有分子量或分子量值是近似的,并提供用于说明。虽然与本文描述的那些方法和材料类似或等同的方法和材料可以用于本披露的实践或测试,但是以下描述合适的方法和材料。所有的公开物、专利申请、专利、以及本文提及的其他参考文献通过引用以其全文并入。在有矛盾的情况下,将以本说明书(包括术语的解释)为准。此外,材料、方法和实施例仅为说明性的并且不旨在是限制性的。
[0091]
重组aav(raav):
[0092]
本发明提供了组合物及其用于基因疗法的方法。更特别地,本文提供了重组腺相关病毒(raav),其包含腺相关病毒(aav)衣壳、和包装在其中的用于治疗cdd的载体基因组。
[0093]
在一方面,本披露提供了重组腺相关病毒(raav),其中所述raav包含aav衣壳、和包装在其中的载体基因组,其中所述载体基因组包含:(a)启动子序列;和(b)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列。在示例性实施方案中,编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列。
[0094]
在一些实施方案中,经包装的载体基因组可进一步包含如本文所述的5
’‑
itr序列、增强子、内含子、共有科扎克序列、聚腺苷酸化信号、和/或3
’‑
itr序列。在一些实施方案中,重组载体可以进一步包含一个或多个填充核酸序列。在一个实施方案中,填充核酸序列位于内含子和cdkl5的部分或完全编码序列之间。
[0095]
在本文所述的各实施方案中,raav包含aav衣壳。aav衣壳可以来自血清型1、2、3、4、5、6、7、8、9、10、11、12、rh10、hu37的aav(即aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aavrh10、aavhu37),以及从人和非人灵长类动物组织中分离出的超过100种变体中的任何一种。参见,例如choi等人,2005,curr gene ther.[当代基因治疗]5:299-310,2005和gao等人,2005,curr gene ther.[当代基因治疗]5:285-297。
[0096]
除上述衣壳外,已被工程化以具有一种或多种有益的治疗特性(例如,提高对选定组织的靶向性、提高逃避免疫反应的能力、减少对中和抗体的刺激等)的变体aav衣壳也包括在本发明范围内。此类工程化的变体衣壳的非限制性实施例描述于美国专利号9,506,083、9,585,971、9,587,282、9,611,302、9,725,485、9,856,539、9,909,142、9,920,097、10,011,640、10,081,659、10,179,176、10,202,657、10,214,566、10,214,785、10,266,845、10,294,281、10,301,648、10,385,320、和10,392,632中,以及描述于pct公开号wo/2017/165859、wo/2018/022905、wo/2018/156654、wo/2018/222503、和wo/2018/226602中,其披露内容通过引用并入本文。
[0097]
在某些在示例性实施方案中,根据本发明施用的raav包含aav9衣壳。aav9衣壳是由多种aav9 vp蛋白组成的自组装aav衣壳。aav9 vp蛋白典型地表达为由seq id no:21的核酸序列或与其具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少99%同一性的序列编码的选择性剪接变体,该序列编码seq id no:22的vp1氨基酸序列(genbank登录号:aas99264)。这些剪接变体产生seq id no:22的长度不同的蛋白质。如本文所用,aav9变体包括例如wo/2016/049230、美国专利号8,927,514、美国专利公开号2015/0344911和美国专利号8,734,809中描述的那些。
[0098]
如本文所指示,在一些实施方案中,根据本发明施用的raav可以包含aav9衣壳。然而,在其他实施方案中,选择另一种aav衣壳。组织特异性由衣壳类型决定。转导合适靶标(例如肝、肌肉、肺或cns)的aav血清型可被选作aav病毒载体衣壳的来源,包括例如aav1、aav2、aav3、aav4、aav5、aav6、aav6.2、aav7、aav8、aav9、aavrh10、aavrh64r1、aavrh64r2、aavrh8。参见,例如,美国专利公开号2007/0036760;美国专利公开号2009/0197338;和ep 1310571。还参见wo 2003/042397(aav7和其他猿猴aav)、美国专利号7282199和7790449(aav8)。此外,尚未发现的aav或基于其的重组aav可用作aav衣壳的来源。这些文献还描述了可被选择用于产生aav的其他aav,并通过引用并入本文。在一些实施方案中,用于在病毒
载体中使用的aav衣壳可以通过诱变(即通过插入、缺失或取代)上述aav衣壳之一或其编码核酸来产生。在一些实施方案中,aav衣壳是嵌合的,包含来自上述aav衣壳蛋白中的两个或三个或四个或更多个的结构域。在一些实施方案中,aav衣壳是来自两种或三种不同aav或重组aav的vp1、vp2和vp3单体的嵌合体。在一些实施方案中,raav组合物包含上述衣壳中的多于一个。
[0099]
末端反向重复(itr):
[0100]
在一些实施方案中,raav包含含有aav itr序列的经包装的载体基因组,当aav和腺病毒辅助功能以反式提供时,aav itr序列既起载体dna复制起点作用,又起载体基因组的包装信号作用。此外,itr是大rep蛋白单链核酸内切的靶,从复制中间体拆分单个基因组。
[0101]
在一些实施方案中,5
’‑
itr序列来自aav2。在一些实施方案中,3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2并且包含seq id no:11或由其组成。在其他实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自非aav2来源。
[0102]
启动子:
[0103]
在本文所述的各个方面,raav包含经包装的载体基因组,该载体基因组包含有助于驱动和调节cdkl5表达的启动子序列。在示例性实施方案中,启动子序列位于5
′‑
itr序列与cdkl5的部分或完全编码序列之间。在一些实施方案中,启动子序列位于增强子序列的下游。在一些实施方案中,启动子序列位于内含子序列的上游。
[0104]
在一些实施方案中,启动子是神经元特异性启动子。在一个实施方案中,神经元特异性启动子选自人突触蛋白1(syn1)启动子、小鼠钙/钙调蛋白依赖性蛋白激酶ii(camkii)启动子、大鼠微管蛋白αi(ta1)启动子、大鼠神经元特异性烯醇化酶(nse)启动子、人神经元特异性烯醇化酶(eno2)启动子、人血小板源性生长因子β链(pdgf)启动子、人bm88启动子、和神经元烟碱受体β2(chrnb2)启动子。
[0105]
在示例性实施方案中,神经元特异性启动子是syn1启动子(例如,人syn1启动子)。在一个实施方案中,syn1启动子(例如,人syn1启动子)与seq id no:12具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在示例性实施方案中,syn1启动子(例如,人syn1启动子)包含seq id no:12或由其组成。
[0106]
在一些实施方案中,启动子选自鸡β-肌动蛋白(cba)启动子、巨细胞病毒(cmv)即早期基因启动子、甲状腺素转运蛋白(ttr)启动子、甲状腺素结合球蛋白(tbg)启动子、和α-1抗胰蛋白酶(a1at)启动子。
[0107]
在示例性实施方案中,启动子是cba启动子。在一个实施方案中,cba启动子包含seq id no:13或由其组成。
[0108]
在一些实施方案中,启动子示基因特异性内源性启动子。在一个实施方案中,启动子包含天然基因启动子元件。在一些说明性实施方案中,本文所述的经包装的基因组包含cdkl5基因特异性内源性启动子,该cdkl5基因特异性内源性启动子包含至少15个连续核苷酸的核苷酸序列,该核苷酸序列与seq id no:14的相等长度区域具有至少95%同一性。在某些实施方案中,本文所述的经包装的基因组包含cdkl5基因特异性内源性启动子,该
cdkl5基因特异性内源性启动子包含至少约15个连续核苷酸(例如,约30、约45、约60、约70、约80、约90、约100、约110、约120、约130、约140、约150、约160、约170、约180、约190、约200、约210、约220、约230、约240、约250、约260、约270、约280、约290、约300、约325、约350、约375、约400、约425、约450、约475、约500、约525、约550、约575、约600、约625、约650、约675、约700、约800、约900、约1000、约1100、约1200、约1300、约1400、或约1500个)的核苷酸序列,该核苷酸序列与seq id no:14的相等长度区域具有至少95%同一性。在一些说明性实施方案中,本文所述的经包装的基因组包含cdkl5基因特异性内源性启动子,该cdkl5基因特异性内源性启动子包含至少15个连续核苷酸的核苷酸序列,该核苷酸序列与seq id no:14的相等长度区域具有100%同一性。
[0109]
其他载体元件:
[0110]
除启动子和cdkl5的编码序列外,经包装的基因组可含有其他合适的转录起始、终止、增强子序列和有效的rna加工信号。如下文进一步详述的,此类序列包括剪接和聚腺苷酸化(聚a)信号、增强表达的调节元件、稳定细胞质mrna的序列、增强翻译效率的序列(即科扎克共有序列)和增强蛋白质稳定性的序列。
[0111]
在一些实施方案中,raav含有包含一个或多个增强子序列的经包装的载体基因组。在一个实施方案中,增强子选自巨细胞病毒即早期基因(cmv)增强子、甲状腺素转运蛋白增强子(enttr)、鸡β-肌动蛋白(cba)增强子、en34增强子、和apoe增强子。在示例性实施方案中,增强子是cmv增强子(例如,cmv即早期基因增强子)。在一个实施方案中,cmv增强子(例如,cmv即早期基因增强子)包含seq id no:17或由其组成。
[0112]
在一些实施方案中,raav含有包含一个或多个内含子序列的经包装的载体基因组。在一个实施方案中,内含子选自sv40小t内含子、兔血红蛋白亚基β(rhbb)内含子、人β珠蛋白ivs2内含子、β-珠蛋白/igg嵌合内含子、和hfix内含子。在一个示例性实施方案中,内含子是sv40小t内含子。在一个实施方案中,sv40小t内含子序列包含seq id no:18或由其组成。
[0113]
在一些实施方案中,raav含有包含共有科扎克序列的经包装的载体基因组。在一些实施方案中,共有科扎克序列位于内含子序列的下游。在一个实施方案中,共有科扎克序列是gccgccacc(seq id no:16)。
[0114]
在一些实施方案中,raav含有包含聚腺苷酸化信号序列的经包装的载体基因组。在一个实施方案中,聚腺苷酸化信号序列选自牛生长激素(bgh)聚腺苷酸化信号序列、sv40聚腺苷酸化信号序列、兔β珠蛋白聚腺苷酸化信号序列、和cdkl5基因特异性内源性聚腺苷酸化信号序列。在示例性实施方案中,聚腺苷酸化信号序列是sv40聚腺苷酸化信号序列。在一个实施方案中,sv40聚腺苷酸化信号序列包含seq id no:15或由其组成。
[0115]
cdkl5多肽和多核苷酸:
[0116]
如本文所述,本发明的方面提供了包括经包装的基因组的重组载体,该经包装的基因组包含启动子序列和cdkl5或其同种型或其功能性片段或功能性变体的部分或完全编码序列。
[0117]
在一个实施方案中,cdkl5的部分或完全编码序列是野生型编码序列。如本文所用,术语
″
野生型
″
是指与自然界中存在的生物聚合物(例如,多肽序列或多核苷酸序列)相同的生物聚合物(例如,多肽序列或多核苷酸序列)。
[0118]
在替代实施方案中,cdkl5的部分或完全编码序列是密码子优化的编码序列。在一个实施方案中,cdkl5的部分或完全编码序列经密码子优化以在人中表达。
[0119]
在本文所述的各实施方案中,提供了含有经包装的基因组的载体,该经包装的基因组包含cdkl5的编码序列。与本文所述的载体一起递送的多肽涵盖可用于治疗哺乳动物(包括人)的cdkl5多肽。
[0120]
在一些实施方案中,用本文所述的载体表达的多肽是cdkl5同种型2(seq id no:9,genbank登录号np_001310218.1,960个氨基酸)或其功能性片段或功能性变体。在一些实施方案中,用本文所述的载体表达的多肽是cdkl5同种型2,并且包含seq id no:9或由其组成。在一个实施方案中,cdkl5同种型2多肽由seq id no:1所示的野生型编码序列编码。在替代性实施方案中,cdkl5同种型2多肽由密码子优化的编码序列编码。在一些实施方案中,cdkl5同种型2多肽由与seq id no:1所示的野生型编码序列具有小于80%同一性的密码子优化的编码序列编码。在一些示例性实施方案中,cdkl5同种型2多肽由选自seq id no:3-5的密码子优化的编码序列编码。在一些实施方案中,cdkl5同种型2的编码序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。
[0121]
在一些实施方案中,用本文所述的载体表达的多肽是cdkl5同种型1(seq id no:10,genbank登录号np_001032420.1,1030个氨基酸)或其功能性片段或功能性变体。在一些实施方案中,用本文所述的载体表达的多肽是cdkl5同种型1,并且包含seq id no:10或由其组成。在一个实施方案中,cdkl5同种型1多肽由seq id no:2所示的野生型编码序列编码。在替代性实施方案中,cdkl5同种型1多肽由密码子优化的编码序列编码。在一些实施方案中,cdkl5同种型1多肽由与seq id no:2所示的野生型编码序列具有小于80%同一性的密码子优化的编码序列编码。在一些示例性实施方案中,cdkl5同种型1多肽由选自seq id no:6-8的密码子优化的编码序列编码。在一些实施方案中,cdkl5同种型1的编码序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。
[0122]
在各种方面,本发明可用于递送本文所述的cdkl5多肽的片段、变体、同种型或融合物。
[0123]
在一些实施方案中,本发明可用于递送cdkl5多肽的片段,这些片段包含至少50个、至少100个、至少150个、至少200个、至少250个、至少300个、至少350个、至少400个、至少450个、至少500个、至少550个、或至少600个氨基酸残基,并且保留与全长多肽相关的一种或多种活性(例如,在cdkl5的情况下的激酶活性)。此类片段可通过本领域常规且众所周知的重组技术获得。此外,可以通过本领域技术人员已知的常规体外测定来测试此类片段的活性。例如,cdkl5活性可以通过如lin等人,2005,human mol genet[人类分子遗传学]14(24):3775-86中所述的体外自磷酸化激酶测定来测定。简而言之,可以将500μg的异位表达的flag-标记的cdkl5与5μg的m2结合的琼脂糖一起温育4h。可以将珠粒用tlb洗涤三次,并且用激酶缓冲液(25mm hepes,ph 7.4、10mm mgcl2、10mm mncl2、10mm二硫苏糖醇、0.2mm钒酸钠和10mm硝基苯磷酸盐)洗涤两次。然后可以将flag肽用于洗脱cdkl5。然后可以将生成的珠粒重悬于30μl的添加有100μm atp、5μci的[γ-32
p]-atp(nen)和底物的激酶缓冲液中。激酶测定可在30℃下进行15min,并通过添加sds-page蛋白上样缓冲液终止。
[0124]
在一些方面,本披露还提供了编码上述多肽片段的核酸分子。
[0125]
在一些实施方案中,本发明可用于递送cdkl5多肽的变体。在一些实施方案中,变
体多肽可与野生型治疗性多肽,例如seq id no:9的野生型cdkl5同种型2多肽或seq id no:10的野生型cdkl5同种型1多肽具有至少80%(例如,80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.6%、99.7%、99.8%、99.9%、或100%)同一性。在一些实施方案中,与相应的野生型多肽相比,变体治疗性多肽可具有至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少至少24个、至少25个、至少26个、至少27个、至少28个、至少29个、至少30个、至少31个、至少32个、至少33个、至少34个、至少35个、至少36个、至少37个、至少38个、至少39个、或至少40个不同残基。此类变体可通过本领域常规且众所周知的重组技术获得。此外,可以通过本领域技术人员已知的常规体外测定来测试此类变体的激酶活性。有关cdkl5激酶活性测定的说明,参见例如,lin等人,2005,human mol genet[人类分子遗传学]14(24):3775-86。
[0126]
在一些方面,本披露还提供了编码上述治疗性多肽变体的核酸分子。
[0127]
新颖密码子优化的序列:
[0128]
在一些方面,本披露提供了编码cdkl5同种型2的新颖密码子优化的核酸序列。在一个实施方案中,编码cdkl5同种型2的密码子优化的核酸序列与seq id no:1所示的野生型编码序列具有小于80%同一性。在一些实施方案中,编码cdkl5同种型2的密码子优化的核酸序列与seq id no:3-5具有至少80%(例如,80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.6%、99.7%、99.8%、99.9%、或100%)同一性。在一些实施方案中,编码cdkl5同种型2的密码子优化的核酸序列与选自seq id no:3-5的序列具有100%同一性。在一些实施方案中,本披露提供了核酸序列,这些核酸序列与seq id no:1所示的野生型编码序列具有小于80%同一性,并且与seq id no:3-5具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在示例性实施方案中,本披露提供了编码cdkl5同种型2的核酸序列,该核酸序列选自seq id no:3-5。进一步提供了seq id no:3-5所示的核酸序列的片段,这些片段编码具有功能性cdkl5活性的多肽。在一些实施方案中,编码cdkl5同种型2的核酸序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。
[0129]
在一些方面,本披露提供了编码cdkl5同种型1的新颖密码子优化的核酸序列。在一个实施方案中,编码cdkl5同种型1的密码子优化的核酸序列与seq id no:2所示的野生型编码序列具有小于80%同一性。在一些实施方案中,编码cdkl5同种型1的密码子优化的核酸序列与seq id no:6-8具有至少80%(例如,80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、99.6%、99.7%、99.8%、99.9%、或100%)同一性。在一些实施方案中,编码cdkl5同种型1的密码子优化的核酸序列与选自seq id no:6-8的序列具有100%同一性。在一些实施方案中,本披露提供了核酸序列,这些核酸序列与seq id no:2所示的野生型编码序列具有小于80%同一性,并且与选自seq id no:6-8的序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或更多同一性。在示例性实施方案中,本披露提供了编码cdkl5同种型1的核酸序列,该核酸
序列选自seq id no:6-8。进一步提供了seq id no:6-8所示的核酸序列的片段,这些片段编码具有功能性cdkl5活性的多肽。在一些实施方案中,编码cdkl5同种型1的核酸序列在3’末端处可以进一步包含终止密码子(tga、taa、或tag)。
[0130]
包含重组核酸分子的宿主细胞:
[0131]
在一些方面,本文提供了包含本文披露的重组核酸分子、病毒载体(例如aav载体)或raav的宿主细胞。在特定的实施方案中,宿主细胞可以适合aav的繁殖。
[0132]
可以使用比如细菌、酵母、昆虫、哺乳动物细胞等多种宿主细胞。在一些实施方案中,宿主细胞可以是适合于产生重组aav(raav)的细胞(或细胞系),例如hela、cos-7、hek293、a549、bhk、vero、rd、ht-1080、arpe-19或mrc-5细胞。
[0133]
可以使用本领域已知的任何合适的方法将重组核酸分子或载体递送到宿主细胞培养物中。在一些实施方案中,产生了具有插入其基因组中的重组核酸分子或载体的稳定宿主细胞系。在一些实施方案中,产生稳定的宿主细胞系,其含有本文所述的raav载体。将raav载体转染至宿主培养物后,可以通过比如抗生素选择、荧光激活细胞分选、蛋白质印迹、基于pcr的检测、荧光原位杂交(如nakai等人,nature genetics[自然遗传学](2003)34,297-302;philpott等人,journal of virology[病毒学杂志](2002)76(11):5411-5421和howden等人,j gene med[基因药物杂志]2008;10:42-50中所述)等多种方法测定raav进入宿主基因组的整合。此外,稳定细胞系可以根据比如在clark,kidney international[国际肾脏杂志]第61卷(2002):s9-s15,和yuan等人,human gene therapy[人基因疗法]2011年5月;22(5):613-24中所述的那些方案等本领域众所周知的方案建立。
[0134]
用于基因疗法的重组aav:
[0135]
aav属于细小病毒科(parvoviridae)和依赖病毒属(dependovirus)。aav是一种小型无包膜病毒,其包装线性单链dna基因组。aav dna的有义链和反义链都以相同的频率包装到aav衣壳中。
[0136]
aav基因组的特征是两个末端反向重复(itr),它们位于两个开放阅读框(orf)的侧翼。例如,在aav2基因组中,itr的前125个核苷酸是回文,它自身折叠以最大化碱基配对并形成t形发夹结构。itr的其他20个碱基,称为d序列,保持未配对状态。itr是对aav dna复制很重要的顺式作用序列;itr是复制起点,并作为dna聚合酶合成第二链的引物。在此合成过程中形成的双链dna,称为复制型单体,用于第二轮自引发复制并形成复制型二聚体。这些双链中间体通过链置换机制进行处理,产生用于包装的单链dna和用于转录的双链dna。位于itr内的是rep结合元件和末端解离位点(trs)。在aav复制过程中,病毒调节蛋白rep使用这些特征来处理双链中间体。除了在aav复制中的作用外,itr对于aav基因组包装、转录、非许可条件下的负调节和位点特异性整合也必不可少(days和berns,clin microbiol rev[临床微生物学评论]21(4):583-593,2008)。
[0137]
aav的左侧orf包含rep基因,其编码四种蛋白质-rep78、rep68、rep52和rep40。右侧orf包含cap基因,其产生三种病毒衣壳蛋白(vp1、vp2和vp3)。aav衣壳包含60个病毒衣壳蛋白,它们排列成二十面体对称。vp1、vp2和vp3以1∶1∶10的摩尔比存在(daya和berns,clin microbiol rev[临床微生物学评论]21(4):583-593,2008)。
[0138]
aav是目前基因治疗中最常用的病毒之一。尽管aav会感染人和其他一些灵长类动物,但它已知不会引起疾病并引发非常温和的免疫应答。利用aav的基因疗法载体可以感染
分裂细胞和休眠细胞,并且以染色体外状态持续存在而不整合到宿主细胞的基因组中。由于aav的有利特征,本披露考虑将aav用于本文披露的重组核酸分子和方法。
[0139]
aav具有基因疗法载体的几个令人期望的特征,包括结合并进入靶细胞、进入细胞核的能力,在细胞核中长时间表达的能力以及低毒性。然而,aav基因组的小尺寸限制了可以掺入的异源dna的大小。为了尽量最小化这个问题,已经构建了不编码rep和整合效率元件(iee)的aav载体。itr被保留,因为它们是包装所需的顺式信号(daya和berns,clin microbiol rev[临床微生物评论],21(4):583-593,2008)。
[0140]
生产适用于基因疗法的raav的方法是本领域众所周知的(参见,例如,美国专利申请号2012/0100606;2012/0135515;2011/0229971;和2013/0072548;和ghosh等人,gene ther[基因疗法]13(4):321-329,2006),并且可以与本文披露的重组核酸分子和方法一起使用。
[0141]
在一些方面,本披露提供了本文披露的raav用于治疗cdkl5缺陷障碍(cdd)的用途,其中该raav包括aav衣壳和包装在其中的载体基因组。在一些实施方案中,raav含有经包装的基因组,该经包装的基因组按5’至3’顺序包含以下作为可操作地连接的组分:5
’‑
itr、启动子序列、cdkl5或其功能性片段或功能性变体的部分或完全编码序列、和3
’‑
itr。在一些实施方案中,cdkl5的编码序列选自seq id no:1-8或与其具有至少95%同一性的序列。
[0142]
在示例性实施方案中,cdkl5的编码序列包含seq id no:1或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0143]
在示例性实施方案中,cdkl5的编码序列包含seq id no:2或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0144]
在示例性实施方案中,cdkl5的编码序列包含seq id no:3或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0145]
在示例性实施方案中,cdkl5的编码序列包含seq id no:4或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0146]
在示例性实施方案中,cdkl5的编码序列包含seq id no:5或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0147]
在示例性实施方案中,cdkl5的编码序列包含seq id no:6或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0148]
在示例性实施方案中,cdkl5的编码序列包含seq id no:7或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0149]
在示例性实施方案中,cdkl5的编码序列包含seq id no:8或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。在一些实施方案中,衣壳是aav8衣壳。在一些实施方案中,衣壳是aav9变体衣壳。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列来自aav2。在一些实施方案中,5
’‑
itr序列和/或3
’‑
itr序列包含seq id no:11或由其组成。
[0150]
图1提供了显示用于表达cdkl5的示例性经包装的载体基因组构建体的示意图,该示意图以5’至3’的顺序显示了:5
’‑
itr、syn1启动子、cdkl5编码序列、sv40聚腺苷酸化信号序列、和3
’‑
itr。这一示例性经包装的载体基因组构建体的3,828bp序列提供于seq id no:19中。
[0151]
图2提供了显示用于表达cdkl5的示例性经包装的载体基因组构建体的另一示意图,该示意图以5’至3’的顺序显示了:5
’‑
itr、cmv增强子(例如,cmv即早期基因增强子)、cba启动子、sv40小t内含子、cdkl5编码序列、sv40聚腺苷酸化信号序列、和3
’‑
itr。这一示例性经包装的载体基因组构建体的4,057bp序列提供于seq id no:20中。
[0152]
药物组合物:
[0153]
在一些方面,本披露提供了包含本发明的raav(例如,用于递送cdkl5的raav)和药学上可接受的载剂或赋形剂的药物组合物。在一些实施方案中,包含本发明的raav(例如,用于递送cdkl5的raav)的药物组合物被配制用于皮下、肌内、皮内、腹膜内、鞘内、脑室内、静脉内、或大脑池内施用。在示例性实施方案中,药物组合物被配制用于鞘内施用。在另一
个示例性实施方案中,药物组合物被配制用于大脑池内施用。
[0154]
在一些实施方案中,raav在适合输注人受试者的缓冲液/载剂中配制。缓冲液/载剂应包括防止raav粘附在输液管上,但不会干扰raav体内结合活性的组分。各种合适的溶液可能包括以下中的一个或多个:缓冲盐水、表面活性剂和生理上相容的盐或盐的混合物(其离子强度被调节至相等于约100mm氯化钠(nacl)至约250mm氯化钠)、或被调节至相等离子浓度的生理上相容的盐。ph值可以在6.5到8.5、或7到8.5、或7.5到8的范围内。合适的表面活性剂或表面活性剂的组合可选自泊洛沙姆,即由聚氧丙烯10(聚(环氧丙烷))的中心疏水链和侧翼的两个聚氧乙烯(聚(环氧乙烷))亲水链构成的非离子三嵌段共聚物、solutol hs 15(macrogol-15羟基硬脂酸酯)、labrasol(聚氧辛酸甘油酯)、聚氧10油基醚、tween(聚氧乙烯脱水山梨糖醇脂肪酸酯)、乙醇和聚乙二醇。
[0155]
在示例性实施方案中,raav在包含nacl(例如,200mm nacl)、mgcl2(例如,1mm mgcl2)、tris(例如,20mm tris)(ph 8.0)、和泊洛沙姆188(例如,0.005%或0.01%泊洛沙姆188)的溶液中配制。
[0156]
在一些实施方案中,raav在包含至少一种二元或多元醇的药物组合物中配制。在一个实施方案中,二元或多元醇是选自由聚乙二醇、丙二醇和山梨糖醇组成的组的一种或多种醇。
[0157]
在示例性实施方案中,raav在包含山梨糖醇的药物组合物中配制。在一个实施方案中,山梨糖醇以0.5wt%至20wt%的范围存在于配制剂中。在一个实施方案中,山梨糖醇以1wt%至10wt%的范围存在于配制剂中。在一个实施方案中,山梨糖醇以约1wt%、约2wt%、约3wt%、约4wt%、约5wt%、约6wt%、约7wt%、约8wt%、约9wt%、或约10wt%存在于配制剂中。
[0158]
在示例性实施方案中,raav在包含5wt%的山梨糖醇和泊洛沙姆188(例如,0.005%或0.01%泊洛沙姆188)的药物组合物中配制。
[0159]
治疗cdkl5缺陷障碍(cdd)的方法:
[0160]
在又另一方面,本披露提供了在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括向该人受试者施用治疗有效量的本文披露的至少一种raav。
[0161]
在一个实施方案中,本披露提供了治疗cdd的方法,该方法包括施用包括aav衣壳和包装在其中的载体基因组的raav,其中该载体基因组包含cdkl5或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,cdkl5的编码序列选自seq id no:1-8或与其具有至少95%同一性的序列。在示例性实施方案中,cdkl5的编码序列包含seq id no:1或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。
[0162]
在某些实施方案中,本披露提供了在人受试者中治疗cdd的方法,该方法包括向经诊断具有至少一种cdkl5突变的人受试者施用治疗有效量的本文披露的至少一种raav。cdkl5中的病原性突变的非限制性列表描述于hector等人,2017,neurol genet[神经基因]3(6):e200中、russo等人,2009,neurogenetics[神经遗传学]10(3):241-50中、和莱顿开放变异数据库(lovd)全球cdkl5变异组(leiden open variation database(lovd)global variome for cdkl5)处。
[0163]
在一个实施方案中,本披露提供了在经诊断具有至少一种cdkl5突变的人受试者
中治疗cdd的方法,该方法包括施用包括aav衣壳和包装在其中的载体基因组的raav,其中该载体基因组包含cdkl5或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,cdkl5的编码序列选自seq id no:1-8或与其具有至少95%同一性的序列。在示例性实施方案中,cdkl5的编码序列包含seq id no:1或由其组成。在一些实施方案中,启动子序列选自seq id no:12-14。在示例性实施方案中,启动子序列包含seq id no:12或由其组成。在一些实施方案中,衣壳是aav9衣壳。
[0164]
可以使用任何合适的方法或途径来施用本文所述的raav或含有raav的组合物。施用途径包括,例如,皮下、皮内、腹膜内、鞘内、脑室内、静脉内、大脑池内、和其他肠胃外施用途径。在示例性实施方案中,将raav通过鞘内施用。在另一个示例性实施方案中,将raav通过经由大脑池施用。
[0165]
在一个实施方案中,raav可以经由脑池鞘内途径施用。在另一个实施方案中,raav可以经由腰椎鞘内途径施用。在一些实施方案中,可以使用自动鞘内注射器施用raav。例如,利用csf动力学、生理脉动和体积位移的注射器可用于鞘内递送raav。用于在本发明的方法中使用一种可能的注射器的一个实施例是alcyone生命科学公司正在开发的pulsar
tm
智能鞘内递送平台。
[0166]
施用的特定剂量对于每个患者可以是均一剂量,例如,1.0x10
11-1.0x10
14
个病毒基因组拷贝(gc)/患者。可替代地,患者的剂量可以根据患者的大致体重或表面积进行调整。确定合适剂量的其他因素可包括要治疗或预防的疾病或病症,疾病的严重程度,施用途径,以及患者的年龄、性别和医学病症。确定合适的治疗剂量所需的计算的进一步细化由本领域技术人员常规地进行,尤其是根据本文披露的剂量信息和测定。剂量也可以通过使用已知的用以确定剂量的测定结合适当的剂量-应答数据来确定。当监测疾病的进展时,也可以调整个体患者的剂量。
[0167]
在一些实施方案中,将raav以例如约1.0x10
11
个基因组拷贝/千克患者体重(gc/kg)至约1x10
14
gc/kg、约5x10
11
个基因组拷贝/千克患者体重(gc/kg)至约5x10
13
gc/kg,或约1x10
12
至约1x10
13
gc/kg的剂量施用,如通过qpcr或数字液滴pcr(ddpcr)测量。在一些实施方案中,将raav以约1x10
12
至约1x10
13
个基因组拷贝(gc)/kg的剂量施用。在一些实施方案中,将raav以约1.1x10
11
、约1.3x10
11
、约1.6x10
11
、约1.9x10
11
、约2x10
11
、约2.5x10
11
、约3.0x10
11
、约3.5x10
11
、约4.0x10
11
、约4.5x10
11
、约5.0x10
11
、约5.5x10
11
、约6.0x10
11
、约6.5x10
11
、约7.0x10
11
、约7.5x10
11
、约8.0x10
11
、约8.5x10
11
、约9.0x10
11
、约9.5x10
11
、约1.0x10
12
、约1.5x10
12
、约2.0x10
12
、约2.5x10
12
、约3.0x10
12
、约3.5x10
12
、约4.0x10
12
、约4.5x10
12
、约5.0x10
12
、约5.5x10
12
、约6.0x10
12
、约6.5x10
12
、约7.0x10
12
、约7.5x10
12
、约8.0x10
12
、约8.5x10
12
、约9.0x10
12
、约9.5x10
12
、约1.0x10
13
、约1.5x10
13
、约2.0x10
13
、约2.5x10
13
、约3.0x10
13
、约3.5x10
13
、约4.0x10
13
、约4.5x10
13
、约5.0x10
13
、约5.5x10
13
、约6.0x10
13
、约6.5x10
13
、约7.0x10
13
、约7.5x10
13
、约8.0x10
13
、约8.5x10
13
、约9.0x10
13
、约9.5x10
13
个基因组拷贝(gc)/kg的剂量施用。raav可以根据所期望治疗结果的需要以单剂量或多剂量(比如2、3、4、5、6、7、8、9、10或更多个剂量)施用。
[0168]
在一些实施方案中,根据本发明的治疗cdd的方法可进一步包含在施用本文所述的raav之前施用igg降解蛋白酶。因此,本披露提供了治疗cdd的方法,该方法包括首先施用igg降解蛋白酶,随后施用包括aav衣壳和包装在其中的载体基因组的raav,其中该载体基
因组包含cdkl5或其功能性片段或功能性变体的部分或完全编码序列。
[0169]
在一些实施方案中,根据本发明的治疗cdd的方法在已经施用了igg降解蛋白酶的人受试者上进行。
[0170]
可用于本发明的蛋白酶的实施例包括,例如但不限于wo/2020/016318和/或wo/2020/159970中描述的那些,包括例如来自酿脓链球菌、马链球菌、犬支原体(mycoplasma canis)、停乳链球菌(streptococcus agalactiae)、假豕链球菌(streptococcuspseudoporcinus)、或恶臭假单胞菌(pseudomonasputida)的半胱氨酸蛋白酶。
[0171]
在某些实施方案中,igg降解蛋白酶是来自酿脓链球菌(seq id no:23)的ides或与seq id no:23具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%同一性的蛋白酶。在一些实施方案中,蛋白酶是seq id no:23的工程化的变体。工程化的ides蛋白酶的实施例描述于wo/2020/016318和美国专利公开号20180023070和20180037962中。在一些实施方案中,工程化的ides变体相对于seq id no:20可以具有1个、2个、3个、4个、5个、或更多个氨基酸修饰。
[0172]
在某些实施方案中,igg降解蛋白酶是来自马链球菌(seq id no:24)的idez或与seq id no:24具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%同一性的蛋白酶。在一些实施方案中,蛋白酶是seq id no:24的工程化的变体。工程化的idez蛋白酶的实施例描述于wo/2020/016318中。在一些实施方案中,工程化的idez变体相对于seq id no:21可以具有1个、2个、3个、4个、5个或更多个氨基酸修饰。
[0173]
可用于本发明的其他蛋白酶包括,例如但不限于,来自猪链球菌(streptococcus suis)、豕链球菌(streptococcus porcinus)、和马链球菌的igde酶,描述于wo/2017/134274中。
[0174]
在一些实施方案中,igg降解蛋白酶可以包封在脂质体、纳米颗粒、脂质纳米颗粒(lnp)、聚合物、微粒、微胶囊、胶束或细胞外囊泡中或与其复合。
[0175]
包括使用皮质类固醇的治疗cns障碍的方法:
[0176]
本发明诸位发明人已经出人意料地观察到,在施用raav之前施用皮质类固醇泼尼松龙导致多个脑组织中存在的载体基因组的数目增加。不受理论的束缚,假设皮质类固醇用以减少cns组织中的炎症,这允许raav渗透到深部cns组织中,否则在没有皮质类固醇施用的情况下将不可到达这些深部cns组织。因此,在又另一方面,本披露提供了在人受试者中治疗cns障碍的方法,该方法包括首先向该受试者施用皮质类固醇,随后施用治疗有效量的经设计用于治疗所述cns障碍的至少一种raav,其中将该raav通过鞘内、脑室内、或经由大脑池内递送施用。还提供了在人受试者中治疗cns障碍的方法,该方法包括施用治疗有效量的经设计用于治疗所述cns障碍的至少一种raav,其中已经向该受试者施用了皮质类固醇;任选地,将该raav通过鞘内、脑室内、或经由大脑池内递送施用。
[0177]
在根据该方面的各种实施方案中,皮质类固醇可以选自泼尼松龙、泼尼松、地塞米松、氢化可的松、曲安西龙、甲泼尼龙、布地奈德、倍他米松、和地夫可特。在示例性实施方案中,皮质类固醇是泼尼松龙。
[0178]
在根据该方面的各种实施方案中,在施用raav前至少约12小时向受试者施用皮质类固醇。在另一个实施方案中,在施用raav前至少约24小时向受试者施用皮质类固醇。在又
另一实施方案中,在施用raav前至少约2天向受试者施用皮质类固醇。在又另一实施方案中,在施用raav前至少约3天、4天、5天、6天、7天、或更多天向受试者施用皮质类固醇。在又另一实施方案中,在施用raav前至少约7天、14天、21天、或更多天向受试者施用皮质类固醇。在又另一实施方案中,在施用raav前至少约1个月、至少约2个月、或至少约3个月向受试者施用皮质类固醇。
[0179]
在一个实施方案中,在施用raav前施用皮质类固醇一次。在另一个实施方案中,在施用raav前施用皮质类固醇两次。在又另一实施方案中,在施用raav前施用皮质类固醇3次、4次、5次、或更多次。
[0180]
可通过任何途径向人受试者施用皮质类固醇,包括但不限于口服、静脉内、皮内、经皮、皮下、肌内、吸入(例如,经由气溶胶)、口腔(例如,舌下)、局部(即,皮肤和粘膜表面,包括气道表面)、鞘内、关节内、胸膜内、大脑内、动脉内、腹膜内或鼻内施用。在示例性实施方案中,口服施用皮质类固醇。
[0181]
在某些实施方案中,以mg/kg受试者体重为单位测量皮质类固醇的剂量。在其他实施方案中,以施用至受试者的每剂量mg为单位测量皮质类固醇的剂量。剂量的任何测量都可以与本发明的组合物和方法结合使用,并且剂量单位可以通过本领域的标准方法进行转换。
[0182]
在某些实施方案中,可以约1mg至约1000mg的剂量施用皮质类固醇。在一些实施方案中,以约3mg至约300mg的剂量施用皮质类固醇。在一些实施方案中,以约5mg至约150mg的剂量施用皮质类固醇。在一些实施方案中,以约10mg至约100mg的剂量施用皮质类固醇。在一些实施方案中,以约15mg至约80mg的剂量施用皮质类固醇。在一些实施方案中,以约20mg至约60mg的剂量施用皮质类固醇。
[0183]
在某些实施方案中,可以约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约600mg、约700mg、约800mg、约900mg、或约1000mg的剂量施用皮质类固醇。
[0184]
在某些实施方案中,可以约0.1mg/kg至约100mg/kg的受试者体重的剂量施用皮质类固醇。在一些实施方案中,以约0.2mg/kg至约10mg/kg的剂量施用抗cd19抗体。在一些实施方案中,以约0.5mg/kg至约5mg/kg的剂量施用抗cd19抗体。在一些实施方案中,以约0.2mg/kg、约0.3mg/kg、约0.4mg/kg、约0.5mg/kg、约0.6mg/kg、约0.7mg/kg、约0.8mg/kg、约0.9mg/kg、约1mg/kg、约1.1mg/kg、约1.2mg/kg、约1.3mg/kg、约1.4mg/kg、约1.5mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、或约10mg/kg的受试者体重的剂量施用抗cd19抗体。
[0185]
在一些实施方案中,可以在施用raav之前施用皮质类固醇总共至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天、或更多天。例如,在某些示例性实施方案中,在施用raav之前,以1mg/kg/天施用皮质类固醇5天。
[0186]
在一些实施方案中,可以1mg/kg/天施用皮质类固醇4周,其中第一次给药发生在
施用raav前5天。在一些实施方案中,可以1mg/kg/天施用皮质类固醇4周,其中第一次给药发生在施用raav前5天,随后逐渐减少皮质类固醇,再持续4周。
[0187]
根据该方面的方法可用于治疗基因疗法可能适合的任何cns障碍。在一些实施方案中,cns障碍选自cdd、快乐木偶综合征、巴滕病、克拉伯病、帕金森病、阿尔茨海默病、脊髓性肌萎缩(sma)i、ii、iii、和iv型、x连锁肌小管肌病、弗里德希氏共济失调、卡纳万病、肌萎缩侧索硬化(als)、肾上腺脑白质营养不良、亨廷顿病、雷特综合征、和脊髓小脑性共济失调。在示例性实施方案中,cns障碍是cdd。在另一个示例性实施方案中,用于在根据该方面的方法中使用的raav包含本文所述的可用于治疗cdd的raav。例如,raav可以包含aav衣壳(例如,aav9衣壳)和包装在其中的载体基因组,其中所述载体基因组包含:(a)启动子序列(例如,syn1启动子序列,例如人syn1启动子序列);和(b)cdkl5或其同种型、或其功能性片段或功能性变体的部分或完全编码序列。在一些实施方案中,编码序列包含与选自seq id no:1-8的序列具有至少95%同一性的序列。
[0188]
在整个说明书中,在组合物被描述为具有、包括或包含具体组分的情况下,或在工艺和方法被描述为具有、包括、或包含具体步骤的情况下,考虑到另外地,存在本发明的组合物,其基本上由或由叙述的组分组成,并且存在根据本发明的工艺和方法,其基本上由或由叙述的加工步骤组成。
[0189]
在本披露中,当元件或组分被称为包括在和/或选自所列举的元件或组分的列表中时,应理解该元件或组分可以是所列举的元件或组分中的任何一个,或元件或组分可以从由两个或更多个该元件或组分组成的组中选择。
[0190]
此外,应当理解,本文描述的组合物或方法的要素和/或特征可以以多种方式组合而不脱离本发明的精神和范围,无论是本文明确的还是隐含的。例如,当提及特定化合物时,除非从上下文另有理解,否则该化合物可用于本发明组合物的各种实施方案和/或本发明方法中。换句话说,在本披露中,已经以能够编写和绘制清晰简洁的应用的方式描述和描绘了实施方案,但是意图是并且将理解实施方案可以在不脱离本披露教导和一个或多个发明的情况下以各种方式组合或分离。例如,应当理解,这里描述和描绘的所有特征可以适用于这里描述和描绘的一个或多个发明的所有方面。
[0191]
应当理解,除非从上下文和使用中另有理解,否则表述
″
至少一个
″
单独地包括表述之后所列举的对象中的每一个以及所列举的对象中的两个或更多个的各种组合。除非根据上下文另有理解,否则与三个或更多个列举的对象相关的表述
″
和/或
″
应被理解为具有相同的含义。
[0192]
应理解术语
″
包括(include、includes、including)
″
、
″
具有(have、has、having)
″
、
″
包含(contain、contains或containing)
″
的使用,包括其语法等价物通常作为开放式和非限制性的,例如,不排除另外的未列举的元件或步骤,除非另有明确说明或从上下文中理解。
[0193]
如果术语
″
约
″
的使用在数量值之前,则本发明还包括特定数量值本身,除非另有特别说明。如本文所用,除非另有说明或推断,术语
″
约
″
是指标称值的
±
10%变化。
[0194]
应当理解,只要本发明保持可操作,步骤的顺序或执行某些动作的顺序是无关紧要的。此外,可以同时进行两个或更多个步骤或动作。
[0195]
此处使用的任何和所有示例或示例性语言,例如
″
比如
″
或
″
包括
″
仅旨在更好地说
明本发明,除非声明,否则不对本发明的范围构成限制。说明书中的语言不应当被解释为指示任何未要求保护的要素为实践本发明所必需的。
[0196]
实施例
[0197]
通过参考以下实施例将更容易理解现在在总体上描述的本披露,这些实施例仅被包括用于说明本披露的某些方面和实施方案的目的,并不旨以任何方式在限制本披露的范围。
[0198]
实施例1:
[0199]
本实施例的目的是证明将cba-hcdkl5质粒递送至neuro2a(小鼠神经母细胞瘤)细胞导致cdkl5表达增加,并且随后导致cdkl5的下游靶标eb2(微管相关蛋白rp/eb家族成员2)的磷酸化增加。
[0200]
在本实施例中,neuro2a细胞用含有人cdkl5 cdna上游的cba启动子的质粒瞬时转染48小时或不转染。将细胞固定并使用抗cdkl5抗体和抗磷酸-eb2抗体进行免疫细胞化学。使用zeiss axio imager m2荧光显微镜进行成像。
[0201]
如图3所示,表达高水平hcdkl5的neuro2a细胞显示磷酸化eb2蛋白(cdkl5的下游靶标)水平升高。这表明将cdkl5递送至neuro2a细胞可对比如eb2等cdkl5靶标的活性产生积极影响。
[0202]
实施例2:
[0203]
本实施例的目的是证明增强型绿色荧光蛋白(egfp)在raav9-cba-egfp或raav9-syn-egfp治疗的cdkl5 ko小鼠的各种cns组织中的表达。
[0204]
在本实施例中,向cdkl5缺陷小鼠给药(1)包含aav9衣壳和包含cba启动子和egfp编码序列的载体基因组的raav[raav9-cba-egfp]或(2)包含aav9衣壳和包含syn启动子和egfp编码序列的载体基因组的raav[raav9-syn-egfp]。通过脑室内(icv)注射向小鼠施用raav。在给药后2-4周取回组织用于分析。将大脑固定、切片和免疫染色用于检测egfp。
[0205]
如图4所示,在给药小鼠大脑的多个区域(包括海马、纹状体、额叶皮层、和小脑)中检测到egfp。所有小鼠在海马体和纹状体中具有最高浓度的egfp。给药raav9-cba-egfp的小鼠在皮层中具有较少的细胞,并且在小脑中具有略微更多的细胞;给药raav9-syn-egfp的小鼠在小脑中具有较少的细胞,并且在皮层中具有略微更多的细胞。
[0206]
本实施例证明通过icv注射施用raav9-cba-egfp和raav9-syn-egfp在海马和纹状体细胞中产生高水平的egfp蛋白,而在皮层和小脑细胞中产生较低水平的egfp蛋白。
[0207]
实施例3:
[0208]
本实施例的目的是证明人突触蛋白(syn)启动子、组成型启动子(cba)、或内源性cdkl5启动子都可以驱动cdkl5蛋白在neuro2a细胞中的表达。
[0209]
在本实施例中,neuro2a细胞用表达egfp或hcdkl5的质粒瞬时转染48小时。将未转导的neuro2a细胞用作对照。将细胞固定并使用抗cdkl5抗体进行免疫细胞化学。使用zeiss axio imager m2荧光显微镜进行成像。
[0210]
如图5所示,与使用cba启动子的最高表达水平和来自syn启动子的较低表达水平相比,hcdkl5和egfp以中等水平在使用内源性cdkl5启动子(分别为endo-hcdkl5和endo-egfp)的转染的neuro2a细胞中表达。本实施例表明位于人cdkl5转录起始位点(即内源性cdkl5启动子)上游的核苷酸能够驱动egfp和hcdkl5在neuro2a细胞中的表达。
[0211]
实施例4:
[0212]
本实施例的目的是证明将raav9-syn-hcdkl5和raav9-cba-hcdkl5递送至cdkl5缺陷小鼠的csf导致hcdkl5 mrna和cdna在整个大脑中的稳固分布。
[0213]
在本实施例中,向cdkl5缺陷小鼠给药(1)包含aav9衣壳和包含cba启动子和hcdkl5编码序列的载体基因组的raav[raav9-cba-hcdkl5]或(2)包含aav9衣壳和包含syn启动子和hcdkl5编码序列的载体基因组的raav[raav9-syn-hcdkl5]。通过脑室内(icv)注射向小鼠给药。在给药后2周或3个月取回组织。通过rnascope原位杂交将大脑固定、切片和处理,以检测hcdkl5 mrna和cdna以及rbfox3 mrna(神经元标记)。
[0214]
如图6a所示,两种载体在海马区和纹状体区均产生高水平的hcdkl5。共标记证实两种载体也在整个皮层的神经元中表达hcdkl5(图6b)。如图6b所示,通过icv注射用raav9-cba-hcdkl5(图6b的方块5)或raav9-syn-hcdkl5(图6b的方块7)治疗的小鼠在海马、纹状体和皮层中具有hcdkl5mrna和cdna。注意到两个载体之间总体分布的相似性,并且两个载体驱动神经元中的表达,如图6b显示了与神经元标记rbfox3的共标记。图6b的方块6显示了由raav9-cba-hcdkl5载体和神经元标记rbfox3表达的hcdkl5的共标记。图6b的方块8显示了由raav9-syn-hcdkl5载体和神经元标记rbfox3表达的hcdkl5的共标记。
[0215]
本实施例中显示的数据表明,通过icv注射施用raav9-cba-hcdkl5和raav9-syn-hcdkl5载体导致整个海马、纹状体和额叶皮层的神经元中产生hcdkl5 mrna和cdna。
[0216]
实施例5:
[0217]
本实施例的目的是证明aav9-syn-hcdkl5和aav9-cba-hcdkl5 raav可以将功能性cdkl5蛋白递送至小鼠大脑。
[0218]
在本实施例中,cdkl5缺陷小鼠通过脑室内(icv)注射给药raav9-cba-hcdkl5或raav9-syn-hcdkl5,并且给药后2周取回组织。对大脑进行微切割,且将额叶皮层均质化并在蛋白质印迹上运行,该蛋白质印迹用针对cdkl5、peb2和β-微管蛋白的抗体进行探测。
[0219]
如图7所示,与媒介物对照相比,用raav9-syn-hcdkl5或raav9-cba-hcdkl5治疗的cdkl5缺陷小鼠表现出增加的cdkl5蛋白以及磷酸化eb2(peb2)蛋白水平。cdkl5下游靶标eb2的磷酸化证实了递送的cdkl5充当功能性激酶。
[0220]
实施例6:
[0221]
本实施例的目的是证明aav9-cba-egfp和aav9-syn-egfp在腰椎鞘内递送后能够在非人灵长类动物(nhp)大脑中转导细胞。
[0222]
在本实施例中,通过腰椎鞘内注射向年轻雌性nhp受试者(n=2/载体)施用raav9-cba-egfp或raav9-syn-egfp。在给药后两周,取回多种组织用于通过定量pcr进行载体基因组定量。
[0223]
在经处理的nhp的cns和外周组织中量化了1x103与1x107个拷贝之间的vg/μg组织dna。如图8所示,raav9-cba-egfp和raav9-syn-egfp施用在不同组织之间产生了相似的拷贝数。
[0224]
本实施例显示通过鞘内递送施用raav9-cba-egfp和raav9-syn-egfp在所分析的所有大脑和外周区域中产生了载体基因组,其中载体之间的广泛生物分布没有区别。
[0225]
实施例7:
[0226]
本实施例的目的是证明,在nhp皮层中,aav9-cba-egfp主要在具有胶质细胞形态
的细胞中驱动表达,而aav9-syn-egfp主要在具有神经元形态的细胞中驱动表达。
[0227]
在本实施例中,通过腰椎鞘内注射向年轻雌性nhp受试者(n=2/载体)施用raav9-cba-egfp或raav9-syn-egfp。在给药后两周,将取回,固定,切片,并且通过自由浮动显色检测对egfp进行免疫染色。
[0228]
在同时给药用raav9-cba-egfp和raav9-syn-egfp的nhp受试者的大脑切片中检测到egfp阳性细胞。egfp阳性细胞最常单独出现,但有时会以团簇形式出现。如图9所示,来自给药raav9-cba-egfp的nhp受试者的egfp阳性细胞具有多种形态,尽管大多数具有带有宽树枝状和小细胞体的胶质细胞的外观,这表明cba启动子在星形胶质细胞(即非神经元细胞)中优先表达egfp有效载荷。同时,来自给药raav9-syn-egfp的nhp受试者的egfp阳性细胞具有带有圆形细胞体及较小树状分枝的神经元的外观,这表明syn启动子在所需靶细胞类型(即,神经元)中更有效的表达egfp有效载荷。
[0229]
通过鞘内给药施用raav9-cba-egfp主要产生egfp阳性星形胶质细胞,而施用raav9-syn-egfp主要产生egfp阳性神经元。本实施例中的数据表明,在非人灵长类动物,相对于组成型cba启动子,syn启动子可以有利于cdkl5在神经元细胞中的递送和表达。
[0230]
实施例8:
[0231]
本实施例的目的是证明将raav9-syn-hcdkl5递送至幼年cdkl5缺陷小鼠的csf可以改善学习、记忆和运动功能。
[0232]
在本实施例中,在syn启动子(图1中示出的经包装的基因组,seq id no:19,3,828bp)的控制下,通过脑室内(icv)注射将包含aav9衣壳和表达人cdkl5基因的载体基因组的单次高剂量(1.6e12 vg/小鼠)的重组aav注射至3-5周龄(早期有症状)之间的幼年雄性及雌性cdkl5缺陷小鼠的csf中。一旦小鼠达到2-3个月大(成年),它们就会进行一系列行为测试。在行为测试之后,收集大脑用于cdkl5蛋白表达的蛋白质印迹分析。
[0233]
来自多个大脑区的微切割组织的蛋白质印迹分析表明,给药后大约3个月,经治疗的小鼠大脑中的人cdkl5蛋白的适度持续增加(额叶皮层和脑干中20%-30%的wt水平,海马中为35%-70%)。参见图10a-10c,其显示了展示在cdkl5缺陷小鼠大脑的不同区域(额叶皮层:图10a;海马:图10b;和脑干:图10c)中定量的cdkl5的量的图。并且如图11a-11d所示,经raav9-syn-hcdkl5治疗的雄性和雌性小鼠表现出焦虑样行为(图11a)、运动功能(图11b)和协调(图11c)以及学习和记忆的正常化的改善(图11d)。
[0234]
在本实施例中突出显示的发现表明,当经由raav9-syn-hcdkl5递送至幼年有症状的cdkl5缺陷小鼠时,即使是中等水平的功能性cdkl5也可导致大脑功能显著改善。
[0235]
实施例9:
[0236]
本实施例的目的是证明与腰椎鞘内施用相比,通过大脑池内施用途径施用载体颗粒可以增加raav9-syn-egfp向非人灵长类动物(nhp)的几个cns区的递送。
[0237]
在本实施例中,年轻雌性nhp受试者通过腰椎鞘内(it)注射(n=2)(数据取自上述实施例6)或通过大脑池内(cm)施用(n=3)(本实施例9中新生成的数据)施用raav9-syn-egfp。在给药期间和给药完成后将所有nhp置于头低足高位15min。在给药后两周,取回多种组织用于通过定量pcr进行载体基因组定量。图12是条形图,表明了在头低足高位鞘内(it)递送(ux055-18-0001)8.06x1013个载体基因组(vg)或大脑池内(cm)递送(ux055-19-0002)7.76x1013个raav9-syn-egfp的vg后两周,1-2岁雌性非人灵长类动物(nhp)中cns中每μg的
dna的基因组拷贝(gc)。该图表明大脑池内递送导致各种大脑组织(包括顶叶(10x)、纹状体(10x)和丘脑(8x))中nhp cns中的载体基因组的量增加。收集本图中提供的数据作为两项独立研究的一部分。
[0238]
在经处理的nhp的大脑和脊髓组织中量化了1x103与1x106个拷贝之间的vg/μg组织dna。如图12所示,相比于在许多cns组织中进行腰椎鞘内递送,向大脑池施用raav9-syn-egfp产生更高的拷贝数。
[0239]
在本实施例中突出显示的发现表明,向nhp中的几个cns区增加raav递送可经由大脑池内施用途径来实现。
[0240]
实施例10:
[0241]
本实施例的目的是证明泼尼松龙惊人地增加了在大脑池内注射后递送至nhp中许多cns区的raav9-syn-hcdkl5(ux055-19-003)载体基因组的数量。
[0242]
在本实施例中,年轻雌性nhp受试者通过大脑池内(cm)施用以头低足高位施用raav9-syn-hcdkl5(具有(n=3)或不具有泼尼松龙(n=3))。泼尼松龙治疗组中的nhp在raav9-syn-hcdkl5给药前4天开始通过经口管饲接受单次每日剂量1mg/kg的泼尼松龙,并持续到研究结束。在给药后四周,从大脑的一半取回各种组织用于通过定量pcr进行载体基因组量化,并将大脑的另一半进行冠向切片用于分析使用原位杂交转导的细胞的数量。将探针设计为与载体dna特异性结合,并且将苏木精复染用于观察单个细胞。
[0243]
在经处理的nhp的大脑区、脊髓和背根神经节(drg)中量化了1x103与1x106个拷贝之间的vg/μg组织dna。如图13a所示,与在许多cns组织中单独施用raav9-syn-hcdkl5相比,预处理及持续的泼尼松龙与raav9-syn-hcdkl5组合施用至大脑池时出人意料地产生更高的拷贝数。由于没有预料到转导的增加,这些结果令人惊讶。
[0244]
如图13b所示,对含有枕叶皮层和小脑的切片的basescope(原位杂交)分析表明,在用泼尼松龙处理的nhp中转导的细胞数量有增加的趋势(分图2和4),然而,在非泼尼松龙组中观察到具有一个异常值nhp的显著的动物间差异(分图1和3)。如图13c所示,在非泼尼松龙组中注意到一个具有极高载体基因体阳性细胞数目的异常值nhp。
[0245]
不受理论束缚,假设泼尼松龙抑制先天免疫系统的能力可能有助于这一发现,和/或泼尼松龙抑制炎症的能力可能允许raav渗透到更深的大脑中,导致观察到的通过载体基因组拷贝数测量的转导增加。
[0246]
在本实施例中突出显示的发现表明,当在raav施用之前和施用期间给予皮质类固醇泼尼松龙时,可以实现向nhp中的几个cns区增加raav递送。
[0247]
编号的实施方案
[0248]
本文披露的实施方案包括如在本披露的编号的实施方案中提供的实施方案p1至p53。
[0249]
实施方案p1:一种重组腺相关病毒(raav),其中所述raav包含aav衣壳和包装在其中的载体基因组,其中所述载体基因组包含:
[0250]
(a)启动子序列;以及
[0251]
(b)cdkl5的编码序列,其中所述编码序列包含与seq id no:1-8具有至少95%同一性的序列。
[0252]
实施方案p2:根据实施方案p1所述的raav,其中该aav衣壳来自血清型1、2、3、4、5、
6、7、8、9、10、11、12、rh10或hu37的aav。
[0253]
实施方案p3:根据实施方案p2所述的raav,其中该aav衣壳来自aav9。
[0254]
实施方案p4:根据实施方案p2所述的raav,其中该aav衣壳来自aav8。
[0255]
实施方案p5:根据实施方案p1所述的raav,其中该aav衣壳是aav9变体衣壳。
[0256]
实施方案p6:根据实施方案p1-p5中任一项所述的raav,其中该启动子是神经元特异性启动子。
[0257]
实施方案p7:根据实施方案p6所述的raav,其中该神经元特异性启动子选自人突触蛋白1(syn1)启动子、小鼠钙/钙调蛋白依赖性蛋白激酶ii(camkii)启动子、大鼠微管蛋白αi(ta1)启动子、大鼠神经元特异性烯醇化酶(nse)启动子、人神经元特异性烯醇化酶(eno2)启动子、人血小板源性生长因子β链(pdgf)启动子、人bm88启动子、和神经元烟碱受体β2(chrnb2)启动子。
[0258]
实施方案p8:根据实施方案p7所述的raav,其中该神经元特异性启动子是syn1启动子。
[0259]
实施方案p9:根据实施方案p8所述的raav,其中该syn1启动子序列包含seq id no:12。
[0260]
实施方案p10:根据实施方案p8所述的raav,其中该syn1启动子序列由seq id no:12组成。
[0261]
实施方案p11:根据实施方案p1-p5中任一项所述的raav,其中该启动子选自鸡β-肌动蛋白(cba)启动子、巨细胞病毒(cmv)即早期基因启动子、甲状腺素转运蛋白(ttr)启动子、甲状腺素结合球蛋白(tbg)启动子、和α-1抗胰蛋白酶(a1at)启动子。
[0262]
实施方案p12:根据实施方案p11所述的raav,其中该启动子是cba启动子。
[0263]
实施方案p13:根据实施方案p12所述的raav,其中该cba启动子序列包含seq id no:13。
[0264]
实施方案p14:根据实施方案p12所述的raav,其中该cba启动子序列由seq id no:13组成。
[0265]
实施方案p15:根据实施方案p1-p5中任一项所述的raav,其中该启动子是cdkl5基因特异性内源性启动子。
[0266]
实施方案p16:根据实施方案p15所述的raav,其中该cdkl5基因特异性内源性启动子包含至少15个连续核苷酸的核苷酸序列,该核苷酸序列与seq id no:14的相等长度区域具有至少95%同一性。
[0267]
实施方案p17:根据实施方案p1-p16中任一项所述的raav,其中该载体基因组进一步包含5
’‑
itr序列。
[0268]
实施方案p18:根据实施方案p1-p17中任一项所述的raav,其中该载体基因组进一步包含3
’‑
itr序列。
[0269]
实施方案p19:根据实施方案p17-p18中任一项所述的raav,其中该5
’‑
itr序列和/或该3
’‑
itr序列来自aav2。
[0270]
实施方案p20:根据实施方案p19所述的raav,其中该5
’‑
itr序列和该3
’‑
itr序列包含seq id no:11或由其组成。
[0271]
实施方案p21:根据实施方案p17-p18中任一项所述的raav,其中该5
’‑
itr序列和/
或该3
’‑
itr序列来自非aav2来源。
[0272]
实施方案p22:根据实施方案p1-p21中任一项所述的raav,其中该载体基因组进一步包含聚腺苷酸化信号序列。
[0273]
实施方案p23:根据实施方案p22所述的raav,其中该聚腺苷酸化信号序列选自sv40聚腺苷酸化信号序列、牛生长激素(bgh)聚腺苷酸化信号序列和兔β珠蛋白聚腺苷酸化信号序列。
[0274]
实施方案p24:根据实施方案p23所述的raav,其中该聚腺苷酸化信号序列是sv40聚腺苷酸化信号序列。
[0275]
实施方案p25:根据实施方案p24所述的raav,其中该sv40聚腺苷酸化信号序列包含seq id no:15或由其组成。
[0276]
实施方案p26:根据实施方案p1-p25中任一项所述的raav,其中该载体基因组进一步包含一个或多个增强子序列。
[0277]
实施方案p27:根据实施方案p26所述的raav,其中该增强子选自巨细胞病毒(cmv)即早期基因增强子、甲状腺素转运蛋白增强子(enttr)、鸡β-肌动蛋白(cba)增强子、en34增强子、和载脂蛋白e(apoe)增强子。
[0278]
实施方案p28:根据实施方案p27所述的raav,其中该增强子是cmv增强子。
[0279]
实施方案p29:根据实施方案p28所述的raav,其中该增强子序列包含seq id no:17或由其组成。
[0280]
实施方案p30:根据实施方案p26-p29所述的raav,其中该增强子位于启动子序列的上游。
[0281]
实施方案p31:根据实施方案p1-p30中任一项所述的raav,其中该载体基因组进一步包含一个或多个内含子序列。
[0282]
实施方案p32:根据实施方案p31所述的raav,其中该内含子选自sv40小t内含子、兔血红蛋白亚基β(rhbb)内含子、人β珠蛋白ivs2内含子、β-珠蛋白/igg嵌合内含子、或hfix内含子。
[0283]
实施方案p33:根据实施方案p32所述的raav,其中该内含子是sv40小t内含子。
[0284]
实施方案p34:根据实施方案p33所述的raav,其中该sv40小t内含子序列包含seq id no:18或由其组成。
[0285]
实施方案p35:一种组合物,其包含根据前述实施方案中任一项所述的raav、和药学上可接受的载剂。
[0286]
实施方案p36:一种在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括向该人受试者施用治疗有效量的根据实施方案p1-p34中任一项所述的raav或根据实施方案p35所述的组合物。
[0287]
实施方案p37:根据实施方案p36所述的方法,其中将该raav或该组合物通过皮下、肌内、皮内、腹膜内、鞘内、脑室内、静脉内、或大脑池内施用。
[0288]
实施方案p38:根据实施方案p37所述的方法,其中将该raav或该组合物通过鞘内施用。
[0289]
实施方案p39:根据实施方案p37所述的方法,其中将该raav或该组合物通过大脑池内施用。
[0290]
实施方案p40:根据实施方案p37-p39中任一项所述的方法,其中将该raav以约1x10
11
至约1x10
14
个基因组拷贝(gc)/kg的剂量施用。
[0291]
实施方案p41:一种在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括首先向该人受试者施用皮质类固醇,随后施用治疗有效量的重组腺相关病毒(raav),其中所述raav包含aav衣壳和包装在其中的载体基因组,其中所述载体基因组包含启动子序列和cdkl5的编码序列。
[0292]
实施方案p42:一种在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括首先向该人受试者施用皮质类固醇,随后施用治疗有效量的根据实施方案p1-p34中任一项所述的raav或根据实施方案p35所述的组合物。
[0293]
实施方案p43:根据实施方案p41-p42中任一项所述的方法,其中该皮质类固醇选自泼尼松龙、泼尼松、地塞米松、氢化可的松、曲安西龙、甲泼尼龙、布地奈德、倍他米松、和地夫可特。
[0294]
实施方案p44:根据实施方案p43所述的方法,其中该皮质类固醇是泼尼松龙。
[0295]
实施方案p45:一种在人受试者中治疗cdkl5缺陷障碍(cdd)的方法,该方法包括首先向该人受试者施用igg降解蛋白酶,随后施用治疗有效量的根据实施方案p1-p34中任一项所述的raav或根据实施方案p35所述的组合物。
[0296]
实施方案p46:根据实施方案p45所述的方法,其中该igg降解蛋白酶是酿脓链球菌的ides或其工程化的变体。
[0297]
实施方案p47:根据实施方案p45所述的方法,其中该igg降解蛋白酶是马链球菌的idez或其工程化的变体。
[0298]
实施方案p48:一种多核苷酸,其包含与seq id no:19具有至少95%同一性的核酸序列。
[0299]
实施方案p49:一种多核苷酸,其包含seq id no:19。
[0300]
实施方案p50:一种多核苷酸,其由seq id no:19组成。
[0301]
实施方案p51:一种多核苷酸,其包含与seq id no:20具有至少95%同一性的核酸序列。
[0302]
实施方案p52:一种多核苷酸,其包含seq id no:20。
[0303]
实施方案p53:一种多核苷酸,其由seq id no:20组成。
[0304]
通过引用并入
[0305]
本文提及的每个专利文献和科学文章的全部披露内容出于所有目的通过引用并入。
[0306]
等同物
[0307]
在不脱离本披露的精神或基本特征的情况下,本披露可以以其他特定形式实施。因此,前述实施方案在所有方面都被认为是说明性的而不是限制本文描述的披露内容。不同实施方案的各种结构元件和各种披露的方法步骤可以以各种组合和排列来使用,并且所有此类变型都被认为是本披露的形式。因此,本披露的范围由所附权利要求而不是由前述说明书来指示,并且在权利要求的等效含义和范围内的所有变化旨在包含在其中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1