检测单链RNA病毒的方法与流程
检测单链rna病毒的方法
技术领域
1.本发明涉及检测单链rna病毒的方法。
背景技术:
2.病毒是寄生于细胞的生物,不能单独培养病毒,因此,作为在病毒感染症的诊断中在短时间内确定致病病毒的方法,主要利用基因诊断。在病毒的基因诊断中,通过核酸扩增反应扩增作为检测对象的病毒所固有的核酸序列并进行检测。
3.作为核酸扩增法的一种,已知环介导等温扩增(lamp(loop-mediated isothermal amplification))法(专利文献1)。在该方法中,基于靶核酸的6个区域(f3、f2、f1、b1c、b2c和b3c或者f3c、f2c、f1c、b1、b2和b3)来设计两种内引物(fip引物和bip引物)和两种外引物(f3引物和b3引物),使用这些引物在恒定温度下扩增靶核酸。另外,已知在lamp法中,除了上述内引物和外引物以外,还使用两种环引物(环引物f和环引物b),由此使扩增反应的效率提高(专利文献2)。
4.病毒根据基因组的核酸种类而分类为双链dna病毒、单链rna病毒等。单链rna病毒分为基因在从5’末端到3’末端的方向上被读取的+链(正链)病毒和基因通过互补链在从3’末端到5’末端的方向上被读取的-链(负链)病毒。在扩增rna病毒的核酸的情况下,在扩增反应开始时,需要使用逆转录酶从模板rna合成cdna的逆转录反应。与逆转录反应组合的lamp法被称为逆转录环介导等温扩增(rt-lamp)法(例如专利文献3)。
5.现有技术文献
6.专利文献
7.专利文献1:国际公开第00/28082号
8.专利文献2:国际公开第02/24902号
9.专利文献3:国际公开第2018/042598号
技术实现要素:
10.发明所要解决的问题
11.根据专利文献1~3中记载的lamp法,虽然能够以比较高的灵敏度检测病毒,但由于在病毒性疾病中存在很多带来严重症状的疾病,因此需要更可靠地检测成为这些疾病的原因的病毒的方法。因此,本发明的目的在于以高灵敏度检测单链rna病毒。
12.用于解决问题的方法
13.本发明人进行了深入研究,结果发现,除了以往的6种引物以外,还使用特定的额外的外引物进行rt-lamp反应,由此能够以更高的灵敏度检测单链rna病毒,从而完成了本发明。根据本发明人的新见解,即使追加对与单链rna病毒的靶rna互补的核酸的3’末端侧的区域进行退火的外引物,检测的灵敏度也不提高,与此相对,追加对单链rna病毒的靶rna的3’末端侧的区域进行退火的外引物时,检测的灵敏度提高。
14.本发明涉及以下[1]~[8]。
[0015]
1.[0016]
一种检测试样中的单链rna病毒的方法,其包括使引物组与试样接触而进行逆转录环介导等温扩增反应的步骤,
[0017]
引物组基于单链rna病毒的靶rna的碱基序列和与该靶rna互补的核酸的碱基序列来设计,
[0018]
在单链rna病毒为正链单链rna病毒的情况下,靶rna在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,与靶rna互补的核酸在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,
[0019]
在单链rna病毒为负链单链rna病毒的情况下,靶rna在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,与靶rna互补的核酸在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,
[0020]
引物组包含以下(i)~(v):
[0021]
(i)在5’末端具有与区域f1c相同的碱基序列且在3’末端具有与区域f2相同的碱基序列的fip引物;
[0022]
(ii)在5’末端具有与区域b1c相同的碱基序列且在3’末端具有与区域b2相同的碱基序列的bip引物;
[0023]
(iii)具有与区域f3相同的碱基序列的、作为外引物的f3引物;
[0024]
(iv)具有与区域b3相同的碱基序列的、作为外引物的b3引物;和
[0025]
(v)一种以上额外的外引物,各额外的外引物具有与在与靶rna互补的核酸中比区域b3或区域f3更靠近5’末端侧处存在的任选的区域相同的碱基序列,
[0026]
其中,fip引物、bip引物、f3引物、b3引物和一种以上额外的外引物的碱基序列中可能存在的尿嘧啶可以被置换为胸腺嘧啶。
[0027]
[2]
[0028]
一种检测试样中的正链检测单链rna病毒的方法,其包括使引物组与试样接触而进行逆转录环介导等温扩增反应的步骤,
[0029]
引物组基于靶rna的碱基序列和与靶rna互补的核酸的碱基序列来设计,
[0030]
所述靶rna的碱基序列在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,
[0031]
所述与靶rna互补的核酸的碱基序列在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,
[0032]
引物组包含以下(i)~(v):
[0033]
(i)在5’末端具有与区域f1c相同的碱基序列且在3’末端具有与区域f2相同的碱基序列的fip引物;
[0034]
(ii)在5’末端具有与区域b1c相同的碱基序列且在3’末端具有与区域b2相同的碱基序列的bip引物;
[0035]
(iii)具有与区域f3相同的碱基序列的、作为外引物的f3引物;
[0036]
(iv)具有与区域b3相同的碱基序列的、作为外引物的b3引物;和
[0037]
(v)一种以上额外的外引物,各额外的外引物具有与在与靶rna互补的核酸中比区域b3更靠近5’末端侧处存在的任选的区域相同的碱基序列,
[0038]
其中,fip引物、bip引物、f3引物、b3引物和一种以上额外的外引物的碱基序列中可能存在的尿嘧啶可以被置换为胸腺嘧啶。
[0039]
[3]
[0040]
一种检测试样中的负链单链rna病毒的方法,其包括使引物组与试样接触而进行逆转录环介导等温扩增反应的步骤,
[0041]
引物组基于靶rna的碱基序列和与靶rna互补的核酸的碱基序列来设计,
[0042]
所述靶rna的碱基序列在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,
[0043]
所述与靶rna互补的核酸的碱基序列在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,
[0044]
引物组包含以下(i)~(v):
[0045]
(i)在5’末端具有与区域f1c相同的碱基序列且在3’末端具有与区域f2相同的碱基序列的fip引物;
[0046]
(ii)在5’末端具有与区域b1c相同的碱基序列且在3’末端具有与区域b2相同的碱基序列的bip引物;
[0047]
(iii)具有与区域f3相同的碱基序列的、作为外引物的f3引物;
[0048]
(iv)具有与区域b3相同的碱基序列的、作为外引物的b3引物;和
[0049]
(v)一种以上额外的外引物,各额外的外引物具有与在与靶rna互补的核酸中比区域f3更靠近5’末端侧处存在的任选的区域相同的碱基序列,
[0050]
其中,fip引物、bip引物、f3引物、b3引物和一种以上额外的外引物的碱基序列中可能存在的尿嘧啶可以被置换为胸腺嘧啶。
[0051]
[4]
[0052]
如[1]~[3]中任一项所述的方法,其中,引物组还包含:
[0053]
(vi)具有与区域f1c与区域f2c之间的任选的区域相同的碱基序列的环引物f;和
[0054]
(vii)具有与区域b1c与区域b2c之间的任选的区域相同的碱基序列的环引物b,
[0055]
其中,环引物f和环引物b的碱基序列中可能存在的尿嘧啶可以被置换为胸腺嘧啶。
[0056]
[5]
[0057]
如[1]~[4]中任一项所述的方法,其中,(v)的一种以上额外的外引物的熔解温度为30~55℃。
[0058]
[6]
[0059]
如[1]~[5]中任一项所述的方法,其中,引物组包含一种(v)的额外的外引物。
[0060]
[7]
[0061]
如[1]~[6]中任一项所述的方法,其中,还包括对逆转录环介导等温扩增反应的扩增产物进行检测的步骤。
[0062]
[8]
[0063]
一种用于检测单链rna病毒的试剂盒,其包含引物组,
[0064]
引物组基于单链rna病毒的靶rna的碱基序列和与该靶rna互补的核酸的碱基序列来设计,
[0065]
在单链rna病毒为正链单链rna病毒的情况下,靶rna在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,与靶rna互补的核酸在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,
[0066]
在单链rna病毒为负链单链rna病毒的情况下,靶rna在从3’末端到5’末端的方向上依次具有任选的区域f3c、f2c、f1c、b1、b2和b3,与靶rna互补的核酸在从5’末端到3’末端的方向上依次具有任选的区域f3、f2、f1、b1c、b2c和b3c,
[0067]
引物组包含以下(i)~(v):
[0068]
(i)在5’末端具有与区域f1c相同的碱基序列且在3’末端具有与区域f2相同的碱基序列的fip引物;
[0069]
(ii)在5’末端具有与区域b1c相同的碱基序列且在3’末端具有与区域b2相同的碱基序列的bip引物;
[0070]
(iii)具有与区域f3相同的碱基序列的、作为外引物的f3引物;
[0071]
(iv)具有与区域b3相同的碱基序列的、作为外引物的b3引物;和
[0072]
(v)一种以上额外的外引物,各额外的外引物具有与在与靶rna互补的核酸中比区域b3或区域f3更靠近5’末端侧处存在的任选的区域相同的碱基序列,
[0073]
其中,fip引物、bip引物、f3引物、b3引物和一种以上额外的外引物的碱基序列中可能存在的尿嘧啶可以被置换为胸腺嘧啶。
[0074]
发明效果
[0075]
根据本发明,能够以高灵敏度检测单链rna病毒。
附图说明
[0076]
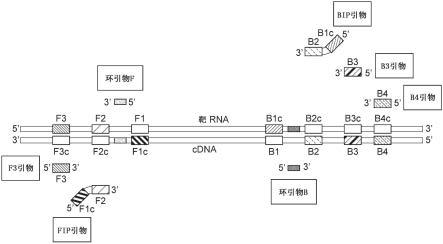
图1示出(+)ssrna病毒的靶rna中的区域f3、f2、f1、b1c、b2c、b3c和b4c、与靶rna互补的cdna中的区域f3c、f2c、f1c、b1、b2、b3和b4、以及基于这些碱基序列设计的引物组(fip引物、bip引物、f3引物、b3引物、b4引物、环引物f和环引物b)。
[0077]
图2示出(-)ssrna病毒的靶rna中的区域f4c、f3c、f2c、f1c、b1、b2和b3、与靶rna互补的cdna中的区域f4、f3、f2、f1、b1c、b2c和b3c、以及基于这些碱基序列设计的引物组(fip引物、bip引物、f3引物、b3引物、f4引物、环引物f和环引物b)。
具体实施方式
[0078]
本发明的一个方式的检测试样中的单链rna病毒的方法为利用rt-lamp法检测核酸扩增来检测试样中的单链rna病毒的方法,其特征在于,作为引物组,除了使用以往的引物(即,fip引物、bip引物、f3引物、b3引物以及任选的环引物f和环引物b)以外,还使用对靶rna的3’末端侧的区域进行退火的一种以上额外的外引物。更具体而言,本发明的一个方式的检测试样中的单链rna病毒的方法包括使引物组与试样接触而进行rt-lamp反应的步骤,引物组包含fip引物、bip引物、f3引物、b3引物以及一种以上后述的额外的外引物,任选包含环引物f和环引物b。
[0079]
要检测的单链rna病毒可以为正链单链rna((+)ssrna)病毒,也可以为负链单链rna((-)ssrna)病毒。(+)ssrna病毒没有特别限定,例如可以为登革热病毒3型(denv3)等登革热病毒、风疹病毒、丙型肝炎病毒、诺如病毒、基孔肯亚病毒、寨卡病毒(zikv)、冠状病毒、
人类免疫缺陷病毒(hiv)或甲型肝炎病毒。(-)ssrna病毒没有特别限定,例如可以为流感病毒、仙台病毒、麻疹病毒、人偏肺病毒或狂犬病病毒(rabv)。
[0080]
试样可以为从疑似感染单链rna病毒的对象采集的试样,例如可以为咳痰、体液、粪便或组织。体液可以为例如鼻涕、唾液、血液、血清、血浆、髓液、尿、精液或羊水。另外,试样可以为支气管肺泡清洗液、鼻腔抽吸液、鼻腔清洗液、鼻拭子、咽拭子或漱口液。或者,试样可以为在感染实验等实验中使用的细胞或其培养液。试样可以为对上述试样进行了分离、提取、浓缩、纯化等预处理的试样。
[0081]
靶rna可以为单链rna病毒所具有的单链rna的整体或一部分。靶rna的长度没有特别限定,例如可以为200~30000个碱基、200~1000个碱基或200~550个碱基。
[0082]
在本说明书中,术语“fip引物”、“bip引物”、“f3引物”、“b3引物”、“环引物f”和“环引物b”与以往的lamp法中的这些术语含义相同,是本领域技术人员所理解的术语。换言之,后述的额外的外引物以外的引物可以基于本领域技术人员公知的文献等的公开而适当设计。
[0083]
以下,参照图1和图2对本方式的方法中的引物组进行说明。引物组基于单链rna病毒的靶rna的碱基序列和与该靶rna互补的核酸的碱基序列来设计。在靶rna和与该靶rna互补的核酸中,在具有能够直接成为蛋白质合成的模板的碱基序列的链中,成为引物设计基础的任选的区域从5’末端侧到3’末端侧依次被称为区域f4、f3、f2、f1、b1c、b2c、b3c和b4c。另一方面,在具有不能直接成为蛋白质合成的模板的碱基序列的链中,成为引物设计基础的任选的区域从3’末端侧到5’末端侧依次被称为区域f4c、f3c、f2c、f1c、b1、b2、b3和b4。区域f4、f3、f2、f1、b1c、b2c、b3c和b4c的碱基序列分别与区域f4c、f3c、f2c、f1c、b1、b2、b3和b4互补。因此,在要检测的单链rna病毒为(+)ssrna病毒的情况下,如图1所示,区域f3、f2、f1、b1c、b2c、b3c和b4c为在靶rna的从5’末端到3’末端的方向上依次存在的任选的区域,区域f3c、f2c、f1c、b1、b2、b3和b4为在与靶rna互补的核酸的从3’末端到5’末端的方向上依次存在的任选的区域。另一方面,在要检测的单链rna病毒为(-)ssrna病毒的情况下,如图2所示,区域f4、f3、f2、f1、b1c、b2c和b3c为在与靶rna互补的核酸的从5’末端到3’末端的方向上依次存在的任选的区域,区域f4c、f3c、f2c、f1c、b1、b2和b3为在靶rna的从3’末端到5’末端的方向上依次存在的任选的区域。需要说明的是,在图1和图2中记载了cdna作为与靶rna互补的核酸,但与靶rna互补的核酸不限于dna,也可以为rna。
[0084]
在本说明书中,术语“互补”不一定表示完全互补。例如,“与某碱基序列互补的碱基序列”的范围包含在严格的条件下与具有某碱基序列的核酸杂交的核酸的碱基序列。严格的条件没有特别限定,例如可以为50%甲酰胺、5
×
ssc(150mlnacl,15mm柠檬酸三钠)、50mm磷酸钠(ph7.6)、5
×
邓哈特溶液和10%葡聚糖硫酸酯。
[0085]
在本说明书中,术语“相同”不一定表示完全相同。例如,“与某碱基序列相同的碱基序列”的范围包含同与某碱基序列互补的碱基序列互补的碱基序列。
[0086]
如本领域技术人员所理解的那样,作为内引物的fip引物在5’末端具有与区域f1c相同的碱基序列,在3’末端具有与区域f2相同的碱基序列。但是,在区域f1c或区域f2中存在尿嘧啶的情况下,fip引物中的对应的尿嘧啶可以被置换为胸腺嘧啶。在与区域f1c相同的碱基序列和与区域f2相同的碱基序列之间,可以存在成为接头的1个以上核苷酸,也可以不存在。成为接头的核苷酸可以为1~500个碱基、1~100个碱基或10~70个碱基。
[0087]
如本领域技术人员所理解的那样,作为内引物的bip引物在5’末端具有与区域b1c相同的碱基序列,在3’末端具有与区域b2相同的碱基序列。其中,在区域b1c或区域b2中存在尿嘧啶的情况下,bip引物中的对应的尿嘧啶可以被置换为胸腺嘧啶。
[0088]
如本领域技术人员所理解的那样,作为外引物的f3引物具有与区域f3相同的碱基序列。其中,在区域f3中存在尿嘧啶的情况下,f3引物中的对应的尿嘧啶可以被置换为胸腺嘧啶。
[0089]
如本领域技术人员所理解的那样,作为外引物的b3引物具有与区域b3相同的碱基序列。其中,在区域b3中存在尿嘧啶的情况下,b3引物中的对应的尿嘧啶可以被置换为胸腺嘧啶。
[0090]
如本领域技术人员所理解的那样,环引物f具有与区域f1c与区域f2c之间的任选的区域相同的碱基序列。其中,在区域f1c与区域f2c之间的任选的区域中存在尿嘧啶的情况下,环引物f中的对应的尿嘧啶可以被置换为胸腺嘧啶。
[0091]
如本领域技术人员所理解的那样,环引物b具有与区域b1c与区域b2c之间的任选的区域相同的碱基序列。其中,在区域b1c与区域b2c之间的任选的区域中存在尿嘧啶的情况下,环引物b中的对应的尿嘧啶可以被置换为胸腺嘧啶。
[0092]
如上所述,本领域技术人员可以适当设计适合于靶rna的扩增的fip、bip、f3、b3引物、环引物f和环引物b。换言之,本领域技术人员可以适宜选择在靶rna中适合作为区域f3、f2、f1、b1c、b2c和b3c的区域。各区域的长度(碱基数)例如可以为5个碱基以上、10个碱基以上、5~200个碱基、10~25个碱基、10~20个碱基或17~25个碱基。各区域的熔解温度(tm)例如可以为55~65℃、60~65℃或55~60℃。本说明书中的tm值为通过最近邻(nearest-neighbor)法(反应液中的钠离子浓度:50mm、镁离子浓度:4mm、寡核酸浓度:0.1μm)计算出的值。各区域的cg含量例如可以为40~60%、40~50%或50~60%。区域f1c和b1c的从5’末端起6个碱基的自由能变化(dg)可以为-4kcal/mol以下。另外,区域f2、b2、f3和b3以及成为环引物f或b的设计基础的区域的从3’末端起6个碱基的dg也可以为-4kcal/mol以下。优选各引物具有不形成极端二级结构的碱基序列。另外,从防止引物二聚体生成的观点考虑,优选各引物的3’末端不具有与自身的3’末端或其它引物的3’末端互补的碱基序列。
[0093]
从区域f2的5’末端到区域b2c的3’末端的距离例如可以为120~180个碱基。区域f2与区域f3之间以及区域b2c与区域b3c之间的距离例如可以为0~20个碱基。从区域f2的5’末端到区域f1的5’末端的距离以及从区域b2的5’末端到区域b1的5’末端的距离例如可以为40~60个碱基。从区域f1到区域b1c之间的距离没有特别限定,区域f1的3’末端和区域b1c的5’末端可以直接结合。
[0094]
在要检测的单链rna病毒为(+)ssrna病毒的情况下,上述额外的外引物具有与在与靶rna互补的核酸中比区域b3更靠近5’末端侧处存在的任选的区域相同的碱基序列。其中,在该区域中存在尿嘧啶的情况下,上述额外的外引物中的对应的尿嘧啶可以被置换为胸腺嘧啶。在图1中,b4引物为上述额外的外引物,b4引物具有与在与靶rna互补的cdna中比区域b3更靠近5’末端侧处存在的任选的区域b4相同的碱基序列。
[0095]
在要检测的单链rna病毒为(-)ssrna病毒的情况下,上述额外的外引物具有与在与靶rna互补的核酸中比区域f3更靠近5’末端侧处存在的任选的区域相同的碱基序列。其中,在该区域中存在尿嘧啶的情况下,上述额外的外引物中的对应的尿嘧啶可以被置换为
胸腺嘧啶。在图2中,f4引物为上述额外的外引物,f4引物具有与在与靶rna互补的cdna中比区域f3更靠近5’末端侧处存在的任选的区域f4相同的碱基序列。
[0096]
上述额外的外引物的tm值例如可以为30~55℃、33~50℃或35~45℃。额外的外引物的长度没有特别限定,例如可以为10~18个碱基、11~16个碱基或12~14个碱基。额外的外引物的cg含量例如可以为30~70%、34~65%或38~54%。额外的外引物的从3’末端起6个碱基的dg可以为-4kcal/mol以下。优选额外的外引物具有不形成极端二级结构的碱基序列。另外,从防止引物二聚体生成的观点考虑,优选额外的外引物的3’末端不具有与自身的3’末端或其它引物的3’末端互补的碱基序列。
[0097]
成为上述额外的外引物的设计基础的上述任选的区域(即,在图1中为区域b4,在图2中为区域f4)的位置只要其区域的一部分或全部存在于在与靶rna互补的核酸中比区域b3(在(+)ssrna病毒的情况下)或区域f3(在(-)ssrna病毒的情况下)更靠近5’末端侧处,就没有特别限定,距区域b3或区域f3的距离没有特别限定。从区域b3或区域f3的5’末端到成为额外的外引物的设计基础的上述任选的区域的3’末端的距离例如可以为-4~50个碱基、-3~35个碱基或-2~21个碱基。在此,在成为外引物的设计基础的上述任选的区域与区域b3或区域f3部分重叠的情况下,从区域b3或区域f3的5’末端到成为额外的外引物的设计基础的上述任选的区域的3’末端的距离用负值表示。
[0098]
上述额外的外引物在图1中仅为b4引物,在图2中仅为f4引物,但额外的外引物的数量没有限定,在引物组中可以含有多种额外的外引物。从实现更高的检测灵敏度的观点考虑,优选引物组中所含的额外的外引物为一种。
[0099]
可以使逆转录酶、dna聚合酶、脱氧核苷三磷酸(dntp:datp、dttp、dctp和dgtp)等用于进行rt-lamp反应的公知的试剂与上述引物组一起与试样接触。
[0100]
dna聚合酶只要是具有链置换活性的模板依赖性核酸合成酶就没有特别限定,例如可以为bst dna聚合酶(大片段)、bca(exo-)dna聚合酶、csa dna聚合酶、大肠杆菌dna聚合酶i的克列诺片段或它们的组合。
[0101]
逆转录酶只要是具有以rna为模板合成cdna的活性的酶,就没有特别限定,例如可以为来自天然的或重组禽类成髓细胞瘤病毒(amv)、小鼠白血病病毒(mmlv)或人类免疫缺陷病毒(hiv)的天然的或重组逆转录酶。作为来自mmlv的逆转录酶,例如可以列举superscript(注册商标)ii逆转录酶、superscript iii逆转录酶和superscript iv逆转录酶(均为赛默飞世尔科技公司制造)以及revertra ace(注册商标)(东洋纺株式会社制造)。作为来自amv的逆转录酶,例如可以列举thermosript(注册商标)逆转录酶(赛默飞世尔科技公司制造)。作为逆转录酶的其它具体例,可以列举omniscript(注册商标)逆转录酶和sensiscript(注册商标)逆转录酶(均为qiagen公司制造)。在使用bca(exo-)dna聚合酶等具有逆转录酶活性和dna聚合酶活性这两者的酶作为dna聚合酶的情况下,可以不使用另外的逆转录酶。
[0102]
作为用于进行rt-lamp反应的其它公知的试剂,例如可以列举对酶反应赋予适当条件的缓冲液或盐以及二硫苏糖醇(dtt)等使酶或模板稳定化的保护剂。
[0103]
也可以使用于检测rt-lamp反应的扩增产物的标记探针或荧光性嵌入剂与上述引物组一起与试样接触。标记探针例如可以为荧光标记探针,荧光标记探针例如可以为后述的荧光猝灭探针。
[0104]
使引物组与试样接触而进行rt-lamp反应的步骤例如可以通过将包含试样和引物组的反应液进行温育来进行。
[0105]
反应液可以包含用于进行rt-lamp反应的上述公知的试剂和上述标记探针或荧光性嵌入剂。温育的时间(即,rt-lamp反应的反应时间)取决于靶rna和引物组,但通常为60分钟以下。温育的温度(即,rt-lamp反应的反应温度)通常为65℃以下。
[0106]
反应溶液中的各内引物的浓度例如可以为0.8~2.4μm。反应溶液中的各外引物的浓度例如可以为0.1~0.3μm。反应溶液中的各环引物的浓度例如可以为0.4~1.2μm。fip引物的浓度例如可以为f3引物的浓度的8倍以上和/或环引物f的浓度的1~4倍。bip引物的浓度例如可以为b3引物的浓度的8倍以上和/或环引物b的浓度的1~4倍。
[0107]
在一个实施方式中,检测试样中的单链rna病毒的方法可以还包括检测rt-lamp反应的扩增产物的步骤。在检测到rt-lamp反应的扩增产物的情况下,可以判定为试样中存在单链rna病毒。扩增产物的检测可以在rt-lamp反应结束后进行,也可以在反应中实时地进行。
[0108]
检测扩增产物的方法没有特别限定,可以利用公知的技术。扩增产物例如可以通过使用标记探针、通过使用荧光性嵌入剂或者通过对反应液进行电泳来检测。或者,在反应液中含有镁离子的情况下,可以通过测定反应液的浊度来检测扩增产物。镁离子与作为核酸合成的副产物的焦磷酸根离子反应而生成白色的焦磷酸镁。
[0109]
作为标记探针,可以使用例如荧光猝灭探针(quenching probe:qprobe(注册商标))等荧光标记探针。由于从荧光淬灭探针发出的荧光在与靶核酸杂交时淬灭,因此可以通过测定荧光的减少来定量或检测扩增产物。作为能够用于荧光猝灭探针的荧光标记,例如可以列举bodipy(注册商标)、bodipy-fl、羧基罗丹明6g(cr6g)、羧基四甲基罗丹明(tamra)、
パシフィックブルー
(注册商标)和荧光素-4-异硫氰酸酯(fitc)。
[0110]
作为荧光性嵌入剂,例如可以使用syto(注册商标)63红色荧光核酸染色剂(赛默飞世尔科技公司制造)等公知的荧光性嵌入剂。
[0111]
本发明的另一个方式为包含上述引物组的用于检测单链rna病毒的试剂盒。该试剂盒可以还包含逆转录酶、dna聚合酶、dntp、缓冲液、盐、保护剂等用于进行rt-lamp反应的上述公知的试剂。另外,该试剂盒可以还包含上述标记探针或荧光性嵌入剂。
[0112]
[实施例]
[0113]
[试验例1](+)ssrna病毒(denv3)的检测
[0114]
<参考例1>
[0115]
在0.2ml的试剂管中制备具有以下组成的反应液25μl:
[0116]
20mm三(羟甲基)甲基甘氨酸(ph8.6)、
[0117]
30mm kcl、
[0118]
8mm mgso4、
[0119]
1.4mm dntps、
[0120]
0.5%吐温20、
[0121]
1.6mm dtt、
[0122]
1.6μm fip引物和bip引物、
[0123]
0.2μm f3引物和b3引物、
[0124]
0.8μm环引物f和环引物b、
[0125]
amv逆转录酶1.0u(20u/μl,roche公司制造)、
[0126]
bst dna聚合酶22.8u(new england biolabs公司制造)、
[0127]
rnase抑制剂(40u/μl,promega公司制造)1μl、
[0128]
模板rna(100拷贝)5μl、
[0129]
ppase 20mu(new england biolabs公司制造)、和
[0130]
0.04μm qprobe(注册商标)。
[0131]
作为fip引物、bip引物、f3引物、b3引物、环引物f、环引物b和qprobe,分别使用表1中所示的denv3_fipv4、denv3_bipv6、denv3_f3、denv3_b3a、denv3_lf、denv3_lbv1和denv3_qp。模板rna(序列号1)通过将利用rt-pcr由denv3衣壳基因制作的cdna整合到质粒中并从该质粒dna转录和纯化rna而制作。在转录中使用script max(注册商标)thermo t7转录试剂盒(东洋纺株式会社制造,编码号:tsk-101),在rna纯化中使用rneasy(注册商标)小提试剂盒(qiagen公司制造,产品目录编号:no.74104)。qprobe的5’末端用bodipy进行了标记,3’末端进行了磷酸化。
[0132]
[表1]
[0133][0134]
使用实时定量pcr系统light cycler(注册商标)96(roche公司制造),在63℃下进行60分钟rt-lamp反应(n=6)。另外,将b3引物的浓度提高2~4倍,进行同样的rt-lamp反应(n=6)。rt-lamp反应的扩增产物通过实时检测qprobe的淬灭来检测。将结果示于表2。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表2中。
[0135]
[表2]
[0136][0137]
在本说明书的表中,sd表示标准偏差,cv表示变异系数,nc表示阴性对照,n.d.表示未检测到。在本试验例中,将在30分钟以内未检测到qprobe的淬灭的情况判定为未检测到。如表2所示,通过增加b3引物的浓度,模板rna的检测灵敏度没有提高。
[0138]
《实施例1》
[0139]
除了向反应溶液中追加终浓度为0.2μm的b4引物以外,与参考例1同样地进行rt-lamp反应(n=2)。作为b4引物,使用表3所示的引物。为了进行比较,即使没有b4引物也进行同样的反应。将结果示于表4。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表4中。
[0140]
[表3]
[0141]
b4引物序列号序列(从5’到3’)tm(℃)denv3_b3-m129atctagccaagac39.13denv3_b3-m1310ctagccaagactc40.44denv3_b3-m1411agccaagactcct44.96denv3_b3-m1612gacttcttgaagg37.89denv3_b3-m1813tcttgaaggttcc39.79denv3_b3-m1914ttgaaggttcccc43.56denv3_b3-m2015ttcttgaaggttc36.95denv3_b3-m2116cttgaaggttccc41.53denv3_b3-m2317aaggttccccatc43.16denv3_b3-m2518ttgaaggttcccc43.56denv3_b3-m2619gaaggttccccat43.16denv3_b3-m2720aggttccccatct44.34
[0142]
[表4]
[0143][0144]
如表4所示,通过追加b4引物,提高了模板rna的检测灵敏度。
[0145]
<实施例2>
[0146]
增加测定次数(n=6),进行与实施例1同样的rt-lamp反应。作为b4引物,使用b3-m27。为了进行比较,即使没有b4引物也进行同样的反应。将结果示于表5中。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表5中。
[0147]
[表5]
[0148][0149]
如表5所示,即使增加测定次数,也确认到通过追加b4引物而带来的检测灵敏度的提高。
[0150]
<比较例1>
[0151]
使用表6所示的f4引物代替b4引物,进行与实施例1同样的rt-lamp反应。为了进行比较,即使没有f4引物也进行同样的反应。将结果示于表7。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表7中。
[0152]
[表6]
[0153]
f4引物序列号序列(从5’到3’)tm(℃)denv3_f4-121gactcggaagctt44.07denv3_f4-222actcggaagcttg44.53denv3_f4-323gactcggaagcttg47.26denv3_f4-424gactcggaagct41.69denv3_f4-525actcggaagctt40.70denv3_f4-626ctcggaagcttg40.54
[0154]
[表7]
[0155][0156]
如表7所示,通过追加f4引物,模板rna的检测灵敏度没有提高。
[0157]
[试验例2](-)ssrna病毒(h5n1)的检测
[0158]
《参考例2》
[0159]
在0.2ml的试剂管中制备具有如下组成的反应液25μl:
[0160]
20mm三(羟甲基)甲基甘氨酸(ph8.6)、
[0161]
30mm kcl、
[0162]
8mm mgso4、
[0163]
1.4mm dntps、
[0164]
0.5%吐温20、
[0165]
1.6mm dtt、
[0166]
1.6μm fip引物和bip引物、
[0167]
0.2μm f3引物和b3引物、
[0168]
0.8μm环引物f和环引物b、
[0169]
amv逆转录酶1.0u(20u/μl,roche公司制造)、
[0170]
bst dna聚合酶22.8u(new england biolabs公司制造)、
[0171]
rnase抑制剂(40u/μl,promega公司制造)1μl、
[0172]
模板rna(200拷贝)5μl、
[0173]
ppase 20mu(new england biolabs公司制造)、和
[0174]
0.1μm syto 63红色荧光核酸染色剂(赛默飞世尔科技公司制造)。
[0175]
作为fip引物、bip引物、f3引物、b3引物、环引物f和环引物b,分别使用表8所示的h5n1-fip、h5n1-bip、h5n1-f3v7、h5n1-b3、h5n1-lf和h5n1-lb。模板rna(序列号27)通过将利用rt-pcr由h5型禽流感病毒(a/viet nam/1203/2004(h5n1),accession no.ay818135)的血凝素(ha)基因的一部分制作的cdna整合到质粒中并从该质粒dna转录和纯化rna来制作。在转录中使用script max thermo t7转录试剂盒(东洋纺株式会社制造,编码号:tsk-101),在rna纯化中使用rneasy小提试剂盒(qiagen公司制造,产品目录编号:no.74104)。
[0176]
[表8]
[0177]
引物序列号序列(从5’到3’)tm(℃)h5n1-f3v728caattttaaagccgaatga50.82h5n1-b329gtcgcaaggactaatct51.85h5n1-fip30accatattccaactcacttttcataatt-tcattgcaccagaatatgc71.32h5n1-bip31caaactccaatgggggc-atggtgagagggtgtat74.29h5n1-lf32gagtcccctttcttgacaat56.69h5n1-lb33gataaactctagtatgcca49.94
[0178]
使用实时定量pcr系统light cycler(注册商标)96(roche公司制造),在63℃下进行60分钟rt-lamp反应(n=6)。另外,将f3引物的浓度提高2~4倍,进行同样的rt-lamp反应(n=6)。rt-lamp反应的扩增产物通过实时检测嵌入剂(syto 63红色荧光核酸染色剂)的荧光来检测。将结果示于表9。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表9中。
[0179]
[表9]
[0180][0181]
在本试验例中,将在30分钟以内未检测到嵌入剂的荧光的情况判定为未检测到。如表9所示,通过增加f3引物的浓度,模板rna的检测灵敏度没有提高。
[0182]
《实施例3》
[0183]
除了在反应溶液中追加终浓度为0.2μm的f4引物以外,与参考例2同样地进行rt-lamp反应(n=6)。作为f4引物,使用表10所示的引物。为了进行比较,即使没有f4引物也进行同样的反应。将结果示于表11。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表11中。
[0184]
[表10]
[0185]
f4引物序列号序列(从5’到3’)tm(℃)h5n1-f4v234aaagtggaagga35.84h5n1-f4v635gggcaaagtgga42.81h5n1-f4v736cgggcaaagtgg45.50h5n1-f4v1737gattggtaccaag37.91
[0186]
[表11]
[0187][0188]
如表11所示,通过追加f4引物,提高了模板rna的检测灵敏度。
[0189]
《比较例2》
[0190]
使用表12所示的b4引物代替f4引物,进行与实施例3同样的rt-lamp反应。为了进行比较,即使没有b4引物也进行同样的反应。将结果示于表13。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表13中。
[0191]
[表12]
[0192]
b4引物序列号序列(从5’到3’)tm(℃)h5n1-b4v138tttctgagccca40.36h5n1-b4v639ggctatttctga33.65h5n1-b4v840agggctatttct34.94
[0193]
[表13]
[0194][0195]
如表13所示,通过追加b4引物,模板rna的检测灵敏度没有提高。
[0196]
[试验例3](+)ssrna病毒(zikv)的检测
[0197]
<参考例3>
[0198]
除了将模板rna和引物组如下所述地改变以外,进行与试验例1的参考例1同样的rt-lamp反应。作为fip引物、bip引物、f3引物、b3引物、环引物f、环引物b和qprobe,分别使用表14所示的zikv fip、zikv bip、zikv f3、zikv b3、zikv lf、zikv lb和zikv qp。模板rna(序列号41)通过将利用rt-pcr由zikv的ns5基因制作的cdna整合到质粒中并从该质粒dna转录和纯化rna来制作。在转录中使用script max thermo t7转录试剂盒,在rna纯化中使用rneasy小提试剂盒。qprobe的3’末端用bodipy进行了标记。将结果示于表15。
[0199]
[表14]
[0200][0201]
[表15]
[0202][0203]
如表15所示,通过增加b3引物的浓度,模板rna的检测灵敏度没有提高。
[0204]
<实施例4>
[0205]
除了在反应溶液中追加终浓度为0.2μm的b4引物以外,与参考例3同样地进行rt-lamp反应(n=6)。作为b4引物,使用表16所示的引物。为了进行比较,即使没有b4引物也进行同样的反应。将结果示于表17。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表17中。
[0206]
[表16]
[0207]
b4引物序列号序列(从5’到3’)tm(℃)zikv_b4-349tagggaatgtctgt42.47zikv_b4-1350gaatgtctgtcc35.68zikv_b4-1451tgtctgtccattt39.05
[0208]
[表17]
[0209][0210]
如表17所示,通过追加b4引物,提高了模板rna的检测灵敏度。
[0211]
《比较例3》
[0212]
使用表18所示的f4引物代替b4引物,进行与实施例4同样的rt-lamp反应。为了进行比较,即使没有f4引物也进行同样的反应。将结果示于表19。另外,作为参考,将使模板rna的量提高到10000拷贝的情况下的检测结果一并示于表19中。
[0213]
[表18]
[0214]
f4引物序列号序列(从5’到3’)tm(℃)zikv_f4-252ctcctttatttcc33.98zikv_f4-353aaatcatatgcgcaaat48.21
[0215]
[表19]
[0216][0217]
如表19所示,通过追加f4引物,模板rna的检测灵敏度没有提高。
[0218]
[试验例4](-)ssrna病毒(rabv)的检测
[0219]
<参考例4>
[0220]
在0.2ml的试剂管中制备具有如下组成的反应液25μl:
[0221]
20mm三(羟甲基)甲基甘氨酸(ph8.6)、
[0222]
30mm kcl、
[0223]
8mm mgso4、
[0224]
1.4mm dntps、
[0225]
0.5%吐温20、
[0226]
1.6mm dtt、
[0227]
1.6μm fip引物和bip引物、
[0228]
0.2μm f3引物和b3引物、
[0229]
0.8μm环引物b、
[0230]
amv逆转录酶1.0u(20u/μl,roche公司制造)、
[0231]
bst dna聚合酶22.8u(new england biolabs公司制造)、
[0232]
rnase抑制剂(40u/μl,promega公司制造)1μl、
[0233]
模板rna(10000拷贝)5μl、
[0234]
ppase 20mu(new england biolabs公司制造)、和
[0235]
0.1μm syto 63红色荧光核酸染色剂(赛默飞世尔科技公司制造)。
[0236]
作为fip引物、bip引物、f3引物、b3引物和环引物b,分别使用表20所示的rabv1-fip、rabv1-bip、rabv1-f3、rabv1-b3和rabv1-lb。这些引物公开在bazartseren b.,s.inoue,a.yamada,et al(2009):rapid detection of rabies virus by reverse transcription loop-mediated isothermal amplification.jpn.j.infect.dis.,62,187-191,2009中。模板rna(序列号54)通过将利用rt-pcr由rabv的n基因制作的cdna整合到质粒中并从该质粒dna转录和纯化rna来制作。在转录中使用script max thermo t7转录试剂盒,在rna纯化中使用rneasy小提试剂盒。
[0237]
[表20]
[0238]
引物序列号序列(从5’到3’)tm(℃)rabv1-f355acatgtccggaagact53.62rabv1-b356cagactcaggagaagacc54.77rabv1-fip57actagagagtttggggtga-ggaccagctatggaatcc73.91rabv1-bip58acgggaattgggctctgac-ctaaagatgcatgttcag73.89rabv1-lb59ggcatggaattgacaagggacc63.58
[0239]
使用实时定量pcr系统light cycler 96,在63℃下进行60分钟rt-lamp反应(n=6)。另外,将f3引物的浓度提高2~4倍,进行同样的rt-lamp反应(n=6)。rt-lamp反应的扩增产物通过实时检测嵌入剂(syto 63红色荧光核酸染色剂)的荧光来检测。将结果示于表21。另外,作为参考,将使模板rna的量提高到1
×
106拷贝的情况下的检测结果一并示于表21中。
[0240]
[表21]
[0241][0242]
在本试验例中,将在30分钟以内未检测到嵌入剂的荧光的情况判定为未检测到。
如表21所示,通过增加f3引物的浓度,模板rna的检测灵敏度没有提高。
[0243]
《实施例5》
[0244]
除了在反应溶液中追加终浓度为0.2μm的f4引物以外,与参考例4同样地进行rt-lamp反应(n=6)。作为f4引物,使用表22所示的引物。为了进行比较,即使没有f4引物也进行同样的反应。将结果示于表23。另外,作为参考,将使模板rna的量提高到1
×
106拷贝的情况下的检测结果一并示于表23中。
[0245]
[表22]
[0246]
f4引物序列号序列(从5’到3’)tm(℃)rabv1-f4v1460cagcagcaatgca47.00
[0247]
[表23]
[0248][0249]
如表23所示,通过追加f4引物,提高了模板rna的检测灵敏度。
[0250]
《比较例4》
[0251]
使用表24所示的b4引物代替f4引物,进行与实施例5同样的rt-lamp反应。为了进行比较,即使没有b4引物也进行同样的反应。将结果示于表25。另外,作为参考,将使模板rna的量提高到1
×
106的情况下的检测结果一并示于表25中。
[0252]
[表24]
[0253]
b4引物序列号序列(从5’到3’)tm(℃)rabv1-b4v361tattttgctcaacc40.21rabv1-b4v762tgtcctgatatttt37.00
[0254]
[表25]
[0255][0256]
如表25所示,通过追加b4引物,模板rna的检测灵敏度没有提高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1