基因治疗
1.本发明涉及包含vegfc转基因和肾脏特异性启动子的基因治疗载体,以及基因治疗载体在治疗或预防糖尿病肾病中的用途。
背景技术:
2.系统性内皮功能障碍是糖尿病血管损伤发展的起始步骤,与微量白蛋白尿(尿白蛋白分泌30-300毫克/天)有关。广泛接受的是微量白蛋白尿指示肾小球的破坏,并且是早期糖尿病肾病(dkd)的最早临床可检测指标。dkd在高达45%的糖尿病患者中发展,糖尿病患者占发达国家终末期肾病患者的50%。
3.血管内皮生长因子(vegf)c作为不同形式的肾功能障碍的潜在治疗剂而出现,包括:通过重塑血管和淋巴网络,防止小鼠模型中多囊性肾病的发展;防止由于增强的淋巴管生成而在单侧输尿管梗阻的模型中的肾间质纤维化;以及最近的,通过增加肾脏淋巴密度,防止肾脏纤维化、白蛋白尿和盐引起的高血压的升高的血压。
4.发明人最近表明,vegfc在肾小球中具有有益效果并且可以防止dkd。淋巴血管并不紧密地支撑肾中的肾小球,而vegfc由足细胞表达,并向培养中的人类肾小球内皮细胞(genc)发出信号以增加屏障性质。小鼠中vegfc的足细胞特异性过表达(podvegfc)防止1型糖尿病模型中的白蛋白尿的发展,并阻止genc开窗密度的降低。此外,在2型糖尿病模型中,重组(r)vegfc拯救了肾小球白蛋白渗透性。有趣的是,当在体内使用糖萼特异性酶破坏genc糖萼时,肾小球白蛋白渗透性被rvegfc显著地拯救(onions等人,2018)。这些数据共同表明vegfc通过维持genc表型来防止早期dkd。vegfc,如其他vegfs,具有约9分钟的血浆半衰期,因此vegfc的治疗潜力依赖于其连续的局部表达。
5.vegfc基因治疗已成功地用于人类。已经使用5型腺病毒(adv5)设计了用于人类的vegfc基因治疗的策略(us2014/0087002)。该基因治疗通过结旁注射递送到患者自身的腹壁或腹股沟区域的组织瓣的脂肪垫中(即,靶向递送)。然后将组织瓣通过外科手术植入到受影响的手臂的腋窝区域。已成功地通过i期临床试验,证明其在15名患者的人群中是安全且良好耐受的。然而,当全身递送时,该adv5载体被快速失活,导致感染效率问题。
6.在人类中对于dkd驱动vegfc基因表达仍然是一个令人兴奋的机会,但它需要对于肾脏和在肾脏内适当地靶向。本发明的目的是提供一种新的基因治疗载体,其能够有效地将vegfc递送到肾小球中的特定细胞,从而提供用于治疗或预防dkd的治疗。
技术实现要素:
7.本发明提供了腺相关病毒(aav)载体基因治疗,其包括血管内皮生长因子(vegf)c转基因和最小肾病蛋白启动子nphs1或足细胞启动子nphs2。该基因治疗载体可用于靶向肾脏的肾小球内的足细胞,以治疗或预防肾脏疾病,例如糖尿病肾病。在不受理论束缚的情况下,本发明人相信,足细胞为肾脏疾病中的基因治疗方案提供了高度可追溯的靶,并且通过
将vegfc靶向到足细胞,可以保护和/或拯救肾小球血管的完整性。
8.合适的aav载体血清型包括2/9、lk03和3b。
9.aav2/9血清型已显示出对新生和成年小鼠肾脏的显著趋向性,定位到肾小球和小管(luo等人,2011;picconi等人,2014;schievenbusch等人,2010),与肾静脉注射结合的aav2/9载体已显示出适合于肾靶向基因递送(rocca等人,2014)。因此,aav 2/9是用于本发明基因治疗的一个合适的载体。
10.合成的aav衣壳(例如lk03)也可以是用于本发明的基因治疗的合适的载体。该载体已显示在体外和体内高效率转导人类原代肝细胞。然而,直到现在它未被用于肾脏靶向基因递送。令人惊讶的是,aav-lk03载体在体外人类足细胞中可以实现接近100%的高转导,并且可以用于在体外转导足细胞(参见wo 2020/148548)。
11.aav-lk03帽子序列由来自七种不同野生型血清型(aav1、2、3b、4、6、8、9)的片段组成,尽管aav-3b表示97.7%的帽子基因序列和98.9%的氨基酸序列。也已知aav-3b的人类肝细胞趋向性,其是用于本发明基因治疗的另一合适的载体。迄今为止,其尚未用于肾脏靶向基因递送。
12.vegfc是一种淋巴管生成生长因子,已知通过两个受体(即vegfr-3(flt 4)和vegfr-2(flk 4))发出信号。vegfc是由前肽形式的细胞产生的,其在裂解成四聚体之前成为二聚物,该四聚体由包含vegf同源结构域的两个n-末端31kda形式和两个含有br3基序的富含半胱氨酸的c-末端29kda形式组成。四聚体形式由细胞分泌,然后被裂解成中间形式,该中间形式由一个含有21kda vegf同源结构域的31kda形式、一个含有br3基序的富含半胱氨酸的29kda形式和一个21kda vegf同源结构域组成。然后移除n-末端前肽以产生成熟vegfc,其由通过非共价相互作用结合的两个21kda vegf同源结构域组成。vegfc的蛋白水解处理的进一步细节描述请见例如joukov等人,1997。
13.vegfc转基因包含编码任何形式的vegfc(例如前肽形式、四聚体形式、中间形式或完全加工的成熟vegfc)的多核苷酸。如果需要,编码不同形式的vegfc多肽的多核苷酸可以以任何组合使用。优选地,vegfc转基因包含编码一种或多种具有vegfc生物活性的多肽(即,能结合并激活vegfr-2和/或vegfr-3的多肽)的多核苷酸。更优选地,vegfc转基因包含一种多核苷酸,其编码包含vegfc同源结构域且具有vegfc生物活性的多肽(即,可结合并激活vegfr-2和/或vegrf-3的多肽)。合适的vegfc多核苷酸和多肽的进一步细节包括wo 2015/022447和us 2014/0087002中描述的那些。
14.转基因物种优选地与患者物种匹配。例如,当治疗人类患者时,通常使用人类转基因。转基因可以是天然存在的,例如野生型,或其可以是重组的。转基因通常被包括在基因治疗载体中作为cdna序列。然而,vegfc转基因可以是任何多核苷酸,例如单链或双链dna或rna,包括编码如上所述的任何vegfc多肽的核酸序列。例如,vegfc多核苷酸可以包含图2的vegfc开放阅读框(orf)序列。vegfc多核苷酸可以包含与图2的vegfc orf序列具有至少85%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸序列,只要其编码的vegfc多肽已经保留了其生物活性,特别是保留了结合和激活vegfr-2和vegfr-3的能力。优选地,图2的vegfc序列包含位于多核苷酸序列末端的终止密码子。合适的终止密码子是技术人员熟悉的,并且包括tag、taa和tga。优选地,终止密码子是taa。
15.在上文的描述中,术语“同一性”用于指两个序列的相似性。出于本发明的目的,这
里定义了:为了确定两个序列的百分比同一性,为了最佳的比较目的将序列对准(例如,可以在第一序列的序列中引入间隙,以与第二氨基酸或核酸序列最佳对准)。然后比较每个位置处的核苷酸/氨基酸残基。当第一序列中的位置被与第二序列中的对应位置相同的氨基酸或核苷酸残基占据时,分子在该位置处相同。两个序列之间的百分比同一性是由序列共享的相同位置的数目的函数(即,%同一性=相同位置的数量/位置的总数(即,重叠位置)
×
100)。通常,这两个序列具有相同的长度。序列比较通常在两个待比较序列的整个长度上进行。
16.技术人员将意识到以下事实,即几个不同的计算机程序可用于确定两个序列之间的同一性。例如,可以使用数学算法来实现序列的比较和两个序列之间的百分比同一性的确定。例如,可以使用序列对准软件clone manager 9(sci-ed software-www.scied.com)使用全局dna对准来确定两个核酸序列之间的百分比同一性;参数:双链;打分矩阵:线性(mismatch 2,opengap 4,extgap 1)。
17.或者,两个氨基酸或核酸序列之间的百分比同一性可以使用needleman和wunsch(1970)算法来确定,其已经被合并到accelrys gcg软件包中的gap程序中(可在http://www.accelrys.com/products/gcg/获得),使用blosum 62矩阵或pam 250矩阵,16、14、12、10、8、6或4的间隙重量和1、2、3、4、5或6的长度重量。评估两个氨基酸或核酸序列之间的百分比同一性的另一种方法可以是使用在国家生物技术信息中心(ncbi)网站(www.blast.ncbi.nlm.nih.gov)上可获得的blast序列比较工具,例如使用blastn用于核苷酸序列,使用blastp用于氨基酸序列,使用默认参数。
18.使用最小肾病蛋白启动子(例如nphs1)或足细胞启动子nphs2,允许将基因治疗载体特异性地靶向足细胞(moeller等人,2002;picconi等人,2014)。这使得转基因表达特异性地靶向肾脏肾小球基底膜中的足细胞,并使离靶表达最小化。由于足细胞是末端分化的和非分裂的细胞,所以它们可以被靶向以稳定表达转基因,并减少或避免任何载体稀释效应的风险。在本发明的优选实施方式中,启动子是nphs1。在图1中示出了nphs1启动子的合适的dna序列的一个实施例。与转基因一样,启动子的种类优选地与患者物种匹配。例如,当治疗人类患者时,通常使用人类nhps1或人类nphs2。
19.aav载体可另外包含土拨鼠肝炎转录后调控元件(wpre)。wpre是当转录时产生增强表达的三级结构的dna序列。包含wpre可以增加由载体递送的转基因的表达。wpre序列可以被突变以减少致癌性,而不会显著丧失rna增强活性(schambach等人,2005,在此通过引用引入)。在图3中示出一个合适的wpre序列的例子。
20.vegfc转基因可以包含蛋白质标签,例如血凝素(ha)标签。ha可以用作表位标签,并且已经显示为不干扰其已添加到的蛋白质的生物活性或生物分布。蛋白质标签可以促进转基因的检测、分离和纯化。其他合适的蛋白质标签可以包括myc标签、多组氨酸标签和flag标签。
21.aav载体基因治疗可另外包含位于启动子与vegfc转基因之间的kozak序列。已知kozak序列在转译过程的开始中起主要作用,因此可以增强vegfc转基因的表达。
22.aav载体基因治疗可以另外包括聚腺苷酸化信号,例如牛生长激素(bgh)聚腺苷酸化信号,例如,如图4所示。聚腺苷酸化是向信使rna添加聚腺苷酸尾巴。聚腺苷酸尾巴由多个腺苷单磷酸组成;换句话说,它是仅具有腺嘌呤碱基的rna的模拟。聚腺苷酸尾巴对于
mrna的核输出、转译和稳定性是重要的。因此,包含聚腺苷酸化信号可增强vegfc转基因的表达。
23.aav载体基因治疗可以另外包括在载体的任一端处的反向末端重复(itr)序列。例如,载体结构按次序可以是:itr-启动子-转基因(具有可选的蛋白质标签)-可选的wrpe-聚腺苷酸化信号-itr。
24.因此,本发明的基因治疗载体可用于治疗或预防患者的肾脏疾病,特别是糖尿病肾病(dkd)。dkd可以是早期糖尿病肾病。糖尿病与血管损伤有关,并且全身性内皮功能障碍是这种损伤的起始步骤。全身性内皮功能障碍与微量白蛋白尿(尿白蛋白分泌30-300毫克/天)有关,表明肾小球的破坏。微量白蛋白尿是dkd的最早临床可检测指标。这样,可以通过微量白蛋白尿的存在来鉴定早期dkd,其可以伴有升高的肾小球滤过率(gfr)。患者可以具有糖尿病,包括1型或2型糖尿病。
25.dkd可以是既定的dkd,其可与1型或2型糖尿病有关。在dkd分期中,gfr是一项可用于检查肾脏工作情况的测试。具体地,它估计每分钟肾小球过滤多少。一位具有既定(中等)dkd的患者可以具有约40至约50ml/min的gfr,正常gfr为约ll0ml/min,而低于约30ml/min的速率表明严重的dkd,低于约15ml/min需要透析。蛋白尿水平也可以用于dkd分期,既定的dkd与超过300毫克/天的尿蛋白分泌有关。蛋白尿水平可以单独使用或与gfr组合使用来分期dkd。
26.本文所用的术语“患者”可以包括任何哺乳动物,包括人。患者可以是成人或儿科患者,例如新生儿或婴儿。
27.aav载体基因治疗可以全身给药,例如通过静脉注射。在本发明的实施方式中,aav载体基因治疗可以通过注射到肾动脉中来给药。在本发明的替代实施方式中,aav载体基因治疗可以通过逆行给药的方式给药(例如,通过使用导尿管的输尿管)。
28.基因治疗可以作为单一剂量给药,换句话说,可以不需要载体的后续剂量。在需要重复剂量的情况下,可以在载体中使用不同的aav血清型。例如,在第一剂量中使用的载体可以包括aav-lk03或aav-3b,而在后续剂量中使用的载体可以包括aav 2/9。
29.可选地,基因治疗可以与患者的临时免疫抑制组合施用,例如通过在口服类固醇治疗的同时或之后施用基因治疗。免疫抑制在基因治疗处理之前和/或期间可能是需要的,以抑制患者对载体的免疫反应。然而,因为aav衣壳未被载体编码,所以aav衣壳仅在转导细胞中瞬时存在。因此,衣壳逐渐被降解和清除,这意味着一种短期的免疫调节方案,该方案阻断对衣壳的免疫反应,直到衣壳序列从转导细胞中清除,可以允许转基因的长期表达。因此,在给予基因治疗后,免疫抑制可能需要大约六周。
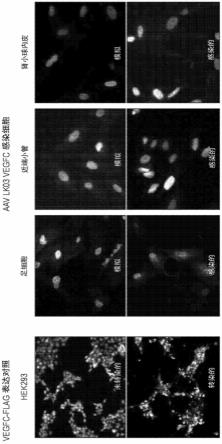
30.基因治疗载体可另外或替代地与现有疗法组合施用。例如,基因治疗载体可以另外地或替代地与肾素-血管紧张素治疗策略组合施用,例如血管紧张素转化酶(ace)抑制剂、醛固酮拮抗剂(例如,螺内酯)或血管紧张素受体阻滞剂(arb)。基因治疗载体可以另外或替代地与一种或多种sglt 2抑制剂组合给药。
31.aav载体基因治疗可以以药物组合物的形式给药。换句话说,aav载体基因治疗可以与一种或多种药学上可接受的载体和/或赋形剂组合。合适的药物组合物优选是无菌的。
附图说明
32.图1示出了用于最小人类肾病蛋白启动子(nphs1)的示例dna序列。
33.图2示出了用于人类vegfc转基因的示例cdna序列。
34.图3示出了用于wpre序列的示例dna序列。
35.图4示出了bgh聚腺苷酸化信号序列的示例dna序列。
36.图5示出了用于生产aav lk03 vegfc的构建体。在该构建体中,hpodocin被vegfc代替。
37.图6显示了人类vegfc-flag在阳性对照(转染的hek293)和在aav lk03 vegfc感染的足细胞中的表达。在近端小管细胞或肾小球内皮细胞中没有观察到表达,表明vegfc表达对足细胞是特异性的。
38.图7显示了从用pcmv3-vegfc表达质粒或模拟物转染的hek细胞和用nphs1.aav-vegfc或对照病毒转染的足细胞获得的vegfc条件培养基的效果。与用条件培养基形式hek细胞刺激的肾小球内皮细胞结合的wga存在强烈的增加趋势(参见图7a),与受足细胞条件培养基刺激的肾小球内皮细胞结合的wga存在显著的增加(参见图7b)。
具体实施方式
39.dkd,一种在肾小球中引发的疾病,缺乏肾小球-特异性治疗策略。目前,治疗的支柱是靶向升高的血压。dkd的早期指标(较高的肾小球过滤速率和微量白蛋白尿)在可以看到足细胞超微结构的改变之前都与肾小球内皮超微结构的变化有关。此时开始进行靶向治疗将是最有利的。
40.该研究的目的是将防止dkd中的微血管并发症的一种成功的策略与安全且成功的基因递送方法结合,使得vegfc基因表达可在疾病早期递送至足细胞。
41.假设:靶向的足细胞腺相关病毒vegfc基因治疗将避免内皮功能障碍并防止dkd。
42.目标1:创建和验证用于足细胞-特异性vegfc转导的aav基因治疗工具。
43.目标2:证明这可以防止实验性dkd的发展。
44.目标3:原理证明:靶向人肾小球组织中的足细胞vegfc基因表达。
45.足细胞靶向基因治疗:我们已经利用腺相关病毒(aav)开发了在人和小鼠足细胞中的靶向基因递送系统(见pct/gb2020/050097)。使用足细胞-特异性启动子(肾病蛋白),aav血清型2/9在体内成功感染足细胞,诱导足蛋白表达。在使用cre-loxp系统(nphs2fl/fl)敲除足蛋白导致蛋白尿的动物中,aav治疗成功恢复了足蛋白表达并改善了蛋白尿。此外,我们已经显示了使用相同启动子在人类足细胞中通过aav lk03(具有比aav2/9更好的效率)对gfp的高效和特异性转导。结合该技术,我们的目的是在小鼠中驱动足细胞vegfc基因转导,然后在人类肾小球组织中展示原理证明。
46.目标1:创建和验证用于足细胞-特异性vegfc转导的aav基因治疗工具
47.该项目将使用aav 2/9用于小鼠工作,使用aavlk03用于人类工作。aav3b也将用于人类工作,并且将用于大型动物研究。我们已经证明使用aav,在细胞培养和小鼠模型中,尽管aav的限制包装尺寸(4.7kb),最小肾病蛋白启动子(1.2kb)成功诱导足细胞中的转导。人和小鼠最小肾病蛋白启动子有效地在小鼠组织中驱动转导,因此将在整个该项目中使用人的肾病蛋白启动子。这证明,我们可以在体内在足细胞中有效地驱动基因转导。
48.当通过渗透微型泵输送时,人类的rvegfc以前已被证明在小鼠肾脏中具有体内效果,并且人类的vegfc在小鼠皮肤中转基因过表达,具有功能效果。因此,人类的vegfc将在用于小鼠和人类工作的同一构建体中使用
49.aav载体被认为是用于人类中基因递送的主要平台。它们是具有单链dna基因组的26nm直径的衣壳。它们是非致病性的,具有低免疫原性,并且在许多临床试验中已经证明是成功的,第一个;glybera,一种编码脂蛋白脂肪酶的aav1,随后是包括全身应用的其他(aav8和aav9)。在全身施用后,靶向转导至足细胞应消除肝趋向性的影响
50.带有n-末端ha标签(1260bp,sinobiological)或n-末端myc标签的人类全长度vegfc(jha等人)将被连接到我们的包含人最小肾病蛋白启动子(nphs2)的aav2/9、aavlk03和aavl3载体中。
51.小鼠足细胞、肾小球内皮细胞和近端小管上皮细胞将被aav2/9vegfc或空载体感染。合适的滴定度将被确定。感染将通过rna提取和用于病毒颗粒的qpcr来量化。转导将通过在细胞裂解物上使用elisa量化的ha、myc和/或vegfc表达的免疫荧光染色来确认。
52.人类足细胞和肾小球内皮细胞和近端小管上皮细胞将被aav vegfc(lk03或3b)或空载体感染。感染和转导将被确认为上述的小鼠细胞系。
53.期望的是所有细胞类型将被感染,但是vegfc的表达将仅发生在足细胞中。
54.目标2:证明这可以防止实验性dkd的发展
55.两种具有糖尿病肾病的1型糖尿病小鼠模型是可用的:stz dba2/j和ove26 fvb。后者提供了更严重的糖尿病肾病模型、更紧密地类似人类病理生理学(8周时白蛋白尿、3个月时超滤和9个月时gfr降低)和8个月时升高的血压(收缩压和舒张压)。在12周时可观察到足细胞损失。
56.并行使用stz和ove 26的初步研究:
57.aav-vegfc或载体将在stz-后6或12周或6和12周龄(ove26)进行尾静脉注射。每组n=2只。两周后取尿液样本。颊静脉血将被每两周取样一次。尿白蛋白肌酐比(uacr)和egfr将被计算出来。肾小球vegfc表达将与每个模型中的足细胞活力相关。这将有助于定义每个模型和实验终点中的(最新)干预时间。
58.stz dba2/j小鼠-雄性每个条件n=9
59.(i)sham+载体
60.(ii)stz+载体
61.(iii)stz+aav vegfc
62.读出:uacr、egfr、肾小球通透性检测、包括em的组织学特征。
63.ove26 fvb小鼠-雄性和雌性。每个条件n=9。
64.(i)同窝对照非糖尿病+载体
65.(ii)糖尿病+载体
66.(iii)糖尿病+aav vegfc
67.读出:uacr、egfr、肾小球通透性检测、包括em的组织学特征。
68.该目标将证实,vegfc转导防止dkd中的早期genc变化和白蛋白尿,并且证实该治疗是长期有效的。
69.目标3:原理证明:在人体组织中靶向足细胞vegfc基因表达
70.将从不适合移植的人类供体肾脏中分离出肾小球。我们已经建立了基础设施,以在现有项目中定期地接收这些肾脏。感染了aav的来自多能干细胞的人类肾脏类器官,之前已经显示出按天表达。在aavlk03 vegfc、aav3b vegfc或空载体被添加到培养基中之前,肾小球将被悬浮培养1天。五天后,将裂解的肾小球固定在tissue-tek中并像我们之前对悬浮培养的人类肾小球所做的那样切片。
71.感染:肾小球裂解物将被提取mrna并通过qpcr进行病毒颗粒定量。
72.vegfc表达:将进行共焦免疫荧光共定位研究,以证明vegfc通过足细胞而不是内皮细胞或系膜细胞转导。对于人类vegfc elisa,还将在裂解的肾小球中量化vegfc表达。
73.人类肾小球活力:我们已经表明,人类肾小球可以在悬浮液中培养长达10天并保持生理反应,并且人类肾小球在培养中可存活长达7天。将在终点(培养的第6天)在新鲜肾小球上确认活力。
74.这些实验将在至少三个独立的分离的人类肾小球群体中进行(即3个肾脏)。
75.如果成功,该目标将证明使用临床安全载体在人类肾小球中有效转导vegfc。
76.实施例2:将人类vegfc克隆到aav载体中
77.将人类vegfc-flag克隆到aav lk03载体中,使用aflii和sbfi限制性位点在最小肾病蛋白启动子(hnphs1)下表达(见图5)。验证克隆序列,然后生长和纯化。
78.vegfc-flag克隆到aav载体中
79.使用含有aflii限制的引物序列gatccttaaggcgatcgccatgcacttgctgg作为正向引物,含有sbfi限制位点的gatccctgcaggttaaaccttatcgtcgtcatcctt作为反向引物,从作为模板的sinobiologicals公司的pcmv3-orf-flag扩增vegfc插入。neb q5 hf 2x master mix(m042s)按照制造商的说明书用于扩增,60c作为引物的退火温度。在使用qiagen pcr纯化试剂盒(28104)清理pcr反应之前,通过凝胶电泳确认了在正确尺寸(1200bp处的带)下的单个产物。vegfc扩增子和aav载体pav.hnphs1.hpodha.wpre.bgh在37℃下用aflii和sbfi双消化2小时。aav载体的限制性消化在100v下在1%琼脂糖凝胶上运行1.5小时,以允许从消化产物中分离线性化的双消化载体。使用qiagen pcr纯化试剂盒再次清理vegfc pcr消化。消化的aav载体被切除凝胶(6500bp带),并用qiagen凝胶纯化试剂盒(28115)纯化。一旦清理和纯化完成,使用1:1的载体与插入物的比率,使用100ng载体建立连接。用promega t4连接酶(m180)按照制造商说明书进行连接。一旦连接完成,使用neb 5-alpha感受态大肠杆菌(高效率)(c2987)细胞按照制造商说明书转化连接产物。转化在带有100μg/ml氨苄青霉素的lb琼脂平板上制成显微片,置于37℃过夜。筛选出vegfc插入物的菌落并进行序列验证。
80.通过免疫荧光在肾细胞系中的vegfc-flag表达
81.将温度敏感的sv40 t-抗原转化的肾小球内皮细胞(genc)、足细胞(ly)和近端小管上皮细胞(ptec)接种在6孔板中的盖玻片上,允许达到80%的融合。然后用25ul纯化的aav lk 03vegfc病毒感染细胞,并从33℃热切换至37℃,这导致sv40 t-抗原的降解,从而允许细胞分化。将gencs和ptecs分化5天,而lys分化10天。作为阳性对照,用pcmv3-orf-flag质粒转染293hek细胞,该质粒在cmv启动子下表达vegfc,导致高表达水平。然后用pbs洗涤细胞,用4%pfa固定,并用来自sigma(f3165)的anti-flag m2染色,之后用来自sigma(sab4600092)的anti-mouse 594染色,以确定每个细胞类型中的表达水平。作为阳性对照,
用pcmv3-orf-flag质粒转染293hek细胞,该质粒在cmv启动子下表达vegfc,导致高表达水平。然后在epi-荧光显微镜上成像细胞。
82.结果
83.结果显示人类vegfc-flag在阳性对照(转染hek293)和aav lk 03vegfc感染的足细胞中的表达(见图6)。在近端小管细胞或肾小球内皮细胞中没有观察到表达,表明vegfc表达对足细胞是特异的。因此,aav lk03 vegfc载体可以被成功制备并且特异地靶向足细胞。发明人较早的工作表明,vegfc促进肾小球内皮细胞的存活并减少白蛋白渗透性(foster等人2008),并且vegfc可增强内皮细胞表面上的糖萼层,其可控制内皮白蛋白渗透性(foster等人,2013),考虑到以上,这些数据一起表明,本发明的基因治疗载体可用于靶向肾脏肾小球内的足细胞,以便治疗或预防肾脏疾病,例如糖尿病肾病。
84.实施例3:来自aav-vegfc感染的足细胞的条件培养基增加细胞表面凝集素与肾小球内皮糖萼的结合
85.用pcmv3-vegfc表达质粒或模拟品转染hek细胞,并用nphsl.aav-vegfc或对照病毒感染足细胞。移除条件培养基,使用旋转柱浓缩并重新悬浮在肾小球内皮培养基中。
86.将条件培养基加入肾小球内皮细胞中1小时,固定细胞并使用绿色标记的小麦凝集凝集素(wga)进行免疫荧光染色。这与内皮细胞表面上的糖残基(内皮糖萼)结合。细胞表面荧光强度被量化。wga与用条件培养基形式hek细胞刺激的肾小球内皮细胞的结合有增加的强烈趋势(见图7a),wga与用足细胞条件培养基刺激的肾小球内皮细胞的结合有显著增加的强烈趋势(见图7b,非配对t-检验,p《0.05)。这表明感染了nphs1.aav-vegfc的足细胞分泌vegfc,其作用于肾小球内皮细胞以增强糖萼层。
87.参考文献
88.foster rr,slater sc,seckley j,kerjaschki d,bates do,mathieson pw,satchell sc.vascular endothelial growth factor-c,a potential paracrine regulator of glomerular permeability,increases glomerular endothelial cell monolayer integrity and intracellular calcium.am j pathol 2008 173:938-948
89.foster rr,armstrong l,baker s,wong dwl,wylie ec,ramnath r,jenkins r,singh a,steadman r,welsh gi,mathieson pw,satchell sc.glycosaminoglycan regulation by vegfa and vegfc of the glomerular microvascular endothelial cell glycocalyx in vitro.am j pathol 2013 183:604-616
90.jha,sk,rauniyar,k,karpanen,t,leppanen,vm,brouillard,p,vikkula,m,alitalo,k,jeltsch,m:efficient activation of the lymphangiogenic growth factor vegf-c requires the c-terminal domain of vegf-c and the n-terminal domain of ccbe1.sci rep,7:4916,2017.
91.joukov v,sorsa t,kumar v,jeltsch m,claesson-welsh l,cao y,saksela o,kalkkinen n,alitalo k.proteolytic processing regulates receptor specificity and activity of vegf-c.embo j.1997 jul 1;16(13):3898-911.
92.luo,x.,hall,g.,li,s.,bird,a.,lavin,p.j.,winn,m.p.,kemper,a.r.,brown,t.t.&koeberl,d.d.2011.hepatorenal correction in murine glycogen storage disease type i with a double-stranded adeno-associated virus vector.mol ther,
19,1961-70.
93.moeller,m.j.,sanden,s.k.,soofi,a.,wiggins,r.c.&holzman,l.b.2002.two gene fragments that direct podocyte-specific expression in transgenic mice.j am soc nephrol,13,1561-7.
94.onions kl,gamez m,buckner nr,baker sl,betteridge kb,desideri s,dallyn bp,ramnath rd,neal cr,farmer lk,mathieson pw,gnudi l,alitalo k,bates do,salmon ahj,welsh gi,satchell sc,foster rr.vegfc reduces glomerular albumin permeability and protects against alterations in vegf receptor expression in diabetic nephropathy.diabetes.2019 jan;68(1):172-187
95.picconi,j.l.,muff-luett,m.a.,wu,d.,bunchman,e.,schaefer,f.&brophy,p.d.2014.kidney-specific expression of gfp by in-utero delivery of pseudotyped adeno-associated virus 9.molecular therapy.methods&clinical development,1,14014.
96.rocca,c.j.,ur,s.n.,harrison,f.&cherqui,s.2014.raav9 combined with renal vein injection is optimal for kidney-targeted gene delivery:conclusion of a comparative study.gene therapy,21,618-628.
97.schambach,a.,bohne,j.,baum,c.,hermann,f.g.,egerer,l.,von laer,d.&giroglou,t.2005.woodchuck hepatitis virus post-transcriptional regulatory element deleted from x protein and promoter sequences enhances retroviral vector titer and expression.gene therapy,13,641.
98.schievenbusch,s.,strack,i.,scheffler,m.,nischt,r.,coutelle,o.,m.,hallek,m.,fries,j.w.u.,dienes,h.-p.,odenthal,m.&h.2010.combined paracrine and endocrine aav9 mediated expression of hepatocyte growth factor for the treatment of renal fibrosis.molecular therapy,18,1302-1309.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1