抗苗勒管激素受体2抗体和使用方法与流程
抗苗勒管激素受体2抗体和使用方法
1.相关申请的交叉引用
2.本技术根据35u.s.c.
§
119要求2020年1月31日提交的美国临时申请第62/968,840号的权益,其中其内容通过引用方式以其整体并入本文。
背景技术:
3.上皮性卵巢癌(eoc)是最普遍且最致命的卵巢癌形式,占所有卵巢癌症的约85%。一系列与eoc发作相关的不明确症状以及缺乏用于早期检测的有效生物标志物通常会导致晚期疾病分期时的晚期诊断,从而导致按照当前的护理标准,疾病复发率高且预后差。
4.amhr2是一种与转化生长因子-β(tgfβ)超家族的ii型受体同源的丝氨酸/苏氨酸激酶受体。抗苗勒管激素(amh)是amhr2的同源配体,并且amh与amhr2的胞外结构域(amhr2-ed)结合发出细胞周期停滞和程序性细胞死亡的信号,导致男性发育期间苗勒管的退化和卵母细胞发育的调节,以及成年女性的卵巢储备和生育能力的控制。amhr2在大多数人eoc中过表达。
5.因此,迫切需要新的有效疗法用于治疗和管理癌症,尤其是eoc,包括靶向amhr2的疗法。
技术实现要素:
6.本发明部分基于可用于治疗癌症(例如卵巢癌)的抗-amhr2抗体和amhr2疫苗制剂的发现。
7.在一个方面,提供了与人抗苗勒管激素受体ii(amhr2)结合的分离抗体,其中所述抗体结合在amhr2胞外结构域(seq id no:11)的残基11-32(seq id no:12)内。在一些实施方案中,所述抗体结合在amhr2胞外结构域(seq id no:11)的残基20-26(seq id no:13)内。在一些实施方案中,所述抗体结合在amhr2胞外结构域(seq id no:11)的残基22-26(seq id no:14)内。
8.在一个方面,提供了与人amhr2(seq id no:9)结合的分离抗体,其中所述抗体与抗苗勒管激素(amh)竞争与人amhr2的结合。在一个方面,提供了与人amhr2(seq id no:9)结合的分离抗体,其中所述抗体与本文所公开的抗体竞争与人amhr2的结合。
9.在一个方面,提供了一种包含重链和轻链的分离的抗体,所述重链包含可变重(vh)链序列,所述可变重链序列包含三个重链cdr序列cdr-h1、cdr-h2和cdr-h3,所述轻链包含可变轻(vl)链序列,所述可变轻链序列包含三个轻链cdr序列cdr-l1、cdr-l2和cdr-l3,其中cdr-h1包含seq id no:1中所示序列,cdr-h2包含seq id no:2中所示序列,cdr-h3包含seq id no:3中所示序列,cdr-l1包含seq id no:4中所示序列,cdr-l2包含seq id no:5中所示序列,并且cdr-l3包含seq id no:6中所示序列。
10.在任何前述抗体的一些实施方案中,所述vh链序列包含seq id no:7中所示序列,并且/或者所述vl链序列包含seq id no:8中所示序列。在一些实施方案中,所述vh链序列实质上由seq id no:7中所示序列组成,并且/或者所述vl链序列实质上由seq id no:8中
所示序列组成。在一些实施方案中,所述vh链序列由seq id no:7中所示序列组成,并且/或者所述vl链序列由seq id no:8中所示序列组成。
11.在任何前述抗体的一些实施方案中,如通过表面等离子体共振(spr)所测量,所述抗体以小于或等于约0.1、0.2、0.5、1、2、3、4或5
×
10-9m的kd结合至人amhr2。
12.在任何前述抗体的一些实施方案中,所述抗体是人源化抗体、人抗体或嵌合抗体。例如,在一些实施方案中,所述重链cdr和轻链cdr插入在人或人源化免疫球蛋白框架区之间。在一些实施方案中,所述抗体为单克隆抗体。
13.在任何前述抗体的一些实施方案中,所述抗体包含选自igg、iga、igd、ige和igm的类别的重链人恒定区或人fc区。在一些实施方案中,所述重链人恒定区或所述人fc区属于igg类和选自igg1、igg2、igg3和igg4的亚类,例如,所述抗体包含野生型人igg1 fc区。在一些实施方案中,所述重链人恒定区或所述人fc区包含一个或多个氨基酸置换,其中所述一个或多个置换导致与不含所述一个或多个置换的恒定区或fc相比抗体半衰期增加、adcc活性增加、adcp活性增加或cdc活性增加。在一些实施方案中,所述重链人恒定区或所述人fc区结合选自由以下组成的组的fcγ受体:fcγri、fcγriia、fcγriib、fcγriic、fcγriiia和fcγriiib。
14.在任何前述抗体的一些实施方案中,所述抗体诱导细胞(例如,amhr2+细胞)的凋亡。在一些实施方案中,所述抗体具有抗体依赖性细胞介导的细胞毒性(adcc)活性。在一些实施方案中,所述抗体具有抗体介导的细胞吞噬(adcp)活性。在一些实施方案中,所述抗体具有补体依赖性细胞毒性(cdc)活性。
15.在一个方面,提供了分离的多核苷酸或多核苷酸组,其编码任何前述抗体、其vh、其vl、其轻链、其重链或其抗原结合部分。在一些实施方案中,所述分离的多核苷酸或多核苷酸组包含cdna。在一个方面,提供了包含任何前述多核苷酸或多核苷酸组的载体或载体组。在一个方面,提供了包含任何前述多核苷酸或多核苷酸组或任何前述载体或载体组的宿主细胞。在一个方面,提供了产生抗体的方法,所述方法包括(i)在一定条件下温育任何前述宿主细胞,以使所述宿主细胞表达所述抗体,以及(ii)纯化所述抗体。
16.在一个方面,提供了药物组合物,所述药物组合物包含任何前述抗体和药学上可接受的载剂或赋形剂。在一个方面,本文提供了药盒,该药盒包含任何前述抗体或组合物和使用说明书。
17.在一个方面,本文提供了一种使在细胞表面表达amhr2的细胞(amhr2+细胞)死伤、失能或耗尽的方法,所述方法包括使amhr2+细胞与任何前述抗体或组合物接触。在一些实施方案中,所述抗体通过程序性细胞死亡、抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(cdc)和抗体介导的吞噬作用(adcp)中的至少一者来使所述amhr2+细胞死伤、失能或耗尽。在一些实施方案中,使amhr2+细胞与所述抗体或组合物接触诱导amhr2+细胞的凋亡(例如,由半胱天冬酶-3介导)、裂解、死亡、吞噬或生长停滞。在一些实施方案中,所述抗体诱导细胞中parp-1的切割。在一些实施方案中,所述抗体被所述细胞内化。在一些实施方案中,所述抗体具有受体-配体阻断剂、激动剂或拮抗剂活性。
18.在一些实施方案中,所述amhr2+细胞是癌细胞。在一些实施方案中,使所述amhr2+细胞与所述抗体或组合物接触发生在体外。在一些实施方案中,使所述amhr2+细胞与所述抗体或组合物接触发生在体内,例如发生在受试者,例如癌症受试者中。在一些实施方案
中,所述癌症是实体癌,例如卵巢癌,例如i期、ia期、ib期、ic期、ii期、iia期、iib期、iii期、iiia1期、iiia2期、iiib期、iiic期、iv期、iva期或ivb期卵巢癌。在一些实施方案中,所述癌症是转移性的和/或难治性的癌症。
19.在一个方面,本文提供了治疗有需要的受试者的癌症(例如,amhr2+癌症)的方法,所述方法包括给受试者施用任何前述抗体或组合物。在一些实施方案中,所述癌症是实体癌,例如卵巢癌,例如i期、ia期、ib期、ic期、ii期、iia期、iib期、iii期、iiia1期、iiia2期、iiib期、iiic期、iv期、iva期或ivb期卵巢癌。在一些实施方案中,所述癌症是转移性的和/或难治性的癌症。在一些实施方案中,与施用所述抗体之前的癌症体积相比,所述抗体在减少癌症体积方面是有效的。在一些实施方案中,如与施用所述抗体之前的癌症生长速率相比,所述抗体在减少癌症生长速率方面是有效的。在一些实施方案中,所述抗体在消除癌症方面是有效的。
20.在一个方面,提供了诱导有需要的受试者的免疫反应的方法,所述方法包括给受试者施用包含amhr2胞外结构域多肽的组合物。在一个方面,提供了治疗有需要的受试者的癌症(例如,amhr2+癌症)的方法,所述方法包括给受试者施用包含amhr2胞外结构域多肽的组合物。在一些实施方案中,所述施用诱导受试者的免疫反应。在一些实施方案中,所述免疫反应是适应性免疫反应。在一些实施方案中,所述amhr2胞外结构域多肽包含seq id no:11的氨基酸序列或包含seq id no:11的至少8个连续氨基酸的氨基酸序列。在一些实施方案中,所述组合物进一步包含佐剂,其中所述佐剂包含(a)碳水化合物和(b)可代谢的油。
21.在一个方面,提供了治疗有需要的受试者的癌症(例如,amhr2+癌症)的方法,所述方法包括给受试者施用治疗有效量的(i)抗-amhr2抗体(例如,本文所公开的抗体)和(ii)包含amhr2胞外结构域多肽的组合物。在一些实施方案中,所述amhr2胞外结构域多肽包含seq id no:11的氨基酸序列或包含seq id no:11的至少8个连续氨基酸的氨基酸序列。
22.在一些实施方案中,所述抗-amhr2抗体和包含所述amhr2胞外结构域多肽的组合物是同时施用的(例如,包含所述amhr2胞外结构域多肽的组合物进一步包含抗-amhr2抗体)。在一些实施方案中,所述抗-amhr2抗体和包含所述amhr2胞外结构域多肽的组合物是分开施用的,例如,首先施用所述抗-amhr2抗体,其次施用包含所述amhr2胞外结构域多肽的组合物。在一些实施方案中,包含amhr2胞外结构域的组合物进一步包含佐剂,其中所述佐剂包含(a)碳水化合物和(b)可代谢的油。
23.在一个方面,提供了治疗有需要的受试者的癌症(例如,amhr2+癌症)的方法,所述方法包括给受试者施用治疗有效量的组合物,所述组合物包含amhr2胞外结构域多肽和佐剂,其中所述佐剂包含(a)碳水化合物和(b)可代谢的油。在一些实施方案中,所述amhr2胞外结构域多肽包含seq id no:11的氨基酸序列或包含seq id no:11的至少8个连续氨基酸的氨基酸序列。
24.在前述方法的一些实施方案中,其中所述方法包括施用包含佐剂的组合物,所述佐剂包含碳水化合物,所述碳水化合物包含多糖。在一些实施方案中,所述多糖包括至少两种或三种多糖的混合物。在一些实施方案中,所述佐剂包含具有至少两种或三种多糖的混合物的碳水化合物,并且当所述组合物被施用给受试者时,所述组合物能够诱导包括1型和17型促炎性t细胞反应二者的抗原特异性t细胞免疫反应。在一些实施方案中,所述碳水化合物结合至模式识别受体,例如,tlr2或dectin-1。在一些实施方案中,所述多糖或多糖混
合物中的每种多糖选自由甲壳素、右旋糖酐、葡聚糖、香菇多糖(lentanan)、甘露聚糖以及它们的组合组成的组。在一些实施方案中,所述多糖或多糖混合物包含葡聚糖,例如,β-葡聚糖,例如,1-3β-葡聚糖。在一些实施方案中,所述多糖混合物包括甲壳素、葡聚糖和甘露聚糖的混合物。在一些实施方案中,所述佐剂中至少50%的碳水化合物是β-葡聚糖。在一些实施方案中,所述佐剂包含酵母聚糖。
25.在前述方法的一些实施方案中,其中所述方法包括施用包含佐剂的组合物,所述佐剂包含可代谢的油,所述可代谢的油包括纯化油。在一些实施方案中,所述纯化油是矿物油,例如,drakeol
tm 6vr。在一些实施方案中,所述可代谢的油包括可生物降解的油,例如肉豆蔻酸异丙酯、角鲨烯油、角鲨烷油、植物油(例如,杏仁油、蓖麻油、大风子油、椰子油、玉米油、棉籽油、橄榄油、花生油、桃仁油、红花油或大豆油)或它们的组合。在一些实施方案中,所述可代谢的油包括药物级油。
26.在前述方法的一些实施方案中,其中所述方法包括施用包含佐剂的组合物,所述佐剂进一步包含表面活性剂。在一些实施方案中,所述表面活性剂包含二缩甘露醇单油酸酯(例如,montanide
tm
,例如,montanide
tm isa 51vg)、异二缩甘露醇单油酸酯或它们的组合。
27.在前述方法的一些实施方案中,其中所述方法包括施用包含佐剂的组合物,所述佐剂是水和油的乳液,例如,油包水型乳液。在一些实施方案中,所述抗原和碳水化合物以从约10:1至约1:10(w/w)的比率存在,例如,所述抗原和碳水化合物以约1:1(w/w)的比率存在。
28.在前述方法的一些实施方案中,其中所述方法包括施用包含amhr2胞外结构域多肽的组合物,所述方法诱导抗原特异性t细胞免疫反应,例如,cd4+t细胞和/或cd8+t细胞反应。在一些实施方案中,所述t细胞免疫反应包含1型和/或17型促炎性t细胞反应。在一些实施方案中,施用所述组合物导致相对于参考水平,例如,在施用了包含完全弗氏佐剂的组合物的受试者中观察到的肉芽肿形成水平而言,肉芽肿形成减少。
29.在任何前述方法的一些实施方案中,所述受试者已经被施用、将被施用或同时被施用额外的抗癌疗法。在一些实施方案中,所述抗癌疗法包含抗癌剂,例如,选自贝伐珠单抗、博来霉素、卡铂、顺铂、环磷酰胺、多西他赛、多柔比星、依托泊苷、吉西他滨、来曲唑、奥拉帕利、他莫昔芬、托泊替康、曲贝替定(trabectedin)、ctla4抗体、pd-1抗体、pd-l1抗体和tgfβ抗体的抗癌剂。
30.在一个方面,提供了包含amhr2胞外结构域多肽、酵母聚糖和montanide
tm
的油包水型乳液的制剂,其中所述amhr2胞外结构域多肽和酵母聚糖在制剂中以介于约1:5(w/w)和5:1(w/w)之间的比率存在,并且其中所述amhr2胞外结构域多肽包含与seq id no:11的氨基酸序列至少80%、85%、90%、95%同一的氨基酸序列。在一些实施方案中,所述制剂进一步包含抗-amhr2抗体(例如,本文所公开的抗-amhr2抗体)。
31.本发明的这些和其他方面和特征描述在以下具体实施方式和权利要求书中。
附图说明
32.图1示出对rhamhr2-ed有特异性的mab的生成。(a)elisa示出在1/10,000的血清稀释度下12个杂交瘤对amhr2-ed和特异性对照抗原重组β-酪蛋白的反应。(b)在1/10,000的
稀释度下4d12杂交瘤的4d12c6、4d12c7和4d12g1亚克隆的同种型分析。(c)通过竞争性elisa和(d)通过流式细胞术分析确定每个亚克隆与ovcar8细胞结合的抗原特异性。使用可商购获得的抗-amhr2-ed mab(abcam)执行amhr2-ed-ovcar8细胞的阳性对照染色,而将具有不相关特异性的igg1同种型抗体用作阴性对照。在所有情况下,误差条表示
±
sd,并且示出的结果代表了三个产生相似结果的实验。
33.图2显示4d12g1 mab识别人eoc中的amhr2-ed并且与amh竞争与amhr2-ed的结合。(a)流式细胞术分析显示4d12g1mab与由检查的两个原发性hgsoc组织产生的大部分细胞结合。误差条表示
±
sd。(b)4d12g1 mab被用于七种不同的hgsoc组织裂解物(25μg蛋白质/泳道)的蛋白质印迹分析中,阳性对照裂解物由幼龄c57bl/6卵巢生成,并且阴性对照裂解物由c4-2人前列腺癌细胞生成。用β-肌动蛋白抗体进行的免疫染色被用于确认归一化的裂解物负载。所示的蛋白质印迹代表三个产生相似结果的实验。(c)4d12g1mab被用于来自四名hgsoc患者的组织切片(左栏)及其正常相邻输卵管组织(右栏)的免疫组织化学染色(20x)中。箭头指示肿瘤实质的染色。eoc肿瘤的间质区域未被免疫染色,正常相邻输卵管组织的所有区域也未被免疫染色。所有实验都执行了三次,得到相似的结果。(d)用来自c4-2前列腺癌细胞的裂解物作为对照,对来自ovcar8细胞和amhr2-ovcar8细胞的裂解物进行蛋白质印迹分析,并且使用β-肌动蛋白抗体免疫染色来确认归一化的裂解物负载。流式细胞术分析显示:(e)4d12g1 mab与91%的amhr2-ovcar8细胞结合;(f)amhr2-ed的amh同源配体以剂量依赖性方式与4d12g1 mab有效地竞争与amhr2-ovcar8细胞的结合;(g)重组卵清蛋白未能与4d12g1 mab竞争与amhr2-ovcar8细胞的结合。数据代表三个产生相似结果的独立实验。
34.图3示出4d12g1 mab的amhr2-ed结合位点的鉴定。(a)示出了人amhr2-ed的整个132个氨基酸序列。(b)将跨越具有一个氨基酸移位的人amhr2-ed的整个序列的重叠系列的16聚体肽铺板以使用4d12g1 mab作为一级抗体进行直接elisa测试。4d12g1mab识别残基amhr2-ed 11-32。(c)跨越amhr2-ed 13-30的重叠肽被合成为在每个n末端残基处具有丙氨酸置换,或具有针对任何天然n末端丙氨酸残基的甘氨酸置换。竞争性elisa结果表明,跨越amhr2-ed 20-26的残基(
20
ktlgell
26
)处的丙氨酸置换降低了4d12g1 mab与amhr2-ed的结合。(d)将使用跨越amhr2-ed 9-40的4-16聚体肽的spot肽阵列固定在纤维素膜上,用4d12g1 mab处理,并通过化学发光检测结合的抗体。结果表明,amhr2-ed 22-26 5聚体序列(
22
lgell
26
)代表用于4d12g1 mab结合的最小序列。(e)spot肽阵列是使用跨越amhr2-ed 17-33结构域并且在每个连续氨基酸处含有丙氨酸置换的膜结合的17聚体肽制成的。leu22、gly23和leu26的丙氨酸替换完全消除了4d12g1 mab的结合。所有误差条均表示
±
sd,并且所有实验都代表三个产生相似数据的实验。
35.图4示出人amhr2-ed的分子模型。同源amh配体的建议结合位点包括关键天然amh i结合位点,即4rrtcvffeapgv
15
,其在(a)主要氨基酸序列中以红色表示并且在(b)带状模型中作为红色β折叠表示,与在一级序列中和在带状模型中作为β折叠都以蓝色描绘的4d12g1 mab的
20
ktlgell
26
结合位点并置但反平行。另一个强amh结合位点ii,即
34
rairclysr
42
,其由也与4d12g1 mab的
20
ktlgell
26
结合位点相邻的黄色长环表示。相比之下,12g4 mab及其3c23k人源化和糖工程改造的变异体(又名gm102)的
53
draqvem
59
结合位点分别更接近较弱的三级和四级amh结合位点
46
giwnl
50
和
83
pspgstlft
91
。在(c)带状模型的顶视图以及在(d)
90
°
旋转视图中,箭头指向4d12g1 mab的蓝色
20
ktlgell
26
结合位点与红色amh i结合位点4rrtcvffeapgv
15
和黄色amh结合位点ii 34
rairclysr
42
的并置。
36.图5显示了4d12g1 mab通过诱导细胞凋亡、cdc和adcp来使eoc细胞死伤。(a)为了评估4d12g1 mab是否诱导eoc细胞的凋亡,在补充有热灭活血清的dmem中用绿色荧光染料和4d12g1mab处理amhr2-ovcar8细胞,并使用incucyte s3活细胞分析系统通过实时成像实时评估该amhr2-ovcar8细胞的凋亡诱导。与用igg1同种型对照mab处理(a,左图)相比,用4d12g1 mab处理16小时诱导大量细胞凋亡(a,右图)。(b)用不同浓度的4d12g1 mab处理amhr2-ovcar8细胞24小时,并且细胞裂解物的蛋白质印迹分析显示检测到完整的116kda parp-1及其与细胞凋亡一致的89kda的经切割的变异体。用β-肌动蛋白抗体进行的免疫染色被用于确认归一化的裂解物负载。(c)将amhr2-ovcar8细胞与4d12g1mab一起在37℃(b,左栏)或4℃(b,右栏)下温育不同时间段。在37℃下处理后1小时,4d12g1 mab与amhr2受体的复合体在amhr2-ovcar8细胞的细胞质中变得明显,在37℃下处理后2和3小时,细胞质抗体-受体复合体的簇状模式变得越来越明显,全部与细胞凋亡的诱导一致。在4℃下用4d12g1 mab进行的处理显示在处理后3小时细胞质抗体-受体复合体很少,并且在单独用二级抗体处理的细胞中没有发生染色(c,右栏,底图)。(d)为了确定4d12g1 mab是否诱导eoc细胞的cdc,将amhr2-ovcar8细胞在10%正常人血清或10%热灭活人血清中温育,并用不同剂量的4d12g1 mab或同种型对照mab处理4小时。细胞裂解通过ldh活性的释放来测量,并且仅发生在用4d12g1 mab处理的细胞中。(e)为了确定4d12g1 mab是否诱导eoc细胞的adcp,用绿色荧光染料标记amhr2-ovcar8靶细胞,并且将该细胞在没有任何血清的情况下与两种不同浓度的4d12g1 mab或同种型对照mab一起温育30分钟。将经洗涤过的细胞与来自c57bl/6小鼠骨髓的效应巨噬细胞以10:1的效应子:靶细胞比率混合,并且在3天后通过流式细胞术分析靶细胞。仅在用4d12g1 mab处理的细胞中发生靶细胞死亡。所有误差条均表示
±
sd,并且所有实验都代表三个产生相似数据的实验。
37.图6显示4d12g1 mab抑制人eoc异种移植物的生长。将人eoc肿瘤皮下注射到免疫缺陷小鼠中。当肿瘤变得可被触及时,每周给小鼠i.p.注射200μg的4d12g1 mab或同种型对照mab,连续5周。用4d12g1 mab处理显著抑制(a)严重免疫缺陷nsg小鼠(p《0.001)和(b)t细胞缺陷无胸腺裸鼠(p《0.0001)中ovcar8肿瘤的生长。用4d12g1 mab处理显著抑制由最近确诊的患者产生并且被异种移植到免疫缺陷nsg小鼠中的三个原发性hgsoc肿瘤的生长(在所有情况下p《0.0001),该三个原发性hgsoc肿瘤包括(c)pdx-4、(d)pdx-6和(e)pdx-9。(f)与用同种型对照mab处理的小鼠(f,左栏)相比,在用4d12g1 mab处理的小鼠(f,右栏)中用箭头示出了处于20x下的来自nsg小鼠的ovcar8(f,上排)和pdx-4肿瘤(f,下排)中半胱天冬酶-3阳性细胞的检测。示出的半胱天冬酶-3数据代表三个产生相似结果的实验。所有误差条都表示
±
sd。
具体实施方式
38.i.定义
39.为了方便起见,在此收集了说明书、实施例和随附权利要求书中使用的某些术语。
40.冠词“一个/种(a)”和“一个/种(an)”在本文中用于指代一个/种或多于一个/种(即,至少一个/种)冠词语法对象。举例来说,“要素(element)”意指一种要素或多于一种要
素。
41.如本文所用,“佐剂”意指这样的物质,该物质在施用抗原之前、与施用抗原一起或施用抗原之后被施用时使对该抗原的免疫反应的质量和/或强度与施用单独的抗原所引发的反应相比得到加速、延长和/或提高。
42.如本文所用,“抗癌疗法”意指旨在治疗癌症或癌性病状、改善癌症或癌性病状,以及/或者降低癌症或癌性病状的风险或进展。在一些实施方案中,抗癌疗法包含抗癌剂,即用于治疗癌症或癌性病状、改善癌症或癌性病状,以及/或者降低癌症或癌性病状的风险或进展的剂。
43.如本文所用,术语“抗原”具有其在本领域中的普通含义,并且是指可以单独或与佐剂和/或药学上可接受的载剂联合产生免疫反应例如抗体和/或t细胞反应的任何分子或分子的一部分。
44.如本文所用,术语“施用(administering)”意指提供药剂或组合物给受试者,并且包括但不限于由医学专业人员施用或自我施用。
45.如本文所用,“可生物降解(的)”在被用于提及材料时,意指那些当被引入细胞中时通过细胞机制(例如,酶促降解)或通过水解成细胞可以重复使用或处置的组分而分解且对细胞没有显著毒性影响的材料。在一些实施方案中,由可生物降解材料的分解产生的组分不会在体内诱发炎症和/或其他不良反应。在一些实施方案中,可生物降解材料是被酶促分解的。替代地或另外地,在一些实施方案中,可生物降解材料是通过水解分解的。
46.术语“免疫反应”在本文中是指免疫系统对抗原或抗原决定簇的任何反应。示例性免疫反应包括体液免疫反应(例如产生抗原特异性抗体(中和或以其他方式))和细胞介导的免疫反应(例如淋巴细胞增殖)。1型促炎性免疫反应的特征在于ifnγ产生。2型调节性免疫反应的特征在于il-4或il-5表达。17型促炎免疫反应的特征在于il-17表达。在一些情况下,可以产生混合免疫反应。例如,在一些情况下,产生了混合1型/17型炎性免疫反应,其特征在于ifnγ和il-17二者的表达。
47.如本文所用,短语“可代谢的油”意指这样的油,该油在被引入到生物体中时,(1)可在更大程度上被生物体分解或从生物体中消除;(2)可以更快地被生物体分解或从生物体中消除;以及/或者(3)导致与参考水平,诸如施用了完全弗氏佐剂的受试者的肉芽肿形成水平或施用了不完全弗氏佐剂的受试者的所述水平相比,肉芽肿形成减少。因此,如本文所用的短语“可代谢的油”不需要是完全可代谢的。“肉芽肿形成减少”的特征可为例如以下一种或多种:形成的肉芽肿更少、肉芽肿严重程度降低、肉芽肿严重程度更快地降低和肉芽肿更快地(部分或完全)消退。
48.如本文所用,术语“多肽”和“蛋白质”可互换使用,并且通常具有其在本领域公认的至少三个氨基酸的聚合物的含义。术语“多肽”可以指代呈中性(不带电荷)形式或呈盐形式并且未经修饰或例如通过糖基化、侧链氧化或磷酸化进行修饰的多肽。术语“多肽”也可用于指代特定功能类别的多肽。当被用于指代一个功能类别的多肽时,该术语意图包括参考多肽的功能片段、变异体(例如,等位基因变异体)和衍生物,以及参考多肽的全长、野生型型式。在一些实施方案中,某种功能类别的多肽在氨基酸水平上与参考多肽的全长型式共享至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少97.5%的序列同一性。
49.如本文所用,氨基酸序列之间的“同一性百分比”与“同源性百分比”同义,它们都可以使用karlin和altschul的算法(proc.natl.acad.sci.usa 87,2264-2268,1990)来确定,该算法由karlin和altschul修改(proc.natl.acad.sci.usa 90,5873-5877,1993)修改。上述算法被纳入到altschul等人的nblast和xblast的程序(j.mol.biol.215,403-410,1990)中。使用nblast程序、分数=100、字长=12执行blast核苷酸搜索,以获得与本文所述的多核苷酸同源的核苷酸序列。使用xblast程序、分数=50、字长=3执行blast蛋白质搜索,以获得与参考多肽同源的氨基酸序列。为了获得间隙比对用于比较目的,如altschul等人所述(nucleic acids res.25,3389-3402,1997)的那样使用gapped blast。当使用blast和gapped blast程序时,使用各个程序(例如,xblast和nblast)的默认参数。
50.如本文所用的短语“药学上可接受的载剂”意指参与将主题化合物从一个器官或身体的一部分携带或转运到另一个器官或身体的一部分中的药学上可接受的材料、组合物或媒介物,诸如液体或固体填充剂、稀释剂、赋形剂、增稠剂、溶剂或封装材料。术语“载剂”涵盖非共价附接的载剂和共价附接到其中所运输的化合物或组合物的载剂二者。
51.如本文所用,术语“纯化(的)”意指分子、化合物或组合物相对于天然环境中通常与该分子、化合物或组合物相关联的其他组分的富集。术语“纯化(的)”不一定指示已达到分子、化合物或组合物的完全纯度。在一些实施方案中,“纯化的”分子、化合物或组合物是至少90%、至少95%或至少97.5%地不含其他成分。
52.如本文所用,术语“肿瘤相关抗原”具有其在本领域公认的含义,并且是指其表达与肿瘤细胞高度相关的抗原。肿瘤相关抗原在正常细胞中可能表达,也可能不表达。在一些实施方案中,肿瘤相关抗原在肿瘤细胞中过表达。在一些实施方案中,肿瘤相关抗原的表达与肿瘤细胞的一种或多种特定亚型相关。
53.如本文所用,术语“受试者”和“患者”是可互换的,并且是指接受治疗(例如,通过施用如本文公开的抗体、组合物或制剂)的生物体。受试者和患者的实例包括哺乳动物,诸如人或非人类动物。
54.如本文所用的短语“治疗有效量”和“有效量”意指在受试者的至少细胞亚群中以适用于任何医学治疗的合理的获益/风险比有效产生所需治疗效果的剂的量。
[0055]“治疗”受试者的疾病或“治疗”患有疾病的受试者是指使受试者接受药物治疗(例如,药物的施用),以减轻该疾病的至少一种症状或者防止该疾病的至少一种症状恶化。
[0056]
术语“参考”是指用于比较目的的任何样本、标准或水平。短语“参考标准”和“参考水平”可以互换使用,并且是指从参考样本或受试者得出的值或数字。在一些实施方案中,将由参考水平所源自的样本或受试者通过以下标准中的至少一个标准与受试者样本匹配:年龄、体重、疾病阶段和总体健康状况。例如,在一些实施方案中,参考水平是临床等级或分数,或平均临床等级或分数。
[0057]
术语“退休(retired)的自身抗原”和“退休的自身蛋白”在本文中可互换使用,并且是指在正常老化的组织中不再以自身免疫原性水平表达的自身蛋白。
[0058]
如本文所用的术语“表面活性剂”具有其在本领域公认的含义,并且是指倾向于降低两种液体之间、气体和液体之间,或液体和固体之间的表面张力的物质。在一些实施方案中,表面活性剂是乳化剂,一种稳定乳液的物质。
[0059]
术语“任选地”意指当顺序使用时,包括从一种到所有被列举的组合并考虑所有子
组合。
[0060]
术语“调节(modulate)”和“调节(modulation)”是指减少或抑制或者,替代地,激活或增加所列举的变量。
[0061]
术语“增加”和“激活”是指所列举的变量增加10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、100%、2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍或更高。
[0062]
术语“减少”和“抑制”是指所列举的变量减少10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍或更高。
[0063]
术语“激动”是指激活受体信号转导以诱导与受体激活相关的生物反应。“激动剂”是结合至受体并激动受体的实体。
[0064]
术语“拮抗”是指抑制受体信号转导以抑制与受体激活相关的生物反应。“拮抗剂”是结合至受体并拮抗受体的实体。
[0065]
对于本文所述的任何结构和功能特征,确定这些特征的方法是本领域已知的。
[0066]
在说明书通篇中,当组合物被描述为具有、包括或包含特定组分时,或者当工艺和方法被描述为具有、包括或包含特定步骤时,考虑了另外存在实质上由或者由所列举的组分组成的本发明的组合物,并且存在实质上由或者由所列举的加工步骤组成的根据本发明的工艺和方法。
[0067]
在本技术中,当要素或组分被说成包括在所列举的要素或组分的列表中并且/或者选自所列举的要素或组分的列表时,应当理解所述要素或组分可以是所列举的要素或组分中的任何一种,或者所述要素或组分可选自由所列举的要素或组分中的两种或更多种组成的组。
[0068]
进一步地,应当理解,在不背离本发明的精神和范围的情况下,本文描述的组合物或方法的要素和/或特征可以以多种方式组合,无论是本文中明确的还是隐含的。例如,当提及特定化合物时,该化合物可用于本发明组合物的各种实施方案中和/或用于在本发明的方法中,除非从上下文中另有理解。换言之,在本技术中,实施方案已经以能够书写和绘制清晰简明的申请的方式进行描述和描绘,但是意图并且将理解的是,实施方案可以在不脱离本教导和一项或多项发明的情况下以各种方式组合或分离。例如,应当理解,这里描述和描绘的所有特征都可以适用于本文描述和描绘的一项或多项发明的所有方面。
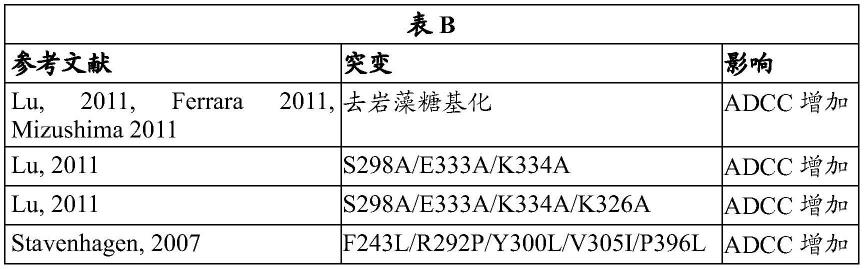
[0069]
应当理解,除非从上下文和使用中另有理解,否则表述“......中的至少一个/种/者”单独地包括该表述之前的所列举对象中的每个对象以及所列举对象中的两个或更多个对象的各种组合。除非从上下文中另有理解,否则与三个或更多个所列举对象结合的表述“和/或”应理解为具有相同的含义。
[0070]
术语“包含/包括(include)”、“包含/包括(includes)”、“包含/包括(including)”、“具有(have)”、“具有(has)”、“具有(having)”、“含有(contain)”、“含有(contains)”或“含有(containing)”(包括其语法等价物)的使用一般应被理解为开放式和非限制性的,例如,不排除额外的未列举的要素或步骤,除非另有明确说明或从上下文中理解。
[0071]
应当理解,只要本发明仍可操作,步骤的顺序或用于执行某些操作的顺序是不重要的。另外,两个或更多个步骤或操作可同时进行。
[0072]
本文的任何和所有实例或示例性语言,例如,“诸如”或“包括”的使用仅意图更好地举例说明本发明并且不会对本发明的范围构成限制,除非另外要求保护。本说明书中的语言不应解读为将任何非要求保护的要素指示为实践本发明所必需。
[0073]
ii.抗苗勒管激素受体2抗体
[0074]
概述
[0075]
抗苗勒管激素受体2(amhr2)是与转化生长因子β(tgfβ)超家族的ii型受体同源的丝氨酸/苏氨酸激酶受体。抗苗勒管激素(amh)是amhr2的同源配体,并且amh与amhr2的胞外结构域(amhr2-ed)结合发出细胞周期停滞和程序性细胞死亡的信号,导致男性发育期间苗勒管的退化和卵母细胞发育的调节,以及成年女性的卵巢储备和生育能力的控制。在成年女性中,最长的amhr2转录物编码573个氨基酸的蛋白质和403个氨基酸的胞质激酶结构域(amhr2-cd),二者都表现出卵巢外表达,其中所述573个氨基酸的蛋白质仅在卵巢中表达,并且包括卵巢特异性的127个氨基酸的amhr2-ed配体结合结构域以及26个氨基酸的跨膜结构域。
[0076]
本文提供了针对抗苗勒管激素受体2的抗体。在一些实施方案中,所述抗体包括结合至人抗苗勒管激素受体ii(amhr2)(seq id no:9)的分离的抗体,其中所述抗体结合在amhr2胞外结构域(seq id no:11)的残基11-32(seq id no:12)内。在一些实施方案中,所述抗体结合在amhr2胞外结构域(seq id no:11)的残基20-26(seq id no:13)内。在一些实施方案中,所述抗体结合在amhr2胞外结构域(seq id no:11)的残基22-26(seq id no:14)内。在一些实施方案中,所述结合至人amhr2(seq id no:9)的分离的抗体与抗苗勒管激素(amh)竞争与人amhr2的结合。在一些实施方案中,所述结合至人amhr2(seq id no:9)的分离的抗体与本文所公开的抗体竞争与人amhr2的结合。在一些实施方案中,所述抗体包含人fc区。
[0077]
本文还提供了包含重链和轻链的分离的抗体,所述重链包含可变重(vh)链序列,所述可变重链序列包含三个重链cdr序列cdr-h1、cdr-h2和cdr-h3,所述轻链包含可变轻(vl)链序列,所述可变轻链序列包含三个轻链cdr序列cdr-l1、cdr-l2和cdr-l3,其中cdr-h1包含seq id no:1中所示序列,cdr-h2包含seq id no:2中所示序列,cdr-h3包含seq id no:3中所示序列,cdr-l1包含seq id no:4中所示序列,cdr-l2包含seq id no:5中所示序列,cdr-l3包含seq id no:6中所示序列。
[0078]
在一些实施方案中,所述vh链序列包含seq id no:7中所示的vh序列。在一些实施方案中,所述vl链序列包含seq id no:8中所示的vl序列。在一些实施方案中,所述vh链序列包含seq id no:7中所示的vh序列;并且所述vl链序列包含seq id no:8中所示的vl序列。在一些实施方案中,所述vh链序列包含seq id no:7中所示的vh序列;并且所述vl链序列包含seq id no:8中所示的vl序列,并且所述人fc区域包含野生型人igg1 fc。
[0079]
在一些实施方案中,所述vh链序列由seq id no:7中所示的vh序列组成。在一些实施方案中,所述vl链序列由seq id no:8中所示的vl序列组成。在一些实施方案中,所述vh链序列由seq id no:7中所示的vh序列组成;并且所述vl链序列由seq id no:8中所示的vl序列组成。在一些实施方案中,所述vh链序列由seq id no:7中所示的vh序列组成;并且所述vl链序列由seq id no:8中所示的vl序列组成,并且所述人fc区域包含野生型人igg1 fc。
[0080]
术语“抗体”在本文中以其最广泛的含义使用,并且包括某些类型的免疫球蛋白分子,所述免疫球蛋白分子包含一个或多个特异性地结合至抗原或表位的抗原结合结构域。如本文所用,除非另有说明,否则术语“抗体”应理解为意指完整抗体(例如,完整的单克隆抗体)或其片段,诸如抗体的fc片段(例如,单克隆抗体的fc片段)或抗体的抗原结合片段(例如,单克隆抗体的抗原结合片段),包括已经过修饰、工程改造或化学缀合的完整抗体、抗原结合片段或fc片段。抗原结合片段的实例包括fab、fab'、(fab')2、fv、单链抗体(例如,scfv)、微型抗体和双抗体。已被修饰或工程改造的抗体的实例包括嵌合抗体、人源化抗体和多特异性抗体(例如,双特异性抗体)。化学缀合的抗体的实例是与毒素部分缀合的抗体。
[0081]
公认的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因,以及无数免疫球蛋白可变区基因。轻链分为k轻链或λ轻链。抗体或免疫球蛋白的“类别”是指其重链拥有的恒定结构域或恒定区的类型。有五种主要类别的抗体:iga、igd、ige、igg和igm,并且这些类别中的几种可以被进一步划分成亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。对应于免疫球蛋白的不同类别的重链恒定结构域分别被称为α、δ、ε、γ和μ。
[0082]
示例性免疫球蛋白(抗体)结构单元由两对多肽链组成,每一对均具有一条“轻”链(约25kda)和一条“重”链(约50-70kda)。每条链的n末端结构域界定了主要负责抗原识别的约100至110或更多个氨基酸的可变区。术语“可变轻链(vl)”和“可变重链(vh)”分别指这些轻链和重链结构域。igg1重链从n末端到c末端分别包含vh、ch1、ch2和ch3结构域。所述轻链从n末端到c末端包含vl和cl结构域。igg1重链包含介于ch1和ch2结构域之间的铰链。在某些实施方案中,所述免疫球蛋白构建体包含至少一个来自连接至治疗性多肽的igg、igm、iga、igd或ige的免疫球蛋白结构域。在一些实施方案中,在本文提供的抗体中发现的免疫球蛋白结构域来自或衍生自基于免疫球蛋白的构建体,诸如双抗体或纳米抗体。在某些实施方案中,本文所述的免疫球蛋白构建体包含至少一个来自重链抗体诸如骆驼抗体的免疫球蛋白结构域。在某些实施方案中,本文提供的免疫球蛋白构建体包含至少一个来自哺乳动物抗体诸如牛抗体、人抗体、骆驼抗体、小鼠抗体或任何嵌合抗体的免疫球蛋白结构域。
[0083]
在一些实施方案中,本文提供的抗体包含重链。在一个实施方案中,所述重链是iga。在一个实施方案中,所述重链是igd。在一个实施方案中,所述重链是ige。在一个实施方案中,所述重链是igg。在一个实施方案中,所述重链是igm。在一个实施方案中,所述重链是igg1。在一个实施方案中,所述重链是igg2。在一个实施方案中,所述重链是igg3。在一个实施方案中,所述重链是igg4。在一个实施方案中,所述重链是iga1。在一个实施方案中,所述重链是iga2。
[0084]
如本文所用,术语“高变区”或“hvr”是指抗体可变结构域的每个区域,其在序列上高度可变并且/或者形成结构确定的环(“高变环”)。通常,天然四链抗体包含六个hvr;三个在vh(h1、h2、h3)中,并且三个在vl(l1、l2、l3)中。hvr通常包含来自高变环和/或来自“互补决定区”(cdr)的氨基酸残基,后者具有最高的序列可变性和/或参与抗原识别。除了vh中的cdr1外,cdr通常包含形成高变环的氨基酸残基。高变区(hvr)也称为“互补决定区”(cdr),并且这些术语在提及形成抗原结合区的可变区的部分时在本文中可互换使用。该特定区域已由kabat等人(u.s.dept.of health and human services,sequences of proteins of immunological interest(1983))和由chothia等人(j mol biol 196:901-917(1987))描述,其中定义包括相互比较时氨基酸残基的重叠或子集。尽管如此,应用任一定义来指代抗
体或其变异体的cdr意图落入如本文所定义和使用的术语的范围内。涵盖特定cdr的确切残基数量将根据cdr的序列和大小而变化。给定抗体的可变区氨基酸序列,本领域的技术人员可以常规确定哪些残基包含特定cdr。
[0085]
cdr的氨基酸序列边界可以由本领域技术人员使用许多已知编号方案中的任何一种来确定,这些编号方案包括由kabat等人(“kabat”编号方案)、al-lazikani等人1997,j.mol.biol.,273:927-948(“chothia”编号方案)、maccallum等人1996,j.mol.biol.262:732-745(“contact”编号方案)、lefranc等人dev.comp.immunol.,2003,27:55-77(“imgt”编号方案)、honegge和pl
ü
ckthun j.mol.biol.,2001,309:657-70(“aho”编号方案)描述的那些;其中的每一者都通过引用方式以其整体并入本文。
[0086]
表a提供了如通过kabat和chothia方案标识的cdr-l1、cdr-l2、cdr-l3、cdr-h1、cdr-h2和cdr-h3的位置。对于cdr-h1,残基编号是使用kabat和chothia编号方案提供的。
[0087]
cdr可以例如使用抗体编号软件诸如abnum(可在www.bioinf.org.uk/abs/abnum/获取,并描述于通过引用方式以其整体并入的abhinandan和martin,immunology,2008,45:3832-3839中)进行分配。
[0088]
表a.根据kabat和chothia编号方案的cdr中的残基。
[0089]
cdrkabatchothial1l24-l34l24-l34l2l50-l56l50-l56l3l89-l97l89-l97h1(kabat编号)h31-h35bh26-h32或h34*h1(chothia编号)h31-h35h26-h32h2h50-h65h52-h56h3h95-h102h95-h102
[0090]
*当使用kabat编号惯例编号时,cdr-h1的c末端根据cdr的长度在h32和h34之间变化。
[0091]
当提及抗体重链恒定区中的残基时,通常使用“eu编号方案”(例如,如上述kabat等人所报道)。除非另有说明,否则eu编号方案被用于指代本文所述的抗体重链恒定区中的残基。
[0092]
如本文所用,术语“单链”是指包含由肽键线性地连接的氨基酸单体的分子。在特定的此类实施方案中,fab轻链的c末端连接至单链fab分子中fab重链的n末端。如本文更详细描述的,scfv具有轻链(vl)的可变结构域,该结构域从其c末端通过多肽链连接到重链可变结构域(vh)的n末端。可替代地,scfv包含这样的多肽链,在该多肽链中,vh的c末端通过多肽链连接到vl的n末端。
[0093]“fab片段”(也称为抗原结合片段)含有轻链的恒定结构域(cl)和重链的第一恒定结构域(ch1),以及分别位于轻链和重链上的可变结构域vl和vh。可变结构域包含参与抗原结合的互补决定环(cdr,也称为高变区)。fab'片段与fab片段的不同之处在于重链ch1结构域的羧基末端添加了几个残基,包括一个或多个来自抗体铰链区的半胱氨酸。
[0094]“f(ab')
2”片段含有两个在铰链区附近通过二硫键连接的fab'片段。f(ab')2片段可以例如通过重组方法或通过完整抗体的胃蛋白酶消化产生。f(ab')片段可以例如通过用
β-巯基乙醇处理来解离。
[0095]“fv”片段包含一个重链可变结构域和一个轻链可变结构域的非共价连接的二聚体。
[0096]“单链fv”或“scfv”包括抗体的vh和vl结构域,其中这些结构域存在于单个多肽链中。在一个实施方案中,fv多肽进一步包含位于vh和vl结构域之间的多肽接头,该接头使scfv能够形成用于抗原结合的期望结构。关于scfv片段的综述,参见pluckthun在the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore编,(springer-verlag,new york),第269-315页(1994)。her2抗体scfv片段描述于wo93/16185、美国专利第5,571,894号和美国专利第5,587,458号。
[0097]“scfv-fc”片段包含附接到fc结构域的scfv。例如,fc结构域可以附接到scfv的c末端。fc结构域可以跟随vh或v
l
,取决于scfv中可变结构域的去向(即,v
h-v
l
或v
l-vh)。可以使用本领域已知的或本文描述的任何合适的fc结构域。在一些情况下,fc结构域包含igg4 fc结构域。
[0098]
术语“单结构域抗体”或“sdab”是指其中抗体的一个可变域特异性地结合至抗原而不存在其他可变结构域的分子。单结构域抗体及其片段描述于arabi ghahroudi等人,febs letters,1998,414:521-526和muyldermans等人,trends in biochem.sci.,2001,26:230-245,其中每一者都通过引用方式以其整体并入本文。单结构域抗体也称为sdab或纳米抗体。sdab是相当稳定的,并且容易表达为含抗体fc链的融合伴侣(harmsen mm,de haard hj(2007)"properties,production,and applications of camelid single-domain antibody fragments".appl.microbiol biotechnol.77(1):13-22)。
[0099]
术语“全长抗体”、“完整抗体”和“全抗体”在本文中可以互换地用来指代具有基本上类似于天然存在的抗体结构的结构并且具有包含fc区的重链的抗体。例如,当被用于指代igg分子时,“全长抗体”是包含两条重链和两条轻链的抗体。
[0100]
术语“表位”意指特异性地结合至抗体的抗原的一部分。表位经常由表面可接近的氨基酸残基和/或糖侧链组成,并且可能具有特定的三维结构特征以及特定的电荷特征。构象表位和非构象表位的区别在于,在变性溶剂存在的情况下与前者的结合可能会丧失,但与后者的结合不会丧失。表位可包含直接参与结合的氨基酸残基和不直接参与结合的其他氨基酸残基。抗体所结合至的表位可以使用用于表位确定的已知技术来确定,所述技术为,例如,测试抗体与具有不同点突变的amhr2变异体的结合或者抗体与嵌合amhr2变异体的结合。
[0101]“多特异性抗体”是包含共同特异性地结合两个或更多个不同表位的两个或更多个不同抗原结合结构域的抗体。该两个或更多个不同表位可以是相同抗原(例如,由细胞表达的单个amhr2分子)上或不同抗原(例如,由相同细胞表达的不同amhr2分子,或amhr2分子和非amhr2分子)上的表位。在一些方面,多特异性抗体结合两个不同的表位(即,“双特异性抗体”)。在一些方面,多特异性抗体结合三个不同的表位(即,“三特异性抗体”)。
[0102]“单特异性抗体”是包含一个或多个与单个表位特异性结合的结合位点的抗体。单特异性抗体的实例是天然存在的igg分子,该igg分子虽然是二价的(即,具有两个抗原结合结构域),但在两个抗原结合结构域的每一个上识别相同的表位。结合特异性可以任何合适的化合价存在。
[0103]
术语“单克隆抗体”是指来自基本上同质的抗体的群体的抗体。基本上同质的抗体的群体包括基本上相似并且结合一个或多个相同表位的抗体,在单克隆抗体生产期间可能正常出现的变异体除外。此类变异体一般仅以少量存在。单克隆抗体通常通过包括从多种抗体中选择单一抗体的工艺获得。例如,选择工艺可以是从多个克隆诸如杂交瘤克隆、噬菌体克隆、酵母克隆、细菌克隆或其他重组dna克隆的库中选择出唯一的克隆。可以进一步改变所选择的抗体,例如,以提高对靶标的亲和力(“亲和力成熟”),以使抗体人源化,以提高其在细胞培养中的产量,以及/或者以降低其在受试者中的免疫原性。
[0104]“效应功能”是指由抗体的fc区介导的那些生物活性,该活性可能随抗体同种型而发生变化。抗体效应功能的实例包括c1q结合以激活补体依赖性细胞毒性(cdc)、fc受体结合以激活抗体依赖性细胞毒性(adcc)和抗体依赖性细胞吞噬作用(adcp)、受体配体阻断、激动作用或拮抗作用。
[0105]“amhr2抗体”、“抗-amhr2抗体”或“amhr2特异性抗体”是如本文所提供的与抗原amhr2特异性结合的抗体。在一些实施方案中,所述抗体结合amhr2的胞外结构域。在某些实施方案中,本文提供的amhr2抗体结合至amhr2的表位,该表位在来自不同物种的amhr2蛋白之间或之中是保守的。
[0106]
术语“嵌合抗体”是指其中一部分重链和/或轻链衍生自特定来源或物种,而剩余的重链和/或轻链衍生自不同来源或物种的抗体。
[0107]
非人抗体的“人源化”形式是含有衍生自非人抗体的最小序列的嵌合抗体。人源化抗体一般是其中来自一个或多个cdr的残基被来自一个或多个非人抗体(供体抗体)的cdr的残基替换的人抗体(受体抗体)。供体抗体可以是任何合适的非人抗体,诸如具有期望特异性、亲和力或生物学效应的小鼠、大鼠、兔、鸡或非人灵长类动物抗体。如与非人类物种抗体相比,人源化抗体在被施用给人类受试者时不太可能诱导免疫反应以及/或者诱导不太严重的免疫反应。在一些情况下,将受体抗体的选定框架区残基用来自供体抗体的相应框架区残基替换。人源化抗体还可包含在受体抗体中或在供体抗体中未发现的残基。可以制作此类修饰以进一步完善抗体功能。如何制备人源化抗体的实例可以在美国专利第6,054,297号、第5,886,152号和第5,877,293号中找到,所述专利中的每一者都通过引用方式以其整体并入。对于进一步的细节,参见jones等人,nature,1986,321:522-525;riechmann等人,nature,1988,332:323-329;以及presta,curr.op.struct.biol.,1992,2:593-596,所述每一者都通过引用方式以其整体并入本文。
[0108]
在一个实施方案中,使来自人抗体的一个或多个恒定结构域与非人物种的一个或多个可变结构域融合。在另一个实施方案中,对非人抗体的一个或多个cdr序列中的一个或多个氨基酸残基进行改变,以降低非人抗体在被施用给人类受试者时的可能免疫原性,其中所述经改变的氨基酸残基要么对于抗体与其抗原的免疫特异性结合不是关键的,要么对氨基酸序列所做的改变是保守的改变以使得人源化抗体与抗原的结合并未显著差于非人抗体与该抗原的结合。
[0109]“人抗体”是这样的抗体,该抗体具有对应于由人或人细胞产生的抗体的氨基酸序列的氨基酸序列,或者来源于利用人抗体库或人抗体编码序列(例如,由人源得到或从头设计)的非人源的氨基酸序列。人抗体特别排除了人源化抗体。在一个实施方案中,所有可变结构域和恒定结构域均衍生自人免疫球蛋白序列(完全人抗体)。这些抗体可以以多种方式
制备,该方式包括通过用被基因修饰成表达衍生自人重链和/或轻链编码基因的抗体的小鼠的感兴趣的抗原进行免疫。
[0110]
用于降低或消除抗体和抗体片段的抗原性的方法是本领域已知的。当将抗体施用给人时,优选将抗体“人源化”以降低或消除在人中的抗原性。优选地,每种人源化抗体对抗原的亲和力与该每种人源化抗体所衍生自的非人源化小鼠抗体对抗原的亲和力相同或基本相同。
[0111]
在一种人源化方法中,产生其中小鼠免疫球蛋白恒定区被人免疫球蛋白恒定区替换的嵌合蛋白。参见,例如,morrison等人,1984,proc.nat.acad.sci.81:6851-6855,neuberger等人,1984,nature 312:604-608;美国专利第6,893,625号(robinson)、第5,500,362号(robinson)和第4,816,567号(cabilly)。
[0112]
在称为cdr接枝的方法中,轻链和重链可变区的cdr被接枝到另一个物种的框架中。例如,鼠类cdr可被接枝到人fr中。在一些实施方案中,所述抗体的轻链和重链可变区的cdr被接枝到人fr或共有人fr中。为了产生共有人fr,比对来自几个人重链或轻链氨基酸序列的fr以鉴定共有氨基酸序列。cdr接枝描述于美国专利第7,022,500号(queen)、第6,982,321号(winter)、第6,180,370号(queen)、第6,054,297号(carter)、第5,693,762号(queen)、第5,859,205号(adair)、第5,693,761号(queen)、第5,565,332号(hoogenboom)、第5,585,089号(queen);第5,530,101号(queen);jones等人(1986)n
ature 321:522-525;riechmann等人(1988)n
ature 332:323-327;verhoeyen等人(1988)s
cience 239:1534-1536;以及winter(1998)f
ebs lett 430:92-94。
[0113]
在称为“superhumanization
tm”的方法中,基于人cdr结构与待人源化的小鼠抗体结构的相似性,从人种系基因中选取人cdr序列。参见,例如,美国专利第6,881,557号(foote);和tan等人,2002,j.i
mmunol
.169:1119-1125.
[0114]
其他降低免疫原性的方法包括“重塑(reshaping)”、“超嵌合”和“镶面/表面重修(veneering/resurfacing)”。参见,例如,vaswami等人,1998,a
nnals o
f a
llergy
,a
sthma
,&i
mmunol
.81:105;roguska等人,1996,p
rot
.e
ngineer 9:895-904;和美国专利第6,072,035号(hardman)。在镶面/表面重修方法中,鼠抗体中表面可接近的氨基酸残基被在人抗体中相同位置处更频繁发现的氨基酸残基替换。这种类型的抗体表面重修描述于例如美国专利第5,639,641号(pedersen)中。
[0115]
另一种将小鼠抗体转化为适用于人类医学用途的形式的方法称为activmab
tm
技术(vaccinex,inc.,rochester,ny),其涉及用于在哺乳动物细胞中表达抗体的基于牛痘病毒的载体。可以产生高水平的igg重链和轻链组合多样性。参见,例如,美国专利第6,706,477号(zauderer);第6,800,442号(zauderer);和第6,872,518号(zauderer)。另一种将小鼠抗体转化为适用于人类使用的形式的方法是由kalobios pharmaceuticals,inc.(palo alto,ca)进行商业实践的技术。该技术涉及使用专有的人类“受体”文库来产生用于抗体选择的“表位聚焦(epitope focused)”文库。另一种将小鼠抗体修饰成适合人类医学用途的形式的方法是human engineering
tm
技术,该技术由xoma(us)llc商业化实施。参见,例如,国际(pct)公布第wo 93/11794号和美国专利第5,766,886号(studnicka)、第5,770,196号(studnicka)、第5,821,123号(studnicka)和第5,869,619号(studnicka)。
[0116]
包括任何上述方法在内的任何合适的方法都可用于降低或消除抗体的人免疫原
性。
[0117]
此外,可以在小鼠中产生完全人抗体。缺乏任何非人序列的完全人mab可以通过例如lonberg等人,nature 368:856-859,1994;fishwild等人,nature biotechnology 14:845-851,1996;和mendez等人,nature genetics 15:146-156,1997中引用的技术,由人免疫球蛋白转基因小鼠制备。完全人单克隆抗体还可以通过例如knappik等人,j.mol.biol.296:57-86,2000和krebs等人,j.i
mmunol
.m
eth
.254:67-84 2001)中引用的技术,由噬菌体展示文库制备和优化。
[0118]
在一些实施方案中,本文提供的抗体包含抗体片段。在一些实施方案中,本文提供的抗体由抗体片段组成。在一些实施方案中,本文提供的抗体实质上由抗体片段组成。在一些实施方案中,所述抗体片段是fv片段。在一些实施方案中,所述抗体片段是fab片段。在一些实施方案中,所述抗体片段是f(ab’)2片段。在一些实施方案中,所述抗体片段是fab’片段。在一些实施方案中,所述抗体片段是scfv(sfv)片段。在一些实施方案中,所述抗体片段是scfv-fc片段。在一些实施方案中,所述抗体片段是单结构域抗体的片段。
[0119]
本发明还包括编码所公开的多肽或抗体的多核苷酸。除非另有指示,特定的核酸序列还隐含地涵盖其保守修饰的变异体(包括但不限于简并密码子置换)和互补序列以及明确指示的序列。具体而言,简并密码子置换可通过生成其中一个或多个选定(或所有)密码子的第三位置被混合碱基和/或脱氧肌苷残基置换的序列来实现(batzer等人,nucleic acid res.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);rossolini等人,mol.cell.probes 8:91-98(1994))。
[0120]“保守修饰的变异体”适用于氨基酸和核酸序列。关于特定的核酸序列,“保守修饰的变异体”是指那些编码同一或实质上同一的氨基酸序列的核酸,或者在所述核酸不编码氨基酸序列的情况下,是指实质上同一的序列。由于遗传密码的简并性,大量功能上同一的核酸编码任何给定的蛋白质。例如,密码子gca、gcc、gcg和gcu都编码氨基酸丙氨酸。因此,在由密码子指定丙氨酸的每个位置处,可以将密码子改变为所描述的相应密码子中的任一种而不改变编码的多肽。此类核酸变异是“沉默变异”,它们是一类保守修饰的变异。本文中编码多肽的每种核酸序列还描述核酸的每种可能的沉默变异。本领域的普通技术人员将认识到,核酸中的每个密码子(除了通常是甲硫氨酸的唯一密码子的aug和通常是色氨酸的唯一密码子的tgg)都可被修饰以产生功能上同一的分子。因此,编码多肽的核酸的每个沉默变异隐含在每个描述的序列中。
[0121]
对于氨基酸序列,本领域的普通技术人员将认识到,针对核酸、肽、多肽或蛋白质序列的单独置换、缺失或添加(其改变、添加或删除所编码序列中的单一氨基酸或少量氨基酸)是"保守性修饰的变异体",其中所述改变将导致氨基酸缺失、氨基酸添加或氨基酸被化学上相似的氨基酸置换。提供功能上相似的氨基酸的保守置换表是本领域普通技术人员已知的。此类保守性修饰的变异体是对本文所述的多态性变异体、种间同源物和等位基因的补充,并且不排除多态性变异体、种间同源物和等位基因。
[0122]
提供功能上相似的氨基酸的保守置换表是本领域普通技术人员已知的。以下八个组每一组都含有彼此为保守性置换的氨基酸:1)丙氨酸(a)、甘氨酸(g);2)天冬氨酸(d)、谷氨酸(e);3)天冬酰胺(n)、谷氨酰胺(q);4)精氨酸(r)、赖氨酸(k);5)异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w);7)丝氨酸(s)、苏氨
酸(t);以及8)半胱氨酸(c)、甲硫氨酸(m)(参见,例如,creighton,proteins:structures and molecular properties(w h freeman&co.;第2版(1993年12月)。
[0123]
vh结构域
[0124]
在一些实施方案中,本文提供的抗体包含vh链,该vh链包含seq id no:7的序列。在一些实施方案中,本文提供的抗体包含vh链,该vh链由seq id no:7的序列组成。
[0125]
在一些实施方案中,本文提供的抗体包含vh链,该vh链包含与seq id no:7中提供的说明性vh序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的序列。在一些实施方案中,本文提供的抗体包含seq id no:7中提供的vh序列,具有至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0126]
vl结构域
[0127]
在一些实施方案中,本文提供的抗体包含vl链,该vl链包含seq id no:8的序列。
[0128]
在一些实施方案中,本文提供的抗体包含vl链,该vl链包含与seq id no:8中提供的说明性vl序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的序列。在一些实施方案中,本文提供的抗体包含seq id no:8中提供的vl序列,具有至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0129]
vh-vl组合
[0130]
在一些实施方案中,本文提供的抗体包含vh链和vl链,所述vh链包含seq id no:7的序列,所述vl链包含seq id no:8的序列。在一些实施方案中,本文提供的抗体包含vh链和vl链,所述vh链包含seq id no:7中提供的序列,具有至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸置换,并且所述vl链包含seq id no:8中提供的序列,具有至多1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0131]
cdr
[0132]
在一些实施方案中,本文提供的抗体包含一至三个选自seq id no:7的vh结构域的cdr。在一些实施方案中,本文提供的抗体包含二至三个选自seq id no:7的vh结构域的
cdr。在一些实施方案中,本文提供的抗体包含三个选自seq id no:7的vh结构域的cdr。
[0133]
在一些实施方案中,所述cdr是与seq id no:7的cdr-h1、cdr-h2或cdr-h3具有至少约50%、75%、80%、85%、90%或95%同一性的cdr。在一些实施方案中,所述cdr-h1是选自seq id no:7的vh结构域的cdr-h1,具有至多1、2、3、4或5个氨基酸置换。在一些实施方案中,所述cdr-h2是选自seq id no:7的vh结构域的cdr-h2,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些实施方案中,所述cdr-h3是选自seq id no:7的vh结构域的cdr-h3,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些实施方案中,所述cdr是与seq id no:8的cdr-l1、cdr-l2或cdr-l3具有至少约50%、75%、80%、85%、90%或95%同一性的cdr。在一些实施方案中,所述cdr-l1是选自seq id no:7的vh结构域的cdr-l1,具有至多1、2、3、4或5个氨基酸置换。在一些实施方案中,所述cdr-l2是选自seq id no:8的vh结构域的cdr-l2,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些实施方案中,所述cdr-l3是选自seq id no:8的vh结构域的cdr-l3,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0134]
在一些实施方案中,本文提供的抗体包含选自seq id no:3的cdr-h3。在一些方面,所述cdr-h3与seq id no:3的cdr-h3具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-h3是选自seq id no:3的cdr-h3,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0135]
在一些实施方案中,本文提供的抗体包含seq id no:2的cdr-h2。在一些方面,所述cdr-h2与seq id no:2的cdr-h2具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-h2是seq id no:2的cdr-h2,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0136]
在一些实施方案中,本文提供的抗体包含seq id no:1的cdr-h1。在一些方面,所述cdr-h1与seq id no:1的cdr-h1具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-h1是seq id no:1的cdr-h1,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得
到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0137]
在一些实施方案中,本文提供的抗体包含seq id no:3的cdr-h3和seq id no:2的cdr-h2。在一些实施方案中,本文提供的抗体包含seq id no:3的cdr-h3、seq id no:2的cdr-h2和seq id no:1的cdr-h1。在一些实施方案中,所述cdr-h3与seq id no:3的cdr-h3具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-h2与seq id no:2的cdr-h2具有至少约50%、75%、80%、85%、90%或95%的同一性,并且所述cdr-h1与seq id no:1的cdr-h1具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-h3是seq id no:3的cdr-h3,具有至多1、2、3、4、5、6、7或8个氨基酸置换;所述cdr-h2是seq id no:2的cdr-h2,具有至多1、2、3、4、5、6、7或8个氨基酸置换;并且所述cdr-h1是seq id no:1的cdr-h1,具有至多1、2、3、4或5个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0138]
在一些实施方案中,本文提供的抗体包含seq id no:6的cdr-l3。在一些方面,所述cdr-l3与seq id no:6的cdr-l3具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-l3是seq id no:6的cdr-l3,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0139]
在一些实施方案中,本文提供的抗体包含seq id no:5的cdr-l2。在一些方面,所述cdr-l2与seq id no:5的cdr-l2具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-l2是seq id no:5的cdr-l2,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0140]
在一些实施方案中,本文提供的抗体包含seq id no:4的cdr-l1。在一些方面,所述cdr-l1与seq id no:4的cdr-l1具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-l1是seq id no:4的cdr-l1,具有至多1、2、3、4、5、6、7或8个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0141]
在一些实施方案中,本文提供的抗体包含seq id no:6的cdr-l3和seq id no:5的cdr-l2。在一些实施方案中,本文提供的抗体包含seq id no:6的cdr-l3、seq id no:5的cdr-l2和seq id no:4的cdr-l1。在一些实施方案中,所述cdr-l3与seq id no:6的cdr-l3具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-l2与seq id no:5的cdr-l2具有至少约50%、75%、80%、85%、90%或95%的同一性,并且所述cdr-l1与seq id no:4的cdr-l1具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-l3是seq id no:6的cdr-l3,具有至多1、2、3、4或5个氨基酸置换;所述cdr-l2是seq id no:5的cdr-l2,具有至多1、2、3或4个氨基酸置换;并且所述cdr-l1是seq id no:4的cdr-l1,具有至多1、2、3、4、5或6个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0142]
在一些实施方案中,本文提供的抗体包含seq id no:3的cdr-h3、seq id no:2的cdr-h2、seq id no:1的cdr-h1、seq id no:6的cdr-l3、seq id no:5的cdr-l2和seq id no:4的cdr-l1。在一些实施方案中,所述cdr-h3与seq id no:3的cdr-h3具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-h2与seq id no:2的cdr-h2具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-h1与seq id no:1的cdr-h1具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-l3与seq id no:6的cdr-l3具有至少约50%、75%、80%、85%、90%或95%的同一性,所述cdr-l2与seq id no:5的cdr-l2具有至少约50%、75%、80%、85%、90%或95%的同一性,并且所述cdr-l1与seq id no:4的cdr-l1具有至少约50%、75%、80%、85%、90%或95%的同一性。在一些实施方案中,所述cdr-h3是seq id no:3的cdr-h3,具有至多1、2、3、4、5、6、7或8个氨基酸置换;所述cdr-h2是seq id no:2的cdr-h2,具有至多1、2、3、4、5、6、7或8个氨基酸置换;所述cdr-h1是seq id no:1的cdr-h1,具有最多1、2、3、4或5个氨基酸置换;所述cdr-l3是seq id no:6的cdr-l3,具有至多1、2、3、4或5个氨基酸置换;所述cdr-l2是seq id no:5的cdr-l2,具有最多1、2、3或4个氨基酸置换;并且所述cdr-l1是seq id no:4的cdr-l1,具有至多1、2、3、4、5或6个氨基酸置换。在一些方面,氨基酸置换是保守性氨基酸置换。在一些实施方案中,本段中描述的抗体在本文中称为“变异体”。在一些实施方案中,此类变异体由本文提供的序列,例如,通过亲和力成熟、定点诱变、随机诱变或本领域已知或本文描述的任何其他方法衍生得到。在一些实施方案中,此类变异体并非衍生自本文提供的序列,并且可以例如根据本文提供的用于获得抗体的方法从头分离。
[0143]
在一些实施方案中,本文提供的抗体包含seq id no:1的cdr-h1、seq id no:2的cdr-h2、seq id no:3的cdr-h3、seq id no:4的cdr-l1、seq id no:5的cdr-l2和seq id no:6的cdr-l1。
[0144]
fc区
[0145]
本文的术语“fc结构域”或“fc区”被用于定义免疫球蛋白重链的c末端区域,其含有所述恒定区的至少一部分。该术语包括天然序列fc区和变异体fc区。除非本文另外指明,fc区或恒定区中的氨基酸残基的编号是根据eu编号系统(也称为eu索引),如kabat等人,
sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md,1991中所述。如本文所用的二聚fc的“fc多肽”是指形成二聚fc结构域的两种多肽中的一种,即包含免疫球蛋白重链的c末端恒定区、能够稳定自缔合的多肽。例如,二聚igg fc的fc多肽包含igg ch2和igg ch3恒定结构域序列。fc可以属于iga、igd、ige、igg和igm类,并且这些类别中的几种可以进一步划分成亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。
[0146]
术语“fc受体”和“fcr”被用于描述与抗体fc区结合的受体。例如,fcr可以是天然序列人fcr。通常,fcr是结合igg抗体的受体(γ受体),并且包括fcγri、fcγrii和fcγriii亚类的受体,包括这些受体的等位基因变异体和可变剪接形式。fcγrii受体包括fcγriia(“活化受体”)和fcγriib(“抑制受体”),该fcγriia和fcγriib具有相似的氨基酸序列,该氨基酸序列主要差异在于它们的细胞质结构域。其他同种型的免疫球蛋白也可以被某些fcr结合(参见,例如,janeway等人,immuno biology:the immunosystem in health and disease,(elsevier science ltd.,ny)(第4版,1999年))。激活受体fcγriia在其细胞质结构域中含有基于免疫受体酪氨酸的活化基序(itam)。抑制受体fcγriib在其细胞质结构域中含有基于免疫受体酪氨酸的抑制基序(itim)(综述于annu.rev.immunol.15:203-234(1997年))。fcr综述于ravetch and kinet,annu.rev.immunol 9:457-92(1991)、capel等人,immunomethods 4:25-34(1994)和de haas等人,j.lab.clin.med.126:330-41(1995)中。本文中的术语“fcr”涵盖了其他fcr,包括未来要确定的那些fcr。该术语还包括新生儿受体fcrn,该受体负责将母体igg转移至胎儿(guyer等人,j.immunol.117:587(1976);和kim等人,j.immunol.24:249(1994))。
[0147]
在一些实施方案中,所述抗体是igg1抗体。
[0148]
在一些实施方案中,所述抗体是igg3抗体。
[0149]
在一些实施方案中,所述抗体是igg2抗体。
[0150]
在一些实施方案中,所述抗体是igg4抗体。
[0151]
ch2结构域中的修饰可以影响fcr与fc的结合。fc区中的许多用于选择性地改变fc对不同fc-γ(fcγ)受体的亲和力的氨基酸修饰在本领域是已知的。在一个实施方案中,fc包含一种或多种用于促进fc-γ受体的选择性结合的修饰。
[0152]
下面列出了改变fcr与fc结合的示例性突变:
[0153]
s298a/e333a/k334a,s298a/e333a/k334a/k326a(lu y,vernes jm,chiang n,等人,j immunol methods.2011年2月28日;365(1-2):132-41);
[0154]
f243l/r292p/y300l/v305i/p396l,f243l/r292p/y300l/l235v/p396l(stavenhagen jb,gorlatov s,tuaillon n,等人,cancer res.2007年9月15日;67(18):8882-90;nordstrom jl,gorlatov s,zhang w,等人,breast cancer res.2011年11月30日;13(6):r123);
[0155]
f243l(stewart r,thom g,levens m,等人,protein eng des sel.2011年9月;24(9):671-8.),s298a/e333a/k334a(shields rl,namenuk ak,hong k,等人,j biol chem.2001年3月2日;276(9):6591-604);
[0156]
s239d/i332e/a330l,s239d/i332e(lazar ga,dang w,karki s,等人,proc natl acad sci u s a.2006年3月14日;103(11):4005-10);
[0157]
s239d/s267e,s267e/l328f(chu sy,vostiar i,karki s,等人,mol immunol.2008年9月;45(15):3926-33);
[0158]
s239d/d265s/s298a/i332e,s239e/s298a/k326a/a327h,g237f/s298a/a330l/i332e,s239d/i332e/s298a,s239d/k326e/a330l/i332e/s298a,g236a/s239d/d270l/i332e,s239e/s267e/h268d,l234f/s267e/n325l,g237f/v266l/s267d以及通过引用方式并入本文的wo2011/120134和wo2011/120135中列出的其他突变。therapeutic antibody engineering(william r.strohl和lila m.strohl,woodhead publishing series in biomedicine no 11,isbn 1 907568 37 9,2012年10月)在第283页列出了突变。
[0159]
在一些实施方案中,本文所述的抗体包括用于提高其介导效应器功能的能力的修饰。此类修饰在本领域中是已知的并且包括去岩藻糖基化(afucosylation),或工程改造fc对活化受体(主要是fcgr3a)的亲和力(针对adcc)和fc对c1q的亲和力(针对cdc)。下表b总结了文献中报告的效应器功能工程改造的各种设计。
[0160]
在某些实施方案中,本文提供的抗体包含这样的fc区,该的fc区具有一个或多个提高adcc的氨基酸置换,诸如位于该fc区的位置298、333和/或334中的一者或多者处的置换。在一些实施方案中,本文提供的抗体包含具有位于位置239、332和330中的一者或多者处的氨基酸置换的fc区,如lazar等人,proc.natl.acad.sci.usa,2006,103:4005-4010中所述,该文献通过引用方式以其整体并入。
[0161]
在一些实施方案中,本文提供的抗体包含一个或多个提高或减少c1q结合和/或cdc的改变。参见美国专利第6,194,551号、wo99/51642和idusogie等人,j.immunol.,2000,164:4178-4184;其中每一者都通过引用方式以其整体并入本文。
[0162]
因此,在一个实施方案中,本文所述的抗体可以包括二聚fc,该二聚fc包含一个或多个如表b中所指出的赋予改进的效应器功能的氨基酸修饰。在另一个实施方案中,所述抗体可以被去岩藻糖基化以提高效应器功能。
[0163]
表b:ch2结构域和效应器功能工程改造
[0164]
[0165][0166]
在不改变氨基酸序列的情况下产生在fc糖基化位点(asn 297eu编号)上具有很少或没有岩藻糖的抗体的方法是本领域众所周知的。技术(probiogen ag)基于引入将岩藻糖生物合成的细胞途径转向用于抗体生产的细胞的酶的基因。这防止产生抗体的细胞将“岩藻糖”添加到n连接的抗体碳水化合物部分(von horsten等人(2010)glycobiology.2010年12月;20(12):1607-18.)。能够产生脱岩藻糖基化(defucosylated)抗体的细胞系的实例包括稳定过表达细菌氧化还原酶gdp-6-脱氧-d-来苏-4-己糖还原酶(rmd)的cho-dg44(参见henning von horsten等人,glycobiol 2010,20:1607-1618)或缺乏蛋白质岩藻糖基化的lec13 cho细胞(参见ripka等人,arch.biochem.biophys.,1986,249:533-545;美国专利公开号2003/0157108;wo 2004/056312;其每一者都通过引用方式以其整体并入本文)和诸如α-1,6-岩藻糖基转移酶基因或fut8敲除cho细胞的敲除细胞系(参见yamane-ohnuki等人,biotech.bioeng.,2004,87:614-622;等人,biotechnol.bioeng.,2006,94:680-688和wo 2003/085107;其中每一者都通过引用方式以其整体并入本文)。另一种用于获得具有降低的岩藻糖基化水平的抗体的方法可见于美国专利8,409,572,该专利教导了针对细胞系在抗体上产生较低岩藻糖基化水平的能力来选择细胞系用于抗体生产。
[0167]
抗体可以是完全去岩藻糖基化的(意味着它们不含可检测到的岩藻糖),也可以是部分去岩藻糖基化的,意味着分离的抗体含有的岩藻糖量为正常情况下对哺乳动物表达系统产生的类似抗体检测到的岩藻糖量的少于95%、少于85%、少于75%、少于65%、少于55%、少于45%、少于35%、少于25%、少于15%或少于5%。
[0168]
在一些方面,本文提供的抗体包含在位置asn 297处具有与天然存在的igg1结构域相比降低的岩藻糖含量的igg1结构域。已知此类fc结构域具有改进的adcc。参见shields等人,j.biol.chem.,2002,277:26733-26740,其通过引用方式以其整体并入。在一些方面,此类抗体在位置asn 297处不包含任何岩藻糖。岩藻糖的量可以使用任何合适的方法,例如如通过引用整体并入的wo 2008/077546中所述的方法来确定。
[0169]
在一些实施方案中,本文提供的抗体包含二分型寡糖,诸如附接至被glcnac二分的抗体fc区的双天线寡糖(biantennary oligosaccharide)。此类抗体变异体可以具有降低的岩藻糖基化和/或改进的adcc功能。此类抗体变异体的实例描述于例如wo2003/011878、美国专利第6,602,684号和美国专利公布号2005/0123546;其中每一者都通过引用方式以其整体并入本文。
[0170]
其他可掺入本文提供的抗体中的示例性糖基化变异体描述于例如美国专利公布
号2003/0157108、2004/0093621、2003/0157108、2003/0115614、2002/0164328、2004/0093621、2004/0132140、2004/0110704、2004/0110282、2004/0109865;国际专利公布号2000/61739、2001/29246、2003/085119、2003/084570、2005/035586、2005/035778;2005/053742、2002/031140;okazaki等人,j.mol.biol.,2004,336:1239-1249;以及yamane-ohnuki等人,biotech.bioeng.,2004,87:614-622;其中的每一者都通过引用以其整体并入本文。
[0171]
在一些实施方案中,本文提供的抗体包含这样的fc区,该fc区在附接至该fc区的寡糖中具有至少一个半乳糖残基。此类抗体变异体可以具有改进的cdc功能。此类抗体变异体的实例描述于例如wo 1997/30087、wo 1998/58964和wo 1999/22764中;其中的每一者都通过引用方式以其整体并入。
[0172]
能够产生脱岩藻糖基化抗体的细胞系的实例包括稳定过表达细菌氧化还原酶gdp-6-脱氧-d-来苏-4-己糖还原酶(rmd)的cho-dg44(参见henning von horsten等人,glycobiol 2010,20:1607-1618)或缺乏蛋白质岩藻糖基化的lec13 cho细胞(参见ripka等人,arch.biochem.biophys.,1986,249:533-545;美国专利公布号2003/0157108;wo 2004/056312;其中的每一者都通过引用方式以其整体并入本文)和诸如α-1,6-岩藻糖基转移酶基因或fut8敲除cho细胞的敲除细胞系(参见yamane-ohnuki等人,biotech.bioeng.,2004,87:614-622;等人,biotechnol.bioeng.,2006,94:680-688和wo 2003/085107;其中每一者都通过引用方式以其整体并入本文)。
[0173]
在一些实施方案中,所述抗体具有抗体依赖性细胞吞噬(adcp)活性。当抗体与致病或致瘤靶细胞表面上的抗原结合时,可以发生adcp。包括单核细胞和巨噬细胞在内的细胞表面携带有fc受体的吞噬细胞识别并结合与靶细胞结合的抗体的fc区。在fc受体与抗体结合的靶细胞结合后,可以启动靶细胞的吞噬作用。adcp可以被认为是adcc的一种形式。
[0174]
在一些实施方案中,所述抗体能够形成免疫复合体。例如,免疫复合体可以是被抗体覆盖的肿瘤细胞。
[0175]
在一些实施方案中,所述抗体是单克隆抗体。
[0176]
在一些实施方案中,所述抗体是多克隆抗体。
[0177]
在一些实施方案中,所述抗体是由杂交瘤产生。在其他实施方案中,所述抗体由经工程改造成表达所需可变结构域和恒定结构域的重组细胞产生。
[0178]
在一些实施方案中,所述抗体可以是单链抗体或其他保留抗原特异性和下部铰链区的抗体衍生物或其变异体。
[0179]
在一些实施方案中,所述抗体可以是多功能抗体、重组抗体、人抗体、人源化抗体、它们的片段或变异体。在特定实施方案中,抗体片段或其衍生物选自fab片段、fab'2片段、cdr和scfv。
[0180]
在一些实施方案中,所述抗体对表面抗原诸如amhr2蛋白具有特异性。在一些实施方案中,治疗性抗体对肿瘤抗原(例如,由肿瘤细胞特异性表达的分子)具有特异性。在特定实施方案中,治疗性抗体可具有人或非人灵长类动物igg1或igg3 fc部分。
[0181]
结合
[0182]
关于抗体与靶分子的结合,术语“结合”特定抗原(例如多肽靶标)或特定抗原上的表位、“特异性结合”特定抗原(例如多肽靶标)或特定抗原上的表位、“特异性结合至”特定
抗原(例如多肽靶标)或特定抗原上的表位、“对特定抗原(例如多肽靶标)或特定抗原上的表位有特异性”、“选择性结合特定抗原(例如多肽靶标)或特定抗原上的表位”以及“对特定抗原(例如多肽靶标)或特定抗原上的表位有选择性”意指与非特异性或非选择性相互作用(例如,与非靶标分子)显著不同的结合。特异性结合可以例如通过测量与靶分子的结合并将其和与非靶分子的结合相比较来测量。特异性结合也可以通过与模拟在靶分子上识别的表位的对照分子的竞争来确定。在这种情况下,如果抗体与靶分子的结合被对照分子竞争性地抑制,则指示特异性结合。
[0183]“亲和力”是指分子(例如,抗体)的单一结合位点与其结合伴侣(例如,抗原或表位)之间的全部非共价相互作用总和的强度。除非另外说明,本文所用的“亲和力”是指反映结合对的成员(例如,抗体和抗原或表位)之间1:1相互作用的内在结合亲和力。分子x对其伴侣y的亲和力可用解离平衡常数(kd)来表示。有助于解离平衡常数的动力学组分在下文中更详细地描述。亲和力可通过本领域已知的常用方法测量,该方法包括本文所述的那些方法,诸如表面等离子体共振(spr)技术(例如)或生物层干涉仪(例如)。
[0184]
如本文所用的术语“k
d”(sec-1
)是指特定抗体-抗原相互作用的解离速率常数。该值也称为k
off
值。
[0185]
如本文所用的术语“k
a”(m-1
×
sec-1
)是指特定抗体-抗原相互作用的解离速率常数。该值也称为k
on
值。
[0186]
如本文所用,术语“k
d”(m)是指特定抗体-抗原相互作用的解离平衡常数。kd=kd/ka。在一些实施方案中,所述抗体的亲和力是根据此类抗体与其抗原之间相互作用的kd来描述的。为清楚起见,如本领域已知,较小的kd值指示较高的亲和力相互作用,而较大的kd值指示较低的亲和力相互作用。
[0187]
如本文所用的术语“k
a”(m-1
)是指特定抗体-抗原相互作用的解离平衡常数。ka=ka/kd。
[0188]
在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的小于或等于约0.001、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.95、2、3、4、5、6、7、8、9或10
×
10-9
m的kd结合人amhr2。在一些实施方案中,如通过biacore测定法所测量,本文提供的抗体的kd为约0.001-0.01、0.01-0.1、0.01-0.05、0.05-0.1、0.1-0.5、0.5-1、0.25-0.75、0.25-0.5、0.5-0.75、0.75-1、0.75-2、1.1-1.2、1.2-1.3、1.3-1.4、1.4-1.5、1.5-1.6、1.6-1.7、1.7-1.8、1.8-1.9、1.9-2、1-2,1-5、2-7、3-8、3-5、4-6、5-7、6-8、7-9、7-10或5-10
×
10-9
m。
[0189]
在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的小于或等于约2、1.98、1.95、1.9、1.85、1.8、1.75、1.7、1.65、1.6、1.55、1.50、1.45或1.4
×
10-9
m或更小的kd结合人amhr2。在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的介于1.9-1.8、1.8-1.7、1.7-1.6、1.6-1.5或1.9-1.5
×
10-9
m之间的kd结合人amhr2。在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的小于或等于约10、9.56、9.5、9.0、8.88、8.84、8.5、8、7.5、7.32、7、6.5、6、5.5、5、4.5、4、3.5、3、2.5、2、1.5或1
×
10-4
(1/s)或更小的kd结合人amhr2。在一些实施方案中,本文提供的抗体以如通过biacore测定
法所测量的介于7-10、7-8、8-9、9-10、7-7.5、7.5-8、8.-8.5、8.5-9、9-9.5,或9.5-10
×
10-4
(1/s)之间的kd结合人amhr2。在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的大于或等于约4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、45、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6、7、8、9或10
×
105(1/ms)或更大的ka结合人amhr2。在一些实施方案中,本文提供的抗体以如通过biacore测定法所测量的介于4-7、4-4.5、4.5-5、5-5.5、5.5-6、6-6.5或6.5-7、7-8、8-9或9-10
×
105(1/ms)之间的ka结合amhr2。
[0190]
为了筛选与感兴趣抗体(例如,amhr2)所结合的靶抗原上的表位结合的抗体,可以执行常规交叉阻断测定,诸如antibodies,a laboratory manual,cold spring harbor laboratory,编者harlow and david lane(1988)中所述的交叉阻断测定。替代地,或另外地,表位作图可以通过本领域已知的方法进行。
[0191]
当在本文中在两种或更多种抗体的背景下使用时,术语“与......竞争”或“与......交叉竞争”指示两种或更多种抗体竞争与抗原(例如,amhr2)的结合。在一个示例性测定中,将amhr2或amhr2-胞外结构域(amhr2-ed)包被在表面上并且与第一amhr2抗体接触,之后添加第二amhr2抗体。在另一个示例性测定中,将第一amhr2抗体包被在表面上并且与amhr2或amhr2-ed接触,然后添加第二amhr2抗体。如果在任一测定中第一amhr2抗体的存在降低第二amhr2抗体的结合,则该抗体相互竞争。术语“与......竞争”还包括这样的抗体组合,其中一种抗体降低了另一种抗体的结合,但当该抗体以相反顺序添加时未观察到竞争。然而,在一些实施方案中,所述第一抗体和第二抗体抑制彼此的结合,无论添加它们的顺序如何。在一些实施方案中,一种抗体使另一种抗体与其抗原的结合减少了至少25%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%或者至少95%。熟练的技术人员可以基于抗体对amhr2的亲和力和抗体的效价来选择竞争测定中使用的抗体浓度。该定义中描述的测定是说明性的,技术人员可以利用任何合适的测定来确定抗体是否相互竞争。合适的测定描述于例如cox等人,“immunoassay methods,”,见assay guidance manual[internet],更新日期2014年12月24日(www.ncbi.nlm.nih.gov/books/nbk92434/;访问日期2015年9月29日);silman等人,cytometry,2001,44:30-37;以及finco等人,j.pharm.biomed.anal.,2011,54:351-358;其中的每一者都通过引用方式以其整体并入本文。
[0192]
抗体之间的竞争可以通过其中测试中的抗体抑制或阻断参考抗体与共同抗原的特异性结合的测定法(参见,例如,junghans等人,cancer res.50:1495,1990;fendly等人,cancer research 50:1550-1558;us 6,949,245)来确定。如果如在竞争性结合测定中所测量,过量的测试抗体(例如,至少2x、5x、10x、20x或100x)抑制或阻断参考抗体的结合达例如至少50%、60%、70%、75%、80%、85%、90%、95%或99%,则该测试抗体与参考抗体竞争。通过竞争测定鉴定的抗体(竞争抗体)包括结合至与参考抗体相同表位的抗体以及结合至与参考抗体所结合表位足够接近从而发生空间位阻的临近表位的抗体。例如,可以鉴定与本文所述的第一抗体竞争与amhr2的结合的第二竞争抗体。在某些情况下,如在竞争性结合测定中所测量,第二抗体可以阻断或抑制第一抗体的结合达例如至少50%、60%、70%、75%、80%、85%、90%、95%或99%。在某些情况下,第二抗体可以置换第一抗体达大于50%、60%、70%、75%、80%、85%、90%、95%或者99%。
[0193]
功能
[0194]
在一些实施方案中,所述抗体诱导程序性细胞死亡。在一些实施方案中,所述程序性细胞死亡是细胞凋亡。在一些实施方案中,所述程序性细胞死亡是由半胱天冬酶-3介导的。在一些实施方案中,所述细胞凋亡是由半胱天冬酶-3介导的。在一些实施方案中,所述抗体诱导细胞中parp-1的切割。在一些实施方案中,所述抗体被所述细胞内化。
[0195]
程序性细胞死亡是细胞的死亡,并且是由细胞内程序介导。细胞凋亡和自噬是由细胞启动的程序性细胞死亡的形式。坏死是一种由外部因素诸如外伤或感染引起的细胞死亡的形式。细胞凋亡是通过内在途径或外在途径通过半胱天冬酶依赖性通路启动。内在细胞凋亡通常由胞外或胞内微环境的扰动引发。外在细胞凋亡通常通过基于受体的检测由胞外微环境的扰动来启动。这两种通路都由半胱天冬酶-3(casp3)加速。包括程序性细胞死亡在内的细胞死亡的概述提供于galluzzi l等人,cell death&differentiation第25卷,第486
–
541页(2018)中,其通过引用方式以其整体并入本文。
[0196]
在一些实施方案中,所述抗体具有抗体依赖性细胞细胞毒性(adcc)活性。当抗体结合至致病或致瘤靶细胞表面上的抗原时,可以发生adcc。细胞表面携带有fcγ受体(fcγr或fcgr)的效应细胞(包括细胞毒性t细胞、自然杀伤(nk)细胞、巨噬细胞、中性粒细胞、嗜酸性粒细胞、树突状细胞或单核细胞)识别并结合与靶细胞结合的抗体的fc区。此种结合可以触发导致细胞死亡的细胞内信号转导通路的激活。在特定实施方案中,所述抗体的免疫球蛋白fc区亚型(同种型)包括人igg1和igg3。如本文所用,adcc是指细胞介导的反应,其中表达fc受体(fcr)的非特异性细胞毒性细胞(例如自然杀伤(nk)细胞、中性粒细胞和巨噬细胞)识别靶细胞上的结合抗体并且随后导致靶细胞裂解。介导adcc的主要细胞(nk细胞)仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。造血细胞上的fcr表达汇总于ravetch和kinet,annu.rev.immunol 9:457-92(1991)第464页的表3中。为评估感兴趣分子的adcc活性,可以执行体外adcc测定,诸如美国专利第5,500,362号或第5,821,337号中所述的体外adcc测定。对于此类测定有用的效应细胞包括外周血单核细胞(pbmc)和自然杀伤(nk)细胞。替代地,或者另外地,感兴趣分子的adcc活性可以体内评估,例如,例如在诸如clynes等人,proc.natl.acad.sci.(usa)95:652-656(1998)中公开的动物模型中评估。
[0197]
在一些实施方案中,所述抗体具有补体依赖性细胞毒性(cdc)活性。抗体诱导的cdc通过经典补体级联蛋白介导,并由补体蛋白clq与抗体的结合触发。与clq结合的抗体fc区可以诱导补体级联的活化。在特定实施方案中,所述抗体的免疫球蛋白fc区亚型(同种型)包括人igg1和igg3。如本文所用,cdc是指分子在补体存在下裂解靶标的能力。补体活化途径是由补体系统的第一组分(c1q)结合到与同源抗原复合的分子(例如多肽(例如,抗体))来启动。为了评估补体活化,可以执行cdc测定,例如如gazzano-santoro等人,j.immunol.methods 202:163(1996)中所述的cdc测定。
[0198]
在一些实施方案中,所述抗体是耗尽性抗体(depleting antibody)。耗尽性抗体是一种在接触后通过抗体与分子的其他免疫细胞相互作用来使表达amhr2的癌细胞死伤的抗体。例如,抗体在与携带amhr2蛋白的细胞结合时,可以与补体蛋白接合(engage)并且诱导补体依赖性细胞裂解。抗体在与携带amhr2蛋白的细胞结合时,还可以触发携带fc受体的相邻细胞通过抗体依赖性细胞毒性(adcc)使它们死伤。
[0199]
在一些实施方案中,所述抗体是激动性抗体。在激动性抗体结合细胞上表达的amhr2蛋白后,该激动性抗体可以诱导(例如,增加)表达amhr2的细胞的一种或多种活性或
功能。激动性抗体可以结合至表达amhr2的细胞并且激活该表达amhr2的细胞,从而导致细胞增殖发生变化或改变抗原呈递能力。激动性抗体可以结合至表达amhr2的细胞并且激活该表达amhr2的细胞,从而触发导致改变的细胞生长或凋亡的胞内信号转导通路。在一些实施方案中,抗-amhr2抗体与amhr2的结合可以诱导细胞周期停滞和程序性细胞死亡。
[0200]
在一些实施方案中,所述抗体是拮抗性抗体。在拮抗性抗体结合细胞上表达的trem2蛋白后,该拮抗性抗体可以阻断(例如,降低)表达amhr2的细胞的一种或多种活性或功能。例如,拮抗性抗体可以结合至一种或多种表达amhr2的细胞蛋白并且阻断配体与该一种或多种表达amhr2的细胞蛋白的结合,从而阻止细胞的分化和增殖或者改变抗原呈递能力。拮抗性抗体可以结合至amhr2蛋白并且阻止amhr2蛋白的配体对amhr2蛋白的活化,从而改变有助于细胞生长和存活的细胞内信号转导通路。
[0201]
在一些实施方案中,抗-amhr2抗体是受体配体阻断抗体。受体阻断抗体与amhr2的胞外结构域结合并且阻断同源amhr2配体amh的结合。在一些实施方案中,配体结合的阻断可以阻止amhr2信号转导通路的活化。
[0202]
在一个实施方案中,与靶标结合的抗-amhr2抗体负责引起该抗体所结合至的癌细胞的体内耗尽。在一些实施方案中,由聚集抗体诱导的效应蛋白可以触发各种各样的反应,该反应包括炎性细胞因子的释放、抗原产生的调节、内吞作用或细胞死伤。在一个实施方案中,所述抗体能够在体内募集和激活补体(cdc)或介导抗体依赖性细胞细胞毒性(adcc),或者通过体内结合fc受体来介导吞噬作用(adcp)。该抗体还可以通过在结合后诱导amhr2+癌细胞的凋亡或坏死来耗尽amhr2+癌细胞。
[0203]
iii.疫苗、佐剂和制剂
[0204]
在另一个方面,本文提供了组合物,例如,包含amhr2胞外结构域多肽的组合物,该组合物诱导包含1型和17型t细胞的免疫反应,同时诱导有限的毒性或不诱导毒性。
[0205]
介导适应性免疫反应的t细胞根据其细胞因子谱分为亚组。1型促炎性t细胞产生ifnγ并且介导针对病毒和细菌感染的免疫,而2型调节性t细胞产生白细胞介素(il)-4、il-5和il-13并且介导针对寄生虫感染的体液免疫。最近的研究确定了产生il-17的17型促炎性t细胞,其为一种独特的亚型,在炎症中也起着重要作用。需要1型和17型t细胞谱系二者来诱导针对自身蛋白的优化组织损伤(steinman等人,(2007)nat med 13:139-145;luger等人,(2008)j exp med 205:799-810)。
[0206]
抗癌疫苗被设计成刺激免疫系统攻击癌细胞。这些疫苗通常包括由癌细胞优先表达的抗原(“肿瘤相关抗原”)。目前大多数临床疫苗制剂诱导促炎性1型免疫,但很少(如果有的话)诱导17型免疫。本发明涵盖以下认识:许多当前临床疫苗制剂是无效的,因为它们不会引发1型和17型免疫反应。根据本发明,所提供的组合物诱导包含1型和17型促炎性t细胞的免疫反应。此外,本发明公开的组合物在被注射到动物模型中时诱导有限的毒性或不诱导毒性,表明它们适合人类临床使用。
[0207]
本发明涵盖诱导可有效抑制和/或阻止癌症生长的适应性免疫反应的疫苗制剂。在一些实施方案中,所述癌症是卵巢癌。本发明公开的组合物包含如本文进一步描述的amhr2胞外结构域多肽抗原和佐剂组分。在一些实施方案中,所述组合物进一步包含抗-amhr2抗体。因此,本发明公开的疫苗制剂、组合物和方法可用于治疗和/或预防卵巢癌。
[0208]
如本文所述,本公开涉及诱导用于抑制诸如卵巢癌的癌症生长的适应性免疫反应
(例如,1型和17型t细胞)的免疫原/佐剂组合。在一些方面,所述组合物包含amhr2胞外结构域多肽和酵母聚糖。在一些方面,所述组合物包含amhr2胞外结构域多肽和montanide
tm
。在一些方面,所述组合物包含amhr2胞外结构域多肽、酵母聚糖和montanide
tm
。本公开的amhr2胞外结构域与酵母聚糖和/或montanide
tm
的组合诱导与有效肿瘤免疫相关的高频率的1型/17型t细胞,而不会诱导与用cfa(“金标准”佐剂)进行的疫苗接种相关的未解决的肉芽肿。因此,用amhr2胞外结构域与酵母聚糖和/或montanide
tm
的组合进行的疫苗接种提供了一种用于提供对抗人类卵巢癌生长的安全有效免疫的独特方式。在一些实施方案中,所述可代谢的油包括可生物降解的油。例如,所述可生物降解的油可以是肉豆蔻酸异丙酯、角鲨烯油、角鲨烷油、植物油或它们的组合。在一些实施方案中,所述可生物降解的油是植物油,诸如,例如选自由杏仁油、蓖麻油、大风子油、椰子油、玉米油、棉籽油、橄榄油、花生油、桃仁油、红花油和大豆油组成的组的植物油。
[0209]
在一些实施方案中,所述可代谢的油是药物级油。
[0210]
在一些实施方案中,所述组合物进一步包含表面活性剂,例如二缩甘露醇单油酸酯、异二缩甘露醇单油酸酯或它们的组合。在一些实施方案中,所述表面活性剂包含二缩甘露醇单油酸酯。例如,所述组合物可以包含montanide tm,诸如montanide tm isa 51vg。
[0211]
在一些实施方案中,所述组合物是水和油的乳液,例如油包水型乳液。
[0212]
在一些实施方案中,所述抗原包括多肽抗原。在一些实施方案中,所述多肽抗原是退休的(retired)自身抗原。在一些实施方案中,所述抗原包含amhr2胞外结构域多肽。
[0213]
碳水化合物
[0214]
在一些实施方案中,碳水化合物包括多糖,例如,选自由甲壳素、右旋糖酐、葡聚糖、香菇多糖、甘露聚糖以及它们的组合组成的组的多糖。
[0215]
在一些实施方案中,所述组合物包括多糖混合物,例如,包含至少三种多糖的混合物。
[0216]
在一些实施方案中,所述多糖或多糖混合物中的每种多糖选自由甲壳素、右旋糖酐、葡聚糖、香菇多糖、甘露聚糖以及它们的组合组成的组。
[0217]
在一些实施方案中,所述多糖或多糖混合物包含葡聚糖,例如,β-葡聚糖,诸如但不限于,1-3β-葡聚糖。在一些实施方案中,所述组合物中至少50%的碳水化合物是β-葡聚糖。
[0218]
在一些实施方案中,所述多糖混合物包括甲壳素、葡聚糖和甘露聚糖的混合物。
[0219]
在一些实施方案中,所述碳水化合物结合至模式识别受体,例如,tlr2和/或dectin-1。
[0220]
例如,在一些实施方案中,所述组合物包含酵母聚糖。酵母聚糖是来自酿酒酵母的面包酵母提取物的粗制细胞壁组分混合物,其主要由β-葡聚糖(50-57%)、甘露聚糖和甲壳素组成。美国食品药品管理局(fda)已将这些源自酵母提取物的β-葡聚糖评为gras(“公认安全”)等级。酵母酵母聚糖充当β(1,3)葡聚糖的丰富来源。酵母衍生的β(1,3)葡聚糖似乎部分地通过作为机体对抗真菌感染的基本防御的一部分的激活先天免疫系统来刺激免疫系统(huang等人,(2013)clin vaccine immunol 20:1585-1591)。酵母β(1,3)葡聚糖是一种主要由β(1-3)连接的葡萄糖分子组成的多糖,该β(1-3)连接的葡萄糖分子具有通过β(1-6)键联连接的周期性β(1-3)分支,并且酵母β(1,3)葡聚糖更正式地被称为聚-(1-6)-β-吡
喃葡萄糖基-(1-3)-β-d-吡喃葡萄糖。
[0221]
可代谢的油
[0222]
如本文所用,短语“可代谢的油”意指这样的油,该油在被引入到生物体中时,(1)可在更大程度上被生物体分解或从生物体中消除;(2)可以更快地被生物体分解或从生物体中消除;以及/或者(3导致)与不完全弗氏佐剂相比,肉芽肿形成减少。因此,如本文所用的短语“可代谢的油”不需要是完全可代谢的。“肉芽肿形成减少”的特征可为例如以下一种或多种:形成的肉芽肿更少、肉芽肿严重程度降低和肉芽肿消退更快。
[0223]
在一些实施方案中,所述可代谢的油包括矿物油。
[0224]
在一些实施方案中,所述可代谢的油包括纯化油,例如,纯化矿物油(诸如但不限于drakeol
tm 6vr)。
[0225]
在一些实施方案中,所述可代谢的油包括可生物降解的油。可生物降解的油的非限制性实例包括肉豆蔻酸异丙酯、角鲨烯油(例如mf59)、角鲨烷油、植物油或它们的组合。在一些实施方案中,可生物降解的油是植物油,诸如,例如杏仁油、蓖麻油、大风子油、椰子油、玉米油、棉籽油、橄榄油、花生油、桃仁油、红花油、大豆油或它们的组合。
[0226]
在一些实施方案中,所述可代谢的油包括鱼油。
[0227]
在某些实施方案中,所述可代谢的油是药物级油。
[0228]
表面活性剂/乳液
[0229]
在一些实施方案中,提供的组合物包含一种或多种表面活性剂。合适的表面活性剂的非限制性实例包括二缩甘露醇单油酸酯、异二缩甘露醇单油酸酯以及它们的组合。在一些实施方案中,所述组合物包含二缩甘露醇单油酸酯。
[0230]
在一些实施方案中,提供的组合物包含montanide
tm
,例如,montanide
tm isa系列佐剂,该佐剂包含可代谢的油。
[0231]
montanide
tm isa(isa=不完全seppic佐剂)佐剂(seppic sa,paris,france)是一组基于油/表面活性剂的佐剂,其中不同的表面活性剂与不可代谢的矿物油、可代谢的油或两者的混合物组合在一起。它们通常被制备成与抗原水溶液一起用作乳液。各种montanide
tm isa组佐剂用作油包水型乳液、水包油型乳液或水包油包水型乳液。
[0232]
在一些实施方案中,所述组合物包含montanide
tm isa 51、montanide
tm isa 51 vg或任何由其衍生(例如,通过用从另一种来源或合成来源分离的油酸代替从橄榄中分离的油酸)的生物等效佐剂。montanide
tm isa 51是高纯化矿物油(drakeol
tm 6vr)和表面活性剂(二缩甘露醇单油酸酯)的混合物。montanide
tm isa 51 vg是类似的组合物,其中所述油酸是从橄榄而非从动物来源得到。
[0233]
在一些实施方案中,提供的组合物是水和油的乳液,例如,油包水型乳液。制作油包水(w/o)型乳液的方法在本领域中是众所周知的。油包水型乳液可以通过各种各样的方案(诸如使用诸如高剪切混合器、涡旋混合器和带有或不带有连接器的注射器(例如,t形或i形注射器)的各种各样的装置中的任一种装置的方案)中的任一种方案获得。在一些实施方案中,提供的组合物包含产生贮库效应的佐剂(诸如montanide
tm
佐剂),即导致相同组合物中的抗原在体内缓慢释放,从而延长免疫细胞在抗原中的暴露的佐剂。
[0234]
抗原
[0235]
通常,任何需要针对其产生免疫反应的分子或分子的部分都可以用作抗原。抗原
可以包括以下中的任一种,但不限于以下:肽、多肽、蛋白质、细胞(或其组分)、减毒活病原体(或其组分)和热灭活病原体(或其组分)。
[0236]
在一些实施方案中,抗原是非自身抗原,即它们对于意图被施用包含抗原的组合物的生物体是外来的。
[0237]
在一些实施方案中,抗原是自身抗原,因为它们在或曾经在意欲被施用包含抗原的组合物的生物体中的至少一些细胞中表达。在一些实施方案中,抗原是退休的自身蛋白,因为它们曾经在生物体中表达,但不再在非恶性成熟细胞中以自身免疫原性水平表达。
[0238]
在一些实施方案中,抗原是肿瘤相关抗原。
[0239]
在一些实施方案中,提供的组合物或制剂包含不同抗原的混合物。
[0240]
抗原可以包含一种或多种修饰。例如,可以使用一种或多种影响抗原或其片段的加工、细胞摄取、免疫原性和/或稳定性(例如,在肽/mhc复合体内)的修饰。
[0241]
在一些实施方案中,抗原包括多肽抗原。多肽抗原可以是多种长度中的任何一种,并且它们的序列可能对应于或可能不对应于天然存在的蛋白质的序列。例如,在一些实施方案中,全长或接近全长的蛋白质可被用作多肽抗原。在一些实施方案中,抗原或抗原混合物包含蛋白质的一种或多种片段或变异体。
[0242]
抗苗勒管激素受体2多肽
[0243]
在一些实施方案中,所述抗原包含抗苗勒管激素受体2胞外结构域(amhr2-ed)或其免疫原性片段。在一些实施方案中,所述抗原包含多个(例如,至少2、3、4、5、6、7、8、9或10个)不同的amhr2-ed多肽或片段。在一些实施方案中,提供的组合物包含编码amhr2-ed多肽的核酸来代替amhr2-ed多肽或作为对amhr2-ed多肽的补充。
[0244]
在成年女性中,最长的amhr2转录物编码573个氨基酸的蛋白质和403个氨基酸的胞质激酶结构域(amhr2-cd),二者都表现出卵巢外表达,其中所述573个氨基酸的蛋白质仅在卵巢中表达,并且包括卵巢特异性的127个氨基酸的amhr2-ed配体结合结构域以及26个氨基酸的跨膜结构域。术语“抗苗勒管激素受体2多肽”、“amhr2多肽”、“抗苗勒管激素受体2胞外结构域多肽”或“amhr2-ed多肽”意图包括片段、变异体(例如,等位基因变异体)以及它们的衍生物。代表性的人amhr2 cdna和人amhr2蛋白质序列在本领域是众所周知的,并且可从美国国家生物技术信息中心(ncbi)公开获得。例如,至少三种人amhr2同种型是已知的。人amhr2异构体1(np_065434.1和uniprot q16671-1)是由转录变异体(nm_020547.3)编码。人类以外的生物体中amhr2同源物的核酸和多肽序列是众所周知的,并且包括例如黑猩猩amhr2(xm_016923338.1和xp_016778827.1)、恒河猴amhr2(xm_028829519.1和xp_028685352.1)、狗amhr2(xm_543632.6和xp_543632.4)、小鼠amhr2(nm_144547.2和np_653130.2)和大鼠amhr2(nm_030998.1和np_112260.1)。上述mrna和蛋白质序列中的每一者都通过引用并入本文。
[0245]
在一些实施方案中,本文提供的是amhr2多肽和/或编码amhr2多肽的核酸。amhr2多肽是包含与amhr2或其一部分的氨基酸序列具有足够的序列同一性以引发amhr2特异性免疫反应的氨基酸序列的多肽。
[0246]
在某些实施方案中,所述amhr2多肽具有包含seq id no:11或9中所列出的amhr2氨基酸序列的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135
或140个连续氨基酸的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列是同一的。
[0247]
在某些实施方案中,所述amhr2多肽具有实质上由seq id no:11或9中所列出的amhr2氨基酸序列的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135或140个连续氨基酸组成的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列的氨基酸序列是同一的。
[0248]
在某些实施方案中,所述amhr2多肽具有由amhr2氨基酸序列的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135或140个连续氨基酸组成的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列是同一的。
[0249]
在一些实施方案中,所述amhr2多肽具有包含8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135或140个与seq id no:11或9中所列出的amhr2氨基酸序列至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的连续氨基酸的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列是同一的。
[0250]
在一些实施方案中,所述amhr2多肽具有包含seq id no:11或9的至少8个连续氨基酸的氨基酸序列。
[0251]
在某些实施方案中,所述amhr2多肽具有实质上由至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135或140个与seq id no:11或9中所列出的amhr2氨基酸序列至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的连续氨基酸组成的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列是同一的。
[0252]
在某些实施方案中,所述amhr2多肽具有由至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135或140个与seq id no:11或9中所列出的amhr2氨基酸序列至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一的连续氨基酸组成的氨基酸序列。在一些实施方案中,所述连续氨基酸与seq id no:11或9中所列出的amhr2氨基酸序列是同一的。
[0253]
如本领域技术人员所众所周知的,具有基本序列相似性的多肽可以在宿主生物体中引起同一或非常相似的免疫反应。因此,在一些实施方案中,作为amhr2的衍生物、等价物、变异体、片段或突变体的amhr2多肽也可适用于本文提供的方法和组合物。
[0254]
在一些实施方案中,提供的amhr2多肽是功能等价物,因为它们具有相对于amhr2多肽的序列改变但仍引发免疫反应的氨基酸序列(例如,通过保守置换)。如本文所用,术语“保守性置换”表示氨基酸残基被另一个生物学上相似的残基替换。本领域众所周知的是,同一保守基团中的氨基酸通常可以相互置换,而不会显著影响蛋白质的功能或免疫原性。
[0255]
在一些实施方案中,本文提供了编码本文所述的amhr2多肽的核酸,诸如dna分子。在一些实施方案中,提供了包含表达载体的组合物,所述表达载体包含编码amhr2多肽的开放阅读框。在一些实施方案中,所述amhr2核酸包括促进所述开放阅读框表达的调控元件。此类元件可包括例如启动子、起始密码子、终止密码子和多腺苷酸化信号中的一者或多者。此外,可以包括一种或多种增强剂。这些元件可以可操作地连接至编码amhr2多肽的序列。
[0256]
启动子的实例包括但不限于来自猿猴病毒40(sv40)、小鼠乳房肿瘤病毒(mmtv)、人类免疫缺陷病毒(hiv)(诸如hiv长末端重复(ltr)启动子)、莫洛尼病毒、巨细胞病毒(cmv)(诸如cmv立即早期启动子)、epstein barr病毒(ebv)、rous肉瘤病毒(rsv)的启动子,以及来自诸如人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸和人金属硫蛋白的人基因的启动子。合适的多腺苷酸化信号的实例包括但不限于sv40多腺苷酸化信号和ltr多腺苷酸化信号。
[0257]
增强剂或增强剂/启动子的非限制性实例包括例如来自人肌动蛋白、人肌球蛋白、人血红蛋白、人肌肉肌酸的增强剂,以及病毒增强剂,诸如来自cmv、rsv和ebv的那些。
[0258]
在一些实施方案中,将提供的核酸掺入在载剂或递送载体中。有用的递送载体包括但不限于可生物降解的微胶囊、免疫刺激复合体(iscom)、脂质体和经基因工程改造的减毒活载剂,诸如病毒或细菌。
[0259]
在一些实施方案中,所述载体是病毒载体,其非限制性实例包括慢病毒、逆转录病毒、疱疹病毒、腺病毒、腺相关病毒、牛痘病毒、杆状病毒、禽痘病毒、av痘病毒、改良的安卡拉牛痘(mva)病毒以及其他重组病毒。例如,牛痘病毒载体可用于感染树突细胞。
[0260]
制剂
[0261]
在一些实施方案中,所述抗原和碳水化合物以从约10:1至约1:10(w/w),例如,从约5:1至约1:5(w/w)、从约4:1至1:4(w/w)、从约3:1至约1:3(w/w)或从约1:2至约2:1(w/w)的比率存在。在一些实施方案中,所述抗原和碳水化合物以约1:1(w/w)的比率存在。
[0262]
在一些实施方案中,提供的组合物包含抗原、酵母聚糖和montanide
tm
。在一些这样的实施方案中,所述抗原是多肽抗原。
[0263]
例如,可能适合于治疗和/或预防乳腺癌的组合物可包含amhr2多肽、酵母聚糖和montanide
tm
,其中所述amhr2多肽包含与seq id no:11的氨基酸序列至少80%、85%、90%或95%同一的氨基酸序列。在一些实施方案中,所述amhr2多肽包含与seq id no:11的氨基酸序列100%同一的氨基酸序列。
[0264]
在一些实施方案中,提供的组合物被配制为水和油的乳液,例如,油包水型乳液。
[0265]
在一些实施方案中,提供了包含抗原、酵母聚糖和montanide
tm
的油包水型乳液的制剂。在一些这样的实施方案中,所述抗原是多肽抗原。
[0266]
例如,在一些实施方案中,所述制剂包含α-乳清蛋白多肽、酵母聚糖和montanide
tm
的油包水型乳液,其中所述amhr2多肽和酵母聚糖在制剂中以介于1:5(w/w)和5:1)(w/w)之间的比率存在,并且其中所述amhr2多肽包含与seq id no:11的氨基酸序列至少80%、85%、90%或95%同一的氨基酸序列。在一些此类实施方案中,所述amhr2多肽包含与seq id no:11的氨基酸序列100%同一的氨基酸序列。
[0267]
在一些方面,本文提供了药物组合物(例如,疫苗组合物)。例如,在一些实施方案中,提供的组合物进一步包含药学上可接受的载剂。
[0268]
在一些实施方案中,组合物进一步包含抗生素。
[0269]
在一些实施方案中,使用了额外的生理学上可接受的佐剂。此种额外的佐剂可以以包括但不限于以下的许多种方式中的任一种方式使用或纳入:(i)在抗原(例如多肽抗原)复原后与如本文提供的药物组合物中的其他组分混合,并且任选地用如上定义的可代谢的油乳化,(ii)作为如本文提供的复原的含抗原组合物的一部分,(iii)物理地连接至待复原的一种或多种抗原;以及(iv)单独施用给受试者。该额外的佐剂可以例如缓慢释放抗原(例如,额外的佐剂可以是脂质体)并且/或者它可以是本身具有免疫原性从而与抗原(即存在于所提供的组合物中的抗原)协同作用的佐剂。
[0270]
例如,额外的佐剂可以是已知的佐剂或其他促进抗原摄取、将免疫系统细胞募集到施用部位以及/或者促进响应淋巴细胞的免疫激活的物质。合适的额外的佐剂的实例包括但不限于免疫调节分子(例如,细胞因子),油和水乳液,氢氧化铝,葡聚糖,硫酸右旋糖酐,氧化铁,海藻酸钠,细菌佐剂,合成聚合物(诸如聚氨基酸)和氨基酸、皂苷、石蜡油和胞壁酰二肽的共聚物。在一些实施方案中,该额外的佐剂是佐剂65、α-galcer、磷酸铝、氢氧化铝、磷酸钙、β-葡聚糖肽、cpg dna、gm-csf、gpi-0100、ifa、ifn-γ、il-17、脂质a、脂多糖、lipovant、montanide
tm
、n-乙酰基-胞壁酰-l-丙氨酰-d-异谷氨酰胺、pam3csk4、quil a、海藻糖二霉菌酸酯或酵母聚糖。在一些实施方案中,该额外的佐剂诱导混合的1型/17型免疫反应。
[0271]
在一些实施方案中,该额外的佐剂是增强免疫反应的免疫调节分子。例如,所述免疫调节分子可以是细胞因子、趋化因子或免疫刺激剂、前述中的任一种的重组型式,或编码前述中的任一种的核酸。
[0272]
免疫调节细胞因子的实例包括但不限于干扰素(例如,ifnα、ifnβ和ifnγ)、白细胞介素(例如,il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-17和il-20)、肿瘤坏死因子(例如,tnfα和tnfβ)、促红细胞生成素(epo)、flt-3配体、gip10、tca-3、mcp-1、mif、mip-1α、mip-1β、rantes、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)和粒细胞-巨噬细胞集落刺激因子(gm-csf),以及前述中的任一种的功能片段。
[0273]
在一些实施方案中,提供的组合物包含与趋化因子受体例如cxc、cc、c或cx3c趋化因子受体结合的免疫调节趋化因子。趋化因子的实例包括但不限于mip1α、mip-1β、mip-3α(larc)、mip-3β、rantes、hcc-1、mpif-1、mpif-2、mcp-1、mcp-2、mcp-3、mcp-4、mcp-5、嗜酸粒细胞趋化因子(eotaxin)、tarc、elc、i309、il-8、gcp-2gro-α、gro-β、gro-γ、nap-2、ena-78、gcp-2、ip-10、mig、i-tac、sdf-1和bca-1(blc),以及前述中的任一种的功能片段。
[0274]
核酸
[0275]
在一些实施方案中,所述组合物包含编码本文所述的amhr2多肽抗原或抗-amhr2抗体的核酸(例如,dna或rna分子)。在此类实施方案中,所述组合物可以包含核酸来替代抗原和/或抗体或作为对抗原和/或抗体的补充。在一些实施方案中,所述组合物包含表达载体,所述表达载体包含编码多肽(例如amhr2多肽和/或抗体)的开放阅读框。
[0276]
当被细胞(例如,肌肉细胞、抗原呈递细胞(apc)诸如树突细胞、巨噬细胞等)摄取时,dna分子可以在细胞中作为染色体外分子存在并且/或者可以整合到染色体中。dna可以以质粒的形式引入到细胞中,该质粒可以作为单独的遗传物质保留。可替代地,可将能够整合到染色体中的线性dna引入到细胞中。任选地,当将dna引入到细胞中时,可以添加促进
dna整合到染色体中的试剂。
[0277]
iv.方法
[0278]
使表达amhr2的细胞死伤、耗尽或失能(disabling)的方法
[0279]
在一方面,本文提供了使表达amhr2的癌细胞与抗-抗苗勒管激素受体2(amhr2)抗体诸如人源化抗体、人抗体或嵌合抗体接触的方法,该接触导致表达amhr2的癌细胞的死伤、失能或耗尽。
[0280]
在一些实施方案中,本技术提供了使表达amhr2的癌细胞失能的方法,其包括使表达amhr2的癌细胞与amhr2抗体接触,从而使表达amhr2的癌细胞死伤。"使......失能"是指使细胞部分或完全不起作用。在一些实施方案中,使表达amhr2的癌细胞失能导致诱导癌细胞的生长停滞。在一些实施方案中,使表达amhr2的癌细胞失能导致癌细胞凋亡。在一些实施方案中,使表达amhr2的癌症失能导致该细胞裂解,如例如通过补体依赖性细胞毒性(cdc)或抗体依赖性细胞毒性(adcc)来导致该细胞裂解。在一些实施方案中,使表达amhr2的癌细胞失能导致该细胞坏死。在一些实施方案中,使表达amhr2的癌细胞失能导致诱导该细胞的生长停滞。在一些实施方案中,使表达amhr2的癌细胞失能导致使癌细胞失活。在一些实施方案中,使表达amhr2的癌细胞失能导致中和该细胞中amhr2蛋白的活性。在一些实施方案中,使表达amhr2的癌细胞失能导致细胞增殖减少。在一些实施方案中,使表达amhr2的癌细胞失能导致肿瘤组织或肿瘤微环境(tme)内该细胞的时间表达改变。在一些实施方案中,所述方法进一步包括去除表达amhr2的癌细胞。
[0281]
在使如本文所述的表达amhr2的癌细胞失能的任何和所有方面中,一个或多个特征或一个或多个功能的方面的任何增加或减少或改变是与未与抗-amhr2抗体接触的细胞进行比较的。
[0282]
在一些实施方案中,本技术提供了使表达amhr2的癌细胞死伤(也称为诱导细胞死亡)的方法,其包括使表达amhr2的癌细胞与抗-trem2抗体接触,从而使表达amhr2的癌细胞死伤。在一些实施方案中,死伤相对于尚未与抗trem2抗体接触的表达amhr2的癌细胞是增加的。在一些实施方案中,所述接触诱导表达amhr2的癌细胞的程序性细胞死亡。在一些实施方案中,所述接触诱导表达amhr2的癌细胞凋亡。在一些实施方案中,所述程序性细胞死亡是由半胱天冬酶-3介导的。在一些实施方案中,所述细胞凋亡是由半胱天冬酶-3介导的。在一些实施方案中,表达amhr2的癌细胞中10%-100%的癌细胞死伤。在一些实施方案中,表达amhr2的癌细胞中至少10%、20%、30%、40%、50%、60%、70%、80%、90或100%的癌细胞死伤。
[0283]
治疗癌症的方法
[0284]
在另一个方面,本文提供了通过施用抗-抗苗勒管激素受体2(amhr2)抗体来治疗癌症的方法。
[0285]
在一些实施方案中,所述表达amhr2的癌细胞的数目减少。在一些实施方案中,所述表达amhr2的癌细胞例如通过坏死或细胞凋亡而死伤。在一些实施方案中,所述表达amhr2的癌细胞被诱导经受生长停滞。在一些实施方案中,所述表达amhr2的癌细胞不再增殖。
[0286]
在一些实施方案中,所述接触是体外的。在一些实施方案中,所述接触是体内的。在一些具体实施方案中,所述接触是在人体内进行的。在一些实施方案中,所述接触是通过
施用抗-amhr2抗体实现的。在一些实施方案中,接受抗体的个体(诸如人)患有癌症。
[0287]
在另一方面,本发明提供了治疗个体的免疫相关病状(例如,癌症)的方法,其包括给个体施用有效量的包含抗-amhr2抗体的组合物。在另一方面,本发明提供了增强个体的免疫反应的方法,其包括给个体施用有效量的包含抗-amhr2抗体的组合物。免疫反应可以是适应性免疫反应或先天免疫反应。示例性免疫反应包括体液免疫反应(例如产生抗原特异性抗体(中和或以其他方式))和细胞介导的免疫反应(例如淋巴细胞增殖)。1型促炎性免疫反应的特征在于ifnγ产生。2型调节性免疫反应的特征在于il-4或il-5表达。17型促炎免疫反应的特征在于il-17表达。在一些情况下,可以产生混合免疫反应。例如,在一些情况下,产生了混合1型/17型炎性免疫反应,其特征在于ifnγ和il-17二者的表达。
[0288]
在一些实施方案中,本文提供的方法(诸如导致表达amhr2的细胞失能的方法)可用于治疗癌症,因此接受抗-amhr2抗体或抗-amhr2抗体的个体患有癌症。
[0289]
可以用本文提供的抗体治疗任何合适的癌症。癌症的实例包括实体瘤、软组织肿瘤、造血肿瘤和转移性病变。造血肿瘤的实例包括白血病、急性白血病、急性淋巴细胞白血病(all)、b细胞all、t细胞all或fab all、急性髓系白血病(aml)、慢性髓细胞白血病(cml)、慢性淋巴细胞白血病(cll),例如,转化的cll、弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤、毛细胞白血病、骨髓增生异常综合征(mds)、淋巴瘤、霍奇金病、恶性淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤或richter综合征(richter转化)。实体瘤的实例包括各种器官系统的恶性肿瘤,例如,肉瘤、腺癌和癌,诸如影响头颈部(包括咽)、甲状腺、肺(小细胞肺癌或非小细胞肺癌(nsclc))、乳腺、淋巴、胃肠道(例如,口腔、食道、胃、肝、胰腺、小肠、结肠和直肠、肛管)、生殖器和泌尿生殖道(例如,肾、尿路上皮、膀胱、卵巢、子宫、宫颈、子宫内膜、前列腺、睾丸)、cns(例如,神经或胶质细胞,例如,神经母细胞瘤或胶质瘤)或皮肤(例如,黑素瘤)的恶性肿瘤。
[0290]
在一些实施方案中,所述癌症是医学领域已知的表达amhr2的癌症,诸如卵巢癌。在一些实施方案中,所述癌症是实体瘤。在一些实施方案中,所述癌症是免疫逃避的。在一些实施方案中,所述癌症是免疫反应的。在一些实施方案中,所述癌症是卵巢癌。
[0291]
在一些实施方案中,所述卵巢癌是i期、ia期、ib期、ic期、ii期、iia期、iib期、iii期、iiia1期、iiia2期、iiib期、iiic期、iv期、iva期或ivb期卵巢癌。两种用于确定癌症分期的系统被广泛使用:figo(国际妇产科联合会(international federation of gynecology and obstetrics))系统和ajcc(美国癌症联合委员会(american joint committee on cancer))tnm分期系统。然而,卵巢癌在两种系统中的因素和分期大体上相同。因此,figo分期下的ii2b期卵巢癌与ajcc分期下的ii2b期卵巢癌相同。在一些实施方案中,所述癌症是转移性卵巢癌
[0292]
在一些实施方案中,所述癌症是至少一种治疗难治的。在一些实施方案中,所述癌症是多于一种治疗难治的。在一些实施方案中,所述癌症是至少两种治疗、三种治疗或四种治疗难治的。难治性或耐药性癌症是对治疗没有反应的癌症。难治性癌症可能在治疗开始时是耐药性的或在治疗过程中获得耐药性。
[0293]
在一些实施方案中,所述抗体治疗增强受试者的免疫反应。在一些实施方案中,所述增强的免疫反应是适应性免疫反应。在一些实施方案中,所述增强的免疫反应是先天免疫反应。
[0294]
在一些实施方案中,所述抗体诱导持久的免疫反应。持久的免疫反应是长期的免疫反应。在一些实施方案中,持久的免疫反应是持续超过6个月的免疫反应。在一些实施方案中,持久的免疫反应持续超过12个月。持久的免疫反应可以持续超过6个月、8个月、10个月、12个月、14个月、16个月、18个月、20个月、24个月、26个月、28个月、30个月、32个月、34个月或36个月或更长时间。
[0295]
在一些实施方案中,所述方法进一步包括确定来自个体的生物样本中amhr2蛋白的表达水平。在一些实施方案中,生物样本包括但不限于体液、组织样本、器官样本、尿液、粪便、血液、唾液、csf以及它们的任何组合。在一些实施方案中,所述生物样本来源于肿瘤组织。在一些实施方案中,所述表达水平包括编码amhr2蛋白的mrna的mrna表达水平。在一些实施方案中,样本中amhr2蛋白的表达水平是使用选自由facs、蛋白质印迹、elisa、免疫沉淀、免疫组织化学、免疫荧光、放射免疫测定、斑点印迹、免疫检测方法、hplc、表面等离子体共振、光学光谱法、质谱法、hplc、qpcr、rt-qpcr、多重qpcr或rt-qpcr、rna-seq、微阵列分析、sage、massarray技术和fish以及它们的组合组成的组的方法检测的。
[0296]
组合疗法
[0297]
在某些实施方案中,本文提供的方法进一步包括施用一种或多种额外的剂,或者本文提供的组合物进一步包含一种或多种额外的剂,该一种或多种额外的剂为诸如但不限于抗癌剂(例如,化疗剂)、免疫治疗剂、免疫调节剂和/或抗血管生成剂。
[0298]
在一些实施方案中,组合物包含额外的抗癌剂。在一些实施方案中,所述抗癌剂选自由贝伐珠单抗、博来霉素、卡铂、顺铂、环磷酰胺、多西他赛、多柔比星、依托泊苷、吉西他滨、来曲唑、奥拉帕利、他莫昔芬、托泊替康、曲贝替定(trabectedin)、ctla4抗体、pd-1抗体、pd-l1抗体和tgfβ抗体组成的组。
[0299]
在一些实施方案中,所述额外的剂是天然存在的或合成的抗癌剂,例如,如“cancer chemotherapeutic agents,”american chemical society,1995,w.o.foye ed.中所述的抗癌剂。
[0300]
在一些实施方案中,所述抗癌剂包括小分子。
[0301]
在一些实施方案中,所述抗癌剂是受体拮抗剂或阻断剂。在一些实施方案中,所述化学治疗剂选自由vegf受体拮抗剂(诸如,例如,伐他拉尼(vatalanib)(ptk-787/zk222584)、su-5416、su-6668、su-11248、su-14813、azd-6474、azd-2171、cp-547632、cep-7055、ag-013736、im-842或gw-786034)、vegftrap、egfr和/或her2拮抗剂(诸如,例如,吉非替尼、厄洛替尼、ci-1033、gw-2016、赫赛汀、易瑞沙(zd-1839)、特罗凯(osi-774)、pki-166、ekb-569或hki-272)、整联蛋白受体拮抗剂和蛋白激酶受体拮抗剂(例如,阿曲生坦)组成的组。在一些实施方案中,所述化疗剂抑制her2的表达。
[0302]
在一些实施方案中,所述抗癌剂包括蛋白激酶的拮抗剂,例如,丝裂原活化蛋白激酶(例如,bay-43-9006或bay-57-9006)或伊马替尼的拮抗剂。
[0303]
在一些实施方案中,所述抗癌剂包括微管蛋白结合剂。
[0304]
在一些实施方案中,所述抗癌剂包括抗体。例如,化疗抗体包括但不限于针对细胞因子(例如tgfβ)的抗体、靶向癌细胞表面分子的抗体和靶向生长因子或其受体的抗体。抗体化学治疗剂的非限制性实例包括阿仑单抗(alemtuzumab)、阿泊珠单抗(apolizumab)、贝伐珠单抗、达珠单抗(daclizumab)、西妥昔单抗、ibritumomab、米妥莫单抗(mitumomab)、马
妥珠单抗(matuzumab)、奥戈伏单抗(oregovomab)、利妥昔单抗、vitaxin(玻璃体结合蛋白(vitronectic)受体抗体)、dc101(vegfr2抗体)、id09c3(mhc ii类单克隆抗体)和imc-1c11(激酶插入结构域受体抗体)。
[0305]
在一些实施方案中,所述抗癌剂包括细胞周期抑制剂。
[0306]
在一些实施方案中,所述抗癌剂包括细胞因子抑制剂。
[0307]
在一些实施方案中,所述抗癌剂包括缺氧选择性细胞毒素。
[0308]
在一些实施方案中,所述抗癌剂包括tnfα抑制剂,例如,依那西普。
[0309]
在一些实施方案中,所述抗癌剂包括干扰素,例如,β干扰素。
[0310]
在一些实施方案中,所述抗癌剂包括白细胞介素,例如,il-10或il-12。
[0311]
在一些实施方案中,所述抗癌剂包括免疫调节剂,例如,来那度胺或沙利度胺。
[0312]
在一些实施方案中,所述抗癌剂是免疫检查点抑制剂。在一些实施方案中,所述免疫检查点抑制剂是ctla4抑制剂,诸如ctla4抗体(例如,伊匹木单抗(bms)、曲美木单抗(tremelimumab)(astrazeneca)和/或kahr-102(kahr medical))。在一些实施方案中,所述免疫检查点抑制剂是pd-1抑制剂,诸如pd-1抗体(例如,纳武利尤单抗(bms)、帕博利珠单抗/lambrolizumab(merck)、pidilizumab(curetech)、amp-224(gsk)、amp-514(astrazeneca)、sti-a1110(sorrento)和/或tsr-042(tesaro)。在一些实施方案中,所述免疫检查点抑制剂是pd-l1和/或pd-l2的抑制剂,诸如pd-l1和/或pd-l2抗体(例如,rg-7446(roche)、bms-936559(bms)、medi-4736(astrazeneca)、msb-0020718c(merck)、aur-012(pierre fabre med)、sti-a1010(sorrento))。在一些实施方案中,所述抗癌剂包括白三烯拮抗剂。
[0313]
在一些实施方案中,所述抗癌剂包括dna烷化剂,诸如,例如氮芥或其衍生物(例如苯达莫司汀、苯丁酸氮芥、双氯乙基甲胺(chlormethine)(二氯甲基二乙胺(mechlorethamine))、氧氮杂膦(oxazaphosphorines)(例如,环磷酰胺、异环磷酰胺和曲磷酰胺)、美法仑、甲氧氮芥(nitromin)、乌拉莫司汀)、亚硝基脲(例如,卡莫司汀、洛莫司汀或链脲霉素)、烷基磺酸酯(例如,白消安)、乙烯亚胺(氮丙啶)(例如,塞替派或六甲嘧胺)、金属盐(例如,卡铂、顺铂或奥沙利铂)或肼(例如,六甲蜜胺、丙卡巴肼、达卡巴嗪或替莫唑胺)。
[0314]
在一些实施方案中,所述抗癌剂包括铂化合物,诸如,例如顺铂、奥沙利铂、卡铂、沙铂、四铂或异丙铂。
[0315]
在一些实施方案中,所述抗癌剂包括dna嵌入剂,例如,蒽环类药物,诸如,例如柔红霉素、多柔比星(阿霉素)、脂质体多柔比星(doxil)、表柔比星或伊达比星。
[0316]
在一些实施方案中,所述抗癌剂包括dna小沟结合化合物。
[0317]
在一些实施方案中,所述抗癌剂包括dna交联剂。
[0318]
在一些实施方案中,所述抗癌剂包括抗代谢物,诸如,例如嘧啶或嘌呤类似物或拮抗剂,或核苷二磷酸还原酶抑制剂。抗代谢物的非限制性实例包括阿糖胞苷、5-氟尿嘧啶(5-fu)、培美曲塞、替加氟/尿嘧啶、尿嘧啶氮芥、氟尿苷、氟达拉滨、吉西他滨、卡培他滨、巯基嘌呤、克拉屈滨、硫鸟嘌呤、甲氨蝶呤、喷司他丁或羟基脲。
[0319]
在一些实施方案中,所述抗癌剂包括dna转录、rna翻译或蛋白质表达的抑制剂。dna转录抑制剂的非限制性实例包括拓扑异构酶i或ii抑制剂(例如,喜树碱、伊立替康、拓
扑替康、表鬼臼毒素、依托泊苷、替尼泊苷或基于三环甲酰胺的剂)和转录因子复合体抑制剂(诸如,例如esx/drip130/sur-2复合物的抑制剂)。
[0320]
在一些实施方案中,所述抗癌剂包含蛋白酶体抑制剂,诸如,例如硼替佐米。
[0321]
在一些实施方案中,所述抗癌剂包括酶,例如,门冬酰胺酶或聚乙二醇化天冬酰胺酶(培门冬酶)。
[0322]
在一些实施方案中,所述抗癌剂包括寡核苷酸或多核苷酸。
[0323]
在一些实施方案中,所述抗癌剂包括组蛋白脱乙酰酶抑制剂,诸如,例如saha、md-275、曲古抑菌素a、cbha、laq824或丙戊酸。
[0324]
在一些实施方案中,所述化疗剂包括化学辐射增敏剂或保护剂。
[0325]
在一些实施方案中,所述抗癌剂包括癌基因抑制剂,例如,p53或rb抑制剂。
[0326]
在一些实施方案中,所述抗癌剂包括植物来源的剂,诸如紫杉烷(例如,紫杉醇或多西他赛)、长春花生物碱(例如,诺维本、长春碱、长春新碱、长春地辛或长春瑞滨)或热带生物碱(例如,秋水仙碱或其衍生物)。
[0327]
在一些实施方案中,所述抗癌剂包括喹唑啉或其衍生物,诸如,例如阿法他尼(afatanib)、厄洛替尼、吉非替尼或拉帕替尼。
[0328]
在一些实施方案中,所述抗癌剂包括抗有丝分裂剂,例如,抗有丝分裂肽(例如,拟茎点霉毒素(phomopsin)和多拉司他汀(dolastatin))、抗有丝分裂氨基甲酸酯衍生物(例如,考布他汀(combretastatin)(a4)或amphetinile)。
[0329]
在一些实施方案中,所述抗癌剂包括五加前胡素(steganacin)。
[0330]
在一些实施方案中,所述抗癌剂包括激素阻断剂,例如,抗雄激素、抗雌激素、促性腺激素释放激素(gnrh)拮抗剂(例如,阿巴瑞克(abarelix))、gnrh类似物和芳香酶抑制剂。此类抗雄激素的非限制性实例包括尼鲁米特(anandron)、比卡鲁胺、康士得、醋酸环丙孕酮、氟他胺、米托坦(mitotane)和尼鲁米特(nilutamide)。抗雌激素的非限制性实例包括屈洛昔芬(droloxifene)、雷洛昔芬、他莫昔芬、曲昔芬(trioxifene)和秦哚昔芬(zindoxifene)。gnrh类似物的非限制性实例包括亮丙瑞林(leuprolide)、布舍瑞林(buserelin)、戈舍瑞林和曲普瑞林。芳香酶抑制剂的非限制性实例包括氨鲁米特(aminogluthetimide)、阿那曲唑、法曲唑(fadrozole)、福美坦或来曲唑,和睾内酯酮(testalactone)。激素阻滞剂的额外实例包括非那雄胺。
[0331]
在一些实施方案中,所述抗癌剂是激素或其衍生物,例如,雌激素(例如,雌莫司汀(t-66)、17-β-雌二醇(包括衍生物ici 164,384或ici 182,780)、孕酮(gestagen)或孕激素(progestin)(例如,甲地孕酮)。
[0332]
在一些实施方案中,所述抗癌剂包含哌嗪衍生物,例如,哌泊溴烷(piprobroman)。
[0333]
在一些实施方案中,所述抗癌剂包括谷胱甘肽类似物,例如,tlk-286。
[0334]
在一些实施方案中,所述抗癌剂包括生物反应调节剂,例如,阿地白介素(aldesleukin)或地尼白介素2(denileukin diftitox)。
[0335]
在一些实施方案中,所述抗癌剂包括基质金属蛋白酶抑制剂,例如,马马司他(marimastat)、timp-1或timp-2。
[0336]
在一些实施方案中,所述抗癌剂包括稀土元素的络合物,例如,镧系元素络合物。
[0337]
在一些实施方案中,所述抗癌剂包括具有抗癌作用的金属,例如,锌。
[0338]
在一些实施方案中,所述抗癌剂包括光化学活化药物,例如,卟菲尔(porfimer)、光卟啉(photofrin)、苯并卟啉衍生物、脱镁叶绿甲酯酸衍生物(pheophorbide derivative)、部花青540(mc-540)或锡依替卟啉(tin etioporpurin)。
[0339]
在一些实施方案中,所述抗癌剂包括用于光化学疗法的剂,例如与紫外线疗法一起使用的补骨脂素。
[0340]
在一些实施方案中,所述抗癌剂包括硝基芳族化合物,例如,rsu-1069、rb-6145或cb-1954。在一些实施方案中,所述化疗剂包括硝酰基或n-氧化物,例如,sr-4233。
[0341]
在一些实施方案中,所述抗癌剂包含反义rna或dna,例如,奥利美生(oblimersen)。
[0342]
在一些实施方案中,所述抗癌剂包括卤代嘧啶类似物,例如,溴脱氧尿苷或碘脱氧尿苷。
[0343]
在一些实施方案中,所述额外的剂包括血管生成抑制剂,诸如,例如dc-101、新伐司他(neovastat)、四硫代钼酸盐、胸苷-磷酸化酶抑制剂或tnp-470。
[0344]
在一些实施方案中,所述额外的剂包括抗生素(包括大环内酯类)、抗真菌剂或抗寄生虫剂,它们可能具有或可能不具有抗癌作用。可用作额外的剂的抗生素的非限制性实例包括吖啶、放线菌素、安吖啶、安丝菌素、安曲霉素、博来霉素、氯霉素、放线菌素d、偏端霉素(distamycin)、多卡霉素(duocarmycin)、格尔德霉素(geldanamycin)、酮康唑、利博霉素(liblomycin)、美坦辛(maytansine)、光神霉素、丝裂霉素、米托蒽醌、纺锤菌素(netropsin)、硝基咪唑(例如,苄硝唑(benznidazole)、甲硝唑、米索硝唑(misonidazole)、尼莫唑(nimorazole)、nla-1、nlp-1)、硝基吖啶、硝基喹啉、硝基吡唑并吖啶、橄榄霉素(olivomycin)、腐草霉素(phleomycin)、邻苯二甲酰二苯胺(例如,丙脒或芪脒(stilbamidine))、哌苯苄醇(pibenzimol)、普利霉素(plicamycin)、利福霉素、根霉素、角鲨胺、坦螺旋霉素(17-烯丙基氨基格尔德霉素),或前述中的任一种的衍生物或盐。
[0345]
在一些实施方案中,所述额外的剂包括氮丙啶醌(aziridoquinone)(例如,丝裂霉素c、bmy-42355、azq或eo-9)。
[0346]
在一些实施方案中,所述额外的剂包括2-硝基咪唑,诸如米索尼唑、nlp-1或nla-1、硝基吖啶、硝基喹啉、硝基吡唑并吖啶、
[0347]
在一些实施方案中,所述额外的剂包括抗炎剂,诸如,例如类固醇或非类固醇抗炎药。类固醇的非限制性实例包括泼尼松、泼尼松龙、甲泼尼龙、地塞米松、布地诺苷(budenoside)、氟可龙或曲安西龙。额外的抗炎剂的非限制性实例包括乙酰水杨酸、美沙拉秦、布洛芬、萘普生、氟比洛芬、非诺洛芬、芬布芬、酮洛芬、吲哚洛芬(indoprofen)、吡洛芬(pirprofen)、卡洛芬(carprofen)、奥沙普秦、普拉洛芬、咪洛芬(miroprofen)、硫噁洛芬(tioxaprofen)、舒洛芬(suprofen)、阿明洛芬(alminoprofen)、噻洛芬酸(tiaprofenic acid)、氟洛芬(fluprofen)、吲哚美辛、舒林酸、托美丁、佐美酸(zomepirac)、萘丁美酮、双氯芬酸、芬氯酸(fenclofenac)、阿氯芬酸(alclofenac)、溴芬酸、异丁芬酸(ibufenac)、醋氯芬酸、阿西美辛、芬替酸(fentiazac)、环氯茚酸(clidanac)、依托度酸、奥西平酸(oxpinac)、甲芬那酸、甲氯芬那酸(meclofenamic acid)、氟芬那酸、尼氟酸(nifluminic acid)、托芬那酸(tolfenamic acid)、二氟尼柳、氟苯柳(flufenisal)、吡罗昔康、替诺昔康(tenoxicam)、洛莫昔康(lomoxicam)、尼美舒利、美洛昔康、塞来昔布和罗非昔布。
[0348]
在一些实施方案中,所述额外的剂包括双膦酸盐或其衍生物,例如米诺膦酸或其衍生物(ym-529、ono-5920、yh-529)、唑来膦酸一水合物、伊班膦酸钠水合物或氯膦酸二钠。
[0349]
在一些实施方案中,所述额外的剂是药学上可接受的盐、水合物和/或溶剂化物的形式。在一些实施方案中,所述化学治疗剂是单独的旋光异构体、单独的对映异构体的混合物或其外消旋体的形式。
[0350]
所述额外的治疗剂可以通过任何合适的方式施用。在一些实施方案中,本文提供的抗体和所述额外的治疗剂包含在相同的药物组合物中。在一些实施方案中,本文提供的抗体和所述额外的治疗剂包含在不同的药物组合物中。
[0351]
在本文提供的抗体和所述额外的治疗剂包含在不同的药物组合物中的实施方案中,所述抗体的施用可以在所述额外的治疗剂施用之前、施用的同时和/或施用之后进行。在一些实施方案中,本文提供的抗体和所述额外的治疗剂的施用发生在彼此的约一个月内。在一些实施方案中,本文提供的抗体和所述额外的治疗剂的施用发生在彼此的约一周内。在一些实施方案中,本文提供的抗体和所述额外的治疗剂的施用发生在彼此的约一天内。在一些实施方案中,本文提供的抗体和所述额外的治疗剂的施用发生在彼此的约十二个小时内。在一些实施方案中,本文提供的抗体和所述额外的治疗剂的施用发生在彼此的约一小时内。
[0352]
剂量
[0353]
在一些实施方案中,对于本文所述的抗-amhr2抗体的体内施用,正常剂量的量可以从每天约10ng/kg到至多约100mg/kg个体体重或更多,优选约1mg/kg/天到10mg/kg/天,这取决于施用途径。对于在几天或更长时间内的重复施用,根据待治疗的疾病或病症的严重程度,通常维持治疗直到实现期望的症状抑制。示例性给药方案包括施用约2mg/kg的抗-amhr2抗体初始剂量,随后每隔一周施用约1mg/kg的每周维持剂量。其他剂量方案可能有用,这取决于医生希望实现的药代动力学衰减模式。例如,本文考虑每周给个体给药一至二十一次。在某些实施方案中,可以使用范围从约3μg/kg到约2mg/kg(诸如约3μg/kg、约10μg/kg、约30μg/kg、约100μg/kg、约300μg/kg、约1mg/kg以及约2/mg/kg)的剂量。在某些实施方案中,给药频率是每天三次、每天两次、每天一次、每隔一天一次、每周一次、每两周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次,或每月一次、每两个月一次、每三个月一次,或更长时间一次。治疗的进展容易通过常规技术和测定进行监控。给药方案(包括施用的抗-amhr2抗体)可以独立于使用的剂量而随时间变化。
[0354]
在某些实施方案中,所述治疗有效量包括多于一个剂量,例如,至少两个剂量或至少三个剂量。在一些实施方案中,所述治疗有效量包括不超过三个剂量,例如,恰好三个剂量。在一些实施方案中,每个剂量间隔一周或多周,例如,间隔至少两周或更多周、间隔至少三周或更多周,或间隔至少四周施用。在一些实施方案中,每个剂量间隔约四周施用。
[0355]
在一些实施方案中,每个剂量含有大约相同量的抗原。在一些实施方案中,每个剂量含有大约相同量的抗原和相同量的碳水化合物。
[0356]
在一些实施方案中,施用初始剂量,并且监测受试者的免疫和/或临床反应。合适的免疫学监测手段包括使用患者的外周血单核细胞(pbmc)作为反应物和肿瘤细胞或抗原作为用于确定记忆或回忆反应的刺激物。免疫反应也可以通过施用部位延迟炎症反应的存
在来确定。可以在初始剂量之后酌情施用一剂或多剂,例如,以每月、每半月或每周为基础,直至达到所需效果。此后,可以根据需要给予额外的加强或维持剂量,特别是当免疫或临床获益似乎减弱时。
[0357]
合适的剂量可以例如通过参考施用该剂量的受试者中相应的血浆浓度来确定。例如,可以使用最大血浆浓度(cmax)和从时间0到无穷大的血浆浓度-时间曲线下面积(auc(0-4))。剂量包括产生某些期望的cmax和auc(0-4)的值的剂量。
[0358]
剂量可能取决于多种因素,诸如,例如特定抗原或组合物的活性;施用途径;施用时间;正在使用的特定组合物中组分的排泄或代谢率;治疗持续时间;与特定抗原组合物组合使用的其他药物、化合物和/或材料;受试者的年龄、性别、体重、病状、一般健康状况和既往病史;以及医学领域中众所周知的类似因素。
[0359]
一般而言,本文所述组合物的“治疗有效量”将是这样的量,即有效产生所需免疫、预防或治疗效果的最低量。例如,在一些实施方案中,治疗有效量是能够在待治疗的受试者中诱导有效的体液或细胞t细胞反应或在一些实施方案中诱导有效的全身免疫反应的量。此种有效量通常将取决于某些因素,诸如上述那些因素。
[0360]
在一些实施方案中,每个剂量含有介于约1μg至约20mg之间的抗原,例如,介于约1μg至约5mg之间、介于约50μg至约2mg之间的抗原或介于约100μg至约1mg之间的抗原。例如,在一些实施方案中,每个剂量含有约1μg、约2μg、约3μg、约4μg、约5μg、约10μg、约15μg、约20μg、约30μg、约40μg、约50μg、约60μg、约70μg、约80μg、约90μg、约100μg、约150μg、约200μg、约250μg、约300μg、约350μg、约400μg、约450μg、约500μg、约550μg、约600μg、约650μg、约700μg、约750μg、约800μg、约850μg、约900μg、约950μg、约1mg、约1.5mg、约2mg、约2.5mg、约3mg、约3.5mg、约4mg、约4.5mg、约5mg、约5.5mg、约6mg、约6.5mg、约7mg、约7.5mg、约8mg、约8.5mg、约9mg、约9.5mg、约10mg、约15mg、约20mg或介于其间的任何值的抗原。
[0361]
在一些实施方案中,每个剂量含有约1μg至约20mg,例如,介于约10μg至约10mg之间、从约50μg至约5mg、从约100μg至约2mg或从约100μg至约1mg的碳水化合物。例如,在一些实施方案中,每个剂量含有约1μg、约2μg、约3μg、约4μg、约5μg、约10μg、约15μg、约20μg、约30μg、约40μg、约50μg、约60μg、约70μg、约80μg、约90μg、约100μg、约150μg、约200μg、约250μg、约300μg、约350μg、约400μg、约450μg、约500μg、约550μg、约600μg、约650μg、约700μg、约750μg、约800μg、约850μg、约900μg、约950μg、约1mg、约1.5mg、约2mg、约2.5mg、约3mg、约3.5mg、约4mg、约4.5mg、约5mg、约5.5mg、约6mg、约6.5mg、约7mg、约7.5mg、约8mg、约8.5mg、约9mg、约9.5mg、约10mg、约15mg或约20mg或介于其间的任何值的碳水化合物。
[0362]
在一些实施方案中,抗体是静脉内、肌内、皮下、外用(topically)、经口、经真皮、腹膜内、眶内、通过植入、通过吸入、鞘内、脑室内或鼻内施用的。可以施用有效量的抗trem2抗体用于治疗癌症。抗trem2抗体的合适剂量可根据待治疗癌症的类型、抗trem2抗体的类型、癌症的严重程度和病程、个体的临床状况、个体的临床病史和对治疗的反应,以及主治医师的酌处权来确定。
[0363]
本文公开的组合物(包括药物组合物)可以通过包括经口、肠胃外和“药物组合物”部分中讨论的其他施用途径在内的任何合适的施用途径施用。在一些实施方案中,治疗有效量的组合物是通过全身施用途径(例如,通过经口或肠胃外施用)施用的。在一些实施方案中,治疗有效量的组合物是局部(locally)施用的。在一些实施方案中,治疗有效量的组
合物是通过皮下、真皮内、真皮下或肌内注射施用的。
[0364]
受试者
[0365]
本文所述的方法可用于治疗任何有需要的受试者。
[0366]
通常,施用本发明公开的组合物或制剂的受试者具有适应性免疫系统。在一些实施方案中,受试者是哺乳动物。受试者的实例包括但不限于人、家畜、狗、猫、小鼠、大鼠以及它们的转基因物种。在一些实施方案中,受试者是人。
[0367]
在一些实施方案中,所述受试者患有癌症或具有患癌症的风险。例如,所述受试者可能已被诊断患有癌症。所述癌症可以是原发性癌症或转移性癌症。受试者可以患有任何阶段的癌症,例如,i期、ii期、iii期或iv期,伴有或不伴有淋巴结受累和伴有或不伴有转移。提供的组合物可以预防或减少癌症的进一步生长以及/或者以其他方式改善癌症(例如,预防或减少转移)。
[0368]
在一些实施方案中,受试者未患有癌症,但已被确定具有患癌症的风险,例如,因为存在一种或多种风险因素,诸如环境暴露、一种或多种基因突变或变异体的存在、家族史等。
[0369]
在一些实施方案中,所述受试者未被诊断患有癌症。例如,提供的组合物和制剂可以用作预防性疫苗,例如,在被确定为具有风险的个体中,在预防可能特别有效的一个或多个亚群中,等等。例如,在对抗乳腺癌的疫苗的背景下,所述受试者可以是例如非哺乳期女性。
[0370]
在一些实施方案中,所述癌症是卵巢癌(例如,原发性卵巢癌、转移性卵巢癌)。在一些实施方案中,所述乳腺癌对amhr2呈阳性或包含对amhr2呈阳性的细胞。
[0371]
在一些实施方案中,所述受试者已接受手术以切除卵巢肿瘤的至少一部分。在一些实施方案中,所述受试者由于具有与此种风险相关的突变,例如,brca1或brca2基因的突变,因此在遗传上易患卵巢癌。在一些实施方案中,所述受试者具有卵巢癌家族史。
[0372]
在一些实施方案中,所述癌症表达或过表达这样的多肽,该多肽在所提供的组合物或制剂中用作抗原,或者该多肽的一个或多个片段和/或一个或多个变异体在所提供的组合物或制剂中用作抗原。例如,在一些实施方案中,所述癌症(例如,乳腺癌)表达或过表达amhr2。
[0373]
在一些实施方案中,所述受试者已被施用、将被施用或同时被施用额外的疗法。额外的疗法可以包括例如手术切除、放射疗法、化学疗法和/或其他免疫疗法模式。在一些实施方案中,所述额外的疗法包含如本文所述的额外的剂。
[0374]
例如,在一些实施方案中,所述受试者已被施用、将被施用或同时被施用包含如本文所述的抗癌剂的抗癌疗法。
[0375]
在一些实施方案中,以避免干扰本文所述组合物的免疫原性的方式相对于额外的疗法来安排施用时间。
[0376]
在一些实施方案中,所述受试者已被施用额外的疗法,并且作为所述额外的疗法的结果,所述受试者没有表现出受试者正被治疗的疾病的临床症状,例如,没有临床上可测量的肿瘤。然而,在一些实施方案中,所述受试者被确定处于疾病复发或进展的风险中。例如,当疾病是癌症时,在一些实施方案中,所述受试者可被确定处于癌症复发或进展的风险中,例如,在原始肿瘤部位附近和/或在转移部位处。此类受试者可被进一步分类为高风险
受试者和低风险受试者。可以根据例如用额外的疗法治疗之前和/或用额外的疗法治疗之后观察到的特征进行分类。这些特征在临床领域中是已知的并且可以针对每种类型的癌症进行定义。高风险亚组的典型特征包括邻近组织的侵袭和/或淋巴结受累。因此,例如,可将本文所述的药物组合物施用给所述受试者以引发抗癌反应,以防止癌症的复发或进展。
[0377]
反应
[0378]
在一些实施方案中,施用所述组合物诱导免疫反应。
[0379]
通常,所述免疫反应可以包括体液免疫反应、细胞介导的免疫反应或两者。
[0380]
例如,体液反应可以例如通过来自接受所述药物组合物的受试者的血清样本中抗体水平的标准免疫测定来确定。
[0381]
细胞免疫反应是通常涉及t细胞的反应,并且可以体外或体内确定。例如,一般细胞免疫反应可以确定为在施用药学上可接受的组合物后在合适的时间从受试者取样的细胞(例如,外周血白细胞(pbl))中的t细胞增殖活性。例如,在pbmc与刺激物一起温育适当的时间后,可以确定[3h]胸苷掺入。可以使用流式细胞术确定增殖t细胞的百分比。另一种测量细胞免疫的方法涉及测量响应于抗原分泌促炎性1型和/或17型细胞因子的t细胞的循环频率。
[0382]
在一些实施方案中,所述免疫反应包括抗原特异性t细胞免疫反应,其可以包括例如cd4+t细胞、cd8+t细胞或两者。在一些实施方案中,所述t细胞免疫反应包括1型或17型促炎性t细胞反应。在一些实施方案中,所述t细胞免疫反应包括1型和17型促炎性t细胞反应二者。
[0383]
当所述抗原在细胞上表达时,施用所述组合物可引发对该细胞的免疫反应。例如,当所述抗原是肿瘤相关抗原时,施用所述组合物可引发对表达该抗原的肿瘤细胞的免疫反应。
[0384]
在一些实施方案中,施用导致相对于参考水平而言,受试者的肉芽肿形成减少。例如,所述参考水平可以是在施用了包含完全弗氏佐剂的组合物的受试者中观察到的肉芽肿形成水平。在一些实施方案中,所述参考水平是在施用了包含不完全弗氏佐剂的组合物的受试者中观察到的肉芽肿形成水平。“肉芽肿形成减少”的特征可为例如以下一种或多种:形成的肉芽肿更少、肉芽肿严重程度降低、肉芽肿严重程度更快地降低和肉芽肿更快地(部分或完全)消退。
[0385]
细胞疗法
[0386]
在一些实施方案中,提供了方法,该方法包括给受试者施用已在体外与如本文公开的组合物接触的细胞(例如,抗原呈递细胞或其前体)或已由此类细胞产生的细胞,诸如抗原引发的抗原呈递细胞或抗原特异性淋巴细胞。
[0387]
制备方法
[0388]
本文描述的抗体可以使用例如如美国专利第4,816,567号中描述的重组方法和组合物来产生。
[0389]
在一个实施方案中,提供了编码本文所述的抗体的分离的核酸。此类核酸可以编码构成所述抗体的vl的氨基酸序列和/或构成所述抗体的vh的氨基酸序列(所述抗体的轻链和/或重链)或者构成单结构域抗体的vhh的氨基酸序列。在进一步的实施方案中,提供了包含此类核酸的一种或多种载体(例如,表达载体)。在一个实施方案中,所述核酸提供在多
顺反子载体中。在进一步的实施方案中,提供了包含此类核酸的宿主细胞。在一个此种实施方案中,宿主细胞包含下列载体(例如,已经用下列载体转化):(1)包含编码构成所述抗体的vl的氨基酸序列和构成所述抗原结合多肽构建体的vh的氨基酸序列的核酸的载体,或(2)包含编码构成所述抗原结合多肽构建体的vl的氨基酸序列的核酸的第一载体,以及包含编码构成所述抗原结合多肽构建体的vh的氨基酸序列的核酸的第二载体。在一个实施方案中,所述宿主细胞是真核的,例如中国仓鼠卵巢(cho)细胞或人胚肾(hek)细胞或淋巴样细胞(例如,y0、ns0、sp20细胞)。在一个实施方案中,提供了制备抗体的方法,其中所述方法包括将包含编码如上文所提供的抗体的核酸的宿主细胞在适合于使所述抗体表达的条件下培养,以及任选地,从宿主细胞(或宿主细胞培养基)回收所述抗体。
[0390]
对于抗体的重组生产,将编码例如如上所述的抗体的核酸分离出来,并插入到一种或多种载体中以在宿主细胞中进一步克隆和/或表达。使用常规程序可以容易地分离和测序此种核酸(例如,通过使用能够特异性地结合至编码所述抗体的重链和轻链的基因的寡核苷酸探针)。
[0391]
术语“基本上纯化的”是指这样的本文所述的构建体或其变体,其可以基本上或实质上不含在其天然存在的环境中发现的蛋白质通常伴随或与该蛋白质相互作用的组分,即在某些实施方案中基本上不含细胞材料的天然细胞或在重组生产的抗体情况下的宿主细胞包括具有少于约30%、少于约25%、少于约20%、少于约15%、少于约10%、少于约5%、少于约4%、少于约3%、少于约2%或少于约1%(以干重计)的污染蛋白质的蛋白质制备物。当所述抗体或其变异体是由宿主细胞重组产生时,所述蛋白质在某些实施方案中以该细胞干重的约30%、约25%、约20%、约15%、约10%、约5%、约4%、约3%、约2%或约1%或更低值存在。当所述抗体或其变异体是由宿主细胞重组产生时,所述蛋白质在某些实施方案中以该细胞干重的约5g/l、约4g/l、约3g/l、约2g/l、约1g/l、约750mg/l、约500mg/l、约250mg/l、约100mg/l、约50mg/l、约10mg/l或约1mg/l或更低值存在于培养基中。在某些实施方案中,如通过适当的方法诸如sds/page分析、rp-hplc、sec和毛细管电泳所确定,通过本文所述的方法产生的“基本上纯化的”抗体具有至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%的纯度水平,具体地说,至少约75%、80%、85%的纯度水平,更具体地说,至少约90%的纯度水平、至少约95%的纯度水平、至少约99%或更高的纯度水平。
[0392]
适合于克隆或表达编码抗体的载体的宿主细胞包括本文所述的原核或真核细胞。
[0393]“重组宿主细胞”或“宿主细胞”是指包含外源多核苷酸的细胞,而不管用于插入的方法(例如直接摄取、转导、f-交配或本领域已知用于产生重组宿主细胞的其他方法)如何。所述外源多核苷酸可以被维持为非整合载体,例如质粒,或者可替代地,可以整合到宿主基因组中。宿主细胞可以包括cho、cho的衍生物、ns0、sp2o、cv-1、vero-76、hela、hepg2、per.c6或bhk。
[0394]
如本文所用,术语“真核生物”是指属于系统发育域真核生物的生物体,诸如动物(包括但不限于哺乳动物、昆虫、爬行动物、鸟类等)、纤毛虫、植物(包括但不限于单子叶植物、双子叶植物、藻类等)、真菌、酵母、鞭毛虫、微孢子虫、原生生物等。
[0395]
如本文所用,术语“原核生物”是指原核生物体。例如,非真核生物体可以属于真细菌(包括但不限于,大肠杆菌(escherichia coli)、嗜热栖热菌(thermus thermophilus)、
嗜热脂肪芽孢杆菌(bacillus stearothermophilus)、荧光假单胞菌(pseudomonas fluorescens)、铜绿假单胞菌(pseudomonas aeruginosa)、恶臭假单胞菌(pseudomonas putida)等)系统发育域,或古细菌(archaea)(包括但不限于不限于,詹氏甲烷球菌(methanococcus jannaschii)、嗜热自养甲烷杆菌(methanobacterium thermoautotrophicum)、盐杆菌属(halobacterium)诸如沃氏嗜盐富饶菌(haloferax volcanii)和盐杆菌属物种(halobacterium species)nrc-1、闪烁古球菌(archaeoglobus fulgidus)、激烈热球菌(pyrococcus furiosus)、掘越氏热球菌(pyrococcus horikoshii)、aeuropyrum pernix等)系统发育域。
[0396]
例如,抗体可以在细菌中产生,特别是在不需要糖基化和fc效应功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,美国专利第5,648,237号、第5,789,199号和第5,840,523号。(还参见charlton,methods in molecular biology,第248卷(b.k.c.lo,编,humana press,totowa,n.j.,2003),第245-254页,描述了抗体片段在大肠杆菌中的表达)表达后,可将所述抗体在可溶性部分中从细菌细胞糊中分离出来,并且可以进一步纯化。
[0397]
除了原核生物外,真核微生物诸如丝状真菌或酵母是用于抗体编码载体的合适的克隆或表达宿主,包括其中的糖基化途径已经“人源化”从而导致产生具有部分或完全人糖基化样式的抗体的真菌和酵母菌株。参见gerngross,nat.biotech.22:1409-1414(2004)和li等人,nat.biotech.24:210-215(2006)。
[0398]
适合于表达糖基化抗体的宿主细胞也衍生自多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定出许多杆状病毒株,其可以与昆虫细胞一起使用,特别是用于转染草地夜蛾(spodoptera frugiperda)细胞。
[0399]
也可以利用植物细胞培养物作为宿主。参见,例如,美国专利第5,959,177号、第6,040,498号、第6,420,548号、第7,125,978号和第6,417,429号(描述了用于在转基因植物中产生抗体的plantibodies
tm
技术)。
[0400]
也可以使用脊椎动物细胞作为宿主。例如,适合于在悬浮液中生长的哺乳动物细胞系可能是有用的。其他有用的哺乳动物宿主细胞系的实例是由sv40(cos-7)转化的猴肾cv1系;人胚胎肾系(293或293细胞,如,例如在graham等人,j.gen virol.36:59(1977)中所述);小仓鼠肾细胞(bhk);小鼠塞尔托利氏细胞(sertoli cell)(tm4细胞,如mather,biol.reprod.23:243-251(1980)中所述);猴肾细胞(cv1);非洲绿猴肾细胞(vero-76);人宫颈癌细胞(hela);犬肾细胞(mdck;buffalo大鼠肝细胞(brl 3a);人肺细胞(w138);人肝细胞(hep g2);小鼠乳腺肿瘤(mmt 060562);tri细胞,如例如mather等人,annals ny acad.sci.383:44-68(1982)中所述;mrc 5细胞;和fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa77:4216(1980));和骨髓瘤细胞系,诸如y0、ns0和sp2/0。对于适用于抗体生产的某些哺乳动物宿主细胞系的综述,参见,例如,yazaki和wu,methods in molecular biology,第248卷(bkc lo编,humana press,totowa,n.j.),第255-268页(2003)。
[0401]
在一个实施方案中,本文所述的抗体通过包括以下的方法在稳定的哺乳动物细胞中产生:用预定比率的编码所述抗体的核酸转染至少一种稳定的哺乳动物细胞;以及使该核酸在该至少一种哺乳动物细胞中表达。在一些实施方案中,在瞬时转染实验中确定核酸
的预定比率以确定导致表达产物中抗体的百分比最高的输入核酸的相对比率。
[0402]
在一些实施方案中,提供了如本文所述的在稳定的哺乳动物细胞中产生抗体的方法,其中如与单体重链或轻链多肽或其他多肽相比,所述至少一种稳定哺乳动物细胞的表达产物包含更大百分比的期望抗体。
[0403]
在一些实施方案中,提供了本文描述的在稳定的哺乳动物细胞中产生抗体的方法,所述方法包括鉴定和纯化期望抗体。在一些实施方案中,所述鉴定是通过液相色谱法和质谱法中的一者或两者来进行。
[0404]
如果需要,可以在表达后纯化或分离所述抗体。可以以本领域技术人员已知的多种方式分离或纯化蛋白质。标准纯化方法包括在大气压或在高压下使用诸如fplc和hplc的系统进行的色谱技术,包括离子交换、疏水相互作用、亲和、尺寸排阻或凝胶过滤和反相色谱技术。纯化方法还包括电泳、免疫学(immunological)、沉淀、透析和色谱聚焦技术。与蛋白质浓缩相结合的超滤和渗滤技术也是有用的。如本领域所熟知的,多种天然蛋白质结合fc和抗体,并且这些蛋白质可以在本发明中用于纯化抗体。例如,所述细菌蛋白a和g与fc区结合。同样,所述细菌蛋白l与一些抗体的fab区结合。纯化往往可以由特定的融合伴侣实现。例如,如果采用gst融合,则可以使用谷胱甘肽树脂纯化抗体,如果使用his标签则使用ni
+2
亲和色谱法,或者如果使用flab标签则使用经固定的抗flag抗体。对于合适的纯化技术的一般指导,参见,例如通过引用protein purification:principles and practice,第3版,scopes,springer-verlag,ny,1994完全并入,该文献通过引用完全并入本文。必要的纯化程度将根据抗体的用途而有所不同。在一些情况下,不需要纯化。
[0405]
在某些实施方案中,所述抗体是使用阴离子交换色谱法来纯化,所述阴离子交换谱法包括但不限于在q-琼脂糖、deae琼脂糖、poros hq、poros deaf、toyopearl q、toyopearl qae、toyopearl deae、resource/source q和deae、fractogel q和deae柱上的色谱法。
[0406]
在具体实施方案中,本文所述的蛋白质使用阳离子交换色谱法纯化,所述阳离子交换色谱法包括但不限于sp-琼脂糖、cm琼脂糖、poros hs、poros cm、toyopearl sp、toyopearl cm、resource/source s和cm、fractogel s和cm柱及其等效物和可比物。
[0407]
此外,本文所述的抗体可以使用本领域已知的技术(例如,参见creighton,1983,proteins:structures and molecular principles,w.h.freeman&co.,n.y和hunkapiller等人nature,310:105-111(1984))化学合成。例如,对应于多肽片段的多肽可以利用肽合成仪来合成。此外,如果需要,可以将非经典氨基酸或化学氨基酸类似物作为置换或添加引入多肽序列中。非经典氨基酸包括但不限于常见氨基酸的d-异构体、2,4-二氨基丁酸、α-氨基异丁酸、4-氨基丁酸、abu、2-氨基丁酸、g-abu、e-ahx、6-氨基己酸、aib、2-氨基异丁酸、3-氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺基丙氨酸(cysteic acid)、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸、环己基丙氨酸、丙氨酸、氟氨基酸、设计氨基酸(诸如甲基氨基酸、c-甲基氨基酸、n-甲基氨基酸和一般氨基酸类似物)。此外,所述氨基酸可以是d(右旋)或l(左旋)。
[0408]
v.药物组合物
[0409]
本文提供了药物组合物,其包含抗苗勒管激素受体2(amhr2)抗体和药学上可接受的载剂或赋形剂。本技术提供了包含抗体的组合物,包括包含任何一种或多种本文所述的
抗体和一种或多种药学上可接受的赋形剂的药物组合物。在一些实施方案中,所述组合物是无菌的。所述药物组合物通常包含有效量的抗体。
[0410]
除了一种或多种本文公开的抗体之外,这些组合物还可以包含药学上可接受的赋形剂、载剂、缓冲剂、稳定剂或本领域技术人员熟知的其他材料。此类材料应无毒且不应干扰活性成分的功效。载剂或其他材料的确切性质可取决于施用途径,例如口服、静脉内、皮肤或皮下、鼻、肌内、腹膜内途径。
[0411]
本文公开的药物组合物可以特别配制用于以固体或液体形式施用,包括适合于以下施用途径的那些固体或液体形式:(1)经口施用,例如,灌服剂(drench)(水性或非水性溶液或悬浮液)、片剂(例如,针对经颊、舌下或全身吸收的那些)、大丸剂(bolus)、粉剂、颗粒剂或糊剂(例如,用于施加到舌部);(2)肠胃外施用,例如,通过皮下、肌内、静脉内或硬膜外注射来施用。适用于肠胃外施用的制剂的非限制性实例包括无菌溶液、无菌悬浮液和缓释制剂。
[0412]
用于经口施用的药物组合物可以是片剂、胶囊剂、粉剂或液体形式。片剂可以包含固体载剂,诸如明胶或佐剂。液体药物组合物通常包含液体载剂,诸如水、石油、动物油或植物油、矿物油或合成油。可以包含生理盐水溶液、右旋糖或其他糖溶液或二醇类,诸如乙二醇、丙二醇或聚乙二醇。
[0413]
适用于肠胃外施用的药物组合物可以作为药学上可接受的无菌等渗水溶液或非水溶液、分散体、悬浮液或乳液提供。替代地或另外地,用于肠胃外施用的药物组合物可以作为无菌粉末提供,该无菌粉末可以在临使用前重构为无菌可注射溶液或分散体。此类可注射溶液可以含有一种或多种使制剂与预期接受者的血液等渗的剂、一种或多种助悬剂和/或一种或多种增稠剂。例如,可注射溶液可包含糖、醇、抗氧化剂、缓冲剂、抑菌剂和溶质中的一种或多种。
[0414]
合适的水性和非水性的药学上可接受的载剂的实例包括但不限于水、乙醇、多元醇(诸如丙三醇、丙二醇、聚乙二醇等)和它们的合适混合物;植物油,诸如橄榄油;以及可注射的有机酯,诸如油酸乙酯。例如,可以通过使用包衣材料(诸如卵磷脂)、通过维持所需的粒度(在分散体的情况下)以及通过使用表面活性剂来维持适当的流动性。
[0415]
本文公开的药物组合物可被配制成乳液。例如,提供了配制为乳液的疫苗组合物,其提供了基于铝的疫苗的替代物。如本文进一步描述的,乳液制剂可以通过用油(诸如任何可代谢的油)乳化溶解在水性缓冲液中的抗原来制备。乳液制剂可以形成短寿命的贮库以促进先天免疫细胞对疫苗的吞噬作用,从而产生免疫反应(leenaars,koedam等人,1998)。与包含明矾佐剂的疫苗相比,此类乳液中使用的油可以赋予独特的免疫刺激并产生更强的免疫反应(de gregorio,caproni等人,2013)。
[0416]
在一些实施方案中,本公开提供了一种药物组合物,其包括如本文所述的包含抗原和可代谢油的乳液,例如油包水乳液。例如,在一些实施方案中,本公开提供了一种药物组合物,其包含α-乳清蛋白多肽、酵母聚糖和可代谢的油。
[0417]
在某些实施方案中,本公开提供了一种药物组合物,其包含用约40-60体积%的可代谢的油(任选地其中混合有如本文进一步描述的碳水化合物)乳化的约40-60体积%的水相抗原。例如,所述药物组合物可包含约0.1-25mg/ml(例如,0.5-5mg/ml)的在约50体积%的可代谢的油/碳水化合物组合物中的抗原。
[0418]
在一些实施方案中,本文公开的药物组合物的乳液是通过将水相抗原与可代谢的油以从约1.5:1至约1:1.5,诸如约1.5:1、约1.4:1、约1.3:1、约1.2:1、约1.1:1、约1:1、约1:1.1、约1:1.2、约1:1.3、约1:1.4或约1:1.5或介于其间的任何值的比率混合形成的。在一些实施方案中,将碳水化合物在形成乳液之前悬浮在可代谢的油中。在一些实施方案中,将酵母聚糖在形成乳液之前悬浮在可代谢的油中。
[0419]
本文公开的药物组合物可以通过本领域技术人员已知的常规方法配制成药学上可接受的剂型。
[0420]
在一些实施方案中,可代谢的油和/或碳水化合物在所提供的药物组合物中可以充当增加药物组合物的免疫原性的佐剂。
[0421]
对于静脉内、皮肤或皮下注射,或在痛苦部位的注射,活性成分将是肠胃外可接受的水性溶液的形式,该水性溶液无热原并具有合适的ph、等渗性和稳定性。本领域的相关技术人员能够很好地使用例如等渗媒介物诸如氯化钠注射液、林格注射液、乳酸林格注射液来制备合适的溶液。防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂可以根据需要包含在内。
[0422]
组合物可以单独施用或与其他治疗组合同时或依序施用,这取决于待治疗的病状。
[0423]
制备这些制剂或组合物的方法可以包括将抗原与碳水化合物、可代谢的油、药学上可接受的载剂和任选的一种或多种辅助成分结合的步骤。一般而言,制剂可通过使一种或多种本文描述的组合物成分与液体的药学上可接受的载剂、微细的固体的药学上可接受的载剂或二者均匀并紧密地结合,随后在需要时使产物成型而制备。
[0424]
无论是多肽、抗体(例如,抗-amhr2抗体)、核酸、小分子或其他需要给予个体的药学上有用的化合物,施用优选以“治疗有效量”或“预防有效量”(视情况而定,但是预防治疗可被视为治疗)进行,这足以显示对个体的益处。施用的实际量和施用的速度和时间-过程将取决于所治疗的蛋白质聚集疾病的性质和严重程度。治疗处方,例如剂量决定等,在全科医生和其他医生的责任范围内,并通常会考虑要治疗的病症、个体受试者的病状、递送部位、施用方法以及从业者已知的其他因素。上面提到的技术和方案的实例可以在remington's pharmaceutical sciences,第16版,osol,a.(编者),1980中找到。
[0425]
vi.药盒和生产制品
[0426]
本技术提供了药盒,其包含任何一种或多种本文所述的抗体和/或疫苗组合物。在一些实施方案中,所述药盒进一步含有选自任何二级抗体的组分、免疫组化分析试剂、药学上可接受的赋形剂和使用说明书以及它们的任何组合。在一个具体实施方案中,所述药盒包含药物组合物,所述药物组合物包含任何一种或多种本文所述的抗体组合物,以及一种或多种药学上可接受的赋形剂。
[0427]
本技术还提供了制品,其包括任何一种本文所述的抗体组合物或药盒。制品的实例包括小瓶(包括经密封的小瓶)。
[0428]
实施例
[0429]
以下是用于实施本发明的具体实施方案的实施例。提供实施例仅为了说明目的而并非意图以任何方式限制本发明的范围。已经努力确保关于所使用的数值(例如,量、温度等)的准确性,但也应允许一些实验误差和偏差。
[0430]
实施例1:人amhr2-ed抗体的生成
[0431]
材料和方法
[0432]
重组人amhr2-ed的生成
[0433]
人amhr2的重组胞外结构域(rhamhr2-ed;ncbi参考序列:ng_015981.1;uniprot q16671)是作为无内毒素的c末端六组氨酸(6xhis-)标记的融合蛋白生成和纯化的,如先前mazumder等人(2017)cancer prev res(phila)10:612-24中所述。用于重组融合蛋白的人amhr2的胞外结构域在本文中描述于seq id no:11中。
[0434]
免疫和杂交瘤的生成
[0435]
雌性balb/cj小鼠购自jackson laboratory(存货编号000651;bar harbor,me),并在7-8周龄时用100μg rhamhr2-ed在100μl usp级水和100μl sigma adjuvant(#s6322;sigma-aldrich,st.louis,mo)中的乳液进行免疫。每只小鼠接受以2-3周间隔执行的四次同一的免疫,首次免疫是皮下(sc)施用,其余的三次加强免疫则通过腹膜内施用。最后一次免疫后三天,使用聚乙二醇(peg;sigma-aldrich)将来自经免疫小鼠的脾细胞与小鼠骨髓瘤细胞系sp2/o-ag14(#crl-1581;american type culture collection(atcc),manassas,va)融合。将融合的杂交瘤细胞在补充有次黄嘌呤-氨基蝶呤-胸苷(hat;thermo fisher,waltham,ma)的dmem-20/hepes/丙酮酸盐培养基中在37℃及5%co2的加湿空气中培养。第15天,当细胞为约25%汇合时,使用重组小鼠β-酪蛋白作为特异性对照,通过如下所述的elisa测试杂交瘤上清液与rhamhr2-ed的抗原特异性结合。随后通过有限稀释对抗原特异性杂交瘤进行亚克隆,如上所述纯化其上清液,并使用mouseisotyping panel(bio-rad,hercules,ca)对经亚克隆的单克隆抗体(mab)进行同种型分析。将杂交瘤克隆在含有10%胎牛血清(fbs)或超低igg fbs的dmem(hyclone,logan,ut)中生长至达到对数生长期。通过使用pierce protein g igg结合缓冲液(thermo fisher)进行蛋白g层析(genscript biotech,piscataway,nj),接着使用pierce igg洗脱缓冲液(thermo fisher)进行洗脱来从杂交瘤上清液纯化出mab。将mab收集在ph 9.0的1m tris-hcl中。将所有收集的级分浓缩,用1mg/ml的盐水重构,从0.22μm过滤器上通过,并在-20℃下储存直至需要。
[0436]
竞争性elisa
[0437]
mab的特异性是通过竞争性elisa确定的。简而言之,将mab与浓度不断增加的rhamhr2-ed在含有0.02%吐温20(bio-rad)的液相pbs中在4℃下温育24小时。将抗原-抗体混合物加入到预先用4μg/ml rhamhr2-ed包被并且随后用1%bsa(sigma-aldrich)封闭的96孔maxisorp微量滴定板(corning life sciences,tewksbury,ma)中。用重组小鼠β-酪蛋白作为特异性对照。然后将孔同与辣根过氧化物酶(hrp;milliporesigma,burlington,ma)缀合的二级抗小鼠igg一起温育,随后加入2,2'-联氮基-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(abts)底物(sigma-aldrich)。光密度是由405nm下的吸光度确定的。
[0438]
人eoc细胞系
[0439]
人卵巢癌8(ovcar8)eoc细胞系是商购获得的(atcc#cvcl-1629),并由genetica dna laboratories(burlington,nc)认证。使ovcar8细胞在补充有来自绝经后女性的10%人血清(低/无amh;bioivt,westbury,ny)、5%hepes缓冲液(sigma-aldrich)、2mm l-谷氨酰胺(thermo fisher)和1%青霉素/链霉素(invitrogen,carlsbad,ca)的dmem中生长。定
期测试ovcar8的支原体,并且其传代次数不超过10次。amhr2-ovcar8细胞系是通过将人amhr2的转录变异体1(登记号nm_020547;origene,rockville,md)克隆到pez-m68载体(genecopoeia,rockville,md)中,并且利用该表达载体使用3000(thermo fisher)转染ovcar8细胞而生成。如上针对亲本ovcar8细胞所描述的那样使amhr2-ovcar8细胞生长。
[0440]
eoc细胞裂解物的生成和蛋白质印迹
[0441]
来自细胞系、组织,或来自新鲜人高度浆液性卵巢癌(hgsoc)的裂解物是通过在dmem中切碎和压碎,随后用胶原酶(sigma-aldrich)和dna酶(invitrogen)处理来制备。将悬浮液离心以去除碎片,将裂解物在pbs中洗涤,并将来自每种裂解物的25μg蛋白质加载到变性sds-page凝胶(bio-rad)的每个泳道中。将凝胶转移到聚偏二氟乙烯(pvdf)膜(bio-rad)上,并用0.001μg/ml的作为一级抗体的4d12g1 mab处理。在图2d中,使用可商购获得的1.0μg/ml amhr2-ed mab(#sc-377413;santa cruz biotechnology,dallas,tx)替代4d12g1 mab作为用于检测amhr2-ed的一级抗体。通过使用一级兔抗体检测完整的116kda聚(adp-核糖)聚合酶-1(parp-1)及其与细胞凋亡相关的89kda的经切割的变异体(cell signaling technology,danvers,ma),利用使用裂解物的蛋白质印迹检测用浓度不断增加的4d12g1 mab(1.0-10μg/ml)处理的amhr2-ovcar8细胞中parp-1的半胱天冬酶-3介导的切割。二级检测抗体包括用hrp缀合的兔抗小鼠igg(milliporesigma)的1:10,000稀释液或hrp缀合的山羊抗兔抗体(milliporesigma)的1:5,000稀释液处理。在所有情况下,使用针对β-肌动蛋白的一级mab(sigma-aldrich)归一化裂解物负载,阴性对照裂解物是由人前列腺癌细胞系c4-2(#crl-3314)产生,并且使用hyglo
tm
化学发光系统(thomas scientific,swedesboro,nj)显色印迹。
[0442]
免疫组织化学
[0443]
在福尔马林固定、石蜡包埋的5μm切片上对人hgsoc和正常邻近组织进行免疫染色。一级抗体包括0.005μg/ml纯化的4d12g1mab(用于可视化amhr2-ed分布,随后用hrp缀合的抗小鼠igg(abcam,cambridge,uk)检测)和兔多克隆半胱天冬酶-3抗体(r&d systems,minneapolis,mn)(用于检测凋亡细胞,然后检测hrp缀合的抗兔igg(abcam))。
[0444]
流式细胞术
[0445]
将收获的细胞用fc受体阻滞剂(bd biosciences,san jose,ca)处理,并与针对rhamhr2-ed产生的纯化mab或与同种型对照小鼠igg一起温育。然后用fitc标记的山羊抗小鼠igg(bd biosciences)处理细胞,并使用facsaria ii流式细胞仪和bdfacsdiva软件(bd biosciences)通过流式细胞术分析该细胞的抗原特异性。使用针对amhr2-ed(abcam)的可商购获得的mab执行阳性对照染色,而具有不相关特异性的小鼠igg1同种型抗体(thermo fisher)则用作阴性对照。在竞争性结合测定中使用重组人amh(lsbio,seattle,wa)和重组卵清蛋白(sigma-aldrich)。
[0446]
4d12g1 mab识别的amhr2-ed序列的鉴定
[0447]
竞争性elisa被用于确定4d12g1 mab识别的amhr2-ed序列。生成了一组跨越人amhr2-ed的整个132个氨基酸的序列的重叠的16聚体肽。每个肽移位一个氨基酸并且所有半胱氨酸残基都被丝氨酸替换,以避免二硫键形成(thermo fisher)。将单独的16聚体肽以固相铺板在微量滴定孔中,将浓度不断增加的每种16聚体肽与呈液相的4d12g1 mab一起温
育,并如上所述的那样执行elisa。4d12g1 mab的结合位点是使用重叠肽通过竞争性elisa确认的,该重叠肽含有针对跨越amhr2-ed的免疫反应区的每个氨基酸的丙氨酸置换。将被置换的肽以液相与4d12g1 mab一起用于确定对固相中rhamhr2-ed的结合抑制。4d12g1 mab的amhr2-ed结合序列和用于此类结合的关键amhr2-ed残基是由spot肽阵列确认的。在纤维素膜(jpt peptide technologies,berlin,germany)上合成了》90%纯度的跨越amhr2-ed 9-40免疫反应区且长度范围为4-16聚体的肽,将其用封闭缓冲液(thermo fisher)处理过夜,随后用1.0μg/ml的4d12g1 mab在室温下处理3小时,随后用含有0.01%吐温-20(bio-rad)的pbs洗涤3次。然后将该膜用hrp缀合的兔抗小鼠igg(milliporesigma)的1:10,000稀释液处理,随后用含有0.01%吐温20(bio-rad)的pbs洗涤3次。使用hyglo化学发光系统(thomas scientific)检测结合的抗体。
[0448]
表面等离子体共振(spr)
[0449]
4d12g1 mab和rhamhr2-ed之间的平衡解离常数(kd)是由使用biacore 3000仪器(ge healthcare bio-sciences,piscataway,nj)在25℃下通过spr实时测量的高灵敏度结合来确定的。简而言之,将300nm的4d12g1 mab在ph 5.0的乙酸钠中稀释,并使用n-乙基-n'-(3-二甲基氨基丙基)碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs;sigma-aldrich)的水溶液将该4d12g1 mab共价固定在金表面上的羧甲基化葡聚糖上。在含有10mm hepes ph 7.4、150mm nacl、3mm edta和0.005%p20洗涤剂的运行缓冲液中的不同浓度(10-1-103nm)的rhamhr2-ed受体分析物通过以30ml/min流过固定的4d12g1配体而被捕获。使用ph 1.7的10mm甘氨酸(sigma-aldrich)执行流动池的再生。通过减去对照流动池的低信号和4d12g1 mab的解离曲线来校正所有传感图。考虑到亲和力和亲合力的kd值是使用langmuir 1:1拟合模型和biaevaluation 3.2软件(ge healthcare bio-sciences)计算的。
[0450]
人amhr2-ed的分子建模
[0451]
使用phyre2和3dligandsite工具对amhr2-ed执行分子建模。基于启发式方法选择了四个模板对amhr2-ed进行建模,以最大限度地提高置信度、同一性百分比和比对覆盖率。这些模板包括:1)用于激活素2型受体(acvr2)的胞外结构域的1bte;2)用于激活素受体样激酶1(alk1)的4fao;3)用于2型骨形态发生蛋白受体(bmpr2)的2hlq;和4)用于骨形态发生蛋白2(bmp2)的三元配体-受体复合物的2h62。选择具有100%置信度的结构建模进行后续分析。使用pymol molecular graphics system 1.5.0.5版可视化amhr2-ed蛋白质片段。
[0452]
程序性细胞死亡的实时成像
[0453]
将amhr2-ovcar8细胞与绿色荧光染料incucyte cytotox(essen bioscience,ann arbor,mi)一起在含有10μg/ml 4d12g1 mab或igg1同种型对照mab的无补体dmem中在37℃下一起温育16小时。使用incucyte s3活细胞分析对细胞死亡进行实时成像。
[0454]
检测parp-1切割
[0455]
parp-1是一种116kda的核蛋白,该核蛋白是半胱天冬酶-3的主要切割靶点之一,导致生成89kda的片段,该片段可被检测为程序性细胞死亡的特征。用不同浓度的4d12g1 mab处理amhr2-ovcar8细胞24小时,并使用识别完整parp-1和经切割的parp-1二者的抗体(cell signaling technology,danvers,ma;parp 46d11兔mab#9532)通过蛋白质印迹检查细胞裂解物中是否存在完整parp-1及其89kda的经切割的变异体。来自未处理细胞的裂解物用作对照,并使用针对β肌动蛋白(sigma-aldrich)的一级mab对裂解物负载进行归一化。
印迹是使用hyglo
tm
化学发光系统(thomas scientific)显影的。
[0456]
4d12g1 mab的内化
[0457]
通过免疫荧光检查在amhr2-ovcar8细胞中与amhr2-ed结合后4d12g1 mab的内化。将处于对数生长期的amhr2-ovcar8细胞用5μg/ml的在含有0.1%bsa(sigma-aldrich)的pbs中的4d12g1 mab在37℃或4℃下处理不同时间。几次洗涤后,将细胞用3.7%甲醛固定,并用含有0.4%triton-x100(sigma-aldrich)的pbs渗透。洗涤后,将细胞与alexa fluor 488缀合的抗小鼠igg(abcam)一起在室温下温育1小时。将细胞核在室温下用4',6-二脒基-2-苯基吲哚(dapi;sigma-aldrich)染色30分钟,使用vectashield antifade mounting media(vector laboratories,burlingame,ca)将盖玻片固定在载玻片上,然后通过荧光显微镜观察该细胞。
[0458]
补体依赖性细胞毒性(cdc)测定
[0459]
用不同浓度的4d12g1 mab或同种型对照mab洗涤和处理amhr2-ovcar8细胞。然后将该细胞在含有10%正常人血清或10%热灭活正常人血清的96孔平底板(corning life sciences)中温育。4小时后,去除上清液样本并用裂解缓冲液处理培养物。使用cyquant ldh细胞毒性测定试剂盒(thermo fisher)对细胞外的和总的乳酸脱氢酶(ldh)活性进行量化,该试剂盒测量ldh催化的乳酸向丙酮酸的转化以及随后在490nm处测量的四唑盐向红色甲臜产物的还原。甲臜形成的水平与释放到培养基中的ldh活性的量成正比,并且释放的ldh百分比由在培养细胞中检测到的测量的总ldh活性确定。
[0460]
抗体依赖性细胞吞噬作用(adcp)测定
[0461]
将靶amhr2-ovcar8细胞用celltracker green cmfda染料(thermo fisher)标记,并与不同浓度的4d12g1 mab或同种型对照mab一起在补充有10%fbs的dmem中温育。30分钟后,将来源于c57bl/6骨髓(sciencell research laboratories,carlsbad,ca)的分化型巨噬细胞作为效应细胞添加到效应器中,以达到10:1的效应器:靶细胞比率。3天后,通过流式细胞仪测定活靶细胞的百分比来测定adcp。
[0462]
ovcar8和患者来源的异种移植物(pdx)
[0463]
雌性无胸腺裸小鼠(nu/j,jax存货编号002019)是在6-8周龄时购买(jackson laboratory),用作ovcar8异种移植物的受体。雌性nod-scid il2rgamma
null
(nsg)免疫缺陷小鼠是在6-8周龄时从cleveland clinic biological resources unit(cleveland,oh)购买。将5
×
106ovcar8个细胞皮下注射到6-8周龄的(a)nsg小鼠和(b)无胸腺裸鼠的侧腹中。当肿瘤在约50mm3时可被触及时,每周一次向小鼠腹膜内(i.p.)注射200μg 4d12g1 mab或同种型对照mab,连续5周。当肿瘤达到3cm3时终止实验。pdx是通过将来自患者的hgsoc植入到6-8周龄的雌性nsg小鼠中产生的。将新鲜切除的肿瘤切成约2mm3大小的碎片,并皮下植入到侧腹区域中,然后滴入4℃冷冻的matrigel(corning life sciences)。将直接植入了患者肿瘤样本的小鼠指定为p1。使用游标卡尺定期测量肿瘤生长。将p1终点肿瘤剖出并且如上所述的那样植入到新的雌性nsg小鼠中。将传代≥p2用于研究每周一次连续5周(从肿瘤变得可触及时开始)i.p.注射200μg4d12g1 mab或同种型对照mab的功效。
[0464]
eoc细胞表面上amhr2受体密度的量化
[0465]
amhr2受体密度是使用系列的6个包被有不同但明确数量的小鼠mab的珠群(agilent technologies,carpinteria,ca)在由ovcar8异种移植物和pdx获得的肿
瘤细胞上测量的。以4d12g1 mab作为一级抗体在饱和浓度下对样本细胞进行标记,使得结合的4d12g1 mab抗体分子的数量与抗原位点的数量相对应。然后将细胞与珠、与fitc缀合的多克隆山羊抗小鼠免疫球蛋白以及与饱和浓度的山羊f(ab')2平行温育。通过将单个珠群的平均荧光强度(mfi)对珠上的mab分子数目作图来构建校准曲线。然后通过插值法确定样本细胞上抗原位点的数目并且将该抗原位点的数目表示为amhr2受体数目/细胞数目。
[0466]
统计学分析
[0467]
使用双因素方差分析(anova)比较了肿瘤大小、cdc测定和表位作图的竞争性elisa分析的差异。使用单样本学生t检验比较了通过流式细胞术进行的adcp测定和单克隆抗体与人细胞的结合测定的差异。当p≤0.05(95%置信区间)时,所有差异均被认为具有统计学意义。所有实验独立重复3次。
[0468]
结果
[0469]
对rhamhr2-ed特异的mab的生成
[0470]
使用重组小鼠β-酪蛋白作为特异性对照,通过elisa筛选约300种杂交瘤上清液以检测对rhamhr2-ed的特异性。12个杂交瘤显示出高滴度的amhr2-ed特异性反应(图1a)。基于与ovcar8细胞的流式细胞术结合分析(数据未示出),通过有限稀释选择出4d12亲本杂交瘤以进行亚克隆。4d12的亚克隆产生了4d12c6、4d12c7和4d12g1三个亚克隆,其中的每一者均表达igg1/κ-链同种型(图1b)并且在竞争性elisa(图1c)和ovcar8细胞的流式细胞术分析(图1d)中表现出抗原特异性。进一步检查了4d12g1 mab。
[0471]
4d12g1 mab包含seq id no:7中描述的vh序列(包含seq id no:1中描述的cdr-h1、seq id no:2中描述的cdr-h2和seq id no:3中描述的cdr-h3)和seq id no:8中描述的vl序列(包含seq id no:4中描述的cdr-l1、seq id no:5中描述的cdr-l2和seq id no:6中描述的cdr-l3)。
[0472]
4d12g1 mab识别人eoc中的amhr2
[0473]
4d12g1 mab被用于检测源自新鲜hgsoc组织的人eoc细胞原代培养物中的amhr2。流式细胞术分析表明,4d12g1在58.2%的原代hgsoc-1细胞和93.7%的原代hgsoc-2细胞中检测到amhr2,同种型对照mab分别仅与1.5%和1.1%的培养的细胞结合(图2a)。通过蛋白质印迹分析,4d12g1 mab对七种不同的原发性hgsoc组织裂解物以及源自取自正常c57bl/6幼年雌性小鼠的卵巢的阳性对照裂解物进行了免疫染色,从而指示4d12g1 mab在识别人和小鼠amhr2-ed中的交叉反应特征(图2b)。4d12g1 mab未对源自c4-2人前列腺癌细胞系的阴性对照裂解物进行免疫染色。用β-肌动蛋白抗体(sigma-aldrich)进行的免疫染色被用于确认归一化的裂解物负载。4d12g1 mab被用于对13个来自平均年龄60.2岁、范围38-76岁的女性的原发性hgsoc组织(表1)和与eoc肿瘤相邻的正常输卵管组织的免疫组织化学染色。提供的是从平均年龄64岁、范围59-70岁的患者1-4获得的结果。箭头指示四个hgsoc肿瘤实质被染色(图2c,左栏),间质区域未被染色,正常相邻输卵管组织的任何区域均未被染色(图2c,右栏)。四个未被4d12g1 mab染色的正常相邻输卵管组织来自59-70岁的绝经后女性,因此预计不会表达amhr2-ed,即一种在绝经后卵巢中“退休”而不表达的蛋白质结构域。
[0474]
表1.eoc患者以及他们的被检查的肿瘤的详细信息
22
lgell
26
代表4d12g1 mab结合所需的最小序列(图3d)。使用具有跨越免疫反应区并且在每个n末端残基处含有丙氨酸置换的膜结合的17聚体肽的spot阵列获得了额外的结合详细信息。结果表明,
20
ktlgell
26
序列的leu22、gly23和leu26残基的丙氨酸替换完全消除了与4d12g1 mab的结合(图3e)。因此,l22、g23和l26代表结合4d12g1 mab的必需残基。最后,我们使用表面等离子体共振(spr)测量4d12g1 mab和amhr2-ed之间在119pm下的平衡解离常数(kd)(数据未示出)。
[0483]
人amhr2-ed的分子建模
[0484]
为了在整个amhr2-ed蛋白的背景下对4d12g1 mab的结合位点区域进行成像,使用phyre2和3dligandsite工具执行分子建模,并使用pymol molecular graphics system 1.5.0.5版可视化最高置信度模型。amh同源配体的建议结合位点包括跨越amhr2-ed 4-154rrtcvffeapgv
15
的关键天然amh i结合位点,其在主要氨基酸序列中以红色表示(图4a)并且在带状模型中作为红色β折叠表示,与在一级序列中(图4a)和在带状模型中作为β折叠(图4b)都以蓝色描绘的4d12g1 mab的
20
ktlgell
26
结合位点并置但反平行。另一个跨越amhr2-ed 34-42 34
rairclysr
42
的强amh ii结合位点由也与4d12g1 mab的
20
ktlgell
26
结合位点相邻的黄色长环表示(图4b)。绿色表示的跨越amhr2-ed 46-50 46
giwnl
50
的弱amh iii结合位点和青色表示的跨越amhr2-ed 83-91 83
pspgstlft
91
的甚至更弱的amh iv结合位点与4d12g1 mab的
20
ktlgell
26
结合位点相距甚远(图4b)。4d12g1 mab的蓝色
20
ktlgell
26
结合位点与红色amh i结合位点4rrtcvffeapgv
15
和黄色amh ii结合位点
34
rairclysr
42
的并置在带状模型的顶视图(图4c)中以及在90
°
旋转视图(图4d)中也很明显。因此,4d12g1 mab识别的amhr2-ed结合位点非常靠近关键的主要和次要amh结合位点,这一特征可能解释了amh与4d12g1 mab竞争与amhr2-ed结合的能力(图2f)。这一观点得到以下事实的支持:另一种针对amhr2-ed的特征性mab,即12g4 mab,可能无法与amh竞争amhr2-ed受体结合,因为它识别了amhr2-ed的
53
draqvem
59
序列(在整个图4中为紫色),该序列远离强amh i和amh ii结合位点,并且更接近与amh与amhr2-ed弱结合相关的amh iii和amh iv结合位点。
[0485]
4d12g1 mab诱导eoc细胞的程序性细胞死亡
[0486]
为了确定4d12g1 mab是否通过抗体介导的程序性细胞死亡诱导来抑制eoc肿瘤的生长,我们通过在补充有热灭活血清的dmem中用4d12g1 mab体外处理的amhr2-ovcar8细胞的实时成像来评估细胞凋亡的实时诱导。结果表明,与用同种型对照igg1 mab处理16小时相比(图5a;左图),用4d12g1 mab处理16小时在amhr2-ovcar8细胞中诱导了显著水平的细胞凋亡(图5a;右图)。
[0487]
检测parp-1切割
[0488]
parp-1是一种116kda的核蛋白,该核蛋白是半胱天冬酶-3的主要切割靶点之一,导致生成89kda的片段,该片段可被检测为程序性细胞死亡的特征。因此,我们检查了4d12g1 mab是否能够由于诱导凋亡信号而切割parp-1。用不同浓度的4d12g1 mab处理amhr2-ovcar8细胞24小时,然后通过蛋白质印迹检查细胞裂解物中是否存在经切割的89kda parp-1片段。结果表明,在低至1.0μg/ml的4d12g1 mab剂量下在裂解物中检测到经切割的parp-1(图5b)。用β-肌动蛋白抗体(sigma-aldrich)进行的免疫染色被用于确认归一化的裂解物负载。
[0489]
amhr2-mab复合物的内化
[0490]
由于同源amh/amhr2信号转导涉及内吞受体内化,因此我们检查了这个过程是否发生在用4d12g1 mab处理的amhr2-ovcar8细胞中。将amhr2-ovcar8细胞与4d12g1 mab一起在37℃(图5c;左栏)或4℃(图5c;右栏)下温育不同时间段。在37℃下用4d12g1 mab处理后1小时,4d12g1 mab与amhr2受体的复合物在amhr2-ovcar8细胞的细胞质中很明显,并且细胞质mab-受体复合物的簇状模式在37℃下处理后2和3小时越来越明显。相比之下,在4℃下用4d12g1 mab处理甚至在处理后3小时也几乎没有显示出细胞质抗体-受体复合物(图5c;右栏,中图)。在单独用二级检测抗体处理的细胞中未观察到染色(图5c;右栏,下图)。我们的结果表明,由4d12g1 mab与amhr2结合诱导的信号转导导致eoc细胞凋亡,同时伴随mab-amhr2复合物的内吞内化和半胱天冬酶-3介导的parp-1切割。
[0491]
4d12g1 mab通过cdc诱导eoc细胞裂解
[0492]
确定了4d12g1 mab介导cdc的能力。在含有补体的10%正常人血清或加热至灭活补体的10%正常人血清存在下,用不同剂量的4d12g1 mab体外处理amhr2-ovcar8细胞4小时。另外的对照包括在10%正常人血清或10%热灭活人血清存在下用不同剂量的同种型对照mab处理4小时的amhr2-ovcar8细胞。通过乳酸脱氢酶活性的释放来测量细胞裂解。结果表明,与4d12g1 mab在热灭活人血清存在下诱导的裂解相比,4d12g1 mab在含有补体的正常人血清存在下诱导显著增加的细胞裂解(p《0.0001)(图5d)。
[0493]
4d12g1 mab通过adcp诱导eoc细胞裂解
[0494]
确定了4d12g1 mab介导adcp的能力。用绿色荧光染料标记amhr2-ovcar8靶细胞,并且将该细胞在没有任何血清的情况下与两种不同浓度的4d12g1 mab或同种型对照mab一起温育30分钟。将经洗涤过的细胞与来自c57bl/6小鼠骨髓的效应巨噬细胞以10:1的效应子:靶细胞比率混合,并且在3天后通过流式细胞术确定活靶细胞的百分比。用100ng/ml(p=0.001)和1000ng/ml(p=0.0002;图5e)的4d12g1 mab处理的amhr2-ovcar8细胞中活靶细胞百分比与用同种型对照mab的相同处理相比明显降低。
[0495]
4d12g1 mab抑制异种移植的人eoc的生长
[0496]
将ovcar8细胞和人hgsoc肿瘤皮下注射到免疫缺陷小鼠的侧腹中。当肿瘤在约50mm3时变得可被触及时,每周给小鼠i.p.注射200μg的4d12g1 mab或同种型对照mab,连续5周。结果表明,用4d12g1 mab处理可显著抑制严重免疫缺陷nsg小鼠(p《0.001;图6a)或t细胞缺陷无胸腺裸鼠(p《0.0001;图6b)中ovcar8肿瘤的生长。无胸腺裸小鼠中肿瘤生长与nsg小鼠相比的抑制显著增加可能反映不存在溶血补体系统、树突细胞功能降低以及nsg小鼠(而不是无胸腺裸小鼠)特有的巨噬细胞活性缺陷,从而排除了cdc和adcp免疫机制在nsg抗肿瘤反应中的贡献。用4d12g1 mab进行的处理显著抑制了由最近确诊的患者产生并且被异种移植到免疫缺陷nsg小鼠中的三个原发性hgsoc肿瘤的生长(在所有情况下p《0.0001),该三个原发性hgsoc肿瘤包括pdx-4(图6c)、pdx-6(图6d)和pdx-9(图6e)。与同种型对照mab处理的小鼠(图6f,左栏)相比,在用4d12g1 mab处理的小鼠(图6f,右栏)中通过箭头以20x示出了nsg小鼠中生长的ovcar8肿瘤(图6f,上排)和nsg小鼠中生长的pdx-4肿瘤(图6f,下排)中的半胱天冬酶-3阳性细胞的检测。示出的半胱天冬酶-3数据代表三个产生相似结果的实验。所有误差条都表示
±
sd。
[0497]
eoc细胞表面上amhr2受体密度的量化
[0498]
低至4,000amhr2受体/细胞可能足以介导amhr2-ed特异性mab对异种移植物中eoc
生长的抑制。为了进一步研究这个问题,我们使用系列包被珠(agilent technologies)和流式细胞术分析来测量异种移植到免疫缺陷小鼠中的eoc细胞上amhr2受体的细胞表面密度。在异种移植到裸小鼠中的ovcar8细胞、异种移植到nsg小鼠中的ovcar8细胞以及异种移植到nsg小鼠中的pdx-4、pdx-6和pdx-9hgsoc肿瘤细胞上测量的amhr2受体的细胞表面密度分别为2,674、3,917、2,674、22,286、8,907和10,067个受体/细胞(数据未示出)。这些结果表明,2,674个受体/细胞足以使4d12g1 mab介导异种移植物中eoc生长的抑制,与以前指示的4,000个amhr2受体/细胞阈值略有不同。这些数据表明,人hgsoc肿瘤在其细胞表面上具有足够的amhr2分子,从而为通过4d12g1mab处理介导卵巢癌的免疫疗法提供足够的可用靶标。
[0499]
总之,本实施例中的结果表明,4d12g1 mab是一种igg1,其在elisa、人eoc肿瘤的裂解物和免疫染色的人eoc组织中显示出与人amhr2-ed的高亲和力抗原特异性结合。4d12g1 mab识别7聚体amhr2-ed序列
20
ktlgell
26
,该序列位于同源抗苗勒管激素(amh)配体的一级和二级结合位点附近,从而使4d12g1 mab能够与amh有效竞争与amhr2-ed同源受体的结合。4d12g1 igg1 mab以119pm的高亲和力kd结合amhr2-ed,并通过诱导表达amhr2的人eoc细胞的大量凋亡并伴有受体-mab复合物的内吞内化和半胱天冬酶-3介导的parp-1切割发挥类似人amh同源配体的作用。此外,4d12g1 mab通过主要的细胞凋亡机制显著抑制免疫缺陷小鼠中人eoc异种移植物的生长,但也能够诱导针对eoc细胞的cdc和adcp。
[0500]
以引用的方式并入
[0501]
出于所有目的,本文提及的每篇专利和科学文献的全部公开内容都通过引用并入本文。
[0502]
等效方案
[0503]
在不脱离本发明的精神或基本特征的情况下,本发明能以其它具体形式来实施。因此,上述实施方案应在所有方面均被视为说明性的,而非是对本文所描述的本发明的限制。因此,本发明的范围是由随附权利要求而非由上述描述所指示,并且属于权利要求的等效性含义和范围内的所有变化都意图包括在其中。
[0504]
非正式序列表
[0505]
[0506]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1