合成高分子及其制备方法、成型材料以及成型体与流程
1.本公开涉及一种合成高分子及其制备方法、成型材料以及成型体。
背景技术:
2.由于蚕丝丝心蛋白和蜘蛛丝丝心蛋白等结构蛋白质能够发挥出优异的牢固性,因此其作为由合成树脂等构成的结构材料的替代物质而受到关注。近年来,随着重组技术的发展,模仿如上所述那样的结构蛋白质的重组结构蛋白质的量产技术正在开发中(例如,专利文献1)。
3.由于蛋白质在主链上具有多个酰胺基,在侧链上具有多个羧基、氨基、羰基、硫醇基等极性基团,因此在分子间形成多个氢键。因此,认为通过对结构蛋白质进行加热加压成型而得到的成型体的机械强度优异,但是也具有因受到冲击等而产生龟裂、裂纹等较脆的一面。如上所述那样的情况成为将蛋白质作为普通通用塑料的替代品而使用的阻碍。
4.现有技术文献
5.专利文献
6.专利文献1:国际公开第2015/178466号
技术实现要素:
7.发明所要解决的问题
8.当使用结构蛋白质形成成型体时,也可以考虑通过如通用塑料那样添加增塑剂来提高成型体的柔性。但是,增塑剂通常为疏水性的,并且与具有如上所述那样的多个极性基团的蛋白质之间的相容性低。根据本发明人等的研究,判明当在结构蛋白质中通过混合增塑剂以形成成型体时,在结构蛋白质与增塑剂之间会发生相分离,无法获得所期待的效果。此外,期望使用蛋白质或结构蛋白质的薄膜或纤维等通过加热加压成型以外的成型方法来制备的蛋白质成型体也具有高柔性。
9.本公开的目的在于提供一种能够制备具有优异柔性的成型体的合成高分子及其制备方法,其中,该合成高分子是一种具有肽骨架的高分子材料。本公开的目的还在于提供一种含有上述合成高分子的成型材料以及成型体。
10.用于解决问题的方法
11.本公开的一个侧面提供一种合成高分子,其具有包含多肽骨架的第一链段和与上述第一链段直接结合的一个或多个第二链段,上述第二链段包含对上述多肽骨架具有增塑功能的分子基团。
12.由于上述合成高分子具有第二链段,因此其与蛋白质同样地具有多肽骨架,同时作为合成高分子整体,成为柔性优异的材料。此外,由于上述合成高分子的第一链段和第二链段直接结合,因此减少了当将增塑剂与蛋白质简单地混合时那样的宏观相分离的发生。因此,能够制备柔性优异的成型体。
13.上述多肽骨架可以为疏水性多肽骨架。该疏水性多肽骨架的平均亲水指数(疏水
性程度:疏水性指标)可以为0.22以上。由于多肽骨架为如上所述那样的疏水性多肽骨架,因此与具有增塑功能的分子基团的第一链段之间的亲和性提高,并且可以制备柔性更为优异的成型体。
14.当将上述第一链段的分子量设为100时,上述第二链段的分子量可以为1~70范围内的值。由此,在使用合成高分子得到的成型体中,可以在保持第一链段的特性(例如高机械强度)的同时,有利地提高成型体整体的柔性。
15.上述第二链段可以包含来源于选自由聚醚、聚酯、聚碳酸酯、聚酰胺、多元醇、聚烯烃、聚缩醛、聚缩酮、聚(甲基)丙烯酸酯、硅酮、聚氨酯、聚亚烷基亚胺、酚醛树脂、尿素树脂、三聚氰胺树脂和多糖类构成的组中的至少一种的骨架。
16.上述第二链段可以包含选自由聚醚基、聚酯基、聚碳酸酯基、聚酰胺基、多元醇基和改性多糖基构成的组中的至少一种。
17.具有多个上述第一链段,并且上述第二链段的一部分也可以与2个以上的上述第一链段结合以形成网络结构。由于具有网络结构,例如由上述合成高分子构成的成型体可以发挥出较大的伸长率。此外,由于具有网络结构,例如由上述合成高分子构成的成型体可以被赋予作为弹性体的功能。
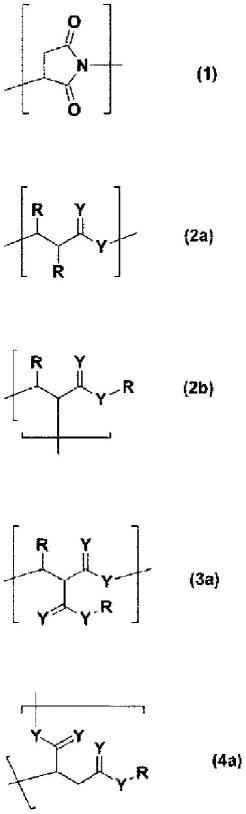
18.具有多个上述第一链段,并且上述第一链段和第二链段也可以交替结合。由于交替结合第一链段和第二链段,例如由上述合成高分子构成的成型体可以发挥出较大的伸长率。
19.上述第二链段包含多个上述分子基团,并且多个上述分子基团也可以彼此连接。可以进一步扩大第二链段的设计范围,并且可以更容易地调节合成高分子的柔性。
20.第二链段可进一步包含连接体(反应性官能团),并且上述分子基团和上述多肽也可以经由上述连接体结合。
21.上述连接体也可以包含选自由下述式(1)表示的结构单元、下述通式(2a)~(6)表示的结构单元、下述式(7)表示的结构单元、下述通式(8a)~(9)表示的结构单元、下述通式(10)~(11b)表示的结构单元以及下述通式(13)~(16)表示的结构单元构成的组中的至少一种。
22.[化学式1]
[0023][0024]
[化学式2]
[0025][0026]
[化学式3]
[0027]
[0028]
[化学式4]
[0029][0030]
[化学式5]
[0031][0032]
[化学式6]
[0033][0034]
[化学式7]
[0035][0036]
[化学式8]
[0037][0038]
[化学式9]
[0039][0040]
[化学式10]
[0041][0042]
[化学式11]
[0043][0044]
[化学式12]
[0045][0046]
[化学式13]
[0047][0048]
[化学式14]
[0049][0050]
[化学式15]
[0051][0052]
[化学式16]
[0053][0054]
[化学式17]
[0055][0056]
[化学式18]
[0057][0058]
[化学式19]
[0059][0060]
在上述通式(2a)、(2b)、(3a)、(4a)、(4b)、(5)、(6)、(10)、(11a)及(11b)中,y相互独立地表示氧原子、硫原子或nr1,r1表示氢、烃基、芳香族基、羰基及磺酰基;在上述通式(2a)、(2b)、(3a)、(4a)、(4b)、(8a)、(8b)、(9)、(10)、(11a)及(11b)中,r相互独立地表示氢、烃基和芳香族基。
[0061]
上述连接体可以选自由上述式(1)表示的结构单元、以及上述通式(2a)、(3a)、(4a)、(4b)及(10)表示的结构单元构成的组中的至少一种。
[0062]
上述多肽骨架也可以包含来源于人造蛋白质的骨架。
[0063]
上述人造蛋白质也可以包含人造结构蛋白质。
[0064]
上述人造结构蛋白质也可以包含人造丝心蛋白。
[0065]
上述人造丝心蛋白也可以包含人造改造蜘蛛丝丝心蛋白。
[0066]
本公开的一个方面提供一种含有上述合成高分子的成型材料。
[0067]
由于上述成型材料含有上述合成高分子,因此可以制备柔性优异的成型体。
[0068]
本公开的一个方面提供一种含有上述合成高分子的成型体。
[0069]
由于上述成型体含有上述合成高分子,因此柔性优异。
[0070]
本公开的一个方面提供一种合成高分子的制备方法,该方法具备以下工序:通过使包含多肽骨架的化合物与下述通式(1a)~(16a)表示的化合物反应来获得合成高分子的工序;其中,上述多肽骨架具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基、酰胺基、叠氮基和炔基构成的组中的至少一种。
[0071]
[化学式20]
[0072][0073]
[化学式21]
[0074][0075]
[化学式22]
[0076][0077]
[化学式23]
[0078][0079]
[化学式24]
[0080][0081]
[化学式25]
[0082][0083]
[化学式26]
[0084][0085]
[化学式27]
[0086][0087]
[化学式28]
[0088][0089]
[化学式29]
[0090][0091]
[化学式30]
[0092][0093]
[化学式31]
[0094][0095]
[化学式32]
[0096][0097]
[化学式33]
[0098][0099]
[化学式34]
[0100][0101]
[化学式35]
[0102]
z-r2ꢀꢀ
(12a)
[0103]
[化学式36]
[0104]
ocn-r2ꢀꢀ
(13a)
[0105]
[化学式37]
[0106][0107]
[化学式38]
[0108][0109]
[化学式39]
[0110]n3-r2ꢀꢀ
(16a)
[0111]
在上述通式(1a)、(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(6a)、(7a)、(8a)、(8b)、(9a)、(10a)、(11a)、(11b)及(12a)中,r2表示对上述多肽骨架具有增塑功能的分子基团;在上述通式(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(6a)、(8b)、(9a)、(10a)、(11a)及(11b)中,y相互独立地表示氧原子、硫原子或nr1,r1表示氢、烃基、芳香族基、羰基和磺酰基;在上述通式(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(8a)、(8b)、(9a)、(10a)、(11a)及(11b)中,r相互独立地表示氢、烃基和芳香族基;在上述通式(6a)及(12a)中,z表示卤原子、磺酸酯基及含氟羧酸酯基;在上述通式(15a)中,x表示卤原子。
[0112]
上述合成高分子的制备方法是通过使包含具有特定官能团的多肽骨架的化合物与下述通式(1a)~(16a)表示的特定化合物反应来制备合成高分子,其中,该特定化合物具有对多肽骨架具有增塑功能的分子基团。由此,得到的合成高分子具有对多肽骨架具有增塑功能的分子基团,并且其与蛋白质同样地具有多肽骨架,同时作为合成高分子整体,成为柔性优异的材料。因此,能够制备柔性优异的成型体。此外,由于上述合成高分子的第一链段和第二链段结合,因此减少了当将增塑剂与蛋白质简单地混合时那样的宏观相分离的发生。
[0113]
包括多肽骨架的化合物与下述通式(1a)~(12a)或(14a)表示的化合物之间的反应为也可以迈克尔加成反应。
[0114]
上述多肽骨架可以为疏水性多肽骨架。该疏水性多肽骨架的平均亲水指数也可以为0.22以上。
[0115]
当将上述所述多肽骨架的分子量设为100时,对上述多肽骨架具有增塑功能的分子基团可以为1~70范围内的值。
[0116]
具有上述多肽骨架的化合物也可以包含人造蛋白质。
[0117]
上述人造蛋白质可以包含人造结构蛋白质。
[0118]
本公开的一个方面提供一种合成高分子的制备方法,该方法具备以下工序:使包含多肽骨架的化合物、包含对上述多肽骨架具有增塑功能的分子基团的化合物、与具有2个以上的选自由下述通式(2-1a)~(2-16a)表示的结构单元构成的组中的至少一种结构单元的化合物反应来获得合成高分子的工序;其中,上述多肽骨架具有由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基、酰胺基、叠氮基和炔基构成的组中的至少一种,而包含上述分子基团的化合物具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基、酰胺基、叠氮基和炔基构成的组中的至少一种。
[0119]
[化学式40]
[0120][0121]
[化学式41]
[0122][0123]
[化学式42]
[0124][0125]
[化学式43]
[0126][0127]
[化学式44]
[0128][0129]
[化学式45]
[0130][0131]
[化学式46]
[0132][0133]
[化学式47]
[0134][0135]
[化学式48]
[0136][0137]
[化学式49]
[0138][0139]
[化学式50]
[0140][0141]
[化学式51]
[0142][0143]
[化学式52]
[0144][0145]
[化学式53]
[0146][0147]
[化学式54]
[0148][0149]
[化学式55]
[0150]
[0151]
[化学式56]
[0152][0153]
[化学式57]
[0154][0155]
[化学式58]
[0156][0157]
[化学式59]
[0158][0159]
在上述通式(2-2a)、(2-2b)、(2-3a)、(2-3b)、(2-4a)、(2-5a)、(2-6a)、(2-10a)、(2-11a)、及(2-11b)中,y相互独立地表示氧原子、硫原子或nr1,r1表示氢、烃基、芳香族基、羰基和磺酰基;在上述通式(2-2a)、(2-2b)、(2-3a)、(2-3b)、(2-4a)、(2-8a)、(2-8b)、(2-9a)、(2-10a)、(2-11a)、(2-11b)、及(2-12a)中,r相互独立地表示氢、烃基和芳香族基;在上述通式(2-6a)及(2-12a)中,z表示卤原子、磺酸酯基及含氟羧酸酯基;在上述通式(2-15a)中,x表示卤原子。
[0160]
上述合成高分子的制备方法是通过使包含具有特定官能团的多肽骨架的化合物、对多肽骨架具有增塑功能且包含具有特定官能团的分子基团的化合物、与具有2个以上的选自由通式(2-1a)~(2-16a)表示的结构单元构成的组中的至少一种结构单元的化合物反应来制备合成高分子。由此,得到的合成高分子具有对多肽骨架具有增塑功能的分子基团,并且其与蛋白质同样地具有多肽骨架,同时作为合成高分子整体,成为柔性优异的材料。因此,能够制备柔性优异的成型体。此外,由于上述合成高分子的第一链段和第二链段结合,因此减少了当将增塑剂与蛋白质简单地混合时那样的宏观相分离的发生。
[0161]
上述多肽骨架可以为疏水性多肽骨架。该疏水性多肽骨架的平均亲水指数也可以为0.22以上。
[0162]
当将上述所述多肽骨架的分子量设为100时,对上述多肽骨架具有增塑功能的分子基团的分子量可以为1~70范围内的值。
[0163]
发明效果
[0164]
根据本公开,可以提供一种能够制备具有优异柔性的成型体的合成高分子,其中,该合成高分子是一种具有肽骨架的高分子材料。根据本公开,还可以提供一种含有上述合成高分子的成型材料以及成型体。
附图说明
[0165]
图1是人造丝心蛋白的结构域序列的一例示意图。
[0166]
图2是天然来源的丝心蛋白的z/w(%)值的分布图。
[0167]
图3是天然来源的丝心蛋白的x/y(%)值的分布图。
[0168]
图4是人造丝心蛋白的结构域序列的一例示意图。
[0169]
图5是丝心蛋白的结构域序列的一例示意图。
[0170]
图6是示出在实施例中制备的成型材料的sds-page的测量结果的图。
[0171]
图7是示出在实施例中制备的成型材料的sds-page的测量结果的图。
[0172]
图8是在实施例中使用的加压成型机的示意性剖视图。
[0173]
图9是示出图8所示的加压成型机的使用方法的示意图,(a)是组合物导入前的加压成型机的示意性剖视图,(b)是刚刚导入组合物后的加压成型机的示意性剖视图,(c)是对组合物进行加热及加压的状态下的加压成型机的示意性剖视图。
[0174]
图10是示出使用实施例1中的合成高分子成型的成型体的外观的图片。
[0175]
图11是示出通过使用比较例2的混合物成型的成型体的外观的图片。
[0176]
图12是示出通过使用比较例3的混合物成型的成型体的外观的图片。
[0177]
图13是示出在实施例12中制备的纤维的外观的图片。
[0178]
图14是示出对在实施例13中制备的合成高分子进行gpc测量的结果的图表。
[0179]
图15是示出对在实施例14中制备的合成高分子进行gpc测量的结果的图表。
[0180]
图16是示出对在实施例15中制备的合成高分子进行gpc测量的结果的图表。
[0181]
图17是示出对在实施例16中制备的合成高分子进行gpc测量的结果的图表。
[0182]
图18是示出对在实施例17中制备的合成高分子进行gpc测量的结果的图表。
[0183]
图19是示出参考例2中的gpc测量结果的图表。
[0184]
图20是示出参考例3中的接触角的测量结果的图片。
具体实施方式
[0185]
以下,根据情况参照附图对本公开具体实施方式详细进行说明。然而,以下实施方式是用于描述本公开的示例,本公开并不限于以下内容。
[0186]
除非另有说明,否则本说明书中例示的材料可以单独使用1种或组合使用2种以上。当存在多种相当于组合物中的各成分的物质的情况下,除非另有说明,否则组合物中各成分的含量是指存在于组合物中的该多种物质的总量。
[0187]
在本说明书中,成型材料是指用于制备成型体的材料。本公开所涉及的上述成型材料可以说是对重组结构蛋白质进行了化学修饰的蛋白质材料。本说明书中的成型体的形状并没有特别限定,例如可以是薄膜状、板状、块状、海绵状(sponge形状)以及纤维状等。本说明书中的成型材料的形态也并没有任何限定,例如可以是粉末、颗粒、液体及凝胶等。此外,本公开所涉及的成型材料可以是通过例如加热加压成型、铸造成型和纺丝等来制成的各种形状的成型体。成型时,也可以根据需要来使用模具。
[0188]
[合成高分子]
[0189]
合成高分子的一个实施方式具有包含多肽骨架的第一链段和与上述第一链段结合的一个或多个第二链段。上述第二链段包含对上述多肽骨架具有增塑功能的分子基团。相对于1个第一链段,第二链段的数量为一个或多个,优选为2个以上,更优选为2~10个,进一步优选为2~8个,更进一步优选为2~6个,最优选为2~4个。
[0190]
作为合成高分子,只要是具有第一链段和第二链段的高分子即可,例如,可以是与1个第一链段结合的一个或多个第二链段的高分子,也可以是与多个包含第一链段和与第一链段结合的第二链段的嵌段相连接的高分子。即,合成高分子可以是以包含多肽骨架的
第一链段为主链,在侧链具有第二链段的高分子(例如接枝聚合物等),此外,也可以是包含第一链段和第二链段的嵌段聚合物。即,具有多个上述第一链段,并且上述第一链段和第二链段也可以交替结合。由于交替结合第一链段和第二链段,例如由上述合成高分子构成的成型体可以发挥出较大的伸长率。
[0191]
此外,合成高分子具有多个上述第一链段,并且上述第二链段的一部分也可以与2个以上的上述第一链段结合以形成网络结构。由于具有网络结构,例如由上述合成高分子构成的成型体可以发挥出较大的伸长率。此外,由于具有网络结构,例如由上述合成高分子构成的成型体可以被赋予作为弹性体的功能。
[0192]
第一链段和第二链段的结合可以直接结合,也可以通过第一链段与第二链段之间结合的结构来结合。另外,在这些任一结合方式中,第一链段与第二链段之间的结合也可以是共价键。
[0193]
(第一链段)
[0194]
第一链段可以通过构成多肽骨架的氨基酸序列中的官能团(例如,半胱氨酸所具有的硫醇基等)与第二链段结合。换言之,只要是具有可与第二链段结合的官能团的多肽,就可以用作上述多肽骨架。此时,多肽所具有的上述官能团的数量例如可以为1个以上、2个以上或4个以上。多肽所具有的上述官能团的数量例如可以为30个以下、25个以下、20个以下、15个以下、10个以下或8个以下。多肽所具有的上述官能团的数量可以在上述范围内调整,例如可以为1~30、1~25、1~20、1~15、1~10、1~8或2~8。第一链段也可以通过向构成多肽骨架的氨基酸序列中的官能团导入的官能团与第二链段结合。
[0195]
上述官能团例如可以为选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基、酰胺基、叠氮基和炔基构成的组中的至少一种,优选为选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基和酰胺基构成的组中的至少一种,更优选为选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基和吲哚基构成的组中的至少一种,进一步优选为选自由硫醇基、氨基、羟基、胍基、羧基和苯氧基构成的组中的至少一种,更进一步优选为选自由硫醇基、氨基、羟基、胍基和羧基构成的组中的至少一种,再进一步优选为选自由硫醇基、氨基、羟基和胍基构成的组中的至少一种,特别优选为选自由硫醇基、氨基和羟基构成的组中的至少一种,尤其优选为选自由硫醇基和氨基构成的中的至少一种,最优选为硫醇基。氨基例如可以为赖氨酸所具有的氨基。羟基例如可以为丝氨酸所具有的羟基和苏氨酸所具有的羟基等。胍基例如可以为精氨酸所具有的胍基。羧基例如可以为谷氨酸所具有的羧基和天冬氨酸所具有的羧基等。苯氧基例如可以为酪氨酸所具有的苯氧基。吲哚基例如可以为色氨酸所具有的吲哚基。酰胺基例如可以为谷氨酰胺所具有的酰胺基和天冬酰胺所具有的酰胺基等。炔基可以为通过使卤化乙炔与半胱氨酸所具有的硫醇基反应而导入的炔基。
[0196]
第一链段包含多肽骨架,例如也可以仅由多肽骨架构成。多肽骨架可以包含来源于人造蛋白质的骨架,也可以仅由来源于人造蛋白质的骨架构成。上述人造蛋白质可以包含人造丝心蛋白,也可以仅由人造丝心蛋白构成。可以通过使多肽骨架包含来源于重组蛋白质的骨架来任意调节构成多肽骨架的氨基酸序列中的官能团的数量和位置。由此,这使得设计合成高分子和成型材料的结构和特性成为可能。此外,通过使重组蛋白质包含人造丝心蛋白,合成高分子的原纤化变得容易。由此,得到以下优点:提高将合成高分子用作成型材料时的纤维形成能力等。
[0197]
第一链段的分子量例如优选为200~1000000,更优选为300~900000,进一步优选为400~800000,更进一步优选为500~700000,再进一步优选为600~600000,更优选为1000~600000,进一步优选为3000~600000,更进一步优选为5000~600000,再进一步优选为10000~600000,更优选为5000~100000。另外,当第一链段的分子量小于200时,相对于包含具有增塑功能的分子基团的第二链段(软链段),作为硬链段发挥作用的第一链段可能变得太小。在这种情况下,使用合成高分子(成型材料)成型的成型体的刚性变小,例如可能难以作为结构体使用。另一方面,当第一链段的分子量超过1000000时,连接反应的反应性降低,因此作为化学工程学材料无法在可商业生产时间内完成反应,其结果有可能导致残留于成型体内的未反应的第二链段产生定域性。此外、第一链段的分子量和包含在第一链段中的多肽骨架的分子量例如可以为1000以上、2000以上、3000以上、4000以上、5000以上、6000以上、7000以上、8000以上、9000以上、10000以上、20000以上、30000以上、40000以上、50000以上、60000以上、70000以上、80000以上、90000以上、100000以上。进一步地,第一链段的分子量和包含在第一链段中的多肽骨架的分子量可以为400000以下、小于360000、300000以下、200000以下。第一链段或多肽骨架具有分子量越小,在溶剂中的溶解度越高这样的倾向。因此,当多肽骨架或第一链段的分子量例如为200000以下或100000以下的情况下,在通过使包含多肽骨架的化合物溶解于溶剂中,并与包含对多肽骨架具有增塑功能的分子基团的化合物反应来得到合成高分子时,有望提高目标合成高分子的生成效率。此外,在使用以这种方式得到的合成高分子成型的成型体中,有望在确保一定程度的强度的同时提高柔性。此外,当多肽骨架或第一链段的分子量例如为200000以下或100000以下的情况下,为了提高合成高分子的柔性,有望能够尽可能地抑制第二链段的使用量。另外,上述第一链段的分子量和多肽骨架的分子量为重均分子量。
[0198]
本说明书中的分子量是通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)测定的值。另外,该电泳按照以下的步骤来实施。即,首先,在2mg的粉末样品中加入200μl的2m氯化锂dmso(富士胶片和光纯药制造),在80℃下加热60分钟、进而在95℃下加热10分钟的同时进行搅拌,从而使样品溶解。然后,用10m脲溶液将样品稀释50倍,再用试样用缓冲液(富士胶片和光纯药制造)稀释2倍,在95℃下加热5分钟,从而使蛋白质发生变性。接下来,将sds-page用凝胶(bio-lad制造)安装在电泳装置(bio-lad制)上,在装置中充填满sds缓冲液的同时,将电泳装置连接到电源装置(bio craft制)中。将变性后的样品分别以10μl添加至sds-page用凝胶的各孔中,在30ma/1片、30分钟的条件下使电流流通。电泳结束后,从装置中取出sds-page用凝胶,浸渍在oriole荧光凝胶染料(bio-lad制造)中,振荡1小时。然后,将凝胶放在uv样品盘(bio-lad制造)上,用gel doc ez凝胶成像装置(bio-lad制造)获得染色图像。
[0199]
《人造蛋白质》
[0200]
作为人造蛋白质,可以列举出可通过工业规模制备的任意的蛋白质,例如,可以列举出可用于工业的蛋白质等。所谓可用于工业用途,是指例如可用于在室内或室外使用的各种通用材料等。作为可用于工业用途的蛋白质的具体例,可以列举出结构蛋白质。此外,作为结构蛋白质的具体例子,可以列举出蜘蛛丝(蛛丝)、蚕丝、角蛋白、胶原蛋白、弹性蛋白、节肢弹性蛋白、以及来源于它们的蛋白质等。作为使用的蛋白质,优选人造丝心蛋白,更优选人造蜘蛛丝丝心蛋白(人造改造蜘蛛丝丝心蛋白)。
[0201]
另外,人造蛋白质包括重组(recombinant)蛋白质和合成蛋白质。也就是说,在本说明书中,所谓“人造蛋白质”,是指人工制造的蛋白质。人造蛋白质可以是其结构域序列与天然来源的蛋白质的氨基酸序列不同的蛋白质,也可以是与天然来源的蛋白质的氨基酸序列相同的蛋白质。此外“人造蛋白质”可以是直接利用天然来源的蛋白质的氨基酸序列的蛋白质,也可以是依据天然来源的蛋白质的氨基酸序列来改造该氨基酸序列的蛋白质(例如,通过对克隆出的天然来源的蛋白质的基因序列进行改造来改造氨基酸序列而得到的蛋白质),此外也可以为不依赖天然来源的蛋白质而人造设计和合成的蛋白质(例如,通过对编码所设计的氨基酸序列的核酸进行化学合成而具有所需氨基酸序列的蛋白质)。另外,人造蛋白质与天然蛋白质不同,其可以自由地设计氨基酸序列,因此当该人造蛋白质包含在后述的本实施方式中的成型材料或成型体所包含的合成高分子中的情况下,通过适当地设计人造蛋白质的氨基酸序列,可以任意控制成型材料或成型体的功能或特性、物理特性等。此外,由于能够经常进行均一的分子设计,因此能够稳定地获得与目标蛋白质同源性高、符合目标的蛋白质。由此,可以有利于实现目标合成高分子、进而使用该合成高分子得到的成型材料或成型体的品质的稳定化。
[0202]
本实施方式所涉及的多肽只要氨基酸残基数为50个以上即可。该氨基酸残基数例如可以为100以上、150以上、200以上、250以上、300以上、350以上、400以上、450以上或500以上。该氨基酸残基数例如可以为5000以下、4500以下、4000以下、3500以下、3000以下、2500以下、2000以下、1500以下、1000以下。氨基酸残基数越少,在溶剂中的溶解度越高这样的倾向。因此,本实施方式所涉及的多肽的氨基酸残基数例如为5000以下或2500以下的情况下,在通过使包含多肽骨架的化合物溶解于溶剂中,并与包含对多肽骨架具有增塑功能的分子基团的化合物反应来得到合成高分子时,有望提高目标合成高分子的生成效率。此外,在使用以这种方式得到的合成高分子的成型体中,有望在确保一定程度的强度的同时提高柔性。
[0203]
(多肽骨架)
[0204]
多肽骨架例如可以为疏水性多肽骨架。多肽骨架为疏水性多肽骨架的情况下,与具有增塑功能的分子基团的第一链段之间的亲和性提高,并且可以制备柔性更为优异的成型体。此外,该成型体的耐水性提高,例如,当成型体作为工业用通用材料使用的情况下,可以有利于实现使用寿命的延长。此外,本实施方式所涉及的合成高分子,例如,通过控制第二链段所包含的、对多肽骨架具有增塑功能的分子基团的疏水性或亲水性,可以任意调整合成高分子整体的疏水性或亲水性,但是当多肽骨架为疏水性多肽骨架的情况下,与多肽骨架为亲水性多肽骨架的情况相比,可以使合成高分子整体移向疏水性侧,由此可以在更宽的范围内控制合成高分子整体的疏水性或亲水性。
[0205]
疏水性多肽骨架中的疏水性可以将后述的平均亲水指数值作为指标来进行估计。疏水性多肽骨架的平均亲水指数值例如可以为0.00以上、0.10以上、0.20以上、0.22以上、0.25以上、0.30以上、0.35以上、0.40以上、0.45以上、0.50以上、0.55以上、0.60以上、0.65以上或0.70以上。此外,其上限值并没有特别限制,例如可以为1.00以下,也可以为0.7以下。
[0206]
疏水性多肽骨架优选为在60℃的溴化锂水溶液(浓度:9m)中的溶解性低的多肽骨架。该溶解性可以使用通过分解相当于上述疏水性多肽骨架的化合物(多肽)或合成高分子
且仅分离疏水性多肽骨架而得到的多肽来进行评价。在60℃的溴化锂水溶液(浓度:9m)中溶解上述多肽时的最大浓度例如可以小于30质量%、小于25质量%、小于20质量%、小于15质量%、小于10质量%、小于5质量%、或小于1质量%。另外,作为疏水性多肽骨架,可以使用完全不溶于60℃的溴化锂水溶液(浓度:9m)中的多肽骨架。
[0207]
疏水性多肽骨架优选为与水的接触角较大的多肽骨架。在基材上,水的接触角可以使用通过分解相当于上述疏水性多肽骨架的化合物(多肽)或合成高分子且仅分离疏水性多肽骨架而得到的多肽所形成的膜来进行评价。作为上述疏水性多肽骨架,优选为构成在该薄膜上滴水且经过5秒钟后的接触角为55
°
以上的薄膜的多肽。上述接触角例如可以为60
°
以上、65
°
以上或70
°
以上。
[0208]
疏水性多肽骨架优选为耐热水性优异的多肽骨架。对热水性可以使用通过分解相当于上述疏水性多肽骨架的化合物(多肽)或合成高分子且仅分离疏水性多肽骨架而得到的多肽来进行评价。作为上述疏水性多肽骨架,优选为制备由上述多肽和水构成的分散液且上述多肽的含量为5质量%的分散液,并将该分散液在100℃下加热处理5小时也不会分解的多肽。
[0209]
例如,本实施方式所涉及的多肽骨架可以是结构蛋白质。所谓结构蛋白质,是指与生物体的结构相关的蛋白质、或构成由生物体产生的结构体的蛋白质、或来源于它们的蛋白质。结构蛋白质是指在一定条件下自凝集,形成纤维、薄膜、树脂、凝胶、胶束、纳米颗粒等结构体的蛋白质。天然的结构蛋白质,例如可以列举出丝心蛋白、角蛋白、胶原蛋白、弹性蛋白以及节肢弹性蛋白。
[0210]
结构蛋白质也可以是人造结构蛋白质。在本说明书中,所谓“人造结构蛋白质”,是指人工制造的结构蛋白质。人造结构蛋白质可以是通过基因重组微生物产生的结构蛋白质,包括从成型性和生产率的观点出发改良氨基酸序列后的结构蛋白质,并不限定于天然来源的结构蛋白质的序列。
[0211]
当人工成型人造结构蛋白质时,侧链越小的氨基酸越容易氢键,更容易得到强度高的成型体。此外,由于丙氨酸残基和甘氨酸残基是侧链为非极性的氨基酸,因此在生成多肽的折叠过程中向内侧配置,并容易形成α螺旋结构或β片层结构。因此,有望提高甘氨酸残基、丙氨酸残基、丝氨酸残基等氨基酸的比例。从获得强度更优异的成型体的观点出发,丙氨酸残基含量例如为10~40%即可,可以为12~40%、15~40%、18~40%、20~40%或22~40%。从获得强度更优异的成型体的观点出发,甘氨酸残基含量例如为10~55%即可,可以为11~55%、13~55%、15~55%、18~55%、20~55%、22~55%或25~55%。
[0212]
另外,在本说明书中,“丙氨酸残基含量”是指下述式表示的值。
[0213]
丙氨酸残基含量=(包含在多肽中的丙氨酸残基数量/多肽的所有氨基酸残基数量)
×
100(%)
[0214]
此外,甘氨酸残基含量、丝氨酸残基含量、苏氨酸残基含量、脯氨酸残基含量及酪氨酸残基含量与在上述式中分别将丙氨酸残基替换为甘氨酸残基、丝氨酸残基、苏氨酸残基、脯氨酸残基及酪氨酸残基的含义相同。
[0215]
从提高加工性的观点出发,在加工时抑制分子间的牢固的氢键是很重要的,从这一观点出发,侧链大的氨基酸或具有弯曲性的氨基酸有望以一定程度均质地包含在整个序列中,具体而言,包含酪氨酸残基、苏氨酸残基和脯氨酸残基的基序也可以重复周期地添
加。例如,在任意连续的20个氨基酸残基中,脯氨酸残基、苏氨酸残基和酪氨酸残基的总含量也可以为5%以上、大于5.5%、6.0%以上、大于6.5%、7.0%以上、大于7.5%、8.0%以上、大于8.5%、9.0%以上,10.0%以上或15.0%以上。此外,例如,在任意连续的20个氨基酸残基中,脯氨酸残基、苏氨酸残基和酪氨酸残基的总含量也可以为50%以下、40%以下、30%以下或20%以下。
[0216]
一个实施方式所涉及的人造结构蛋白质中的丝氨酸残基含量、苏氨酸残基含量及酪氨酸残基含量的总和可以为4%以上、4.5%以上、5%以上、5.5%以上、6%以上、6.5%以上或7%以上。丝氨酸残基含量、苏氨酸残基含量及酪氨酸残基含量的总和例如可以为35%以下、33%以下、30%以下、25%以下或20%以下。
[0217]
一个实施方式所涉及的人造结构蛋白质可以是具有重复序列的蛋白质。即,本实施方式所涉及的多肽可以在多肽内存在多个序列一致性高的氨基酸序列(重复序列单元)。重复序列单元的氨基酸残基数优选为6~200个。此外,重复序列单元间的序列一致性例如可以为85%以上、90%以上、95%以上、96%以上、97%以上、98%以上或99%以上。此外,重复序列单元的疏水性程度(亲水指数)例如可以为-0.80以上、-0.70以上、-0.60以上、-0.50以上、-0.40以上、-0.30以上、-0.20以上、-0.10以上、0.00以上、0.22以上、0.25以上、0.30以上、0.35以上、0.40以上、0.45以上、0.50以上、0.55以上、0.60以上、0.65以上或0.70以上。另外,重复序列单元的疏水性程度的上限值并没有特别限制,例如可以为1.0以下,也可以为0.7以下。
[0218]
一个实施方式所涉及的人造结构蛋白质可以是包含(a)n基序的蛋白质。在本说明书中,(a)n基序是指以丙氨酸残基为主的氨基酸序列。(a)n基序的氨基酸残基数可以为2~27,还可以为2~20、2~16或2~12的整数。此外,(a)n基序中的丙氨酸残基数相对于氨基酸残基总数的比例可以为40%以上,也可以为60%以上、70%以上、80%以上、83%以上、85%以上、86%以上、90%以上、95%以上或100%(意味着其仅由丙氨酸残基构成)。
[0219]
在人造结构蛋白质中,优选为在与甘氨酸残基、丝氨酸残基或丙氨酸残基相邻的位置处具有相当于插入半胱氨酸残基的氨基酸序列,更优选为在与甘氨酸残基相邻的位置处具有相当于插入半胱氨酸残基的氨基酸序列。半胱氨酸残基具有巯基(也称为硫醇基或氢硫基),通过巯基的选择性,可以很容易地与第二链段结合。因此,根据人造结构蛋白质中半胱氨酸残基的插入位置,可以将第二链段与第一链段的多肽骨架的结合位置设为任意位置。另外,半胱氨酸残基可以位于甘氨酸残基、丝氨酸残基或丙氨酸残基与甘氨酸残基、丝氨酸残基或丙氨酸残基之间,也可以位于丝氨酸残基与甘氨酸残基之间。
[0220]
人造结构蛋白质优选具有相当于在疏水性氨基酸残基相邻的位置处插入半胱氨酸残基的氨基酸序列的结构蛋白质。在这种情况下,疏水性氨基酸残基通过疏水相互作用固定在分子之间。半胱氨酸残基可以位于疏水性氨基酸残基的旁边,也可以位于疏水性氨基酸残基与除疏水性氨基酸残基以外的氨基酸残基之间,还可以位于疏水性氨基酸残基与甘氨酸残基、丝氨酸残基或丙氨酸残基之间,也可以位于疏水性氨基酸残基与甘氨酸残基之间。疏水性氨基酸残基可以是选自由异亮氨酸残基、缬氨酸残基、亮氨酸残基、苯丙氨酸残基、蛋氨酸残基和丙氨酸残基构成的组中的1种。
[0221]
作为人造结构蛋白质,优选为人造丝心蛋白。作为丝心蛋白,例如可以列举出天然来源的丝心蛋白。作为天然来源的丝心蛋白,例如可以列举出昆虫或蜘蛛类产生的丝心蛋
白。
[0222]
作为昆虫产生的丝心蛋白,可以列举例如家蚕(bombyx mori)、野桑蚕(bombyx mandarina)、天蚕(antheraea yamamai)、柞蚕(anteraea pernyi)、枫蚕(eriogyna pyretorum)、蓖麻蚕(pilosamia cynthia ricini)、樗蚕(samia cynthia)、樟蚕(caligura japonica)、印度柞蚕(antheraea mylitta)、琥珀蚕(antheraea assama)等蚕产生的蚕丝蛋白及雀蜂(vespa simillima xanthoptera)幼虫吐出的蜂丝蛋白。
[0223]
作为昆虫产生的丝心蛋白的更具体的示例,可以列举例如蚕
·
丝心蛋白l链(genbank登录号m76430(碱基序列)、aaa27840.1(氨基酸序列))。
[0224]
作为蜘蛛类产生的丝心蛋白,例如,可以列举出大腹园蛛、十字园蛛、肥胖园蛛、五纹园蛛和野岛园蛛(araneus nojimai)等属于园蛛属(araneus属)的蜘蛛、青新园蛛、嗜水新园蛛、灌木新园蛛和类青新园蛛等属于新园蛛属(neoscona属)的蜘蛛、小岬蛛等属于岬蛛属(pronus属)的蜘蛛、蟾蜍曲腹蛛和对称曲腹蛛等属于曲腹蛛属(cyrtarachne属)的蜘蛛、库氏棘腹蛛和乳突棘腹蛛等属于棘腹蛛属(gasteracantha属)的蜘蛛、何氏瘤腹蛛和六刺瘤腹蛛等属于瘤腹蛛属(ordgarius属)的蜘蛛、悦目金蛛、小悦目金蛛和横纹金蛛等属于金蛛属(argiope属)的蜘蛛、双峰尾园蛛等属于尾园蛛属(arachnura属)的蜘蛛、褐吊叶蛛等属于吊叶蛛属(acusilas属)的蜘蛛、红云斑蛛、花云斑蛛和全色云斑蛛等属于云斑蛛属(cytophora属)的蜘蛛、丑锥头蛛等属于锥头蛛属(poltys属)的蜘蛛、八瘤艾蛛、四突艾蛛、圆腹艾蛛和黑尾艾蛛等属于艾蛛属(cyclosa属)的蜘蛛和日本壮头蛛等属于壮头蛛属(chorizopes属)的蜘蛛所产生的蛛丝蛋白、以及前齿肖蛸、锥腹肖蛸、直伸肖蛸和鳞纹肖蛸等属于肖蛸属(tetragnatha属)的蜘蛛、纵条银鳞蛛、肩斑银鳞蛛和小肩斑银鳞蛛等属于银鳞蛛属(leucauge属)的蜘蛛、棒络新妇和斑络新妇等属于络新妇属(nephila属)的蜘蛛、美丽麦蛛等属于麦蛛属(menosira属)的蜘蛛、柔弱粗螯蛛等属于锯螯蛛属(dyschiriognatha属)的蜘蛛、红斑寇蛛、哈氏寇蛛、几何寇蛛和间斑寇蛛等属于寇蛛属(latrodectus属)的蜘蛛、以及属于育儿网蛛属(euprosthenops属)的蜘蛛等属于肖蛸科(tetragnathidae科)的蜘蛛所产生的蛛丝蛋白。作为蛛丝蛋白,例如,可以列举出masp(masp1和masp2)、adf(adf3和adf4)等牵引丝蛋白、以及misp(misp1和misp2)等。
[0225]
作为蜘蛛类产生的丝心蛋白的更具体的示例,可以列举例如丝心蛋白-3(fibroin-3,adf-3)[十字园蛛(araneus diadematus)来源](genbank登录号aac47010(氨基酸序列)、u47855(碱基序列))、丝心蛋白-4(fibroin-4,adf-4)[十字园蛛来源](genbank登录号aac47011(氨基酸序列)、u47856(碱基序列))、牵引丝蛋白蛛丝蛋白1(dragline silk protein spidroin 1)[金纺蜘蛛(nephila clavipes)来源](genbank登录号aac04504(氨基酸序列)、u37520(碱基序列))、大壶状腺蛛丝蛋白1(major ampullate spidroin 1)[黑寡妇蜘蛛(latrodectus hesperus)来源](genbank登录号abr68856(氨基酸序列)、ef595246(碱基序列))、牵引丝蛋白蛛丝蛋白2(dragline silk protein spidroin 2)[棒络新妇(nephila clavata)来源](genbank登录号aal32472(氨基酸序列)、af441245(碱基序列))、大壶状腺蛛丝蛋白1[非洲育儿网蛛(euprosthenops australis)来源](genbank登录号caj00428(氨基酸序列)、aj973155(碱基序列))和大壶状腺蛛丝蛋白2(major ampullate spidroin2)[非洲育儿网蛛](genbank登录号cam32249.1(氨基酸序列)、am490169(碱基序列))、小壶状腺丝蛋白1(minor ampullate silk protein1)[金纺蜘
蛛](genbank登录号aac14589.1(氨基酸序列))、小壶状腺丝蛋白2(minor ampullate silk protein 2)[金纺蜘蛛](genbank登录号aac14591.1(氨基酸序列))、以及小壶状腺蛛丝蛋白样蛋白质(minor ampullate spidroin-like protein)[nephilengys cruentata](genbank登录号abr37278.1(氨基酸序列)等。
[0226]
天然来源的丝心蛋白的更具体示例可以进一步例举出在ncbi genbank中登录有序列信息的丝心蛋白。例如,可以通过从ncbi genbank中登录的序列信息中的包含inv作为分类码(division)的序列中提取出在定义(definition)中记载有蛛丝蛋白、壶状腺、丝心蛋白、“丝和多肽”或“丝和蛋白质”作为关键词的序列、从cds中提取出指定产物的字符串、从来源(source)中提取出在组织类型(tissue type)中记载有指定字符串的序列来确认。
[0227]
在本说明书中,“人造丝心蛋白”是指人工制造的丝心蛋白(人造丝心蛋白)。人造丝心蛋白可以是与天然来源的丝心蛋白的氨基酸序列不同的丝心蛋白,也可以是与天然来源的丝心蛋白的氨基酸序列相同的丝心蛋白。
[0228]
人造丝心蛋白可以为具有适用于天然来源的丝心蛋白的结构的纤维状蛋白质,也可以为具有与天然来源的丝心蛋白所具有的重复序列相同的序列的丝心蛋白。所谓“与丝心蛋白所具有的重复序列相同的序列”,实际上可以为天然来源的丝心蛋白所具有的序列,也可以为与其类似的序列。
[0229]
"人造丝心蛋白"只要具有本公开中指定的氨基酸序列即可,可以为依据天然来源的丝心蛋白对其氨基酸序列进行改造而得到的丝心蛋白(例如,通过对克隆出的天然来源的丝心蛋白的基因序列进行改造来改造氨基酸序列而得到的丝心蛋白),另外也可以为不依赖于天然来源的丝心蛋白而人为设计氨基酸序列的丝心蛋白(例如,通过对编码所设计的氨基酸序列的核酸进行化学合成而具有所期望的氨基酸序列的丝心蛋白)。另外,对人造丝心蛋白的氨基酸序列进行改造的丝心蛋白,只要其氨基酸序列与天然来源的丝心蛋白的氨基酸序列不同,就可以包含在人造丝心蛋白中。作为人造丝心蛋白,例如可以例举出人造蚕丝(丝绸)丝心蛋白(对蚕产生的蚕丝蛋白的氨基酸序列进行过改造的丝心蛋白),以及人造蜘蛛丝丝心蛋白(对蜘蛛类产生的蛛丝蛋白的氨基酸序列进行过改造的丝心蛋白)等。当将本公开所涉及的合成高分子用作成型材料的情况下,蜘蛛丝丝心蛋白比较容易地进行原纤化,并且纤维形成能力高,因此,人造丝心蛋白优选地包含人造蜘蛛丝丝心蛋白,更优选地由人造蜘蛛丝丝心蛋白构成。
[0230]
作为本实施方式所涉及的人造丝心蛋白的具体实施例,可以列举出来自于蜘蛛的大壶状腺所产生的大吐丝管牵引丝蛋白的人造丝心蛋白(第1人造丝心蛋白)、具有降低了甘氨酸残基含量的结构域序列的人造丝心蛋白(第2人造丝心蛋白)、具有降低了(a)n基序含量的结构域序列的人造丝心蛋白(第3人造丝心蛋白)、降低了甘氨酸残基的含量及(a)n基序的含量的人造丝心蛋白(第4人造丝心蛋白)、具有局部包含疏水性指标大的区域的结构域序列的人造丝心蛋白(第5人造丝心蛋白)、及具有降低了谷氨酰胺残基的含量的结构域序列的人造丝心蛋白(第6人造丝心蛋白)。
[0231]
作为第1人造丝心蛋白可以例举包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。在第1人造丝心蛋白中,(a)n基序的氨基酸残基数优选为3~20的整数,更优选为4~20的整数,进一步优选为8~20的整数,更进一步优选为10~20的整数,进一步还优选为4~16的整数,特别优选为8~16的整数,最优选为10~16的整数。在第1人造丝心蛋白,式1中构
成rep的氨基酸残基数优选为10~200个残基,更优选为10~150个残基,进一步优选为20~100个残基,更进一步优选为20~75个残基。在第1人造丝心蛋白中,式1:[(a)n基序-rep]m所示的氨基酸序列所含的甘氨酸残基、丝氨酸残基及丙氨酸残基的合计残基数相对于氨基酸残基总数优选为40%以上,更优选为60%以上,进一步优选为70%以上。
[0232]
第1人造丝心蛋白可以为以下这种多肽:包含式1:[(a)n基序-rep]m所示的氨基酸序列的单元,并且c末端序列为序列号1~3中任意一个所示的氨基酸序列、或与序列号1~3中任意一个所示的氨基酸序列具有90%以上的同源性的氨基酸序列。
[0233]
序列号1所示的氨基酸序列与由adf3(gi:1263287、ncbi)的氨基酸序列的c末端的50个残基的氨基酸构成的氨基酸序列相同,序列号2所示的氨基酸序列与从序列号1所示的氨基酸序列的c末端除去20个残基后的氨基酸序列相同,序列号3所示的氨基酸序列与从序列号1所示的氨基酸序列的c末端除去29个残基后的氨基酸序列相同。
[0234]
作为第1人造丝心蛋白的更具体示例,可以列举出包含与(1-i)序列号4(recombinant spider silk protein adf3kailargenrsh1)所示的氨基酸序列或(1-ii)序列号4所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。序列一致性优选为95%以上。
[0235]
序列号4所示的氨基酸序列为在n末端添加有由起始密码子、his10标签及hrv3c蛋白酶(human rhinovirus 3c蛋白酶)识别位点构成的氨基酸序列(序列号5)的adf3的氨基酸序列中,以使第1~13位的重复区域增加为约2倍、并且在第1154位氨基酸残基处终止翻译的方式突变后得到。序列号4所示的氨基酸序列的c末端的氨基酸序列与序列号3所示的氨基酸序列相同。
[0236]
(1-i)的人造丝心蛋白可以由序列号4所示的氨基酸序列构成。
[0237]
第2人造丝心蛋白具有其结构域序列与天然来源的丝心蛋白相比甘氨酸残基的含量降低的氨基酸序列。第2人造丝心蛋白与天然来源的丝心蛋白相比,可以具有与至少rep中的一个或多个甘氨酸残基被置换为其他氨基酸残基相当的氨基酸序列。
[0238]
第2人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,在rep中的选自ggx及gpgxx(其中,g表示甘氨酸残基,p表示脯氨酸残基,x表示甘氨酸以外的氨基酸残基)中的至少一种基序序列中,可以具有相当于至少一个或多个该基序序列中的一个甘氨酸残基被置换为其他氨基酸残基的氨基酸序列。
[0239]
第2人造丝心蛋白中,上述甘氨酸残基被置换为其他氨基酸残基的基序序列的比例相对于全部基序序列可以为10%以上。
[0240]
第2人造丝心蛋白包括式1:[(a)n基序-rep]m所示的结构域序列并且可以具有下述氨基酸序列:当将从上述结构域序列中除去自位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列后得到的序列中的全部rep所包含的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z、并且将从上述结构域序列中除去自位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列后得到的序列中的氨基酸残基总数设为w时,z/w为30%以上、40%以上、50%以上或50.9%以上。(a)n基序中的丙氨酸残基数相对于氨基酸残基总数可以为83%以上,优选为86%以上,更优选为90%以上,进一步优选为95%以上,更进一步优选为100%(意味着仅由丙氨酸残基构成)。
[0241]
第2人造丝心蛋白优选地通过将ggx基序中的一个甘氨酸残基置换为其他氨基酸
残基来提高由xgx构成的氨基酸序列的含有比例。在第2人造丝心蛋白中,结构域序列中的由ggx构成的氨基酸序列的含有比例优选为30%以下,更优选为20%以下,进一步优选为10%以下,更进一步优选为6%以下,进一步还优选为4%以下,特别优选为2%以下。结构域序列中的由ggx构成的氨基酸序列的含有比例可以通过与下述的由xgx构成的氨基酸序列的含有比例(z/w)的计算方法相同的方法来计算。
[0242]
对z/w的计算方法进一步进行详细说明。首先,在包含式1:[(a)n基序-rep]m所示的结构域序列的丝心蛋白(人造丝心蛋白或天然来源的丝心蛋白)中,从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的全部rep中,提取由xgx构成的氨基酸序列。构成xgx的氨基酸残基的总数为z。例如,当提取了50个由xgx构成的氨基酸序列时(没有重复),z为50
×
3=150。此外,例如,如由xgxgx构成的氨基酸序列的情况那样,当包含在2个xgx中的x(中间的x)存在时,通过扣除重复部分来进行计算(当为xgxgx时,为5个氨基酸残基)。w为从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得序列中包含的氨基酸残基总数。例如,为图1所示的结构域序列时,w为4+50+4+100+4+10+4+20+4+30=230(已经除去位于最靠c末端侧的(a)n基序)。然后,通过将z除以w,可以计算出z/w(%)。
[0243]
在此,对天然来源的丝心蛋白中的z/w进行说明。首先,如上所述,通过例举出的方法对ncbi genbank中登录有氨基酸序列信息的丝心蛋白进行确认后,提取出663种丝心蛋白(其中,来源于蜘蛛类的丝心蛋白为415种)。在所提取的所有丝心蛋白中,从包含式1:[(a)n基序-rep]m所表示的结构域序列且由丝心蛋白中的ggx构成的氨基酸序列的含有比例为6%以下的天然来源的丝心蛋白的氨基酸序列中,根据上述计算方法,计算出z/w。其结果如图2所示。图2的横轴表示z/w(%),纵轴表示频率。由图2可知,天然来源的丝心蛋白中的z/w均小于50.9%(最大为50.86%)。
[0244]
在第2人造丝心蛋白中,z/w优选为50.9%以上,更优选为56.1%以上,进一步优选为58.7%以上,更进一步优选为70%以上,进一步还优选为80%以上。z/w的上限并没有特别限制,例如可以为95%以下。
[0245]
例如可以通过如下方式进行改造而获得第2人造丝心蛋白:从克隆出的天然来源的丝心蛋白的基因序列中,对编码甘氨酸残基的碱基序列的至少一部分进行置换并使其编码其他氨基酸残基。此时,作为修饰的甘氨酸残基,可以选择ggx基序及gpgxx基序中的一个甘氨酸残基、另外也可以用将z/w设定为50.9%以上的方式进行置换。此外,例如,也可以通过根据天然来源的丝心蛋白的氨基酸序列设计满足上述方式的氨基酸序列,并通过化学合成编码所设计的氨基酸序列的核酸来获得。在任何一种情况下,除了与在从天然来源的丝心蛋白的氨基酸序列中将rep中的甘氨酸残基置换为其他氨基酸残基相当的改造之外,还可以进一步进行与置换、缺失、插入及/或添加一个或多个氨基酸残基相当的氨基酸序列的改造。
[0246]
作为上述的其他氨基酸残基,只要是除甘氨酸残基以外的氨基酸残基即可,并没有特别限制,优选缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、蛋氨酸(m)残基、脯氨酸(p)残基、苯丙氨酸(f)残基及色氨酸(w)残基等疏水性氨基酸残基、谷氨酰胺(q)残基、天冬酰胺(n)残基、丝氨酸(s)残基、赖氨酸(k)残基及谷氨酸(e)残基等亲水性氨基酸残基,更优选缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、苯丙氨酸(f)残基及谷氨酰胺(q)
残基,进一步优选谷氨酰胺(q)残基。
[0247]
作为第2人造丝心蛋白的更具体示例,可以列举出包含与(2-i)序列号6(met-prt380)、序列号7(met-prt410)、序列号8(met-prt525)或序列号9(met-prt799)所示的氨基酸序列、或者(2-ii)序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0248]
对(2-i)的人造丝心蛋白进行说明。将相当于天然来源的丝心蛋白的序列号10(met-prt313)所示的氨基酸序列的rep中的ggx全部置换为gqx,从而得到序列号6所示的氨基酸序列。序列号7所示的氨基酸序列在序列号6所示的氨基酸序列中从n末端侧向c末端侧使(a)n基序每隔2个发生缺失,并进一步在c末端序列的近端插入一个[(a)n基序-rep]。序列号8所示的氨基酸序列在序列号7所示的氨基酸序列的各(a)n基序的c末端侧插入2个丙氨酸残基,进一步将部分谷氨酰胺(q)残基置换为丝氨酸(s)残基,并且使c末端侧的部分氨基酸缺失以使得其与序列号7的分子量几乎相同。序列号9所示的氨基酸序列,在将序列号7所示的氨基酸序列中存在的20个结构域序列的区域(其中,该区域的c末端侧的数个氨基酸残基被置换)重复4次后的序列的c末端中添加预定的铰链序列和his标签序列。
[0249]
序列号10所示的氨基酸序列(相当于天然来源的丝心蛋白)中的z/w值为46.8%。序列号6所示的氨基酸序列、序列号7所示的氨基酸序列、序列号8所示的氨基酸序列及序列号9所示的氨基酸序列中的z/w的值分别为58.7%、70.1%、66.1%及70.0%。此外,序列号10、序列号6、序列号7、序列号8及序列号9所示的氨基酸序列的锯齿比率(在下文中说明)为1:1.8~11.3时的x/y值分别为15.0%、15.0%、93.4%、92.7%及89.8%。
[0250]
(2-i)的人造丝心蛋白可以由序列号6、序列号7、序列号8或序列号9所示的氨基酸序列构成。
[0251]
(2-ii)的人造丝心蛋白包含与序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(2-ii)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0252]
(2-ii)的人造丝心蛋白与序列号6、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上序列一致性,并且将rep中所含的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z,将上述结构域序列中的rep的氨基酸残基总数设为w时,z/w优选为50.9%以上。
[0253]
第2人造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。由此,可以实现人造丝心蛋白的分离、固定、检测及可视化等。
[0254]
作为标签序列,例如,可以列举出利用与其他分子的特异性亲和性(结合性、亲和性)的亲和性标签。作为亲和性标签的具体示例,可以列举出组氨酸标签(his标签)。his标签是由4至10个左右的组氨酸残基排列而成的短肽,具有与镍等的金属离子特异性结合的性质,因此可以用于通过金属螯合层析(chelating metal chromatography)进行的人造丝心蛋白的分离。作为标签序列的具体示例,例如,可以列举出序列号11所示的氨基酸序列(包含his标签序列及铰链序列的氨基酸序列)。
[0255]
此外,也可以利用与谷胱甘肽特异性结合的谷胱甘肽-s-转移酶(gst)、与麦芽糖特异性结合的麦芽糖结合蛋白(mbp)等标签序列。
[0256]
更进一步地,还可以使用利用抗原抗体反应的“表位标签”。通过添加用于显示抗
原性的肽(表位)作为标签序列,可以结合针对该表位的抗体。作为表位标签,可以列举出ha(流感病毒血凝素的肽序列)标签、myc标签、flag标签等。通过利用表位标签,可以很容易地以高特异性对人造丝心蛋白进行纯化。
[0257]
更进一步地,也可以使用利用特定的蛋白酶将标签序列切除而得到的标签。也可以通过对经由该标签序列吸附的蛋白质进行蛋白酶处理,来回收切除标签序列后的人造丝心蛋白。
[0258]
作为含有标签序列的人造丝心蛋白的更具体示例,可以列举出包含与(2-iii)序列号12(prt380)、序列号13(prt410)、序列号14(prt525)或序列号15(prt799)所示的氨基酸序列、或者(2-iv)序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0259]
分别在序列号10、序列号6、序列号7、序列号8及序列号9所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列),从而得到序列号16(prt313)、序列号12、序列号13、序列号14及序列号15所示的氨基酸序列。
[0260]
(2-iii)的人造丝心蛋白可以由序列号12、序列号13、序列号14或序列号15所示的氨基酸序列构成。
[0261]
(2-iv)的人造丝心蛋白包含与序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(2-iv)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0262]
(2-iv)的人造丝心蛋白与序列号12、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性,并且将rep中所含的由xgx(其中,x为甘氨酸以外的氨基酸残基)构成的氨基酸序列的氨基酸残基总数设为z,将上述结构域序列中的rep的氨基酸残基总数设为w时,z/w优选为50.9%以上。
[0263]
第2人造丝心蛋白可以含有用于将人造蛋白质生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主种类来适当设定。
[0264]
第3人造丝心蛋白具有其结构域序列与天然来源的丝心蛋白相比(a)n基序的含量降低的氨基酸序列。第3人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,可以具有相当于缺失了至少一个或多个(a)n基序的氨基酸序列。
[0265]
第3人造丝心蛋白可以具有相当于从天然来源的丝心蛋白中缺失了10~40%的(a)n基序的氨基酸序列。
[0266]
第3人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其可以至少从n末端侧向c末端侧具有相当于每1~3个(a)n基序中缺失一个(a)n基序的氨基酸序列。
[0267]
第3人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其可以至少从n末端侧向c末端侧具有相当于依次重复发生了两个连续的(a)n基序的缺失及一个(a)n基序的缺失的氨基酸序列。
[0268]
第3人造丝心蛋白的结构域序列可以至少从n末端侧向c末端侧具有相当于每隔2个发生一次缺失(a)n基序的氨基酸序列。
[0269]
第3人造丝心蛋白包括式1:[(a)n基序-rep]m所示的结构域序列并且可以具有下述氨基酸序列:从n末端侧向c末端侧依次比较相邻的2个[(a)n基序-rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基
数的比为1.8~11.3的相邻的2个[(a)n基序-rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y为20%以上、30%以上、40%以上或50%以上。(a)n基序中的丙氨酸残基数相对于氨基酸残基总数可以为83%以上,优选为86%以上,更优选为90%以上,进一步优选为95%以上,更进一步优选为100%(意味着仅由丙氨酸残基构成)。
[0270]
参照图1进一步详细说明x/y的计算方法。图1示出了从人造丝心蛋白中除去n末端序列及c末端序列后的结构域序列。该结构域序列从n末端侧(左侧)起具有(a)n基序-第1rep(50个氨基酸残基)-(a)n基序-第2rep(100个氨基酸残基)-(a)n基序-第3rep(10个氨基酸残基)-(a)n基序-第4rep(20个氨基酸残基)-(a)n基序-第5rep(30个氨基酸残基)-(a)n基序的序列。
[0271]
以不重复的方式从n末端侧向c末端侧依次选择相邻的2个[(a)n基序-rep]单元。此时,也可以存在未被选择的[(a)n基序-rep]单元。图1示出了模式1(第1rep与第2rep的比较、以及第3rep与第4rep的比较)、模式2(第1rep与第2rep的比较、以及第4rep与第5rep的比较)、模式3(第2rep与第3rep的比较、以及第4rep与第5rep的比较)、模式4(第1rep与第2rep的比较)。另外,除此之外还存在选择方法。
[0272]
然后,对各模式中所选择的相邻的2个[(a)n基序-rep]单元中的各rep的氨基酸残基数进行比较。比较方法是将氨基酸残基数较少一方设为1,然后求出另一个氨基酸残基数的比值。例如,比较第1rep(50个氨基酸残基)与第2rep(100个氨基酸残基)时,将氨基酸残基数较少的第1rep设为1,则第2rep的氨基酸残基数的比值为100/50=2。同样地,将第4rep(20个氨基酸残基)与第5rep(30个氨基酸残基)进行比较时,将氨基酸残基数较少的第4rep设为1,则第5rep的氨基酸残基数的比值为30/20=1.5。
[0273]
图1中,用实线表示将氨基酸残基数较少一方设为1时另一方氨基酸残基数的比值为1.8~11.3的[(a)n基序-rep]单元的组。在本说明书中,将该比率称为锯齿比率。用虚线表示将氨基酸残基数较少一方设为1时另一方氨基酸残基数的比值小于1.8或大于11.3的[(a)n基序-rep]单元的组。
[0274]
在各模式中,将实线所示的相邻的2个[(a)n基序-rep]单元的所有氨基酸残基数相加(不仅是rep,还是(a)n基序的氨基酸残基数)。而且,将相加后的合计值进行比较,并将该合计值最大的模式的合计值(合计值的最大值)设为x。在图1所示的示例中,模式1的合计值最大。
[0275]
然后,可以通过x除以结构域序列的氨基酸残基总数y来计算出x/y(%)。
[0276]
在第3人造丝心蛋白中,x/y优选为50%以上,更优选为60%以上,进一步优选为65%以上,更进一步优选为70%以上,进一步还优选为75%以上,特别优选为80%以上。x/y的上限并没有特别限制,例如可以为100%以下。当锯齿比率为1:1.9~11.3时,x/y优选为89.6%以上,当锯齿比率为1:1.8~3.4时,x/y优选为77.1%以上,当锯齿比率为1:1.9~8.4时,x/y优选为75.9%以上,当锯齿比率为1:1.9~4.1时,x/y优选为64.2%以上。
[0277]
当第3人造丝心蛋白为在结构域序列中存在多个(a)n基序中的至少7个仅由丙氨酸残基构成的人造丝心蛋白时,x/y优选为46.4%以上,更优选为50%以上,进一步优选为55%以上,更进一步优选为60%以上,进一步还优选为70%以上,特别优选为80%以上。x/y的上限并没有特别限制,为100%以下即可。
[0278]
在此,对天然来源的丝心蛋白中的x/y进行说明。首先,如上所述,通过例举出的方法对ncbi genbank中登录有氨基酸序列信息的丝心蛋白进行确认后,提取出663种丝心蛋白(其中,来源于蜘蛛类的丝心蛋白为415种)。在所提取的所有丝心蛋白中,从由式1:[(a)n基序-rep]m所表示的结构域序列构成的天然来源的丝心蛋白的氨基酸序列中,根据上述计算方法,计算出x/y。图3表示锯齿比率为1:1.9~4.1时的结果。
[0279]
图3的横轴表示x/y(%),纵轴表示频率。由图3可知,天然来源的丝心蛋白中的x/y均小于64.2%(最大为64.14%)。
[0280]
例如可以通过从克隆出的天然来源的丝心蛋白的基因序列中,以将x/y设为64.2%以上的方式使编码(a)n基序的序列中的一个或多个缺失,从而得到第3人造丝心蛋白。此外,例如,也可以设计出相当于从天然来源的丝心蛋白的氨基酸序列中,以将x/y设为64.2%以上的方式使一个或多个(a)n基序发生缺失的氨基酸序列,并通过化学合成用于编码所设计的氨基酸序列的核酸来获得。在任意情况下,除了可进行相当于从天然来源的丝心蛋白的氨基酸序列中缺失(a)n基序的改造外,还可以进一步进行相当于置换、缺失、插入及/或添加一个或多个氨基酸残基的氨基酸序列改造。
[0281]
作为第3人造丝心蛋白的更具体示例,可以列举出包含与(3-i)序列号17(met-prt399)、序列号7(met-prt410)、序列号8(met-prt525)或序列号9(met-prt799)所示的氨基酸序列、或者(3-ii)序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0282]
对(3-i)的人造丝心蛋白进行说明。序列号17所示的氨基酸序列在相当于天然来源的丝心蛋白的序列号10(met-prt313)所示的氨基酸序列中从n末端侧向c末端侧使(a)n基序每隔2个发生缺失,并进一步在c末端序列的近端插入一个[(a)n基序-rep]。序列号7、序列号8或序列号9所示的氨基酸序列如第2人造丝心蛋白中所说明的那样。
[0283]
序列号10所示的氨基酸序列(相当于天然来源的丝心蛋白)的锯齿比率为1:1.8~11.3中的x/y值为15.0%。序列号17所示的氨基酸序列及序列号7所示的氨基酸序列中的x/y的值均为93.4%。序列号8所示的氨基酸序列中的x/y的值为92.7%。序列号9所示的氨基酸序列中的x/y的值为89.8%。序列号10、序列号17、序列号7、序列号8及序列号9所示的氨基酸序列中的z/w的值分别为46.8%、56.2%、70.1%、66.1%及70.0%。
[0284]
(3-i)的人造丝心蛋白可以由序列号17、序列号7、序列号8或序列号9所示的氨基酸序列构成。
[0285]
(3-ii)的人造丝心蛋白包含与序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(3-ii)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0286]
(3-ii)的人造丝心蛋白与序列号17、序列号7、序列号8或序列号9所示的氨基酸序列具有90%以上的序列一致性,并且从n末端侧向c末端侧依次比较相邻的2个[(a)n基序-rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基数的比为1.8~11.3(锯齿比率为1:1.8~11.3)的相邻的2个[(a)n基序-rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y优选为64.2%以上。
[0287]
第3人造丝心蛋白可以在n末端及c末端中的任意一端或两端包含上述标签序列。
[0288]
作为含有标签序列的人造丝心蛋白的更具体示例,可以列举出包含与(3-iii)序列号18(prt399)、序列号13(prt410)、序列号14(prt525)或序列号15(prt799)所示的氨基酸序列、或者(3-iv)序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0289]
分别在序列号17、序列号7、序列号8及序列号9所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列),从而得到序列号18、序列号13、序列号14及序列号15所示的氨基酸序列。
[0290]
(3-iii)的人造丝心蛋白可以由序列号18、序列号13、序列号14或序列号15所示的氨基酸序列构成。
[0291]
(3-iv)的人造丝心蛋白包含与序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(3-iv)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0292]
(3-iv)的人造丝心蛋白与序列号18、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上的序列一致性,并且从n末端侧向c末端侧依次比较相邻的2个[(a)n基序-rep]单元的rep的氨基酸残基数,将氨基酸残基数少的rep的氨基酸残基数设为1时,并且将另一个rep的氨基酸残基数的比为1.8~11.3的相邻的2个[(a)n基序-rep]单元的氨基酸残基数相加而得到的合计值的最大值设为x、将结构域序列的氨基酸残基总数设为y时,x/y优选为64.2%以上。
[0293]
第3人造丝心蛋白可以含有用于将人造蛋白质生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主种类来适当设定。
[0294]
第4人造丝心蛋白是其结构域序列与天然来源的丝心蛋白相比,除了降低(a)n基序的含量之外,还具有降低甘氨酸残基含量的氨基酸序列的丝心蛋白。第4人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其除了至少一个或多个(a)n基序缺失之外,还可以具有相当于至少rep中的一个或多个甘氨酸残基被其他氨基酸残基置换的氨基酸序列。即,第4人造丝心蛋白是同时具有上述的第2人造丝心蛋白和第3人造丝心蛋白的特征的人造丝心蛋白。具体的实施方式等如第2人造丝心蛋白及第3人造丝心蛋白中所说明的那样。
[0295]
作为第4人造丝心蛋白的更具体示例,可以列举出包含与(4-i)序列号7(met-prt410)、序列号8(met-prt525)、序列号9(met-prt799)、序列号13(prt410)、序列号14(prt525)或序列号15(prt799)所示的氨基酸序列、或者(4-ii)序列号7、序列号8、序列号9、序列号13、序列号14或序列号15所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。包含序列号7、序列号8、序列号9、序列号13、序列号14或序列号15所示的氨基酸序列的人造丝心蛋白的具体的实施方式如上所述。
[0296]
第5人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其可以具有相当于rep中的一个或多个氨基酸残基被置换为疏水性指标大的氨基酸残基及/或在rep中插入了一个或多个疏水性指标大的氨基酸残基的、且局部包含疏水性指标大的区域的氨基酸序列。
[0297]
局部疏水性指标大的区域优选由连续的2~4个氨基酸残基构成。
[0298]
上述疏水性指标大的氨基酸残基更优选为选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)及丙氨酸(a)中的氨基酸残基。
[0299]
第5人造丝心蛋白与天然来源的丝心蛋白相比,其除了相当于将rep中的一个或多个氨基酸残基置换为疏水性指标大的氨基酸残基及/或在rep中插入一个或多个疏水性指标大的氨基酸残基的改造之外,进一步与天然来源的丝心蛋白相比,还可以进行相当于与置换、缺失、插入及/或添加一个或多个氨基酸残基的氨基酸序列的改造。
[0300]
例如可以通过从克隆出的天然来源的丝心蛋白的基因序列中将rep中的一个或多个亲水性氨基酸残基(例如疏水性指标为负的氨基酸残基)置换为疏水性氨基酸残基(例如疏水性指标为正的氨基酸残基)、及/或在rep中插入一个或多个疏水性氨基酸残基,从而得到第5人造丝心蛋白。此外,例如也可以通过设计出相当于从天然来源的丝心蛋白的氨基酸序列中,将rep中的一个或多个亲水性氨基酸残基置换为疏水性氨基酸残基、及/或在rep中插入一个或多个疏水性氨基酸残基的氨基酸序列,并且对编码所设计的氨基酸序列的核酸进行化学合成后得到。在任何情况下,除了相当于从天然来源的丝心蛋白的氨基酸序列中将rep中的一个或多个亲水性氨基酸残基置换为疏水性氨基酸残基、及/或在rep中插入一个或多个疏水性氨基酸残基的改造之外,还可以进一步进行与置换、缺失、插入及/或添加一个或多个氨基酸残基相当的氨基酸序列的改造。
[0301]
第5人造丝心蛋白包含式1:[(a)n基序-rep]m所示的结构域序列,并且可以具有下述氨基酸序列:从上述结构域序列中除去自位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列后得到的序列所含的所有rep中,将连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域所含的氨基酸残基的总数设为p、将从上述结构域序列中除去自位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基的总数设为q时,p/q为6.2%以上。
[0302]
关于氨基酸残基的疏水性指标,使用公知的指标(hydropathy index:kyte j,&doolittle r(1982)"a simple method for displaying the hydropathic character of a protein",j.mol.biol.,157,pp.105-132)。具体而言,各氨基酸的疏水性指标(亲水指数,以下也记为“hi”)如下述表1所示。
[0303]
[表1]
[0304]
氨基酸hi氨基酸hi异亮氨酸(ile)4.5色氨酸(trp)-0.9缬氨酸(val)4.2酪氨酸(tyr)-1.3亮氨酸(leu)3.8脯氨酸(pro)-1.6苯丙氨酸(phe)2.8组氨酸(his)-3.2半胱氨酸(cys)2.5天冬酰胺(asn)-3.5蛋氨酸(met)1.9天冬氨酸(asp)-3.5丙氨酸(ala)1.8谷氨酰胺(gln)-3.5甘氨酸(gly)-0.4谷氨酸(glu)-3.5苏氨酸(thr)-0.7赖氨酸(lys)-3.9丝氨酸(ser)-0.8精氨酸(arg)-4.5
[0305]
对p/q的计算方法进一步进行详细说明。在计算中,使用从式1:[(a)n基序-rep]m所示的结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列所得序列(以下称为“序列a”)。首先,在序列a包含的所有rep中,计算连续4个氨基酸残基的
疏水性指标的平均值。疏水性指标的平均值是通过将连续的4个氨基酸残基中所含有的各氨基酸残基的hi的总和除以4(氨基酸残基数)而求出的。疏水性指标的平均值是针对所有连续的4个氨基酸残基而求出的(各氨基酸残基用于1~4次平均值的计算)。接下来,确定连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域。即使某个氨基酸残基属于多个“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”的情况下,也会作为一个氨基酸残基包含在区域中。而且,该区域中所含的氨基酸残基的总数为p。此外,序列a中所含的氨基酸残基总数为q。
[0306]
例如,提取到20处“疏水性指标的平均值为2.6以上的连续4个氨基酸残基”时(没有重复),在连续4个氨基酸残基的疏水性指标的平均值为2.6以上的区域中含有20处连续4个氨基酸残基(没有重复),p为20
×
4=80。此外,例如在2处“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”仅有一个氨基酸残基重复存在的情况下,在连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域中,含有7个氨基酸残基(p=2
×
4-1=7。
“‑
1”为重复部分的扣除)。例如,为图4所示的结构域序列时,“疏水性指标的平均值为2.6以上的连续的4个氨基酸残基”不重复且存在7个,因此p为7
×
4=28。此外,例如当为图4所示的结构域序列时,q为4+50+4+40+4+10+4+20+4+30=170(不包含位于c末端侧最后的(a)n基序)。然后,通过p除以q,可以计算出p/q(%)。图4时为28/170=16.47%。
[0307]
在第5人造丝心蛋白中,p/q优选为6.2%以上,更优选为7%以上,进一步优选为10%以上,更进一步优选为20%以上,进一步还优选为30%以上。p/q的上限并没有特别限制,例如可以为45%以下。
[0308]
例如,可以通过将克隆出的天然来源的丝心蛋白的氨基酸序列的rep中的一个或多个亲水性氨基酸残基(例如疏水性指标为负的氨基酸残基)置换为疏水性氨基酸残基(例如疏水性指标为正的氨基酸残基)、及/或在rep中插入一个或多个疏水性氨基酸残基,使其满足上述p/q的条件,来将其改造成包含局部疏水性指标大的区域的氨基酸序列,从而得到第5人造丝心蛋白。此外,例如,也可以通过根据天然来源的丝心蛋白的氨基酸序列设计满足上述p/q的条件的氨基酸序列,并通过对编码所设计的氨基酸序列的核酸进行化学合成后得到。在任何情况下,与天然来源的丝心蛋白相比,除了进行相当于rep中的一个或多个氨基酸残基被置换为疏水性指标大的氨基酸残基、及/或在rep中插入一个或多个疏水性指标大的氨基酸残基的改造之外,还可以进一步进行相当于置换、缺失、插入及/或添加一个或多个氨基酸残基的改造。
[0309]
作为疏水性指标大的氨基酸残基,并没有特别限制,优选为异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)及丙氨酸(a),更优选为缬氨酸(v)、亮氨酸(l)及异亮氨酸(i)。
[0310]
作为第5人造丝心蛋白的更具体示例,可以列举出包含与(5-i)序列号19(met-prt720)、序列号20(met-prt665)或序列号21(met-prt666)所示的氨基酸序列、或者(5-ii)序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0311]
对(5-i)的人造丝心蛋白进行说明。相对于序列号7(met-prt410)所示的氨基酸序列,除c末端侧的终端的结构域序列外,每隔一个rep插入2处分别由3个氨基酸残基构成的氨基酸序列(vli),进而将一部分的谷氨酰胺(q)残基置换为丝氨酸(s)残基,并且使c末端
侧的一部分氨基酸缺失,从而得到序列号19所示的氨基酸序列。相对于序列号8(met-prt525)所示的氨基酸序列,每隔一个rep插入1处分别由3个氨基酸残基构成的氨基酸序列(vli),从而得到序列号20所示的氨基酸序列。相对于序列号8所示的氨基酸序列,每隔一个rep插入2处分别由3个氨基酸残基构成的氨基酸序列(vli),从而得到序列号21所示的氨基酸序列。
[0312]
(5-i)的人造丝心蛋白可以由序列号19、序列号20或序列号21所示的氨基酸序列构成。
[0313]
(5-ii)的人造丝心蛋白包含与序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(5-ii)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0314]
(5-ii)的人造丝心蛋白与序列号19、序列号20或序列号21所示的氨基酸序列具有90%以上的序列一致性,并且优选地,从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,将连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域所含的氨基酸残基的总数设为p、将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基的总数设为q时,p/q为6.2%以上。
[0315]
第5人造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。
[0316]
作为含有标签序列的人造丝心蛋白的更具体示例,可以列举出包含与(5-iii)序列号22(prt720)、序列号23(prt665)或序列号24(prt666)所示的氨基酸序列、或者(5-iv)序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0317]
分别在序列号19、序列号20及序列号21所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列),从而得到序列号22、序列号23及序列号24所示的氨基酸序列。
[0318]
(5-iii)的人造丝心蛋白可以由序列号22、序列号23或序列号24所示的氨基酸序列构成。
[0319]
(5-iv)的人造丝心蛋白包含与序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(5-iv)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0320]
(5-iv)的人造丝心蛋白与序列号22、序列号23或序列号24所示的氨基酸序列具有90%以上的序列一致性,并且优选地,从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,将连续的4个氨基酸残基的疏水性指标的平均值为2.6以上的区域所含的氨基酸残基的总数设为p、将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的氨基酸残基的总数设为q时,p/q为6.2%以上。
[0321]
第5人造丝心蛋白可以含有用于将人造蛋白质生产系统所生产的蛋白质释放到宿主外部的分泌信号。分泌信号的序列可以根据宿主种类来适当设定。
[0322]
第6人造丝心蛋白与天然来源的丝心蛋白相比,具有降低谷氨酰胺残基含量的氨基酸序列。
[0323]
第6人造丝心蛋白优选在rep的氨基酸序列中包含选自ggx基序及gpgxx基序中的至少1种基序。
[0324]
第6人造丝心蛋白在rep中包括gpgxx基序时,gpgxx基序含有率通常为1%以上,也可以为5%以上,优选为10%以上。gpgxx基序含有率的上限并没有特别限制,可以为50%以下,也可以为30%以下。
[0325]
在本说明书中,“gpgxx基序含有率”是通过以下方法计算出的值。
[0326]
在包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的丝心蛋白(人造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,当将该区域所含的gpgxx基序的个数的总数乘以3而得到的数(即,相当于gpgxx基序中的g及p的总数)设为s,并且将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列且除去(a)n基序后得到的所有rep的氨基酸残基的总数设为t时,以s/t来计算gpgxx基序含有率。
[0327]
在gpgxx基序含有率的计算中,将“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”作为对象是为了排除下述影响:“自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列”(相当于rep的序列)中有时包含与丝心蛋白的特征性序列相关性低的序列,m较小时(即,结构域序列较短时)会影响gpgxx基序含有率的计算结果。另外,“gpgxx基序”位于rep的c末端时,即使“xx”例如为“aa”,也作为“gpgxx基序”来处理。
[0328]
图1是表示人造丝心蛋白的结构域序列的示意图。参照图1来具体说明gpgxx基序含有率的计算方法。首先,在图1所示的人造丝心蛋白的结构域序列(“[(a)n基序-rep]
m-(a)n基序”类型)中,所有rep都包含在“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”(图1中“区域a”所示的序列)中,因此用于计算s的gpgxx基序的个数为7,s为7
×
3=21。同样地,由于所有rep都包含在“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列”(图1中“区域a”所示的序列)中,因此从该序列中进一步除去(a)n基序后得到的所有rep的氨基酸残基的总数t为50+40+10+20+30=150。接下来,通过将s除以t,可以计算出s/t(%),在图1的人造丝心蛋白的情况下,为21/150=14.0%。
[0329]
在第6人造丝心蛋白中,谷氨酰胺残基含有率优选为9%以下,更优选为7%以下,进一步优选为4%以下,特别优选为0%。
[0330]
在本说明书中,“谷氨酰胺残基含有率”是通过以下方法计算出的值。
[0331]
在包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的丝心蛋白(人造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列(相当于图1的“区域a”的序列)所含的所有rep中,当将该区域所含的谷氨酰胺残基的总数设为u,并且将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列且进一步除去(a)n基序后得到的所有rep的氨基酸残基的总数设为t时,以u/t来计算谷氨酰胺残基含有率。在谷氨酰胺残基含有率的计算中,以“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”为对象的理由与上述理由相同。
[0332]
第6人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,可以具有相当于使rep中的一个或多个谷氨酰胺残基发生缺失或置换为其他氨基酸残基的氨基酸序列。
[0333]“其他氨基酸残基”只要是谷氨酰胺残基以外的氨基酸残基即可,优选为疏水性指标大于谷氨酰胺残基的氨基酸残基。氨基酸残基的疏水性指标如表1所示。
[0334]
如表1所示,作为疏水性指标大于谷氨酰胺残基的氨基酸残基,可以列举出选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)、丙氨酸(a)、甘氨酸(g)、苏氨酸(t)、丝氨酸(s)、色氨酸(w)、酪氨酸(y)、脯氨酸(p)及组氨酸(h)中的氨基酸残基。其中,更优选为选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)、苯丙氨酸(f)、半胱氨酸(c)、蛋氨酸(m)及丙氨酸(a)中的氨基酸残基,进一步优选为选自异亮氨酸(i)、缬氨酸(v)、亮氨酸(l)及苯丙氨酸(f)中的氨基酸残基。
[0335]
第6人造丝心蛋白的rep的疏水性程度(亲水指数)例如可以是-0.80以上、-0.70、-0.60以上、-0.50以上、-0.40以上、-0.30以上、-0.20以上、-0.10以上、0.00以上、0.10以上、0.20以上、0.22以上、0.25以上、0.30以上、0.35以上、0.40以上、0.45以上、0.50以上、0.55以上、0.60以上、0.65以上或0.70以上。rep的疏水性程度的上限并没有特别限制,可以为1.0以下,也可以为0.7以下。
[0336]
在本说明书中,“rep的疏水性程度”为通过以下方法而计算出的值。
[0337]
在包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的丝心蛋白(人造丝心蛋白或天然来源的丝心蛋白)中,在从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列(相当于图1的“区域a”的序列)所含的所有rep中,当将该区域的各氨基酸残基的疏水性指标的总和设为v,并且将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列且进一步除去(a)n基序后得到的所有rep的氨基酸残基的总数设为t时,以v/t来计算rep的疏水性程度。在rep的疏水性程度的计算中,以“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”为对象的理由与上述理由相同。
[0338]
第6人造丝心蛋白的结构域序列与天然来源的丝心蛋白相比,其除了相当于缺失了rep中的一个或多个谷氨酰胺残基、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基的改造之外,还可以进一步进行相当于置换、缺失、插入及/或添加一个或多个氨基酸残基的氨基酸序列的改造。
[0339]
例如可以通过在克隆出的天然来源的丝心蛋白的基因序列中使rep中的一个或多个谷氨酰胺残基发生缺失、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基,从而得到第6人造丝心蛋白。此外,例如也可以通过设计出相当于在天然来源的丝心蛋白的氨基酸序列中,使rep中的一个或多个谷氨酰胺残基发生缺失、及/或将rep中的一个或多个谷氨酰胺残基置换为其他氨基酸残基的氨基酸序列,并且对编码所设计的氨基酸序列的核酸进行化学合成后得到。
[0340]
作为第6人造丝心蛋白的更具体示例,可以列举出包含(6-i)序列号25(met-prt888)、序列号26(met-prt965)、序列号27(met-prt889)、序列号28(met-prt916)、序列号29(met-prt918)、序列号30(met-prt699)、序列号31(met-prt698)、序列号32(met-prt966)、序列号41(met-prt917)或序列号42(met-prt1028)所示的氨基酸序列的人造丝心蛋白,或者包含与(6-ii)序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序
列号31、序列号32、序列号41或序列号42所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0341]
对(6-i)的人造丝心蛋白进行说明。将序列号7所示的氨基酸序列(met-prt410)中的qq全部置换为vl,从而得到序列号25所示的氨基酸序列。序列号26所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为ts、并且将剩余的q置换为a而得到的氨基酸序列。序列号27所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vl、并且将剩余的q置换为i而得到的氨基酸序列。序列号28所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vi、并且将剩余的q置换为l而得到的氨基酸序列。序列号29所表示的氨基酸序列是将序列号7所表示的氨基酸序列中的qq全部置换为vf、并且将剩余的q置换为i而得到的氨基酸序列。
[0342]
序列号30所表示的氨基酸序列是将序列号8所表示的氨基酸序列(met-prt525)中的qq全部置换为vl而得到的氨基酸序列。序列号31所表示的氨基酸序列是将序列号8所表示的氨基酸序列中的qq全部置换为vl、并且将剩余的q置换为i而得到的氨基酸序列。
[0343]
将序列号7所示的氨基酸序列(met-prt410)中存在的20个结构域序列的区域重复2次后得到的序列中的qq全部置换为vf,并且将剩余的q置换为i,从而得到序列号32所示的氨基酸序列。
[0344]
将序列号7所示的氨基酸序列中的qq全部置换为li,并且将剩余的q置换为v,从而得到序列号41所示的氨基酸序列(met-prt917)。将序列号7所示的氨基酸序列中的qq全部置换为if,并且将剩余的q置换为t,从而得到序列号42所示的氨基酸序列(met-prt1028)。
[0345]
序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41及序列号42所示的氨基酸序列的谷氨酰胺残基含有率均为9%以下(表2)。
[0346]
[表2]
[0347]
改造丝心蛋白谷氨酰胺残基含有率gpgxx基序含有率rep疏水性程度met-prt410(序列号7)17.7%27.9%-1.52met-prt888(序列号25)6.3%27.9%-0.07met-prt965(序列号26)0.0%27.9%-0.65met-prt889(序列号27)0.0%27.9%0.35met-prt916(序列号28)0.0%27.9%0.47met-prt918(序列号29)0.0%27.9%0.45met-prt699(序列号30)3.6%26.4%-0.78met-prt698(序列号31)0.0%26.4%-0.03met-prt966(序列号32)0.0%28.0%0.35met-prt917(序列号41)0.0%27.9%0.46met-prt1028(序列号42)0.0%28.1%0.05
[0348]
(6-i)的人造丝心蛋白可以由序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41或序列号42所示的氨基酸序列构成。
[0349]
(6-ii)的人造丝心蛋白包含与序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41或序列号42所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(6-ii)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m或式2:
[(a)n基序-rep]
m-(a)n基序所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0350]
(6-ii)的人造丝心蛋白的谷氨酰胺残基含有率优选为9%以下。此外,(6-ii)的人造丝心蛋白的gpgxx基序含有率优选为10%以上。
[0351]
第6人造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。由此,可以实现人造丝心蛋白的分离、固定、检测及可视化等。
[0352]
作为含有标签序列的人造丝心蛋白的更具体示例,可以列举出包含(6-iii)序列号33(prt888)、序列号34(prt965)、序列号35(prt889)、序列号36(prt916)、序列号37(prt918)、序列号38(prt699)、序列号39(prt698)、序列号40(prt966)、序列号43(prt917)或序列号44(prt1028)所示的氨基酸序列的人造丝心蛋白,或者包含与(6-iv)序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列具有90%以上序列一致性的氨基酸序列的人造丝心蛋白。
[0353]
分别在序列号25、序列号26、序列号27、序列号28、序列号29、序列号30、序列号31、序列号32、序列号41及序列号42所示的氨基酸序列的n末端添加序列号11所示的氨基酸序列(包含his标签序列及铰链序列),从而得到序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43及序列号44所示的氨基酸序列。由于仅在n末端添加了标签序列,因此谷氨酰胺残基含有率没有变化,序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43及序列号44所示的氨基酸序列的谷氨酰胺残基含有率均为9%以下(表3)。
[0354]
[表3]
[0355]
改造丝心蛋白谷氨酰胺残基含有率gpgxx基序含有率rep疏水性程度prt888(序列号33)6.3%27.9%-0.07prt965(序列号34)0.0%27.9%-0.65prt889(序列号35)0.0%27.9%0.35prt916(序列号36)0.0%27.9%0.47prt918(序列号37)0.0%27.9%0.45prt699(序列号38)3.6%26.4%-0.78prt698(序列号39)0.0%26.4%-0.03prt966(序列号40)0.0%28.0%0.35prt917(序列号43)0.0%27.9%0.46prt1028(序列号44)0.0%28.1%0.05
[0356]
(6-iii)的人造丝心蛋白可以由序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列构成。
[0357]
(6-iv)的人造丝心蛋白包含与序列号33、序列号34、序列号35、序列号36、序列号37、序列号38、序列号39、序列号40、序列号43或序列号44所示的氨基酸序列具有90%以上序列一致性的氨基酸序列。(6-iv)的人造丝心蛋白也为包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
[0358]
(6-iv)的人造丝心蛋白的谷氨酰胺残基含有率优选为9%以下。此外,(6-iv)的人造丝心蛋白的gpgxx基序含有率优选为10%以上。
[0359]
第6人造丝心蛋白可以含有用于将人造蛋白质生产系统所生产的蛋白质释放到宿
主外部的分泌信号。分泌信号的序列可以根据宿主种类来适当设定。
[0360]
人造丝心蛋白可以为兼具第1人造丝心蛋白、第2人造丝心蛋白、第3人造丝心蛋白、第4人造丝心蛋白、第5人造丝心蛋白及第6人造丝心蛋白所具有的特征中的至少2种以上特征的人造丝心蛋白。
[0361]
本实施方式所涉及的人造丝心蛋白也可以为包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]m-(a)n基序所表示的结构域序列的蛋白质。人造丝心蛋白可以在结构域序列的n末端侧及c末端侧中的任意一个末端侧或两个末端侧进一步添加氨基酸序列(n末端序列及c末端序列)。n末端序列及c末端序列并不限定于此,典型地,不具有丝心蛋白中的特征性的氨基酸基序的重复的区域,并且由100个残基左右的氨基酸构成。
[0362]
在本说明书中,"结构域序列"为生成丝心蛋白特有的结晶区(通常相当于氨基酸序列的(a)n基序)和非晶区(通常相当于氨基酸序列的rep)的氨基酸序列,是指式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的氨基酸序列。在此,(a)n基序表示由4~27个氨基酸残基构成的氨基酸序列,并且(a)n基序中的丙氨酸残基数相对于总氨基酸残基数为80%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示10~300的整数。m优选为20~300的整数,更优选为30~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。存在的多个rep可以是彼此相同的氨基酸序列,也可以是彼此不同的氨基酸序列。
[0363]
在结构域序列中两个以上存在的(a)n基序优选至少7个仅由丙氨酸残基构成。仅由丙氨酸残基构成是指(a)n基序具有(ala)k(ala表示丙氨酸残基)所表示的氨基酸序列。k优选为4~27的整数,更优选为4~20的整数,进一步优选为4~16的整数。
[0364]
rep由10~200个氨基酸残基构成。构成rep的氨基酸残基的1个以上可以为选自由甘氨酸残基、丝氨酸残基和丙氨酸残基构成的组中的氨基酸残基。即,rep可以包含选自由甘氨酸残基、丝氨酸残基和丙氨酸残基构成的组中的氨基酸残基。
[0365]
构成rep的氨基酸残基的1个以上可以为疏水性氨基酸残基。即,rep优选地包含疏水性氨基酸残基。所谓疏水性氨基酸残基,是指疏水性指标为正的氨基酸残基。关于氨基酸残基的疏水性指标(亲水指数,以下也记为“hi”),使用公知的指标公知的指标(hydropathy index:kyte j,&doolittle r(1982)"a simple method for displaying the hydropathic character of a protein",j.mol.biol.,157,pp.105-132)。作为疏水性氨基酸残基,例如,可以列举出异亮氨酸(hi:4.5)、缬氨酸(hi:4.2)、亮氨酸(hi:3.8)、苯丙氨酸(hi:2.8)、蛋氨酸(hi:1.9)、丙氨酸(hi:1.8)。
[0366]
在本实施方式所涉及的人造丝心蛋白中,与天然来源的丝心蛋白相比,结构域序列优选具有相当于在rep中插入半胱氨酸残基的氨基酸序列。
[0367]
结构域序列优选为在rep中与甘氨酸残基、丝氨酸残基或丙氨酸残基相邻的位置处具有相当于插入半胱氨酸残基的氨基酸序列,更优选为在rep中与甘氨酸残基相邻的位置处具有相当于插入半胱氨酸残基的氨基酸序列。rep中的半胱氨酸残基可以位于甘氨酸残基、丝氨酸残基或丙氨酸残基与甘氨酸残基、丝氨酸残基或丙氨酸残基之间,也可以位于丝氨酸残基与甘氨酸残基之间。
[0368]
结构域序列优选具有相当于在rep中与疏水性氨基酸残基相邻的位置处插入半胱氨酸残基的氨基酸序列的结构域序列。在这种情况下,疏水性氨基酸残基通过疏水相互作
用固定在分子之间。rep中的半胱氨酸残基可以位于疏水性氨基酸残基的旁边,也可以位于疏水性氨基酸残基与除疏水性氨基酸残基以外的氨基酸残基之间,还可以位于疏水性氨基酸残基与甘氨酸残基、丝氨酸残基或丙氨酸残基之间,也可以位于疏水性氨基酸残基与甘氨酸残基之间。疏水性氨基酸残基可以是选自由异亮氨酸残基、缬氨酸残基、亮氨酸残基、苯丙氨酸残基、蛋氨酸残基和丙氨酸残基构成的组中的1种。
[0369]
与天然来源的丝心蛋白相比,结构域序列也可以具有相当于在位于结构域序列的n末端和/或c末端附近的rep中插入半胱氨酸残基的氨基酸序列。在这种情况下,可以延长分子链。在本说明书中,所谓位于结构域序列的n末端附近的rep,是指位于从结构域序列的n末端起第1~3个位置处的rep。例如,半胱氨酸残基也可以位于从结构域序列的n末端起第1~2个位置处的rep中。在本说明书中,所谓位于结构域序列的c末端附近的rep,是指位于从结构域序列的c末端起第1~3个位置处的rep。例如,半胱氨酸残基也可以位于从结构域序列的c末端起第1~2个位置处的rep中。半胱氨酸残基优选位于结构域序列的最靠n末端侧和/或最靠c末端侧的rep中。
[0370]
与天然来源的丝心蛋白相比,结构域序列也可以具有相当于在rep中的中心处或中心附近插入半胱氨酸残基的氨基酸序列。在本说明书中,所谓rep中的氨基酸序列的中心附近,表示从位于rep中心处的氨基酸残基(当位于中心处的氨基酸残基存在2个的情况下,为n末端侧的氨基酸残基)向n末端侧第1~5个位置处、或者从位于rep中心处的氨基酸残基(当位于中心的氨基酸残基存在2个的情况下,为c末端侧的氨基酸残基)起第1~5个位置处。例如,半胱氨酸残基也可以位于rep的中心处,还可以从位于rep的中心处的氨基酸残基向n末端侧或c末端侧的第1~3个或第1~2个位置处。在此,当使用包含多肽骨架的第一链段的情况下,可以获得通过这样的第一链段和第二链段以一个个地交替位于其中的方式连接而成的合成高分子,其中,该多肽骨架例如以分别位于结构域序列的n末端侧和c末端侧中每一侧的方式插入有半胱氨酸残基。有望提高使用该合成高分子获得的成型体(例如纤维或薄膜、凝胶等)的伸长率。此外,当使用包含多肽骨架的第一链段的情况下,相对于这样的第一链段,与第二链段连接而成的合成高分子在溶剂中的溶解度有望提高,其中,该多肽骨架例如以位于比结构域序列的n末端侧或c末端侧更靠近中心部侧的方式插入有半胱氨酸残基。
[0371]
人造丝心蛋白优选在rep的氨基酸序列中包含gpgxx基序(g表示甘氨酸残基,p表示脯氨酸残基,x表示除甘氨酸残基以外的氨基酸残基)。通过在rep中包含该基序,可以提高人造丝心蛋白的的伸长率。
[0372]
人造丝心蛋白在rep中包括gpgxx基序时,gpgxx基序含有率通常为1%以上,也可以为5%以上,优选为10%以上。在这种情况下,人造丝心蛋白纤维的应力得以进一步提高。gpgxx基序含有率的上限并没有特别限制,可以为50%以下,也可以为30%以下。
[0373]
在本说明书中,“gpgxx基序含有率”是根据以下方法计算出的值。在包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的丝心蛋白中,在从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列所含的所有rep中,当将该区域所含的gpgxx基序的个数的总数乘以3而得到的数(即,相当于gpgxx基序中的g及p的总数)设为c,并且将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列且除去(a)n基序后得到的所有rep的氨基
酸残基的总数设为d时,以c/d来计算gpgxx基序含有率。
[0374]
在gpgxx基序含有率的计算中,将“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”作为对象是为了排除下述影响:“自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列”(相当于rep的序列)中有时包含与丝心蛋白的特征性序列相关性低的序列,m较小时(即,结构域序列较短时)会影响gpgxx基序含有率的计算结果。另外,“gpgxx基序”位于rep的c末端时,即使“xx”例如为“aa”,也作为“gpgxx基序”来处理。
[0375]
图5是表示丝心蛋白的结构域序列的示意图。参照图5来具体说明gpgxx基序含有率的计算方法。首先,在图5所示的丝心蛋白的结构域序列(“[(a)n基序-rep]
m-(a)n基序”类型)中,所有rep都包含在“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”(图5中“区域a”所示的序列)中,因此用于计算c的gpgxx基序的个数为7,c为7
×
3=21。同样地,由于所有rep都包含在“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列”(图5中“区域a”所示的序列)中,因此从该序列中进一步除去(a)n基序后得到的所有rep的氨基酸残基的总数d为50+40+10+20+30=150。接下来,通过将c除以d,可以计算出c/d(%),在图5的丝心蛋白的情况下,为21/150=14.0%。
[0376]
人造丝心蛋白的rep的疏水性程度(亲水指数:疏水性指标)例如可以是-0.80、-0.70、-0.06以上、-0.50以上、-0.40以上、-0.30以上、-0.20以上、-0.10以上、0.00以上、0.10以上、0.20以上、0.22以上、0.25以上、0.30以上、0.35以上、0.40以上、0.45以上、0.50以上、0.55以上、0.60以上、0.65以上、0.70以上。rep的疏水性程度的上限并没有特别限制,可以为1.0以下,也可以为0.7以下。
[0377]
在本说明书中,“rep的疏水性程度”为通过以下方法而计算出的值。在包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所示的结构域序列的丝心蛋白中,在从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后得到的序列(相当于图5的“区域a”的序列)所含的所有rep中,当将该区域的各氨基酸残基的疏水性指标的总和设为e,并且将从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列且除去(a)n基序后得到的所有rep的氨基酸残基的总数设为f时,以e/f来计算rep的疏水性程度。在rep的疏水性程度的计算中,以“从结构域序列中除去自位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列后所得的序列”为对象的理由与上述理由相同。
[0378]
与天然来源的丝心蛋白相比,结构域序列也可以具有相当于在rep中插入1以上、小于16的半胱氨酸残基的氨基酸序列。也就是说,相当于插入到rep中的半胱氨酸残基的总数可以为1以上且小于16。相当于插入到rep中的半胱氨酸残基的总数也可以为1以上且12以下、1以上且10以下、1以上且8以下、1以上且6以下、或2以上4以下。例如,结构域序列中一个rep的半胱氨酸残基数可以为1~3,也可以为1~2,还可以为1。
[0379]
本实施方式所涉及的人造丝心蛋白的半胱氨酸残基的总数可以为1以上且小于16、1以上且12以下、1以上且10以下、1以上且8以下、1以上且6以下、或2以上且4以下。
[0380]
本实施方式所涉及的人造丝心蛋白除了上述rep中的半胱氨酸残基相关的改造外,与天然来源的丝心蛋白相比,还可以进一步进行与置换、缺失、插入及/或添加一个或多
个氨基酸残基相当的氨基酸序列的改造。
[0381]
本实施方式所涉及的人造丝心蛋白的分子量没有特别限定,例如可以为10kda以上且700kda以下。本实施方式的人造丝心蛋白的分子量例如可以为2kda以上、3kda以上、4kda以上、5kda以上、6kda以上、7kda以上、8kda以上、9kda以上、10kda以上、20kda以上、30kda以上、40kda以上、50kda以上、60kda以上、70kda以上、80kda以上、90kda以上或100kda以上,还可以为600kda以下、500kda以下、400kda以下、小于360kda、300kda以下或200kda以下。
[0382]
作为本实施方式所涉及的人造丝心蛋白,优选为具有相当于插入半胱氨酸残基的氨基酸序列,作为该人造丝心蛋白的具体示例,可以例举出包括(i)序列号46、序列号47、序列号48、序列号49、序列号50、或序列号51所示的氨基酸序列的人造丝心蛋白,或者包括(ii)序列号52、序列号53、序列号54或序列号55所示的氨基酸序列的人造丝心蛋白。
[0383]
相对于序列号56所示的氨基酸序列(prt11),序列号46所示的氨基酸序列(prt1)为在位于结构域序列的最靠n末端侧的rep插入1处半胱氨酸残基的序列。即,序列号46所示的氨基酸序列(prt1)中的半胱氨酸残基的总数为1。
[0384]
相对于序列号57所示的氨基酸序列(prt12),序列号47所示的氨基酸序列(prt2)为在位于结构域序列的最靠n末端侧的rep插入1处半胱氨酸残基的序列。即,序列号47所示的氨基酸序列(prt2)中的半胱氨酸残基的总数为1。
[0385]
相对于序列号57所示的氨基酸序列(prt12),序列号48所示的氨基酸序列(prt3)为在分别位于结构域序列的最靠n末端侧的rep和最靠c末端侧的rep中,分别各插入1处半胱氨酸残基的序列。即,序列号48所示的氨基酸序列(prt3)中的半胱氨酸残基的总数为2。
[0386]
相对于序列号57所示的氨基酸序列(prt12),序列号49所示的氨基酸序列(prt4)为在分别位于从结构域序列的n末端侧和c末端侧起第1个和第2个位置处的rep中,分别各插入有1处半胱氨酸残基的序列。即,序列号49所示的氨基酸序列(prt4)中的半胱氨酸残基的总数为4。
[0387]
相对于序列号57所示的氨基酸序列(prt12),序列号50所示的氨基酸序列(prt5)为在分别位于从结构域序列的n末端侧和c末端侧起第1~4位置处的rep中,分别各插入有1处半胱氨酸残基的序列。即,序列号50所示的氨基酸序列(prt5)中的半胱氨酸残基的总数为8。
[0388]
相对于序列号57所示的氨基酸序列(prt12),序列号51所示的氨基酸序列(prt6)为在分别位于从结构域序列的n末端侧和c末端侧起第1~8位置处的rep中,分别各插入有1处半胱氨酸残基的序列。即,序列号51所示的氨基酸序列(prt6)中的半胱氨酸残基的总数为16。
[0389]
相对于序列号58所示的氨基酸序列(prt13),序列号52所示的氨基酸序列(prt7)为在分别位于结构域序列的最靠n末端侧和最靠c末端侧的rep分别插入1处半胱氨酸残基的序列。即,序列号52所示的氨基酸序列(prt7)中的半胱氨酸残基的总数为2。
[0390]
相对于序列号59所示的氨基酸序列(prt14),序列号53所示的氨基酸序列(prt8)为在分别位于结构域序列的最靠n末端侧和最靠c末端侧的rep分别插入1处半胱氨酸残基的序列。即,序列号53所示的氨基酸序列(prt8)中的半胱氨酸残基的总数为2。
[0391]
相对于序列号59所示的氨基酸序列(prt14),序列号54所示的氨基酸序列(prt9)
为在分别位于从结构域序列的n末端侧和c末端侧起第1~4个位置处的rep中,分别各插入有1处半胱氨酸残基的序列。即,序列号54所示的氨基酸序列(prt9)中的半胱氨酸残基的总数为8。
[0392]
相对于序列号59所示的氨基酸序列(prt14),序列号55所示的氨基酸序列(prt10)为在分别位于从结构域序列的n末端侧和c末端侧起第1~8个位置处的rep中,分别各插入有1处半胱氨酸残基的序列。即,序列号55所示的氨基酸序列(prt10)中的半胱氨酸残基的总数为16。
[0393]
(i)的人造丝心蛋白可以是仅具有序列号46、序列号47、序列号48、序列号49、序列号50、或序列号51所示的氨基酸序列的人造丝心蛋白。(ii)的人造丝心蛋白可以是仅具有序列号52、序列号53、序列号54或序列号55所示的氨基酸序列的人造丝心蛋白。
[0394]
上述人造丝心蛋白可以在n末端及c末端中的任意一端或两端包含标签序列。由此可以实现人造丝心蛋白的分离、固定、检测及可视化等。
[0395]
作为标签序列,例如,可以列举出利用与其他分子的特异性亲和性(结合性、亲和性)的亲和性标签。作为亲和性标签的具体示例,可以列举出组氨酸标签(his标签)。his标签是由4至10个左右的组氨酸残基排列而成的短肽,具有与镍等的金属离子特异性结合的性质,因此可以用于通过金属螯合层析(chelating metal chromatography)进行的人造丝心蛋白的分离。作为标签序列的具体例,可以列举例如序列号70或序列号71所示的氨基酸序列(包含his标签的氨基酸序列)。
[0396]
此外,也可以利用与谷胱甘肽特异性结合的谷胱甘肽-s-转移酶(gst)、与麦芽糖特异性结合的麦芽糖结合蛋白(mbp)等标签序列。
[0397]
更进一步地,还可以使用利用抗原抗体反应的“表位标签”。通过添加用于显示抗原性的肽(表位)作为标签序列,可以结合针对该表位的抗体。作为表位标签,可以列举出ha(流感病毒血凝素的肽序列)标签、myc标签、flag标签等。通过利用表位标签,可以很容易地以高特异性对人造丝心蛋白进行纯化。
[0398]
更进一步地,也可以使用利用特定的蛋白酶将标签序列切除而得到的标签。也可以通过对经由该标签序列吸附的蛋白质进行蛋白酶处理,来回收切除标签序列后的人造丝心蛋白。
[0399]
作为含有标签序列的人造丝心蛋白的更具体示例,可以列举出包含(iii)序列号60(prt15)、序列号61(prt16)、序列号62(prt17)、序列号63(prt18)、序列号64(prt19)、或序列号65(prt20)所示的氨基酸序列的人造丝心蛋白,或者包含(iv)序列号66(prt21)、序列号67(prt22)、序列号68(prt23)、或序列号69(prt24)所示的氨基酸序列的人造丝心蛋白。
[0400]
另外,序列号60(prt15)、序列号61(prt16)、序列号62(prt17)、序列号63(prt18)、序列号64(prt19)及序列号65(prt20)所示的氨基酸序列分别为在序列号46(prt1)、序列号47(prt2)、序列号48(prt3)、序列号49(prt4)、序列号50(prt5)及序列号51(prt6)所示的氨基酸序列的n末端导入了包含序列号70所示的氨基酸序列的标签序列的氨基酸序列。此外,序列号66(prt21)、序列号67(prt22)、序列号68(prt23)及序列号69(prt24)所示的氨基酸序列分别为在序列号52(prt7)、序列号53(prt8)、序列号54(prt9)及序列号55(prt10)所示的氨基酸序列的n末端导入了包含序列号70所示的氨基酸序列的标签序列的氨基酸序列。
[0401]
(iii)的人造丝心蛋白可以是仅具有序列号60、序列号61、序列号62、序列号63、序列号64、或序列号65所示的氨基酸序列的人造丝心蛋白。
[0402]
包括序列号60(prt15)、序列号61(prt16)、序列号62(prt17)、序列号63(prt18)、序列号64(prt19)或序列号65(prt20)所示的氨基酸序列,人造丝心蛋白的gpgxx基序含有率分别为40.2%、39.9%、39.9%、39.7%、39.3%和38.6%,均为10%以上。
[0403]
(iv)的人造丝心蛋白可以是仅具有序列号66、序列号67、序列号68或序列号69所示的氨基酸序列的人造丝心蛋白。
[0404]
包括序列号66(prt21)、序列号67(prt22)、序列号68(prt23)或序列号69(prt24)所示的氨基酸序列,人造丝心蛋白的gpgxx基序含有率分别为39.9%、39.9%、39.3%和38.6%,均为10%以上。
[0405]
上述人造丝心蛋白可以包含用于将重组蛋白生产系统中生产的蛋白质释放到宿主的外部的分泌信号。分泌信号的序列可以根据宿主种类来适当设定。
[0406]
[核酸]
[0407]
一个实施方式的核酸编码上述人造丝心蛋白。作为核酸的具体示例,可以列举编码包含序列号46、序列号47、序列号48、序列号49、序列号50、序列号51、序列号52、序列号53、序列号54、或序列号55所示的氨基酸序列的人造丝心蛋白、或者编码在这些氨基酸序列的n末端和c末端中的任意一个或两个末端结合序列号70或序列号71所示的氨基酸序列(标签序列)的人造丝心蛋白等的核酸。
[0408]
一个实施方式的核酸为下述核酸:在严格条件下与编码上述人造丝心蛋白的核酸的互补链杂交,并且编码包含式1:[(a)n基序-rep]m或式2:[(a)n基序-rep]
m-(a)n基序所表示的结构域序列的人造丝心蛋白。通过该核酸编码的人造丝心蛋白的上述结构域序列,与天然来源的丝心蛋白相比,具有相当于在rep中插入半胱氨酸残基的氨基酸序列。
[0409]
"严格条件"是指所谓的形成特异性杂交体而不形成非特异性杂交体的条件。"严格条件"可以为低严格条件、中严格条件和高严格条件中的任意一种。低严格条件是指仅在序列间存在至少85%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5
×
ssc在42℃下进行杂交的条件。中严格条件是指仅在序列间存在至少90%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5
×
ssc在50℃下进行杂交的条件。高严格条件是指仅在序列间存在至少95%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5
×
ssc在60℃下进行杂交的条件。
[0410]
[宿主和表达载体]
[0411]
一个实施方式的表达载体具有上述核酸序列和以能够工作的方式与该核酸序列连接的一个或两个以上调节序列。调节序列是对宿主中的重组蛋白的表达进行调控的序列(例如启动子、增强子、核糖体结合序列、转录终止序列等),可以根据宿主的种类适当选择。表达载体的种类可以根据宿主的种类来适当地选择质粒载体、病毒载体、柯斯质粒载体、福斯质粒载体、人工染色体载体等。
[0412]
一个实施方式所涉及的宿主是利用上述表达载体进行转化而得到的。作为宿主,可以优选使用原核生物、以及酵母、丝状真菌、昆虫细胞、动物细胞及植物细胞等真核生物中的任意一种。
[0413]
作为表达载体,优选使用在宿主细胞中能够自主复制、或者能够整合到宿主的染
色体中、且在能够对一个实施方式所涉及的核酸进行转录的位置含有启动子的表达载体。
[0414]
在使用细菌等原核生物作为宿主的情况下,一个实施方式所涉及的表达载体优选为在原核生物中能够自主复制的同时包含启动子、核糖体结合序列、一个实施方式所涉及的核酸和转录终止序列的载体。也可以含有控制启动子的基因。
[0415]
作为原核生物,可以列举出属于埃希氏菌属、短芽孢杆菌属、沙雷氏菌属、芽孢杆菌属、微杆菌属、短杆菌属、棒杆菌属、及假单胞菌属等的微生物。
[0416]
作为属于埃希氏菌属的微生物,可以列举例如大肠杆菌bl21(novagen公司)、大肠杆菌bl21(de3)(life technologies公司)、大肠杆菌blr(de3)(默克密理博公司)、大肠杆菌dh1、大肠杆菌gi698、大肠杆菌hb101、大肠杆菌jm109、大肠杆菌k5(atcc 23506)、大肠杆菌ky3276、大肠杆菌mc1000、大肠杆菌mg1655(atcc 47076)、大肠杆菌no.49、大肠杆菌rosetta(de3)(novagen公司)、大肠杆菌tb1、大肠杆菌tuner(novagen公司)、大肠杆菌tuner(de3)(novagen公司)、大肠杆菌w1485、大肠杆菌w3110(atcc 27325)、大肠杆菌(escherichia coli)xl1-blue、以及大肠杆菌xl2-blue等。
[0417]
作为属于短芽孢杆菌属的微生物,可以列举例如土壤短芽孢杆菌、波茨坦短芽孢杆菌、中孢短芽孢杆菌、美丽短芽孢杆菌、污染短芽孢杆菌、侧孢短芽孢杆菌、沼泽短芽孢杆菌、副短短芽孢杆菌、罗伊氏短芽孢杆菌、热红短芽孢杆菌、短短芽孢杆菌47(ferm bp-1223)、短短芽孢杆菌47k(ferm bp-2308)、短短芽孢杆菌47-5(ferm bp-1664)、短短芽孢杆菌47-5q(jcm8975)、桥石短芽孢杆菌hpd31(ferm bp-1087)、桥石短芽孢杆菌hpd31-s(ferm bp-6623)、桥石短芽孢杆菌hpd31-ok(ferm bp-4573)、以及桥石短芽孢杆菌sp3株(takara公司制)等。
[0418]
作为属于沙雷氏菌属的微生物,可以列举例如液化沙雷氏菌(serratia liquefacience)atcc14460、嗜虫沙雷氏菌(serratia entomophila)、无花果沙雷氏菌(serratia ficaria)、居泉沙雷氏菌(serratia fonticola)、格氏沙雷氏菌(serratia grimesii)、变形斑沙雷氏菌(serratia proteamaculans)、气味沙雷氏菌(serratia odorifera)、普城沙雷氏菌(serratia plymuthica)、以及深红沙雷氏菌(serratia rubidaea)等。
[0419]
作为属于芽孢杆菌属的微生物,可以列举例如枯草芽孢杆菌(bacillus subtilis)及解淀粉芽孢杆菌(bacillus amyloliquefaciens)等。
[0420]
作为属于微杆菌属的微生物,可以列举例如嗜氨微杆菌atcc15354等。
[0421]
作为属于短杆菌属的微生物,可以列举例如叉开短杆菌(谷氨酸棒杆菌)atcc14020、黄色短杆菌(谷氨酸棒杆菌atcc14067)atcc13826、atcc14067、乳发酵短杆菌(brevibacterium immariophilum)atcc14068、乳酸发酵短杆菌(谷氨酸棒杆菌atcc13869)atcc13665、atcc13869、玫瑰色短杆菌atcc13825、解糖短杆菌(brevibacterium saccharolyticum)atcc14066、生硫短杆菌atcc19240、白色短杆菌atcc15111、以及蜡状短杆菌atcc15112等。
[0422]
作为属于棒杆菌属的微生物,可以列举例如产氨棒杆菌(corynebacterium ammoniagenes)atcc6871、atcc6872、谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032、谷氨酸棒杆菌atcc14067、嗜乙酰乙酸棒杆菌(corynebacterium acetoacidophilum)atcc13870、醋谷棒杆菌atcc15806、解碱棒杆菌atcc21511、帚石南棒杆
菌atcc15991、谷氨酸棒杆菌atcc13020、atcc13032、atcc13060、百合棒杆菌atcc15990、栖糖蜜棒杆菌atcc17965、热产氨棒杆菌aj12340(fermbp-1539)、以及力士棒杆菌atcc13868等。
[0423]
作为属于假单胞菌(pseudomonas)属的微生物,可以列举例如恶臭假单胞菌(pseudomonas putida)、荧光假单胞菌(pseudomonas fluorescens)、油菜假单胞菌(pseudomonas brassicacearum)、黄褐假单胞菌(pseudomonas fulva)和假单胞菌属细菌(pseudomonas sp.)d-0110等。
[0424]
向上述宿主细胞中导入表达载体的方法只要是向上述宿主细胞中导入dna的方法均可以使用。可以列举例如使用钙离子的方法[proc.natl.acad.sci.usa,69,2110(1972)]、原生质体法(日本特开昭63-248394号公报)、或gene,17,107(1982)、molecular&general genetics,168,111(1979)中记载的方法等。
[0425]
属于短芽孢杆菌属的微生物的转化可以利用例如takahashi等的方法(j.bacteriol.,1983,156:1130-1134)、takagi等的方法(agric.biol.chem.,1989,53:3099-3100)、或okamoto等的方法(biosci.biotechnol.biochem.,1997,61:202-203)来实施。
[0426]
作为导入一个实施方式所涉及的核酸的载体(以下简称为"载体"),可以列举例如pbtrp2、pbtac1、pbtac2(均由boehringer mannheim公司销售)、pkk233-2(pharmacia公司制)、pse280(invitrogen公司制)、pgemex-1(promega公司制)、pqe-8(qiagen公司制)、pkyp10(日本特开昭58-110600号公报)、pkyp200[agric.biol.chem.,48,669(1984)]、plsa1[agric.biol.chem.,53,277(1989)]、pgel1[proc.natl.acad.sci.usa,82,4306(1985)]、pbluescript ii sk(-)(stratagene公司制)、ptrs30[由大肠杆菌jm109/ptrs30(ferm bp-5407)制备]、ptrs32[由大肠杆菌jm109/ptrs32(ferm bp-5408)制备]、pgha2[由大肠杆菌igha2(ferm b-400)制备、日本特开昭60-221091号公报]、pgka2[由大肠杆菌igka2(ferm bp-6798)制备、日本特开昭60-221091号公报]、pterm2(us4686191、us4939094、us5160735)、psupex、pub110、ptp5、pc194、peg400[j.bacteriol.,172,2392(1990)]、pgex(pharmacia公司制)、以及pet系统(novagen公司制)等。
[0427]
在使用大肠杆菌作为宿主的情况下,例如可以列举puc18、pbluescriptii、psupex、pet22b、及pcold等作为优选的载体。
[0428]
作为属于短芽孢杆菌属的微生物的优选载体的具体例,可以列举作为枯草杆菌载体公知的pub110、或phy500(日本特开平2-31682号公报)、pny700(日本特开平4-278091号公报)、phy4831(j.bacteriol.,1987,1239-1245)、pnu200(鹈高重三、日本农艺化学会志1987,61:669-676)、pnu100(appl.microbiol.biotechnol.,1989,30:75-80)、pnu211(j.biochem.,1992,112:488-491)、pnu211r2l5(日本特开平7-170984号公报)、pnh301(appl.environ.microbiol.,1992,58:525-531)、pnh326、pnh400(j.bacteriol.,1995,177:745-749)、pht210(日本特开平6-133782号公报)、pht110r2l5(appl.microbiol.biotechnol.,1994,42:358-363)、或大肠杆菌与属于短芽孢杆菌属的微生物的穿梭载体pnco2(日本特开2002-238569号公报)等。
[0429]
作为启动子,只要在宿主细胞中发挥功能则没有限制。可以列举例如trp启动子(ptrp)、lac启动子、pl启动子、pr启动子、t7启动子等来源于大肠杆菌或噬菌体等的启动
子。此外,也可以使用将两个ptrp串联而成的启动子(ptrp
×
2)、tac启动子、lact7启动子、let i启动子这样人为地进行了设计改造的启动子等。
[0430]
优选使用将作为核糖体结合序列的夏因-达尔加诺(shine-dalgarno)序列与起始密码子之间调节为适当距离(例如6~18个碱基)的质粒。在表达载体中,上述核酸的表达不一定需要转录终止序列,但优选紧挨在结构基因的下游配置转录终止序列。
[0431]
作为真核生物的宿主,可以列举例如酵母、丝状真菌(霉菌等)和昆虫细胞。
[0432]
作为酵母,可以列举例如属于酵母(saccharomyces)属、裂殖酵母(schizosaccharomyces)属、克鲁维酵母(kluyveromyces)属、丝孢酵母(trichosporon)属、许旺酵母(schwanniomyces)属、毕赤酵母(pichia)属、假丝酵母(candida)属、耶氏酵母属和汉逊酵母属等的酵母。更具体而言,可以列举酿酒酵母(saccharomyces cerevisiae)、粟酒裂殖酵母(schizosaccharomyces pombe)、乳酸克鲁维酵母(kluyveromyces lactis)、马克斯克鲁维酵母(kluyveromyces marxianus)、丛生丝孢酵母(trichosporon pullulans)、河岸许旺酵母(schwanniomyces alluvius)、西方许旺酵母(schwanniomyces occidentalis)、产朊假丝酵母(candida utilis)、巴斯德毕赤酵母(pichia pastoris)、安格斯毕赤酵母(pichia angusta)、甲醇毕赤酵母(pichia methanolica)、多形毕赤酵母(pichia polymorpha)、树干毕赤酵母(pichia stipitis)、解脂耶氏酵母(yarrowia lipolytica)、以及多形汉逊酵母(hansenula polymorpha)等。
[0433]
使用酵母作为宿主细胞的情况下的表达载体通常优选包含复制起点(需要在宿主中扩增的情况)和用于大肠杆菌中的载体的增殖的筛选标志物、用于酵母中的重组蛋白表达的启动子和终止子、以及用于酵母的筛选标志物。
[0434]
在表达载体为非整合载体的情况下,优选进一步包含自主复制序列(ars)。由此能够提高表达载体在细胞内的稳定性(myers、a.m.、et al.(1986)gene 45:299-310)。
[0435]
作为使用酵母作为宿主的情况下的载体,可以列举例如yep13(atcc37115)、yep24(atcc37051)、ycp50(atcc37419)、yip、phs19、phs15、pa0804、phil3ol、phil-s1、ppic9k、ppiczα、pgapzα及ppicz b等。
[0436]
作为启动子,只要能够在酵母中表达则没有限制。作为启动子,可以列举例如己糖激酶等糖酵解系统的基因的启动子、pho5启动子、pgk启动子、gap启动子、adh启动子、gal 1启动子、gal 10启动子、热休克多肽启动子、mfα1启动子、cup 1启动子、pgap启动子、pgcw14启动子、aox1启动子及mox启动子等。
[0437]
向酵母中导入表达载体的方法只要是向酵母中导入dna的方法均可以使用。作为向酵母中导入表达载体的方法,可以列举例如电穿孔法(methods enzymol.,194,182(1990))、原生质球法(proc.natl.acad.sci.,usa,81,4889(1984))、乙酸锂法(j.bacteriol.,153,163(1983))、及proc.natl.acad.sci.usa,75,1929(1978)记载的方法等。
[0438]
作为丝状真菌,可以列举例如属于顶孢霉(acremonium)属、曲霉(aspergillus)属、黑粉霉(ustilago)属、木霉(trichoderma)属、链孢霉(neurospora)属、镰孢霉(fusarium)属、腐质霉(humicola)属、青霉(penicillium)属、毁丝霉(myceliophtora)属、灰霉(botryts)属、稻瘟霉(magnaporthe)属、毛霉(mucor)属、绿僵菌(metarhizium)属、红曲霉(monascus)属、根霉(rhizopus)属和根毛霉属的菌等。
manual(杆状病毒表达载体实验室手册),w.h.freeman and company,纽约(1992))。
[0444]
在使用昆虫细胞作为宿主的情况下,可以利用例如current protocols in molecular biology(分子生物学现行规范);baculovirus expression vectors,a laboratory manual(杆状病毒表达载体实验室手册),w.h.freeman and company,纽约(1992)及bio/technology,6,47(1988)等中记载的方法对多肽进行表达。即,可以将重组基因导入载体和杆状病毒共导入昆虫细胞中,在昆虫细胞培养上清中得到重组病毒(表达载体)后,进一步使重组病毒感染昆虫细胞,使多肽进行表达。作为该方法中使用的基因导入载体,可以列举例如pvl1392、pvl1393及pbluebaciii(均为invitorogen公司制)等。
[0445]
作为用于制备重组病毒的、重组基因导入载体和杆状病毒向昆虫细胞中的共导入方法,可以列举例如磷酸钙法(日本特开平2-227075号公报)及脂质体转染法(proc.natl.acad.sci.usa,84,7413(1987))等。
[0446]
一个实施方式所涉及的重组载体优选进一步含有用于转化体选择的选择标志物基因。例如,在大肠杆菌中,作为选择标志物基因,可以使用针对四环素、氨苄西林、卡那霉素等各种药剂的抗性基因。也可以使用能够与营养缺陷型相关的基因变异互补的劣性的选择标志物。在酵母中,作为选择标志物基因,可以使用针对遗传霉素的抗性基因,也可以使用与营养缺陷型相关的基因变异互补的基因、leu2、ura3、trp1、his3等选择标志物。在丝状真菌中,作为选择标志物基因,可以列举选自由niad(biosci.biotechnol.biochem.,59,1795-1797(1995))、argb(enzyme microbiol technol,6,386-389,(1984))、sc(gene,84,329-334,(1989))、ptra(bioscibiotechnol biochem,64,1416-1421,(2000))、pyrg(biochembiophys res commun,112,284-289,(1983)),amds(gene,26,205-221,(1983))、金担子素抗性基因(mol gen genet,261,290-296,(1999))、苯菌灵抗性基因(proc natl acad sci usa,83,4869-4873,(1986))和潮霉素抗性基因(gene,57,21-26,(1987))组成的组中的标志物基因、亮氨酸缺陷型互补基因等。另外,在宿主为营养缺陷型变异株的情况下,也可以使用与该营养缺陷型互补的野生型基因作为选择标志物基因。
[0447]
利用一个实施方式所涉及的表达载体进行了转化的宿主的选择可以通过使用选择地与上述核酸结合的探针的噬菌斑杂交和菌落杂交等来进行。作为该探针,可以使用将基于上述核酸的序列信息利用pcr法扩增出的部分dna片段用放射性同位素或地高辛进行修饰而得到的探针。
[0448]
[人造丝心蛋白的制备方法]
[0449]
本实施方式所涉及的人造丝心蛋白可以通过包含在利用上述表达载体进行了转化的宿主中表达上述核酸的工序的方法,进行制造。作为表达方法,除了直接表达以外,还可以依据分子克隆第二版中记载的方法等进行分泌生产、融合蛋白表达等。在利用酵母、动物细胞、昆虫细胞进行表达的情况下,可以以附加有糖或糖链的多肽的形式得到人造丝心蛋白。
[0450]
本实施方式所涉及的人造丝心蛋白例如可以通过将利用上述表达载体进行了转化的宿主在培养用培养基中进行培养,使本实施方式的人造丝心蛋白在培养用培养基中生成蓄积,并从该培养用培养基中收集来进行制造。将上述宿主在培养用培养基中进行培养的方法可以按照宿主培养通常使用的方法来进行。
[0451]
在上述宿主为大肠杆菌等原核生物或酵母等真核生物的情况下,作为上述宿主的
培养用培养基,只要是含有该宿主可同化的碳源、氮源及无机盐类等、并且能够高效地进行该宿主的培养的培养基,则可以使用天然培养基及合成培养基中的任意一种。
[0452]
作为碳源,只要是该宿主可同化的物质即可。作为碳源,例如,可以使用葡萄糖、果糖、蔗糖以及含有这些糖的糖蜜、淀粉及淀粉水解物等碳水化合物、乙酸及丙酸等有机酸、以及乙醇及丙醇等醇类。
[0453]
氮源例如可以使用氨、氯化铵、硫酸铵、乙酸铵及磷酸铵等无机酸或有机酸的铵盐、其他含氮化合物、以及蛋白胨、肉提取物、酵母提取物、玉米浆、酪蛋白水解物、豆粕及豆粕水解物、各种发酵菌体及其消化产物。
[0454]
作为无机盐,可以使用例如磷酸二氢钾、磷酸氢二钾、磷酸镁、硫酸镁、氯化钠、硫酸亚铁、硫酸锰、硫酸铜和碳酸钙。
[0455]
大肠杆菌等原核生物或酵母等真核生物的培养例如可以在振荡培养或深部通气搅拌培养等需氧条件下进行。培养温度例如为15~40℃。培养时间通常为16小时~7天。培养中的培养用培养基的ph值优选保持在3.0~9.0之间。培养用培养基的ph值的调整可以使用无机酸、有机酸、碱溶液、尿素、碳酸钙及氨等进行。
[0456]
此外,在培养中,可以根据需要在培养用培养基中添加氨苄西林及四环素等抗生素。当对通过使用诱导型启动子以作为启动子的表达载体进行转化后的微生物进行培养时,可以根据需要在培养基中添加诱导剂。例如,对利用采用lac启动子的表达载体进行转化后的微生物进行培养时,可以在培养基中添加异丙基-β-d-硫代半乳糖吡喃糖苷等;对利用采用trp启动子的表达载体进行转化后的微生物进行培养时,可以在培养基中添加吲哚丙烯酸等。
[0457]
作为昆虫细胞的培养用培养基,例如可以使用通常使用的tnm-fh培养基(pharmingen公司制)、sf-900 ii sfm培养基(life technologies公司制)、excell400、excell405(均为jrh biosciences公司制)及grace's昆虫培养基(nature,195,788(1962))等。
[0458]
昆虫细胞的培养例如可以在培养用培养基的ph为6~7、培养温度为25~30℃等条件下使培养时间为1~5天来进行。另外,培养中,可以根据需要在培养用培养基中添加庆大霉素等抗生素。
[0459]
在宿主为植物细胞的情况下,转化后的植物细胞可以直接进行培养,另外也可以分化为植物的器官来进行培养。作为培养该植物细胞的培养基,例如可以使用通常使用的murashige&skoog(ms)培养基、怀特(white)培养基、或者在这些培养基中添加生长素、细胞分裂素等植物激素而得到的培养基等。
[0460]
动物细胞的培养例如可以在培养用培养基的ph为5~9、培养温度为20~40℃等条件下使培养时间为3~60天来进行。另外,培养中,可以根据需要在培养基中添加卡那霉素、潮霉素等抗生素。
[0461]
作为使用利用上述表达载体进行了转化的宿主来生产人造丝心蛋白的方法,有下述方法:在宿主细胞内生产该人造丝心蛋白的方法;使该人造丝心蛋白分泌到宿主细胞外的方法;和在宿主细胞外膜上生产该人造丝心蛋白的方法的。可以通过改变所使用的宿主细胞和所生产的人造丝心蛋白的结构来选择这些各方法。
[0462]
例如,在人造丝心蛋白生产于宿主细胞内或宿主细胞外膜上的情况下,可以通过
应用鲍尔森等的方法(j.biol.chem.,264,17619(1989))、row等的方法(proc.natl.acad.sci.usa,86,8227(1989)、genes develop.,4,1288(1990))、或日本特开平5-336963号公报、国际公开第94/23021号等中记载的方法来进行变更,以使人造丝心蛋白主动地分泌到宿主细胞外。即,使用基因重组的方法,以在包含人造丝心蛋白的活性部位的多肽上附加有信号肽的形式进行表达,由此能够使人造丝心蛋白主动地分泌到宿主细胞外。
[0463]
由利用上述表达载体进行了转化的宿主生产的人造丝心蛋白可以利用蛋白质的分离纯化中通常使用的方法进行分离和纯化。例如,在人造丝心蛋白以溶解状态在细胞内进行表达的情况下,在培养结束后,通过离心分离回收宿主细胞,使其悬浮于水系缓冲液中后,利用超声波破碎机、弗氏压碎器、manton-gaulin高压匀浆器和戴诺研磨机(dyno-mill)等将宿主细胞破碎,得到无细胞提取液。从通过对该无细胞提取液进行离心分离而得到的上清液中,单独或组合使用蛋白质的分离纯化中通常使用的方法、即溶剂提取法、利用硫酸铵等的盐析法、脱盐法、利用有机溶剂的沉淀法、使用二乙氨基乙基(deae)-琼脂糖、diaion hpa-75(三菱化成公司制)等树脂的阴离子交换层析法、使用s-sepharose ff(pharmacia公司制)等树脂的阳离子交换层析法、使用丁基琼脂糖、苯基琼脂糖等树脂的疏水性层析法、使用分子筛的凝胶过滤法、亲和层析法、色谱聚焦法、等电点电泳等电泳法等方法,能够得到纯化制备品。
[0464]
作为上述层析,优选采用使用了phenyl-toyopearl(东曹)、deae-toyopearl(东曹)、sephadex g-150(pharmacia biotech)的柱层析。
[0465]
此外,在人造丝心蛋白在细胞内形成不溶体而进行表达的情况下,同样在回收宿主细胞后将其破碎并进行离心分离,由此以沉淀级分的形式回收人造丝心蛋白的不溶体。回收的人造丝心蛋白的不溶体可以利用蛋白变性剂进行可溶化。该操作后,利用与上述同样的分离纯化法能够得到人造丝心蛋白的纯化制备品。
[0466]
在人造丝心蛋白或在人造丝心蛋白上附加有糖链的衍生物被分泌到细胞外的情况下,可以从培养上清中回收人造丝心蛋白或其衍生物。即,通过离心分离等方法对培养物进行处理,由此获得培养上清,通过使用与上述同样的分离纯化法,能够从该培养上清中得到纯化制备品。
[0467]
(第二链段)
[0468]
上述第二链段,包含对上述多肽骨架具有增塑功能的分子基团。所谓对多肽骨架具有增塑功能的分子基团,是指该分子基团之间的分子间作用力比多肽骨架之间的分子间作用力小,当将两者混合的情况下,与多肽骨架单体相比,更能够提高材料的柔性的分子基团。此外,所谓对多肽骨架具有增塑功能的分子基团,也可以说是熔点或玻璃化转变温度比多肽骨架低的分子基团。作为这样的分子基团,例如,可以列举出后述的聚醚等。另外,所谓增塑功能,也可以说是提高柔性的功能、或者提高弯曲或拉伸时的断裂伸长率的功能。此外,对多肽骨架具有增塑功能的分子基团优选使用具有生物降解性的分子基团、或者是生物质来源的分子基团。由此,可以充分期待其作为合成高分子(成型材料)整体具有生物降解性,进而可以实现合成高分子(成型材料)的生产能量的降低。
[0469]
上述第二链段可以包含多个上述分子基团。而且,上述第二链段包含多个上述分子基团,并且多个上述分子基团也可以彼此连接。此外,上述分子基团之间的连接也可以在
一部分中具有支链。由于上述连接在一部分中具有支链,因此第二链段可以具有由多个上述分子基团形成的支链结构,也可以在每个支链上与第一链段形成多个键。即,可以通过在上述连接的一部分中导入支链,来形成第一链段和第二链段的网络结构。如此一来,第二链段包含多个上述分子基团,这些分子基团相互连接,从而可以进一步扩大第二链段的设计范围,例如,可以更容易地调整合成高分子的柔性。另外,在第二链段仅含有一个上述分子基团的情况下,也可以使多个第二链段之间相互连接,并且也可以将这些多个第二链段中的至少一个与第一链段结合。或者,也可以将多个第二链段与一个第一链段结合。另外,在多个第二链段之间相互连接的情况下,也可以通过在多个第二链段之间的连接的一部分中导入支链,来形成第二链段的网络。
[0470]
第二链段例如可以包含来源于选自由聚醚、聚酯、聚碳酸酯、聚酰胺、多元醇(聚乙烯醇等)、聚烯烃、聚缩醛、聚缩酮、聚(甲基)丙烯酸酯、硅酮、聚氨酯、聚亚烷基亚胺、酚醛树脂、尿素树脂、三聚氰胺树脂和多糖类构成的组中的至少一种的骨架;优选地,也可以包含选自由聚醚基、聚酯基、聚碳酸酯基、聚酰胺基、多元醇基(聚乙烯醇基等)和改性多糖基构成的组中的至少一种官能团;还可以包含选自由醚基、酯基、碳酸酯基、酰胺基和改性多糖基构成的组中的至少一种官能团。第二链段例如可以包含选自由具有醚键、酯键、碳酸酯键(碳酸酯键)、酰胺基、硅氧烷键、氨基甲酸酯键、氨基甲酸酯键或脲键的结构单元构成的组中的至少一种结构单元;也可以说包含选自由具有亚烷基、取代亚烷基、氧亚甲基、亚烷基亚胺基、或者改性多糖基的结构单元构成的组中的至少一种结构单元。
[0471]
作为聚醚基,例如可以列举出来源于聚乙二醇、聚丙二醇、环氧乙烷/环氧丙烷共聚物和聚丁二醇等聚亚烷基二醇类的官能团。另外,当这些聚醚基包含在第二链段中的情况下,聚醚基根据需要也可以与包含在第二链段中的后述连接体所具有的酯基或硫酯基、酰胺基中的杂元素(o,n,s)直接连接。或者,聚醚基也可以与包含在第一链段中的多肽骨架所具有的酯基或硫酯基、酰胺基中的杂元素(o,n,s)直接连接。在这种情况下,整个聚醚基可以很容易地从连接体或第一链段分离,从而可以提高聚醚基的生物降解速率。
[0472]
作为聚酯基,例如可以列举出来源于聚乳酸、聚(3-羟基丁酸)、聚羟基丁酸/羟基戊酸共聚物、聚羟基丁酸/4-羟基丁酸共聚物、聚羟基丁酸/羟基己酸共聚物、聚对苯二甲酸丙二醇酯、丁二醇/长链二羧酸共聚物、聚对苯二甲酸乙二醇酯、聚丁二酸丁二醇酯、聚丁二酸丁二醇酯-己二酸酯共聚物、聚己二酸丁二醇酯-对苯二甲酸共聚物、聚己内酯和聚三甲基呋喃二甲酸酯(poly(trimethylene furandicarboxylate);ptf)等聚酯类的官能团。在上述聚酯类中,聚酯基优选为来源于聚己内酯等生物质塑料或生物降解性塑料的官能团。
[0473]
作为聚碳酸酯基,例如,可以列举出来源于1,6-己二醇聚碳酸酯、1,5-戊二醇聚碳酸酯和1,10-癸二醇碳酸酯等的以脂肪族烃链作为主骨架的聚碳酸酯类的官能团。
[0474]
作为聚酰胺基,例如,可以列举出来源于尼龙3、尼龙4、尼龙5、尼龙6、尼龙11和尼龙610等聚酰胺类的官能团。在上述聚酰胺类中,聚酰胺基优选为来源于生物质塑料或生物降解性塑料的官能团。
[0475]
作为多元醇基(聚乙烯醇基等),例如,可以列举出来源于聚乙烯醇、乙烯-乙烯醇共聚物等多元醇类(聚乙烯醇类等)的官能团。在上述多元醇类中,多元醇基优选为来源于生物质塑料或生物降解性塑料的官能团。
[0476]
作为改性多糖基,例如,可以列举出来源于对纤维素、淀粉、壳多糖和壳聚糖等进行了化学修饰的化合物的官能团。上述进行了化学修饰的化合物例如可以列举出醋酸纤维素、乙基纤维素、醋酸淀粉、羟丙基淀粉、羧甲基壳多糖和羧甲基壳聚糖等。
[0477]
除了对上述多肽骨架具有增塑功能的分子基团之外,第二链段还可以包含连接体(反应性官能团)。在这种情况下,上述分子基团和上述多肽骨架可以经由上述连接体结合。连接体例如可以包含选自由下述式(1)表示的结构单元、下述通式(2a)~(6)表示的结构单元、下述式(7)表示的结构单元、下述通式(8a)~(9)表示的结构单元、下述通式(10)~(11b)表示的结构单元和下述通式(13)~(16)表示的结构单元构成的组中的至少一种;也可以包含选自由下述式(1)表示的结构单元、下述通式(2a)~(6)表示的结构单元、下述式(7)表示的结构单元和下述通式(8a)~(9)表示的结构单元构成的组中的至少一种;从提高生物降解性的观点出发,优选地包含选自由下述式(1)表示的结构单元、以及下述通式(2a)、(3a)、(4a)、(4b)和(10)表示的结构单元构成的组中的至少一种。连接体可以包含多个上述结构单元。即,连接体可以仅由上述结构单元构成,也可以具有多个上述结构单元(多个上述结构单元可以与连接体的主体部共价键)优选地,连接体的主体部的分子量较小。当连接体具有3个以上的上述结构单元的情况下,例如,3个第一链段可以与1个第二链段结合,通过这样的选择,也可以在上述合成高分子中导入网络结构。此外,也可以通过选择用于上述合成高分子的制备的原料(通过调整具有多肽骨架的化合物、以及包含对该多肽骨架具有增塑功能的分子基团的化合物的官能团),来制成多个第二链段中的一部分相互结合的合成高分子。当连接体具有多个上述结构单元的情况下,可以是多个结构单元中的至少一个与上述多肽骨架结合,至少一个与上述分子基团结合的结构。当连接体仅仅由上述结构单元构成的情况下,在表示连接体的结构单元的表达式中记载的两个键中的一个与肽骨架结合,另一个与上述分子基团结合。例如,当上述连接体由下述式(1)表示时,优选地,上述分子基团与氮(n)结合,另一个与多肽骨架结合。当连接体具有多个上述结构单元的情况下,例如,在下述式(1)表示的结构单元的情况下,优选地,氮(n)与连接体的主体部结合,另一个与上述多肽骨架和上述分子基团结合。
[0478]
[化学式60]
[0479][0480]
[化学式61]
[0481][0482]
[化学式62]
[0483][0484]
[化学式63]
[0485][0486]
[化学式64]
[0487][0488]
[化学式65]
[0489][0490]
[化学式66]
[0491][0492]
[化学式67]
[0493][0494]
[化学式68]
[0495][0496]
[化学式69]
[0497][0498]
[化学式70]
[0499][0500]
[化学式71]
[0501][0502]
[化学式72]
[0503]
[0504]
[化学式73]
[0505][0506]
[化学式74]
[0507][0508]
[化学式75]
[0509][0510]
[化学式76]
[0511][0512]
[化学式77]
[0513][0514]
[化学式78]
[0515][0516]
在上述通式(2a)、(2b)、(3a)、(4a)、(4b)、(5)、(6)、(10)、(11a)及(11b)中,y相互独立地表示氧原子、硫原子或nr1。在上述nr1中,r1表示氢、烃基、芳香族基、羰基及磺酰基。在上述通式(2a)、(2b)、(3a)、(4a)、(4b)、(8a)、(8b)、(9)、(10)、(11a)及(11b)中,r相互独立地表示氢、烃基和芳香族基。
[0517]
第二链段的分子量(对多肽骨架具有增塑功能的分子基团)例如为200~500000、300~400000、350~350000、400~300000、500~200000、600~1000000、700~50000、800~10000、900~7500或100~5000。这是因为,当第二链段的分子量的分子量为小于200的低值的情况下,具有增塑功能的上述分子基团很难在分子的三维结构中产生定域性,因此,为了发挥一定水平的功能而不得不导入的具有增塑功能的分子基团的重量比不得不提高到必要以上。其结果是,有可能不得不延长合成高分子在制备过程中的反应时间、或提高必要的反应温度。另一方面,当第二链段的分子量的分子量超过500000的情况下,分子量变得过大,第二链段与第一链段的结合反应性有可能会降低。另外,上述第二链段的分子量为重均分子量,通常通过使用gpc的公知的方法来求出。
[0518]
相对于第一链段的分子量(多肽骨架),第二链段(对多肽骨架具有增塑功能的分子基团)的分子量可以根据合成高分子的用途等来适当调整。以将第一链段的分子量设为100为基准,,第二链段的分子量(当2个以上的第二链段与1个第一链段结合的情况下,总分子量)例如优选为1~10000,更优选为1.5~9000,进一步优选为2~8000,更进一步优选为3
~7000,再进一步优选为5~5000,更进一步优选为7~3000,再进一步优选为10~2000。当第二链段的分子量与第一链段的分子量的比率小于1时,则在使用合成高分子(成型材料)得到的成型体中可塑性(柔性)可能不充分;另一方面,当超过10000,则可塑性过高,并且成型体的刚性可能会降低。在上述范围内,可以制备柔性更优异的成型体。此外,当将第一链段的分子量或第一链段中包含的多肽骨架的分子量设为100时(优选地将第一链段中包含的多肽骨架的分子量设为100时),第二链段的分子量和对多肽骨架具有增塑功能的分子基团的分子量例如可以为1.4以上、1.5以上、1.6以上、1.7以上、1.8以上、1.9以上、2.0以上、5.0以上、10以上、20以上、30以上、40以上。另外,其上限值并没有特别限定,例如,可以为100以下、80以下、70以下、60以下、50以下。进一步地,当将第一链段的分子量设为100时,第二链段的分子量优选为1~70的范围内,更优选为1.5~60,进一步优选为1.5~50,特别优选为2.0~50。当第一链段(多肽骨架)的分子量与第二链段(对多肽骨架具有增塑功能的分子基团)的分子量之比为上述范围内的值的情况下,例如,在使用合成高分子而得到的成型体中,在充分保持因具有多肽骨架而引起的第一链段的特性(例如,高机械强度)的同时,有望提高合成高分子整体的柔性、或者拉伸性等。另外,上述的当将第一链段的分子量设为100时,第二链段的分子量的比率是通过重均分子量来求出的。
[0519]
第一链段(多肽骨架)和第二链段(具有增塑功能的分子基团)在合成高分子中的含量比可以根据合成高分子的用途等来适当调整。关于含量比,以质量比计,当将第二链段的设为100时,第一链段例如可以为50以上、60以上、70以上、80以上、90以上、100以上、110以上、150以上、200以上、250以上、300以上、300以上、400以上、450以上、500以上、550以上、600以上。相关值的上限值并没有特别限定,可以为1000以下、900以下、800以下、700以下。通过将第一链段和第二链段在合成高分子中的含量比设为上述范围内的值,可以抑制第二链段的浪费使用,并且可以抑制合成高分子的制造成本。另外,在合成高分子中,第二链段与第一链段的含量比的降低,例如可以通过降低第一链段的分子量等来有利地实现。
[0520]
在上述实施方式的说明中,将连接体作为第二链段的构成要素进行了说明,但也可以与第二链段分开处理。此外,也可以将连接体作为第一链段的构成要素来处理。另外,连接体部的分子量比上述多肽骨架和上述分子基团小,但在将连接体与第二链段分开处理的情况下,上述第二链段的分子量将减去连接体部的分子量后得到的范围作为第二链段的分子量的优选范围来处理。同样地,当将连接体部作为第一链段的构成要素来处理的情况下,上述第一链段的分子量将加上连接体部的分子量后得到的范围作为第一链段的分子量的优选范围来处理。
[0521]
[成型材料和成型体]
[0522]
成型材料的一个实施方式含有上述合成高分子。由于上述成型材料含有上述合成高分子,因此可以制备柔性优异的成型体。成型材料除了上述合成高分子以外,还可以包含其他成分。作为其他成分,例如,可以列举出聚酯、聚酰胺、多糖类等通用高分子或无机盐类等。当成型材料包含其他成分的情况下,以成型材料的总量为基准,上述合成高分子的含量例如可以为70质量%以上、80质量%以上或90质量%以上。
[0523]
成型体的一个实施方式含有上述合成高分子。由于上述成型体含有上述合成高分子,因此柔性优异。
[0524]
[合成高分子的制备方法]
[0525]
上述合成高分子例如可以通过利用用于构成多肽骨架的半胱氨酸硫醇基(也称为巯基或氢硫基)与马来酰亚胺或马来酸衍生物的碳-碳双键的1,4-加成反应来生成硫醚键,并通过将上述分子基团所具有的官能团(例如,选自由聚醚基、聚酯基、聚碳酸酯基、聚酰胺基、多元醇基和改性多糖基构成的组中的至少一种官能团)导入第一链段中来进行制备。上述合成高分子也可以应用上述制备方法的一例,例如,通过利用上述马来酰亚胺基的1,4-加成反应形成硫醚键来进行制备;其中,该加成反应是使包含具有半胱氨酸的多肽骨架的化合物、包含对该多肽骨架具有增塑功能的分子基团且具有硫醇基的化合物与具有2个以上马来酰亚胺基的化合物进行反应。此外,上述合成高分子还可以通过利用例如与环氧基或异氰酸酯基的加成反应、与α-卤代羰基的取代反应、炔基与叠氮基之间的huisgen环化反应来进行制备。
[0526]
更一般地,合成高分子的制备方法的一个实施方式具备:通过使包含多肽骨架的化合物与下述通式(1a)~(16a)表示的化合物中的至少1种反应来得到合成高分子的工序。上述工序可以是通过使包含多肽骨架的化合物与下述通式(1a)~(12a)表示的化合物反应来得到合成高分子的工序。上述多肽骨架具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基,酰胺基、叠氮基和炔基构成的组中的至少一种,优选具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基和酰胺基构成的组中的至少一种。包括多肽骨架的化合物与下述通式(1a)~(12a)或(14a)表示的化合物之间的反应为可以迈克尔加成反应。
[0527]
[化学式79]
[0528][0529]
[化学式80]
[0530][0531]
[化学式81]
[0532][0533]
[化学式82]
[0534][0535]
[化学式83]
[0536][0537]
[化学式84]
[0538][0539]
[化学式85]
[0540][0541]
[化学式86]
[0542][0543]
[化学式87]
[0544][0545]
[化学式88]
[0546][0547]
[化学式89]
[0548][0549]
[化学式90]
[0550][0551]
[化学式91]
[0552][0553]
[化学式92]
[0554][0555]
[化学式93]
[0556][0557]
[化学式94]
[0558]
z-r2ꢀꢀ
(12a)
[0559]
[化学式95]
[0560]
ocn-r2ꢀꢀ
(13a)
[0561]
[化学式96]
[0562][0563]
[化学式97]
[0564][0565]
[化学式98]
[0566]n3-r2ꢀꢀ
(16a)
[0567]
在上述通式(1a)、(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(6a)、(7a)、(8a)、(8b)、(9a)、(10a)、(11a)、(11b)及(12a)中,r2表示对上述多肽骨架具有增塑功能的分子基团。作为对上述多肽骨架具有增塑功能的分子基团,可以使用在对上述合成高分子的说明中例示的分子基团。
[0568]
在上述通式(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(6a)、(8b)、(9a)、(10a)、(11a)及(11b)中,y相互独立地表示氧原子、硫原子或nr1。在上述nr1中,r1表示氢、烃基、芳香族基、羰基及磺酰基;在上述通式(2a)、(2b)、(3a)、(3b)、(4a)、(5a)、(8a)、(8b)、(9a)、(10a)、(11a)及(11b)中,r相互独立地表示氢、烃基和芳香族基。在上述通式(6a)及(12a)中,z表示卤原子、磺酸酯基及含氟羧酸酯基。在上述通式(15a)中,x表示卤原子。
[0569]
相对于具有多肽骨架的一个化合物(一个第一链段)来导入的对多肽骨架具有增塑功能的分子基团(第二链段)的数量为来源于用于构成多肽骨架的氨基酸序列的硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基、酰胺基、叠氮基和炔基(优选为硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基和酰胺基)的官能团总数以下,例如,可以为1个以上、2个以上或4个以上,也可以为30个以下、25个以下、20个以下、15个以下、10个以下、或8个以下。相对于具有多肽骨架的一个化合物(一个第一链段)来导入的对多肽骨架具有增塑功能的分子基团(第二链段)的数量可以在上述范围内调整,例如,可以为1~30、1~25、1~20、1~15、1~10、1~8或2~8。
[0570]
在合成高分子的制备方法中,例如,可以在溶剂中混合具有多肽骨架的化合物和通式(1a)~(16a)表示的化合物中的至少1种(优选通式(1a)~(12a)表示的化合物)。此外,当反应难以进行的情况下,也可以进行酸、碱基的添加和加热等。反应温度通常为0~150℃,例如可以为50~150℃、70~120℃或90~100℃,也可以为10~110℃、20~100℃或25~90℃。所使用的溶剂只要是能够溶解具有多肽骨架的化合物和通式(1a)~(16a)表示的化合物、并且不阻碍所期望的反应的溶剂即可。作为这样的溶剂,可以列举出六氟异丙醇(hfip)、二甲基亚砜(dmso)、二甲基甲酰胺(dmf)、二甲基乙酰胺(dma)、乙酸、甲酸等。
[0571]
通过上述反应得到的产物(包含合成高分子的粗产物)例如可以通过再沉淀、正相柱色谱、反相柱色谱、尺寸排阻色谱、溶剂洗涤等进行纯化。
[0572]
上述合成高分子的制备方法的一个实施方式具备:通过使包含多肽骨架的化合物、对所述多肽骨架具有增塑功能且包含分子基团的化合物、与具有2个以上的选自由下述通式(2-1a)~(2-16a)表示的结构单元构成的组中的至少一种结构单元的化合物反应来获得合成高分子的工序。上述工序可以是通过使包含多肽骨架的化合物、包含对上述多肽骨架具有增塑功能的分子基团的化合物、与具有2个以上选自由下述通式(2-1a)~(2-12a)表示的结构单元构成的组中的至少一种的官能团的化合物反应来得到合成高分子的工序。
[0573]
上述多肽骨架具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基,酰胺基、叠氮基和炔基构成的组中的至少一种,优选具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基和酰胺基构成的组中的至少一种。包含上述分子基团的化合物具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基,酰胺基、叠氮基和炔基构成的组中的至少一种,优选具有选自由硫醇基、氨基、羟基、胍基、羧基、苯氧基、吲哚基和酰胺基构成的组中的至少一种。多肽骨架所具有的官能团和包含上述分子基团的化合物所具有的官能团可以根据具有2个以上选自由通式(2-1a)~(2-16a)表示的结构单元构成的组中的至少一种官能团的化合物的官能团的种类来选择,可以相同也可以不同。当多肽骨架所具有的官能团与包含上述分子基团的化合物所具有的官能团不同的情况下,可以更容易地控制合成高分子的分子结构。
[0574]
[化学式99]
[0575][0576]
[化学式100]
[0577][0578]
[化学式101]
[0579][0580]
[化学式102]
[0581][0582]
[化学式103]
[0583][0584]
[化学式104]
[0585][0586]
[化学式105]
[0587][0588]
[化学式106]
[0589]
[0590]
[化学式107]
[0591][0592]
[化学式108]
[0593][0594]
[化学式109]
[0595][0596]
[化学式110]
[0597][0598]
[化学式111]
[0599][0600]
[化学式112]
[0601][0602]
[化学式113]
[0603][0604]
[化学式114]
[0605][0606]
[化学式115]
[0607][0608]
[化学式116]
[0609][0610]
[化学式117]
[0611][0612]
[化学式118]
[0613][0614]
在上述通式(2-2a)、(2-2b)、(2-3a)、(2-3b)、(2-4a)、(2-5a)、(2-6a)、(2-10a)、
(2-11a)、及(2-11b)中,y相互独立地表示氧原子、硫原子或nr1。r1表示氢、烃基、芳香族基、羰基及磺酰基。在上述通式(2-2a)、(2-2b)、(2-3a)、(2-3b)、(2-4a)、(2-8a)、(2-8b)、(2-9a)、(2-10a)、(2-11a)、(2-11b)、及(2-12a)中,r相互独立地表示氢、烃基和芳香族基。在上述通式(2-6a)及(2-12a)中,z表示卤原子、磺酸酯基及含氟羧酸酯基。在上述通式(2-15a)中,x表示卤原子。
[0615]
包含多肽骨架的化合物、包含对上述多肽骨架具有增塑功能的分子基团的化合物与上述具有2个以上特定官能团的化合物之间的反应例如可以为迈克尔加成反应等。
[0616]
在本实施方式所涉及的合成高分子的制备方法中,将使包含具有特定官能团的多肽骨架的化合物与对多肽骨架具有增塑功能且包含具有特定官能团的分子基团的化合物进行反应的官能团作为具有2个以上特定结构单元的化合物进行拆分。通过采取这样的制备方法,可以不在包含具有特定官能团的多肽骨架的化合物与对多肽骨架具有增塑功能且包含具有特定官能团的分子基团的化合物之间进行反应的情况下制备反应溶液。由于即使混合也不会进行反应,因此,例如,在其达到充分均匀的状态之前,可能需要一些时间。在制备均匀的反应溶液后,调配具有2个以上特定结构单元的化合物后开始反应,从而可以更容易地控制反应体系,并且可以制备更加均匀的合成高分子。当根据多肽骨架或分子基团的种类而导致其在溶剂等中的溶解性低时,这种方法特别有用。
[0617]
以上,对几个优选实施方式进行了说明,但本公开并不限定于上述实施方式。此外,上述实施方式的说明内容可以相互应用。
[0618]
实施例
[0619]
下面,将基于实施例等更具体地说明本公开。但是,本公开并不限于以下实施例。
[0620]
〔人造丝心蛋白的制造〕
[0621]
(1)表达载体的制备
[0622]
设计了具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白、具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白、以及具有序列号63所示的氨基酸序列(prt18)的人造丝心蛋白。另外,具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白的平均亲水指数的值为0.44,具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白的平均亲水指数的值为0.45,具有序列号63所示的氨基酸序列(prt18)的人造丝心蛋白的平均亲水指数的值为0.46。
[0623]
相对于序列号72所示的氨基酸序列(prt27),序列号62所示的氨基酸序列(prt17)为在分别位于从结构域序列的n末端侧和c末端侧起第1个位置处的rep中,分别各插入有1处半胱氨酸残基的序列。具有序列号62所示的氨基酸序列的人造丝心蛋白的半胱氨酸残基的总数为2。相对于序列号72所示的氨基酸序列(prt27),序列号63所示的氨基酸序列(prt18)为在分别位于从结构域序列的n末端侧和c末端侧起第1~2个位置处的rep中,分别各插入有1处半胱氨酸残基的序列。具有序列号63所示的氨基酸序列的人造丝心蛋白的半胱氨酸残基的总数为4。
[0624]
分别合成了对具有序列号62、序列号63和序列号72所示的氨基酸序列的人造丝心蛋白进行编码的核酸。该核酸中,在5'末端附加有ndei位点、在终止密码子下游附加有ecori位点。将该核酸克隆至克隆载体(puc118)中。然后,利用ndei和ecori对该核酸进行限制酶处理并将其切出后,重组到蛋白质表达载体pet-22b(+)中,得到表达载体。
[0625]
(2)蛋白质的制造
[0626]
用得到的表达载体转化大肠杆菌blr(de3)。将该转化的大肠杆菌在含有氨苄西林的2ml lb培养基中培养15小时。将该培养液添加到含有氨苄西林的100ml的种子培养用培养基(表4)中,以使od
600
达到0.005。将培养液温度保持在30℃,进行烧瓶培养直至od
600
达到5为止(约15小时),得到种子培养液。
[0627]
[表4]
[0628]
种子培养用培养基
[0629][0630]
将该种子培养液添加到加有500ml生产培养基(表5)的发酵罐中,以使od
600
达到0.05。将培养液温度保持在37℃,将ph值恒定控制在6.9下进行培养。此外,将培养液中的溶解氧浓度维持于溶解氧饱和浓度的20%。
[0631]
[表5]
[0632]
生产培养基
[0633][0634]
在生产培养基中的葡萄糖完全消耗后,立即以1ml/分钟的速度添加进料液(葡萄糖455g/1l、酵母提取物120g/1l)。将培养液温度保持在37℃,将ph值恒定控制在6.9下进行培养。此外,将培养液中的溶解氧浓度维持在溶解氧饱和浓度的20%,培养20小时。然后,向培养液中添加1m的异丙基-β-硫代半乳糖吡喃糖苷(iptg)以使其最终浓度为1mm,并表达诱导人造丝心蛋白。在添加iptg后经过20小时的时间点,对培养液进行离心分离,回收菌体。使用由添加iptg前和添加iptg后的培养液制备的菌体进行sds-page,根据依赖于iptg添加的目标人造丝心蛋白尺寸的条带的出现,确认到目标人造丝心蛋白的表达。
[0635]
(3)蛋白质的纯化
[0636]
将添加iptg后经过2小时回收的菌体用20mm tris-hcl buffer(ph7.4)进行洗涤。将洗涤后的菌体悬浮在含有约1mm的pmsf的20mm tris-hcl缓冲液(ph7.4)中,用高压均质器(gea niro soavi公司制)来破碎细胞。对破碎后的细胞进行离心分离,得到沉淀物。将得到的沉淀物用20mm tris-hcl缓冲液(ph7.4)洗涤,直至达到高纯度为止。将洗涤后的沉淀物以达到100mg/ml浓度的方式悬浊在8m胍缓冲液(8m胍盐酸盐、10mm磷酸二氢钠、20mm nacl、1mm tris-hcl、ph7.0)中,在60℃下用搅拌器搅拌30分钟,使其溶解。溶解后,使用透
析管(三光纯药株式会社制造的纤维素管36/32)用水进行透析。通过离心分离来回收透析后得到的白色凝聚蛋白质,用冷冻干燥机除去水分,通过回收冻干粉,而获得粉末状的人造丝心蛋白(prt17、prt18、prt27)。确认插入半胱氨酸残基的人造丝心蛋白在分子间形成有二硫键。确认在人造丝心蛋白中,相对于单体100质量份,其包含二聚体13.8质量份、三聚体2.1质量份、四聚体0.8质量份。通过sds-page来测量二硫键的形成。
[0637]
(实施例1)
[0638]
使用数均分子量:5000的甲氧基聚乙二醇马来酰亚胺(西格玛奥德里奇公司制造:第二链段)来制备合成高分子。具体而言,在玻璃容器中称取如上所述那样制备的具有序列号63所示的氨基酸序列(prt18)的且数均分子量:50000的人造丝心蛋白(第一链段)2500mg、以及上述甲氧基聚乙二醇马来酰亚胺500mg后,再加入六氟异丙醇(中央硝子株式会社制造,hfip)50ml作为溶剂,进行搅拌,使人造丝心蛋白等进行溶解来得到反应溶液。然后,在室温(25℃)下搅拌反应溶液20小时,以进行反应。
[0639]
经过20小时后,馏去溶剂,将粗产物用甲醇(nacalai tesque株式会社制造)洗涤3次。一次洗涤使用甲醇50ml。通过洗涤操作,除去甲氧基聚乙二醇马来酰亚胺等未反应物。洗涤操作后,通过进行减压干燥,得到产物(合成高分子)。通过对产物的sds-page检测,确认分子量的增大,并确认在人造丝心蛋白中导入了聚乙二醇链。确认得到的合成高分子为1~4个第二链段与一个第一链段结合的高分子。图6表示sds-page的结果。在图6中,泳道1和7为用于确定分子量的标准样品,2和3为具有序列号63所示的氨基酸序列(prt18)的人造丝心蛋白,4为实施例1中制备的上述合成高分子。
[0640]
(实施例2)
[0641]
除了使用数均分子量为10000的甲氧基聚乙二醇马来酰亚胺(西格玛奥德里奇公司制造)、将甲氧基聚乙二醇马来酰亚胺的调配量设为20mg、将人造丝心蛋白设为50mg、加入1ml六氟异丙醇(中央硝子株式会社制造,hfip)以作为溶剂、以及使用甲醇1ml对粗产物进行一次洗涤以外,其他以与实施例1同样的方式来制备合成高分子。通过对产物的sds-page检测,确认分子量的增大,并确认在人造丝心蛋白中导入了聚乙二醇链。确认得到的合成高分子为1~4个第二链段与一个第一链段结合的高分子。在图6中,泳道5为实施例2中制备的上述构成高分子。
[0642]
(实施例3)
[0643]
除了使用数均分子量为750的甲氧基聚乙二醇马来酰亚胺(西格玛奥德里奇公司制造)和将甲氧基聚乙二醇马来酰亚胺的调配量设为1.5mg以外,其他以与实施例2同样的方式来制备合成高分子。通过对产物的sds-page检测,确认分子量的增大,并确认在人造丝心蛋白中导入了聚乙二醇链。确认得到的合成高分子为1~4个第二链段与一个第一链段结合的高分子。在图6中,泳道6为实施例3中制备的上述构成高分子。
[0644]
(比较例1)
[0645]
为了比较,使用不具有半胱氨酸的人造丝心蛋白进行同样的实验。即,在玻璃容器中称取如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)20mg、以及数均分子量:5000的甲氧基聚乙二醇马来酰亚胺(西格玛奥德里奇公司制造)4mg后,再加入六氟异丙醇(中央硝子株式会社制造,hfip)1ml作为溶剂,进行搅拌,使人造丝心蛋白等进行溶解来得到反应溶液。然后,在室温(25℃)下搅拌反应溶液
20小时,以进行反应。
[0646]
经过20小时后,馏去溶剂,将粗产物用甲醇(nacalai tesque株式会社制造)洗涤3次。一次洗涤使用甲醇1ml。通过洗涤操作,除去甲氧基聚乙二醇马来酰亚胺等未反应物。洗涤操作后,通过进行减压干燥,得到产物。通过对产物的sds-page检测,确认分子量没有变化,并确认人造丝心蛋白与甲氧基聚乙二醇马来酰亚胺之间没有反应。图7表示sds-page的结果。在图7中,泳道1为用于确定分子量的标准样品,泳道6为产物,泳道7为具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白。
[0647]
(比较例2)
[0648]
制备如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)和聚环氧乙烷的混合物。具体而言,在容器中调配上述人造丝心蛋白10g和以上述人造丝心蛋白总量为100质量%计其重量为5质量%的聚环氧乙烷(数均分子量:4000),使用珠磨机(日本焦化工业株式会社制造,attritor),在转速:1000次/分钟的条件干式混合10分钟后,制备混合物。
[0649]
(比较例3)
[0650]
除了使用数均分子量为20000的聚环氧乙烷作为聚环氧乙烷以外,其他以与比较例2同样的方式来制备混合物。
[0651]
(比较例4)
[0652]
制备如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)和聚环氧乙烷单硬脂酸酯(40e.o.、数均分子量:2044)的混合物。以人造丝心蛋白总量为100质量%计,调配聚环氧乙烷单硬脂酸酯以使其重量为10质量%,在乙醇(99.5%)中混合15小时,并在60℃的烘箱中干燥5小时,制备混合物。
[0653]
《成型体的评价》
[0654]
使用实施例1~3中制备的合成高分子、以及比较例2、3和4中制备的混合物,分别在以下条件下通过加热加压成型来制备成型体。成型使用图8所示的加压成型机10。图8是加压成型机的示意性剖视图。图8所示的加压成型机10具备:形成有贯通孔且能够加热的模具2、以及能够在模具2的贯通孔内上下移动的上侧销4和下侧销6;将样品导入通过将上侧销4或下侧销6插入到模具2中而产生的空隙中,对模具2进行加热的同时,用上侧销4和下侧销6压缩组合物,从而能够得到成型体。
[0655]
使用图9来说明得到成型体的工序。图9(a)是组合物导入前的加压成型机的示意性剖视图,(b)是刚刚导入样品后的加压成型机的示意性剖视图,(c)是样品加热及加压状态下的加压成型机的示意性剖视图。如图9(a)所示,在仅仅将下侧销6插入模具2的贯通孔的状态下向贯通孔内导入组合物,如图9(b)所示,将上侧销4插入模具2的贯通孔后使其下降,开始对模具2进行加热,在贯通孔内对加热加压前的样品8a进行加热加压。使上侧销4下降直至达到预先设定的加压,在图9的(c)所示的状态下继续加热及加压直到样品达到预定温度,得到加热加压后的成型体8b。在某些情况下,也可以使用冷却器(例如,点式冷却器)来降低模具2的温度,在成型体8b达到预定温度时,从模具2中拔出上侧销4或下侧销6,以得到成型体。关于加压,也可以在固定下侧销6的状态下通过使上侧销4下降来实施,也可以实施上侧销4的下降和下侧销6的上升这两者。
[0656]
具体而言,首先,称取上述合成高分子或上述混合物0.6g,导入至图8所示的加压
成型机10的模具2(对于实施例1而言,使用具有直径:14mm的圆形贯通孔的圆柱形状的模具,对于比较例2、3及4而言,使用具有横截面为35mm
×
25mm的长方形贯通孔的圆柱形状的模具)的贯通孔内。此时,添加样品以使厚度均匀。在导入所有的样品后,开始对模具2进行加热的同时,使用手动压力机(npa system株式会社制造,商品名:nt-100h-v09),将上侧销4和下侧销6插入贯通孔内,从而对样品进行加压。此时,将样品的加压条件控制为50mpa。当样品温度达到150℃并经过5分钟后,停止加热并使用点式冷却器(trusco中山株式会社制,商品名:ts-25ep-1)冷却,当样品温度达到50℃时取出,去毛刺后,得到直径:14mm
×
厚度:3.0mm的圆盘状成型体(在比较例2、3和4中,为纵:35mm
×
横:25mm
×
厚度:3.0mm的长方体形状的成型体)。另外,成型中使用的上述成型材料和上述混合物的水分含量用加热干燥式水分计测量,结果均为7~9质量%。
[0657]
对于得到的成型体,进行外观的目视观察,以及用手指触摸观察渗出,并按照以下基准进行评价。结果如表6所示。此外,成型体的外观如图10、图11和图12所示。
[0658]
[外观的评价基准]
[0659]
a:均匀。
[0660]
b:均匀但浑浊。
[0661]
c:不均匀。
[0662]
[渗出的评价基准]
[0663]
a:没有粘腻感。
[0664]
b:刚刚成型时有发粘,但擦拭后没有发粘。
[0665]
c:即使擦拭仍然有发粘,或者再次发粘。
[0666]
[表6]
[0667] 外观渗出实施例1aa实施例2a-实施例3a-比较例2ba比较例3ca比较例4bc
[0668]
在表6中,
“‑”
表示没有进行测量。从表6、图10、图11、图12所示的结果可以确认,由于第一链段和第二链段直接结合,因此在实施例1~3中没有确认到相分离等。另一方面,确认人造丝心蛋白和柔性高分子的混合物在比较例1~4中发生了相分离和渗出。
[0669]
(实施例4)
[0670]
对实施例1中制备的合成高分子、以及包含如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)的薄膜进行成型。具体而言,在容器中称取二甲基亚砜4.4g,向其中称取上述人造丝心蛋白0.15g,在氮气下,120℃的条件下搅拌15分钟,以使上述人造丝心蛋白溶解。进一步加入上述人造丝心蛋白0.15,在氮气下,120℃的条件下搅拌30分钟,制备总共溶解了0.30g的上述人造丝心蛋白的溶液。在上述溶液中,称取上述合成高分子0.15g,在氮气下,90℃的条件下搅拌15分钟,以使上述合成高分子溶解。进一步加入上述合成高分子0.15g,在氮气下,90℃的条件下搅拌30分钟,从
而制备分别溶解上述人造丝心蛋白和上述合成高分子各0.30g的纺丝原液。在纺丝原液中,调整混合比以使合成高分子:人造丝心蛋白:二甲基亚砜为6质量%:6质量%:88质量%。
[0671]
将上述纺丝原液在80℃下静置30分钟,以使其脱泡。使用涂布机(株式会社井元制作所制造),通过脱泡后的纺丝原液来成型薄膜。首先,将pet薄膜(150mm
×
200mm)设置在涂布机上作为脱模部件,在涂布器厚度为0.5mm、涂布速度为20m/分钟的条件下,并在40℃的温度条件下将纺丝原液的液膜设置成上述pet薄膜状。然后,将纺丝原液的液膜与pet薄膜一起静置在鼓风烘箱内,在100℃的条件下干燥15分钟,再转移到真空烘箱中,在80℃的条件下真空干燥15小时,使其绝对干燥,由此制备由合成高分子和人造丝心蛋白构成的薄膜状成型体(薄膜)。
[0672]
确认所制备的薄膜无色透明,并且具有柔性。确认了该薄膜即使在施加弯曲应力的情况下也不会产生裂纹。
[0673]
(实施例5)
[0674]
在茄形烧瓶内,将如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000:第一链段)2300mg和数均分子量为20,000的聚乙二醇双马来酰亚胺(biochempeg scientific inc.制造,ho022022-20k:第二链段)900mg溶解于115ml的溶剂(dmso,岸田化学株式会社制造)中之后,加入三乙胺(nacalai tesque株式会社制造)12μl,在80℃下搅拌17小时的同时发生反应。加入乙酸乙酯(关东化学株式会社制造))300ml,再加入己烷(关东化学株式会社制造))300ml,静置2小时后,使产物沉淀。进一步进行离心(1000g
×
10分钟),除去上清液。为了除去未反应的聚乙二醇双马来酰亚胺,再次添加乙酸乙酯,并将离心、除去上清液重复3次。进而,通过减压干燥来得到产物。所制备的合成高分子具有以下结构:对具有聚乙二醇链的n-取代马来酰亚胺(相当于第二链段)结合在人造丝心蛋白(相当于第一链段)的分子链末端的嵌段进行多次重复。即,该合成高分子为按照第二链段、第一链段和第二链段的顺序结合有3个链段的分子。
[0675]
对包含如上所述那样制备的合成高分子的薄膜进行成型。具体而言,在容器中称取二甲基亚砜4.55g,向其中加入上述合成高分子0.45g,在氮气下、90℃的条件下搅拌30分钟,由此制备溶解有上述合成高分子的纺丝原液。搅拌速度设定为100rpm。在纺丝原液中,调整混合比以使合成高分子:二甲基亚砜为9质量%:91质量%。
[0676]
使用上述纺丝原液,以与实施例4同样的方式来制备薄膜状成型体(薄膜)。确认到所制备的薄膜无色透明,并且柔性比实施例4的薄膜更为优异。确认了该薄膜即使在施加弯曲应力的情况下也不会产生裂纹。
[0677]
(实施例6)
[0678]
在茄形烧瓶内,将如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000:第一链段)1424mg和数均分子量为20,000的甲氧基聚乙二醇马来酰亚胺(biochempeg scientific inc.制造,mf001022-20k:第二链段)1076mg溶解于71ml的溶剂(dmso,岸田化学株式会社制造)中之后,加入三乙胺(nacalai tesque株式会社制造)7.5μl,在80℃下搅拌17小时的同时发生反应。加入乙酸乙酯(关东化学株式会社制造))210ml,再加入己烷(关东化学株式会社制造))210ml,静置17小时后,使产物沉淀。进一步进行离心(1000g
×
10分钟),除去上清液。为了除去未反应的甲氧基聚乙二醇马来酰亚胺,再次添加乙酸乙酯,并将离心、除去上清液重复3次。进一步通过减压干燥得到合成高
分子。所制备的合成高分子具有以下结构:对具有聚乙二醇链的n-取代马来酰亚胺(相当于第二链段)结合在人造丝心蛋白(相当于第一链段)的分子链两末端。即,该合成高分子为按照第二链段、第一链段和第二链段的顺序结合有3个链段的分子。
[0679]
对包含如上所述那样制备的合成高分子的薄膜进行成型。具体而言,在容器中称取二甲基亚砜4.30g,向其中加入上述合成高分子0.70g,在氮气下、90℃的条件下搅拌30分钟,由此制备溶解有上述合成高分子的纺丝原液。搅拌速度设定为100rpm。在纺丝原液中,调整混合比以使合成高分子:二甲基亚砜为14质量%:86质量%。
[0680]
使用上述纺丝原液,以与实施例4同样的方式来制备薄膜状成型体(薄膜)。确认到所制备的薄膜无色透明,并且柔性比实施例4的薄膜更为优异。确认了该薄膜即使在施加弯曲应力的情况下也不会产生裂纹。
[0681]
(实施例7)
[0682]
通过使两末端具有马来酰亚胺基的聚乙二醇(biochempeg公司制造,数均分子量:20000)与具有2个半胱氨酸残基的人造丝心蛋白反应来制备合成高分子。具体而言,在茄形烧瓶中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)4.022g、两末端具有马来酰亚胺基的聚乙二醇1.564g和作为溶剂的二甲基亚砜201ml,在80℃下搅拌48小时,使其溶解并反应,从而得到合成高分子的溶液。在得到的溶液中加入乙酸乙酯603ml和己烷603ml,搅拌2小时,进行离心分离后,再用乙酸乙酯洗涤3次。然后,用蒸发器干燥,最后在室温下真空干燥,得到合成高分子的粉末。
[0683]
(实施例8)
[0684]
通过使两末端具有马来酰亚胺基的聚乙二醇(biochempeg公司制造,数均分子量:20000)与具有2个半胱氨酸残基的人造丝心蛋白反应,来制备合成高分子。具体而言,在不锈钢容器中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)348mg,并加入作为溶剂的二甲基亚砜2.11ml,进行搅拌使其溶解,从而得到丝心蛋白溶液。此外,在玻璃容器中称取两末端具有马来酰亚胺基的聚乙二醇132mg,并加入二甲基亚砜1.09ml作为溶剂,进行搅拌使其溶解,从而得到聚乙二醇溶液。将得到的丝心蛋白溶液和聚乙二醇溶液边搅拌边混合,在100℃下边搅拌边反应5分钟后,再在100℃下静置10分钟以使其发生反应,从而制备合成高分子。在实施例8中,保持将合成高分子溶解于二甲基亚砜中的状态,不进行干燥,以供后述的薄膜成型使用。
[0685]
(实施例9)
[0686]
通过使两末端具有马来酰亚胺基的聚乙二醇(biochempeg公司制造,数均分子量:20000)与具有2个半胱氨酸残基的人造丝心蛋白、和具有4个半胱氨酸残基的人造丝心蛋白反应来制备合成高分子。具体而言,在玻璃容器中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000,半胱氨酸残基总数为2)336mg、具有序列号63所示的氨基酸序列(prt18)的人造丝心蛋白(数均分子量:53100,半胱氨酸残基的总数为4)44mg、以及两末端具有马来酰亚胺基的聚乙二醇160mg,并加入二甲基亚砜4.42ml作为溶剂,边搅拌边使上述成分溶解,从而得到反应溶液。将得到的反应溶液在100℃下边搅拌边反应10分钟后,再在100℃下静置5分钟以使其发生反应,从而制备合成高分子。在实施例9中,保持将合成高分子溶解于二甲基亚砜中的状态,不进行干燥,以供后述的薄膜成型使用。
[0687]
(实施例10)
[0688]
通过使两末端具有马来酰亚胺基的聚乙二醇(biochempeg公司制造,数均分子量:20000)与具有2个硫醇基的2,2
’‑
(乙二基双氧代)双乙硫醇、和具有2个半胱氨酸残基的人造丝心蛋白反应来制备合成高分子。具体而言,在玻璃容器中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)300mg和两末端具有马来酰亚胺基的聚乙二醇284mg,并加入二甲基亚砜3.42ml作为溶剂,进行搅拌以使各成分溶解,从而得到反应溶液。将得到的反应溶液在100℃下搅拌15分钟并使其反应后,再加入2,2
’‑
(乙二基双氧代)双乙硫醇1.55mg,在100℃下搅拌10分钟以使其反应,从而制备合成高分子。在实施例10中,保持将合成高分子溶解于二甲基亚砜中的状态,不进行干燥,以供后述的薄膜成型使用。
[0689]
(实施例11)
[0690]
通过使两末端具有马来酰亚胺基的聚乙二醇(biochempeg公司制造,数均分子量:1000)、两末端具有半胱氨酸残基(即,在两末端具有硫醇基)的聚乙二醇(biochempeg公司制造,数均分子量:2000)与具有2个半胱氨酸残基的人造丝心蛋白反应来制备合成高分子。具体而言,在小瓶中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)378mg、两末端具有马来酰亚胺基的聚乙二醇79mg和两末端具有半胱氨酸残基的聚乙二醇143mg,并加入二甲基亚砜4.40ml作为溶剂,进行搅拌以使溶解,从而得到反应溶液。将反应溶液在100℃下边搅拌边反应10分钟后,再在100℃下静置10分钟以使其发生反应,从而制备合成高分子。在实施例11中,保持将合成高分子溶解于二甲基亚砜中的状态,不进行干燥,以供后述的薄膜成型使用。
[0691]
(比较例5)
[0692]
为了与实施例7~11中制备的合成高分子进行比较,使用如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(分子量:100000)进行了类似的操作。具体而言,在不锈钢容器中称取如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(分子量:100000)的粉末650mg,并加入作为溶剂的二甲基亚砜3.955ml,搅拌获分散液。将得到的分散液在120℃下搅拌30分钟并溶解后,再在100℃下静置10分钟。在比较例5中,保持将人造丝心蛋白溶解于二甲基亚砜中的状态,不进行干燥,以供后述的薄膜成型使用。
[0693]
《成型体的评价》
[0694]
使用实施例7~11中制备的合成高分子,在以下条件下制作薄膜状的成型体。对于实施例7中制备的合成高分子,首先,将合成高分子粉末530mg加入到的二甲基亚砜3.53ml中,并在90℃下搅拌40分钟以使上述粉末溶解,从而制此纺丝溶液;然后,在80℃下静置30分钟,并使其脱泡后,以供薄膜成型使用。将实施例8~11中制备的合成高分子溶解于二甲基亚砜中,并保持该状态,不进行干燥,作为纺丝溶液以供薄膜成型使用。此外,也同样地将比较例5中的人造丝心蛋白溶解于二甲基亚砜中,并保持该状态,不进行干燥,作为纺丝溶液以供薄膜成型使用。
[0695]
首先,准备pet薄膜(150mm
×
200mm)作为脱模部件,用涂布器将纺丝溶液的液膜设置在上述pet薄膜上以使其厚度为0.4mm。然后,将上述液膜与pet薄膜一起静置在鼓风烘箱内,在60℃的条件下干燥30分钟,再转移到真空烘箱中,在80℃的条件下真空干燥15小时,
使其绝对干燥,由此制备由合成高分子或人造丝心蛋白构成的薄膜状成型体(薄膜)。
[0696]
通过对制备的各薄膜进行拉伸试验,来评价弹性模量、拉伸强度、断裂伸长率和韧性。结果如表7所示。表7还一并记载了绝对干燥状态下的薄膜的膜厚。另外,表7所示的断裂伸长率用以比较例5中得到的结果为基准的相对值来表示。
[0697]
[表7]
[0698] 膜厚[μm]弹性模量断裂伸长率韧性实施例726731292639实施例8277654002927实施例9226385203120实施例102824223327190实施例115938436217比较例549100100100
[0699]
如表7所示,可知:实施例7~11中得到的薄膜与比较例5中得到的薄膜相比,断裂伸长率极大,并且将弹性模量抑制得很低。由此也可以确认,实施例7~11中得到的薄膜的柔性非常优异。此外,实施例7~11中得到的薄膜的韧性也非常优异。
[0700]
由实施例7和实施例8的结果可以确认,与先将合成高分子作为粉体进行分离再使其溶解以制成薄膜相比,可以通过由反应后的溶液直接成型薄膜来制成弹性模量、断裂伸长率和韧性更为优异的薄膜;此外,由实施例8、实施例10和实施例11的结果可以确认,可以通过制备用于构成第二链段的柔性来制备所得到的薄膜的柔性,并且可以通过延长第二链段来使得该倾向更为明显。
[0701]
(实施例12)
[0702]
将如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000:第一链段)2177mg和数均分子量为20000的聚乙二醇双马来酰亚胺(biochempeg scientific inc.制造,ho022022-20k:第二链段)823mg溶解于氯化锂的浓度为2m的二甲基亚砜溶液(dmso,岸田化学株式会社制造)12000mg中之后,在氮气下、100℃下边搅拌边反应4小时,从而制备溶解有上述合成高分子的纺丝原液。搅拌速度设定为100rpm。在纺丝原液中,调整混合比以使合成高分子:二甲基亚砜为20质量%:80质量%。得到的纺丝原液在100℃下的粘度为10900mpa
·
s。所制备的纺丝原液中的合成高分子具有以下结构:对具有聚乙二醇链的n-取代马来酰亚胺(相当于第二链段)结合在人造丝心蛋白(相当于第一链段)的分子链末端的嵌段进行多次重复。
[0703]
使用上述纺丝原液,在以下所示的条件下进行干湿式纺丝,从而制成纤维。用齿轮泵将100℃的纺丝原液从喷嘴(喷嘴直径:0.1mm)中与氮气一起挤出,使其通过第一凝固浴(第1浴)、第二凝固浴(第2浴)和拉伸浴(第3浴)后,利用设定为60℃的加热辊进行卷取。拉伸浴中的拉伸倍率设为8.5倍。第1浴为0℃的甲醇浴,第2浴为25℃的甲醇浴,第3浴为54℃的水浴。确认得到的纤维具有充分的拉伸性。得到的纤维的外观如图13所示。
[0704]
以上实施例是以第二链段具有马来酰亚胺基的情况为例进行了说明。下面,对于使用不同的官能团来代替马来酰亚胺基的情况、以及改变第一链段与第二链段之间的键类型的情况,通过举例进行说明。
[0705]
(实施例13)
[0706]
通过使用数均分子量:6000的聚(乙二醇)缩水甘油醚(默克公司制造:第二链段)来制备合成高分子。具体而言,在玻璃容器中称取如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)且数均分子量:50000的人造丝心蛋白(第一链段)27mg和上述聚(乙二醇)缩水甘油醚3.1mg。进一步地,加入三乙胺(nacalai公司制造)0.14μl和作为溶剂的氯化锂的n,n-二甲基甲酰胺溶液(氯化锂浓度为2质量%)1.73ml,以得到反应溶液。另外,氯化锂使用富士胶片和光纯药制造的产品,n,n-二甲基甲酰胺使用关东化学的产品。
[0707]
使上述反应溶液在50℃或80℃下反应3小时或20小时。反应后,加入ro水6ml后,使产物沉淀,并通过离心分离除去溶剂。进一步地,用ro水洗涤3次,用丙酮洗涤2次,每次都通过离心分离除去洗涤液。另外,一次洗涤使用溶剂(ro水或丙酮)15ml。通过这样的洗涤操作,除去未反应的聚(乙二醇)二缩水甘油醚等。洗涤后,通过使其减压干燥,得到合成高分子。通过对得到的合成高分子进行gpc测定,确认了作为产物的合成高分子的分子量比反应前的人造丝心蛋白大,并确认了在人造丝心蛋白与聚(乙二醇)二缩水甘油醚之间形成有共价键。gpc的结果如图14所示。
[0708]
(实施例14)
[0709]
通过使数均分子量:20000的聚乙二醇(nacalai公司制造)与六亚甲基二异氰酸酯(东京化成公司制造)反应来制备相当于第二链段的高分子化合物。通过使上述高分子化合物与人造丝心蛋白反应来制备合成高分子。
[0710]
具体而言,在玻璃容器中称取上述聚乙二醇197mg,并加入作为溶剂的n,n-二甲基甲酰胺0.847μl,加热至40℃后使其溶解。将其恢复到25℃,加入上述六亚甲基二异氰酸酯3.2μl,以制备反应液。将反应液在40℃或60℃下搅拌4小时,从而使其进行反应。
[0711]
此外,在另一个玻璃容器中称取具有序列号72所示的氨基酸序列(prt27)且数均分子量:10000的人造丝心蛋白(第一链段)42.9mg,并向其中加入作为溶剂的氯化锂的n,n-二甲基甲酰胺溶液(氯化锂浓度为2质量%)1.47ml,通过在100℃下加热10分钟使其溶解,以制备溶液。此外,除此之外,在另一个玻璃容器中称取具有序列号62所示的氨基酸序列(prt17)且数均分子量:50000的人造丝心蛋白(第一链段)42.9mg,并向其中加入作为溶剂的氯化锂的n,n-二甲基甲酰胺溶液(氯化锂浓度为2质量%)1.47ml,通过在60℃下加热10分钟使其溶解,以制备溶液。分别将这2种人造丝心蛋白溶液放冷至30℃。
[0712]
将通过在包含相当于第二链段的高分子化合物的溶液中加入氯化锂16mg后制备的溶液分别加入到上述2种人造丝心蛋白溶液86mg中,以得到2种反应溶液。然后,各反应溶液在30℃下搅拌20小时,以分别进行反应。
[0713]
反应后,用与实施例13相同的方法进行洗涤,除去未反应的高分子化合物等。洗涤后,通过减压干燥,得到包含具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白的合成高分子和包含具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白的合成高分子。通过对得到的2种合成高分子进行gpc测定,确认了作为产物的2种合成高分子的分子量均比反应前的人造丝心蛋白大,并确认了在人造丝心蛋白与高分子化合物(聚乙二醇与六亚甲基二异氰酸酯的反应物)之间形成有共价键。gpc的结果如图15所示。图15(a)示出了包含具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白的合成高分子的结果,图15(b)示出了包含具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白的合成高分子的结果。
[0714]
(实施例15)
[0715]
通过使数均分子量:20000的聚乙二醇(nacalai公司制造)与3-丁炔酸(3-butynoic acid、东京化成公司制造)反应来制备相当于第二链段的高分子化合物。通过使上述高分子化合物与人造丝心蛋白反应,来制备合成高分子。
[0716]
具体而言,在玻璃容器中称取上述聚乙二醇1g、3-丁炔酸25mg和作为酸催化剂的对甲苯磺酸(岸田化学公司制造)10.3mg,并加入作为溶剂的甲苯(岸田化学公司制造)10ml,以得到反应液。通过将该反应液在90℃下搅拌20小时来进行反应。经过20小时后,加入50ml环戊基甲醚(富士胶片和光纯药公司制造),并静置2小时,以使其沉淀。过滤收集沉淀物,用环戊基甲醚洗涤3次,以得到粉末。一次洗涤使用溶剂(环戊基甲醚)15ml。通过洗涤操作,去除了3-丁炔酸等未反应物。将该沉淀和纯化操作重复2次后,进行减压干燥,从而得到相当于第二链段的高分子化合物的粉末。
[0717]
接下来,在玻璃容器中加入如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)且数均分子量:50000的人造丝心蛋白蛋白(第一链段)40mg、上述高分子化合物16mg、作为碱催化剂的三乙胺(nacalai公司制造)0.22μl或1.67μl、以及作为溶剂的氯化锂的n,n-二甲基甲酰胺溶液(氯化锂浓度为2质量%)或二甲基亚砜2.8ml,以制备反应溶液。通过将该反应溶液在25℃或80℃下搅拌20小时来进行反应。
[0718]
反应后,用与实施例13相同的方法进行洗涤,除去未反应的高分子化合物等。洗涤后,通过使其减压干燥,得到合成高分子。通过对得到的合成高分子进行gpc测定,确认了作为产物的合成高分子的分子量比反应前的人造丝心蛋白大,并确认了在人造丝心蛋白与高分子化合物(聚乙二醇和3-丁炔酸的反应物)之间形成有共价键。gpc的结果如图16所示。
[0719]
(实施例16)
[0720]
通过使数均分子量:20000的聚乙二醇(nacalai公司制造)与溴乙酸甲酯(东京化成公司制造)反应来调整相当于第二链段的高分子化合物。通过使上述高分子化合物与人造丝心蛋白反应,来制备合成高分子。通过将该反应液在90℃下搅拌20小时来进行反应。
[0721]
具体而言,在玻璃容器中称取上述聚乙二醇300mg、溴乙酸甲酯8.3μl和作为酸催化剂的对甲苯磺酸(岸田化学公司制造)3.1mg,并加入作为溶剂的甲苯(岸田化学公司制造)3ml,制备反应液。通过将该反应液在90℃下搅拌20小时来进行反应。经过20小时后,加入50ml环戊基甲醚(富士胶片和光纯药公司制造),并静置2小时,以使其沉淀。过滤收集沉淀物,用环戊基甲醚洗涤3次,以使其沉淀。过滤收集沉淀物,用环戊基甲醚洗涤3次,以得到粉末。一次洗涤使用溶剂(环戊基甲醚)5ml。通过洗涤操作,去除了溴乙酸甲酯等未反应物。将该沉淀和纯化操作重复2次后,进行减压干燥,从而得到相当于第二链段的高分子化合物的粉末。
[0722]
接下来,在玻璃容器中加入如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)且数均分子量:50000的人造丝心蛋白蛋白(第一链段)36mg、上述高分子化合物13.7mg、作为碱催化剂的三乙胺(nacalai公司制造)0.19μl、以及作为溶剂的氯化锂的n,n-二甲基甲酰胺溶液(氯化锂浓度为2质量%)2.9ml,以制备反应溶液。通过将该反应溶液在50℃下搅拌20小时来进行反应。
[0723]
反应后,用与实施例13相同的方法进行洗涤,除去未反应的高分子化合物等。洗涤后,通过使其减压干燥,得到合成高分子。通过对得到的合成高分子进行gpc测定,确认了作为产物的合成高分子的分子量比反应前的人造丝心蛋白大,并确认了在人造丝心蛋白与高
分子化合物(聚乙二醇和溴乙酸甲酯的反应物)之间形成有共价键。gpc的结果如图17所示。
[0724]
(实施例17)
[0725]
使数均分子量:400的聚乙二醇(富士胶片和光纯药公司制造)、对甲苯磺酸一水合物(岸田化学公司制造)与叠氮化钠(nacalai公司制造)反应,以制备相当于第二链段的高分子化合物。另外,使人造丝心蛋白与炔丙基溴(东京化成公司制造)反应,制备具有相当于第一链段的炔基的人造丝心蛋白(第一链段),并通过与上述高分子化合物反应,来制备合成高分子。
[0726]
具体而言,在玻璃容器中称取上述聚乙二醇200mg、对甲苯磺酰氯210mg、作为碱催化剂的三乙胺(nacalai公司制造)348μl,以制备反应液。通过将该反应液在25℃下搅拌5小时来进行反应。经过5小时后,加入1n盐酸(关东化学公司制造)9ml和乙酸乙酯(关东化学公司制造)9ml,转移到分液漏斗中,并进行3次的乙酸乙酯萃取。进一步地,用碳酸氢钠溶液(关东化学公司制造)和饱和食盐水(关东化学公司制造)洗涤乙酸乙酯层,并用硫酸钠(nacalai公司制造)进行脱水。然后,进行减压干燥,以得到反应物。
[0727]
接下来,在玻璃容器中加入上述反应物20mg、叠氮化钠5.5mg、作为催化剂的四丁基碘化铵(东京化成公司制造)0.5mg、以及作为溶剂的二甲基亚砜(岸田化学公司制造)1ml,以制备反应液。通过将该反应液在80℃下搅拌20小时来使其反应。经过20小时后,加入饱和氯化铵溶液(关东化学公司制造)3ml,转移到分液漏斗中,并进行3次的乙酸乙酯萃取。进一步地,用硫酸钠(nacalai公司制造)进行脱水。然后,进行减压干燥,以得到相当于第二链段的高分子化合物。
[0728]
接下来,在玻璃容器中加入如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)且数均分子量:50000的人造丝心蛋白蛋白(第一链段)30mg、炔丙基溴0.9μl、以及作为溶剂的二甲基亚砜(岸田化学公司制造)1ml,以制备反应液。通过将该反应液在25℃下搅拌20小时来使其反应。经过20小时后,加入乙酸乙酯(关东化学公司制造)3ml,以使产物沉淀。过滤收集沉淀物,用乙酸乙酯洗涤3次。每次洗涤使用5ml溶剂(乙酸乙酯)。通过洗涤操作,去除了炔丙基溴等未反应物。洗涤操作后,进行减压干燥,以得到具有相当于第一链段的炔基的人造丝心蛋白(第一链段)。
[0729]
在玻璃容器中,称取上述高分子化合物0.4mg、具有相当于上述第一链段的炔基的人造丝心蛋白(第一链段)30mg、作为催化剂的碘化铜(i)(nacalai公司制造)0.17mg、以及作为溶剂的二甲基亚砜(岸田化学公司制造)1ml,以制备反应溶液。通过将该反应溶液在80℃下搅拌20小时来进行反应。经过20小时后,加入乙酸乙酯3ml,以使产物沉淀。过滤收集沉淀物,用乙酸乙酯洗涤3次。每次洗涤使用5ml溶剂(乙酸乙酯)。通过洗涤操作,去除了未反应的高分子化合物等。洗涤后,通过使其减压干燥,得到合成高分子。通过对得到的合成高分子进行gpc测定,确认了作为产物的合成高分子的分子量比反应前的人造丝心蛋白大,并确认了在具有炔基的人造丝心蛋白与高分子化合物(聚乙二醇和叠氮化钠的反应物)之间形成有共价键。gpc的结果如图18所示。
[0730]
(参考例1:结构蛋白质的疏水性评价(溶解性))
[0731]
对人造丝心蛋白、蚕丝丝心蛋白(平均亲水指数的值:0.21)在9m溴化锂水溶液中的溶解性进行评价。作为蚕丝丝心蛋白,使用kb seiren公司制造的“silk power im”;作为人造丝心蛋白,使用如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造
丝心蛋白(数均分子量:50000)以及如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)。具体而言,溶解性的评价是通过在9m溴化锂水溶液中分别添加预定量的蚕丝丝心蛋白和人造丝心蛋白,并观察在60℃下搅拌30分钟后的水溶液的外观,由此对溶解性进行评价。结果如表8所示。在表8中,“a”表示添加的丝心蛋白完全溶解,并可制备设定浓度的溶液,“b”表示观察到丝心蛋白的溶解残留。即,确认了人造丝心蛋白即使相对于60℃的9m溴化锂水溶液也不能溶解相当于5质量%的量,是疏水性高的丝心蛋白。
[0732]
[表8]
[0733][0734]
(参考例2:结构蛋白质的疏水性评价(耐热水性))
[0735]
对人造丝心蛋白、蚕丝丝心蛋白进行耐热水性试验,并对其耐热水性进行评价。作为蚕丝丝心蛋白,使用kb seiren公司制造的“silk power im”;作为人造丝心蛋白,使用如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)。为了使丝心蛋白的含量为5质量%,在玻璃容器中加入丝心蛋白50mg和作为溶剂的ro水950mg,以制备分散液。将该分散液在100℃下搅拌5小时。经过5小时后,通过离心分离除去溶剂。除去溶剂后,用丙酮洗涤2次,通过离心分离除去丙酮。洗涤操作后,通过进行减压干燥,得到处理粉末。通过对处理粉末进行gpc测定,确认分解的程度。gpc的结果如图19所示。由图19可知,蚕丝丝心蛋白与处理前相比,确认分子量有所减少,而人造丝心蛋白未确认到分子量的减少。从该结果可以推测,上述人造丝心蛋白对ro水的亲水性比蚕丝丝心蛋白低。换言之,可以说上述人造丝心蛋白的疏水性高。另外,图19中,将具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)的结果记为prt100。
[0736]
(参考例3:结构蛋白质的疏水性评价(接触角))
[0737]
对人造丝心蛋白、蚕丝丝心蛋白与水的接触角进行测定和评价。作为蚕丝丝心蛋白,使用kb seiren公司制造的“silk power im”;作为人造丝心蛋白,使用如上所述那样制备的具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白(数均分子量:50000)以及如上所述那样制备的具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白(数均分子量:100000)。具体而言,对于接触角的测定,首先,为了使丝心蛋白的含量为3质量%,在玻璃容器中加入丝心蛋白30mg和作为溶剂的二甲基亚砜970mg,以制备分散液。将该分散液在100℃下搅拌15分钟,以制备二甲基亚砜溶液。接下来,在载玻片上粘贴厚度为100μm的遮蔽胶带,制成垫片,并浇铸如上所述那样制备的二甲基亚砜溶液,以形成液膜。然后,将整个载玻片移动至真空烘箱(东京理科危机公司制,产品名:vos-210c)内,静置,并在80℃下进行减压干燥,从而形成丝心蛋白膜(薄膜)。对该薄膜滴加2μl的ro水,将经过5秒钟后的水的接触角用接触角计(共和界面科学公司制造,产品名:dms-061)进行测定。对于各种丝心蛋白,用6个样品进行测定,将其平均值用于评价。结果如表9和图20所示。如表9所示,确认与蚕丝丝心蛋白相比,人造丝心蛋白与水的接触角更大,疏水性更高。在图20中,蚕丝丝心蛋白的结果示于左侧,具有序列号62所示的氨基酸序列(prt17)的人造丝心蛋白的结果示于右侧,而
具有序列号72所示的氨基酸序列(prt27)的人造丝心蛋白的结果示于中心。
[0738]
[表9]
[0739][0740]
工业应用性
[0741]
根据本公开,可以提供一种能够制备具有优异柔性的成型体的合成高分子,其中,该合成高分子是一种具有肽骨架的高分子材料。根据本公开,还可以提供一种含有上述合成高分子的成型材料以及成型体。
[0742]
根据本公开,可以通过选择相对于第一链段导入的第二链段来调整合成高分子的物理特性和功能。进而,可以调整通过使用上述合成高分子来制备的成型体的物理特性和功能。
[0743]
符号说明
[0744]2ꢀꢀ
模具
[0745]4ꢀꢀ
上侧销
[0746]6ꢀꢀ
下侧销
[0747]
8a 样品
[0748]
8b 成型体
[0749]
10 加压成型机
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1