结合B7H4的抗体的制作方法
结合b7h4的抗体
技术领域
1.本发明涉及结合b7h4的抗体,特别是结合b7h4和cd3的双特异性抗体。本发明进一步提供了包含该抗体的药物组合物以及该抗体在治疗和诊断规程中的用途,特别是在癌症疗法中的用途。
2.发明背景
3.b7h4(b7-h4,含有v-set域的t细胞活化抑制剂1或vtcn1)是b7蛋白家族的成员,该家族包含与淋巴细胞上的受体结合的细胞表面蛋白配体。b7家族在免疫应答的调节中起重要作用。b7h4通过抑制t细胞活化、增殖、细胞因子产生和细胞毒活性来负调节t细胞介导的免疫应答(prasad et al.,2003,immunity 18:863-873)。b7h4是i型跨膜蛋白,其包括短的细胞内域、疏水性跨膜域和细胞外域,所述细胞外域具有igv和igc样域,其具有四个保守的半胱氨酸残基和七个n-连接糖基化位点。(sica et al.,2003,immunity 18:849-861)。迄今为止,尚未鉴定出b7h4受体。
4.在正常成人组织中,b7h4表达非常有限,而b7h4表达在许多癌症组织的肿瘤细胞上发现(kaur and janakiram,2019,esmo open 4:e000554)。在癌症中,b7h4表达与癌症晚期、不良预后和降低的总体患者生存相关。
5.因此,已提出靶向b7h4用于治疗癌症(podojil and miller,immunological reviews,2017:276;40-51)。目前,正在开发用于癌症疗法的b7h4结合抗体。例如,fpa150是无岩藻糖基化(afucosylated)人抗体,其减轻b7h4介导的对t细胞活化的抑制并表现出抗体依赖性细胞性的细胞毒性(adcc)活性(wainberg et al.,2019,annals of oncology 30,suppl.5,v489(1198p))。它目前作为单一疗法或联合派姆单抗用于晚期实体瘤的早期临床试验。
6.还努力将t细胞靶向b7h4。基于小鼠抗人b7h4抗体和小鼠抗人cd3抗体的fab和单链可变片段(scfv)结构制备b7h4/cd3双特异性单链抗体fab scfv(iizuka et al.,2019,clin cancer res 25:2925-2934)。smith等人已经描述具有b7h4特异性嵌合抗原受体(car)的工程化t细胞,其针对b7h4阳性人卵巢肿瘤异种移植物展示出抗肿瘤活性,但也在小鼠中显示出多器官淋巴细胞浸润和致死毒性(smith et al.2016,molecular therapy,vol.24iss.11pp1987-99)。
7.尽管已经取得一些进展,但仍需要开发对人使用而言有效和/或安全的靶向b7h4的基于抗体的癌症疗法。
8.发明概述
9.本发明的目的是提供包含能够结合人b7h4的抗原结合区和结合cd3诸如人cd3ε(epsilon)的抗原结合区的抗体。此类抗体的抗原结合区至少包含人框架区,诸如fr1、fr2、fr3和fr4。最优选的是所有框架区均是人的。此类抗原结合区是人源化和/或人的抗原结合区。这些抗体可用于治疗病况,其中期望b7h4表达细胞的特异性靶向和t细胞介导的杀伤,例如在病况诸如癌症中。优选地,此类抗体适合人使用,例如在医疗中使用。可以适合治疗的癌症是实体瘤。根据本发明,所述b7h4表达和t细胞介导的杀伤(例如在癌细胞中)的范围
可以为b7h4的相对低表达,诸如在mcf-7细胞中,至b7h4的相对高表达,诸如在sk-br3细胞中,如例如在实施例12中所示。更优选地,此类双特异性抗体具有在恒定区内的使得fc区(如果存在)为惰性的取代。
10.在一个实施方案中,提供了双特异性抗体,其包含能够结合人b7h4的抗原结合区和能够结合cd3诸如人cd3ε(ε)的抗原结合区,其中该能够结合人b7h4的抗原结合区包含可变重链(vh)区和可变轻链区,该可变重链(vh)区包含seq id no.25、29或31的cdr1、cdr2和cdr3区,该可变轻链区包含seq id no.33的cdr1、cdr2和cdr3,并且其中该能够结合cd3的抗原结合区包含重链可变区(vh)和轻链可变区(vl),该重链可变区(vh)包含分别为18、19和21的cdr1、cdr2和cdr3序列;该轻链可变区(vl)包含分别为seq id no:23、gtn和24的cdr1、cdr2和cdr3序列。
11.在另一方面,提供了编码如本文所定义的抗体的核酸,诸如dna或rna,以及产生如本文所定义的抗体或其组分的方法。
12.在进一步的方面,根据本发明的所述抗体或核酸用于医学治疗。
13.附图简述
14.图1.使用b7h4-b7h3嵌合分子确定参与结合的b7h4域。使用经转染以表达人b7h4(i)、人b7h4-b7h3嵌合分子b7h3-igv/b7h4-igc(ii)或b7h4-igv/b7h3-igc(iii),或人b7h3(iv)的一组细胞来确定b7h4抗体的b7h4域特异性。通过流式细胞术测定结合。a=bsigg1-hucd3-fealxb7h4-c4-fear;b=bsigg1-hucd3-fealxb7h4-c3-fear;c=bsigg1-hucd3-fealxb7h4-c2-fear;d=bsigg1-hucd3-fealxb7h4-c1-fear;e=igg1-b7h3-brca84d。
15.图2.b7h4抗体与b7h4、b7h3或b7h4-b7h3嵌合分子的结合。使用流式细胞术评估bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear、bsigg1-hucd3-h101g-fealxb7h4-c2-fear、bsigg1-hucd3-h101g-fealxb7h4-c3-fear、bsigg1-hucd3-h101g-fealxb7h4-c4-fear和bsigg1-hucd3-h101g-fealxb7h4-c5-fear与经瞬时转染以表达人b7h4或b7h4-b7h3嵌合分子b7h3-igv/b7h4-igc或b7h4-igv/b7h3-igc的hek细胞的结合。
16.图3.b7h4抗体与具有ecd中的丙氨酸突变的b7h4变体的结合。结合表示为与参考抗体相比的倍数变化。倍数变化定义为log10(归一化gmfi[ala突变体]/归一化gmfi[wt])。认为其中结合中倍数变化低于平均倍数变化-1.5xsd的残基是“结合丢失突变体”。结合中具有正倍数变化的残基是参考抗体的结合丢失残基。x轴下方的数字是指氨基酸位置。(a)c1-n52s的结果,以c2作为参考抗体。(b)c2的结果,以c1-n52s作为参考抗体。(c)c3的结果,c2作为参考抗体。
[0017]
图4.b7h4抗体和cd3xb7h4双特异性抗体与人和食蟹猴b7h4的结合。通过流式细胞术测定igg1-b7h4-c1-n52s-fear(a)和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(b)与用人b7h4或食蟹猴b7h4瞬时转染的hek-293f细胞的结合。未转染的hek-293f细胞(c)用作阴性对照;对于这些,显示了bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的结合。
[0018]
图5.b7h4抗体和cd3xb7h4双特异性抗体与来自兔、大鼠、小鼠、犬和猪的b7h4的结合。通过流式细胞术测定igg1-b7h4-c1-n52s-fear(a)和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(b)与用来自兔、大鼠、小鼠、犬或猪的b7h4瞬时转染的hek-293f细胞的结合。未转染的hek-293f细胞(c)用作阴性对照;对于这些,显示了bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的结合。
[0019]
图6.b7h4抗体与来自不同物种的b7h4瞬时转染的hek-293f细胞的结合。通过流式细胞术测定igg1-b7h4-c1-n52s-fear(a)、igg1-b7h4-c3-fear(b)、igg1-b7h4-c2-fear(c)、igg1-b7h4-c4-fear(d)和igg1-b7h4-c5-fear(e)与用来自人、食蟹猴、小鼠、大鼠或猪的b7h4转染的hek-293f细胞,或未转染的hek-293f细胞的结合。igg1-b12用作非结合对照抗体(未显示)。
[0020]
图7.igg1-b7h4-c1-n52s-fear(a)和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(b)与mcf-7和mda-mb-468细胞的结合。通过流式细胞术测定结合。igg1-b12(c)和bsigg1-hucd3-h101g-fealxb12-fear(d)用作非结合对照抗体。
[0021]
图8.bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a)与nih-ovcar-3、hcc1954和hela细胞的结合。通过流式细胞术测定结合。bsigg1-hucd3-h101g-fealxb12-fear(b)用作非结合对照抗体。
[0022]
图9.bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a)和bsigg1-hucd3-fealxb7h4-c1-n52s-fear(b)与sk-br3和mda-mb-486细胞的结合。通过流式细胞术测定结合。bsigg1-hucd3-fealxb12-fear(c)和bsigg1-hucd3-h101g-fealxb12-fear(d)用作非结合对照抗体。
[0023]
图10同二聚体和bsab格式的各种b7h4抗体与mda-mb-486和hcc1954细胞的结合。通过流式细胞术测定igg1-b7h4-c1-n52s-fear(a同二聚体)、igg1-b7h4-c2-fear(b同二聚体)、igg1-b7h4-c3-fear(c同二聚体)、igg1-b7h4-c4-fear(d同二聚体)、igg1-b7h4-c5-fear(e同二聚体)、bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a bsab)、bsigg1-hucd3-fealxb7h4-c2-fear[mda-mb-468]或bsigg1-hucd3-h101g-fealxb7h4-c2-fear[hcc1954](b bsab)、bsigg1-hucd3-h101g-fealxb7h4-c3-fear(c bsab)、bsigg1-hucd3-h101g-fealxb7h4-c4-fear(d bsab)和bsigg1-hucd3-h101g-fealxb7h4-c5-fear(e bsab)的结合。bsigg1-hucd3-h101g-fealxb12-fear(f bsab)或igg1-b12-k409r(f同二聚体)用作非结合对照抗体。
[0024]
图11.使用纯化的t细胞作为效应细胞,以不同的效应物与靶物比(e:t),通过cd3xb7h4双特异性抗体在体外诱导sk-br3细胞的t细胞介导的细胞毒性。bsigg1-hucd3-fealxb12-fear用作非结合对照抗体。a=bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear;b=bsigg1-hucd3-fealxb7h4-c1-n52s-fear;c=bsigg1-hucd3-fealxb12-fear。
[0025]
图12.在具有不同cd3臂的cd3xb7h4双特异性抗体存在下,在各种肿瘤细胞系中体外诱导t细胞介导的细胞毒性。bsigg1-hucd3-fealxb12-fear用作非结合对照抗体。a=bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear;b=bsigg1-hucd3-fealxb7h4-c1-n52s-fear;c=bsigg1-hucd3-fealxb12-fear,d=bsigg1-hucd3-h101g-fealxb12-fear。
[0026]
图13.b7h4表达水平和t细胞介导的肿瘤细胞杀伤的ic50。(a)肿瘤细胞系上的b7h4表达水平的定量流式细胞术分析。显示的是个体测量值(点)、几何平均值(条)和标准偏差(误差条)。sabc=特异性抗体结合能力。(b)对于不同肿瘤细胞系,在bsigg1-hucd3-fealxb7h4-c1-n52s-fear(i)或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(ii)存在下的t细胞介导的肿瘤细胞杀伤的ic50。每个点代表用个体t细胞供体(每个细胞系4-6个供体)进行的实验,水平线表示中位数。细胞系根据b7h4表达水平进行排序。
[0027]
图14.在t细胞-肿瘤细胞共培养物中通过b7h4双特异性抗体的t细胞活化。(a)通
过流式细胞术测定的,对于各种b7h4阳性肿瘤细胞系,在bsigg1-hucd3-fealxb7h4-c1-n52s-fear(i)或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(ii)存在下的t细胞活化(cd8+细胞上cd69的%)。(b)对于每个靶细胞系,使用衍生自3-5个供体的t细胞,t细胞活化的ec50。每个点代表用个体t细胞供体进行的实验;水平线表示几何平均值。
[0028]
图15.通过多重u-plex测定法测定的,对于bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a)和bsigg1-hucd3-fealxb7h4-c1-n52s-fear(b),使用来自3-4个供体的t细胞,在ec50、ec90和ec99下的t细胞-肿瘤细胞共培养物的上清液中的ifnγ。显示的是个体测量值(点)、几何平均值(水平线)和标准偏差(误差条)。
[0029]
图16.用bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a)或bsigg1-hucd3-fealxb7h4-c1-n52s-fear(b)的单剂量iv输注处理的食蟹猴血浆中的il-6和mcp-1水平。
[0030]
图17.bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(a)或bsigg1-hucd3-fealxb7h4-c1-n52s-fear(b)的单次iv输注后的平均血浆浓度-时间曲线图。
[0031]
图18.一系列原发性实体瘤中的b7h4 mrna表达水平。b7h4 mrna水平从omicsoft tcga数据库中提取,并使用oncoland软件进行可视化。根据b7h4 mrna表达的中位数对适应症进行排序。thym=胸腺瘤,uvm=葡萄膜黑色素瘤,pcpg=嗜铬细胞瘤和副神经节瘤,acc=肾上腺皮质癌,meso=间皮瘤,skcm=皮肤黑色素瘤,read=直肠腺癌,coad=结肠腺癌,gmb=多形性胶质母细胞瘤,sarc=肉瘤,lihc=肝细胞癌,lgg=脑低级别胶质瘤,kirc=肾透明细胞癌,tgct=睾丸生殖细胞肿瘤,kich=肾嫌色细胞,stad=胃腺癌,thca=甲状腺癌,hnsc=头颈部鳞状细胞癌,prad=前列腺腺癌,luad=肺腺癌,esca=食管癌,cesc=宫颈鳞状细胞癌和宫颈腺癌,kirp=肾乳头状细胞癌,ucs=子宫癌肉瘤,blca=膀胱尿路上皮癌,paad=胰腺腺癌,lusc=肺鳞状细胞癌,brca=乳腺侵入癌,ucec=子宫体子宫内膜癌,ov=卵巢浆液性囊腺癌和chol=胆管癌。
[0032]
表1-氨基酸和核酸序列
[0033]
[0034]
[0035]
[0036]
[0037]
[0038]
[0039]
[0040][0041]
上表中的cdr区(cdr1、cdr2和cdr3,以及vh和vl序列中带下划线的序列)已根据imgt(参见lefranc mp.et al.,nucleic acids research,27,209-212,1999]和brochet x.nucl.acids res.36,w503-508(2008))进行注释。如上表中使用,对k405l和k409r的引用符合eu-编号索引(描述于kabat,e.a.et al.,sequences of proteins of immunological interest.5th edition-us department of health and human services,nih publication no.91-3242,pp662,680,689(1991)。
[0042]
发明详述
[0043]
定义
[0044]
如本文所用,术语“抗体”意图指具有在典型的生理条件和/或肿瘤特异性条件下以相当长的时间段的半衰期,诸如至少约30分钟、至少约45分钟、至少约1小时、至少约2小时、至少约4小时、至少约8小时,至少约12小时、至少约24小时或更多、至少约48小时或更多、至少约3、4、5、6、7或更多天等,或任何其他相关的功能定义的时段(例如足以诱导、促进、增强和/或调节与抗体与抗原的结合相关的生理应答的时间和/或足以使抗体内在化的时间)与抗原特异性结合的能力的免疫球蛋白分子、免疫球蛋白分子的片段或其任一者的衍生物。抗体包含可以与抗原相互作用的结合区(或在本文中可以使用的具有相同含义的结合域)、包含免疫球蛋白分子的重链和轻链的可变区的结合区等。抗体可以包含可以介导免疫球蛋白与宿主组织或因子的结合的抗体(ab)的恒定区,其包括免疫系统的各种细胞(诸如效应细胞)和补体系统的组分,诸如c1q,补体激活的经典途径中的第一组分。
[0045]
在本发明的上下文中,术语“抗体”包括单克隆抗体(mab)、抗体样多肽,、嵌合抗体、人源化抗体,以及通过任何已知技术诸如酶促裂解、肽合成和重组dna技术提供的“抗体片段”或“其片段”,其保留与抗原特异性结合的能力(抗原结合片段)。术语“抗体”包括双特异性抗体和/或具有进一步修饰的抗体,例如,其抗体-药物缀合物。
[0046]
除非本文的公开内容另外受到限制,否则根据本发明定义的抗体可以具有任何同种型。
[0047]
已经显示抗体的抗原结合功能可以通过全长抗体的片段进行。术语“抗体”中涵盖的抗原结合片段的实例包括(i)fab’或fab片段,由轻链可变域(vl)、重链可变域(vh)、轻链恒定区(cl)和重链恒定区域1(ch1)域组成的单价片段或如wo 2007/059782中所述的单价抗体;(ii)f(ab’)2片段,包含在铰链区处通过二硫键连接的两个fab片段的二价片段;(iii)基本上由vh和ch1域组成的fd片段;(iv)基本上由抗体单臂的vl和vh域组成的fv片
段,(v)dab片段ward et al.,nature 341,544-546(1989),其基本上由vh域组成并且也称为域抗体holt et al;trends biotechnol.2003nov;21(11):484-90;(vi)骆驼抗体或纳米抗体revets et al;expert opin biol ther.2005jan;5(1):111-24和(vii)分离的互补决定区(cdr)。此外,尽管fv片段的两个域vl和vh由不同的基因编码,但可以使用重组方法通过合成接头将它们连接起来,所述合成接头使它们能够制备成单一蛋白链,其中vl区和vh区配对以形成单价分子(称为单链抗体或单链fv(scfv),参见例如revets et al;expert opin biol ther.2005jan;5(1):111-24and bird et al.,science 242,423-426(1988)。除非另有说明或上下文明确指出,否则此类单链抗体涵盖在术语抗体内。尽管此类片段通常包括在抗体的含义内,但是它们共同且各自独立地是本发明的独特特征,表现出不同的生物学特性和效用。在本发明的上下文中,这些和其他有用的抗体片段在本文中进一步讨论。
[0048]
可以在不同的体外或离体表达或生产系统中生产抗体并从中收集抗体,例如从重组修饰的宿主细胞,从杂交瘤或使用支持体外转录和/或翻译编码该抗体的核酸序列的细胞提取物的系统中。应当理解,多种不同的抗体(所述抗体如在本发明的上下文中定义)可以通过在如上所述的生产系统中分开生产每种抗体并然后混合抗体,或者通过在相同生产系统中生产几种抗体来提供。
[0049]
如本文所用,术语“免疫球蛋白重链”或“免疫球蛋白的重链”是指免疫球蛋白的重链之一。重链通常由定义免疫球蛋白同种型的重链可变区(在本文中缩写为vh)和重链恒定区(在本文中缩写为ch)组成。重链恒定区通常由三个域ch1、ch2和ch3组成。如本文所用,术语“免疫球蛋白”意指由两对多肽链,一对轻(l)低分子量链和一对重(h)链组成的一类结构相关的糖蛋白,所有四者潜在通过二硫键相互连接。免疫球蛋白的结构已经得到充分表征(参见例如fundamental immunology ch.7(paul,w.,ed.,2nd ed.raven press,n.y.(1989))。在免疫球蛋白的结构内,两条重链在所谓的“铰链区”中经由二硫键相互连接。与重链相同,每个轻链通常由几个区域组成:轻链可变区(在本文中缩写为vl)和轻链恒定区。轻链恒定区通常由一个域cl组成。此外,vh和vl区可进一步细分为高变性区(或高变区,其在序列和/或结构上定义的环的形式上可以是高变的),也称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl通常由三个cdr和四个fr组成,其从氨基端到羧基端按以下次序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
[0050]
当在本文中使用时,术语“半分子”、“fab臂”和“臂”是指一个重链-轻链对。当双特异性抗体被描述为包含“衍生自”第一抗体的半分子抗体和“衍生自”第二抗体的半分子抗体时,术语“衍生自”表示双特异性抗体通过任何已知方法将来自所述第一抗体和第二抗体中每一种的所述半分子重组为所得的双特异性抗体来生成。在此上下文下,“重组”并不意图受到任何特定的重组方法的限制,并且因此包括例如下文所述的用于产生双特异性抗体的所有方法,包括例如通过半分子交换进行重组以及在核酸水平上的重组和/或通过在同一细胞中两个半分子的共表达的重组。
[0051]
如本文所用,术语“抗原结合区”或“结合区”是指能够结合抗原的抗体的区域。抗原可以是任何分子,诸如多肽。抗原可以,例如存在于细胞、细菌或病毒粒子上。除非与上下文相矛盾,否则术语“抗原”和“靶物”可以在本发明的上下文中可互换地使用。除非与上下文相矛盾,否则术语“抗原结合区”和“抗原结合位点”可以在本发明的上下文中可互换地使
prot no p09693或食蟹猴cd3γuniprotkb/swiss-prot no q95li7),cd3δ(delta)链(人cd3δuniprotkb/swiss-prot no p04234或食蟹猴cd3δuniprotkb/swiss-prot no q95li8),两条cd3ε(epsilon)链(人cd3εuniprotkb/swiss-prot no p07766,其序列在此并入作为seq id no:13,其中氨基酸残基1-22代表信号肽,并且氨基酸残基23-207代表成熟cd3ε多肽;食蟹猴cd3εuniprotkb/swiss-prot no q95li5;或猕猴(rhesus monkey)cd3εuniprotkb/swiss-prot no g7ncb9)和cd3ζ链(zeta)链(人cd3ζuniprotkb/swiss-prot no p20963,食蟹猴cd3ζuniprotkb/swiss-prot no q09tk0)。这些链与称为t细胞受体(tcr)的分子缔合,并在t淋巴细胞中生成活化信号。tcr和cd3分子一起构成tcr复合物。
[0059]
术语“抗体结合区”是指抗原中包含抗体结合的表位的区域。可以通过使用生物层干涉测量法的表位框并,通过丙氨酸扫描或通过域改组测定法(使用将抗原区域与另一种抗原区域交换的抗原构建体,并且测定抗体仍结合抗原与否)来测定抗体结合区域。可以通过氢/氘交换质谱法和/或通过与其抗原结合的抗体的晶体学测定参与与抗体的相互作用的抗体结合区内的氨基酸。
[0060]
术语“表位”是指被抗体特异性结合的抗原决定簇。表位通常由诸如氨基酸、糖侧链或其组合的分子的表面分组组成,并且通常具有特定的三维结构特征以及特定的电荷特征。构象性和非构象性表位的区别在于,在存在变性溶剂的情况下,失去与前者的结合而非与后者的结合。表位可以包含直接参与结合的氨基酸残基,以及不直接参与结合的其他氨基酸残基,例如当抗体与抗原结合时被抗体有效阻断或覆盖的氨基酸残基(换言之,氨基酸残基在特定抗体的足迹内或与该足迹紧密相邻)。
[0061]
如本文所用,术语“单克隆抗体”、“单克隆ab”、“单克隆抗体组合物”、“mab”等是指单分子组成的抗体分子的制备物,并且通常表现出对特定表位的单一结合特异性和亲和力。单克隆抗体通常可以由相同的细胞制备,这些相同的细胞均是独特亲本细胞的克隆,诸如例如杂交瘤、稳定细胞系等。因此,术语“人单克隆抗体”是指表现出单一结合特异性的抗体,其具有源自人种系免疫球蛋白序列的可变区和恒定区。人单克隆抗体可以由杂交瘤产生,所述杂交瘤包括与永生化细胞融合的从转基因或转染色体非人动物如转基因小鼠获得的b细胞,所述b细胞具有包含人重链转基因和轻链转基因的基因组。人单克隆抗体可以衍生自人b细胞或浆细胞。也可以从重组修饰的宿主细胞或使用支持体外转录和/或翻译编码抗体的核酸序列的细胞提取物的系统产生单克隆抗体。
[0062]
如本文所用,术语“同种型”是指由重链恒定区基因编码的免疫球蛋白类别(例如igg1、igg2、igg3、igg4、igd、iga、ige或igm)或其任何同种异型,例如igg1m(za)和igg1m(f))。此外,每个重链同种型均可与kappa(κ)或lambda(λ)轻链组合。
[0063]
当在本文中使用时,术语“全长抗体”是指包含一对重链和轻链或两对不同的重链和轻链的抗体(例如,亲本或变体抗体),每对重链和轻链含有重链和轻链恒定和可变域,诸如通常在该同种型的野生型抗体的重链-轻链对中发现的。在全长变体抗体中,与全长亲本或野生型抗体相比,重链和轻链恒定和可变域可以特别含有修饰和/或改善抗体的功能特性的氨基酸取代。根据本发明的全长抗体可以通过包括以下步骤的方法来产生:(i)将cdr序列克隆到包含完整重链和轻链序列的一个或多个合适载体中,和(ii)在合适的表达系统中表达所获得的具有完整的重链和轻链序列的合适载体。当从cdr序列或完整可变区序列开始时产生全长抗体在本领域技术人员的知识范围内。因此,本领域技术人员知道如何生
成根据本发明的全长抗体。
[0064]
如本文所用,术语“人源化抗体”是指遗传工程化的非人抗体,其含有人抗体恒定域和经修饰以与人可变域具有高水平序列同源性的非人可变域。这可以通过将一起形成抗原结合位点的非人抗体互补决定区(cdr)移植到同源人受体框架区(fr)上来实现(参见例如wo92/22653和ep0629240)。为了完全重建亲本抗体的结合亲和力和特异性,可以需要将来自亲本抗体(即非人抗体)的构架残基替换为人构架区(反向突变)。结构同源性建模可以帮助鉴定构架区中对于抗体的结合特性重要的氨基酸残基。因此,人源化抗体可包含非人cdr序列,主要地人框架区以及完全人恒定区,所述人框架区任选地包含一个或多个向非人氨基酸序列的氨基酸反向突变。任选地,可以应用不一定是反向突变的其他氨基酸修饰,以获得具有优选特性诸如特别有用的亲和力和生化特性,例如来包括修饰以避免脱酰胺,提供“惰性fc区”,和/或改进制造的人源化抗体。
[0065]
如本文所用,术语“人抗体”意图包括具有衍生自人种系免疫球蛋白序列的可变区和框架区和衍生自人免疫球蛋白恒定域的恒定域的抗体。本发明的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变、插入或缺失)。“人抗体”可以掺入已经从人、转基因动物诸如本文实施例中所述的、his小鼠等中的人种系免疫球蛋白序列生成的vh和vl序列。此类vh和vl序列被认为是人vh和vl序列,其已经例如融合至衍生自人免疫球蛋白恒定域的恒定域。
[0066]
因此,“人抗体”可以是工程化抗体。“人抗体”可能已经受进一步的工程化改造,例如包括修饰以避免脱酰胺、提供“惰性fc区”、实现双特异性抗体生成和/或改进制造。人抗体也可以在非人细胞中产生,例如在cho细胞等中产生。然而,如本文所用,术语“人抗体”并不意图包括其中衍生自另一非人物种如小鼠的种系的cdr序列已被移植到人框架序列上的抗体。
[0067]
如本文所用,术语“fc区”是指在从抗体的两条重链的n端至c端末端的方向上至少包含铰链区、ch2区和ch3区的区域。抗体的fc区可以介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(诸如效应细胞)和补体系统的组分。
[0068]
如本文所用,术语“铰链区”是指免疫球蛋白重链的铰链区。因此,例如人igg1抗体的铰链区对应于根据如kabat kabat,e.a.et al.,sequences of proteins of immunological interest.5th edition-us department of health and human services,nih publication no.91-3242,pp 662,680,689(1991)中阐述的eu编号的氨基酸216-230。然而,铰链区也可以是如本文所述的任何其他亚型。
[0069]
如本文所用,术语“ch1区”或“ch1域”是指免疫球蛋白重链的ch1区。因此,例如,人igg1抗体的ch1区对应于根据如kabat(同上)中所阐述的eu编号的氨基酸118-215。然而,ch1区域也可以是如本文所述的任何其他亚型。
[0070]
如本文所用,术语“ch2区”或“ch2域”是指免疫球蛋白重链的ch2区。因此,例如,人igg1抗体的ch2区对应于根据如kabat(同上)中所阐述的eu编号的氨基酸231-340。然而,ch2区域也可以是如本文所述的任何其他亚型。
[0071]
如本文所用,术语“ch3区”或“ch3域”是指免疫球蛋白重链的ch3区。因此,例如,人igg1抗体的ch3区对应于根据如kabat(同上)中所阐述的eu编号的氨基酸341-447。然而,ch3区域也可以是如本文所述的任何其他亚型。
[0072]
如本文所用,术语“fc介导的效应物功能”意图指作为多肽或抗体与其在细胞膜上的靶物或抗原结合结果的功能,其中fc介导的效应物功能可归因于多肽或抗体的fc区。fc介导的效应物功能的实例包括(i)c1q结合,(ii)补体激活,(iii)补体依赖性细胞毒性(cdc),(iv)抗体依赖性细胞介导的细胞毒性(adcc),(v)fc-gamma受体(fcgr)结合,(vi)抗体依赖性fcγr介导的抗原交联,(vii)抗体依赖性细胞吞噬(adcp),(viii)补体依赖性细胞性细胞毒性(cdcc),(ix)补体增强的细胞毒性,(x)由抗体介导的调理抗体与补体受体的结合,(xi)调理和(xii)(i)至(xi)中任一项的组合。
[0073]
如本文所用,术语“惰性”、“惰性的”或“非活化的”指至少不能结合任何fcγr,诱导fc介导的fcγr交联或诱导经由个别抗体的两个fc区的fcγr介导的靶抗原交联,或无法结合c1q的fc区。其实例是如本文所述的恒定域内的fea取代。可以使用单特异性或双特异性形式的抗体来测试抗体的fc区的惰性。
[0074]
当在抗体的上下文中使用时,术语“全长”表示该抗体不是片段,但是含有与特定同种型相对应的所有域,诸如对于该同种型通常在自然界发现的,例如igg1抗体的vh、ch1、ch2、ch3、铰链、vl和cl域。
[0075]
在本发明的上下文中,术语“单价抗体”是指可以凭借仅一个抗原结合域(例如一个fab臂)与抗原相互作用的抗体分子。在双特异性抗体的上下文中,“单价抗体结合”是指双特异性抗体凭借仅一个抗原结合域(例如一个fab臂)与一个抗原的结合。
[0076]
在本发明的上下文中,术语“单特异性抗体”是指仅对一种抗原、一个表位具有结合特异性的抗体。该抗体可以是单特异性单价抗体(即仅携带一个抗原结合区)或单特异性二价抗体(即具有两个相同抗原结合区的抗体)。
[0077]
术语“双特异性抗体”是指抗体,其具有结合不同表位的两个抗原结合域,例如两对不同的vh和vl区、两个不同的fab臂或两个具有不同cdr区的fab臂。在本发明的上下文中,双特异性抗体对至少两个不同的表位具有特异性。此类表位可以在相同或不同的抗原或靶物上。若表位在不同的抗原上,则此类抗原可以在同一细胞或不同细胞、细胞类型或结构上,例如细胞外基质或囊泡和可溶性蛋白上。因此,双特异性抗体可能能够交联多种抗原,例如,两个不同细胞。
[0078]
术语“二价抗体”是指具有两个抗原结合区的抗体,所述两个抗原结合区结合相同抗原上的相同表位中的两个或结合相同或不同抗原上的两个不同表位。因此,二价抗体可以是单特异性抗体或双特异性抗体。
[0079]
术语“氨基酸”和“氨基酸残基”在本文中可以互换使用,并且不应理解为限制性的。氨基酸是含有胺(-nh2)和羧基(-cooh)官能团以及每个氨基酸特有的侧链(r基团)的有机化合物。在本发明的上下文中,可以基于结构和化学特性对氨基酸进行分类。因此,氨基酸类别可反映在以下一个或两个表中:
[0080]
基于r基团的结构和一般化学表征的主要分类
[0081]
表2
[0082]
类别氨基酸酸性残基d和e碱性残基k、r和h亲水性的不带电荷的残基s、t、n和q
脂肪族的不带电荷的残基g、a、v、l和i非极性的不带电荷的残基c、m和p芳香族残基f、y和w
[0083]
表3
[0084]
氨基酸残基的替代物理和功能分类
[0085][0086][0087]
用一个氨基酸取代另一个氨基酸可分类为保守或非保守取代。在本发明的上下文中,“保守取代”是一个氨基酸被具有相似结构和/或化学特征的另一个氨基酸取代,如用一个氨基酸残基取代如上文两个表的任一个中定义的相同类别的另一个氨基酸残基:例如,亮氨酸可以被异亮氨酸取代,因为它们均是脂肪族的、支链的疏水物。类似地,天冬氨酸可以被谷氨酸取代,因为它们都是小的带负电荷的残基。
[0088]
在本发明的上下文中,抗体中的取代表示为:
[0089]
原始氨基酸-位置-取代氨基酸;
[0090]
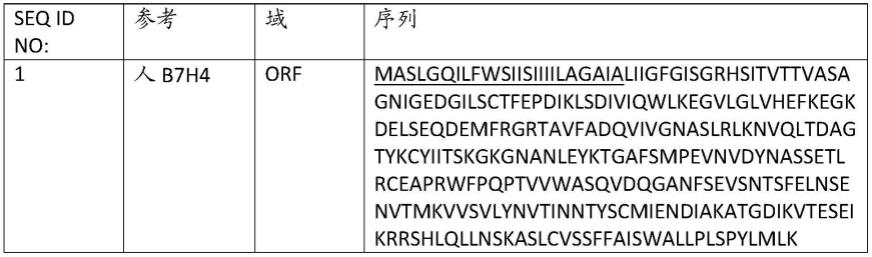
参照公认的氨基酸命名法,使用三个字母代码或一个字母代码,包括代码“xaa”或“x”表示任何氨基酸残基。因此,xaa或x通常可以代表20种天然存在的氨基酸中的任一种。如本文所用,术语“天然存在的”是指以下氨基酸残基中的任何一个;甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、赖氨酸、精氨酸、组氨酸、天冬氨酸、天冬酰胺、谷氨酸、谷氨酰胺、脯氨酸、色氨酸、苯丙氨酸、酪氨酸、甲硫氨酸和半胱氨酸。
[0091]
因此,符号“k409r”或“lys409arg”是指该抗体在氨基酸位置409处包含赖氨酸被
精氨酸的取代。将给定位置处的氨基酸取代为任何其他氨基酸被称为:原始氨基酸-位置;或例如“k409”。对于其中一个或多个原始氨基酸和/或一个或多个取代氨基酸可以包含超过一个但并非所有氨基酸的修饰,超过一个氨基酸可以用“,”或“/”分开。例如,位置409处的赖氨酸经精氨酸、丙氨酸或苯丙氨酸的取代是:“lys409arg,ala,phe”或“lys409arg/ala/phe”或“k409r,a,f”或“k409r/a/f”或“k409至r,a或f”。此类名称在本发明的上下文中可以互换使用,但是具有相同的含义和目的。
[0092]
此外,术语“取代”包括取代成任何一个或其他19种天然氨基酸,或取代成其他氨基酸,例如非天然氨基酸。例如,位置409中的氨基酸k的取代包括以下每个取代:409a、409c、409d、409e、409f、409g、409h、409i、409l、409m、409n、409q、409r、409s、409t、409v、409w、409p和409y。顺便说一下,这等同于名称409x,其中x表示除原始氨基酸以外的任何氨基酸。这些取代也可以称为k409a、k409c等或k409a,c等或k409a/c/etc。类似地,这适用于本文提及的每个位置,以在本文中具体包括此类取代的任一个。
[0093]
根据本发明的抗体还可以包含氨基酸残基的缺失。此类缺失可以表示为“del”,并且包括例如写为k409del。因此,在此类实施方案的情况中,位置409中的赖氨酸已经从氨基酸序列中缺失。
[0094]
如本文所用,术语“宿主细胞”意图指已经引入核酸诸如表达载体的细胞。应当理解,此类术语不仅意图指特定的对象细胞,而且还可以包括此类细胞的后代。因为某些修饰可以由于突变或环境影响而在后代中发生,所以此类后代实际上可以与亲本细胞不同,但仍在本文所用的术语“宿主细胞”的范围内。重组宿主细胞包括例如转染瘤,例如cho细胞、hek 293细胞、expi293f细胞、per.c6细胞、ns0细胞和淋巴细胞,以及原核细胞,例如大肠杆菌和其他真核宿主,例如植物细胞和真菌。
[0095]
如本文所用,术语“转染瘤”包括表达抗体或靶抗原的重组真核宿主细胞,例如cho细胞、per.c6细胞、ns0细胞、hek 293细胞、expi293f细胞,植物细胞或真菌,包括酵母细胞。
[0096]
为了本发明的目的,使用needleman-wunsch算法(needleman and wunsch,1970,j.mol.biol.48:443-453),如在emboss包(emboss:the european molecular biology open software suite,rice et al.,2000,trends genet.16:276-277)的needle程序,优选5.0.0版本以上中实施,在参考序列的长度上测定两个氨基酸序列之间的序列同一性。使用的参数是空位开放罚分10,空位延伸罚分0.5和eblosum62(blosum62的emboss版本)取代矩阵。标有“最长身份”的needle的输出(使用-nobrief选项获得)用作同一性百分比,并且如下计算:
[0097]
(相同残基x 100)/(比对长度-比对中的空位总数)。
[0098]
相似残基的保留也可以或备选地可以通过相似性得分测量,如通过使用blast程序(例如,经由ncbi获得的blast 2.2.8,使用标准设置blosum62,开放空位=11和延伸空位=1)测定。合适的变体通常与亲本或参考序列表现出至少约45%,例如至少约55%,至少约65%,至少约75%,至少约85%,至少约90%,至少约95%或更多(例如,约99%)相似性。
[0099]
如本文所用,术语“内在化的”或“内在化”是指分子如根据本发明的抗体被细胞膜吞噬并被吸入细胞内部中的生物学过程。内在化也可以称为“胞吞”。靶向cd3xb7h4的双特异性抗体
[0100]
在本发明的第一方面,提供了包含能够结合人b7h4的抗原结合区和能够结合人
cd3的抗原结合区的抗体,其中所述抗原结合区包含重链和轻链可变区,其中所述抗原结合区是人可变区和/或人源化可变区。例如,一个抗原结合区可以包含人重链和轻链可变区,而另一个抗原结合区可以包含人源化重链和轻链可变区。或者,两个抗原结合区均可以包含人重链和轻链可变区,或两个抗原结合区均可以包含人源化重链和轻链可变区。因此,相应地,提供了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中所述抗原结合区包含重链和轻链可变区,其中所述重链和轻链可变区包括人框架区。如本文所述的根据本发明的抗体,其包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区,也可以在本文中称为例如b7h4xcd3抗体。
[0101]
此类抗体优选地是双特异性抗体。如上所述的此类抗体在另一个实施方案中能够结合癌细胞和t细胞,诸如实施例中所描述的。可以选择的癌细胞是表达人b7h4的癌细胞和/或属于实体瘤的癌细胞。此类抗体优选能够诱导t细胞介导的癌细胞杀伤。
[0102]
如实施例中所示,能够结合理解为包括在结合测定中,抗体与其靶物结合,如通过例如典型的结合曲线,诸如本文图3和4中所示,或通过使用例如生物层干涉测量法测定结合亲和力,如实施例3和4所示。不能与特定靶物结合的抗原结合区具有例如不可检测的对其靶物的结合亲和力,例如在诸如实施例3所示的典型生物层干涉测定法中使用的最高浓度下具有《0.05nm的响应。在任何情况下,技术人员很清楚如何确定抗原结合区是否能够结合至其靶物。
[0103]
双特异性格式
[0104]
本发明提供双特异性cd3xb7h4抗体,其高效促进表达b7h4的肿瘤细胞的t细胞介导的杀伤。取决于特定用途期望的功能特性,特定抗原结合区可以选自本发明提供的一组抗体或抗原结合区。双特异性抗体的许多不同格式和用途是本领域已知的,并由kontermann;drug discov today,2015jul;20(7):838-47和;mabs,2012mar-apr;4(2):182-97进行了综述。根据本发明的双特异性抗体可以不限于任何特定的双特异性格式或产生其的方法。
[0105]
可以用于本发明的双特异性抗体分子的实例包括(i)具有包含不同抗原结合区的两个臂的单第一抗体,(ii)对两个不同表位具有特异性的单链抗体,例如经由通过额外的肽接头串联连接的两个scfv;(iii)双重可变域抗体(dvd-ig),其中每个轻链和重链含有经由短肽连接串联的两个可变域(wu et al.,generation and characterization of a dual variable domain immunoglobulin(dvd-ig
tm
)molecule,in:antibody engineering,springer berlin heidelberg(2010));(iv)化学连接的双特异性(fab’)2片段;(v)tandab,其是两个单链双抗体(diabodies)的融合体,产生四价双特异性抗体,其对每个靶抗原具有两个结合位点;(vi)弹性体(flexibody),其是scfv与双抗体的组合,产生多价分子;(vii)基于蛋白质激酶a中的“二聚化和对接域”的所谓“对接和锁(dock and lock)”分子,所述二聚化和对接域当应用于fab时可以产生三价双特异性结合蛋白,其由与不同fab片段连接的两个相同fab片段组成;(viii)所谓的scorpion分子,其包含例如与人fab臂的两个末端融合的两个scfv;和(ix)双抗体。
[0106]
在一个实施方案中,本发明的双特异性抗体是双抗体、交叉抗体(cross-body),或通过受控的fab臂交换获得的双特异性抗体(诸如wo2011131746(genmab)中所述)。
[0107]
不同类别的双特异性抗体的实例包括但不限于(i)具有互补ch3域以迫使异源二
聚化的igg样分子;(ii)重组igg样双重靶向分子,其中分子的两侧各含有至少两种不同抗体的fab片段或fab片段的一部分;(iii)igg融合分子,其中全长igg抗体与额外的fab片段或fab片段的一部分融合;(iv)fc融合分子,其中单链fv分子或稳定化的双抗体与重链恒定域、fc区或其部分融合;(v)fab融合分子,其中不同的fab片段融合在一起,融合至重链恒定域、fc区或其部分;(vi)基于scfv的和基于双抗体的重链抗体(例如,域抗体、纳米抗体),其中将不同的单链fv分子或不同的双抗体或不同的重链抗体(例如,域抗体、纳米抗体)彼此融合或者与另一种蛋白质或载体分子融合,所述另一种蛋白质或载体分子与重链恒定域,fc区或其部分融合。
[0108]
具有互补的ch3域分子的igg样分子的实例包括但不限于triomab/quadroma分子(trion pharma/fresenius biotech;roche,wo2011069104)、所谓的杵入臼(knobs-into-holes)分子(genentech,wo9850431)、crossmabs(roche,wo2011117329)和静电匹配分子(amgen,ep1870459和wo2009089004;chugai,us201000155133;oncomed,wo2010129304)、luz-y分子(genentech,wranik et al.j.biol.chem.2012,287(52):43331-9,doi:10.1074/jbc.m112.397869.epub 2012nov 1)、dig-body和pig-body分子(pharmabcine,wo2010134666,wo2014081202)、链交换工程化域抗体(strand exchange engineered domain body,seedbody)分子(emd serono,wo2007110205)、biclonics分子(merus,wo2013157953)、fcδadp分子(regeneron,wo201015792)、双特异性igg1和igg2分子(pfizer/rinat,wo11143545)、azymetric支架分子(zymeworks/merck,wo2012058768)、mab-fv分子(xencor,wo2011028952)、二价双特异性抗体(wo2009080254)和分子(genmab a/s,wo2011131746)。
[0109]
重组igg类双重靶向分子的实例包括但不限于双重靶向(dt)-ig分子(wo2009058383)、二合第一抗体(genentech;bostrom,et al 2009.science 323,1610
–
1614)、交联mabs(karmanos cancer center)、mab2(f-star,wo2008003116)、zybody分子(zyngenia;lafleur et al.mabs.2013mar-apr;5(2):208-18)、用共同轻链的方法(crucell/merus,us7,262,028)、κλbodies(novimmune,wo2012023053)和covx-body(covx/pfizer;doppalapudi,v.r.,et al 2007.bioorg.med.chem.lett.17,501
–
506.)。
[0110]
igg融合分子的实例包括但不限于双重可变域(dvd)-ig分子(abbott,us7,612,181)、双重域双重头抗体(unilever;sanofi aventis,wo20100226923)、igg样双特异性分子(imclone/eli lilly,lewis etal.nat biotechnol.2014feb;32(2):191-8)、ts2ab(medimmune/az;dimasi et al.j mol biol.2009oct30;393(3):672-92)和bsab分子(zymogenetics,wo2010111625)、hercules分子(biogen idec,us007951918)、scfv融合分子(novartis)、scfv融合分子(changzhou adam biotech inc,cn 102250246)和tvab分子(roche,wo2012025525,wo2012025530)。
[0111]
fc融合分子的实例包括但不限于scfv/fc融合物(pearce et al.,biochem mol biol int.1997sep;42(6):1179-88)、scorpion分子(emergent biosolutions/trubion,blankenship jw,et al.aacr 100th annual meeting 2009(abstract#5465);zymogenetics/bms,wo2010111625)、双重亲和再靶向技术(dual affinity retargeting technology)(fc-dart)分子(macrogenics,wo2008157379,wo2010080538)和双重(scfv)2-fab分子(national research center for antibody medicine
–
china)。
[0112]
fab融合双特异性抗体的实例包括但不限于f(ab)2分子(medarex/amgen;deo et al j immunol.1998feb 15;160(4):1677-86.)、dual-action或bis-fab分子(genentech,bostrom,et al 2009.science 323,1610
–
1614.)、对接-和-锁(dnl)分子(immunomedics,wo2003074569,wo2005004809)、二价双特异性分子(biotecnol,schoonjans,j immunol.2000dec 15;165(12):7050-7.)和fab-fv分子(ucb-celltech,wo 2009040562 a1)。
[0113]
基于scfv的抗体、基于双抗体的抗体和域抗体的实例包括但不限于接合剂(bite)分子(micromet,wo2005061547)、串联双抗体分子(tandab)(affimed)le gall et al.,protein eng des sel.2004apr;17(4):357-66.)、双重亲和再靶向技术(dart)分子(macrogenics,wo2008157379,wo2010080538)、单链双抗体分子(lawrence,febs lett.1998apr 3;425(3):479-84)、tcr样抗体(ait,receptorlogics)、人血清白蛋白scfv融合物(merrimack,wo2010059315)和combody分子(epigen biotech,zhu et al.immunol cell biol.2010aug;88(6):667-75.)、双重靶向纳米抗体(dual targeting nanobodies)(ablynx,hmila et al.,faseb j.2010)和双重靶向的仅重链的域抗体。
[0114]
本发明的双特异性抗体可以是任何同种型。示例性同种型包括但不限于人igg1、igg2、igg3和igg4同种型中的任一种。优选地,双特异性抗体可以选择为人igg1同种型,如实施例中所示。可以使用人轻链恒定区κ或λ中的任一种。在一个实施方案中,本发明的抗体的两条重链均属于igg1同种型,例如igg1,κ。在一个实施方案中,双特异性抗体的两条重链分别属于igg1和igg4同种型。优选地,双特异性抗体可以选择为人igg1同种型,如实施例中所示。任选且优选地,所选同种型的重链及其fc序列可以如本文所述在铰链区和/或ch3区进行修饰,以使得能够生成双特异性抗体并引入惰性。
[0115]
在一个方面,本发明的双特异性抗体包含fc区,该fc区包含第一重链和第二重链,该第一重链具有包含第一ch3区的第一fc序列,该第二重链具有包含第二ch3区的第二fc序列,其中第一和第二ch3区的序列不同并且使得所述第一和第二ch3区之间的异二聚体相互作用比所述第一和第二ch3区的同二聚体相互作用中的每一个强。wo2011131746和wo2013060867(genmab)中提供了关于这些相互作用以及如何实现它们的更多细节,其在此通过引用并入。
[0116]
如本文进一步描述的,基于一种b7h4抗体和一种cd3抗体,可以以高产率获得稳定的双特异性cd3xb7h4抗体,每种抗体由两条相同的重链和两条相同的轻链组成,每种抗体仅含有在ch3区域中的少量、相当保守、(不对称)突变。不对称突变是指所述第一和第二ch3区的序列在不同位置含有一个或多个氨基酸取代。
[0117]
能够结合cd3的抗原结合区
[0118]
如所述,本发明提供了根据本发明的抗体,其包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区。此外,本发明提供了根据本发明的抗体,其包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区,其中能够结合cd3的抗原结合区能够结合人cd3ε(epsilon),诸如seq id no:13中指定的人cd3ε(epsilon)。此类抗原结合区能够结合人cd3ε(epsilon),如在t细胞诸如原代人t细胞上存在的。
[0119]
根据本发明的所述抗体可以是包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含
[0120]
重链可变区(vh),其包含seq id no:16或seq id no.17的cdr1、cdr2和cdr3区,以及,任选地,
[0121]
轻链可变区(vl),其包含seq id no:22的cdr1、cdr2和cdr3区。
[0122]
可以使用本领域已知的方法从可变的重链和轻链区鉴定cdr1、cdr2和cdr3区。可以根据imgt注释来自所述可变重链和轻链区的cdr区(参见lefranc mp.et al.,nucleic acids research,27,209-212,1999]and brochet x.nucl.acids res.36,w503-508(2008))。因此,还公开了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含
[0123]
重链可变区(vh),其包含分别为seq id no:18、19和20或18、19和21的cdr1、cdr2和cdr3序列;以及,任选地
[0124]
轻链可变区(vl),其包含分别为seq id no:23、gtn和24的cdr1、cdr2和cdr3序列。
[0125]
进一步公开了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含
[0126]
重链可变区(vh),其包含seq id no:16的序列,或与seq id no:16的序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性的序列;以及,任选地
[0127]
轻链可变区(vl),其包含seq id no:22的序列,或与seq id no:22的序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的序列。
[0128]
此类能够结合人cd3的抗原结合区已经在例如wo2015001085和wo2017009442中进行了描述。能够结合人cd3的另外的抗原结合区在wo2015001085和wo2017009442中公开和描述,其可以进一步考虑并充当生成根据本发明的抗体的基础,其通过引用并入本文。
[0129]
根据本发明的所述抗体可以是与人cd3结合的抗原结合区和人cd3之间的平衡解离常数kd在1-1000nm的范围内。
[0130]
根据本发明的所述抗体可以在结合人cd3的抗原结合区和人cd3之间以平衡解离常数kd结合,该kd在1-100nm的范围内,诸如在5-100nm的范围内、在10-100nm的范围内、在1-80nm的范围内、在1-60nm的范围内、在1-40nm的范围内、在1-20nm的范围内、在5-80nm的范围内、在5-60nm的范围内、在5-40nm的范围内、在5-20nm的范围内、在10-80nm的范围内、在10-60nm的范围内、在10-40nm的范围内,或诸如在10-20nm的范围内。示例性且合适的抗原结合区包含seq id no:16的重链可变区(vh)和seq id no:22的轻链可变区(vl)区。此类可变区已在例如wo2015001085中描述。
[0131]
在本发明的另一个方面,所述抗体对人cd3ε的结合亲和力低于具有抗原结合区的抗体,该抗原结合区包含如seq id no:16中所列的vh序列和如seq id no:22中所列的vl序列,优选地其中所述亲和力低至少5倍,诸如低至少10倍,例如低至少20倍、低至少30倍、低至少40倍、低至少45倍或诸如低至少50倍。
[0132]
在本发明的另一个方面,所述抗体可以在结合人cd3的抗原结合区和人cd3抗原之间以平衡解离常数kd结合,该kd在200-1000nm的范围内,诸如在300-1000nm的范围内、在400-1000nm的范围内、在500-1000nm的范围内、在300-900nm的范围内、在400-900nm的范围内、在400-700nm的范围内、在500-900nm的范围内、在500-800nm的范围内、在500-700nm的范围内、在600-1000nm的范围内、在600-900nm的范围内、在600-800nm的范围内,或诸如在600-700nm的范围内。示例性且合适的抗原结合区包含seq id no:16或seq id no.17的重
链可变区(vh),以及seq id no:22的轻链可变区(vl)区。此类可变区已在例如wo2017009442中描述。
[0133]
所述结合亲和力可以通过生物层干涉测量法测定,任选地如本文实施例4中所述。因此,如本文所定义的对人cd3具有结合亲和力的根据本发明的抗体可以具有使用包括以下步骤的生物层干涉测量法测定的结合亲和力:
[0134]
i)将抗体以1μg/ml的量在抗人igg fc捕捉生物传感器上固定化600秒;
[0135]
ii)使用范围为1.40nm至1000nm的3倍稀释系列,测定人重组可溶性cd3ε(cd3e27-gska)(seq id no:13的成熟蛋白)在1000秒的时间段内的缔合和2000秒的时间段内的解离。
[0136]
iii)相对于缓冲液对照(0nm)参考数据。
[0137]
此外,所述结合亲和力可以使用抗体诸如单特异性二价抗体,诸如为全长igg1的抗体来测定。
[0138]
因此,在进一步的实施方案中,根据本发明的抗体是抗体,其中
[0139]
结合cd3的抗原结合区包含如本文所定义的重链可变(vh)区,其包含cdr1序列、cdr2序列和cdr3序列,当与包含seq id no:16中所列的序列的重链可变(vh)区相比时,具有在选自下组的位置处的氨基酸取代:t31、n57、h101、g105、s110和y114,该位置根据seq id no:16的序列编号;并且
[0140]
野生型轻链可变(vl)区包含分别在seq id no:23、gtn和seq id no:24中列出的cdr1、cdr2和cdr3序列。
[0141]
特别地,根据本发明的抗体是其中结合cd3的抗原结合区在本文定义的重链可变(vh)区中包含选自下组的取代的抗体:t31m、t31p、n57e、h101g、h101n、g105p、s110a、s110g、y114m、y114r、y114v。
[0142]
此外,根据本发明的抗体是抗体,其中结合cd3的抗原结合区包含如本文所定义的重链可变区,在氨基酸位置31处具有m或p,或在氨基酸位置57处具有e,或在氨基酸位置101处具有g或n,或在氨基酸位置105处具有p,或在氨基酸位置110处具有a或g,或在氨基酸位置114处具有m、r或v,所述位置与具有seq id no:16中所列序列的重链可变(vh)区的氨基酸位置编号相对应。
[0143]
更进一步,根据本发明的抗体是抗体,其中如本文所定义的结合cd3的抗原结合区的重链可变(vh)区的cdr1、cdr2和cdr3,当与seq id no:16的序列的cdr1、cdr2和cdr3相比时,总共包含最多1、2、3、4或5个氨基酸取代,所述氨基酸取代优选包括如上定义的氨基酸取代。
[0144]
能够结合b7h4的抗原结合区
[0145]
特别地,本发明提供了根据本发明的抗体,其包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区,其中所述人b7h4是seq id no.1的人b7h4。优选地,根据本发明的所述抗体包含如seq id no:13中指定的能够结合人cd3ε(epsilon)的抗原结合区,以及能够结合seq id no:1的人b7h4的抗原结合区。
[0146]
特别地,根据本发明的抗体是其中所述能够结合人b7h4的抗原结合区能够结合人b7h4的细胞外域的抗体。优选地,所述b7h4在细胞上,更优选在人细胞上表达。
[0147]
在进一步的实施方案中,根据本发明的抗体是其中所述能够结合人b7h4的抗原结
合区能够结合人b7h4的igc样恒定区的抗体。在另一个进一步的实施方案中,根据本发明的抗体是其中所述能够结合人b7h4的抗原结合区能够结合b7h3-igv/b7h4-igc的抗体。b7h3-igv/b7h4-igc代表人b7h3和b7h4之间的融合物,其中b7h3 igv样域与b7h4 igc样域融合,对应于seq id no.11。所述b7h3-igv/b7h4-igc由诸如本文实施例7中所述的细胞表达。在又进一步的实施方案中,根据本发明的抗体是其中所述能够结合人b7h4的抗原结合区不能结合b7h4-igv/b7h3-igc的抗体。b7h4-igv/b7h3-igc代表人b7h3和b7h4之间的融合物,其中b7h4 igv样域与b7h3 igc样域融合,对应于seq id no.10。所述b7h4-igv/b7h3-igc由诸如本文实施例7中所述的细胞表达。
[0148]
如本文所述的根据本发明考虑的合适的能够结合人b7h4的抗原结合区包含:
[0149]
a)可变重链(vh)区,其包含seq id no.25的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0150]
b)可变重链(vh)区,其包含seq id no.29的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0151]
c)可变重链(vh)区,其包含seq id no.36的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.40的cdr1、cdr2和cdr3区;
[0152]
d)可变重链(vh)区,其包含seq id no.43的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.47的cdr1、cdr2和cdr3区;
[0153]
e)可变重链(vh)区,其包含seq id no.50的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.54的cdr1、cdr2和cdr3区;或者
[0154]
f)可变重链(vh)区,其包含seq id no.31的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区。
[0155]
g)可变重链(vh)区,其包含seq id no.65的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.69的cdr1、cdr2和cdr3区。
[0156]
可以使用本领域已知的方法从可变重链和轻链区鉴定cdr1、cdr2和cdr3区。可以根据imgt注释来自所述可变重链和轻链区的cdr区(参见lefranc mp.et al.,nucleic acids research,27,209-212,1999]和brochet x.nucl.acids res.36,w503-508(2008))。因此,如本文所述的根据本发明考虑的合适的能够结合人b7h4的抗原结合区包含:
[0157]
a)重链可变区(vh),其包含分别为seq id no.26、27和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0158]
b)重链可变区(vh),其包含分别为seq id no.26、30和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0159]
c)重链可变区(vh),其包含分别为seq id no.37、38和39的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.41、dts和seq id no.42的cdr1、cdr2和cdr3;
[0160]
d)重链可变区(vh),其包含分别为seq id no.44、45和46的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.48、yts和seq id no.49的cdr1、cdr2和cdr3;
[0161]
e)重链可变区(vh),其包含分别为seq id no.51、52和53的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.55、gas和seq id no.56的cdr1、cdr2和cdr3;或者
[0162]
f)重链可变区(vh),其包含分别为seq id no.26、32和28的cdr1、cdr2和cdr3区,
以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3
[0163]
g)重链可变区(vh),其包含分别为seq id no.66、67和68的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.70、gas和seq id no.71的cdr1、cdr2和cdr3。
[0164]
如本文所述的根据本发明考虑的更进一步合适的能够结合人b7h4的抗原结合区包含:
[0165]
a)seq id no.25的可变重链(vh)区和seq id no.33的可变轻链区;
[0166]
b)seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;
[0167]
c)seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区;
[0168]
d)seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0169]
e)seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区;或者
[0170]
f)seq id no.31的可变重链(vh)区和seq id no.33的可变轻链区
[0171]
g)seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区。
[0172]
任选地,所述结合b7h4的抗原结合区包含与以下具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性的重链和轻链可变区(vh):
[0173]
a)seq id no.25的可变重链(vh)区和seq id no.33的可变轻链区;
[0174]
b)seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;
[0175]
c)seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区;
[0176]
d)seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0177]
e)seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区;或者
[0178]
f)seq id no.31的可变重链(vh)区和seq id no.33的可变轻链区
[0179]
g)seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区。
[0180]
根据本发明的抗体可以具有能够结合b7h4的抗原结合区,其对b7h4具有对应于5e-7m或更小,诸如1e-7m或更小的kd值的结合亲和性,诸如具有对应于在5e-7至2e-10m的范围内,诸如在2e-7到1e-10m或1e-7到5e-9m的范围内的kd值的结合亲和力。
[0181]
所述结合亲和力可以通过生物层干涉测量法测定,任选地如本文实施例3中所述。因此,对如本文所定义的人b7h4具有结合亲和力的根据本发明的抗体可以具有使用包括以下步骤的生物层干涉测量法测定的结合亲和力:
[0182]
i)将抗体以1μg/ml的量在抗人igg fc捕捉生物传感器上固定化600秒;
[0183]
ii)使用范围为1.56nm至100nm的2倍稀释系列,测定人重组带his标签的b7h4蛋白(sino biological目录号10738-h08h;由编码具有c端多组氨酸标签的人vtcn1(uniprot登录号q7z7d3)(phe29-ala258)的dna序列的构建体表达的蛋白质)在300秒的时间段内的缔合和1000秒的时间段内的解离。
[0184]
iii)相对于缓冲液对照(0nm)参考数据。
[0185]
此外,所述结合亲和力可以使用抗体诸如单特异性二价抗体,诸如为全长igg1的抗体来测定。
[0186]
在进一步的实施方案中,提供了根据本发明的抗体,其包含能够结合人b7h4的抗原区,其中所述抗原结合区能够交叉阻断:
[0187]
抗体,其包含seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;和
[0188]
抗体,其包含seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区;和
[0189]
其中所述抗原结合区不能交叉阻断
[0190]
抗体,其包含seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0191]
抗体,其包含seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区;和
[0192]
抗体,其包含seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区。
[0193]
在又一个进一步的实施方案中,根据本发明的所述抗体包含能够结合人b7h4的抗原区,所述抗原结合区能够交叉阻断
[0194]
抗体,其包含seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0195]
抗体,其包含seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区,和
[0196]
抗体,其包含seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区;
[0197]
并且其中所述抗原结合区不能交叉阻断抗体,所述抗体包括
[0198]
抗体,其包含seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;和
[0199]
抗体,其包含seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区。
[0200]
特别地,“交叉阻断”或根据本发明的抗体阻断另一种抗体与b7h4结合的能力被定义为与b7h4结合的第一抗体阻断第二抗体对与第一抗体结合的b7h4结合的能力。可以使用如实施例5中描述的测定法来确定交叉阻断。此类交叉阻断也可以例如在包括以下步骤的规程中确定:
[0201]
i)提供一组样品,每个样品包含与b7h4结合的抗体;
[0202]
ii)将来自该组样品的第一抗体以20μg/ml的量在胺反应性第二代生物传感器(ar2g)上固定化600秒;
[0203]
iii)用人b7h4的固定化抗体加载arg2生物传感器(100nm人重组带his标签的b7h4蛋白(sino biological目录号10738-h08h;由编码具有c端多组氨酸标签的人vtcn1(uniprot登录号q7z7d3)(phe29-ala258)的dna序列构建体表达的蛋白质)
[0204]
iv)以10μg/ml的量确定来自该组样品的第二抗体的缔合300秒。
[0205]
当第二抗体不能缔合时,认为第一抗体交叉阻断第二抗体。技术人员将熟悉用于确定抗体交叉阻断另第一抗体对其靶物结合的能力的合适技术,本技术公开了适用于确定结合和置换的阻断的规程。在进一步的实施方案中,如本文所述的交叉阻断如实施例5中所述确定。
[0206]
在进一步的实施方案中,根据本发明的抗体具有能够结合人b7h4的抗原结合区,其符合如上所述的交叉阻断特征,其中所述能够结合人b7h4的抗原结合区能够结合b7h3-igv/b7h4-igc(seq id no.11),并且任选地不能够结合b7h4-igv/b7h3-igc(seq id no.10)。
[0207]
cd3和b7h4抗原结合区组合
[0208]
本发明进一步提供了根据本发明的抗体,其包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区,其中结合cd3的抗原结合区包含
[0209]
重链可变区(vh),其包含seq id no:16的cdr1、cdr2和cdr3区的,以及轻链可变区(vl),其包含seq id no:22的cdr1、cdr2和cdr3区。并且
[0210]
其中能够结合b7h4的抗原结合区包括:
[0211]
a)可变重链(vh)区,其包含seq id no.25的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0212]
b)可变重链(vh)区,其包含seq id no.29的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0213]
c)可变重链(vh)区,其包含seq id no.36的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.40的cdr1、cdr2和cdr3区;
[0214]
d)可变重链(vh)区,包含seq id no.43的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.47的cdr1、cdr2和cdr3区的;
[0215]
e)可变重链(vh)区,其包含seq id no.50的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.54的cdr1、cdr2和cdr3区;或者
[0216]
f)可变重链(vh)区,其包含seq id no.31的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区
[0217]
g)可变重链(vh)区,其包含seq id no.65的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.69的cdr1、cdr2和cdr3区。
[0218]
本发明进一步提供根据本发明的抗体可以是包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含
[0219]
重链可变区(vh),其包含seq id no.17的cdr1、cdr2和cdr3区,以及轻链可变区(vl),其包含seq id no:22的cdr1、cdr2和cdr3区。并且
[0220]
其中能够结合b7h4的抗原结合区包括:
[0221]
a)可变重链(vh)区,其包含seq id no.25的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0222]
b)可变重链(vh)区,其包含seq id no.29的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0223]
c)可变重链(vh)区,其包含seq id no.36的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.40的cdr1、cdr2和cdr3区;
[0224]
d)可变重链(vh)区,其包含seq id no.43的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.47的cdr1、cdr2和cdr3区;
[0225]
e)可变重链(vh)区,其包含seq id no.50的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.54的cdr1、cdr2和cdr3区;或者
[0226]
f)可变重链(vh)区,其包含seq id no.31的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区
[0227]
g)可变重链(vh)区,其包含seq id no.65的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.69的cdr1、cdr2和cdr3区。
[0228]
此外,本发明进一步提供了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中能够结合cd3的抗原结合区包含:
[0229]
重链可变区(vh),其包含分别为seq id no:18、19和20的cdr1、cdr2和cdr3序列;以及轻链可变区(vl),其包含分别为seq id no:23、gtn和24的cdr1、cdr2和cdr3序列;并且
[0230]
其中能够结合b7h4的抗原结合区包含:
[0231]
a)可变重链(vh)区,其包含分别为seq id no.:26、27和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0232]
b)可变重链(vh)区,其包含分别为seq id no.26、30和28的cdr1、cdr2和cdr3区,
以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0233]
c)可变重链(vh)区,其包含分别为seq id no.37、38和39的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.41、dts和seq id no.42的cdr1、cdr2和cdr3;
[0234]
d)可变重链(vh)区,其包含分别为seq id no.44、45和46的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.48、yts和seq id no.49的cdr1、cdr2和cdr3;
[0235]
e)可变重链(vh)区,其包含分别为seq id no.51、52和53的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.55、gas和seq id no.56的cdr1、cdr2和cdr3;或者
[0236]
f)可变重链(vh)区,其包含分别为seq id no.26、32和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3
[0237]
g)可变重链(vh)区,其包含分别为seq id no.66、67和68的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.70、gas和seq id no.71的cdr1、cdr2和cdr3。
[0238]
本发明还提供了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区抗体,其中能够结合cd3的抗原结合区包含:
[0239]
重链可变区(vh),其包含分别为seq id no:18、19和21的cdr1、cdr2和cdr3序列;以及轻链可变区(vl),其包含分别为seq id no:23、gtn和24的cdr1、cdr2和cdr3序列;并且
[0240]
其中能够结合b7h4的抗原结合区包含:
[0241]
a)可变重链(vh)区,其包含分别为seq id no.26、27和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0242]
b)可变重链(vh)区,其包含分别为seq id no.26、30和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0243]
c)可变重链(vh)区,其包含分别为seq id no.37、38和39的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.41、dts和seq id no.42的cdr1、cdr2和cdr3;
[0244]
d)可变重链(vh)区,其包含分别为seq id no.44、45和46的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.48、yts和seq id no.49的cdr1、cdr2和cdr3;
[0245]
e)可变重链(vh)区,其包含分别为seq id no.51、52和53的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.55、gas和seq id no.56的cdr1、cdr2和cdr3;或者
[0246]
f)可变重链(vh)区,其包含分别为seq id no.26、32和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3
[0247]
g)可变重链(vh)区,其包含分别为seq id no.66、67和68的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.70、gas和seq id no.71的cdr1、cdr2和cdr3。
[0248]
进一步公开了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含:
[0249]
包含seq id no:16的序列的重链可变区(vh)和包含seq id no:22的序列的轻链可变区(vl);并且
[0250]
其中能够结合b7h4的抗原结合区包含结合b7h4的抗原结合区,其包含具有以下的重链和轻链可变区(vh):
[0251]
a)seq id no.25的可变重链(vh)区和seq id no.33的可变轻链区;
[0252]
b)seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;
[0253]
c)seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区;
[0254]
d)seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0255]
e)seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区;或者
[0256]
f)seq id no.31的可变重链(vh)区和seq id no.33的可变轻链区
[0257]
g)seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区。
[0258]
还进一步公开了包含能够结合人b7h4的抗原结合区和能够结合人cd3的抗原结合区的抗体,其中结合cd3的抗原结合区包含:
[0259]
包含seq id no:17的序列的重链可变区(vh)和包含seq id no:22的序列的轻链可变区(vl);和并且
[0260]
其中能够结合b7h4的抗原结合区包含具有以下的抗原结合重链和轻链可变区(vh):
[0261]
a)seq id no.25的可变重链(vh)区和seq id no.33的可变轻链区;
[0262]
b)seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;
[0263]
c)seq id no.36的可变重链(vh)区和seq id no.40的可变轻链区;
[0264]
d)seq id no.43的可变重链(vh)区和seq id no.47的可变轻链区;
[0265]
e)seq id no.50的可变重链(vh)区和seq id no.54的可变轻链区;或者
[0266]
f)seq id no.31的可变重链(vh)区和seq id no.33的可变轻链区
[0267]
g)seq id no.65的可变重链(vh)区和seq id no.69的可变轻链区。
[0268]
在进一步的实施方案中,在此类双特异性抗体中,所述能够结合人b7h4的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区并且所述轻链包含所述vl区和κ轻链恒定区;并且其中所述能够结合人cd3的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区并且所述轻链包含所述vl区和λ轻链恒定区。更优选地,在此类双特异性抗体中,一个igg1重链恒定区如seq id no.60中所定义并且另一个如seq id no.61中所定义,并且其中所述κ轻链恒定区如seq id no.63中所定义以及所述λ轻链恒定区如seq id no.64中所定义。应理解,任选地,所述igg1重链恒定区如seq id no.60和61中所定义,可以删除末端赖氨酸。
[0269]
如本领域技术人员所熟知的,抗体的每个抗原结合区通常包含重链可变区(vh)和轻链可变区(vl),并且可变区中的每一个包含三个cdr序列,分别为cdr1、cdr2和cdr3,并且可以包含四个框架序列,分别为fr1、fr2、fr3和fr4。抗体的每个抗原结合区通常可以包含重链可变区(vh)和轻链可变区(vl),并且可变区中的每一个包含三个cdr序列,分别为cdr1、cdr2和cdr3,并且可以包括四个人框架序列,分别为fr1、fr2、fr3和fr4。该结构优选地也存在于根据本发明的抗体中。此外,根据本发明的抗体可以包含两个重链恒定区(ch)和两个轻链恒定区(cl)。恒定区的实例.提供在例如seq id no.57-64中。
[0270]
在特定的实施方案中,根据本发明的抗体包含第一和第二重链,如第一和第二重链,其各自至少包含铰链区、ch2和ch3区。可以例如通过如wo2008/119353和wo 2011/131746中提供的所谓fab臂交换,基于两个同源二聚体起始蛋白以高产量获得稳定的异源二聚体抗体,所述同源二聚体起始蛋白仅在ch3区中含有几个不对称突变。因此,在本发明的一些实施方案中,抗体包含第一重链,其中与选自人igg1重链中t366、l368、k370、d399、
f405、y407和k409的位置相对应的位置处的至少一个氨基酸已被取代,和第二重链,其中与选自人igg1重链中t366、l368、k370、d399、f405、y407和k409的位置相对应的位置中的至少一个氨基酸已被取代,其中所述第一和所述第二重链的所述取代不在同一位置中,并且其中所述氨基酸位置根据eu编号进行编号。例如,具有此类取代的恒定域提供在例如seq id no.58和62中,其可以与不具有此类取代的seq id no.57进行比较。
[0271]
如本文所用,术语“与位置相对应的氨基酸”是指人igg1重链中的氨基酸位置编号。通过与人igg1比对,可以发现其他免疫球蛋白中相对应的氨基酸位置。除非另有说明或与上下文相矛盾,否则本文中恒定区序列的氨基酸根据eu编号索引进行编号(描述于kabat,e.a.et al.,1991,sequences of proteins of immunological interest.5th edition-us department of health and human services,nih publication no.91-3242,pp 662,680,689)。因此,“对应于”另一序列中的氨基酸或区段的一个序列中的氨基酸或区段是使用标准序列比对程序(诸如align、clustalw或类似程序,通常在默认设置)与其他氨基酸或区段比对,并且与人igg1重链具有至少50%、至少80%、至少90%或至少95%同一性的氨基酸或区段。如何比对序列或序列中的区段并由此确定序列中与根据本发明的氨基酸位置相对应的位置在本领域中被认为是众所周知的。
[0272]
在特定的实施方案中,本发明提供了抗体,其中与人igg1重链中的k409相对应的位置中的氨基酸在所述第一重链中为r,而与人igg1重链中的f405相对应的位置中的氨基酸在所述第二条重链中为l,反之亦然。
[0273]
在一些实施方案中,根据本发明的抗体除抗原结合区之外还包含具有两条重链的fc序列的fc区。第一和第二fc序列可以各自具有任何同种型,包括任何人同种型,诸如igg1、igg2、igg3、igg4、ige、igd、igm或iga同种型或混合同种型。优选地,fc区是人igg1、igg2、igg3、igg4同种型或混合同种型,诸如人igg1同种型。在一些实施方案中,优选根据本发明的抗体是全长抗体,最优选它是igg1型的。
[0274]
根据本发明的抗体可以在fc区中包含修饰以使抗体成为惰性或非活化抗体。因此,在本文公开的抗体中,可以修饰一条或两条重链,使得相对于除了包含未修饰的第一和第二重链之外相同的抗体,抗体在更小程度上诱导fc介导的效应物功能。可以通过测定t细胞上的fc介导的cd69表达(即,由于cd3抗体介导的、fcγ受体依赖性的cd3交联而产生的cd69表达),通过与fcγ受体结合,通过与c1q结合,或通过诱导fc介导的fcγr交联来测量fc介导的效应物功能。特别地,可以修饰重链恒定序列,使得在与野生型(未修饰的)抗体相比时,将fc介导的cd69表达降低至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中在基于pbmc的功能测定法中测定所述fc介导的cd69表达,例如,如wo2015001085的实施例3中所述。重链和轻链恒定序列的修饰也可以导致c1q与所述抗体的结合减少。与未修饰的抗体相比,可以减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,并且可以通过elisa测定c1q结合。此外,可以修饰fc区,使得与未修饰的抗体相比,所述抗体介导降低至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%的fc介导的t细胞增殖,其中在基于pbmc的功能测定中测量所述t细胞增殖。
[0275]
已经开发了多种不同的非活化抗体格式,其中氨基酸取代及其组合已被引入igg1同种型抗体的恒定重链区以消除fc介导的效应物功能(例如chiu et al.,antibodies 2019dec;8(4):55;liu et al.,antibodies,2020nov 17;9(4):64;29(10):457-66;
shields et al.,j biol chem,.2001mar 2;276(9):6591-604)。
[0276]
可以被修饰的氨基酸位置(例如igg1同种型抗体中)的实例包括位置l234和l235。因此,根据本发明的抗体可以包含第一和第二重链,并且其中在所述第一和第二重链两者中,与根据eu编号的人igg1重链中的位置l234和l235相对应的位置处的氨基酸残基分别为f和e。据了解,除了氨基酸位置l234和l235的修饰,可以修饰进一步的位置。
[0277]
另外,d265a氨基酸取代可以减少与所有fcγ受体的结合并防止adcc(shields et al.,2001,j.biol.chem.(276):6591-604)。因此,根据本发明的抗体可以包含第一和第二重链,其中在第一和第二重链两者中,与根据eu编号的人igg1重链中的位置d265对应的位置处的氨基酸残基是a。本发明的进一步的实施方案提供了抗体,其中在所述第一和第二重链的至少一个中,例如在两者中,在与人igg1重链中的位置l234、l235和d265相对应的位置中的氨基酸分别是f、e和a。在本技术中,具有三个氨基酸取代l234f、l235e和d265a的组合和另外上文公开的k409r或f405l突变的抗体可以分别以后缀“fear”或“feal”称谓。
[0278]
野生型igg1重链恒定区的氨基酸序列在本文中被鉴定为seq id no:57。与以上公开的实施方案一致,本发明的抗体可以包含携带f405l取代的igg1重链恒定区并且可以具有seq id no:58中所列的氨基酸序列和/或携带k409r取代的igg1重链恒定区并且可以具有seq id no:62中所列的氨基酸序列。
[0279]
携带l234f、l235e和d265a取代的igg1重链恒定区的氨基酸序列在本文中被鉴定为seq id no:59。携带l234f、l235e、d265a和f405l取代的igg1重链恒定区的氨基酸序列在本文中鉴定为seq id no:60。携带l234f、l235e、d265a和k409r取代的igg1重链恒定区的氨基酸序列在本文中鉴定为seq id no:61。
[0280]
seq id no.57-62中列出的恒定区序列列出了末端赖氨酸(k),此类序列用于本文的实施例部分。该赖氨酸的来源是在人中发现的天然存在的序列,这些fc区衍生自该序列。在重组抗体的细胞培养生产过程中,该末端赖氨酸可以通过内源性羧肽酶的蛋白水解被裂解出,导致具有相同序列但缺少c端赖氨酸的恒定区。出于制造抗体的目的,编码该末端赖氨酸的dna可以从序列中省略,从而产生没有赖氨酸的抗体。从编码或不编码末端赖氨酸的核酸序列产生的抗体在序列和功能上基本上相同,因为在例如使用在基于cho的生产系统中生产的抗体时,末端赖氨酸的加工程度通常很高(dick,l.w.et al.biotechnol.bioeng.2008;100:1132
–
1143)。因此,应当理解,根据本发明的抗体可以在不编码或不具有诸如本文所列的末端赖氨酸的情况下生成。出于制造目的,因此可以在没有末端赖氨酸的情况下生成抗体。
[0281]
本发明还提供了抗体,其中
[0282]
a)能够结合b7h4的抗原结合区是人的,并且
[0283]
b)能够结合cd3的抗原结合区是人源化的。
[0284]
此外,本发明提供了抗体,其中
[0285]
a)能够结合b7h4的抗原结合区是人的,和/或
[0286]
能够结合cd3的抗原结合区是人源化的
[0287]
在本发明的一些实施方案中,抗体包含kappa(κ)轻链。在本发明特定实施方案中关于双特异性抗体的序列,kappa轻链包含如上文公开的b7h4抗体轻链的cdr1、-2和-3序列。
[0288]
在本发明的进一步实施方案中,根据前述权利要求中任一项的抗体,其中所述抗体包含lambda(λ)轻链。在关于双特异性抗体的本发明的特定实施方案中,lambda轻链包含如上文公开的cd3抗体轻链的cdr1,-2和-3序列,特别是如上文公开的对cd3具有降低的亲和力的cd3抗体的cdr1,-2和-3序列。在本文中作为seq id no:63包括kappa轻链恒定区的氨基酸序列,并且在本文中作为seq id no:64包括lambda轻链恒定区。
[0289]
在特定的实施方案中,抗体包含lambda(λ)轻链和kappa(κ)轻链;例如抗体,其具有包含能够结合cd3的结合区的重链和lambda轻链;以及包含能够结合b7h4的结合区的重链和kappa轻链。
[0290]
因此,在进一步的实施方案中,在如本文所定义的双特异性抗体中,所述能够结合人b7h4的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区并且所述轻链包含所述vl区和κ轻链恒定区;并且所述能够结合人cd3的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区并且所述轻链包含所述vl区和λ轻链恒定区地区。更优选地,在所述双特异性抗体中,一个igg1重链恒定区如seq id no.60中所定义和另一个如seq id no.61中所定义,并且所述κ轻链恒定区如seq id no.63中所定义以及所述λ轻链恒定区如seq id no.64中所定义。应当理解,如seq id no.60和61中所定义的所述igg1重链恒定区可能删除其末端赖氨酸。结合、细胞毒性和t细胞活化
[0291]
如本文所述的可以结合人cd3和人b7h4的抗体,诸如双特异性抗体,可以有利地将t细胞靶向表达人b7h4的癌细胞,从而诱导所述癌细胞的t细胞介导的杀伤。通过在此类抗体中具有降低或惰性的fc功能,如实施例部分所示,可以将安全、有效和足够的抗体施用于人患者,同时针对b7h4表达水平不同的多种多样的癌症有效。
[0292]
如所述,优选地,根据本发明的抗体缺乏或具有降低的fc介导的效应物功能,并且此外,该抗体:
[0293]
a)如本文实施例9和10中所述,能够结合表达b7h4的人肿瘤细胞,
[0294]
b)当如本文实施例11和12中所述进行测定时,在使用例如pbmc或t细胞作为效应细胞时,在表达b7h4的人肿瘤细胞中介导浓度依赖性细胞毒性,
[0295]
c)当如本文实施例11和12中所述进行测定时,在使用例如pbmc或t细胞作为效应细胞时,能够在选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3、hcc1954和nci-h1650的一种或多种表达人b7h4的肿瘤细胞系中介导浓度依赖性细胞毒性,
[0296]
d)在表达b7h4的人肿瘤细胞的存在下,能够在体外激活t细胞;例如当如本文实施例13所述进行测定时,
[0297]
e)在选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3、hcc1954和nci-h1650的一种或多种表达b7h4的人肿瘤细胞系的存在下,能够在体外激活t细胞;例如当如本文实施例13所述进行测定时,
[0298]
f)能够诱导表达b7h4的人肿瘤细胞的细胞毒性;例如当如本文实施例11和12中所述进行测定时,和/或
[0299]
g)能够在选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3、hcc1954和nci-h1650的一种或多种表达b7h4的人肿瘤细胞系中诱导t细胞介导的细胞毒性;例如当如本文实施例11和12中所述进行测定时。
[0300]
此外,根据本发明的抗体可以缺乏或具有降低的fc介导的效应物功能,并且还能
够诱导t细胞介导的细胞毒性抗体,其中细胞毒性在体外ic50测定法中评估,其包括:
[0301]
i)提供来自健康人供体血沉棕黄层的分离的外周血单个核细胞(pbmc)或纯化的t细胞,
[0302]
ii)提供表达b7h4的肿瘤细胞,诸如选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3、hcc1954和nci-h1650的表达人b7h4的肿瘤细胞系;
[0303]
iii)将所述pbmc或所述纯化的t细胞与所述表达b7h4的肿瘤细胞的多个样品组合,其中来自所述pbmc的t细胞或所述纯化的t细胞与所选的肿瘤细胞的数量的比率为8:1;
[0304]
iv)以稀释系列向所述样品提供所述抗体,范围为例如0.0128ng/ml至10,000ng/ml用于所选的表达人b7h4的肿瘤细胞,和
[0305]
v)温育步骤iv)中获得的样品,例如在37℃下72小时;并且随后,
[0306]
vi)评估表达b7h4的肿瘤细胞的存活力,
[0307]
vii)测定每个稀释样品的活细胞百分比,和
[0308]
viii)测定ic50。
[0309]
除了分离的外周血单个核细胞(pbmc),还可以在步骤i)中提供纯化的t细胞。
[0310]
因此,该抗体可以具有在0.001-2微克/ml范围内的ic50,其中ic50在体外细胞毒性测定法中测定,其包括以下步骤:
[0311]
i)提供来自健康的人供体血沉棕黄层分离的外周血单个核细胞(pbmc),
[0312]
ii)提供表达b7h4的肿瘤细胞,诸如选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3和hcc1954的表达人b7h4的肿瘤细胞系;
[0313]
iii)将所述pbmc与所述表达b7h4的肿瘤细胞的多个样品组合,其中来自所述pbmc的t细胞与所选肿瘤细胞的数量的比率为8:1;
[0314]
iv)以稀释系列向所述样品提供所述抗体,范围为例如0.0128ng/ml至10,000ng/ml用于所选的表达人b7h4的肿瘤细胞,和
[0315]
v)温育步骤iv)中获得的样品,例如在37℃下72小时;并且随后,
[0316]
vi)评估表达b7h4的肿瘤细胞的存活力,
[0317]
vii)测定每个稀释样品的活细胞的百分比,和
[0318]
viii)测定ic50。
[0319]
因此,该抗体可以具有0.001-5微克/ml范围内的ic50,其中ic50在体外细胞毒性测定法中测定,其包括以下步骤:
[0320]
i)提供来自健康人供体血沉棕黄层的分离的外周血单个核细胞(pbmc)或纯化的t细胞,
[0321]
ii)提供表达b7h4的肿瘤细胞,诸如选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3、hcc1954和nci-h1650的表达人b7h4的肿瘤细胞系;
[0322]
iii)将所述pbmc或所述纯化的t细胞与所述表达b7h4的肿瘤细胞的多个样品组合,其中来自所述pbmc的t细胞或所述纯化的t细胞与所选的肿瘤细胞的数量的比率为8:1;
[0323]
iv)以稀释系列向所述样品提供所述抗体,范围为例如0.0128ng/ml至10,000ng/ml用于所选的表达人b7h4的肿瘤细胞,和
[0324]
v)温育步骤iv)中获得的样品,例如在37℃下72小时;并且随后,
[0325]
vi)评估表达b7h4的肿瘤细胞的处活力,
[0326]
vii)测定每个稀释样品的活细胞的百分比,和
[0327]
viii)测定ic50。
[0328]
在一个实施方案中,根据本发明的抗体可以具有在0.001-5微克/ml范围内的ic50。在一个实施方案中,根据本发明的抗体可以具有在0.001-2微克/ml范围内的ic50。在另一个实施方案中,根据本发明的抗体可以具有在0.001-0.03微克/ml范围内的ic50。在又进一步的实施方案中,ic50可以在0.05-2微克/ml的范围内。在又一个进一步的实施方案中,ic50可以在0.05-5微克/ml的范围内。所述ic50可以使用诸如实施例12中描述的方法来测定。
[0329]
在进一步的实施方案中,根据本发明的抗体介导t细胞活化的能力在体外测定法中测定,其包括以下步骤:
[0330]
i)提供来自健康的人供体血沉棕黄层分离的外周血单个核细胞(pbmc),ii)提供表达b7h4的肿瘤细胞;
[0331]
iii)将pbmc和多个样品中的表达b7h4的肿瘤细胞组合,其中pbmc与肿瘤细胞的数量的比率为8:1;
[0332]
iv)以稀释系列向所述样品提供所述抗体,范围为例如0.0128ng/ml至10,000ng/ml,和
[0333]
v)温育样品,例如在37℃下72小时;和
[0334]
vi)随后检测细胞因子。
[0335]
可以例如检测到的示例性细胞因子可以是例如ifn-γ,例如在实施例13中描述。优选地,表达b7h4的肿瘤细胞是表达人b7h4的肿瘤,诸如原发性肿瘤,或选自mcf-7、mda-mb-468、sk-br3、nih-ovcar-3和hcc1954的肿瘤细胞系。
[0336]
b7h4抗体
[0337]
在另一个实施方案中,提供了包含能够结合人b7h4的抗原结合区的抗体,其中所述能够结合人b7h4的抗原结合区包含:
[0338]
a)可变重链(vh)区,其包含seq id no.25的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0339]
b)可变重链(vh)区,其包含seq id no.29的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0340]
c)可变重链(vh)区,其包含seq id no.31的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.33的cdr1、cdr2和cdr3区;
[0341]
d)可变重链(vh)区,其包含分别为seq id no.26、27和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0342]
e)可变重链(vh)区,其包含分别为seq id no.26、30和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0343]
f)可变重链(vh)区,其包含分别为seq id no.26、32和28的cdr1、cdr2和cdr3区,以及可变轻链区,其包含分别为seq id no.34、gas和seq id no.35的cdr1、cdr2和cdr3;
[0344]
g)seq id no.25的可变重链(vh)区和seq id no.33的可变轻链区;或者
[0345]
h)seq id no.29的可变重链(vh)区和seq id no.33的可变轻链区;
[0346]
i)seq id no.31的可变重链(vh)区和seq id no.33的可变轻链区;
[0347]
j)具有与相应的seq id no.25的可变重链(vh)和seq id no.33的可变轻链区具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性的重链(vh)和轻链(vh)可变区。
[0348]
此类抗体不一定包含结合cd3的抗原结合区。此类抗体可能是有用的,例如在用于检测b7h4的试剂盒和测定法中。此类抗体还可以在治疗癌症中有用。因此,此类抗体可以是结合b7h4的单特异性抗体。此类抗体可以是二价抗体。
[0349]
优选地,此类抗体是包含重链恒定区的抗体,该重链恒定区是人igg1恒定区。例如,重链恒定区如seq id no.57-62中所列。优选的轻链恒定区是κ轻链,诸如seq id no.63.中所列。
[0350]
在一个实施方案中,本文提供的抗体可以结合人b7h4上的表位或抗体结合区,包含氨基酸残基s151、v157、d158、y159、e164、l166、w173、p175、p177、v179、w181、f199、m208、v210、t222、y223、v240、e242和i245中的一个或多个;每个氨基酸残基的编号参考其在seq id no:1中的位置。在进一步实施方案中,本文提供的抗体可以结合人b7h4上的表位或抗体结合区,包含氨基酸残基v157、d158、y159、e164、l166中的一个或多个;每个氨基酸残基的编号参考其在seq id no:1中的位置。
[0351]
在另一个实施方案中,本文提供的抗体可以结合人b7h4上的表位或抗体结合区,包含氨基酸残基s151、v157、d158、y159、e164、l166、w173、p175、p177、v179、w181、f199、m208、v210、t222、y223、v240、e242和i245;每个氨基酸残基的编号参考其在seq id no:1中的位置。在进一步实施方案中,本文提供的抗体可以结合人b7h4上的表位或抗体结合区,包含氨基酸残基v157、d158、y159、e164、l166;每个氨基酸残基的编号是指其在seq id no:1中的位置。
[0352]
基于本文实施例7中提供的结果,不希望受理论束缚,假设这些氨基酸残基中的任何一个或多个(即s151、v157、d158、y159、e164、l166、w173、p175、p177、v179、w181、f199、m208、v210、t222、y223、v240、e242和i245)直接参与抗体的结合,诸如通过非共价相互作用;例如具有抗体的cdr序列中的氨基酸残基。
[0353]
所述表位或抗体结合区所包含的氨基酸残基和任选地间接参与结合的一个或多个额外氨基酸残基可以通过对具有seq id no:1所列的氨基酸序列或seq id no:1的细胞外域序列的人b7h4的丙氨酸扫描来鉴定。丙氨酸扫描特别地可以如本文实施例7中所述或基本上如本文实施例7中所述进行。
[0354]
此外,丙氨酸扫描可以通过包括以下步骤的规程进行:
[0355]
i)表达突变体人b7h4多肽,其中人b7h4的细胞外域中的氨基酸残基,除了半胱氨酸和丙氨酸,分别地由丙氨酸取代,并且相应的野生型b7h4多肽分别地在人胚胎肾细胞,例如hek 293细胞中,从而为每个突变体或野生型b7h4提供包含40-60.000个细胞,诸如50.000个细胞的样品,
[0356]
ii)用20μl的所述抗体温育每个样品中的细胞,其中所述抗体由单个重链和单个轻链组成,该抗体例如经用于流式细胞术分析的合适标记物,诸如mneogreen标记物标记,并在室温下温育1小时,然后用facs缓冲液(例如磷酸盐缓冲盐水[pbs;lonza,目录号be17-517]+0.1%[w/v]bsa[roche,目录号10735086001]+0.02%[w/v]叠氮化钠[nan3;emelca bioscience,目录号41920044-3)清洗,并将每个样品中的细胞重悬浮于30μl facs缓冲液,
[0357]
iii)对于每个样品,测定每个细胞结合的抗体的平均量,作为所述样品中活的单细胞群的荧光强度(gmfi)的几何平均值,并使用以下等式将每个测试抗体的数据针对非交叉阻断b7h4特异性参考抗体的结合强度进行归一化:
[0358][0359]
其中“aa位置”是指突变为丙氨酸的位置,
[0360]
其中根据以下计算计算倍数变化或z-分数以表达抗体结合的损失或获得:
[0361][0362]
其中在用丙氨酸替换氨基酸后,特定抗体没有结合损失或获得的氨基酸位置将给出结果“0”,并且结合的获得将导致“》0”和结合的损失将导致“《0”,并且其中,对于特定的测试抗体,其中结合倍数变化低于平均倍数变化的-1.5x sd,其中sd是从四个独立实验计算的倍数变化的标准偏差的仅b7h4氨基酸残基被认为是“结合突变体的损失”,并且其中,如果特定b7h4突变体的参考抗体的gmfi低于平均gmfi对照ab的平均gmfi-2.5x sd,则从分析中排除数据。
[0363]
此外,此类抗体也可以是双特异性抗体,该双特异性抗体包含除能够与b7h4结合的抗原结合区之外的另一个抗原结合区。此类另一个抗原结合区可以是能够结合人cd3的抗原结合区。此类能够结合人cd3的抗原结合区可以是如本文所述和公开的能够结合cd3的抗原结合区。
[0364]
在进一步的实施方案中,在此类双特异性抗体中,所述能够结合人b7h4的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区以及所述轻链包含所述vl区和κ轻链恒定区;并且其中所述能够结合人cd3的抗原结合区包含在重链和轻链中,所述重链包含所述vh区和igg1重链恒定区以及所述轻链包含所述vl区和λ轻链恒定区。更优选地,在此类双特异性抗体中,一个igg1重链恒定区如seq id no.60中所定义并且另一个如seq id no.61中所定义,并且其中所述κ轻链恒定区如seq id no.63中所定义并且所述λ轻链恒定区如seq id no.64中所定义。应理解,任选地,如seq id no.60和61中所定义的所述igg1重链恒定区可以删除末端赖氨酸。
[0365]
根据本发明的高度优选的双特异性抗体如实施例部分所述和使用,并且被称为bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear。
[0366]
因此,在优选的实施方案中,提供了能够结合人cd3和人b7h4的双特异性抗体,其包含:
[0367]-第一重链和第一轻链,其包含能够结合人cd3的结合区,其中所述第一重链包含如seq id no:17所定义的重链可变区和如本文所定义的人igg1重链恒定区,并且其中所述第一轻链包含如seq id no:22所定义的轻链可变区和人λ轻链恒定区;和
[0368]-第二重链和第二轻链,其包含能够结合人b7h4的结合区,其中所述第二重链包含如seq id no:29所定义的重链可变区和如本文所定义的人igg1重链恒定区,并且其中所述第二重链包含如seq id no:33定义的轻链可变区和人κ轻链恒定区。
[0369]
应理解,如本文所定义的人igg1重链恒定区可以涵盖本文定义的取代(例如fear/feal)等。还应理解,人igg1重链恒定区可以具有其末端赖氨酸(k)缺失。
[0370]
在进一步优选的实施方案中,提供了能够结合人cd3和人b7h4的双特异性抗体,其包含:
[0371]-第一重链和第一轻链,其包含能够结合人cd3的结合区,其中所述第一重链包含如seq id no:17所定义的重链可变区和如seq id no:60所定义的重链恒定区,并且其中所述第一轻链包含如seq id no:22所定义的轻链可变区和如seq id no:64所定义的轻链恒定区;和
[0372]-第二重链和第二轻链,其包含能够结合人b7h4的结合区,其中所述第二重链包含如seq id no:29所定义的重链可变区和如seq id no:61所定义的重链恒定区,并且其中所述第二轻链包含如seq id no:33所定义的轻链可变区和如seq id no:63所定义的轻链恒定区。
[0373]
同样,应理解人igg1重链恒定区可以缺失其末端赖氨酸(k)。
[0374]
在又一个进一步优选的实施方案中,提供了能够结合人cd3和人b7h4的双特异性抗体,其包含:
[0375]-第一重链和第一轻链,其包含能够结合人cd3的结合区,其中所述第一重链由如seq id no:17所定义的重链可变区和如seq id no:60所定义的重链恒定区组成,并且其中所述第一轻链由如seq id no:22所定义的轻链可变区和如seq id no:64所定义的轻链恒定区组成;和
[0376]-第二重链和第二轻链,其包含能够与人b7h4结合的结合区,其中所述第二重链由如seq id no:29所定义的重链可变区和如seq id no:61所定义的重链恒定区组成,并且其中所述第二轻链由如seq id no:33所定义的轻链可变区和如seq id no:63所定义的轻链恒定区组成。
[0377]
在另一个进一步优选的实施方案中,提供了能够结合人cd3和人b7h4的双特异性抗体,其包含:
[0378]-第一重链和第一轻链,其包含能够结合人cd3的结合区,其中所述第一重链由如seq id no:17所定义的重链可变区和如seq id no:60所定义的重链恒定区组成,其中末端赖氨酸(k)缺失,并且其中所述第一轻链由如seq id no:22所定义的轻链可变区和如seq id no:64所定义的轻链恒定区组成;和
[0379]
第二重链和第二轻链,其包含能够与人b7h4结合的结合区,其中所述第二重链由如seq id no:29所定义的重链可变区和如seq id no:61所定义的重链恒定区组成,其中末端赖氨酸(k)缺失,并且其中所述第二轻链由如seq id no:33所定义的轻链可变区和如seq id no:63所定义的轻链恒定区组成。制备双特异性抗体的方法
[0380]
传统方法诸如杂交杂交瘤和化学缀合方法(marvin and zhu(2005)acta pharmacol sin 26:649)可以用于制备本发明的双特异性抗体。由不同的重链和轻链组成的两种抗体在宿主细胞中的共表达导致除期望的双特异性抗体之外可能的抗体产物的混合物,然后可以通过例如亲和层析或类似方法将其分离。
[0381]
也可以使用有利于在不同抗体构建体共表达时形成功能性双特异性产物的策略,例如lindhofer等人(1995j immunol 155:219)中描述的方法。由于优先的物种限制的重
链/轻链配对,产生不同抗体的大鼠和小鼠杂交瘤的融合导致数量有限的异二聚体蛋白。促进异二聚体形成优于同二聚体的另一种策略是“杵入臼”策略,其中在第一重链多肽上引入突起并在第二重链多肽中引入相应的空腔,使得突起可以是位于这两条重链界面的空腔中,以便促进异二聚体的形成并阻碍同二聚体的形成。通过用较大的侧链替换来自第一多肽界面的小氨基酸侧链来构建“突起”。通过用较小的氨基酸侧链替换大的氨基酸侧链,在第二多肽的界面中产生与突起相同或相似大小的补偿性“空腔”。(美国专利5,731,168)。ep1870459(chugai)和wo2009089004(amgen)描述了在宿主细胞中共表达不同抗体域时有利于异二聚体形成的其他策略。在这些方法中,在两个ch3域中构成ch3-ch3界面的一个或多个残基被带电氨基酸替换,使得同二聚体的形成在静电上是不利的,而异二聚体在静电上是有利的。wo2007110205(merck)描述了又一种策略,其中利用iga和igg ch3域之间的差异来促进异源二聚化。
[0382]
wo2008119353(genmab)中描述了另一种产生双特异性抗体的体外方法,其中在还原条件下温育后通过两个单特异性igg4或igg4样抗体之间的“fab臂”或“半分子”交换(交换重链和连接的轻链)形成双特异性抗体。所得产物是具有可能包含不同序列的两个fab臂的双特异性抗体。
[0383]
制备本发明的双特异性cd3xb7h4抗体的优选方法包括wo2011131746和wo13060867(genmab)中描述的方法,其包括以下步骤:
[0384]
a)提供包含fc区的第一抗体,所述fc区包含第一ch3区;
[0385]
b)提供包含第二fc区的第二抗体,所述fc区包含第二ch3区,其中第一抗体是cd3抗体并且第二抗体是b7h4抗体,或反之亦然;
[0386]
其中所述第一和第二ch3区的序列不同并且是使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二ch3区的同二聚体相互作用中的每一个;
[0387]
c)在还原条件下将所述第一抗体与所述第二抗体一起温育;和
[0388]
d)获得所述双特异性cd3xb7h4抗体。
[0389]
在一个实施方案中,在足以允许铰链区中的半胱氨酸经历二硫键异构化的还原条件下将所述第一抗体与所述第二抗体一起温育,其中在所得异二聚体抗体中所述第一和第二抗体之间的异二聚体相互作用是使得在37℃下24小时后在0.5mm gsh下不发生fab臂交换。
[0390]
不受理论的限制,在步骤c)中,亲本抗体的铰链区中的重链二硫键被还原,然后所得半胱氨酸能够与另一个亲本抗体分子(最初具有不同的特异性)的半胱氨酸残基形成重链间二硫键。在该方法的一个实施方案中,步骤c)中的还原条件包括添加还原剂,例如选自下组的还原剂:2-巯基乙胺(2-mea)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、谷胱甘肽、三(2-羧乙基)膦(tcep)、l-半胱氨酸和β-巯基-乙醇,优选选自下组的还原剂:2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦。在进一步的实施方案中,步骤c)包括恢复条件以变为非还原性或较少还原性,例如通过去除还原剂,例如通过脱盐。
[0391]
对于该方法,可以使用本文所述的任何cd3和b7h4抗体。在特定的实施方案中,可以分别选择cd3和b7h4抗体以获得如本文所述的双特异性cd3xb7h4抗体。
[0392]
在该方法的一个实施方案中,所述第一和/或第二抗体是全长抗体。
[0393]
第一和第二抗体的fc区可以是任何同种型,包括但不限于igg1、igg2、igg3或
igg4。在该方法的一个实施方案中,所述第一抗体和所述第二抗体两者的fc区均是igg1同种型。在另一个实施方案中,所述抗体的一个fc区是igg1同种型并且另一个是igg4同种型。在后一个实施方案中,所得双特异性抗体包含igg1的fc区和igg4的fc区,并且可以因此具有关于激活效应物功能的令人感兴趣的中间特性。
[0394]
在进一步的实施方案中,抗体起始蛋白之一已被工程化改造以不结合蛋白a,因此允许通过将产物通过蛋白a柱将异二聚体蛋白与所述同二聚体起始蛋白分离。
[0395]
如上所述,同二聚体起始抗体的第一和第二ch3区的序列是不同的并且是使得所述第一和第二ch3区之间的异源二聚体作用强于所述第一和第二ch3区的同二聚体相互作用中的每一个。wo2011131746和wo2013060867(genmab)中提供了关于这些相互作用以及如何实现它们的更多细节,在此通过引用整体并入。
[0396]
特别地,基于分别结合cd3和b7h4,并且在ch3区域中仅含有少数相当保守的不对称突变的两种同二聚体起始抗体,可以使用本发明的上述方法以高产率获得稳定的双特异性cd3xb7h4抗体。不对称突变是指所述第一和第二ch3区的序列在不同的位置含有氨基酸取代。
[0397]
本发明的双特异性抗体也可以通过在单个细胞中共表达编码第一和第二多肽的构建体来获得。
[0398]
因此,在另一方面,本发明涉及用于产生双特异性抗体的方法,所述方法包括以下步骤:
[0399]
a)提供编码包含第一抗体重链的第一fc区和第一抗体原结合区的第一多肽的第一核酸构建体,所述第一fc区包含第一ch3区,
[0400]
b)提供编码包含第二抗体重链的第二fc区和第二抗体原结合区的第二多肽的第二核酸构建体,所述第二fc区包含第二ch3区,
[0401]
其中所述第一和第二ch3区的序列不同并且是使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二ch3区的同二聚体相互作用中的每一个,并且其中所述第一同二聚体蛋白质具有在位置409处的除lys、leu或met以外的氨基酸,并且所述第二同型二聚体蛋白具有在选自下组的位置处的氨基酸取代:366、368、370、399、405和407,
[0402]
任选地其中所述第一和第二核酸构建体编码所述第一和第二抗体的轻链序列
[0403]
c)在宿主细胞中共表达所述第一和第二核酸构建体,和
[0404]
d)从细胞培养物中获得所述异二聚体蛋白质。
[0405]
因此,本发明还涉及重组真核或原核宿主细胞,其产生本发明的双特异性抗体。
[0406]
合适的表达载体,包括启动子、增强子等,以及用于产生抗体的合适的宿主细胞是本领域众所周知的。宿主细胞的实例包括酵母、细菌和哺乳动物细胞,诸如cho或hek细胞。
[0407]
在实施方案中,提供了根据本发明的产生能够结合b7h4和cd3两者的抗体的方法,其包括以下步骤:
[0408]
a)提供能够结合b7h4的抗体,所述抗体包含如本文所定义的能够结合b7h4的抗原结合区;
[0409]
b)提供能够结合cd3的抗体,所述抗体包含如本文所定义的能够结合cd3的抗原结合区;
[0410]
c)在足以允许铰链区中的半胱氨酸经历二硫键异构化的还原条件下将所述能够
结合b7h4的抗体与所述能够结合cd3的抗体一起温育,和
[0411]
d)获得所述能够结合b7h4和cd3的抗体。
[0412]
在此类方法中,提供能够结合b7h4和/或cd3的抗体的步骤可以包括以下步骤:
[0413]-提供含有用于产生一种或多种所述抗体的表达载体的细胞;和
[0414]-允许细胞产生一种或多种所述抗体,随后,
[0415]-获得一种或多种所述抗体,从而提供一种或多种所述抗体
[0416]
此外,本发明提供
[0417]
a)编码如本文所定义的能够结合b7h4的抗原结合区的重链序列的核酸序列,和/或
[0418]
b)编码能够结合b7h4的抗原结合区的相应轻链序列的核酸序列。此外,本发明提供一种或多种核酸,其包含:
[0419]
a)编码如本文所定义的能够结合b7h4的抗原结合区的重链序列的核酸序列,
[0420]
b)编码所述能够结合b7h4的抗原结合区的相应轻链序列的核酸序列,
[0421]
c)编码如本文所定义的能够结合cd3的抗原结合区的重链序列的核酸序列;和
[0422]
d)编码所述能够结合cd3的抗原结合区的相应轻链序列的核酸序列。
[0423]
如本文所定义的核酸或一种或多种核酸可以是rna或dna。如本文所定义的核酸或一种或多种核酸可以用于在哺乳动物细胞中的表达。因此,此外,本发明提供了一种或多种细胞,其包含核酸,或包含一种或多种核酸,如本文所定义的。
[0424]
本发明上下文中的核酸可以是表达载体,其可以是任何合适的载体,包括染色体、非染色体和合成核酸载体(包含合适的一组表达控制元件的核酸序列)。此类载体的实例包括sv40的衍生物、细菌质粒、噬菌体dna、杆状病毒、酵母质粒、衍生自质粒和噬菌体dna组合的载体以及病毒核酸(rna或dna)载体。在一个实施方案中,编码b7h4或cd3抗体的核酸包含在裸dna或rna载体中,包括例如线性表达元件(如在例如sykes and johnston,nat biotech 17,355 59(1997)中描述)、紧密核酸载体(如在例如us 6,077、835和/或wo 00/70087中描述)、质粒载体诸如pbr322、puc19/18或puc118/119、“midge”最小尺寸的核酸载体(如在例如schakowski et al.,mol ther 3,793 800(2001)中描述),或作为沉淀的核酸载体构建体,诸如capo4沉淀的构建体(如在例如wo200046147,benvenisty and reshef,pnas usa 83,9551 55(1986),wigler et al.,cell 14,725(1978),和coraro and pearson,somatic cell genetics 7,603(1981)中描述)。此类核酸载体及其用途在本领域中是众所周知的(参见例如us 5,589,466和us 5,973,972)。
[0425]
在一个实施方案中,载体适合于在细菌细胞中表达b7h4抗体和/或cd3抗体。此类载体的实例包括表达载体,例如bluescript(stratagene)、pin载体((van heeke&schuster,j biol chem 264,5503 5509(1989)、pet载体(novagen,madison wi)等)。
[0426]
表达载体还可以或替代地是适合在酵母系统中表达的载体。可以使用任何适合在酵母系统中表达的载体。合适的载体包括,例如,包含组成型或诱导型启动子诸如α因子、醇氧化酶和pgh的载体(综述于:f.ausubel et al.,ed.current protocols in molecular biology,greene publishing and wiley interscience new york(1987),和grant et al.,methods in enzymol 153,516 544(1987))。
[0427]
核酸和/或表达载体还可以包含编码分泌/定位序列的核酸序列,其可以将多肽诸
如新生多肽链靶向周质空间或进入细胞培养基。此类序列是本领域已知的,并且包括分泌前导肽或信号肽。核酸和/或表达载体可以包含促进表达的任何合适的元件,即核酸的转录和/或翻译使得(双特异性)抗体的组分得以表达。核酸和/或载体与任何合适的启动子、增强子和其他促进表达的元件结合。此类元件的实例包括强表达启动子(例如,人cmv ie启动子/增强子以及rsv、sv40、sl33、mmtv和hiv ltr启动子)、有效poly(a)终止序列、大肠杆菌中的质粒产物的复制起点、作为选择标志物的抗生素抗性基因,和/或方便的克隆位点(例如,多接头)。核酸还可以包含与组成型启动子相对的诱导型启动子,诸如cmv ie。
[0428]
在一个实施方案中,编码b7h4和/或cd3抗体的表达载体可以定位在细胞中和/或递送至细胞。因此,在另一方面,本发明涉及包含如本文所定义的核酸或载体的宿主细胞。该细胞可以是人来源的,诸如人胚肾(hek)细胞,诸如hek/expi细胞,或者可以是啮齿动物来源的,诸如中国仓鼠卵巢细胞,诸如cho/n50细胞。
[0429]
组合物和(医疗)用途
[0430]
此外,本发明提供了包含如本文定义的抗体的组合物。优选地,此类组合物是药物组合物,即抗体包含在药学上可接受的载体中。本发明的药物组合物可以含有本发明的双特异性抗体,其靶向b7h4和cd3两者。药物组合物还可以包含靶向b7h4的抗体。药物组合物还可以包含抗体的组合,包括根据本发明的靶向b7h4的抗体和/或双特异性抗体。
[0431]
药物组合物可以根据常规技术,诸如在remington:the science and practice of pharmacy,19th edition,gennaro,ed.,mack publishing co.,easton,pa,1995中公开的那些技术配制。本发明的药物组合物发明可以例如包括稀释剂、填充剂、盐、缓冲剂、去污剂(例如,非离子去污剂,例如tween-20或tween-80)、稳定剂(例如,糖或无蛋白质的氨基酸)、防腐剂、组织固定剂、增溶剂和/或适合包含在药物组合物中的其他材料。
[0432]
根据本发明的抗体、组合物或药物组合物优选用作药物。根据本发明的抗体、组合物或药物组合物优选用于治疗疾病。本发明的双特异性抗体可以用于多种目的。特别地,本发明的双特异性抗体可以用于治疗各种形式的癌症,包括转移性癌症和难治性癌症。优选地,癌症可以是实体瘤类型。
[0433]
特别地,根据本发明的双特异性抗体可以在其中期望对表达b7h4的细胞的特异性靶向和t细胞介导的杀伤的治疗环境中有用。
[0434]
在一个实施方案中,本发明提供了用于治疗受试者癌症的方法,该方法包括施用治疗有效量的本发明的双特异性b7h4xcd3抗体。在进一步的实施方案中,本发明提供了用于在受试者中治疗涉及表达b7h4的细胞的病症的方法,该方法包括施用治疗有效量的本发明的双特异性抗体。
[0435]
在另一个实施方案中,本发明提供了用于治疗受试者癌症的方法,该方法包括施用治疗有效量的本发明的能够结合人b7h4的抗体。在进一步的实施方案中,本发明提供了用于在受试者中治疗涉及表达b7h4的细胞的病症的方法,该方法包括施用治疗有效量的本发明的能够结合人b7h4的单特异性抗体。
[0436]
如所述,可以在根据本发明的方法和用途中考虑的合适疾病是癌症。所述癌症最优选地特征在于b7h4的表达。b7h4在癌症中的表达可以使用本领域已知的方法容易地测定,诸如pcr、免疫染色或facs分析,即检测b7h4转录物和/或蛋白质的表达。如本文所述的能够结合人b7h4的抗体可以用于例如免疫染色和/或facs分析等中。
[0437]
可以表达b7h4的癌症包括乳腺癌、子宫/子宫内膜癌、子宫癌肉瘤、卵巢癌、宫颈癌、非小细胞肺癌(鳞状细胞癌和腺癌)、头颈部鳞状细胞癌、膀胱癌、食管癌、胆管癌、胰腺癌、胃癌、肾癌和前列腺癌。
[0438]
可以表达b7h4的癌症包括癌症诸如胃癌、胆管癌、膀胱癌、非小细胞肺癌(特别是鳞状nsclc)、胰腺癌、宫颈癌、头颈癌、乳腺癌(包括三阴性乳腺癌))、卵巢癌和子宫癌。可能优选的癌症类型是选自子宫癌肉瘤(ucs)、膀胱尿路上皮癌(blca)、胰腺腺癌(paad)、肺鳞状细胞癌(lusc)、乳腺侵入癌(brca)、子宫内膜癌(ucec)、卵巢浆液性囊腺癌(ov)和胆管癌(chol)的癌症。
[0439]
在进一步的实施方案中,可以对被诊断患有癌症的患者进行癌细胞中b7h4表达的评估,并且当检测到可以在从低到高的范围内的b7h4时,可以选择此类患者用根据本发明的抗体进行治疗。被诊断患有胃癌、胆管癌、膀胱癌、非小细胞肺癌(特别是鳞状nsclc)、胰腺癌、宫颈癌、头颈癌、乳腺癌(包括三阴性乳腺癌)、卵巢癌或子宫癌的患者可能接受此类测试。在进一步的实施方案中,被诊断患有子宫癌肉瘤(ucs)、膀胱尿路上皮癌(blca)、胰腺腺癌(paad)、肺鳞状细胞癌(lusc)、乳腺侵入癌(brca)、子宫体子宫内膜癌(ucec)、卵巢浆液性囊腺癌(ov)或胆管癌(chol)的患者可能接受此类测试。然而,在选择患者进行治疗时可能不一定需要包括此类评估。
[0440]
试剂盒
[0441]
本发明进一步提供了包含如上公开的抗体的试剂盒,诸如用作伴随诊断/用于在患者群体内鉴定那些具有响应于用如本文以上定义的抗体或如本文以上定义的免疫缀合物或抗体-药物缀合物(adc)的治疗的倾向的患者,或用于预测所述抗体或免疫缀合物或adc在用于治疗患者时的功效或抗肿瘤活性的试剂盒,该试剂盒包含如上定义的抗体;以及所述试剂盒的使用说明。
[0442]
试剂盒,诸如用作伴随诊断/用于在患者群体中鉴定那些具有对如权利要求1至55中任一项所定义的抗体的治疗的倾向的患者的试剂盒,其包含如权利要求1至55中任一项所定义的抗体;以及该试剂盒的使用说明。
[0443]
因此,在一方面,本发明涉及包含如本文定义的双特异性cd3xb7h4抗体或如本文定义的b7h4抗体的诊断组合物及其用途。
[0444]
在另一个方面,本发明涉及用于检测衍生自患者的样品中表达cd3和b7h4的细胞之间的交联的试剂盒,其包含
[0445]
i)如本文公开的实施方案中任一项的双特异性抗体;和
[0446]
ii)所述试剂盒的使用说明。
[0447]
在一个实施方案中,本发明提供了用于诊断癌症的试剂盒,其包括包含双特异性cd3xb7h4抗体的容器,以及用于检测b7h4表达细胞和cd3表达细胞的交联的一种或多种试剂。试剂可以包括例如荧光标签、酶标签或其他可检测标签。试剂还可以包括二级或三级抗体或用于酶促反应的试剂,其中该酶促反应产生可以可视化的产物。
[0448]
在另一方面,本发明涉及用于检测在施用根据本文公开的实施方案中的任一项的双特异性抗体后在衍生自患者的样品中是否发生表达cd3和b7h4的细胞之间的交联的方法,其包括以下步骤:
[0449]
(i)在允许所述双特异性抗体与表达cd3的细胞和表达b7h4的细胞之间形成复合
物的条件下,使样品与如本文所公开的实施方案中任一项的双特异性抗体接触;和
[0450]
(ii)分析是否已形成复合体。
[0451]
本发明通过以下实施例进一步说明,这些实施例不应被解释为限制本发明的范围。
[0452]
实施例1-b7h4抗体的生成和筛选材料
[0453]
b7h4构建体的表达
[0454]
生成了编码各种全长b7h4变体的构建体:人(智人)b7h4(uniprot登录号q7z7d3)、食蟹猴(食蟹猴)b7h4转录物1(uniprot登录号a0a2k5u6p5)、犬(家犬)b7h4(uniprot登录号f1p8r9)、兔(穴兔)b7h4(uniprot登录号g1tqe8)、大鼠(褐家鼠)b7h4(uniprot登录号q501w4)、小鼠(小家鼠)b7h4(uniprot登录号q7tsp5)和猪(欧亚野猪)b7h4(uniprot登录号f1say4)(见表1)。
[0455]
此外,生成了细胞外域(人b7h4的ecd(来自uniprot登录号q7z7d3的aa 25-259)与具有c端his标签和c标签的人igg1 fc域融合的构建体(b7h4ecd-fchisc)(seq id no:12)。在seq id no:1中,氨基酸残基1-24是信号肽;因此成熟的b7h4ecd-fchisc蛋白对应于seq id no:1的氨基酸残基25-259。
[0456]
构建体含有用于克隆的合适限制性位点和最佳kozak(gccgccacc)序列(kozak,m.,gene 1999;234(2):187-208)。b7h4构建体的全长和ecd被克隆到psb中,psb是哺乳动物表达载体,含有睡美人(sleeping beauty)反向末端重复,其在由cmv启动子和hsv-tk polya信号组成的表达盒侧翼。
[0457]
瞬时表达全长b7h4变体的hek-293f细胞系的生成
[0458]
freestyle
tm 293-f(hek-293亚克隆,适于悬浮生长和化学成分确定的freestyle培养基[hek-293f])细胞获得自invitrogen(目录号r790-07),并根据制造商的说明使用293fectin(invitrogen,目录号12347-019)用上述构建体进行转染。
[0459]
带his标签的b7h4的纯化
[0460]
基本上如制造商所述,使用expi293f表达平台(thermo fisher scientific,waltham,ma,usa,目录号a14527)表达b7h4ecd-fchisc。
[0461]
his标签使得能够用固定化金属亲和层析ni-nta进行纯化。带his标签的蛋白质与柱材料强烈结合,而与带his标签的蛋白质相比,培养物上清液中存在的其他蛋白质不结合或较弱结合,并在流出液中洗脱。清洗柱以去除弱结合的蛋白质。然后用含有咪唑的缓冲液洗脱强烈结合的带his标签的蛋白质,该缓冲液竞争his对ni
2+
的结合。通过在脱盐柱上进行缓冲液交换除去洗脱液。
[0462]
免疫接种
[0463]
如下使动物(表达具有完全人独特型的多样化抗体库的转基因大鼠;ligand pharmaceuticals inc.,san diego,usa)免疫:在双后肢的跗关节中皮下注射(每周两次持续7周)在pbs中与等体积佐剂(sigma佐剂系统(sigma-aldrich,st.louis,mo,usa,目录号s6322)或cfa,完全弗氏佐剂(第一次注射)和ifa,不完全弗氏佐剂(sigma-aldrich,st.louis,mo,usa,目录号f5881/f5506)(后续注射))混合的50μg b7h4ecd-fchisc,然后是在不含佐剂的pbs中的抗原的最后加强s.c.注射。
[0464]
抗体生成
[0465]
在最后加强后3天,根据标准规程将来自免疫动物的淋巴结细胞与小鼠骨髓瘤sp2.0细胞融合。从产生b7h4特异性抗体的杂交瘤中提取rna,并根据制造商的说明,使用smart race cdna扩增试剂盒(clontech)从100ng总rna中制备5
’‑
race互补dna(cdna)。vh和vl编码区通过pcr扩增,并通过连接非依赖性克隆(aslanidis,c.and p.j.de jong,nucleic acids res1990;18(20):6069-74)以符合读码框的方式直接克隆到p33g1f、p33kappa和p33lambda表达载体(基于pcdna3.3的载体,分别具有密码子优化的人igg1m(f)、kappa和lambda恒定域)。对来自这些表达载体的可变域进行测序并根据imgt定义注释cdr(lefranc mp.et al.,nucleic acids research,27,209-212,1999和brochet x.nucl.acids res.36,w503-508(2008))。表达具有正确开放阅读框(orf)的克隆并测试其与抗原的结合。进行抗原特异性筛选测定法后,将重链和轻链可变区序列基因合成并克隆到表达载体中,该表达载体包括含有以下氨基酸突变的人igg1重链:l234f、l235e、d265a和k409r(fear),其中氨基酸位置编号是根据eu编号(对应于seq id no 60),并克隆到到包括人κ或λ轻链的表达载体中。对于抗体中的一些,生成了在可变域中具有点突变的变体以去除半胱氨酸残基,这潜在可以生成不期望的二硫键形成,或将天冬酰胺替换为丝氨酸或种系残基以去除潜在的n连接糖基化位点。例如,从c1重链和轻链可变区序列,制备具有n52s取代的变体,对应于cdr2中的取代(参见表1,seq id no.25和29),并且另外的变体可以具有n52q取代(seq id no.31)。
[0466]
抗原特异性筛选测定法
[0467]
在同质结合测定法中确定免疫动物血清或杂交瘤和转染瘤培养物上清液中b7h4抗体的存在。分析样品中抗体与用为了表达全长b7h4变体而制备的构建体瞬时转染的表达人b7h4、食蟹猴b7h4或鼠b7h4的hek-293f细胞或hek-293f野生型细胞(阴性对照)的结合。将样品添加到细胞中以允许抗体与b7h4结合。随后,使用合适的荧光缀合物(affinipure山羊抗大鼠igg(h+l)alexa647;jackson immunoresearch,目录号112-605-143;affinipure山羊抗人igg fc gamma-alexa647;jackson immunoresearch,目录号109-605-098)检测抗体结合。取决于抗体的主链,将细胞(2.5x105个细胞/ml)与山羊抗人affinipure山羊抗人igg fc gamma-alexa647(0.2μg/ml;jackson immunoresearch laboratories,109-605-098)或affinipure山羊抗大鼠igg(h+l)alexa647(0.2μg/ml;jackson immunoresearch,112-605-143)混合。制备测试和对照抗体的连续稀释物(范围为0.003至3μg/ml,2倍稀释步骤),并将2μl抗体稀释物添加到1536孔板(greiner,目录号789866)中的5μl细胞/缀合物混合物中。将板在室温下温育9小时,然后使用imagexpress velos激光扫描细胞仪(molecular devices,llc,sunnyvale,ca,usa)测定荧光强度,并使用总荧光作为读数。当计数高于50并且计数x荧光比阴性对照高至少3倍时,样品被视为阳性。
[0468]
来自b7h4抗体组生成的结果
[0469]
从产生的193个杂交瘤中的176个中,成功地获得了重链和轻链可变区序列。在测试的351种重链/轻链组合中,98种在使用如上所述的人b7h4转染的hek-293f细胞的抗原筛选测定法中显示出结合。选择了35种抗体:26种具有原始序列,并且9种变体具有在可变域中引入的点突变。抗体作为单价结合抗体(作为cd3双特异性)和二价结合抗体(作为igg1分子)产生,并如下所述测试与肿瘤细胞的结合。在来自所生成的组的抗体中,仅抗体b7h4-c1
及其变体b7h4-c1-n52s,其中相应的vh和vl抗体可变域编码序列列于表1中,提供了与肿瘤细胞结合的抗体,如下所述。
[0470]
另外的b7h4抗体
[0471]
在实施例中,使用了另外的对b7h4具有特异性的抗体,其含有先前在wo2014159835中描述的可变域(在其中引用为seq id no 38和35),在本文中对应于b7h4-c2,可变域的相关序列在本文中列于表1中并且包括seq id no.43和47;wo2014159835(在其中引用为seq id no 56和55),在本文中对应于b7h4-c3,可变域的相关序列在本文中列于表1中并且包括seq id no.36和40;wo2009073533(在其中引用为seq id no 2和7),在本文中对应于b7h4-c4,可变域的相关序列在本文中列于表1中并且包括seq id no.50和54;和us20190085080a1,在本文中对应于b7h4-c5并且可变域的相关序列在本文中列于表1中并且包括seq id no.65和69。合成相应的vh和vl抗体可变域编码序列并克隆到具有密码子优化的人igg1m(f)和kappa或lambda恒定域或其变体的基于pcdna3.3的载体中,以产生单特异性和双特异性抗体。当提及抗体igg1-b7h4-cx-feal时,这表示抗体具有b7h4-cx可变区,属于igg1同种型,并且在重链的恒定区具有氨基酸取代l234f、l235e、d265a和f409r。
[0472]
igg1-b12抗体
[0473]
抗体b12,一种hiv-1gp120特异性抗体(barbas,cf.j mol biol.1993apr5;230(3):812-23)在一些实施例中用作阴性对照igg1,或用作双特异性对照的非结合对照fab臂。合成该对照抗体的密码子优化的抗体编码序列并克隆到基于pcdna3.3的载体中,该载体具有密码子优化的人igg1m(f)和kappa恒定域或其变体。可变重链(vh)区的序列和可变轻链(vl)区的序列分别作为seq id no:14和15包括在本文中。
[0474]
实施例2-用于生成cd3xb7h4双特异性抗体的人源化cd3抗体
[0475]
wo2015/001085的实施例1中描述了人源化抗体igg1-hucd3-h1l1(其可变重链和轻链区序列在本文中列于seq id no:16和22)的生成。igg1-hucd3-h1l1在本文中称为“igg1-hucd3”。抗体igg1-hucd3-h1l1-feal是其在fc域中具有三个氨基酸取代(l234f、l235e、d265a)的变体,此外还有允许通过受控的fab臂交换生成双特异性抗体的氨基酸取代(f405l),如下文所述。已经表明,此类突变对引入它们的抗体的靶物结合没有影响(参见例如us 2015/0337049和engelberts et al.,2020,ebiomedicine 52:102625)。
[0476]
wo2017/009442的实施例2描述了人源化抗体igg1-hucd3-h1l1-h101g(其可变重链和轻链区序列在本文中列为seq id no:17和22)的生成。igg1-hucd3-h1l1-h101g可被称为“igg1-hucd3-h101g”。该变体包含在可变重链区序列中的取代h101g(比较seq id no.16和17),并且具有与igg1-hucd3-h1l1相同的轻链。抗体igg1-hucd3-h101g-feal是其具有氨基酸取代l234f、l235e、d265a和f405l的变体。
[0477]
实施例3-使用生物层干涉测量法的b7h4结合亲和力测定
[0478]
b7h4抗体的靶物结合亲和力通过octet htx仪器(fort
é
bio)上的无标记物的生物层干涉测量法(bli)确定。实验是在30℃下以1,000rpm摇动进行的。最初,使用bli测定igg1-b7h4-c1-n52s-fear、igg1-b7h4-c2-fear、igg1-b7h4-c3-fear和igg1-b7h4-c4-fear对人和小鼠b7h4的亲和力。抗人igg fc捕捉(ahc)生物传感器(fort
é
bio,目录号18-5060)通过暴露于10mm甘氨酸(sigma-aldrich,目录号15527)缓冲液ph 1.7持续5s,然后通过在样品稀释剂(fort
é
bio,目录号18-1048)中进行中和5s进行预处理;这两个步骤重复2次。接
下来,用抗体(样品稀释剂中为1μg/ml)加载ahc传感器600s。在样品稀释剂中进行基线测量(100s)后,用在样品稀释剂中的两倍稀释步骤,对于人和小鼠b7h4分别使用1.56-100nm(0.04-2.68μg/ml)和5.9-375nm(0.16-10μg/ml)的浓度范围,测定人b7h4(sino biological,目录号10738-h08h-100)或小鼠b7h4(r&d systems,目录号2154-b7-050)的缔合(300s)和解离(1,000s)。人b7h4和小鼠b7h4(作为ecd-带his标签分子)的基于其氨基酸序列的理论分子量(分别为26.8kda和26.6kda)用于计算。对于每种抗体,使用了参考传感器,它与样品稀释剂而不是抗原一起温育。ahc传感器通过暴露于10mm甘氨酸缓冲液ph 1.7持续5s,然后在样品稀释剂中进行中和5s再生;这两个步骤重复两次。随后再次用抗体加载传感器用于下一轮动力学测量。
[0479]
使用数据采集软件v9.0.0.49d(fort
é
bio)采集数据,并使用数据分析软件v9.0.0.12(fort
é
bio)进行分析。通过减去参考传感器来校正每个抗体的数据迹线。y轴与基线的最后10s对齐,应用了对解离的interstep correction对齐和savitzky-golay过滤。具有响应《0.05nm的数据迹线被排除在分析之外。使用缔合和解离时间分别设置为300s和200s的感兴趣的窗口,用1:1全局全拟合模型对数据进行拟合。
[0480]
在第二项实验中,使用bli测定igg1-b7h4-c1-n52s-fear、igg1-b7h4-c2-fear、igg1-b7h4-c3-fear、igg1-b7h4-c4-fear和igg1-b7h4-c5-fear对人和小鼠b7h4的亲和力。实验如上所述进行,但有一些小例外。预条件化步骤重复5次。用在样品稀释剂中的两倍稀释步骤,使用0.78-800nm的浓度范围测定人或小鼠b7h4的缔合(200s)和解离(1,000s)。使用数据采集软件v12.0.1.8(fort
é
bio)采集数据,并使用数据分析软件v12.0.1.2(fort
é
bio)进行分析。除使用了1,000s的解离时间的igg1-b7h4-c2-fear外,使用200s缔合时间的感兴趣窗口和200s解离时间的感兴趣窗口,用1:1全局全拟合模型对数据进行拟合。基于r2值、曲线的视觉检查和解离步骤期间至少5%的信号衰减选择解离时间。对于具有低于50nm的亲和力的抗体,用高于100nm的抗原浓度生成的数据迹线被排除在分析之外。
[0481]
此外,通过bli测定对食蟹猴b7h4的亲和力。在第一项实验中,测定了bsigg1-hucd3-fealxb7h4-c1-fear、bsigg1-hucd3-fealxb7h4-c1-n52s-fear、bsigg1-hucd3-fealxb7h4-c2-fear、bsigg1-hucd3-fealxb7h4-c3-fear和bsigg1-hucd3-h101g-fealxb7h4-c4-fear对食蟹猴b7h4的亲和力。通过与20mm edc(n-(3-二甲基氨基丙基)-n
’‑
乙基碳二亚胺盐酸盐)(fort
é
bio,目录号18-1033)和10mm s-nhs(n-羟基磺基琥珀酰亚胺钠盐)(fort
é
bio,目录号18-1067)反应活化胺反应性第二代(ar2g)生物传感器(fort
é
bio,目录号18-5092)300s。活化的传感器用10mm醋酸钠ph 4.0(fort
é
bio,目录号18-1068)中的10μg/ml重组带higg1 fc标签的食蟹猴b7h4(creative biomart,目录号vtcn1-1517r)加载600s并用1m乙醇胺ph 8.5(fort
é
bio,目录号18-1071)淬灭300s。在样品稀释剂(300s;fort
é
bio,目录号18-1048)中进行基线测量后,用在样品稀释剂中的两倍稀释步骤使用0.23-15μg/ml(1.56-100nm)的浓度范围测定cd3xb7h4双特异性抗体对功能性单价b7h4结合的缔合(100s)和解离(1,000s)(如表8所示)。使用分子量为150kda的抗体进行计算。对于每种抗体,使用了参考传感器,它与样品稀释剂而不是抗体一起温育。
[0482]
使用数据采集软件v9.0.0.49d(fort
é
bio)采集数据,并使用数据分析软件v9.0.0.12(fort
é
bio)进行分析。通过减去参考传感器来校正每个抗体的数据迹线。y轴与基线的最后10s对齐,应用了对解离的interstep correction对齐和savitzky-golay过滤。
具有响应《0.05nm的数据迹线被排除在分析之外。使用缔合和解离时间分别设置为100s和200s的感兴趣的窗口,用1:1全局全拟合模型对数据进行拟合。
[0483]
在测定b7h4抗体对食蟹猴b7h4的亲和力的第二项实验中,测定了bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c5-fear的亲和力。实验如上所述进行,但有一些小例外。在样品稀释剂中进行600s的基线测量后,用在样品稀释剂中的两倍稀释步骤,使用大约0.1-116μg/ml(0.78-800nm)的浓度范围测定cd3xb7h4双特异性抗体(如表9所示)对功能性单价b7h4结合的缔合(200s)和解离(1,000s)。每种抗体的特定分子量(约145kda)用于计算。使用数据采集软件v12(fort
é
bio)采集数据,并使用数据分析软件v12(fort
é
bio)进行分析。具有响应《0.03nm的数据迹线被排除在分析之外。使用200s的缔合时间和解离时间的感兴趣窗口,用1:1全局全拟合模型对数据进行拟合。基于r2值、曲线的视觉检查和解离步骤期间至少5%的信号衰减选择解离时间。对于具有低于50nm的亲和力的抗体,用高于200nm的抗体浓度生成的数据迹线被排除在分析之外。所有结果均以至少0.98的r2测定。
[0484]“k
d”(m)是指抗体-抗原相互作用的平衡解离常数,并由kd除以ka获得。“k
d”(sec-1
)是指抗体-抗原相互作用的解离速率常数。这有时也称为k
off
值或解离率。“k
a”(m-1
x sec-1
)是指抗体-抗原相互作用的缔合速率常数。这有时也称为k
on
值或缔合率。
[0485]
表4和5显示了第一项和第二项实验的结果,其中针对人b7h4的指示抗体的缔合速率常数ka(1/ms)、解离速率常数kd(1/s)和平衡解离常数kd(m)由生物层干涉测量法测定。
[0486]
表4.抗体与人b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。nd=未测定。
[0487][0488]
表5.抗体与人b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。
[0489]
[0490][0491]1显示的是n=3次实验的平均结果。
[0492]
表6和7显示了两次实验的结果,其中针对小鼠b7h4的指示抗体的ka(1/ms)、kd(1/s)和kd(m)通过生物层干涉测量法测定。
[0493]
表6.抗体与小鼠b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。nd=未测定;-=无结合(在使用的最高浓度下响应《0.05nm)。
[0494][0495]
表7.抗体与小鼠b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。-=无结合(在使用的最高浓度下响应《0.05nm)。
[0496]
[0497][0498]
表8和表9显示了两次实验的结果,其中针对食蟹猴b7h4的指示抗体的ka(1/ms)、kd(1/s)和kd(m)通过生物层干涉测量法测定。
[0499]
表8.功能性单价抗体与食蟹猴b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。
[0500][0501]
表9.功能性单价抗体与食蟹猴b7h4细胞外域的结合亲和力,如通过无标记物的生物层干涉测量法测定的。
[0502][0503]a显示的是n=3次实验的平均结果。
[0504]b不符合0.98的严格质量控制r2阈值。
[0505]
实施例4-使用生物层干涉测量法测定cd3结合亲和力
[0506]
如wo2017/009442的实施例7中所述,测定igg1-hucd3-feal和igg1-hucd3-h101g-feal的结合亲和力。
[0507]
简而言之,使用fortebio octet htx(fortebio)上的生物层干涉测量法测定igg1-hucd3-feal形式的选定cd3抗体与重组可溶性cd3ε(cd3e27-gska)(seq id no:13的
成熟蛋白)的结合亲和力。将抗人fc捕捉生物传感器(fortebio,目录号18-5060)加载hlgg(1μg/ml)达600s。基线测量(200s)后,以三倍稀释步骤,使用27.11μg/ml-0.04μg/ml(1000nm-1.4nm)的cd3e27-gska浓度范围(样品稀释物,fortebio,目录号18-5028)测定cd3e27-gska的缔合(1000s)和解离(2000s)。为了进行计算,使用基于氨基酸序列的cd3e27-gska的理论分子量,即27.11kda。在30℃以1000rpm摇动的情况下进行实验。在至少两个独立的实验中测试了每种抗体。使用fortebio数据分析软件v8.1,使用1:1模型和具有1000s缔合时间和100s解离时间的全局全拟合分析数据。通过减去参考曲线(生物传感器上的抗体,仅使用样品稀释剂进行测量)校正数据迹线,将y轴与基线的最后10s对齐,并应用步骤间校正以及savitzky-golay过滤。具有响应《0.05nm的数据迹线从分析中排除。
[0508]
表10显示了通过生物层干涉测量法测定的重组cd3ε的缔合速率常数ka(1/ms)、解离速率常数kd(1/s)和平衡解离常数kd(m)。与igg1-hucd3-h101g-feal(kd:683nm)相比,igg1-hucd3-feal对重组cd3ε显示相对高的结合亲和力(kd:15nm)。
[0509]
表10:单特异性二价cd3抗体与重组cd3ε的结合亲和力,如通过无标记物的生物层干涉测量法测定的
[0510][0511]
实施例5-通过生物层干涉测量法测定的b7h4抗体的交叉阻断
[0512]
通过bli在octet htx仪器(fort
é
bio)上进行经典夹心格式的抗体交叉阻断分析(表位框并)。在以1,000rpm摇动的情况下并且在30℃用igg1-b7h4-c1-n52s-fear、igg1-b7h4-c2-fear、igg1-b7h4-c3-fear和igg1-b7h4-c4-fear进行第一次交叉阻断实验。
[0513]
用20mm edc(n-(3-二甲基氨基丙基)-n
’‑
乙基碳二亚胺盐酸盐)(sigma-aldrich,目录号03449)和10mm s-nhs(n-羟基磺基琥珀酰亚胺钠盐)(sigma-aldrich,目录号56485)的溶液活化胺反应性第二代(ar2g)生物传感器(fort
é
bio,目录号18-5092)300s。活化的ar2g传感器用在10mm醋酸钠ph6.0(fort
é
bio,目录号18-1070)中的20μg/ml第一抗体加载600s,并用1m乙醇胺ph 8.5(fort
é
bio目录号18-1071)淬灭300s。在样品稀释剂(50s;fort
é
bio,目录号18-1048)中进行基线测量后,用人b7h4(在样品稀释剂中稀释的100nm或2.68μg/ml;sino biological,目录号10738-h08h)加载含有固定化抗体的ar2g生物传感器300s。基于氨基酸序列的人b7h4的理论分子量(26.8k da)用于计算。测定了第二抗体(样品稀释剂中的10μg/ml)的缔合(300s)。传感器通过暴露于10mm甘氨酸(目录号15527)缓冲液ph 2.5持续5s,然后在样品稀释剂中中和5s进行再生;这两个步骤重复两次。随后再次使用含有固定化第一抗体的传感器,从基线步骤开始。
[0514]
使用数据采集软件v9.0.0.49d(fort
é
bio)采集数据,并使用数据分析ht软件v10.0.17(fort
é
bio)进行分析。通过减去参考曲线(样品稀释剂而不是第二抗体)来校正数据迹线,以校正b7h4从固定化第一抗体的解离。y轴与缔合步骤的开始对齐,并应用了
savitzky-golay过滤。以矩阵格式绘制第二抗体的校正缔合响应。一般来说,》0.05nm的响应被认为是非交叉阻断抗体,而《0.05nm的响应被认为是阻断抗体对。
[0515]
重复交叉阻断实验以也包括igg1-b7h4-c5-fear,并按上述进行,稍作修改。在以1,000rpm摇动的情况下并且在22℃下进行该实验。使用数据采集软件v12.0.1.8(fortebio)采集数据,并使用数据分析ht软件v12.0.1.55(fortebio)进行分析。一般来说,》0.1nm的响应被认为是非交叉阻断抗体,而《0.1nm的响应被认为是阻断抗体对。
[0516]
对抗体igg1-b7h4-c1-n52s-fear、igg1-b7h4-c3-fear、igg1-b7h4-c4-fear和igg1-b7h4-c2-fear进行了初始交叉阻断实验。结果汇总在表11中。进行了第二组交叉阻断实验以也包括igg1-b7h4-c5-fear。这些结果汇总在表12中。第一列显示固定化抗体;第一行显示溶液中的抗体(上面称为“第二抗体”)。显示了溶液中抗体的校正缔合响应。抗体的交叉阻断由深灰色表示,并且非阻断抗体组合未标记(透明背景),表明igg1-b7h4-c1-n52s-fear、igg1-b7h4-c3-fear和igg1-b7h4-c5-fear相互交叉阻断,而不与igg1-b7h4-c4-fear和igg1-b7h4-c2-fear交叉阻断,且反之亦然。
[0517]
表11:使用生物层干涉测量法的第一抗体交叉阻断实验。
[0518]
第一列显示固定化抗体并且第一行显示溶液中的抗体。显示了溶液中抗体的校正缔合响应。抗体的交叉阻断由深灰色表示,非阻断抗体组合未标记(透明背景)。
[0519][0520]
表12:使用生物层干涉测量法的第二抗体交叉阻断实验。
[0521]
第一列显示固定化抗体并且第一行显示溶液中的抗体。显示了溶液中抗体的校正缔合响应。抗体的交叉阻断由深灰色表示,非阻断抗体组合未标记(透明背景)。
[0522][0523]
实施例6-通过2-mea诱导的fab臂交换生成双特异性抗体
[0524]
如wo2011147986、wo2011131746和wo2013060867(genmab)和labrijn等人(labrijn et al.,pnas 2013,110:5145-50;gramer et al.,mabs 2013,5:962-973)所述,使用平台技术,即2-mea诱导的fab-臂交换,在体外产生双特异性抗体。为了使得能够通过这种方法产生双特异性抗体,生成了在ch3域中携带特定的点突变的igg1分子:在一个亲本igg1抗体中为f405l突变(即本技术中的cd3抗体),在另一个亲本igg1抗体中为k409r突变(即本技术中的b7h4或对照,hiv-1gp120特异性抗体)。除这些突变外,亲本igg1抗体包含取代l234f、l235e、d265a(fea)。
[0525]
为了生成双特异性抗体,将两种亲本抗体以等质量的量在pbs缓冲液(磷酸盐缓冲盐水;8.7mm hpo
42-,1.8mm h2po
4-,163.9mm na
+
,140.3mm cl-,ph 7.4)中混合。加入2-巯基乙胺-hcl(2-mea)至终浓度75mm,并将反应混合物在31℃温育5小时。根据制造商的方案,使用10kda分子量截留的slide-a-lyzer滑架(carriages)(thermo fisher scientific),通过透析到pbs缓冲液中去除2-mea,以允许链间二硫键的再氧化和完整的双特异性抗体的形成。
[0526]
在实施例中使用了以下抗体:
[0527]
b7h4抗体
[0528]
igg1-b7h4-c1-fear(具有seq id no:25和seq id no:33中所列的vh和vl序列)。
[0529]
igg1-b7h4-c1-n52s-fear(具有seq id no:29和seq id no:33中所列的vh和vl序列)。
[0530]
igg1-b7h4-c2-fear,具有seq id no:43和seq id no:47中所列的vh和vl序列。
[0531]
igg1-b7h4-c3-fear,具有seq id no:36和seq id no:40中所列的vh和vl序列。
[0532]
igg1-b7h4-c4-fear,具有seq id no:50和seq id no:54中所列的vh和vl序列。
[0533]
igg1-b7h4-c5-fear,具有seq id no:65和seq id no:69中所列的vh和vl序列。
[0534]
注释igg1表明制备了igg1同种型的全长抗体,并且fear注释表明重链恒定区包含氨基酸取代l234f、l235e、d265a和k409r,并且轻链恒定区是κ型(seq id no.61和63)。
[0535]
cd3抗体
[0536]
igg1-hucd3-feal(具有seq id no:16和seq id no:22中所列的vh和vl序列)。
[0537]
igg1-hucd3-h101g-feal(具有seq id no:17和seq id no:22中所列的vh和vl序列)。
[0538]
注释igg1表明制备了igg1同种型的全长抗体,并且feal注释表明重链恒定区包含氨基酸取代l234f、l235e、d265a和f405l,并且轻链恒定区是λ型(seq id no.60和64)。
[0539]
对照抗体
[0540]
igg1-b12-k409r(具有seq id no:14和seq id no:15中所列的vh和vl序列)。
[0541]
注释igg1表明制备了igg1同种型的全长抗体,并且k409r注释表明重链恒定区包含氨基酸取代k409r并且轻链恒定区是κ型(分别为seq id no.62和63)。
[0542]
双特异性抗体
[0543]
将上述cd3和b7h4抗体组合以生成双特异性抗体,其具有一个能够结合人cd3的抗原结合区和另一个能够结合b7h4的抗原结合区,提供同种型igg1的双特异性抗体,其被注释为bsigg1。
[0544]
bsigg1-hucd3-fealxb7h4-c1-fear
[0545]
bsigg1-hucd3-fealxb7h4-c1-n52s-fear
[0546]
bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear
[0547]
bsigg1-hucd3-fealxb7h4-c2-fear
[0548]
bsigg1-hucd3-fealxb7h4-c3-fear
[0549]
bsigg1-hucd3-fealxb7h4-c4-fear
[0550]
bsigg1-hucd3-h101g-fealxb7h4-c2-fear
[0551]
bsigg1-hucd3-h101g-fealxb7h4-c3-fear
[0552]
bsigg1-hucd3-h101g-fealxb7h4-c4-fear
[0553]
bsigg1-hucd3-h101g-fealxb7h4-c5-fear
[0554]
bsigg1-hucd3-fealxb12-fear(对于具有seq id no:14和seq id no:15中所列的vh和vl序列的b12臂)
[0555]
bsigg1-hucd3-h101g-fealxb12-fear
[0556]
实施例7-使用b7h4-b7h3嵌合分子和b7h4丙氨酸扫描文库确定参与结合的b7h4域和功能表位
[0557]
使用终点分析的b7h4-b7h3嵌合分子的域定位
[0558]
使用转染以表达人b7h4、人b7h3(在细胞外域中具有足够氨基酸序列差异的结构上相当的蛋白质)或两种不同的人b7h4-b7h3嵌合分子的一组细胞测定b7h4抗体的b7h4域特异性。制备表达构建体,其编码人b7h4、人b7h3(uniprot登录号q5zpr3-1;seq id no:9)或含有b7h3的igv域和b7h4的igc域的嵌合分子(b7h3-igv/b7h4-igc;seq id no:11),或含有b7h4的igv域和b7h3的igc域的嵌合分子(b7h4-igv/b7h3-igc;seq id no:10)。hek细胞被瞬时转染以表达这些构建体。
[0559]
细胞(3x104个细胞/孔)在聚苯乙烯96孔圆底板(greinerbio-one,目录号650101)中与在50μl pbs/0.1%bsa/0.02%叠氮化物(facs缓冲液)中的抗体的连续稀释物(范围为0.0046至10μg/ml,3倍稀释步骤)在4℃下温育30分钟。在facs缓冲液中清洗两次后,将细胞
mneogreen标记的感兴趣的抗体一起温育。细胞在室温下温育1小时。随后,添加150μl facs缓冲液并用facs缓冲液清洗细胞两次。将细胞重悬浮在30μl新鲜facs缓冲液中,并使用ique screener(intellicyt corporation,usa)通过流式细胞术进行分析。
[0571]
整个实验一式两份地进行2次。
[0572]
数据分析
[0573]
对于每个样品,每个细胞的平均抗体结合确定为非门控细胞群的荧光强度(gmfi)的几何平均值。gmfi受抗体对b7h4突变体的亲和力和每个细胞的b7h4突变体表达水平的影响。由于特定的丙氨酸突变可影响突变体b7h4的表面表达水平,并且通常为了校正每个b7h4突变体的表达差异,使用以下等式将数据相对于非交叉阻断b7h4特异性参考抗体的结合强度进行归一化:
[0574][0575]
其中c2用作c1-n52s和c3的参考抗体,c1-n52s用作c2的参考抗体,并且其中“aa位置”是指b7h4的特定ala突变体或野生型(wt)b7h4。
[0576]
为了在线性倍数变化标度上表达抗体结合的损失或获得,使用了以下计算:
[0577][0578]
在大多数情况下,结合的获得将由参考抗体与特定ala突变体的结合丧失引起。
[0579]
根据这些计算,在用丙氨酸替换氨基酸时,特定抗体没有结合损失或获得的氨基酸位置将给出结果“0”,结合的获得将导致“》0”和结合的损失将导致“《0”。为了校正样品变异,仅b7h4氨基酸残基被认为是“结合丢失突变体”,在所述b7h4氨基酸残基中结合倍数变化低于平均倍数变化-1.5x sd,其中sd是针对特定测试抗体的四个独立实验计算的倍数变化的标准偏差。
[0580]
如果特定b7h4突变体的参考抗体的gmfi低于平均gmfi
对照
ab的平均gmfi-2.5x sd,则从分析中排除数据(对于那些b7h4突变体,假设表达水平不足)。
[0581]
图3显示了b7h4抗体与ecd中具有ala突变的b7h4变体结合的倍数变化,其中注释了氨基酸残基,在所述氨基酸残基中结合的倍数变化低于平均倍数变化-1.5x sd。倍数变化在图3中表示为z分数。结果表明:
[0582]
·
抗体c1-n52s的结合至少依赖于人b7h4的igc域中的aa s151、v157、d158、y159、e164、l166、w173、p175、p177、v179、w181、f199、m208、v210、t222、y223、v240、e242和i245,
[0583]
·
抗体c2的结合至少依赖于人b7h4的igv中的aa r98、g99、r116、k118、n119和d124,并且
[0584]
·
抗体c3的结合至少依赖于人b7h4的igc域中的aa n156、e164、v217和r248,并且
[0585]
·
抗体c1-n52s、c2和c3识别b7h4上不同的功能表位。
[0586]
实施例8-b7h4单特异性和cd3xb7h4双特异性抗体与来自各种物种的b7h4的结合
[0587]
首先,通过流式细胞术分析双特异性cd3xb7h4抗体和单特异性b7h4抗体与用人b7h4或食蟹猴(macaca fascicularis)b7h4瞬时转染的hek-293f细胞的结合。未转染的
hek-293f细胞用作阴性对照;这些细胞(也)被证实不表达cd3。
[0588]
细胞(3x104个细胞/孔)在聚苯乙烯96孔圆底板(greiner bio-one,目录号650180)中与100μl pbs/0.1%bsa/0.02%叠氮化物(染色缓冲液)中的抗体连续稀释物(范围从0.000458到30μg/ml,4倍稀释步骤)在4℃下温育30分钟。实验在技术重复中进行。在染色缓冲液中清洗两次后,将细胞在4℃的50μl第二抗体中温育30分钟。作为第二抗体,使用了r-藻红蛋白(pe)-缀合山羊抗人iggf(ab’)2(facs缓冲液中1:500;jackson immunoresearch laboratories,inc.,westgrove,pa,目录号109-116-098)。将细胞在染色缓冲液中清洗两次,重悬浮在含有topro-3(1:10,000稀释物)的30μl facs缓冲液中,并在ique screener(intellicyt corporation,usa)上进行分析。使用graphpad prism v7.02软件(graphpad software,san diego,ca,usa)使用非线性回归(具有可变斜率的s型剂量响应)分析结合曲线。
[0589]
图4显示igg1-b7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear均与表达人b7h4或食蟹猴b7h4的细胞结合。
[0590]
接着,如上所述,测定对用来自犬、兔、大鼠、小鼠或猪的b7h4瞬时转染的hek-293f细胞的结合。图5显示了igg1-b7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear与来自犬、兔、大鼠和小鼠的b7h4不同程度地结合;对于每种,bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的表观亲和力(ec50)均低于igg1-b7h4-c1-n52s-fear的表观亲和力(ec50)。bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear不能与猪b7h4结合,而igg1-b7h4-c1-n52s-fear结合较弱并且仅在测试的最高抗体浓度下结合。
[0591]
bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear和igg1-b7h4-c1-n52s-fear与人和食蟹猴b7h4结合的ec50在相似的范围内。
[0592]
进行了类似的研究以比较igg1-b7h4-c1-052s-fear、igg1-b7h4-c3-fear、igg1-b7h4-c4-fear、igg1-b7h4-c2-fear和igg1-b7h4-c5-fear与来自不同物种(人、食蟹猴、小鼠、大鼠、兔、犬和猪)的b7h4的结合。图6显示对于测试抗体,对用人和食蟹猴b7h4转染的hek细胞的结合是相似的。用表达兔和犬b7h4的细胞获得了类似的结果。然而,igg1-b7h4-c1-n52s-fear与小鼠b7h4的结合相对于igg1-b7h4-c3-fear、igg1-b7h4-c4-fear、igg1-b7h4-c2-fear和igg1-b7h4-c5-fear的结合似乎更低,与实施例3中的结果一致。另外,gg1-b7h4-c1-n52s-fear和igg1-b7h4-c3-fear与大鼠b7h4的结合相对于igg1-b7h4-c4-fear、igg1-b7h4-c2-fear和igg1-b7h4-c5-fear似乎更低。此外,虽然igg1-b7h4-c4-fear、igg1-b7h4-c2-fear和igg1-b7h4-c5-fear与猪b7h4结合,但igg1-b7h4-c1-052s-fear的结合非常弱并且仅在测试的最高抗体浓度明显。无法检测到igg1-b7h4-c3-fear与猪b7h4的结合。
[0593]
实施例9-b7h4单特异性和cd3xb7h4双特异性抗体与表达b7h4的人肿瘤细胞系的结合
[0594]
测定了igg1-b7h4-c1-n52s-fear和/或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear和/或bsigg1-hucd3-fealxb7h4-c1-n52s-fear与表达b7h4的人肿瘤细胞系mcf-7(乳腺腺癌;atcc,目录号htb-22)、mda-mb-468(乳腺腺癌;atcc,目录号htb-132)和sk-br3(乳腺腺癌;atcc,目录号htb-30)的结合,以及bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear与表达b7h4的人肿瘤细胞系nih-ovcar-3(卵巢腺癌;atcc,目录号htb-161)或hcc1954(乳腺导管癌;atcc,目录号crl-2338)的结合。此外,测定了igg1-b7h4-c1-n52s-fear、
bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear、igg1-b7h4-c2-fear、bsigg1-hucd3-fealxb7h4-c2-fear或bsigg1-hucd3-h101g-fealxb7h4-c2-fear、igg1-b7h4-c3-fear、bsigg1-hucd3-h101g-fealxb7h4-c3-fear、igg1-b7h4-c4-fear、bsigg1-hucd3-h101g-fealxb7h4-c4-fear、igg1-b7h4-c5-fear和/或bsigg1-hucd3-h101g-fealxb7h4-c5-fear与mda-mb-468和hcc1954细胞的结合。实体瘤细胞系通常不表达cd3。作为阴性对照,使用未显示可检测到的b7h4表达的肿瘤细胞系hela(宫颈腺癌;atcc,目录号ccl-2)。如上所述通过流式细胞术分析结合。
[0595]
图7显示igg1-b7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear对mcf-7和mda-mb-468细胞显示出相当的剂量依赖性结合,具有相当的最大结合水平。
[0596]
图8显示了bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear对nih-ovcar-3和hcc1954细胞的剂量依赖性结合,并且缺乏与非b7h4表达细胞系hela的可检测结合。
[0597]
使用mda-mb-486和sk-br3细胞比较bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-fealxb7h4-c1-n52s-fear与表达b7h4的肿瘤细胞的结合。图9显示bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-fealxb7h4-c1-n52s-fear对这些细胞显示出相当的剂量依赖性结合,具有相当的最大结合水平。
[0598]
图10显示同二聚体或双特异性抗体格式的c1-n52s、c2、c3、c4和c5b7h4抗体对mda-mb-468和hcc1954细胞的剂量依赖性结合。基于c4和c5的抗体显示出最高的结合效率,基于c1-n52s和c2的抗体显示出中等的结合效率,基于c3的抗体结合显示出最低的效率。基于c1-n52s、c2、c4和c5的抗体之间的最大结合相当,但基于c3的抗体较低。
[0599]
实施例10-b7h4抗体与原发性肿瘤细胞的结合
[0600]
卵巢癌患者的原发性肿瘤细胞获得自discovery life sciences(huntsville,al,usa;患者id 110045042)。通过流式细胞术评估igg1-b7h4-c1-n52s-fear与肿瘤细胞的结合:将细胞以2x104个细胞/孔接种在聚苯乙烯96孔圆底板(greiner bio-one,目录号650180)中,离心并与在pbs中以1:1000稀释的50μl fixable viability stain fvs-bv510(bdbiosciences,目录号564406)在4℃下温育30分钟。在染色缓冲液中清洗后,将细胞与fitc标记的igg1-b7h4-c1-n52s-fear和一组cd3(ef450标记;ebioscience,目录号48-0037-42)、cd45(bv786标记;biolegend,目录号304048)、cd14(pe-cy7标记;bd biosciences,目录号557742)、cd86(percp-cy5.5标记;biolegend,目录号305420)、cd163(apc-cy7标记;biolegend,目录号333622)和epcam(af700标记;r&d系统,目录号fab9601n)特异性抗体在4℃下温育30分钟。清洗后,将细胞重悬浮在染色缓冲液中并使用facs fortessa(bd biosciences)进行分析。基于散射fsc/ssc对单个细胞进行门控,并通过排除fvs-bv510阳性细胞鉴定活细胞。肿瘤细胞鉴定为epcam阳性细胞。
[0601]
流式细胞术分析显示,igg1-b7h4-n52s-fear结合epcam阳性活肿瘤细胞,但不结合卵巢癌样品的解离肿瘤细胞悬浮液中的单核细胞或t细胞。
[0602]
实施例11-使用纯化的t细胞作为效应细胞以不同的效应物与靶物的比率,通过cd3xb7h4双特异性抗体在体外诱导t细胞介导的细胞毒性
[0603]
为了确定在双特异性抗体bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear存在下t细胞介导的肿瘤细胞杀伤效率,使用b7h4阳性肿瘤细胞系作为靶细胞和纯化的t细胞作为效应细胞,以不同的效应细胞与靶细胞(e:
t)比率进行体外细胞毒性测定。
[0604]
从健康的人供体血沉棕黄层(sanquin,amsterdam,the netherlands)中获得t细胞,并根据制造商的说明使用rosettesep
tm
人t细胞富集混合物(stemcell technologies,france,目录号15061)进行分离。将sk-br3细胞(16,000个细胞/孔)接种到平底96孔板(greiner-bio-one,the netherlands,目录号655180)中,并37℃下静置粘附4小时。将t细胞以2:1、4:1或8:1的效应物与靶物(e:t)比率添加到肿瘤细胞中。添加bsigg1-hucd3-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的连续稀释物(最终浓度范围为10,000至0.0128ng/ml;5倍稀释)并将板在37℃下温育72小时。将板用pbs清洗3次,并将细胞与150μl/孔的10%alamarblue(r)溶液(invitrogen,目录号dal1100)在37℃下温育4小时。作为细胞毒性的阳性对照,将细胞与16μg/ml氧化苯胂(pao;sigma-aldrich,目录号p3075;溶于二甲亚砜[dmso;sigma-adrich,目录号d2438])一起温育。在envision读板器(perkinelmer)上在615nm(od615)处测量alamarblue荧光,作为肿瘤细胞培养物和因此存活肿瘤细胞的代谢活性的量度。将pao处理的肿瘤细胞样品的吸光度设为0%存活,并且将未处理的肿瘤细胞样品的吸光度设为100%存活。“百分比活细胞”计算如下:
[0605]
%活细胞=([样品吸光度-pao处理的靶细胞吸光度]/
[0606]
[未处理的靶细胞吸光度-pao处理的靶细胞吸光度])x100。
[0607]
使用graphpad prism v7.02软件(graphpad software,sandiego,ca,usa)使用非线性回归分析(具有可变斜率的s型剂量响应)生成剂量响应曲线和ic50值。
[0608]
图11显示在所有e:t比率下均观察到t细胞介导的细胞毒性,在e:t比率为8:1时观察到最大的肿瘤细胞杀伤(小于10%的活肿瘤细胞)。
[0609]
实施例12-cd3xb7h4双特异性抗体在各种肿瘤细胞系中体外诱导细胞毒性以及与b7h4表达水平的相关性。
[0610]
使用8:1的e:t比率,如上所述在体外细胞毒性测定法中测定双特异性抗体bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear对各种表达b7h4的肿瘤细胞系的t细胞介导的杀伤。使用了以下细胞系:mcf-7、mda-mb-486、sk-br3、nih-ovcar-3、hcc1954和nci-h1650。对于每次温育,将含有t细胞的150μl上清液转移至u底96孔培养板(cellstar,目录号650180),然后进行清洗和alamarblue温育(以确定t细胞活化和细胞因子释放,如下所述)
[0611]
对于这些肿瘤细胞系,根据制造商的说明,使用bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear通过定量流式细胞术(人igg校准器,biocytex)对b7h4的表达进行量化,以检测b7h4。
[0612]
图12显示了bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear两者在mcf-7、mda-mb-486、sk-br3、nih-ovcar-3和hcc1954细胞中体外诱导的剂量依赖性t细胞介导的细胞毒性。虽然两种bsab变体均达到了最大的细胞毒活性(《10%的活肿瘤细胞),但与bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear相比,这对于bsigg1-hucd3-fealxb7h4-c1-n52s-fear在较低浓度下发生(表13)。
[0613]
对于bsigg1-hucd3-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear(图13b),未观察到肿瘤细胞裂解与b7h4表达水平之间的显著关
系(图13a)。图13b显示了t细胞介导的杀伤的ic50,对于每个细胞系在bsigg1-hucd3-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear存在下,使用衍生自4-6个供体的t细胞,细胞系从最低到最高的b7h4表达水平排列。这意味着t细胞介导的杀伤可以在广泛的b7h4表达水平范围内发生。
[0614]
表13汇总了一组5个细胞系和4个供体间的结果。
[0615]
表13.通过cd3xb7h4双特异性抗体在各种肿瘤细胞系中体外诱导细胞毒性。
[0616][0617]
bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear还诱导测试的nci-h1650 nsclc细胞系的剂量依赖性t细胞介导的细胞毒性。
[0618]
实施例13-在b7h4阳性肿瘤细胞存在下通过cd3xb7h4双特异性抗体外诱导t细胞活化和细胞因子产生
[0619]
将含有实施例12中描述的体外t细胞介导的细胞毒性实验期间收集的上清液的u底96孔培养板在4℃下离心(300x g)3分钟,然后将75μl上清液转移到用于测量细胞因子产生的新板,并保留t细胞以评估t细胞活化(如下所述)。根据制造商的说明,通过多重u-plex测定法(meso scale discovery,usa,目录号k15049k)分析细胞因子产生。
[0620]
对t细胞进行t细胞标记物cd3(1:200;ebioscience,克隆okt3,与efluor450缀合)、cd4(1:50;ebioscience,克隆okt4,与apc-efluor780缀合)、cd8(1:100;biolegend,克隆rpa-t8,与af700缀合)和t细胞活化标志物cd69(1:50;bd biosciences,克隆ab2439,与apc缀合)、cd25(1:50;ebioscience,克隆bc96,与pe-cy7缀合)和cd279/pd1(1:50;biolegend,克隆eh12.2h7,与bv605缀合)染色。包括具有ultracomp珠(5μl;invitrogen,目录号01-2222-42)的单染色样品,并且用于流式细胞仪的补偿调整。在4℃下温育30min后,用pbs/0.1%bsa/0.02%叠氮化物(染色缓冲液)清洗板3次。将细胞重悬浮在120μl染色缓冲液中,并使用facs fortessa(bd biosciences)进行分析。使用flowjo(bd biosciences)处理数据。
[0621]
使用graphpad prism v7.02软件(graphpad software,sandiego,ca,usa),使用非线性回归分析(具有可变斜率的s型剂量响应)计算剂量响应曲线、ec50、ec90和ec99值。
[0622]
图14a显示b7h4阳性肿瘤细胞系在bsigg1-hucd3-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear存在下的t细胞活化,如由cd8+t细胞上的活化标志物cd69表达(通过流式细胞术测定)定义的。图14b显示了对于每个肿瘤细胞系,使用衍生自3-4个供体的t细胞得到的t细胞活化的ec50。
[0623]
总体而言,在bsigg1-hucd3-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear存在下,cd8+t细胞子集(在最高抗体浓度下为约20-50%)变为活化的。bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear诱导的t细胞活化通常在比bsigg1-hucd3-fealxb7h4-c1-n52s-fear诱导的浓度更高的浓度下发生(图14a)。这两种双特异性抗体的t细胞活化的ec50在使用的靶细胞系之间和供体之间是可变的(图14b)。
[0624]
通过mesoscale discovery u-plex多重elisa在肿瘤细胞-t细胞培养物的上清液中评估细胞因子的产生。在细胞系组间分析的10种细胞因子中,使用来自4名供体的t细胞,主要观察到ifn-γ和il-8的细胞因子水平显著增加(》2 000pg/ml)。il-4、il-6和il-13的调节水平要低得多(《500pg/ml),而il-1β、il-2、il-10、il-12p70和tnfα水平通常低于50pg/ml。因为ifn-γ变化被稳健且一致地检测到,并且ifn-γ是细胞因子释放综合征患者血清中升高的核心细胞因子之一,所以代表了该细胞因子的数据。
[0625]
图15显示了在bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear存在下在50%、90%和99%的肿瘤细胞(分别为ec50、ec90、ec99)中诱导t细胞介导的细胞毒性的抗体浓度下,t细胞-肿瘤细胞共培养物的上清液中的ifn-γ水平,每个细胞系使用来自分析的至少3个供体的t细胞进行下。每个供体和每个靶肿瘤细胞系的细胞因子产生水平不同。然而,在诱导相同水平(%)的肿瘤细胞杀伤的抗体浓度下,通常在将t细胞-肿瘤细胞共培养物暴露于bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear后,观察到与暴露于bsigg1-hucd3-fealxb7h4-c1-n52s-fear后的水平相比较低的细胞因子产生水平。因此,在相同的肿瘤细胞杀伤水平下,与bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear温育导致细胞因子产生低于bsigg1-hucd3-fealxb7h4-c1-n52s-fear。
[0626]
实施例14-cd3xb7h4双特异性抗体在食蟹猴中的非临床安全性研究
[0627]
在法国citoxlab,在非人灵长类动物(食蟹猴,macaca fascicularis,起源于毛里求斯)中评估了bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的非临床安全性概况。基于bsigg1-hucd3-fealxb7h4-c1-n52s-fear和bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear的cd3臂的物种特异性,此外由于b7h4臂与人和食蟹猴b7h4的相似结合以及进一步的药理学发现,食蟹猴被认为是非临床安全性研究的唯一相关物种。这些研究是按照动物健康法规(2010年9月22日第2010/63/eu号理事会指令和2013年2月1日关于保护用于科学目的的动物的第2013-118号法国法令)进行的。
[0628]
研究的目的是确定cd3xb7h4双特异性抗体的潜在毒性和毒动学。此处仅描述了毒动学的结果和血浆中细胞因子水平测定。
[0629]
在两项独立的研究中,用单剂量0.1、1、3或10mg/kg bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear或bsigg1-hucd3-fealxb7h4-c1-n52s-fear(每剂一只雌性动物)通过静脉内(iv)输注处理动物。输注之日在研究中表示为第1天。在给药前和给药后0.5h、2h、4h、12h、24h和48h获得血样两次用于评估毒动学概况和血浆细胞因子水平,并且另外在给药后168、336和504小时评估毒动学。
[0630]
细胞因子水平
[0631]
使用luminexxmap技术分析血浆样品的细胞因子水平(il-1β、il-2、il-4、il-5、
il-6、il-8、il-10、tnf、il-12p70、il-15和ccl2/mcp1)。
[0632]
对食蟹猴施用bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear仅产生血浆细胞因子水平的微小变化,这被认为与测试化合物无关,而施用bsigg1-hucd3-fealxb7h4-c1-n52s-fear导致il-6和mcp-1水平的剂量依赖性增加,如图16所示。
[0633]
与bsigg1-hucd3-fealxb7h4-c1-n52s-fear抗体相比,用双特异性bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear治疗后产生的较低细胞因子水平可能在临床环境中提供优势。
[0634]
毒动学
[0635]
使用通用igg pk eclia方法测定cd3xb7h4双特异性的血浆浓度。使用与静脉内输注注射施用途径一致的非房室方法,使用certara phoenix winnonlin药代动力学软件8.1版估计毒动学参数。图17显示这两种cd3xb7h4双特异性抗体的毒动学概况在给药后直至7天高度相当,两者均显示出与剂量相关的血浆暴露。
[0636]
进行药代动力学建模以评估具有较低cd3亲和力的bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear变体所需的预计临床剂量范围是否无法持续较高。使用由食蟹猴中的观察结果得到的pk模型。推导出的临床剂量范围预计产生与体外观察到的t细胞介导的细胞杀伤的ec50至ec90相等的一周平均血浆暴露。所得的剂量范围被认为是可行的,并且这方面没有先验给出相对于另一类双特异性抗体有利于一类双特异性抗体(bsigg1-hucd3-h101g-fealxb7h4-c1-n52s-fear相对于bsigg1-hucd3-fealxb7h4-c1-n52s-fear)的理由。
[0637]
实施例15-b7h4在各种人癌症适应症中的表达
[0638]
从omicsoft tcga数据库中提取b7h4 mrna水平,并使用oncoland软件(qiagen,usa)进行可视化。
[0639]
图18显示了一系列原发性实体瘤中的b7h4 mrna表达水平,根据表达的中位数排列。在一大批癌症适应症中发现mrna表达,并且在每种适应症中有所不同,在子宫癌肉瘤(ucs)、膀胱尿路上皮癌(blca)、胰腺腺癌(paad)、肺鳞状细胞癌(lusc)、乳腺侵入癌(brca)、子宫体子宫内膜癌(ucec)、卵巢浆液性囊腺癌(ov)和胆管癌(chol)中发现最高的表达中位数。
[0640]
通过在组织微阵列(tma;均购自biomax)上的免疫组织化学(ihc)分析结肠、肺(小细胞肺癌,sclc和非小细胞肺癌,nsclc)、胃、胰腺、膀胱、宫颈、头和颈、乳腺(包括三阴性乳腺癌,tnbc)、卵巢癌、食管癌、肾癌、前列腺癌和子宫癌以及胆管癌中b7h4的蛋白质表达。染色前,将新鲜切割的tma切片(5μm)脱蜡并与target retrieval solution ph 9(dako,s2367;97℃下30min,冷却60min)一起温育。在labvision自动染色平台上使用商业兔抗人b7-h4单克隆抗体(克隆d1m8i,#14572,cell signaling technologies)以最佳稀释(1:25;最终浓度2.6μg/ml)进行b7h4 ihc 30min(rt)。随后,切片与抗兔igg聚合物(envisiontm flex+兔(dako,s2022)一起温育,清洗并与dako liquid dab+底物显色系统(dako,k3468)一起温育。苏木精(dako,s3301)用于检测有核细胞。使用optiview检测在ventana benchmark上用小鼠抗细胞角蛋白抗体混合物(克隆ae1/ae3)进行细胞角蛋白(以确定感兴趣的肿瘤区域,roi)ihc。用dab可视化细胞角蛋白,并使用默认的ventana试剂用苏木精复染细胞核。在axioscan(zeiss)上以20x放大率对染色的tma切片进行数字化处理。最初,进
行手动评分以确定平均b7h4染色强度(阴性-低-中-高)和具有》10%b7h4阳性肿瘤细胞的肿瘤核心的百分比。
[0641]
随后,进行了自动评分。使用与b7h4染色的tma切片相邻的tma切片上的细胞角蛋白掩模来定义肿瘤roi。量化肿瘤roi中的b7h4染色强度(阴性、弱(1)、中等(2)或强(3)),并使用halo图像分析软件确定b7h4阳性肿瘤细胞的百分比(范围0-100%)。对于每个适应症,确定具有》10%b7h4阳性肿瘤细胞的肿瘤核心的百分比。
[0642]
表14显示了通过biomax tma的ihc分析测定的b7h4蛋白表达。在结肠癌、前列腺癌、肾癌和小细胞肺癌样品中看到从无b7h4表达至极低的b7h4表达。在来自其他适应症的样品中,b7h4表达有所不同,在胃癌、胰腺癌、胆管癌、食管癌、膀胱癌、非小细胞肺癌(特别是鳞状nsclc)、宫颈癌、头颈癌、乳腺癌(三阴性乳腺癌[tnbc]和非tnbc)、卵巢癌和子宫癌中发现b7h4表达增加。
[0643]
表14.通过biomax tma的ihc分析测定的b7h4蛋白表达。nd=未测定。
[0644]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1