ATRA或其他维甲酸与结合BCMA的免疫治疗剂的联合疗法的制作方法
atra或其他维甲酸与结合bcma的免疫治疗剂的联合疗法
技术领域
1.本发明涉及atra和其他维甲酸与结合bcma的免疫治疗剂的联合疗法,所述免疫治疗剂例如能够结合bcma的car-t细胞、能够结合bcma的抗体或能够结合bcma的抗体片段。根据本发明,这些联合疗法可以有利地应用于癌症如多发性骨髓瘤的治疗,也可以应用于抗体介导的自身免疫疾病的治疗。根据本发明的癌症治疗中的联合疗法是有利的,例如,因为维甲酸如atra可以上调癌细胞中的bcma mrna水平以及bcma蛋白水平,从而使得癌细胞可以更有效地被能够结合bcma的免疫治疗性抗癌剂靶向,例如被能够结合bcma的car-t细胞、能够结合bcma的抗体或能够结合bcma的抗体片段靶向。此外,atra和其他维甲酸可与γ-分泌酶抑制剂和靶向bcma的免疫治疗剂结合使用,从而进一步增加靶细胞上的bcma表达,从而产生更好的免疫治疗反应。
背景技术:
2.多发性骨髓瘤(mm)是一种基本上无法治愈的血液病,其特征是恶性浆细胞在骨髓中不受控制地克隆性增殖
1,2
。尽管最近批准了几种新的治疗方法,仍然认为骨髓瘤是不可治愈的。大多数患者成为难治性患者,或因毒性而不得不停止治疗,最终死于疾病
3-5
。
3.由于car t细胞已被证明能诱导其他晚期血液学恶性肿瘤如急性淋巴细胞白血病(all)和弥漫性大b细胞淋巴瘤(dlbcl)的持久完全缓解,目前正在大力开发基于car的mm治疗方法
6-10
。最近,b细胞成熟抗原(bcma)作为mm治疗的可能靶抗原越来越受到关注
2,11,12
。bcma是一种由mm细胞表达的肿瘤坏死家族受体(tnfr)。它也存在于一些健康的造血细胞上,例如浆细胞和浆细胞样树突状细胞,但不在健康实体组织的细胞上。这种良好的表达情况促进了包括cart细胞疗法在内的bcma特异性免疫疗法的显着发展
13-19
。在最近的i/ii期临床试验中,bcma-car t细胞在部分mm患者中取得了部分和完全反应
16,19
。
4.视黄酸可以影响细胞的基因表达和蛋白质生产
20
。全反式维甲酸(atra)的使用已被广泛调查,作为一些癌症类型的治疗方法,它被证明可以诱发翻译后修饰的重大变化,如肿瘤细胞的组蛋白乙酰化
21-24
。atra治疗还诱导mm细胞的表观遗传变化,导致cd38表达增强,随后增强cd38靶向抗体达雷妥尤单抗(daratumumab)的功效
22,25
。
5.γ-分泌酶抑制剂(gsi)的给药还可以通过阻断普遍存在的多亚基γ-分泌酶复合物对bcma的切割来增加mm细胞上的bcma表达,从而改善bcma-car-t细胞对mm细胞的识别
40
。
6.在本发明之前,本领域仍然需要更有效的癌症疗法,包括多发性骨髓瘤的疗法。
技术实现要素:
7.本发明人研究了atra诱导的表观遗传学变化是否影响癌细胞,特别是mm细胞的bcma表面表达和可溶性bcma(bcmas)分子的释放。此外,还分析了这些atra诱导的变化是否也影响bcma-car t细胞的疗效。
8.b细胞成熟抗原(bcma)优先由b系细胞表达,包括多发性骨髓瘤(mm)细胞。由于其良好的表达模式,它代表了嵌合抗原受体(car)疗法的一个有希望的目标。目前正在进行
bcma-car t细胞的临床试验,并取得了令人鼓舞的初步成果。然而,存在一些治疗上的局限性,如bcma表达低或不均匀,以及抗原丢失或下调后的肿瘤复发。为了克服这些障碍,发明人旨在增加癌细胞(如mm细胞)上bcma的整体表达。
9.本发明人研究了全反式维甲酸(atra)在mm细胞中上调bcma的潜力,从而提高bcma特异性car t细胞的性能。通过使用定量rt-pcr和流式细胞仪,观察到与维甲酸atra共孵化可以诱导原代mm细胞和骨髓瘤细胞系上的bcma rna水平和bcma表面表达明显增加。
10.重要的是,当用atra预处理后,bcma特异性car t细胞显示出对靶细胞系的识别和裂解能力增强。与未经处理的靶细胞相比,用atra处理过的靶细胞刺激后,bcma-car t细胞的细胞因子释放和增殖得到了加强。甚至在mm1.s/nsg小鼠中,当动物注射atra数天后,bcma在肿瘤细胞表面也上调了。与单药治疗相比,atra和bcma特异性car t细胞的联合治疗导致了肿瘤质量明显和长时间的下降。
11.此外,研究表明,通过将atra与γ-分泌酶抑制剂(gsi)相结合,可以进一步增强bcma上调对靶细胞系的影响。通过联合使用这两种药物,bcma-car t细胞的效率在体外和体内得到进一步提高。因此,gsi和atra这两种药物的联合应用导致了关于bcma上调和bcma-car-t细胞识别的更大效果。
12.根据本发明,维甲酸类如atra可用于增强bcma靶向免疫疗法,例如,通过增加肿瘤细胞上的bcma基线表达,并在治疗期间将其保持在高水平。
13.尽管维甲酸atra导致骨髓瘤细胞表面的bcma表达增强,但在atra处理的细胞上清液中没有发现脱落的可溶性bcma(sbcma)的增加。这是维甲酸atra的一个意外的有利影响,因为1)sbcma经常在骨髓瘤患者的血清中发现,因此预计用atra治疗后会增加,而且2)应该避免sbcma的增加,因为它可能干扰和抑制bcma介导的抗癌疗法的疗效。
14.然而,发明人证实,在高浓度的sbcma存在下,他们的bcma car的抗mm反应性不受抑制,高浓度的sbcma可能发生在atra治疗的较晚时间点,并且在骨髓瘤患者的血清中经常发现。
15.根据本发明,bcma的有利上调不仅可以用atra实现,也可以用其他维甲酸类实现。这些维甲酸类认为具有相同的作用(如作为特定的表观遗传调节剂),因此可以根据本发明使用。
16.本发明人所做的研究说明了将维甲酸酯类(如atra)和能够与bcma结合的免疫治疗剂(如bcma-car t细胞)结合起来治疗癌症(如治疗骨髓瘤)的有利效果。
17.此外,根据本发明,这种联合疗法也可以有利地应用于治疗抗体介导的自身免疫性疾病。抗体是由b细胞分泌的,大部分是由浆细胞分泌的,而浆细胞是分化的b细胞。自身抗体是与个体自身蛋白质结合的抗体,可诱发自身免疫性疾病(如红斑狼疮)。因此,b细胞,特别是浆细胞可以作为治疗此类自身免疫性疾病的治疗目标。一些针对cd19、cd20和cd22的单克隆抗体已经被用来针对多种b细胞亚型。cd20靶向抗体利妥昔单抗已经被批准用于类风湿性关节炎、多发性肉芽肿病和显微多血管炎(k hofmann,et.al,front.immunol.,23april 2018,targeting b cells and plasma cells in autoimmune diseases,https://doi.org/10.3389/fimmu.2018.00835;a.rubbert-roth,et.al efficacy and safety of various repeat treatment dosing regimens of rituximab in patients with active rheumatoid arthritis:results of a phase iii randomized study
(mirror),rheumatology,volume 49,issue 9,september 2010,pages 1683
–
1693,https://doi.org/10.1093/rheumatology/keq116)。
18.b细胞成熟抗原(bcma)优先由b系细胞包括浆细胞表达。因此,根据本发明,抗体介导的自身免疫性疾病也可以用根据本发明的能够与bcma结合的免疫治疗剂来治疗。这里,根据本发明施用bcma mrna水平的上调剂,例如根据本发明的维甲酸,有望提高治疗的效率。根据本发明,代替能够与bcma结合的免疫治疗剂,包括编码能够与bcma结合的嵌合抗原受体(car)的基因治疗载体的免疫治疗剂,所述基因治疗载体是用于在免疫细胞中体内表达所述car的基因治疗载体,也可以根据本发明使用。
19.本发明通过以下优选的实施方案举例说明:
20.1.一种能够结合bcma的免疫治疗性抗癌剂,用于针对人类患者的bcma作为癌症抗原的癌症免疫治疗的方法,其中所述方法是一种将bcma mrna水平的上调剂施用于人类患者的方法。
21.2.一种bcma mrna水平的上调剂,用于针对人类患者的bcma作为癌症抗原的癌症免疫治疗的方法,其中所述方法是一种将能够结合bcma的免疫治疗性抗癌剂施用于所述人类患者的方法。
22.3.一种能够结合bcma的免疫治疗性抗癌剂和bcma mrna水平的上调剂的组合,用于针对人类患者的bcma作为癌症抗原的癌症免疫治疗方法。
23.4.一种通过针对人类患者的bcma作为癌症抗原的免疫疗法治疗癌症的方法,所述方法包括向所述人类患者施用能够结合bcma的免疫治疗性抗癌剂和bcma mrna水平的上调剂。
24.5.如第1项所述的免疫治疗性抗癌剂的用途、第2项所述上调剂的用途、第3项所述的组合的用途或第4项所述的方法,其中所述上调剂为维甲酸。
25.6.如第1~5项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述维甲酸为非芳香族维甲酸。
26.7.如第6项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述非芳香族维甲酸为全反式视黄酸(atra)、异维甲酸(13-顺式视黄酸)、阿利维a酸(9-顺式维甲酸)、视黄醛或视黄醇。
27.8.如第1~7项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述上调剂为全反式维甲酸(atra)。
28.9.如权利要求5所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述维甲酸是芳香族维甲酸。
29.10.如第9项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述芳香族维甲酸是单芳香族维甲酸,优选阿维a、依曲替酯或莫维a胺。
30.11.如第9项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述芳香族维甲酸为多芳香族维甲酸,优选为阿达帕林、芳香维甲酸、乙炔维甲酸如他扎罗汀或贝沙罗汀。
31.12.如第1~11项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述癌症是易受所述上调剂上调bcma mrna水平影响的
癌症。
32.13.如第1~12项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述癌症为血液癌,优选为白血病、淋巴瘤或骨髓瘤。
33.14.如第1~13项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中,所述癌症为癌细胞的一部分或全部表达bcma的癌症。
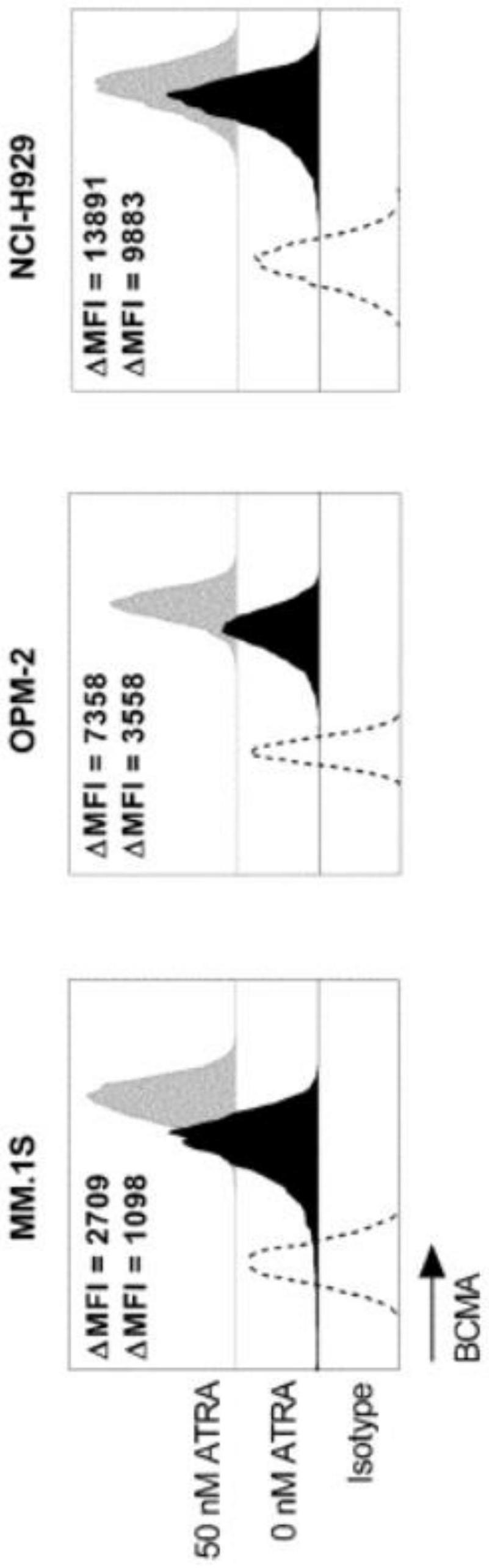
34.15.如第1~14项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述癌症为多发性骨髓瘤、b细胞白血病或b细胞淋巴瘤。
35.16.如第1~15项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中,所述癌症为多发性骨髓瘤。
36.17.如第1~16项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的所述免疫治疗性抗癌剂包含表达能够结合bcma的嵌合抗原受体(car)的免疫细胞。
37.18.如第17项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中表达能够结合bcma的car的所述免疫细胞是表达能够结合bcma的car的t细胞(car-t细胞能够结合bcma)。
38.19.如第1~18项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的所述免疫治疗性抗癌剂包含能够结合bcma的抗体或能够结合bcma的抗体片段,并且其中所述抗体或抗体片段优选地是双特异性抗体,其更优选地选自bite或dart。
39.20.如第19项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的抗体或能够结合bcma的抗体片段是与药物的偶联物。
40.21.如第20项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述药物为抗癌药。
41.22.如第17或18项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中与单独使用免疫细胞的癌症免疫治疗相比,所述用途导致免疫细胞的长期的持久性和/或肿瘤质量的长期下降。
42.23.如第1~22项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述癌症为复发难治性多发性骨髓瘤或新诊断的多发性骨髓瘤。
43.24.如权利要求1~23中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中,在所述方法中,需施用γ分泌酶抑制剂。
44.25.如第24项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中,所述γ分泌酶抑制剂为司马西他(ly450139,semagacestat)、克瑞尼西他(ly3039478,crenigacestat)、ro4929097、dapt或mk-0752。
45.26.一种能够结合bcma的免疫治疗剂,用于治疗人类患者的抗体介导的自身免疫性疾病的方法中,其中所述方法为一种将bcma mrna水平的上调剂施用于所述人类患者的方法。
46.27.一种bcma mrna水平的上调剂,用于治疗人类患者的抗体介导的自身免疫性疾病的方法,其中所述方法为一种将能够结合bcma的免疫治疗剂施用于所述人类患者的方
法。28.一种能够结合bcma的免疫治疗剂和bcma mrna水平上调剂的组合,用于治疗人类患者的抗体介导的自身免疫性疾病的方法。
47.28.能够结合bcma的免疫治疗剂和bcma mrna水平的上调剂的组合,用于治疗人类患者的抗体介导的自身免疫性疾病的方法。
48.29.一种治疗人类患者的抗体介导的自身免疫性疾病的方法,所述方法包括向所述人类患者施用能够结合bcma的免疫治疗剂和bcma mrna水平的上调剂。
49.30.如第26项所述的免疫治疗剂的用途、第27项所述的上调剂的用途、第28项所述的组合的用途或第29项所述的方法,其中所述上调剂如第5~11项中任一项所定义。
50.31.如第26~30项中任一项所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的所述免疫治疗剂包括表达能够结合bcma的嵌合抗原受体(car)的免疫细胞。
51.32.如第31项所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中表达能结合bcma的car的免疫细胞是表达能结合bcma的car的t细胞(能结合bcma的car-t细胞)。
52.33.如第26~32项中任一项中所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的所述免疫治疗剂包括能够结合bcma的抗体或能够结合bcma的抗体片段。
53.34.如第33项所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中能够结合bcma的抗体或能够结合bcma的抗体片段是与药物的偶联物。
54.35.如第34项所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述药物为细胞毒性药物。
55.36.如第26~35项中任一项所述的免疫治疗剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述抗体介导的自身免疫性疾病是格雷夫斯病、重症肌无力、红斑狼疮、类风湿性关节炎,古德帕斯彻综合征(goodpasture syndrome)、硬皮病、crest综合征、肉芽肿性多血管炎、显微镜下多血管炎、寻常型天疱疮、干燥综合征(syndrome)、1型糖尿病、原发性胆汁性胆管炎、桥本甲状腺炎(hashimoto’s thyreoiditis)、视神经脊髓炎谱系疾病、抗nmda受体脑炎、血管炎或多发性硬化症。
56.37.一种免疫治疗性抗癌剂,其包含编码能够结合bcma的嵌合抗原受体(car)的基因治疗载体,所述基因治疗载体是用于在免疫细胞中体内表达所述car的基因治疗载体,用于在人类患者中针对作为癌症抗原的bcma的癌症免疫疗法的方法中,其中所述方法是将bcma mrna水平的上调剂施用于人类患者的方法。
57.38.一种bcma mrna水平的上调剂,用于针对人类患者的bcma作为癌症抗原的癌症免疫治疗的方法,其中所述方法是指将免疫治疗性抗癌剂施用于人类患者的方法,所述免疫治疗性抗癌剂包括编码能够结合bcma的嵌合抗原受体(car)的基因治疗载体,所述基因治疗载体是用于在免疫细胞中体内表达所述car的基因治疗载体。
58.39.一种免疫治疗性抗癌剂和bcma mrna水平上调剂的组合,用于针对人类患者的bcma作为癌症抗原的癌症免疫治疗的方法,所述免疫治疗性抗癌剂包括编码能够结合bcma的嵌合抗原受体(car)的基因治疗载体,所述基因治疗载体是用于所述car在免疫细胞中的体内表达的基因治疗载体。
59.40.一种通过针对人类患者的bcma作为癌症抗原的免疫疗法治疗癌症的方法,该方法包括向人类患者施用一种免疫治疗性抗癌剂和一种bcma mrna水平的上调剂,所述免疫治疗性抗癌剂包括编码能够结合bcma的嵌合抗原受体(car)的基因治疗载体,所述基因治疗载体是用于在免疫细胞中的体内表达所述car的基因治疗载体。
60.41.如第37~40项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述上调剂如第5~11项中任一项所定义。
61.42.如第37~41项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中所述癌症如第12~16或23项中任一项所定义。
62.43.如第37~42项中任一项所述的免疫治疗性抗癌剂的用途、所述上调剂的用途、所述组合的用途或所述方法,其中在所述方法中,需施用γ分泌酶抑制剂,并且所述γ分泌酶抑制剂如第24或25项所定义。
附图说明
63.图1atra治疗导致骨髓瘤细胞系上的bcma表达增强。
64.在不存在或存在50nm atra的情况下培养72小时的mm.1s、opm-2和nci-h929细胞系上的bcma表达的流式细胞术分析。阴影直方图显示用抗bcma mab染色,白色直方图显示用同种型对照抗体染色。7-aad用于从分析中排除死细胞。插图数字表示处理和未处理细胞的mfi与同种型的绝对差异。
65.图2atra处理导致mm.1s、opm-2和nci-h929细胞上的bcma表达增强。
66.条形图显示了在atra处理的骨髓瘤细胞系(通过未处理细胞标准化)上,bcma表达的相对增加。条形图显示平均值+sd(n=3)。使用非配对t检验计算指定组之间的p值。*p《0.05
67.图3atra处理导致mm.1s细胞上的bcma表达增强。
68.通过直接随机光学重建显微镜(dstorm)观察到未处理和atra处理的mm.1s细胞上bcma分子分布的代表性照片。
69.图4atra上调bcma在骨髓瘤细胞系上是可逆的。
70.叠加直方图显示了bcma的表达,在atra处理(50nm)后72小时,在随后移去药物后24小时,以及在重新暴露于atra后72小时,未处理的骨髓瘤细胞系。
71.图5atra处理导致骨髓瘤细胞系中bcma-rna水平升高。
72.在与增加剂量的atra孵育48小时后,通过定量逆转录pcr(qrt-pcr)测定法定量mm.1s(n=4)和opm-2(n=3)中的bcma rna水平。描绘的是平均值+sd。使用非配对t检验计算指定组之间的p值。*p《0.05。
73.图6骨髓瘤患者之间的bcma表达差异很大。
74.bcma和同种型对照染色的差异平均荧光强度(mfi)显示在来自新诊断(nd)和复发/难治性(r/r)骨髓瘤的cd38+cd138+骨髓瘤细胞上,这些骨髓瘤患者之前接受过免疫调节药物和蛋白酶体抑制剂治疗(n=18)。delta mfi是bcma和同种型对照染色的差异mfi。
75.图7atra处理导致原发性骨髓瘤细胞上的bcma表达增强
76.在不存在或存在atra的情况下培养72小时的原发性骨髓瘤细胞上bcma表达的流式细胞术分析。7-aad用于从分析中排除死细胞。
77.图8atra处理导致原发性骨髓瘤细胞上的bcma表达增强。
78.条形图显示atra处理前后原发性骨髓瘤细胞(n=5)上的标准化bcma表达。描绘的是平均值+sd使用非配对t检验计算指定组之间的p值。*p《0.05。
79.图9atra对原发性骨髓瘤细胞的bcma上调是可逆的。
80.叠加直方图显示在atra处理(100nm)后72小时、随后移去药物后24小时和重新暴露于atra后72小时后,未处理的原发性骨髓瘤细胞上的bcma表达。7-aad用于从分析中排除死细胞。
81.图10atra和gsi的组合处理导致mm.1s和opm-2细胞上的bcma表达增强。
82.条形图显示用100nm atra和/或0.01μm gsi ly3039478处理72小时后mm.1s细胞(n=5)和opm-2细胞(n=3)上的bcma表达。描绘的是平均值+sd。使用非配对t检验计算指定组之间的p值。*p《0.05
83.图11atra处理不会影响bcma-car t细胞的活力。
84.流式细胞术测定bcma cd4+和cd8+car t细胞与增加剂量的atra孵育72小时后的活力。条形图显示了在atra处理(通过未处理细胞标准化)后的活(7-aad-)t细胞的百分比。数据表示为平均值+sd(n=3)。
85.图12atra处理不影响bcma-car t细胞上的car表达。
86.用流式细胞仪测定增加剂量的atra培养72小时后,bcma cd4+和cd8+car t细胞的egfrt_bcma-car转基因表达。条形图显示了atra处理(通过未处理细胞标准化)后egfrt+t细胞的百分比。数据以均值+sd表示(n=3)。
87.图13在体外atra或atra+gsi处理的mm.1s,使得bcma-car t细胞具有增强的细胞毒性。
88.将骨髓瘤细胞系与100nm atra和/或0.01μm gsi孵化72小时或不做处理。与靶细胞共同孵育4小时后,在基于生物发光的检测中确定cd8+bcma-car t细胞的细胞溶解活性。在每孔5000个靶细胞的三个孔中进行测定。数据以n=4个独立实验的平均值+sd表示。指定组之间的p值用非配对t检验计算。*p《0.05
89.图14在体外atra或atra+gsi处理的opm-2,使得bcma-car t细胞具有增强的细胞毒性。
90.将骨髓瘤细胞系与100nm atra和/或0.01μm gsi孵化72小时或不做处理。与靶细胞共同孵育4小时后,在基于生物发光的检测中确定cd8+bcma-car t细胞的细胞溶解活性。在每孔5000个靶细胞的三个孔中进行测定。数据以n=4个独立实验的平均值+sd表示。指定组之间的p值用非配对t检验计算。*p《0.05
91.图15在体外用atra或atra+gsi处理的mm.1s刺激后,bcma-car t细胞具有增强的增殖反应性。
92.将mm.1s与100nm atra和/或0.01μm gsi孵化72小时或不做处理。之后,将cfse标记的bcma-car t细胞与这些靶细胞共同孵化。三天后通过测量效应细胞中cfse标记的减少来确定bcma-car t细胞的增殖能力。数据以n=3个独立实验的平均值+sd表示。指定组之间的p值用非配对t检验计算。*p《0.05
93.图16体外用atra或atra+gsi处理的mm.1s刺激后,bcma-car t细胞具有增强的细胞因子释放。
94.将mm.1s与100nm atra和/或0.01μm gsi孵化72小时或不做处理。之后,将bcma-car t细胞与这些靶细胞共同孵化20小时。通过elisa测定上清液中bcma-car t细胞的细胞因子释放。检测在一式三份的孔中进行。数据以n=3个独立实验的平均值+sd表示。指定组之间的p值用非配对t检验计算。*p《0.05
95.图17atra在体内增强了mm.1s上的bcma表达。
96.给nsg小鼠接种mm.1s细胞。12天后,给小鼠静脉注射30mg/kg atra,持续4天。通过流式细胞仪分析从未经处理和atra处理的小鼠骨髓中获得的mm.1s细胞的bcma表达。
97.图18atra和bcma-car t细胞或atra、gsi和bcma-car t细胞的联合治疗可增强体内mm.1s的根除。
98.nsg小鼠接种2
×
106mm.1s细胞(ffluc+gfp+)。14天后,他们接受了1
×
106个bcma-car t细胞(cd4+:cd8+比率=1:1)。bcma-car t细胞单独给药或与atra(30mg/kg体重,腹腔注射)、gsi ly3039478(1mg/kg体重,腹腔注射)或两种药物联合给药。在第12天和第27天(周一至周五)之间注射了12剂atra。在相同时间间隔内给予gsi,小鼠总共接受7剂(每周一、周三和周五)。分析mm.1s信号的平均辐射度以评估每个治疗组的骨髓瘤进展/消退情况。在包括每只小鼠的整个身体的目标区域中,生物发光(bmi)值以光子/秒/cm2/sr的形式获得。a)实验的时间过程。灰色框标记了施用gsi和atra的时间段。b)图表显示生物发光信号从第14天得出的基线值的百分比变化。每个条形代表每个小鼠组的平均值。每组n=3-6只小鼠。
99.图19atra不会增加细胞系上清液中的sbcma。
100.与增加剂量的atra一起孵育后,mm.1s和opm-2细胞上清液中的可溶性bcma浓度。细胞系以1
×
106/孔培养24小时。孵育后,收集上清液并通过elisa分析。3次重复刺激。描绘的是平均值+sd。
101.图20骨髓瘤患者血清中的sbcma水平随肿瘤负担增加而增加。
102.mm患者血清中的可溶性bcma浓度。收集mm患者的外周血。以3000rpm离心10分钟,获得血清,用elisa分析(3次重复刺激)。pd,进展性疾病;sd,稳定的疾病;pr,部分缓解;cr,完全缓解。
103.图21可溶性bcma不会削弱bcma-car t细胞对atra处理的骨髓瘤细胞的作用。
104.在存在或不存在150ng/ml可溶性bcma的情况下,将cd8+bcma-car t细胞与mm.1s或k562/bcma靶细胞共同培养。4小时后,向培养物中加入荧光素,用基于生物发光的检测方法评估细胞毒性。数据显示的是技术3次重复的平均值
±
sd。
105.定义和实施方案
106.除非下文另有定义,本发明中使用的术语应按照本领域技术人员已知的一般含义来理解。
107.在不与本发明矛盾的程度上,出于所有目的,本文引用的每个出版物、专利申请、专利和其他参考文献通过引用整体并入。参考文献由它们的参考编号和它们在“参考文献”部分中提供的相应参考细节表示。
108.术语“k
d”或“kd值”涉及本领域已知的平衡解离常数。在本发明的上下文中,这些术语可以涉及能够结合bcma的免疫治疗剂或抗癌剂(例如car t细胞或抗体)相对于目标抗原(即bcma)的平衡解离常数。平衡解离常数是复合物(例如抗原-靶向剂复合物)可逆地解离
成其组分(例如抗原和靶向剂)的倾向的量度。测定kd值的方法是本领域已知的。
109.嵌合抗原受体能够结合一种或多种抗原,优选癌抗原,更优选癌细胞表面抗原。在一个优选的实施方案中,嵌合抗原受体能够结合癌抗原的细胞外结构域。在一个特别优选的实施方案中,嵌合抗原受体能够结合bcma的胞外结构域,并且甚至更优选地是由seq id no:1的核酸序列编码的嵌合抗原受体和/或具有seq id no:13的氨基酸序列的嵌合抗原受体。
110.根据本发明,免疫细胞如t细胞、nk细胞或pbmcs可以从患者身上分离出来,用根据本发明编码嵌合抗原受体的基因转移载体进行遗传修饰(例如转导),并根据本发明的方法和用途给患者服用。在一个优选的实施方案中,t细胞是cd8+t细胞或cd4+t细胞。另外,也可以使用来自供体,最好是健康供体的异源免疫细胞,如t细胞、nk细胞或pbmcs。它们可以根据本发明用编码嵌合抗原受体的基因转移载体进行遗传修饰(如转导),并按照本发明的方法和用途给病人服用。在一个优选的实施方案中,该t细胞是cd8+t细胞或cd4+t细胞。
111.已有car nk细胞疗法的描述(liu e,et.al.use of car-transduced natural killer cells in cd19-positive lymphoid tumors.n engl j med.2020feb 6;382(6):545-553.)。
112.对于car t细胞疗法,t细胞通常在体外进行操作和扩增。然而,根据本发明,还可以选择在体内进行基因转移。在体内对免疫细胞(如t细胞)进行编程的一种方法是使用携带dna的纳米粒子进行基因转移。所述方法已有描述(t.t.smith,et.al,in situ programming of leukaemia-specific t cells using synthetic dna nanocarriers,nat nanotechnol.2017aug;12(8):813
–
820.)
113.第二种策略是用病毒载体生成体内car免疫细胞(例如car t细胞)。所述策略已有描述(agarwal s,et.al,oncoimmunology.2019oct 10;8(12):e1671761.in vivo generated human car t cells eradicate tumor cells.)
114.本发明中使用的“免疫细胞”没有特别限制,包括例如t细胞、nk细胞或pbmcs。在一个优选的实施方案中,t细胞是cd8+t细胞或cd4+t细胞。
115.如本文所用,术语“抗体”是指能够特异性结合目标抗原的任何功能性抗体。没有特别限制,术语抗体包括来自任何适当来源物种的抗体,包括禽类如鸡和哺乳动物如小鼠、山羊、非人灵长类动物和人。优选地,抗体是人源化或人抗体。人源化抗体是包含人序列和小部分非人序列的抗体,这些序列具有目标抗原(例如bcma)结合特异性。所述抗体优选为单克隆抗体,可通过本领域众所周知的方法制备。术语抗体包括igg-1、-2、-3或-4、ige、iga、igm或igd同种型抗体。术语抗体包括单体抗体(如igd、ige、igg)或低聚物抗体(如iga或igm)。术语抗体(无特别限制)还包括分离的抗体和修饰的抗体,如基因工程抗体,例如嵌合抗体或双特异性抗体,或与药物如抗癌药物或细胞毒药物的抗体偶联物。根据本发明,能够与bcma结合的优选双特异性抗体可以是一种t细胞接合剂,如bite(双特异性t细胞接合剂),例如cd3
×
bcmabite,或dart(双亲和再定向蛋白)。如本文所述的“抗体”(例如单克隆抗体)或“其片段”可能已经衍生化或与不同的分子连接。例如,可以与抗体连接的分子是其他蛋白质(例如其他抗体)、分子标记(例如荧光、发光、有色或放射性分子)、药物和/或毒剂。抗体或抗原结合部分可以直接连接(例如以两种蛋白质之间的融合形式),或通过接头分子(例如本领域已知的任何合适类型的化学接头)连接。
116.如本文所用,能够结合bcma的抗体片段或抗体片段是指保留抗体特异性结合bcma抗原的能力的抗体部分。例如,这种能力可以通过本领域已知的方法确定抗原结合部分与抗体竞争特异性结合抗原的能力来确定。在没有特别限制的情况下,抗体片段可以通过本领域已知的任何合适的方法产生,包括重组dna方法和通过抗体的化学或酶促片段化的制备。抗体片段可以是fab片段、f(ab')片段、f(ab')2片段、单链抗体(scfv)、单域抗体、双抗体或抗体的任何其他部分,它们保留了以下能力:抗体与抗原特异性结合。
117.根据本发明的术语诸如“治疗癌症”或“治疗癌症”或“癌症疗法”或“癌症免疫疗法”是指治疗性治疗。例如,可以通过评估治疗是否抑制接受治疗的患者或患者的癌症生长来评估治疗是否有效。优选地,抑制具有统计学显著性,如通过本领域已知的适当统计测试评估的。可以通过将根据本发明治疗的一组患者中的癌症生长与未治疗患者的对照组进行比较,或通过比较接受本领域的标准癌症治疗加根据本发明的治疗的一组患者与仅接受本领域的标准癌症治疗的对照组患者来评估癌症生长的抑制。此类用于评估癌症生长抑制的研究是根据公认的临床研究标准设计的,例如具有足够统计功效的双盲、随机研究。术语“治疗癌症”包括抑制癌症生长,其中癌症生长被部分抑制(即与对照组患者相比,患者的癌症生长延迟),抑制癌症生长被完全抑制(即患者的癌症生长被停止),以及抑制癌症生长被逆转(即癌症缩小)。可以根据已知的癌症进展的临床指标来评估一种治疗方法是否有效。在不形成实体瘤的癌症的情况下,可以通过已知的方法评估癌症的生长,如基于癌细胞计数的方法。
118.根据本发明使用的“癌症治疗”或“治疗癌症”或“癌症疗法”或“癌症免疫疗法”,优选是对癌症本身的治疗。另外,根据本发明的“治疗癌症”或“治疗癌症”或“癌症疗法”或“癌症免疫疗法”可以是对癌前病变的治疗,该病变优选选自多发性骨髓瘤前体状态,如mgus(未确定意义的单克隆丙种球蛋白病)和阴燃性多发性骨髓瘤。
119.根据本发明对癌症的治疗并不排除在患者身上也出现额外的或次要的治疗效果,例如对淀粉样变的治疗,例如与多发性骨髓瘤相关的淀粉样变。
120.根据本发明的癌症治疗可以是一线疗法、二线疗法、三线疗法或四线疗法。该疗法也可以是超越四线疗法的疗法。这些术语的含义在本领域是已知的,并符合美国国家癌症研究所常用的术语。
121.在一个实施方案中,根据本发明的方法,如癌症免疫疗法的方法或通过免疫疗法治疗癌症的方法,可以是一种方法,其中在该方法中,还将施用表观遗传调节剂。根据本发明的表观遗传调节剂可以是bet抑制剂、组蛋白乙酰转移酶抑制剂、组蛋白去乙酰化酶抑制剂或dna甲基转移酶抑制剂,并且优选选自包括丙戊酸、丁酸、乳酸帕诺比诺斯特(panobinostat lactate)、贝利诺斯特(belinostat)、沃利诺斯特(vorinostat)、达西诺斯特(dacinostat)、恩提诺斯特(entinostat)、莫西诺斯特(mocetinostat)、罗米地辛(romidepsin)和里科林斯特(ricolinostat)的组。
122.本文所用的术语“能够结合”是指能够与要结合的分子(如bcma)形成复合物。结合通常是通过分子间的作用力,如离子键、氢键和范德瓦尔斯力,以非共价方式发生,并且通常是可逆的。确定结合能力的各种方法和检测方法在本领域是已知的。结合通常是具有高亲和力的结合,其中以kd值衡量的亲和力优选为小于1μm,更优选小于100nm,甚至更优选小于10nm,甚至更优选小于1nm,甚至更优选小于100pm,甚至更优选小于10pm,甚至更优选小
于1pm。
123.如本文所用,诸如“包含”或“包含”之类的术语的每次出现可任选地替换为“组成元素为
……”
或“由
……
组成”。
124.根据本发明的“组合”不限于特定的给药方式。能够与bcma结合的免疫治疗剂或抗癌剂和bcma mrna水平的上调剂可以例如单独但同时施用,或以一种组合物同时施用,或者它们可以分开施用并且在不同的时间点给药。
125.一种物质是否是bcma mrna水平的上调剂可以通过本领域已知的方法来确定,例如通过测量感兴趣的细胞中的bcma mrna水平,例如在癌细胞中,通过定量rt-pcr等方法,例如如本文“bcma mrna水平的定量”部分所述。
126.根据本发明的组合物和制剂,其中含有能够结合bcma的免疫治疗性抗癌剂和/或bcma mrna水平的上调剂,按照制备药物组合物和制剂的已知标准来制备。例如,组合物和制剂的制备方式是可以适当地储存和施用,例如通过使用药学上可接受的成分,如载体、赋形剂或稳定剂。这种药学上可接受的成分在向病人施用药物组合物或制剂时的用量是没有毒性的。添加到药物组合物或制剂中的药学上可接受的成分可以根据活性剂的化学性质(例如能够结合bcma的免疫治疗性抗癌剂和/或bcma mrna水平的上调剂)、药物组合物的特定预期用途和给药途径来选择。可以理解的是,根据本发明,该组合物或制剂适合于施用于人。
127.如本领域已知的,药学上可接受的载体,包括任何合适的稀释剂或可用于本文。如本文所用,术语“药学上可接受的”是指被联邦或州政府的监管机构批准或在美国药典、欧洲药典或其他公认的药典中列出用于哺乳动物,更具体地用于人类。药学上可接受的载体包括但不限于盐水、缓冲盐水、葡萄糖、水、甘油、无菌等渗水性缓冲液及其组合。应当理解,该制剂将被适当地调整以适应给药方式。
具体实施方式
128.本发明通过以下非限制性实施例来举例说明。
129.本实施例中使用的材料和方法如下:
130.人类受试者
131.在获得参与维尔茨堡大学机构审查委员会批准的研究方案的书面知情同意后,从健康捐赠者和骨髓瘤患者或者外周血和骨髓样本。
132.细胞系
133.k562、opm-2、nci-h929和mm.1s细胞系来自德国微生物和细胞培养物保藏中心(dsmz,braunschweig,germany)。k562、opm-2和mm.1s细胞系通过慢病毒转导用萤火虫-荧光素_gfp修饰。用编码bcma的慢病毒载体转导k562-ffluc细胞系,产生表达全长人bcma的k562。
134.流式细胞仪
135.用抗cd38和抗cd138 mab(biolegend,koblenz,germany)对骨髓单个核细胞(bmmc)进行染色,根据制造商的说明以鉴定恶性浆细胞和抗bcma mab(biolegend;克隆:19f2)或同种型对照(biolegend;小鼠igg2a,κ)。在canto ii(bd,heidelberg,germany)上进行流式细胞术,并使用flowjo软件(treestar,ashland,or)分析数据。
136.骨髓瘤细胞的atra治疗
137.骨髓瘤细胞在补充有10%胎牛血清的rpmi-1640(gibco,darmstadt,germany)中以1
×
106个细胞/ml培养。atra(sigma-aldrich,darmstadt,germany)在二甲基亚砜中复溶,并添加到培养基中,最终浓度为25、50或100nm。
138.体外t细胞功能测定
139.使用萤火虫-荧光素酶(ffluc)转化的靶细胞,在基于生物发光的试验中分析细胞溶解活性。通过流式细胞仪对cfse增殖染料的稀释来测量增殖。因此,将cfse标记的car t细胞与靶细胞以4:1的效应器与靶细胞比例孵化72小时。通过elisa(biolegend,koblenz,germany)测量t细胞与靶细胞共培养20小时后得到的上清液中的ifnγ和il-2(效应物:靶细胞比例=4:1)。
140.bcma mrna水平的定量
141.根据制造商的方案,用rneasy mini kit(qiagen,hilden,germany)提取总rna。bcma的逆转录定量聚合酶链反应(rt-qpcr)分析使用1μg总rna和superscript
tm
ii逆转录酶(thermo fisher scientific,inc massachusetts)进行。rna的质量和完整性由bioanalyzer 2100(agilent technologies,santa clara,ca)验证。使用的引物序列如下:bcma正向引物,5'-tgt tct tct aat act cct cct ct-3'(seq id no:25)和反向引物,5'-aac tcg tcc ttt aat ggt tc-3'(seq id no:26)。β-肌动蛋白特异性引物用作对照(正向,5'-tcc atc atg aag tgt gac gt-3'(seq id no:27)和反向,5'-gag caa tgatcttgatct tca t-3'(seq id no:28)。rt-qpcr在7900ht快速实时pcr系统(applied biosystems,foster city,ca)中,使用quantitec sybr green kit(qiagen,hilden,germany)在7900ht实时pcr系统(thermo fisher scientific,inc)中进行。pcr条件包括:95℃,3分钟变性;95℃,30秒退火;和62℃,40秒进行延伸,40个循环。从线性范围中选择每个样品的阈值循环,并通过从在同一板上为每组引物生成的标准曲线内插转换为起始量。使用2-δδcq方法(21)将每个孔的bcma信使(m)rna水平标准化为β-肌动蛋白mrna水平。
142.atra在mm.1s体内上调bcma的表达
143.维尔茨堡大学机构动物护理和使用委员会批准了所有小鼠实验。六至八周龄的雌性nsg(nod-scid il2rγnull)小鼠来自charles river,在第0天通过尾静脉注射2
×
106mm.1s/ffluc_gfp,随机分配到atra治疗组和对照组。atra(sigma aldrich,德国达姆施塔特)配制在玉米油中,从肿瘤接种后12天开始,通过腹腔注射(30mg/kg)连续4天。在第16天的实验终点,用canto ii(bd,海德堡,德国)分析这些小鼠的骨髓样本,研究bcma在mm.1s上的表达,并用flowjo软件(treestar,ashland,or)分析数据。
144.atra和gsi组合的体内实验
145.为了研究与bcma-car t细胞的联合治疗,atra和gsi雌性nsg(nod-scid il2rγnull)小鼠在第0天通过尾静脉注射2
×
106mm.1s/ffluc_gfp,随机分配到治疗组和对照组。在第14天,小鼠通过尾静脉注射接受单剂量的1
×
106个t细胞(即0.5
×
106个cd4+和0.5
×
106个cd8+)。atra(sigma aldrich,德国达姆施塔特)在dmso中稀释,配制在peg300、tween80和生理盐水中,通过腹腔注射(i.p)给药,剂量为30mg/kg,从肿瘤接种后12天开始,连续16天。gsi ly3039478(med chem express,nj 08852,usa)在dmso中稀释,配制在peg300、tween80和生理盐水中,通过腹腔注射(i.p)给药,剂量为1mg/kg,从肿瘤接种后12
天开始,连续16天。在静脉注射d-荧光素(0.3mg/g体重)(biosynth,staad,瑞士)后,在ivis lumina(perkin elmer,waltham,ma)上进行生物发光成像,并使用living image软件(perkin elmer)分析数据。
146.统计学分析
147.统计分析使用prism软件6.07版(graphpad,san diego,california)进行。非配对t检验用来分析从体外和体内实验中获得的数据。p值《0.05被认为具有统计学意义。
148.实施例1:atra增强了骨髓瘤细胞系上bcma的表面表达
149.本发明人通过流式细胞仪测定了三种常用的骨髓瘤细胞系的bcma表达,发现bcma的表达有等级之分,mm.1s为bcma低(deltamfi:1098),opm-2为bcma中(deltamfi:3558),nci-h929为bcma高(deltamfi:9883)(图1)。然后,发明人用atra处理每个骨髓瘤细胞系72小时,用流式细胞仪重新检查bcma表达。本发明人发现,bcma的表达在所有三个骨髓瘤细胞系中都有所增加,bcma表达的等级保持不变。mm.1s(deltamfi:2709)《opm-2(deltamfi:7358)《nci-h929(deltamfi:13891)(图1)。本发明人将基线获得的deltamfi标准化为1,因此,atra治疗后bcma表达的相对增加,在mm.1s(图2)和opm-2骨髓瘤细胞(图2)中是1.9倍,在nci-h929骨髓瘤细胞(图2)是1.7倍。停止atra治疗后,所有三种骨髓瘤细胞系的bcma表达在72小时内恢复到基线水平,但在重新开始atra治疗时又以相同幅度增加(图4)。atra治疗后,mm.1s细胞上bcma表面分子的增加还被使用直接随机光学重建显微镜dstorm的单分子敏感超分辨率显微镜所证实(图3)。本发明人假设atra在骨髓瘤细胞中诱导表观遗传学变化,导致bcma基因表达增加,并通过qpcr证实情况确实如此。以mm.1s和opm-2为例,50nm atra处理后,bcma转录物的相对增加分别为1.8倍和2.1倍(图5)。综上所述,这些数据表明,atra治疗导致mm.1s、opm-2和nci-h929骨髓瘤细胞表面的bcma rna和bcma蛋白表达增加。
150.实施例2:atra可上调原发性骨髓瘤细胞上的bcma表面表达
151.为了证实他们在原发性骨髓瘤细胞中的发现,发明人从新诊断的(nd,n=7)和复发/难治的(r/r,n=11)骨髓瘤患者身上获得骨髓。r/r队列中的患者以前接受过免疫调节药物和/或蛋白酶体抑制剂的治疗,没有患者接受过抗bcma治疗。发明人通过流式细胞仪分析了纯化的cd38+cd138+恶性浆细胞,发现通过deltamfi评估,患者之间的bcma表达情况不一(deltamfi低=94;deltamfi高=2650)。来自nd和r/r患者的骨髓瘤细胞上的bcma表达没有明显差异(图6)。在5名患者中,有足够数量的原发性骨髓瘤细胞来进行atra治疗和bcma表达的序贯分析(图7)。在这5名患者中,有3名nd患者和2名r/r患者,他们均匀地覆盖了上述bcma表达从低到高的范围。在这5个患者样本中的每一个,本发明人在用atra处理72小时后,通过流式细胞仪检测到bcma的表达大幅增加。在所有剂量水平上使用atra都可以观察到明显的增加(100nm p=0.04,50nm p=0.006和25nm p=0.04)(图8)。本发明人观察到原发性骨髓瘤细胞在100nm atra治疗后,bcma表达的deltamfi平均增加1.6倍(1.23倍-2.23倍)。同样在原发性骨髓瘤细胞中,一旦停止接触atra,bcma的表达就会下降到基线水平,并在重新接触该药物时再次增加(图9)。总之,这些数据显示,atra治疗可增强nd和r/r疾病患者的原发性骨髓瘤细胞的bcma表面表达。
152.实施例3:atra与gsi组合进一步增加骨髓瘤细胞系上的bcma表达
153.gsi可以诱导骨髓瘤细胞上bcma表达的增加,因为它们可以阻止bcma分子从细胞表面脱落
40
。本发明人确定了atra和gsi的组合是否能进一步增加骨髓瘤细胞上的bcma表
达,以及是否能进一步提高bcma-car t细胞的抗骨髓瘤反应性,超过单独使用atra的效果。用100nm atra和0.01μm gsi ly3039478处理mm.1s和opm-2细胞72h,导致bcma表达明显增加。两种药物联合使用导致bcma的表达比单独使用两种药物中的一种更高(图10)。
154.实施例4:bcma-car t细胞对atra处理的骨髓瘤细胞具有增强的反应性
155.发明人试图确定由atra处理诱导的bcma表达增加是否影响bcma-car t细胞的抗骨髓瘤反应性。首先,发明人证实atra处理对bcma-car t细胞的活力没有负面影响(图11),并且没有降低egfrt_bcma-car转基因的表达(图12)。然后,发明人测试了bcma-car t细胞的细胞溶解活性,发现与未处理的mm.1s骨髓瘤细胞相比,atra处理的mm.1s骨髓瘤细胞的细胞溶解效果更好(图13)。此外,当预先用atra和gsi的组合处理mm.1s靶细胞时,bcma-car t细胞的溶细胞作用可以进一步增强(图13)。opm-2细胞也获得了类似的结果(图14)。此外,当靶细胞单独用atra或atra和gsi的组合预处理时,bcma-car t细胞显示出增强的增殖能力(图15)和细胞因子释放(图16)。
156.这鼓励了在小鼠骨髓瘤异种移植模型(nsg/mm1.s)中进行的实验。在第一组实验中,n=6小鼠接种mm1.s细胞(2
×
106细胞通过尾静脉注射静脉注射)12天以建立全身性骨髓瘤,然后用atra(n=3只小鼠;每天腹腔注射30mg/kg)或溶剂对照(n=3只小鼠)。次日,处死小鼠,从骨髓中分离mm.1s骨髓瘤细胞,流式细胞仪分析bcma表达。与对照小鼠相比,在接受atra的小鼠的mm.1s骨髓瘤细胞上发现了显着更高的bcma表达(p=0.002,图17)。pont等人显示了gsi处理后bcma的体内上调
40
。
157.在第二个mm.1s/nsg小鼠实验中,研究了一下情形下的抗骨髓瘤功效:次优剂量的bcma-car t细胞(1
×
106个总car-t细胞,其中cd8:cd4比例为1:1,在第14天通过尾静脉注射静脉注射)与单独的atra、单独的gsi或两种药物的组合。从肿瘤接种后12天开始,腹腔内施用30mg/kg atra,16天内施用12次。在同一时间间隔内(肿瘤接种后第12天至第28天)腹腔内施用1mg/kg gsi 7次。
158.在car t细胞注射后的第一天,所有小鼠组的生物发光成像均下降。然而,刚刚接受car-t细胞治疗的小鼠在治疗后两周内复发。相比之下,用atra和bcma-car t细胞联合治疗的小鼠复发要慢得多(图18)。此外,当小鼠接受car t细胞、atra和gsi的联合治疗时,生物发光成像显示出更明显和更稳定的肿瘤减少。这些小鼠在随访期间达到并保持完全缓解(图18)
159.总的来说,这些数据表明atra在体内提高了骨髓瘤细胞上bcma的表达,并增强了bcma-car t细胞的抗骨髓瘤反应性。此外,靶向bcma的免疫疗法不仅可以从单独使用atra的治疗中受益,而且还可以从gsi和atra的联合治疗中受益。
160.实施例5:sbcma不会损害bcma-car t细胞对atra处理过的骨髓瘤细胞的功能
161.众所周知,膜结合的bcma的细胞外部分可从骨髓瘤细胞中脱落,释放出较短的可溶性bcma(sbcma)蛋白亚型
26,27
。发明人测定了经atra处理72小时的mm.1s和opm-2的上清液中的sbcma,获得与相应未处理的骨髓瘤细胞系相似的值(图19)。值得注意的是,经atra处理或未处理的mm.1s和opm-2骨髓瘤细胞的条件培养基中sbcma的浓度高于骨髓瘤患者血清中的浓度(图20)。发明人分析了bcma-car t细胞在新鲜或含有sbcma的培养基中的溶细胞活性,并在所有效应物与靶细胞的比率和时间点观察到针对mm.1s或k562/bcma靶细胞的类似有效溶细胞活性(图21)。这些数据表明,atra处理不会加速sbcma从骨髓瘤细胞中的释
t细胞在mm异种移植小鼠中是高效的,尽管sbcma血清水平增加了约7ng/ml
37,41
。此外,r.o.carpenter等人发现浓度高达150ng/ml的sbcma对car t细胞细胞因子的释放没有影响
41
。这些不同的观察结果可能是由于使用了不同的bcma cars,与不同的表位结合。并不是所有这些表位都可以在可溶的bcma构象中获得。
171.综上所述,这项研究表明,通过atra上调抗原表达可以提高bcma-car t细胞治疗的疗效。因此,根据本发明,维甲酸例如atra可以在临床环境中与bcma-car t细胞协同使用,以提高nd和r/r骨髓瘤的应答率并延长反应持续时间。使用精心选择的car结构可能会减少患者血清中sbcma分子的负面影响。不仅使用atra,而且联合使用atra和gsi,bcma上调和bcma-car t细胞靶向的效果甚至更大。
172.工业适用性
173.根据本发明使用的免疫治疗剂和维甲酸可以根据制药和诊断产品制造的已知标准,作为用于所要求保护的方法和用途(例如,用于治疗这里定义的癌症)的产品进行工业制造和销售。因此,本发明在工业上是适用的。
174.序列
175.所有的核苷酸序列都以5’到3’的顺序表示。所有的氨基酸序列都以n到c末端的顺序用三个字母的氨基酸编码表示。
176.能够与实施例中使用的bcma结合的嵌合抗原受体(car)的全核苷酸序列(seq id no:1):
177.atgctgctgctcgtgacatctctgctgctgtgcgagctgccccaccccgcctttctgctgattcct
178.caggtgcagctggtgcagtctggcgccgaagtgaagaaaccaggcgccagcgtgaaggtgtcctgcaaggccagcggctacagcttccccgactactacatcaactgggtgcgccaggcccctggacagggcctggaatggatgggctggatctacttcgccagcggcaactccgagtacaaccagaaattcaccggcagagtgaccatgacccgggacaccagcatcaacaccgcctacatggaactgagcagcctgaccagcgaggataccgccgtgtacttctgcgccagcctgtacgactacgactggtacttcgacgtgtggggccagggcacaatggtcaccgtgtctagc
179.ggaggcggaggctccggagggggaggatctgggggaggcggaagc
180.gatatcgtgatgacccagacccccctgagcctgagcgtgacacctggacagcctgccagcatcagctgcaagagcagccagagcctggtgcacagcaacggcaacacctacctgcactggtatctgcagaagcccggccagagcccccagctgctgatctacaaggtgtccaaccggttcagcggcgtgcccgacagattttctggcagcggctccggcaccgacttcaccctgaagatctcccgggtggaagccgaggacgtgggcatctactactgcagccagtccagcatctacccctggaccttcggccaggggaccaagctggaaatcaaa
181.aaagagtctaagtacggaccgccttgtcctccttgtccagctcctcctgtggccggacctagcgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggacccccgaagtgacctgcgtggtggtggatgtgtcccaggaagatcccgaggtgcagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagttccagagcacctaccgggtggtgtccgtgctgacagtgctgcaccaggactggctgaacggcaaagagtacaagtgcaaggtgtccaacaagggcctgcccagcagcatcgagaaaaccatcagcaaggccaagggccagcctcgcgagccccaggtgtacacactgcctccaagccaggaagagatgaccaagaaccaggtgtccctgacctgtctcgtgaagggcttctaccccagcgacattgccgtggaatgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtgctggacagcgacggctcattcttcctgtacagcagactgaccgtggacaagagccggtggcaggaaggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagtccctgtctctgagcctgggca
ag
182.atgttctgggtgctggtggtcgtgggcggagtgctggcctgttacagcctgctcgtgaccgtggccttcatcatcttttgggtc
183.aagcggggcagaaagaagctgctgtatatcttcaagcagcccttcatgcggcccgtgcagaccacacaggaagaggacggctgctcctgccggttccccgaggaagaagaaggcggctgcgagctg
184.agagtgaagttcagcagaagcgccgacgcccctgcctatcagcagggccagaaccagctgtacaacgagctgaacctgggcagacgggaagagtacgacgtgctggataagcggagaggccgggaccctgagatgggcggcaagcctagaagaaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggaatgaagggcgagcggagaagaggcaagggccacgatggcctgtaccagggactgagcaccgccaccaaggatacctatgacgcactgcacatgcaggccctgccccccaga
185.ctcgagggcggaggcgaaggcagaggatctctgctgacatgcggcgacgtggaagagaaccctggccccaga
186.atgctgctgctcgtgacaagcctgctgctgtgcgagctgccccaccctgcctttctgctgatcccc
187.cggaaagtgtgcaacggcatcggcatcggagagttcaaggacagcctgtccatcaacgccaccaacatcaagcacttcaagaattgcaccagcatcagcggcgacctgcacatcctgccagtggcctttagaggcgacagcttcacccacacccccccactggatccacaggaactggatattctgaaaaccgtaaaggaaatcacagggtttttgctgattcaggcttggcctgaaaacaggacggacctccatgcctttgagaacctagaaatcatacgcggcaggaccaagcaacatggtcagttttctcttgcagtcgtcagcctgaacataacatccttgggattacgctccctcaaggagataagtgatggagatgtgataatttcaggaaacaaaaatttgtgctatgcaaatacaataaactggaaaaaactgtttgggacctccggtcagaaaaccaaaattataagcaacagaggtgaaaacagctgcaaggccacaggccaggtctgccatgccttgtgctcccccgagggctgctggggcccggagcccagggactgcgtctcttgccggaatgtcagccgaggcagggaatgcgtggacaagtgcaaccttctggagggtgagccaagggagtttgtggagaactctgagtgcatacagtgccacccagagtgcctgcctcaggccatgaacatcacctgcacaggacggggaccagacaactgtatccagtgtgcccactacattgacggcccccactgcgtcaagacctgcccggcaggagtcatgggagaaaacaacaccctggtctggaagtacgcagacgccggccatgtgtgccacctgtgccatccaaactgcacctacggatgcactgggccaggtcttgaaggctgtccaacgaatgggcctaagatcccgtccatcgccactgggatggtgggggccctcctcttgctgctggtggtggccctggggatcggcctcttcatgtga
188.gmcsf信号肽的核苷酸序列(seq id no:2):
189.atgctgctgctcgtgacatctctgctgctgtgcgagctgccccaccccgcctttctgctgattcct
190.bcma单链可变片段vh的核苷酸序列(seq id no:3):
191.caggtgcagctggtgcagtctggcgccgaagtgaagaaaccaggcgccagcgtgaaggtgtcctgcaaggccagcggctacagcttccccgactactacatcaactgggtgcgccaggcccctggacagggcctggaatggatgggctggatctacttcgccagcggcaactccgagtacaaccagaaattcaccggcagagtgaccatgacccgggacaccagcatcaacaccgcctacatggaactgagcagcctgaccagcgaggataccgccgtgtacttctgcgccagcctgtacgactacgactggtacttcgacgtgtggggccagggcacaatggtcaccgtgtctagc
192.(4gs)3连接子的核苷酸序列(seq id no:4):
193.ggaggcggaggctccggagggggaggatctgggggaggcggaagc
194.bcma单链可变片段vl的核苷酸序列(seq id no:5):
195.gatatcgtgatgacccagacccccctgagcctgagcgtgacacctggacagcctgccagcatcagctgc
aagagcagccagagcctggtgcacagcaacggcaacacctacctgcactggtatctgcagaagcccggccagagcccccagctgctgatctacaaggtgtccaaccggttcagcggcgtgcccgacagattttctggcagcggctccggcaccgacttcaccctgaagatctcccgggtggaagccgaggacgtgggcatctactactgcagccagtccagcatctacccctggaccttcggccaggggaccaagctggaaatcaaa
196.igg4-fc铰链-ch2-ch3 4/2nq的核苷酸序列(seq id no:6):
197.aaagagtctaagtacggaccgccttgtcctccttgtccagctcctcctgtggccggacctagcgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggacccccgaagtgacctgcgtggtggtggatgtgtcccaggaagatcccgaggtgcagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagttccagagcacctaccgggtggtgtccgtgctgacagtgctgcaccaggactggctgaacggcaaagagtacaagtgcaaggtgtccaacaagggcctgcccagcagcatcgagaaaaccatcagcaaggccaagggccagcctcgcgagccccaggtgtacacactgcctccaagccaggaagagatgaccaagaaccaggtgtccctgacctgtctcgtgaagggcttctaccccagcgacattgccgtggaatgggagagcaacggccagcccgagaacaactacaagaccaccccccctgtgctggacagcgacggctcattcttcctgtacagcagactgaccgtggacaagagccggtggcaggaaggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagtccctgtctctgagcctgggcaag
198.cd28跨膜区的核苷酸序列(seq id no:7):
199.atgttctgggtgctggtggtcgtgggcggagtgctggcctgttacagcctgctcgtgaccgtggccttcatcatcttttgggtc
200.4-1bb胞质结构域的核苷酸序列(seq id no:8):
201.aagcggggcagaaagaagctgctgtatatcttcaagcagcccttcatgcggcccgtgcagaccacacaggaagaggacggctgctcctgccggttccccgaggaagaagaaggcggctgcgagctg
202.cd3 zeta结构域的核苷酸序列(seq id no:9):
203.agagtgaagttcagcagaagcgccgacgcccctgcctatcagcagggccagaaccagctgtacaacgagctgaacctgggcagacgggaagagtacgacgtgctggataagcggagaggccgggaccctgagatgggcggcaagcctagaagaaagaacccccaggaaggcctgtataacgaactgcagaaagacaagatggccgaggcctacagcgagatcggaatgaagggcgagcggagaagaggcaagggccacgatggcctgtaccagggactgagcaccgccaccaaggatacctatgacgcactgcacatgcaggccctgccccccaga
204.t2a核糖体跳跃元件的核苷酸序列(seq id no:10):
205.ctcgagggcggaggcgaaggcagaggatctctgctgacatgcggcgacgtggaagagaaccctggccccaga
206.gmcsf信号肽的核苷酸序列(seq id no:11):
207.atgctgctgctcgtgacaagcctgctgctgtgcgagctgccccaccctgcctttctgctgatcccc
208.tegfr序列的核苷酸序列(seq id no:12):
209.cggaaagtgtgcaacggcatcggcatcggagagttcaaggacagcctgtccatcaacgccaccaacatcaagcacttcaagaattgcaccagcatcagcggcgacctgcacatcctgccagtggcctttagaggcgacagcttcacccacacccccccactggatccacaggaactggatattctgaaaaccgtaaaggaaatcacagggtttttgctgattcaggcttggcctgaaaacaggacggacctccatgcctttgagaacctagaaatcatacgcggcaggaccaagcaacatggtcagttttctcttgcagtcgtcagcctgaacataacatccttgggattacgctccctcaaggagataagtgatggagatgtgataatttcaggaaacaaaaatttgtgctatgcaaatacaataaactggaaaaaactgtttgggacctccg
gtcagaaaaccaaaattataagcaacagaggtgaaaacagctgcaaggccacaggccaggtctgccatgccttgtgctcccccgagggctgctggggcccggagcccagggactgcgtctcttgccggaatgtcagccgaggcagggaatgcgtggacaagtgcaaccttctggagggtgagccaagggagtttgtggagaactctgagtgcatacagtgccacccagagtgcctgcctcaggccatgaacatcacctgcacaggacggggaccagacaactgtatccagtgtgcccactacattgacggcccccactgcgtcaagacctgcccggcaggagtcatgggagaaaacaacaccctggtctggaagtacgcagacgccggccatgtgtgccacctgtgccatccaaactgcacctacggatgcactgggccaggtcttgaaggctgtccaacgaatgggcctaagatcccgtccatcgccactgggatggtgggggccctcctcttgctgctggtggtggccctggggatcggcctcttcatgtga
210.实施例中使用的能够结合bcma的嵌合抗原受体(car)的全氨基酸序列(seq id no:13):
211.met leu leu leu val thr ser leu leu leu cys glu leu pro his pro ala phe leu leu ile pro
212.gln val gln leu val gln ser gly ala glu val lys lys pro gly ala ser val lys val ser cys lys ala ser gly tyr ser phe pro asp tyr tyr ile asn trp val arg gln ala pro gly gln gly leu glu trp met gly trp ile tyr phe ala ser gly asn ser glu tyr asn gln lys phe thr gly arg val thr met thr arg asp thr ser ile asn thr ala tyr met glu leu ser ser leu thr ser glu asp thr ala val tyr phe cys ala ser leu tyr asp tyr asp trp tyr phe asp val trp gly gln gly thr met val thr val ser ser
213.gly gly gly gly ser gly gly gly gly ser gly gly gly gly ser
214.asp ile val met thr gln thr pro leu ser leu ser val thr pro gly gln pro ala ser ile ser cys lys ser ser gln ser leu val his ser asn gly asn thr tyr leu his trp tyr leu gln lys pro gly gln ser pro gln leu leu ile tyr lys val ser asn arg phe ser gly val pro asp arg phe ser gly ser gly ser gly thr asp phe thr leu lys ile ser arg val glu ala glu asp val gly ile tyr tyr cys ser gln ser ser ile tyr pro trp thr phe gly gln gly thr lys leu glu ile lys
215.lys glu ser lys tyr gly pro pro cys pro pro cys pro ala pro pro val ala gly pro ser val phe leu phe pro pro lys pro lys asp thr leu met ile ser arg thr pro glu val thr cys val val val asp val ser gln glu asp pro glu val gln phe asn trp tyr val asp gly val glu val his asn ala lys thr lys pro arg glu glu gln phe gln ser thr tyr arg val val ser val leu thr val leu his gln asp trp leu asn gly lys glu tyr lys cys lys val ser asn lys gly leu pro ser ser ile glu lys thr ile ser lys ala lys gly gln pro arg glu pro gln val tyr thr leu pro pro ser gln glu glu met thr lys asn gln val ser leu thr cys leu val lys gly phe tyr pro ser asp ile ala val glu trp glu ser asn gly gln pro glu asn asn tyr lys thr thr pro pro val leu asp ser asp gly ser phe phe leu tyr ser arg leu thr val asp lys ser arg trp gln glu gly asn val phe ser cys ser val met his glu ala leu his asn his tyr thr gln lys ser leu ser leu ser leu gly lys
al.management of relapsed and refractory multiple myeloma:novel agents,antibodies,immunotherapies and beyond.leukemia.2018feb;32(2):252-262.doi:10.1038/leu.2017.329
249.4.lonial s,boise lh,kaufman j.how i treat high-risk myeloma.blood.2015;126(13):1536-1543.
250.5.kumar sk,lee jh,lahuerta jj,morgan g,richardson pg,crowley j,et al.risk of progression and survival in multiple myeloma relapsing after therapy with imids and bortezomib:a multicenter international myeloma working group study.leukemia.2012;26(1):149-157.
251.6.davila ml,riviere i,wang x,bartido s,park j,curran k et al.efficacy and toxicity management of 19-28z car t cell therapy in b cell acute lymphoblastic leukemia.science translational medicine 2014;6(224):224ra225.doi:10.1126/scitranslmed.3008226
252.7.kochenderfer jn,dudley me,kassim sh,somerville rp,carpenter ro,stetler-stevenson m et al.chemotherapy-refractory diffuse large b-cell lymphoma and indolent b-cell malignancies can be effectively treated with autologous t cells expressing an anti-cd19 chimeric antigen receptor.journal of clinical oncology:official journal of the american society of clinical oncology 2015;33(6):540-549.doi:10.1200/jco.2014.56.2025
253.8.maude sl,frey n,shaw pa,aplenc r,barrett dm,bunin nj et al.chimeric antigen receptor t cells for sustained remissions in leukemia.the new england journal of medicine 2014;371(16):1507-1517.doi:10.1056/nejmoa1407222
254.9.brentjens rj,davila ml,riviere i,park j,wang x,cowell lg,et al.cd19-targeted t cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia.sci transl med.2013mar 20;5(177):177ra38.doi:10.1126/scitranslmed.3005930.
255.10.timmers m,roex g,wang y,campillo-davo d,van tendeloo vfi,chu y,et al.chimeric antigen receptor-modified t cell therapy in multiple myeloma:beyond b cell maturation antigen.front immunol.2019 jul 16;10:1613.doi:10.3389/fimmu.2019.01613.
256.11.garfall al,fraietta ja,maus mv.immunotherapy with chimeric antigen receptors for multiple myeloma.discovery medicine 2014;17(91):37-46.
257.12.maus mv,june ch.carts on the road for myeloma.clinical cancer research:an official journal of the american association for cancer research 2014;20(15):3899-3901.doi:10.1158/1078-0432.ccr-14-0721
258.13.seckinger a,delgado ja,moser s,moreno l,neuber b,grab a et al.target expression,generation,preclinical activity,and pharmacokinetics of the bcma-t cell bispecific antibody em801 for multiple myeloma treatment.cancer cell 2017;31(3):396-410.doi:10.1016/j.ccell.2017.02.002
and epigenetic targets in apl by global chip analyses:emerging opportunity and challenge.cancer cell.2010 feb 17;17(2):112-4.doi:10.1016/j.ccr.2010.01.012.
270.25.nijhof is,casneuf t,van velzen j,van kessel b,axel ae,syed k et al.cd38 expression and complement inhibitors affect response and resistance to daratumumab therapy in myeloma.blood 2016;128(7):959-970.doi:10.1182/blood-2016-03-703439
271.26.laurent sa,hoffmann fs,kuhn ph,cheng q,chu y,schmidt-supprian m et al.gamma-secretase directly sheds the survival receptor bcma from plasma cells.nature communications 2015;6:7333.doi:10.1038/ncomms8333
272.27.sanchez e,li m,kitto a,li j,wang cs,kirk dt et al.serum b-cell maturation antigen is elevated in multiple myeloma and correlates with disease status and survival.british journal of haematology 2012;158(6):727-738.doi:10.1111/j.1365-2141.2012.09241.x
273.28.stone jd,aggen dh,schietinger a,schreiber h,kranz dm.a sensitivity scale for targeting t cells with chimeric antigen receptors(cars)and bispecific t-cell engagers(bites).oncoimmunology.2012 sep 1;1(6):863-873.
274.29.nerreter t,letschert s,r,doose s,danhof s,einsele h,et al.super-resolution microscopy reveals ultra-low cd19 expression on myeloma cells that triggers elimination by cd19 car-t.nat commun.2019 jul 17;10(1):3137.
275.30.walker aj,majzner rg,zhang l,wanhainen k,long ah,nguyen sm,et al.tumor antigen and receptor densities regulate efficacy of a chimeric antigen receptor targeting anaplastic lymphoma kinase.mol ther.2017 sep 6;25(9):2189-2201.doi:10.1016/j.ymthe.2017.06.008.
276.31.ramakrishna s,highfill sl,walsh z,nguyen sm,lei h,shern jf,et al.modulation of target antigen density improves car t-cell functionality and persistence.clin cancer res.2019 sep 1;25(17):5329-5341.
277.32.fry tj,shah nn,orentas rj,stetler-stevenson m,yuan cm,ramakrishna s,et al.cd22-targeted car t cells induce remission in b-all that is naive or resistant to cd19-targeted car immunotherapy.nat med 2018;24:20
–8278.33.sotillo e,barrett dm,black kl,bagashev a,oldridge d,wu g,et al.convergence of acquired mutations and alternative splicing of cd19 enables resistance to cart-19 immunotherapy.cancer discov.5,1282
–
1295(2015).doi:10.1158/2159-8290
279.34.grupp sa,teachey dt,porter dl,grupp sa.durable remissions in children with relapsed/refractory all treated with t cells engineered with a cd19-targeted chimeric antigen receptor(ctl019).blood 126,abstr.681(2015).doi:10.1182/blood-2014-12-580068
generated human car t cells eradicate tumor cells.doi:10.1080/2162402x.2019.1671761.
291.46.liu e,et.al.use of car-transduced natural killer cells in cd19-positive lymphoid tumors.n engl j med.2020 feb 6;382(6):545-553.doi:10.1056/nejmoa1910607.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1