使用结合LGR5及EGFR的抗体的癌症治疗的制作方法
使用结合lgr5及egfr的抗体的癌症治疗
技术领域
1.本公开涉及治疗癌症的手段及方法。本公开尤其关于一种使用结合lgr5及egfr的抗体治疗个体的癌症的方法。本发明进一步关于用于此类方法的组合及用于制造用于治疗胃肠癌的药物的组合。此类抗体尤其适用于治疗胃癌、食道癌或胃-食道接合部癌。
背景技术:
2.传统上,大部分癌症药物发现聚焦于阻断基本细胞功能且经由化学疗法杀死分裂细胞的药物。然而,化学疗法很少引起完全治愈。在大多数情况下,患者中的肿瘤停止生长或暂时缩小(称作缓解),结果却再次开始增殖,有时更加快速(称作再发),且变得愈来愈难以治疗。最近,癌症药物开发的焦点已远离广泛细胞毒性化学疗法移动至具有较少毒性的靶向细胞生长抑制疗法。用特异性抑制信号传导路径组分的靶向疗法治疗晚期癌症已在白血病中临床验证。然而,在大部分癌中,靶向方法仍证明无效。
3.尽管在疾病治疗中已取得许多进展且对导致癌症的分子事件的认识得到提高,但癌症仍为世界上的主要死亡原因。举例而言,胃癌为全世界第5常见诊断出的癌症,且为第3致命的癌症。在2018年,估计783,000人死于胃癌。食道癌为第9常见的癌症,且为第6常见的癌症死亡原因。据报导,表皮生长因子受体(egfr)在超过30%胃腺癌(gac)及食道腺癌(eac)病例中过度表达。然而,评述六项不同研究的分析得出结论,将抗egfr剂添加至化学疗法中不改良患有晚期/转移性eac、gac或胃-食道接合部腺癌(gejac)的患者的总存活期或无进展存活期(kim等人2017 oncotarget.2017年11月17日;8(58):99033-99040)。因此,存在治疗癌症、尤其是治疗胃癌及食道癌的需要。
技术实现要素:
4.本公开提供以下优选地实施方式。然而,本发明不限于这些实施方式。
5.在一些实施方式中,本公开提供抗体或其功能性部分、衍生物和/或类似物,其包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域,用于治疗受试者的癌症,其中所述用途包含向受试者提供1500mg固定剂量(flat dose)的抗体或其功能性部分、衍生物和/或类似物。本公开进一步提供治疗受试者的癌症的方法,包含向有需要的受试者提供1500mg固定剂量的抗体或其功能性部分、衍生物和/或类似物。
6.在一些实施方式中,本公开提供抗体或其功能性部分、衍生物和/或类似物,其包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域,用于治疗受试者的胃癌、食道癌或胃-食道接合部癌。本公开进一步提供在受试者中治疗受试者的胃癌、食道癌或胃-食道接合部癌的方法,包含向有需要的受试者提供抗体或其功能性部分、衍生物和/或类似物。优选地,所述用途包含向受试者提供1500mg固定剂量的抗体或其功能性部分、衍生物和/或类似物。
7.在一些实施方式中,治疗化合物的给药可每周、每两周或每月进行一次。在一些实施方式中,治疗化合物每2周给药一次。
8.在一些实施方式中,本公开提供抗体或其功能性部分、衍生物和/或类似物,其包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域,用于治疗her2阴性受试者的胃癌、食道癌或胃-食道接合部癌。本公开进一步提供治疗her2阴性受试者的胃癌、食道癌或胃-食道接合部癌的方法,包含向有需要的受试者提供抗体或其功能性部分、衍生物和/或类似物。优选地,所述用途包含向受试者提供1500mg固定剂量的抗体或其功能性部分、衍生物和/或类似物。在一些实施方式中,向her2阴性受试者给药治疗化合物可每周、每两周或每月进行一次。优选地,治疗化合物每2周给药一次。
9.优选地,静脉内提供抗体或其功能性部分、衍生物和/或类似物。
10.优选地,癌症在一种或多种选自以下的基因中具有突变:tp53、mlh1、pik3ca、cdkn2a、ugt1a、ugt1a8、braf、pten及kras,优选地其中癌症在一种或多种选自以下的基因中具有突变:tp53、mlh1、cdkn2a、ugt1a、ugt1a8、braf及pten。优选地,癌症具有一种或多种选自以下的突变:tp53 r196t;tp53 r342t;tp53 r248q;mlh1 v384d;pik3ca h1047r;cdkn2a w110t;ugt1a1 g71r;ugt1a8 g71r;及kras g12c。
11.优选地,癌症在编码tp53的基因中具有突变,优选地其中突变为r196t。优选地,癌症在编码tp53的基因中具有突变,优选地其中突变为r342t,且癌症在编码mlh1的基因中具有突变,优选地其中突变为v384d。
12.优选地,癌症在编码tp53的基因中具有突变,优选地其中突变为r248q;癌症在编码pik3ca的基因中具有突变,优选地其中突变为h1047r;癌症在编码cdkn2a的基因中具有突变,优选地其中突变为w110t;癌症在编码ugt1a1的基因中具有突变,优选地其中突变为g71r;且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。
13.优选地,癌症为食道癌,优选地食道鳞状细胞癌(escc)。
14.优选地,癌症在编码braf的基因中具有突变。然而,优选地,癌症在braf中不具有突变v600e,且其中癌症在编码pten的基因中具有突变。然而,优选地,癌症在pten中也不具有突变r130ter。
15.优选地,癌症在编码kras的基因中具有突变,优选地其中突变为g12c;癌症在编码ugt1a1的基因中具有突变,优选地其中突变为g71r;且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。
16.优选地,癌症在编码ugt1a1的基因中具有突变,优选地其中突变为g71r,且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。优选地,癌症进一步在pik3ca中具有突变,优选地其中突变为e545k。
17.优选地,癌症为胃癌。
18.优选地,结合egfr的可变结构域的vh链包含如图3中所描绘的vh链mf3755的氨基酸序列;或在如图3中所描绘的vh链mf3755中相对于该vh具有至多15个,优选地不超过10、9、8、7、6、5、4、3、2、1个且优选地具有不超过5、4、3、2或1个包括插入、缺失、取代或其组合的氨基酸修饰的氨基酸序列;且其中结合lgr5的可变结构域的vh链包含如图3中所描绘的vh链mf5816的氨基酸序列;或在如图3中所描绘的vh链mf5816中相对于该vh具有至多15个,优选地不超过10、9、8、7、6、5、4、3、2、1个且优选地具有不超过5、4、3、2或1个包括插入、缺失、取代或其组合的氨基酸修饰的氨基酸序列。
19.优选地,结合lgr5的可变结构域结合位于图1中所描绘的人类lgr5序列的氨基酸
残基21-118内的表位。优选地,人类lgr5的位置43、44、46、67、90及91处的氨基酸残基参与lgr5结合可变结构域与lgr5的结合。优选地,lgr5结合可变结构域与包含选自43a、44a、46a、67a、90a及91a的氨基酸残基突变中的一者或多者的lgr5蛋白的结合较弱。
20.优选地,结合egfr的可变结构域结合位于图2中所描绘的人类egfr序列的氨基酸残基420-480内的表位。优选地,人类egfr的位置i462、g465、k489、i491、n493及c499处的氨基酸残基参与egfr结合可变结构域与egfr的结合。优选地,egfr结合可变结构域与包含选自i462a、g465a、k489a、i491a、n493a及c499a的氨基酸残基取代中的一者或多者的egfr蛋白的结合较弱。
21.优选地,抗体经adcc增强。优选地,抗体是非岩藻醣修饰的(afucosylated)。
附图说明
22.图1:人类lgr5序列;序列id no:1。
23.图2:人类egfr序列;序列id no:2。
24.图3a):重链可变区的氨基酸序列(序列id no:3-15),其与共同轻链可变区(例如人类κ轻链igvκ1 39*01/igjκ1*01)一起形成结合lgr5及egfr的可变结构域。cdr及构架区在图3b)中指示。各别dna序列在图3c)中指示。
25.图4的a):共同轻链氨基酸序列的氨基酸序列。b):共同轻链可变区dna序列及转译(igkv1-39/jk1)。c):轻链恒定区dna序列及转译。d):v区igkv1-39a;e):根据imgt编号,共同轻链的cdr1、cdr2及cdr3。
26.图5:用于产生-双特异性分子的igg重链。a)ch1区dna序列及转译。b)铰链区dna序列及转译。c)ch2区dna序列及转译。d)含有突变l351k及t366k(kk)dna序列的ch3结构域及转译。e)含有突变l351d及l368e(de)dna序列的ch3结构域及转译。残基位置系根据eu编号。
27.图6:数据显示a)胃pdx模型及b)食道pdx模型中的平均肿瘤大小,误差杠为sem。使用二因子变异数分析(two-way anova)检定来计算给定时间点处的统计显著性。adc=腺癌。scc=鳞状细胞癌。灰色区表示治疗期。
具体实施方式
28.为了使本说明书可更容易理解,首先对某些术语进行定义。其他定义在整个实施方式中阐述。除非本文中单独定义,否则本文所用的所有技术及科学术语皆具有与一般本领域技术人员通常所理解相同的含义,且采用免疫学、蛋白质化学、生物化学、重组dna技术及药理学的常规方法。
29.如本文所用,单数形式“一(a/an)”及“该(the)”包括复数个参考物。术语“包含(comprising)”、“具有(having)”、“包括(including)”以及其他形式,例如“包含(comprise/comprises/comprised)”、“具有(has/have/had)”及“包括(include/includes/included)”的使用不具限制性。
30.如本文所用,术语“抗体”意指属于免疫球蛋白类别的蛋白质的蛋白质分子,其含有结合抗原上的表位的一个或多个结构域,其中此类结构域为抗体的可变区或自其衍生或与该可变区具有序列同源性。抗体通常由基础结构单元构成-各基础结构单元具有二条重链及二条轻链。根据本发明的抗体不限于任何特定形式或其产生方法。
[0031]“双特异性抗体”为如本文所描述的抗体,其中抗体的一个结构域结合至第一抗原,而抗体的第二结构域结合至第二抗原,其中该第一抗原及该第二抗原不相同,或其中一个结构域结合抗原上的第一表位,而第二结构域结合至抗原上的第二表位。术语“双特异性抗体”也涵盖其中一个重链可变区/轻链可变区(vh/vl)组合结合第一抗原或抗原上的第一表位,且第二vh/vl组合结合第二抗原或抗原上的第二表位的抗体。该术语进一步包括其中vh能够特异性识别第一抗原且免疫球蛋白可变区中与vh配对的vl能够特异性识别第二抗原的抗体。所得vh/vl对将结合抗原1或抗原2。此类所谓的“二合一抗体”描述于例如wo 2008/027236、wo 2010/108127以及schaefer等人(cancer cell 20,472-486,2011年10月)中。根据本发明的双特异性抗体不限于任何特定双特异性形式或其产生方法。
[0032]
如本文所用,“共同轻链”是指双特异性抗体中的二条轻链(或其vl部分)。二条轻链(或其vl部分)可相同或具有一些氨基酸序列差异,同时全长抗体的结合特异性不受影响。在添加或不添加术语『重排』的情况下,术语『共同轻链』、“共同vl”、“单一轻链”、“单一vl”均可在本文中互换使用。“共同”也指氨基酸序列不相同的轻链的功能等效物。该轻链存在许多变体,其中存在不影响功能结合区的形成的突变(缺失、取代、插入和/或添加)。本发明的轻链也可为如本文所指定的轻链,其具有0至10个,优选地0至5个氨基酸插入、缺失、取代、添加或其组合。举例而言,例如凭借引入且测试守恒的氨基酸变化,在与重链配对时不促成或仅部分促成结合特异性的区中的氨基酸变化及其类似者,制备或发现不相同但仍在功能上等效的轻链属于如本文所用的共同轻链的定义的范畴内。
[0033]
如本文所用,“包含”及其词形变化形式以其非限制性意义使用,意指包括该词之后的项目,但不排除未具体提及的项目。另外,动词“由
……
组成”可由“基本上由
……
组成”替换,意指如本文所定义的化合物或佐剂化合物可包含除具体鉴别的组分外的(多种)额外组分,该(等)额外组分不改变本发明的独特特征。
[0034]
根据本发明的术语“全长igg”或“全长抗体”定义为包含基本上整个igg,然而其不一定具有完整igg的所有功能。为免生疑问,全长igg含有二条重链及二条轻链。各链含有恒定(c)及可变(v)区,其可分解成命名为ch1、ch2、ch3、vh及cl、vl的结构域。igg抗体经由fab部分中所含的可变区结构域结合至抗原,且结合之后可经由恒定结构域(主要经由fc部分)与免疫系统的分子及细胞相互作用。根据本发明的全长抗体涵盖其中可存在提供所要特征的突变的igg分子。全长igg不应具有任一区的实质性部分的缺失。然而,其中一个或数个氨基酸残基缺失而基本上不改变所得igg分子的结合特征的igg分子包涵在术语“全长igg”内。举例而言,此类igg分子可具有1与10个氨基酸残基的间的缺失,优选地在非cdr区中,其中缺失的氨基酸并非igg的抗原结合特异性所必需。
[0035]“抗体的衍生物”为除cdr区外与天然抗体的氨基酸序列在至多20个氨基酸中有偏差的蛋白质。如本文所公开的抗体的衍生物为与该氨基酸序列在至多20个氨基酸中有偏差的抗体。
[0036]
当在本文中提及核酸或氨基酸序列时,“一致性百分比(%)”定义为在出于最佳比较目的比对序列之后,候选序列中与选定序列中的残基一致的残基的百分比。比较核酸序列的序列一致性百分比使用vector nti11.5.2软件的alignx应用程序,使用默认设置测定,这些预设设置采用改进的clustalw算法(thompson,j.d.,higgins,d.g.及gibson t.j.,(1994)nuc.acid res.22(22):4673-4680)、swgapdnamt分数矩阵、空位开放
4的四受体酪胺酸激酶(rtk)家族的成员。egfr以各种同义词为人所知,其中最常见的为egfr。egfr具有由四个亚结构域构成的胞外结构域(ecd),该四个亚结构域中的二个参与配体结合且二个参与同二聚化及异二聚化。egfr整合来自各种配体的胞外信号以产生多样胞内反应。由egfr活化的主要信号转导路径由ras-促分裂原活化蛋白激酶(mapk)促分裂信号级联构成。此路径的活化凭借将grb2募集至酪胺酸磷酸化egfr来起始。此引起经由grb2结合ras-鸟嘌呤核苷酸交换因子无七之子(son of sevenless,sos)进行的ras活化。另外,pi3-激酶-akt信号转导路径也由egfr活化,但此活化在存在erbb-3(her3)共表达的情况下强得多。egfr牵涉到数种人类上皮恶性疾病,尤其乳癌、膀胱癌、非小细胞肺癌、肺癌、大肠癌、卵巢癌、头颈癌及脑癌。已发现基因中的活化突变以及受体及其配体的过度表达,这些情况产生自分泌活化环。因此,此rtk已广泛用作癌症疗法的目标。靶向rtk的小分子抑制剂及针对胞外配体结合结构域的单株抗体(mab)二者均已得到研发且迄今已显示数项临床成功,即使大部分系精选患者组的临床成功。人类egfr蛋白及其编码基因的数据库寄存编号为genbank nm_005228.3。此寄存编号主要为了提供鉴别作为目标的egfr蛋白的另一方法而给出,抗体所结合的egfr蛋白的实际序列可变化,此例如归因于编码基因突变,例如在一些癌症或其类似疾病中出现的编码基因突变。
[0045]
除非另外说明,否则在本文提及egfr的情况下,提及是指人类egfr。结合egfr的可变结构域抗原结合位点结合egfr及其各种变体,例如在一些egfr阳性肿瘤上表达的彼等。
[0046]
术语“lgr”是指被称为含富白氨酸重复序列的g蛋白偶联受体的蛋白质家族。已知该家族的数种成员参与wnt信号传导路径,值得注意的是lgr4;lgr5及lgr6。
[0047]
lgr5为含富白氨酸重复序列的g蛋白偶联受体5。基因或蛋白质的替代名称为含富白氨酸重复序列的g蛋白偶联受体5;含有富白氨酸重复序列的g蛋白偶联受体5;g蛋白偶联受体hg38;g蛋白偶联受体49;g蛋白偶联受体67;gpr67;gpr49;孤儿g蛋白偶联受体hg38;g蛋白偶联受体49;gpr49;hg38及fex。结合lgr5的本发明的蛋白质或抗体结合人类lgr5。归因于人类与其他哺乳动物异种同源物的间的序列及三级结构类似性,本发明的lgr5结合蛋白或抗体也可结合此类异种同源物,但未必如此。人类lgr5蛋白及其编码基因的数据库寄存编号为(nc_000012.12;nt_029419.13;nc_018923.2;np_001264155.1;np_001264156.1;np_003658.1)。寄存编号主要为了提供鉴别作为目标的lgr5的另一方法而给出,所结合的lgr5蛋白的实际序列可变化,此例如归因于编码基因突变,例如在一些癌症或其类似疾病中出现的编码基因突变。lgr5抗原结合位点结合lgr5及其各种变体,例如由一些lgr5阳性肿瘤细胞表达的彼等。
[0048]
在一些实施方式中,癌症为胃肠癌,例如大肠直肠癌。优选地,癌症为胃癌、食道癌或胃-食道接合部癌。胃癌(gastric cancer/stomach cancer)为自胃粘膜且尤其其中发现的产生粘液的腺细胞发展的癌症。此类癌症也称为腺癌,或在此情况下胃腺癌,因为其自胃粘膜发展。在一优选的实施方式中,癌症因此为胃腺癌或自胃粘膜发展的癌症,该术语在本文中可互换使用。食道癌为自食道发展的癌症。二种主要次型为食道鳞状细胞癌(escc)及食道腺癌(eac)。胃-食道接合部癌(也称为胃-食道接合部腺癌)来源于胃-食道接合部。
[0049]
在一些实施方式中,癌症表达lgr5和/或表达egfr。如本文所用,若癌症包含表达lgr5的细胞,则癌症表达lgr5。表达lgr5的细胞包含可检测水平的编码lgr5的rna。如本文所用,若癌症包含表达egfr的细胞,则癌症表达egfr。表达egfr的细胞包含可检测水平的编
码lgr5的rna。通常也可凭借将细胞与结合至lgr5或egfr的抗体一起培育来检测表达。然而,一些细胞并不以对于此类抗体测试而言足够高的量表达蛋白质。在此类情况下,mrna或其他形式的核酸序列检测优选地。
[0050]
在一些实施方式中,本公开提供抗体或其功能性部分、衍生物和/或类似物,其包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域,用于治疗受试者的胃癌、食道癌或胃-食道接合部癌,该受试者的her2状态选自her2阳性、her2高、her2 3+、her2 2+、her2 1+、her2 0或her2阴性受试者。优选地,受试者为her2阴性。本公开进一步提供治疗her2阴性受试者的胃癌、食道癌或胃-食道接合部癌的方法,包含向有需要的受试者提供抗体或其功能性部分、衍生物和/或类似物。优选地,该用途包含向受试者提供1500mg固定剂量的抗体或其功能性部分、衍生物和/或类似物。在一些实施方式中,向her2阴性受试者给药治疗化合物可每周、每两周或每月进行一次。优选地,治疗化合物每2周给药一次。
[0051]
用于确定受试者的人类表皮生长因子受体2(her2)的表达的方法为此项技术中所熟知。举例而言,her2的表达水平可使用免疫组织化学(ihc)或(荧光)原位杂交(ish)建立,其使得可鉴别her2状态,包括鉴别her2阴性受试者。ihc或ish均为常规用于建立人类受试者中的her2状态的良好定义且标准的程序。本文参考例如根据bartley等人,(her2 testing and clinical decision making in gastroesophageal adenocarcinoma.arch pathol lab med.2016;140∶1345-1363)的asco/cap指南。举例而言,使用抗her-2/neu抗体(克隆4b5)使得可使用ihc半定量检测ffpe胃/胃食道腺癌、胃癌、食道癌或胃-食道接合部癌的切片中的her-2抗原。根据此癌症类型的共识指南进行染色及评分。此类ihc测试通常提供0至3+的评分,其量度癌症组织样品中细胞表面上her2受体蛋白的量。基于ihc评分,患者可分类为her2阴性,例如当量测到0或1+的评分时。倘若ish测试用于建立her2表达,例如使用her2探针(17q11.2-q12)及着丝点17探针(cen 17),则诊断为“阳性”或“阴性”,有时也报告为her2为“零”。本公开的治疗方法为优选地如凭借ihc和/或ish建立为her2阴性的受试者。
[0052]
在本文中,her2阴性受试者意指具有her2阴性的癌症、癌细胞或肿瘤的受试者。her2状态可如上文所描述根据ihc和/或ish确定。
[0053]
优选地,在一些实施方式中,使用抗体或其功能性部分、衍生物和/或类似物治疗之前为诊断受试者的her2状态的步骤。优选地,在一些实施方式中,选择具有her2阴性状态的受试者进行治疗。优选地,在一些实施方式中,治疗受试者之前为诊断患有her2阴性胃癌、食道癌或胃-食道接合部癌的受试者的步骤。凭借本公开的方法治疗的此类癌症包括具有鳞状细胞癌组织学的胃腺癌及食道癌。
[0054]
所述her2阴性诊断优选地涉及对her2状态进行ish或ihc测试。
[0055]
优选地,在一些实施方式中,治疗her2阴性受试者之前为筛选患有her2阴性胃癌、食道癌或胃-食道接合部癌的受试者的步骤。此类癌症尤其为腺癌。该筛选优选地涉及对her2状态进行ish或ihc测试。
[0056]
癌症,例如胃癌、食道癌或胃-食道接合部癌可能与存在突变相关。此类突变包括已知致癌基因,例如pik3ca、kras及braf中的突变。致癌突变一般描述为活化突变或产生新功能的突变。另一类型的癌症突变涉及肿瘤抑制基因,例如tp53、mlh1、cdkn2a及pten。肿瘤
抑制基因中的突变一般为失活性的。
[0057]
tp53编码调节包括压力反应及细胞增殖的多种活动的转录因子。tp53中的突变与各种癌症相关,且估计在超过50%的人类癌症,包括胃癌及食道癌中发生。具体而言,tp53 r248q突变显示为与包括胃癌及食道癌的癌症相关(pitolli等人int.j.mol.sci.2019 20:6241)。位置r196及r342处的无意义突变已在多种肿瘤中鉴别出,例如分别来自乳房及食道;及卵巢、前列腺、乳房、胰脏、胃、大肠/直肠、肺、食道、骨的肿瘤(priestly等人nature 2019 575:210-216)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有tp53突变,尤其导致tp53表达或活性降低的突变的癌症。
[0058]
mutl同源物1(mlh1)编码参与dna错配修复的蛋白质且为已知肿瘤抑制基因。mlh1中的突变与包括胃肠癌的各种癌症相关。低水平的mlh1也与具有食道癌家族病史的食道癌患者相关(chang等.oncol lett.20159:430-436),且1.39%的恶性食道肿瘤患者中mlh1突变(the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。具体而言,mlh1 v384d突变显示为与癌症,例如大肠直肠癌相关(ohsawa等人molecular medicine reports 2009 2∶887-891)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有mlh1突变,尤其导致mlh1表达或活性降低的突变的癌症。
[0059]
磷脂酰肌醇-4,5-双磷酸3-激酶催化次单元α(pik3ca)编码磷脂酰肌醇3-激酶(pi3k)的110kda催化次单元。pik3ca中的突变与各种癌症相关,包括胃肠癌。据美国癌症研究协会(american association for cancer research)报导,12.75%的恶性实体肿瘤患者中pik3ca突变。具体而言,pik3ca h1047r突变在所有恶性实体肿瘤患者的2.91%中存在,且pik3ca e545k在所有恶性实体肿瘤患者的2.55%中存在(参见the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有pik3ca突变,尤其pik2ca中的致癌突变的癌症。
[0060]
周期蛋白依赖型激酶抑制剂2a(cdkn2a)编码抑制cdk4及arf的蛋白质。据美国癌症研究协会报导,22.21%的食道癌患者、28.7%的食道鳞状细胞癌患者及6.08%的胃腺癌患者中cdkn2a突变。具体而言,cdkn2aw110ter突变在大约0.11%的癌症患者中存在。(the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有cdkn2a突变,尤其导致cdkn2a表达或活性降低的突变的癌症。
[0061]
磷酸酶及张力蛋白同源物(pten)编码磷脂酰肌醇3,4,5-三磷酸3-磷酸酶。据美国癌症研究协会报导,6.28%的癌症患者、3.41%的胃腺癌患者、2.37%的食道癌患者及2.22%的食道腺癌患者中pten突变。具体而言,pten r130ter突变(其中ter是指终止(termination/stop)密码子)在所有大肠直肠癌患者的0.21%中存在(the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。在一
些实施方式中,本文所公开的治疗化合物适用于治疗具有pten突变,尤其导致pten表达或活性降低的突变的癌症。
[0062]
braf编码丝氨酸/苏氨酸蛋白激酶b-raf,其参与生长信号传导。据美国癌症研究协会报导,1.91%的胃癌瘤患者及1.93%的胃腺癌患者中braf突变。具体而言,braf v600e突变在2.72%的癌症患者中存在(参见the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有braf突变,尤其braf中的致癌突变的癌症。然而,在一些实施方式中,本文所公开的治疗化合物适用于治疗不具有braf突变v600e的胃癌。
[0063]
基尔斯滕大鼠肉瘤(kirsten rat sarcoma,kras)编码作为ras/mapk路径的一部分的蛋白质。据美国癌症研究协会报导,14.7%的恶性实体肿瘤患者中kras突变,其中kras g12c在所有恶性实体肿瘤患者的2.28%中存在(参见the aacr project genie consortium.aacr project genie:powering precision medicine through an international consortium.cancer discovery.2017;7(8):818-831.数据集第6版)。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有kras突变,尤其kras中的致癌突变的癌症。
[0064]
尿苷二磷酸葡萄糖醛酸基转移酶1a1(ugt1a1)及尿苷二磷酸葡萄糖醛酸基转移酶1a8(ugt1a8)编码葡萄糖醛酸化路径的酶。已知降低酶活性的数种多型现象影响伊立替康(irinotecan)的代谢及效果。举例而言,ugt1a1*6对偶基因(g71r多型现象)在中国、韩国及日本人群中具有大约0.13%的对偶基因频率,且ugt1a1*28对偶基因(启动子区的tata序列中的二核苷酸重复多型现象)为伊立替康诱导的嗜中性白血球减少症的风险因子。在一些实施方式中,本文所公开的治疗化合物适用于治疗具有ugt1a1和/或ugt1a8突变,尤其导致ugt1a1和/或ugt1a8表达或活性降低的突变的癌症。
[0065]
毛细血管扩张性失调突变蛋白(ataxia telangiectaisa mutated,atm)为丝氨酸-苏氨酸激酶家族成员,且经由活化独特dna修复及信号传导路径协调对dna损伤的细胞反应。atm生殖系突变与毛细血管扩张性失调相关,且atm体细胞突变通常在子宫内膜癌、大肠癌、胰脏癌、乳癌及尿道上皮癌中观测到。
[0066]
在优选的实施方式中,本公开提供用于治疗在编码tp53、mlh1、pik3ca、cdkn2a、ugt1a、ugt1a8、braf、pten及kras的基因中具有突变的癌症的方法。优选地,癌症具有一种或多种选自以下的突变:tp53 r196t;tp53 r342t;tp53 r248q;mlh1 v384d;pik3ca h1047r;pik3cae545k;cdkn2aw110t;ugt1a1 g71r;ugt1a8 g71r;及kras g12c。在一些实施方式中,癌症为kras野生型。或者,本公开提供用于治疗在编码atm的基因中具有突变,尤其突变w57t的癌症的方法。具体而言,本公开提供用于治疗在编码atm的基因中具有突变,尤其突变w57t的食道癌,尤其escc的方法。
[0067]
在一些实施方式中,癌症在编码tp53的基因中具有突变,优选地其中突变为r342t,且癌症在编码mlh1的基因中具有突变,优选地其中突变为v384d。
[0068]
在一些实施方式中,癌症在编码tp53的基因中具有突变,优选地其中突变为r248q;癌症在编码pik3ca的基因中具有突变,优选地其中突变为h1047r;癌症在编码cdkn2a的基因中具有突变,优选地其中突变为w110t;癌症在编码ugt1a1的基因中具有突
变,优选地其中突变为g71r;且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。优选地,癌症为食道癌,优选地食道鳞状细胞癌(escc)。
[0069]
在一些实施方式中,癌症在编码braf的基因中具有突变。然而,癌症优选地在编码braf的基因中不具有突变v600e,且优选地在编码pten的基因中不具有突变r130ter。在一些实施方式中,癌症在编码kras的基因中具有突变,优选地其中突变为g12c;癌症在编码ugt1a1的基因中具有突变,优选地其中突变为g71r;且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。在一些实施方式中,癌症在编码ugt1a1的基因中具有突变,优选地其中突变为g71r,且癌症在编码ugt1a8的基因中具有突变,优选地其中突变为g71r。在一些实施方式中,癌症在pik3ca中具有突变,优选地其中突变为e545k。优选地,癌症为胃癌。
[0070]
如本文所描述的抗体或其功能性部分、衍生物和/或类似物包含结合表皮生长因子(egf)受体的胞外部分的可变结构域及结合lgr5的可变结构域。egfr优选地为人类egfr。lgr5优选地为人类lgr5。如本文所描述的抗体或其功能性部分、衍生物和/或类似物包含结合人类表皮生长因子(egf)受体的胞外部分的可变结构域及结合人类lgr5的可变结构域。
[0071]
优选地,如本文所描述的抗体或其功能性部分、衍生物和/或类似物包含结合表皮生长因子(egf)受体的胞外部分且干扰egf与受体结合的可变结构域及结合lgr5的可变结构域,其中抗体与表达lgr5的细胞上的lgr5的相互作用不阻断r脊椎蛋白(rspondin,rspo)与lgr5的结合。用于确定抗体阻断还是不阻断r脊椎蛋白与lgr5的结合的方法描述于wo2017069528中,其在此以引用的方式并入。
[0072]
在本文中给出蛋白质/基因的寄存编号或替代名称时,其主要为了提供鉴别作为目标的所提及蛋白质的另一方法而给出,本发明抗体所结合的目标蛋白的实际序列可变化,例如归因于编码基因中的突变和/或选择性剪接,例如在一些癌症或其类似疾病中出现的彼等。目标蛋白由抗体结合,只要表位存在于蛋白质中且表位为抗体可接近的即可。
[0073]
如本文所描述的抗体或其功能性部分、衍生物和/或类似物优选地干扰egfr的配体与egfr的结合。如本文所用,术语“干扰结合”意指抗体或其功能性部分、衍生物和/或类似物与egfr的结合同配体竞争与egf受体的结合。抗体或其功能性部分、衍生物和/或类似物可减弱配体结合,在此已结合至egf受体时取代配体,或其可例如经由位阻至少部分阻止配体可结合至egf受体。
[0074]
如本文所公开的egfr抗体优选地分别抑制egfr配体诱导的信号传导,其量测为配体诱导的bxpc3细胞(atcc crl-1687)或bxpc3-luc2细胞(perkin elmer 125058)的生长,或配体诱导的a431细胞(atcc crl-1555)的细胞死亡。egfr可结合多种配体且刺激所提及的bxpc3细胞或bxpc3-luc2细胞的生长。在egfr配体存在下,bxpc3或bxpc3-luc2细胞的生长受到刺激。可凭借比较在不存在及存在配体的情况下的细胞生长来量测egfr配体诱导的bxpc3细胞生长。用于量测egfr配体诱导的bxpc3或bxpc3-luc2细胞生长的优选地egfr配体为egf。配体诱导的生长优选地使用饱和量的配体来量测。在一优选的实施方式中,egf以100ng/ml培养基的量使用。egf优选地为egf r&d systems,目录号396-hb及236-eg(也参见wo2017/069628;其以引用的方式并入本文中)。
[0075]
如本文所公开的egfr抗体优选地抑制egfr配体诱导的bxpc3细胞(atcc crl-1687)或bxpc3-luc2细胞(perkin elmer 125058)的生长。egfr可结合多种配体且刺激所提
及的bxpc3细胞或bxpc3-luc2细胞的生长。在配体存在下,bxpc3或bxpc3-luc2细胞的生长受到刺激。可凭借比较在不存在及存在配体的情况下的细胞生长来量测egfr配体诱导的bxpc3细胞生长。用于量测egfr配体诱导的bxpc3或bxpc3-luc2细胞生长的优选地egfr配体为egf。配体诱导的生长优选地使用饱和量的配体来量测。在优选的实施方式中,egf以100ng/ml培养基的量使用。egf优选地为r&d systems,目录号396-hb及236-eg的egf(也参见wo2017/069628;其以引用的方式并入本文中)。
[0076]
为免生疑问,如本文所用提及细胞生长是指细胞数目的变化。生长抑制是指原本将获得的细胞数目的减少。生长增加是指原本将获得的细胞数目的增加。细胞生长通常是指细胞增殖。
[0077]
如本文所描述的抗体是否以多特异性形式抑制信号传导或抑制生长优选地凭借如上文所描述的方法,使用单特异性单价或单特异性二价形式的抗体来确定。此类抗体优选地具有信号传导待确定的受体的结合位点。单特异性单价抗体可具有带有不相关结合特异性,例如破伤风类毒素特异性的可变结构域。优选地抗体为二价单特异性抗体,其中抗原结合可变结构域由结合egf受体家族成员的可变结构域组成。
[0078]
merus在其抗体计划中开发出靶向egfr及lgr5(含富白氨酸重复序列的g蛋白偶联受体)的多特异性抗体。已分别使用患者源crc类器官及小鼠pdx模型活体外及活体内评定此类多特异性抗体的功效(参见例如wo2017/069628;其以引用的方式并入本文中)。靶向egfr及lgr5的多特异性抗体显示抑制肿瘤生长。此类抑制性抗体的效力显示为与来自癌症的细胞的lgr5 rna表达水平相关。如wo2017/069628中所描述的靶向egfr及lgr5的多特异性抗体特别优选。
[0079]
如本文所描述的抗体或其功能性部分、衍生物和/或类似物包含结合lgr5的胞外部分的可变结构域。结合lgr5的胞外部分的可变结构域优选地结合位于图1的序列的氨基酸残基21-118内的表位,该序列中氨基酸残基d43;g44、m46、f67、r90及f91参与抗体与表位的结合。
[0080]
lgr5可变结构域优选地为可变结构域,其中lgr5中的氨基酸残基取代d43a;g44a、m46a、f67a、r90a及f91a中的一者或多者减弱可变结构域与lgr5的结合。
[0081]
lgr5的胞外部分上的表位优选地位于图1的序列的氨基酸残基21-118内。其优选地为表位,其中lgr5可变结构域与lgr5的结合凭借lgr5中的以下氨基酸残基取代中的一者或多者减弱:d43a;g44a、m46a、f67a、r90a及f91a。
[0082]
本公开进一步提供具有结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体,其中lgr5可变结构域结合lgr5上位于图1的序列的氨基酸残基21-118内的表位。
[0083]
lgr5上的表位优选地为构形表位。表位优选地位于图1的序列的氨基酸残基40-95内。抗体与lgr5的结合优选地经以下氨基酸残基取代中的一者或多者减弱:d43a;g44a、m46a、f67a、r90a及f91a。
[0084]
在不受理论束缚的情况下,认为如图1中所描绘的lgr5的m46、f67、r90及f91为如上文所指示的可变结构域的接触残基,也即可变结构域结合lgr5表位的抗原结合位点。氨基酸残基取代d43a及g44a减弱抗体的结合可能归因于这些残基也为接触残基,然而,也有可能这些氨基酸残基取代诱导lgr5中具有其他接触残基(也即在位置46、67、90或91处)中
的一者或多者的部分的构形的(轻微)修改,且该构形变化使得抗体结合减弱。表位的特征在于所提及的氨基酸取代。抗体是否结合相同表位可以各种方式确定。在例示性方法中,cho细胞将lgr5表达于细胞膜,或丙氨酸取代突变体,优选地包含取代m46a、f67a、r90a或f91a中的一者或多者的突变体。使测试抗体与cho细胞接触,且比较抗体与细胞的结合。若测试抗体结合至lgr5,且以较低程度结合至具有m46a、f67a、r90a或f91a取代的lgr5,则测试抗体结合表位。将与各自包含一个丙氨酸残基取代的一组突变体的结合进行比较为优选的。此类结合研究为此项技术中所熟知。通常该组包含覆盖基本上所有氨基酸残基的单一丙氨酸取代突变体。对于lgr5,该组仅需要覆盖蛋白质的胞外部分,且当使用细胞时当然覆盖保证与细胞膜缔合的部分。特定突变体的表达可受到损害,但此容易凭借一种或多种结合至(多种)不同区的lgr5抗体来检测。若对于这些对照抗体,表达也降低,则对于此特定突变体,膜上的蛋白质水平或折迭受到损害。测试抗体与该组的结合特征容易鉴别出测试抗体是否展现与具有m46a、f67a、r90a或f91a取代的突变体的结合减弱,且因此测试抗体是否为本发明抗体。与具有m46a、f67a、r90a或f91a取代的突变体的结合减弱也鉴别出表位位于图1的序列的氨基酸残基21-118内。在优选的实施方式中,该组包括d43a取代突变体、g44a取代突变体或二者。具有mf5816的vh的vh序列的抗体展现与这些取代突变体的结合减弱。
[0085]
在不受任何理论束缚的情况下,认为如图2描绘的氨基酸残基i462;g465;k489;i491;n493;及c499参与由包含如上文所指示的可变结构域的抗体结合表位。参与结合优选地凭借观测可变结构域与具有选自以下的氨基酸残基取代中的一者或多者的egfr的结合减弱来确定:i462a;g465a;k489a;i491a;n493a;及c499a。
[0086]
在一个方面,结合人类egfr的胞外部分上的表位的可变结构域为结合位于图2中所描绘的序列的氨基酸残基420-480内的表位的可变结构域。优选地,可变结构域与egfr的结合凭借egfr中的以下氨基酸残基取代中的一者或多者减弱:i462a;g465a;k489a;i491a;n493a;及c499a。抗体与人类egfr的结合优选地干扰egf与受体的结合。egfr上的表位优选地为构形表位。在一个方面,表位位于图2中所描绘的序列的氨基酸残基420-480内,优选地位于图2中所描绘的序列的430-480;优选地位于图2中所描绘的序列的438-469内。
[0087]
在不受理论束缚的情况下,认为表位的接触残基,也即可变结构域接触人类egfr的位置可能为i462;k489;i491;及n493。氨基酸残基g465及c499可能间接参与抗体与egfr的结合。
[0088]
结合人类egfr的可变结构域优选地为具有重链可变区的可变结构域,该重链可变区包含至少如图3中所描绘的mf3755的vh的cdr3序列,或与如图3中所描绘的mf3755的vh的cdr3序列在至多三个,优选地至多二个,优选地不超过一个氨基酸中不同的cdr3序列。
[0089]
结合人类egfr的可变结构域优选地为具有重链可变区的可变结构域,该重链可变区包含至少如图3中所描绘的mf3755的vh的cdr1、cdr2及cdr3序列;或具有至多三个,优选地至多二个,优选地至多一个氨基酸取代的如图3中所描绘的mf3755的vh的cdr1、cdr2及cdr3序列。
[0090]
结合人类egfr的可变结构域优选地为具有重链可变区的可变结构域,该重链可变区包含如图3中所描绘的mf3755的vh链的序列;或图3中所描绘的mf3755的vh链的氨基酸序列,其相对于mf3755的vh链具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0091]
在一个实施方式中,本公开提供包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体,
[0092]
其中该可变结构域的重链可变区包含至少选自由如图3中所描绘的mf3370;mf3755;mf4280或mf4289组成的组的egfr特异性重链可变区的cdr3序列,或其中该可变结构域的重链可变区包含与选自由如图3中所描绘的mf3370;mf3755;mf4280或mf4289组成的组的vh的cdr3序列在至多三个,优选地至多二个,优选地不超过一个氨基酸中不同的重链cdr3序列。该可变结构域优选地包含有包含至少如图3中所描绘的mf3370;mf3755;mf4280或mf4289的cdr3序列的重链可变区。
[0093]
所述可变结构域优选地包括包含至少选自由如图3中所描绘的mf3370;mf3755;mf4280或mf4289组成的组的egfr特异性重链可变区的cdr1、cdr2及cdr3序列的重链可变区,或包含至少与选自由如图3中所描绘的mf3370;mf3755;mf4280或mf4289组成的组的egfr特异性重链可变区的cdr1、cdr2及cdr3序列在至多三个,优选地至多二个,优选地至多一个氨基酸中不同的cdr1、cdr2及cdr3序列的重链可变区。该可变结构域优选地包含有包含至少如图3中所描绘的mf3370;mf3755;mf4280或mf4289的cdr1、cdr2及cdr3序列的重链可变区。优选的重链可变区为mf3755。另一优选的重链可变区为mf4280。
[0094]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域,其中egfr结合可变结构域具有如上文所指示的cdr3,cdr1、cdr2及cdr3和/或vh序列的抗体优选地具有结合lgr5的可变结构域,该可变结构域包含至少选自由如图3中所描绘的mf5790;mf5803;mf5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818组成的组的lgr5特异性重链可变区的cdr3序列,或与选自由如图3中所描绘的mf5790;mf5803;mf5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818组成的组的vh的cdr3序列在至多三个,优选地至多二个,优选地不超过一个氨基酸中不同的重链cdr3序列。该可变结构域优选地包含有包含至少如图3中所描绘的mf5790;mf5803;mf 5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818的cdr3序列的重链可变区。
[0095]
lgr5可变结构域优选地包含重链可变区,其包含至少选自由如图3中所描绘的mf5790;mf5803;mf5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818组成的组的lgr5特异性重链可变区的cdr1、cdr2及cdr3序列,或与选自由如图3中所描绘的mf5790;mf5803;mf5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818组成的组的lgr5特异性重链可变区的cdr1、cdr2及cdr3序列在至多三个,优选地至多二个,优选地至多一个氨基酸中不同的重链cdr1、cdr2及cdr3序列。该可变结构域优选地包含有包含至少如图3中所描绘的mf5790;mf5803;mf5805;mf5808;mf5809;mf5814;mf5816;mf5817;或mf5818的cdr1、cdr2及cdr3序列的重链可变区。优选的重链可变区为mf5790;mf5803;mf5814;mf5816;mf5817;或mf5818。特别优选重链可变区为mf5790;mf5814;mf5816;及mf5818;优选地mf5814、mf5818及mf5816,重链可变区mf5816特别优选。另一优选的重链可变区为mf5818。
[0096]
已显示当用于抑制egfr配体反应性癌症或细胞的生长时,包含一个或多个具有重链可变区mf3755或其一个或多个cdr的可变结构域的抗体具有较好有效性。在双特异性或多特异性抗体的情形下,包含具有重链可变区mf3755或其一个或多个cdr的可变结构域的抗体的臂与包含具有重链可变区mf5818或其一个或多个cdr的可变结构域的臂良好组合。
[0097]
结合egfr或lgr5的可变结构域的vh链相对于图3中所描绘的序列可具有一个或多
个氨基酸取代。vh链优选地具有图3的egfr或lgr5 vh的氨基酸序列,其相对于图3的vh链序列具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0098]
cdr序列相对于图中的cdr序列可具有一个或多个氨基酸残基取代。此类一个或多个取代例如出于优化目的而进行,优选地为了改良抗体的结合强度或稳定性。优化例如凭借突变诱发程序进行,其中优选地测试所得抗体的稳定性和/或结合亲和力之后,优选地选择改良的egfr特异性cdr序列或lgr5特异性cdr序列。本领域技术人员完全能够产生包含至少一个改变的根据本发明的cdr序列的抗体变体。举例而言,可应用守恒的氨基酸取代。守恒的氨基酸取代的实例包括将一个疏水性残基(例如异白氨酸、缬胺酸、白氨酸或甲硫胺酸)取代为另一疏水性残基,且将一个极性残基取代为另一极性残基,例如将精氨酸取代为赖氨酸,谷氨酸取代为天冬氨酸或谷氨酰胺取代为天冬酰胺。
[0099]
优选地,如本文所指定的vh或vl中所提及的至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地1、2、3、4或5个氨基酸取代优选地为守恒的氨基酸取代。如本文所指定的vh或vl中的氨基酸插入、缺失及取代优选地不存在于cdr3区中。所提及的氨基酸插入、缺失及取代优选地也不存在于cdr1及cdr2区中。所提及的氨基酸插入、缺失及取代优选地也不存在于fr4区中。
[0100]
所提及的至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地1、2、3、4或5个氨基酸取代优选地为守恒的氨基酸取代,插入、缺失、取代或其组合优选地不处于vh链的cdr3区中,优选地不处于vh链的cdr1、cdr2或cdr3区中,且优选地不处于fr4区中。
[0101]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0102]-如图3中所描绘的vh链mf3755的氨基酸序列;或
[0103]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0104]
其中结合lgr5的可变结构域的vh链包含
[0105]-如图3中所描绘的vh链mf5790的氨基酸序列;或
[0106]-如图3中所描绘的vh链mf5790的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0107]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0108]-如图3中所描绘的vh链mf3755的氨基酸序列;或
[0109]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于所述vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0110]
其中结合lgr5的可变结构域的vh链包含
[0111]-如图3中所描绘的vh链mf5803的氨基酸序列;或
[0112]-如图3中所描绘的vh链mf5803的氨基酸序列,其相对于该vh具有至多15个,优选
地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0113]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0114]-如图3中所描绘的vh链mf3755的氨基酸序列;或
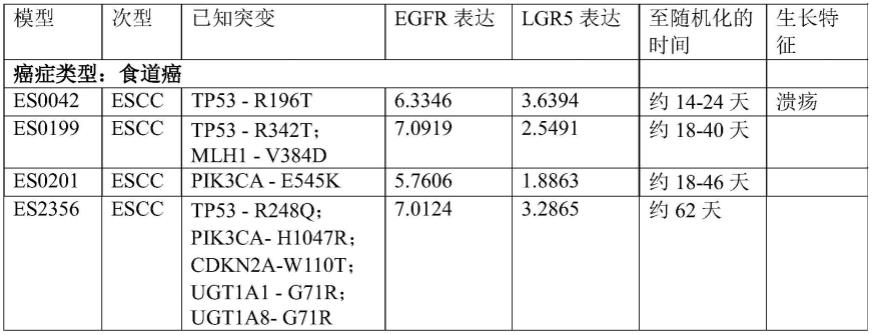
[0115]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0116]
其中结合lgr5的可变结构域的vh链包含
[0117]-如图3中所描绘的vh链mf5814的氨基酸序列;或
[0118]-如图3中所描绘的vh链mf5814的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0119]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0120]-如图3中所描绘的vh链mf3755的氨基酸序列;或
[0121]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0122]
其中结合lgr5的可变结构域的vh链包含
[0123]-如图3中所描绘的vh链mf5816的氨基酸序列;或
[0124]-如图3中所描绘的vh链mf5816的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0125]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0126]-如图3中所描绘的vh链mf3755的氨基酸序列;或
[0127]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0128]
其中结合lgr5的可变结构域的vh链包含
[0129]-如图3中所描绘的vh链mf5817的氨基酸序列;或
[0130]-如图3中所描绘的vh链mf5817的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0131]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体优选地包含
[0132]-如图3中所描绘的vh链mf3755的氨基酸序列或
[0133]-如图3中所描绘的vh链mf3755的氨基酸序列,其相对于该vh具有至多15个,优选
地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合;且
[0134]
其中结合lgr5的可变结构域的vh链包含
[0135]-如图3中所描绘的vh链mf5818的氨基酸序列;或
[0136]-如图3中所描绘的vh链mf5818的氨基酸序列,其相对于该vh具有至多15个,优选地1、2、3、4、5、6、7、8、9或10个且优选地具有1、2、3、4或5个氨基酸插入、缺失、取代或其组合。
[0137]
所公开的氨基酸序列保留egfr或lgr5结合的额外变体可获自例如含有重排人类igkvl-39/igkjl vl区的噬菌体展示文库(de kruif等人biotechnol bioeng.2010(106)741-50),及将氨基酸取代并入至本文所公开的egfr或lgr5 vh区的氨基酸序列中的vh区的集合,如先前所描述(例如wo2017/069628)。编码结合egfr或lgr5的fab区的噬菌体可凭借流式细胞术选择并分析,且经定序以鉴别具有保留抗原结合的氨基酸取代、插入、缺失或添加的变体。
[0138]
egfr/lgr5抗体的vh/vl egfr及lgr5可变结构域的轻链可变区可相同或不同。在一些实施方式中,egfr/lgr5抗体的vh/vl egfr可变结构域的vl区类似于vh/vl lgr5可变结构域的vl区。在某些实施方式中,第一及第二vh/vl可变结构域中的vl区相同。
[0139]
在某些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域的轻链可变区包含共同轻链可变区。在一些实施方式中,一个或二个vh/vl可变结构域的共同轻链可变区包含生殖系igvκ1-39可变区v段。在某一实施方式中,一个或二个vh/vl可变结构域的轻链可变区包含κ轻链v段igvκ1-39*01。igvκ1-39为免疫球蛋白可变κ1-39基因的简写。该基因也称为免疫球蛋白κ可变1-39;igkv139;igkv1-39。基因外部id为hgnc:5740;entrez基因:28930;ensembl:ensg00000242371。适合v区的氨基酸序列提供于图4中。v区可与五个j区中的一者组合。优选地j区为jk1及jk5,且接合序列指示为igkv1-39/jk1及igkv1-39/jk5;替代名称为igvκ1-39*01/igjκ1*01或igvκ1-39*01/igjκ5*01(根据imgt数据库全球信息网imgt.org命名)。在某些实施方式中,一个或二个vh/vl可变结构域的轻链可变区包含κ轻链igvκ1-39*01/igjκ1*01或igvκ1-39*01/igjκ1*05(描述于图4中)。
[0140]
在一些实施方式中,egfr/lgr5双特异性抗体的一个或二个vh/vl可变结构域的轻链可变区包含有包含氨基酸序列qsissy的lcdr1(描述于图4中)、包含氨基酸序列aas的lcdr2(描述于图4中)及包含氨基酸序列qqsystp的lcdr3(描述于图4中)(即,根据imgt的igkv1-39的cdr)。在一些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域的轻链可变区包含有包含氨基酸序列qsissy的lcdr1(描述于图4中)、包含氨基酸序列aaslqs的lcdr2(描述于图4中)及包含氨基酸序列qqsystp的lcdr3(描述于图4中)。
[0141]
在一些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域包含轻链可变区,其包含与图4中所阐述的氨基酸序列至少90%,优选地至少95%,更优选至少97%,更优选至少98%,更优选至少99%一致或100%一致的氨基酸序列。在一些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域包含轻链可变区,其包含与图4中所阐述的氨基酸序列至少90%,优选地至少95%,更优选至少97%,更优选至少98%,更优选至少99%一致或100%一致的氨基酸序列。
[0142]
举例而言,在一些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域的
可变轻链相对于图4中的序列可具有0至10个,优选地0至5个氨基酸插入、缺失、取代、添加或其组合。在一些实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域的轻链可变区相对于指定氨基酸序列包含0至9、0至8、0至7、0至6、0至5、0至4,优选地0至3,优选地0至2,优选地0至1且优选地0个氨基酸插入、缺失、取代、添加或其组合。
[0143]
在其他实施方式中,egfr/lgr5抗体的一个或二个vh/vl可变结构域的轻链可变区包含如图4中所描绘的序列的氨基酸序列。在某些实施例中,egfr/lgr5抗体的二个vh/vl可变结构域包含相同的vl区。在一个实施方式中,egfr/lgr5双特异性抗体的二个vh/vl可变结构域的vl包含图4中所阐述的氨基酸序列。在一个实施方式中,egfr/lgr5双特异性抗体的二个vh/vl可变结构域的vl包含图4中所阐述的氨基酸序列。
[0144]
如本文所描述的egfr/lgr5抗体优选地为具有二个可变结构域的双特异性抗体,一个可变结构域结合egfr且另一可变结构域结合lgr5,如本文所描述。用于本文所公开的方法的egfr/lgr5双特异性抗体可以多种形式提供。此项技术中已知许多不同形式的双特异性抗体,且其已由kontermann(drug discov today,2015年7月;20(7):838-47;mabs,2012年3月-4月;4(2):182-97)及spiess等人,(alternative molecular formats and therapeutic applications for bispecific antibodies.mol.immunol.(2015)http://dx.doi.org/10.1016/j.molimm.2015.01.003)中评述,这些文献各自以引用的方式并入本文中。举例而言,并非具有二个vh/vl组合的典型抗体的双特异性抗体形式具有至少一个包含重链可变区及轻链可变区的可变结构域。此可变结构域可连接至提供第二结合活性的单链fv片段、单功能抗体(monobody)、vh及fab片段。
[0145]
在一些实施方式中,本文提供的方法中所使用的egfr/lgr5双特异性抗体一般为人类igg子类(例如,igg1、igg2、igg3、igg4)。在某些实施例中,抗体为人类igg1子类。全长igg抗体归因于其有利的半衰期且出于低免疫原性的原因而优选地。因此,在某些实施方式中,egfr/lgr5双特异性抗体为全长igg分子。在一实施方式中,egfr/lgr5双特异性抗体为全长igg1分子。
[0146]
因此,在某些实施方式中,egfr/lgr5双特异性抗体包含可结晶片段(fc)。egfr/lgr5双特异性抗体的fc优选地由人类恒定区构成。egfr/lgr5双特异性抗体的恒定区或fc可含有一个或多个,优选地不超过10个,优选地不超过5个与天然存在的人类抗体恒定区的氨基酸差异。举例而言,在某些实施方式中,双特异性抗体的fab臂可进一步包括包含促进双特异性抗体形成、促进稳定性和/或本文所描述的其他特征的修饰的fc区。
[0147]
双特异性抗体通常由表达编码抗体的(多种)核酸的细胞产生。因此,在一些实施方式中,本文所公开的双特异性egfr/lgr5抗体凭借提供细胞产生,该细胞包含一种或多种编码双特异性egfr/lgr5抗体的重链及轻链可变区及恒定区的核酸。细胞优选地为动物细胞,更优选哺乳动物细胞,更优选灵长类动物细胞,最佳人类细胞。适合的细胞为能够包含且优选地能够产生egfr/lgr5双特异性抗体的任何细胞。
[0148]
适用于抗体产生的细胞为此项技术中已知,且包括融合瘤细胞、中国仓鼠卵巢(cho)细胞、ns0细胞或per-c6细胞。各种机构及公司已开发出用于大规模生产抗体的细胞株,例如用于临床用途。此类细胞株的非限制性实例为cho细胞、ns0细胞或per.c6细胞。在特别优选的实施方式中,所述细胞为人类细胞。优选地,细胞经腺病毒e1区或其功能等效物转型。此类细胞株的优选地实例为per.c6细胞株或其等效物。在特别优选的实施方式中,该
biological inc,目录号11896-h07h)及人类lgr5蛋白以一定浓度范围在传感器表面上流动且量测缔合及解离速率。在各循环之后,凭借hcl脉冲使传感器表面再生且再次捕获bsab。根据所获得的传感器图谱,使用biaevaluation软件确定与人类lgr5及egfr结合的缔合及解离速率及亲和力值,如先前在us 2016/0368988中针对cd3所描述。
[0155]
如本文所公开的抗体通常为双特异性全长抗体,优选地为人类igg子类,优选地为人类igg1子类。此类抗体具有必要时可凭借此项技术中已知的技术增强的良好adcc特性,在向人类活体内给药时具有有利半衰期,且存在ch3工程改造技术,其可提供在克隆细胞中共表达时优先于同二聚体形成异二聚体的经修饰重链。
[0156]
当抗体自身具有低adcc活性时,可凭借对抗体恒定区进行修饰来改良抗体的adcc活性。改良抗体的adcc活性的另一方式为凭借酶干扰醣基化路径,引起岩藻糖减少。存在数种用于确定抗体或效应细胞在引发adcc方面的功效的活体外方法。其中有铬-51[cr51]释放分析、铕[eu]释放分析及硫-35[s35]释放分析。通常,将表达某一表面暴露抗原的标记目标细胞株与对该抗原具特异性的抗体一起培育。在洗涤之后,将表达fc受体cd16的效应细胞与经抗体标记的目标细胞共培育。随后凭借闪烁计数器或分光亮度法由胞内标记的释放来量测目标细胞溶解。
[0157]
如本文所公开的双特异性抗体可经adcc增强。在一个实施例中,双特异性抗体可为非岩藻醣修饰的。当与正常cho细胞中产生的相同抗体相比时,双特异性抗体优选地在fc区中包含降低量的n连接碳水化合物结构的岩藻醣基化。
[0158]
包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体可进一步包含一个或多个可结合一个或多个其他目标的额外可变结构域。其他目标优选地为蛋白质,优选地包含胞外部分的膜蛋白。如本文所用的膜蛋白为细胞膜蛋白,例如处于细胞外膜,也即将细胞与外部世界分离的膜中的蛋白质。膜蛋白具有胞外部分。若膜蛋白含有处于细胞的细胞膜中的跨膜区,则膜蛋白至少处于细胞上。
[0159]
具有超过二个可变结构域的抗体为此项技术中已知。举例而言,有可能将额外可变结构域连接至抗体的恒定部分。具有三个或更多个可变结构域的抗体优选地为如pct/nl2019/050199中所描述的多价多聚体抗体,该专利以引用的方式并入本文中。
[0160]
在一个实施方式中,抗体为包含二个可变结构域的双特异性抗体,其中一个可变结构域结合egfr的胞外部分且另一可变结构域结合lgr5的胞外部分。可变结构域优选地为如本文所描述的可变结构域。
[0161]
如本文所描述的抗体的功能性部分包含至少如本文所描述的结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域。因此,其包含如本文所描述的抗体的抗原结合部分,且通常含有抗体的可变结构域。功能性部分的可变结构域可为单链fv片段或所谓的单结构域抗体片段。单结构域抗体片段(sdab)为具有单一单体可变抗体结构域的抗体片段。与完整抗体相同,其能够选择性结合至特异性抗原。单结构域抗体片段的分子量仅为12-15kda,比由二条重蛋白链及二条轻链构成的常见抗体(150-160kda)小得多,且甚至小于fab片段(约50kda,一条轻链及半条重链)及单链可变片段(约25kda,二个可变结构域,一个来自轻链且一个来自重链)。单结构域抗体本身不比正常抗体小很多(通常为90-100kda)。单结构域抗体片段主要由骆驼中发现的重链抗体工程改造得到;这些片段称为vhh片段一些鱼也具有仅含重链的抗体(ignar,『免疫球蛋白新抗原受
体』),由这些抗体可获得称为vnar片段的单结构域抗体片段。一种替代方法将来自人类或小鼠的常见免疫球蛋白g(igg)的二聚体可变结构域分裂成单体。尽管当前针对单结构域抗体的大多数研究基于重链可变结构域,但也显示衍生自轻链的纳米抗体特异性结合至目标表位。抗体部分的此类可变结构域的非限制性实例为vhh、人类结构域抗体(dab)及单抗体(unibody)。优选地抗体部分或衍生物具有抗体的至少二个可变结构域或其等效物。此类可变结构域或其等效物的非限制性实例为f(ab)片段及单链fv片段。双特异性抗体的功能性部分包含双特异性抗体的抗原结合部分,或结合部分的衍生物和/或类似物。如上文所提及,抗体的结合部分涵盖在可变结构域中。
[0162]
也提供如本文所公开的抗体或其功能性部分、衍生物和/或类似物(也即,治疗化合物)及医药学上可接受的载体。此类医药组合物适用于治疗癌症,尤其适用于治疗胃癌、食道癌或胃-食道接合部癌。如本文所用,术语“医药学上可接受”意指由政府管理机构批准或在美国药典(u.s.pharmacopeia)或另一公认药典中列出用于动物,尤其人类,且包括生理兼容的任何及所有溶剂、盐、分散介质、包衣、抗细菌剂及抗真菌剂、等张剂及吸收延迟剂及其类似物。术语“载体”是指与化合物一起给药的稀释剂、佐剂、赋形剂或媒剂。此类医药载体可为无菌液体,例如水及油,包括石油、动物、植物或合成来源的油,例如花生油、大豆油、矿物油、芝麻油、甘油蓖麻醇酸酯及其类似物。可采用水或生理食盐水溶液以及右旋糖及甘油水溶液作为载体,尤其对于可注射溶液而言。用于非经肠给药的液体组合物可调配用于凭借注射或连续输注给药。凭借注射或输注的给药途径包括膀胱内、瘤内、静脉内、腹膜内、肌内、鞘内及皮下。视给药途径(例如静脉内、皮下、关节内及其类似者)而定,可将活性化合物包覆于保护化合物不受酸作用及可使化合物失活的其他天然条件影响的物质中。
[0163]
适合于向人类患者给药的医药组合物通常经调配用于非经肠给药,例如在液体载体中或适合于复原成用于静脉内给药的液体溶液或悬浮液。组合物可以单位剂型调配以易于给药且使剂量均一。也包括意欲在使用之前即刻转化为用于经口或非经肠给药的液体制剂的固体制剂。此类液体形式包括溶液、悬浮液及乳液。
[0164]
所公开的治疗化合物可根据适合剂量及适合途径(例如静脉内、腹膜内、肌内、鞘内或皮下)给药。举例而言,可给药单次推注,可随时间给药数个分次剂量,或可如治疗情况的紧急需要所指示而按比例减少或增加剂量。在一个实施方式中,受试者给药单次剂量的如本文所公开的抗体或其功能性部分、衍生物和/或类似物。在一些实施方式中,治疗化合物将在治疗过程中反复给药。举例而言,在某些实施例中,向需要治疗的受试者给药多次(例如2、3、4、5、6、7、8、9、10次或跟多次)剂量的治疗化合物。在一些实施方式中,治疗化合物的给药可每周、每两周或每月进行一次。
[0165]
临床医师可利用适合于所治疗的患者病状的优选地剂量。剂量可视多种因素而定,包括疾病阶段等。基于一种或多种此类因素的存在来确定应给药的特定剂量在技术人员的技术范围内。一般而言,治疗始于比化合物的最佳剂量小的较小剂量。其后,少量增加剂量,直至达至在这些情况下的最佳效果。为方便起见,必要时,可将总日剂量分次且在一天期间以数份的形式给药。也可使用间歇疗法(例如三周中的一周或四周中的三周)。
[0166]
在某些实施方式中,以0.1、0.3、1、2、3、4、5、6、7、8、9或10毫克/公斤体重的剂量给药治疗化合物。在另一实施方式中,以0.5、1、2、3、4、5、6、7、8、9或10毫克/公斤体重的剂量给药治疗化合物。
[0167]
在优选的实施方式中,以1500mg的剂量向受试者提供治疗化合物(也即,包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体或其功能性部分、衍生物和/或类似物)。固定剂量提供了优于体表或体重给药的多种优点,因为其缩短制备时间且减少潜在剂量计算错误。在一些实施方式中,以至少1100mg的剂量,优选地以1100至2000mg的间的剂量,更优选以1100至1800mg的间的剂量提供治疗化合物。如本领域技术人员所理解,剂量可随时间推移给药。举例而言,剂量可凭借iv给药,例如以1-6小时输注,优选地2-4小时输注给药。在一些实施方式中,治疗化合物每2周给药一次。在一些实施方式中,本文所公开的固定剂量适用于成人和/或体重为至少35kg的受试者。优选地,受试者罹患胃癌、食道癌或胃-食道接合部癌。
[0168]
在一些实施方式中,可使用前置用药(premedication)方案。此类方案可适用于降低输液相关的反应的似然度或严重程度。一般而言,在抗体治疗之前给药(例如经口、静脉内)类固醇,例如地塞米松(dexamethasone)和/或抗组织胺,例如右氯菲安明(dexchlorpheniramine)、苯海拉明(diphenhydramine)或氯芬尼拉明(chlorpheniramine)。
[0169]
本文所描述的治疗方法通常持续,只要监管患者护理的临床医师认为治疗方法有效,也即患者对治疗有反应即可。指示治疗方法有效的非限制性参数可包括以下中的一者或多者:肿瘤细胞减少;肿瘤细胞增殖抑制;肿瘤细胞消除;无进展存活期;适合肿瘤标记物(若适用)的适当反应。
[0170]
关于给药治疗化合物的频率,一般本领域技术人员将能够确定适当频率。举例而言,临床医师可决定相对不频繁地(例如每两周一次)给药治疗化合物,且逐渐缩短患者所耐受的剂量的间的时间段。与根据所主张的方法的疗法过程相关的例示性时间长度包括:约一周;二周;约三周;约四周;约五周;约六周;约七周;约八周;约九周;约十周;约十一周;约十二周;约十三周;约十四周;约十五周;约十六周;约十七周;约十八周;约十九周;约二十周;约二十一周;约二十二周;约二十三周;约二十四周;约七个月;约八个月;约九个月;约十个月;约十一个月;约十二个月;约十三个月;约十四个月;约十五个月;约十六个月;约十七个月;约十八个月;约十九个月;约二十个月;约二十一个月;约二十二个月;约二十三个月;约二十四个月;约三十个月;约三年;约四年;约五年;永久(例如持续存在的维持疗法)。前述持续时间可能与一轮或多轮/周期的治疗相关。
[0171]
可使用任何适合手段评定本文所提供的治疗方法的功效。在一个实施例中,使用癌细胞数目减少作为客观反应标准来分析治疗的临床功效。根据本文所公开的方法治疗的患者(例如人类)优选地经历至少一种癌症病征的改善。在一些实施方式中,可出现以下中的一者或多者:癌细胞的数目可减少;癌症复发经预防或延迟;一种或多种与癌症相关的症状可在一定程度上得到缓解。另外,活体外分析以确定t细胞介导的目标细胞溶解。在一些实施方式中,肿瘤评定基于ct扫描和/或mri扫描,参见例如recist 1.1指南(实体肿瘤反应评估准则(response evaluation criteria in solid tumours))(eisenhauer等人,2009eur j cancer 45∶228-247)。此类评定一般在治疗后每4-8周进行。
[0172]
在一些实施方式中,在如本文所描述的治疗后肿瘤细胞不再可检测。在一些实施方式中,受试者处于部分或完全缓解。在某些实施例中,受试者的总存活期、中值存活率和/或无进展存活期增加。
[0173]
治疗化合物(也即,包含结合egfr的胞外部分的可变结构域及结合lgr5的胞外部分的可变结构域的抗体或其功能性部分、衍生物和/或类似物)也可与因针对所治疗的癌症的特定有用性而选择的其他熟知疗法(例如化学疗法或放射疗法)一起使用。
[0174]
安全且有效给药化学治疗剂的方法为本领域技术人员所知。另外,其给药描述于标准文献中。举例而言,许多化学治疗剂的给药描述于physicians
′
desk reference(pdr),例如1996版(medical economics company,montvale,n.j.07645-1742,usa)中;其公开以引用的方式并入本文中。
[0175]
本领域技术人员将显而易见,(多种)化学治疗剂和/或放射疗法的给药可视所治疗的疾病及(多种)化学治疗剂和/或放射疗法对该疾病的已知作用而变化。此外,根据熟练临床医师的知识,治疗方案(例如剂量及给药时间)可鉴于观测到的所投治疗剂对患者的作用且鉴于观测到的疾病对所投治疗剂的反应而变化。
[0176]
本文所公开的化合物及组合物适用作疗法且适用于治疗性治疗,且因此可适用作药物且用于制备药物的方法。
[0177]
本文所描述的所有文件及参考文献,包括genbank条目、专利及公开专利申请案及网站各自明确地以引用的方式并入本文中,其程度就如同完整或部分地编写在本文件中一般。
[0178]
出于清楚且简洁描述的目的,特征在本文中描述为相同或独立实施方式的一部分,然而,应了解,本发明的范畴可包括具有所描述特征中的全部或一些的组合的实施方式。
[0179]
本发明现参考以下实施例描述,这些实施例仅为说明性的,且不意欲限制本发明。虽然已参考本发明的特定实施例详细描述本发明,但对本领域技术人员而言将显而易见,可在不偏离本发明的精神及范畴的情况下对本发明作出各种改变及修改。
[0180]
实施例
[0181]
如本文所用,其中x独立地为数字0-9的「mfxxxx」是指包含可变结构域的fab,其中vh具有由图3中所描绘的4位阿拉伯数字鉴别的氨基酸序列。除非另外指示,否则可变结构域的轻链可变区通常具有图4b的序列。实施例中的轻链具有如图4a中所描绘的序列。“mfxxxx vh”是指由4位阿拉伯数字鉴别的vh的氨基酸序列。mf进一步包含轻链的恒定区及通常与轻链的恒定区相互作用的重链的恒定区。重链的vh/可变区不同,且通常ch3区也不同,其中重链中的一者的ch3结构域具有kk突变且另一者的ch3结构域具有互补de突变(参见pct/nl2013/050294(公开为wo2013/157954)及图5d及5e供参考。实施例中的双特异性抗体具有如图5中所指示的具有kk/de ch3异二聚化结构域的fc尾、ch2结构域及ch1结构域,如图4a中所指示的共同轻链及如mf数字所指定的vh。举例而言,由mf3755
×
mf5816指示的双特异性抗体具有以上通用序列,及具有具mf3755的序列的vh的可变结构域及具有具mf5816的序列的vh的可变结构域。
[0182]
各种重链可变区(vh)的氨基酸及核酸序列在图3中指示。双特异性抗体egfr/lgr5,mf3755
×
mf5816;包含重链可变区mf3755及mf5816及共同轻链,且包括由非岩藻醣修饰的增强adcc的修饰,以及如图3中所描绘的其他lgr5及egfr组合已在wo2017/069628中显示为有效。
[0183]
双特异性抗体的产生
[0184]
使用专用ch3工程改造技术以确保有效异二聚化及双特异性抗体形成,凭借用二个编码具有不同vh结构域的igg的质体短暂共转染来产生双特异性抗体。也将共同轻链在同一质体或另一质体上共转染于同一细胞中。在吾人的申请案(例如wo2013/157954及wo2013/157953,以引用的方式并入本文中)中,吾人已公开用于自单个细胞产生双特异性抗体的方法及手段,其中提供使双特异性抗体形成优先于单特异性抗体形成的手段。这些方法也可有利地用于本发明中。具体而言,基本上仅产生双特异性全长igg分子的优选突变为在第一ch3结构域中位置351及366处的氨基酸取代,例如l351k及t366k(根据eu编号进行编号)(“kk变体”重链),及在第二ch3结构域中位置351及368处的氨基酸取代,例如l351d及l368e(“de变体”重链),或反之亦然(参见图5d及5e)。先前在所提及的申请案中证明带负电的de变体重链及带正电的kk变体重链优先配对形成异二聚体(所谓的“dekk”双特异性分子)。de变体重链的同二聚化(de-de同二聚体)或kk变体重链的同二聚化(kk-kk同二聚体)由于在一致重链的间ch3-ch3界面中带电残基的间的强斥力而几乎不会发生。
[0185]
将上文所描述的结合lgr5的可变结构域的vh基因克隆至编码带正电的ch3结构域的载体中。将结合egfr的可变结构域的vh基因,例如wo2015/130172(以引用的方式并入本文中)中所公开的彼等克隆至编码带负电的ch3结构域的载体中。在摇动器平台上在t125烧瓶中培育悬浮生长调适的293f freestyle细胞,直至密度为3.0
×
10e6个细胞/毫升。将细胞以0.3-0.5
×
10e6个活细胞/毫升的密度接种在24深孔盘的各孔中。将细胞用二种编码不同抗体、克隆于专用载体系统中的质体的混合物短暂转染。转染后七天,收集细胞上清液且经由0.22μm过滤器(sartorius)过滤。将无菌上清液储存在4℃下,直至进行抗体纯化。
[0186]
igg纯化及定量
[0187]
在无菌条件下在过滤盘中使用蛋白a亲和层析进行纯化。首先,将培养基的ph调节至ph 8.0,且随后将含igg上清液与蛋白a琼脂糖凝胶cl-4b珠粒(50%v/v)(pierce)一起在摇动平台上在600rpm下在25℃下培育2小时。接下来,凭借过滤收集珠粒。用pbs ph 7.4洗涤珠粒二次。随后,在ph 3.0下用0.1m柠檬酸盐缓冲液溶析经结合igg,且紧接着使用tris ph 8.0中和溶析液。凭借使用multiscreen ultracel 10多盘(millipore)离心来进行缓冲液交换。最后,在pbs ph 7.4中收集样品。使用octet量测igg浓度。将蛋白质样品储存在4℃下。
[0188]
为确定纯化igg的量,使用蛋白a生物传感器(forte-bio,根据供货商建议),使用全人类igg(sigma aldrich,目录号i4506)作为标准品借助于octet分析确定抗体浓度。
[0189]
以下双特异性抗体适用于此实施例且适用于本发明的方法:mf3370
×
mf5790、mf3370
×
5803、mf3370
×
5805、mf3370
×
5808、mf3370
×
5809、mf3370
×
5814、mf3370
×
5816、mf3370
×
5817、mf3370
×
5818、mf3755
×
mf5790、mf3755
×
5803、mf3755
×
5805、mf3755
×
5808、mf3755
×
5809、mf3755
×
5814、mf3755
×
5816、mf3755
×
5817、mf3755
×
5818、mf4280
×
mf5790、mf4280
×
5803、mf4280
×
5805、mf4280
×
5808、mf4280
×
5809、mf4280
×
5814、mf4280
×
5816、mf4280
×
5817、mf4280
×
5818、mf4289
×
mf5790、mf4289
×
5803、mf4289
×
5805、mf4289
×
5808、mf4289
×
5809、mf4289
×
5814、mf4289
×
5816、mf4289
×
5817及mf4289
×
5818。各双特异性抗体包含二个分别能够结合egfr及lgr5的由mf编号指定的vh,进一步包含具有分别如由seq id no:136(图5d)及seq id no:138(图5e)指示的kk/de ch3异二聚化结构域的fc尾,如由seq id no:134(图5c)指示的ch2结构域以及如由
seq id no:131(图5a)指示的ch1结构域,如由seq id no:121(图4)指示的共同轻链。
[0190]
实施例1:抗egfr
×
抗lgr5候选物针对各种癌症的评估:
[0191]
小鼠模型选择
[0192]
crown biosciences inc.已开发一系列衍生自以手术方式切除的人类原发性肿瘤的患者源异种移植物(pdx)模型(crown bioscience数据库,http://hubase.crownbio.com)。pdx模型经临床及分子标注且如实代表各别肿瘤的临床流行病学。这些模型可皮下注射于免疫缺乏小鼠的侧腹中。测试不同癌症模型的egfr及lgr5表达,如凭借rna定序(rnaseq)进行分析(参见表1)。选择发现展现高egfr及lgr5表达水平的一组食道癌及胃癌pdx模型,以测试mf3755
×
mf5816双特异性抗体的功效。对于食道癌,选择4种pdx模型,且对于胃癌,选择8种pdx模型。pdx模型的详细信息,包括癌症次型、已知驱动突变、egfr/lgr5表达及达至随机化的时间描述于(表1)中。
[0193]
表1
[0194]
源自食道癌及胃癌患者的pdx模型的特征。
[0195]
凭借rna定序(rnaseq)确定lgr5及egfr表达。凭借基因体分析确定致癌驱动子的突变状态。也提及达至随机化(平均肿瘤达到大致100-150mm3时)的时间,以及肿瘤的生长特征。escc=食道鳞状细胞癌;eac=食道腺癌;adc=腺癌;n/a=不可用或不适用。
[0196][0197]
[0198]
方法
[0199]
自带有已建立的原发性人类肿瘤的小鼠收集用于接种的新鲜肿瘤组织。视模型而定,将肿瘤碎片(直径2-3mm)皮下接种于6-8周龄雌性balb/c裸鼠或nod/scid小鼠的右上背侧。当肿瘤达到100-150mm3大小时,将小鼠随机分组。每个模型登记总共6只小鼠,3只对照小鼠及3只经mf3755
×
mf5816双特异性抗体治疗的小鼠。持续6周,小鼠以200μl注射体积腹膜内接受0.5mg双特异性抗体/周(大约25mg/kg/周),不管其体重如何。对照小鼠接受pbs(200μl)。在6周治疗期之后,再监测肿瘤生长3周。若小鼠达到人道终点,则将其早于63天处死。
[0200]
结果:
[0201]
在所测试的8种胃pdx模型中,mf3755
×
mf5816双特异性抗体治疗显著减少6种模型中的肿瘤生长(图6a)。在这些8种模型中,3种模型(ga0429、ga6833及ga6891)在观测期结束时显示比治疗开始时更低的肿瘤体积,表明双特异性抗体在胃癌中的强肿瘤抑制作用。模型ga2434给出某些反应。关于食道pdx模型,所有四种测试模型对双特异性抗体治疗起反应,模型es2356反应最强(图6b)。在模型es11065的情况下获得利用此实施例的mf3755
×
mf5816双特异性抗体得到的显示统计显著(p《0.0001)治疗功效的结果。
[0202]
实施例2:针对患有eac、gac及gejac的患者的抗egfr
×
抗lgr5抗体的剂量扩增及功效:
[0203]
晚期实体肿瘤中的1期剂量递增研究
[0204]
研究设计
[0205]
进行1期开放标记多中心研究,其具有初始剂量递增部分以确定抗egfr
×
抗lgr5双特异性抗体针对mcrc患者中的实体肿瘤的建议2期剂量(rp2d),起始剂量为5mg固定剂量。一旦建立rp2d,则在研究的扩增部分中,包括在诊断患有eac、gac及gejac的患者中进一步评估抗体。在所有患者中对抗体的安全性、pk、免疫原性及初步抗肿瘤活性进行表征,且进行生物标记物分析,包括egfr及lgr5状态。
[0206]
剂量递增
[0207]
在剂量递增部分中,治疗患有转移性大肠直肠癌(mcrc)腺癌的患者,这些患者先前在转移性背景下用标准经批准疗法治疗,该疗法包括奥沙利铂(oxaliplatin)、伊立替康及氟嘧啶(5-fu和/或卡培他滨(capecitabine)),伴随或不伴随抗血管新生剂及针对kras及nras野生型raswt的抗egfr。
[0208]
基于来自初步及glp食蟹猕猴毒理学研究的可用双特异性抗体血清浓度数据,产生pk模型。在异速增长模型推算(allometric scaling)之后,使用此模型来预测人类中的抗体暴露。抗体起始剂量为每2周5mg(固定剂量)iv,具有4周周期。将研究高达11种剂量水平:5、20、50、90、150、225、335、500、750、1100及1500mg(固定剂量)。各患者及各组的给药物量、剂量增量及给药频率基于患者安全性、pk及pd数据经受变化,然而,剂量将不会超过每周期4500mg。
[0209]
剂量限制性毒性(dlt)
[0210]
在第一周期(28天)期间发生且被研究者视为与抗体治疗相关的以下临床毒性和/或实验室异常中的任一者将视为dlt:
[0211]
·
血液学毒性:
[0212]-4级嗜中性白血球减少症(绝对嗜中性白血球计数[anc]《0.5
×
109个细胞/公升),持续≥7天
[0213]-3-4级发热性嗜中性白血球减少症
[0214]-4级血小板减少症
[0215]-与出血发作相关的3级血小板减少症
[0216]-其他4级血液学毒性
[0217]
·
3-4级非血液学ae及实验室毒性,以下除外:
[0218]-3-4级输注相关反应
[0219]-在最佳治疗的情况下在2周内恢复至≤2级的3级皮肤毒性
[0220]-在最佳治疗的情况下在3天内恢复至≤1级或基线的3级腹泻、恶心和/或呕吐
[0221]-在最佳治疗的情况下在48小时内消退的3级电解质异常
[0222]-持续≤48小时的3-4级肝脏异常
[0223]
·
符合海氏法则(hy
′
s law)定义的任何肝功能异常。
[0224]
·
阻止接下来二次给药的持续≥15天的任何药物相关毒性。
[0225]
剂量扩增
[0226]
在扩增部分中,将在患有eac、gac或gejac的患者中与rp2d给药双特异性抗体。一旦已确定rp2d,则将用此剂量及排程治疗额外患者,以进一步表征抗体的安全性、耐受性、pk及免疫原性,且进行抗肿瘤活性及生物标记物评估的初步评定。所治疗的恶性疾病将已知共表达二种目标(即lgr5及egfr),且可具有对egfr抑制的敏感性的先前迹象。
[0227]
将探索患有eac、gac或gejac的患者中的抗体治疗,例如各适应症10至20名患者,以初步抗肿瘤活性的征象为条件,可能扩增至40名患者)。在研究的扩增部分期间,将由安全监测委员会(safety monitoring committee)持续评估rp2d的安全性。若对于任何组,dlt发生率超过预定义临限值33%,则将暂停此组的登记且将由smc进行对安全性、pk及生物标记物的全面审查,以便判定在该组中继续累积是否安全。届时也将询问药物的整体安全性。
[0228]
研究性疗法及方案
[0229]
抗egfr
×
抗lgr5双特异性抗体调配为用于iv输注的透明溶液。使用标准输注程序每2周进行iv输注,起始剂量为5mg(固定剂量),且建议2期剂量为1500mg(固定剂量)。一旦达到rp2d,则中止剂量递增。在第1周期期间,必须历时最小4小时给药输注。在研究者判断下且在不存在irr的情况下,第1周期之后之后续输注可缩短至2小时。
[0230]
周期视为4周。对于各患者,在初始抗体输注的输注开始之后实施6小时观测期,第二输注实施4小时观测期,且所有后续给药最小2小时观测期,对应于至少输注持续时间。每2周以2至4小时iv输注给药抗体,周期为4周。后续周期的第1天在第29天,或在自与前一周期相关的任何不良效应恢复之后。
[0231]
治疗持续时间
[0232]
给药研究治疗直至确认进行性疾病(按照recist 1.1)、不可接受的毒性、撤回同意、患者不顺应、研究者决定(例如临床恶化)或抗体中断》连续6周。在最后一次抗体输注之后,针对安全性随访患者至少30天且直至所有相关毒性恢复或稳定为止,且针对疾病进展及存活状态随访患者12个月。
[0233]
功效评定
[0234]
在治疗开始后每8周,肿瘤评定基于ct/mri根据recist 1.1对比(eisenhauer等人,2009eur j cancer 45:228-247)。客观反应必须在首次观测之后至少4周确认。如临床指示对基线时患有骨转移或研究中具有疑似病变的患者进行骨扫描。在筛选时及各周期的第1天评估循环血液肿瘤标记物,包括癌胚抗原(cea)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1