治疗多发性骨髓瘤的方法与流程
治疗多发性骨髓瘤的方法
1.要求优先权
2.本技术要求2020年3月26日提交的美国临时申请系列号63/000,229的优先权。前述申请的全部内容通过引用纳入本文。
背景技术:
3.多发性骨髓瘤(mm)是一种在骨髓、外周血或其他髓外部位克隆性增殖的浆细胞的肿瘤性疾病。恶性浆细胞对骨髓微环境和邻近的骨骼产生直接的病理作用,导致贫血、溶骨性骨病变和高钙血症。在大多数情况下,恶性浆细胞也产生被称为m蛋白的异常单克隆免疫球蛋白,但在少数对象中,骨髓瘤细胞只产生单克隆游离轻链(flc)。m蛋白或flc的异常水平可导致疾病的临床表现,包括肾衰竭和对感染的易感性增加(kumar等,nat.rev.dis.primers 3:17046,2017;palumbo等,n.engl.j.med.364(11):1046-1060,2011;rollig等,lancet 385(9983):2197-2208,2015)。
4.mm的标准治疗方法包括含有蛋白酶体抑制剂(pi)的联合化疗方案,如硼替佐米和卡非佐米,以及伊沙佐米(ixazomib),和/或免疫调节药物(imid),如来那度胺和泊马度胺。烷基化剂如美法仑和环磷酰胺对mm也很有效。没有严重合并症并被认为符合条件的患者,通常接受清髓化疗和/或放疗,然后进行自体干细胞移植(asct)(rollig等,lancet.385(9983):2197-208,2015;和rajkumar等,mayo clin proc.91(1):101-19,2016)。最近,靶向cd38抗原的单克隆抗体达雷木单抗已被批准用于治疗rrmm,作为四线治疗的单药疗法。
5.迄今为止,多发性骨髓瘤仍然是不治之症,采用连续的治疗方法管理,通常在每次复发时产生更短的疾病控制期(kumar等,mayo clin.proc.79(7):867-874,2004)。
技术实现要素:
6.在一方面,本技术部分基于发现方法,这些方法导致,例如以下一项或多项:治疗期望的对象血清中抗bcma抗体的稳态浓度,治疗期望的对象血清中游离轻链的稳态水平降低,以及治疗期望的对象中bcma饱和度。
7.在另一方面,本技术基于证据,其证明将某些bcma治疗剂,如bcma抗体,包括非岩藻糖基化抗体,与其他各种治疗剂组合起来治疗癌症(如mm)的效力。被发现与这种bcma剂(如非岩藻糖基化抗体)成功组合的治疗剂包括地塞米松、免疫调节剂(imid)(如泊马度胺)、cd38抗体(如达雷木单抗)和/或γ分泌酶抑制剂(gsi),包括这些治疗剂的所有各种组合。
8.在另一方面,本技术部分基于对各种bcma抗体给药方案的鉴定,包括标准和强化给药方案(定义详见下文),这些方案被证明在单药治疗以及组合治疗中具有治疗效果,包括与地塞米松、imid(如泊马度胺)、cd38抗体(如达雷木单抗)和/或gsi的组合。考虑到能够给予如本文所述的bcma抗体的相对高水平,同时仍然保持可管理的安全状况,包括甚至当作为组合疗法的部分给予bcma抗体时,这些结果是出人意料的。
9.因此,本文提供了一种治疗患有多发性骨髓瘤(mm)的对象的方法,所述方法包括
给予对象一个或多个剂量的特异性结合b细胞成熟抗原(bcma)的抗体或其抗原结合片段,并且其中所述一个或多个剂量以约100mg抗体或抗原结合片段至约2,000mg抗体或抗原结合片段的量独立地给予对象。
10.在本文所述的任何方法的一些实施方式中,该抗体或其抗原结合片段是非岩藻糖基化抗体或抗原结合片段。
11.在一些实施方式中,给予对象包含抗体或其抗原结合片段的组合物。在一些实施方式中,组合物中约或至少95%、97%、98%或99%的抗体或其抗原结合片段是非岩藻糖基化的。
12.在本文所述任何方法的一些实施方式中,抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3。
13.在本文所述任何方法的一些实施方式中,其中所述抗体或其抗原结合片段包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含与seq id no:4有至少80%同一性的氨基酸序列,和所述轻链可变结构域包含与seq id no:8有至少80%同一性的氨基酸序列。
14.在本文所述任何方法的一些实施方式中,其中所述抗体或其抗原结合片段包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含与seq id no:4有至少90%同一性的氨基酸序列,和所述轻链可变结构域包含与seq id no:8有至少90%同一性的氨基酸序列。
15.在本文描述的任何方法的一些实施方式中,抗体或其抗原结合片段包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含氨基酸序列seq id no:4,和所述轻链可变结构域包含氨基酸序列seq id no:8。
16.在本文所述任何方法的一些实施方式中,抗体或抗原结合片段是人源化的。
17.在本文所述任何方法的一些实施方式中,抗体是igg1抗体。在一些实施方式中,抗体或抗原结合片段不是双特异性抗体、双特异性t细胞衔接子(bite)、嵌合抗原受体(car)或抗体药物偶联物(adc)或其部分。
18.在本文所述任何方法的一些实施方式中,一剂或多剂以约800mg的抗体或抗原结合片段至约2,000mg的抗体或抗原结合片段独立地给予对象。
19.在本文所述任何方法的一些实施方式中,一剂或多剂以约1,200mg的抗体或抗原结合片段至约2,000mg的抗体或抗原结合片段独立地给予对象。
20.在本文所述任何方法的一些实施方式中,一剂或多剂以约1,400mg的抗体或抗原结合片段至约1,800mg的抗体或抗原结合片段独立地给予对象。
21.在本文所述任何方法的一些实施方式中,其中所述一剂或多剂以约400mg的抗体或抗原结合片段独立地给予对象。
22.在本文所述任何方法的一些实施方式中,其中所述一剂或多剂以约800mg的抗体或抗原结合片段独立地给予对象。
23.在本文所述任何方法的一些实施方式中,其中所述一剂或多剂以约1,600mg的抗体或抗原结合片段给予对象。
24.在本文所述任何方法的一些实施方式中,给予对象所述两剂或更多剂抗体或抗原结合片段。
25.在本文所述任何方法的一些实施方式中,两剂或更多剂以约一周一次至约每四周一次的频率给予对象。
26.在本文所述任何方法的一些实施方式中,两剂或更多剂以约一周一次的频率给予对象。
27.在本文所述任何方法的一些实施方式中,两剂或更多剂以约两周一次的频率给予对象。
28.在本文所述任何方法的一些实施方式中,两剂或更多剂以约三周一次的频率给予对象。
29.在本文所述任何方法的一些实施方式中,两剂或更多剂以约四周一次的频率给予对象。
30.在本文所述任何方法的一些实施方式中,每剂包含约800mg抗体或抗原结合片段,每两周给予对象。
31.在本文所述任何方法的一些实施方式中,每剂包含约1,600mg抗体或抗原结合片段,每两周给予对象。
32.在本文所述任何方法的一些实施方式中,在28天周期的第1天和第15天给予对象所述单独剂量的抗体或抗原结合片段。
33.在本文所述任何方法的一些实施方式中,给予对象所述剂量的抗体或抗原结合片段,持续多个28天周期。
34.在本文所述任何方法的一些实施方式中,一个或多个剂量包括在诱导期期间给予对象的一个或多个诱导剂量,以及在给予一个或多个诱导剂量之后,在维持期期间给予对象的一个或多个维持剂量。
35.在本文所述任何方法的一些实施方式中,诱导剂量之一以约一周一次给予对象,持续约1-10周。
36.在本文所述任何方法的一些实施方式中,诱导剂量之一每周一次给予对象,持续8周。
37.在本文所述任何方法的一些实施方式中,诱导剂量之一在28天周期内给予4次。
38.在本文所述任何方法的一些实施方式中,诱导剂量之一在两个28天周期内给予8次。
39.在本文所述任何方法的一些实施方式中,在两个28天周期各自的第1天、第8天、第15天和第22天独立地给予所述诱导剂量之一。
40.在本文所述任何方法的一些实施方式中,各诱导剂量包括约100、200、400、800或1,600mg的抗体或抗原结合片段。
41.在本文所述任何方法的一些实施方式中,各诱导剂量包括约800mg的抗体或抗原结合片段。
42.在本文所述任何方法的一些实施方式中,各诱导剂量包括约1,600mg的抗体或抗原结合片段。
43.在本文所述任何方法的一些实施方式中,在所述诱导期完成后每1-4周一次给予
所述一个或多个维持剂量。
44.在本文所述任何方法的一些实施方式中,维持剂量之一每两周给予一次。
45.在本文所述任何方法的一些实施方式中,维持剂量之一在28天周期内的第1天和第15天给予。
46.在本文所述任何方法的一些实施方式中,各维持剂量包括约100、200、400、800或1,600mg的抗体或抗原结合片段。
47.在本文所述任何方法的一些实施方式中,各维持剂量包括约800mg的抗体或抗原结合片段。
48.在本文所述任何方法的一些实施方式中,各维持剂量包括约1,600mg的抗体或抗原结合片段。
49.在本文所述任何方法的一些实施方式中,其中在所述诱导期期间以q1wk给予所述抗体或抗原结合片段,总计8个诱导期剂量,在所述维持期期间以q2wk给予。
50.在本文所述任何方法的一些实施方式中,每个诱导剂量包括约100、200、400或1600mg抗体或抗原结合片段;每个维持剂量包括约100、200、400或1600mg抗体或抗原结合片段;在两个28天周期各自的第1天、第8天、第15天和第22天各给予诱导剂量之一,在诱导期给予总计8个诱导剂量;和在一个或多个后续周期各自的第1天和第15天各给予维持剂量之一。
51.在本文所述任何方法的一些实施方式中,各诱导剂量和各维持剂量包括约800或1,600mg的抗体或抗原结合片段。
52.在本文所述任何方法的一些实施方式中,各诱导剂量和各维持剂量包括约1,600mg的抗体或抗原结合片段。
53.在本文所述任何方法的一些实施方式中,该方法还包括给予对象一个或多个剂量的地塞米松。
54.在本文所述任何方法的一些实施方式中,一个或多个剂量的地塞米松以一周一次的频率独立地给予对象。
55.在本文所述任何方法的一些实施方式中,以约每1-4周一次的频率给予所述抗体或抗原结合片段的所述剂量之一,以约每1-4周一次的频率给予所述地塞米松的剂量。
56.在本文所述任何方法的一些实施方式中,每两周一次给予所述抗体或抗原结合片段的所述剂量之一,和每两周一次给予所述地塞米松的剂量之一。
57.在本文所述任何方法的一些实施方式中,每两周一次给予所述抗体或抗原结合片段的所述剂量之一,和每周一次给予所述地塞米松的剂量之一。
58.在本文所述任何方法的一些实施方式中,其中在28天周期的第1天和第15天各给予所述抗体或抗原结合片段的剂量之一,在同一28天周期的第1天、第8天、第15天和第22天各给予所述地塞米松的剂量之一。
59.在本文所述任何方法的一些实施方式中,在诱导期期间每周一次给予所述抗体或抗原结合片段的剂量之一,所述诱导期之后的后续剂量在维持期期间每两周给予一次;和每周一次给予地塞米松的剂量之一。
60.在本文所述任何方法的一些实施方式中,在诱导期期间每周一次给予所述抗体或抗原结合片段的剂量之一,持续8周,后续剂量在维持期期间每两周给予一次;和每周一次
给予地塞米松的剂量之一。
61.在本文所述任何方法的一些实施方式中,其中在两个28天周期各自的第1天、第8天、第15天和第22天各给予所述抗体或抗原结合片段的剂量之一,然后在后续28天周期的第1天和第15天各自给予;在28天周期的各自的第1天、第8天、第15天和第22天各给予所述地塞米松的剂量之一。
62.在本文所述任何方法的一些实施方式中,当在同一天给予所述抗体或抗原结合片段时,则在给予所述抗体或抗原结合片段之前的约1-3小时给予地塞米松。
63.在本文所述任何方法的一些实施方式中,以约800mg剂量给予每剂抗体或抗原结合片段。
64.在本文所述任何方法的一些实施方式中,以约1,600mg剂量给予每剂抗体或抗原结合片段。
65.在本文所述任何方法的一些实施方式中,以约20至约60mg剂量给予每剂地塞米松。
66.在本文所述任何方法的一些实施方式中,以约40mg剂量或约20mg剂量给予每剂地塞米松。
67.在本文所述任何方法的一些实施方式中,以约1,600mg剂量给予每剂抗体或抗原结合片段,且其中以约40mg剂量给予每剂地塞米松。
68.在一些实施方式中,方法还包括给予对象一剂或多剂抗-cd38抗体或其抗原结合片段。在一些实施方式中,抗-cd38抗体是达雷木单抗。
69.在一些实施方式中,一剂或多剂所述抗-cd38抗体或其抗原结合片段以约5mg/kg(毫克每千克体重)至约30mg/kg独立地给予对象在一些实施方式中,其中所述一剂或多剂抗-cd38抗体或其抗原结合片段以约10mg/kg至约20mg/kg独立地给予对象。在一些实施方式中,所述一剂或多剂抗-cd38抗体或其抗原结合片段以约16mg/kg独立地给予对象。
70.在一些实施方式中,给予对象两剂或更多剂抗-cd38抗体或其抗原结合片段。在一些实施方式中,所述两剂或更多剂抗-cd38抗体或其抗原结合片段以约每周一次至约每四周一次的频率给予对象。在一些实施方式中,两剂或更多剂抗-cd38抗体或其抗原结合片段以约每周一次的频率给予对象。在一些实施方式中,所述两剂或更多剂抗-cd38抗体或其抗原结合片段以约每两周一次或每三周一次的频率给予对象。在一些实施方式中,两剂或更多剂抗-cd38抗体或其抗原结合片段以约每四周一次的频率给予对象。在一些实施方式中,在28天周期的第1天、第8天、第15天和第22天给予对象所述抗-cd38抗体或其抗原结合片段。
71.在一些实施方式中,在第一阶段期间以约每周一次的频率给予对象两剂或更多剂所述抗-cd38抗体或其抗原结合片段;在第二阶段期间以约每两周一次至约每三周一次的频率给予对象两剂或更多剂所述抗-cd38抗体或其抗原结合片段;在第三阶段期间以约每四周一次的频率给予对象两剂或更多剂所述抗-cd38抗体或其抗原结合片段。
72.在一些实施方式中,第一阶段为约6周至约10周。在一些实施方式中,第一阶段为约8周或约9周。在一些实施方式中,第二阶段为约10周至约20周。
73.在一些实施方式中,在第二阶段期间,8剂抗-cd38抗体或其抗原结合片段以约每两周一次的频率给予对象。在一些实施方式中,在第二阶段期间,5剂抗-cd38抗体或其抗原
结合片段以约每三周一次的频率给予对象。
74.在一些实施方式中,在第三阶段期间,直到疾病进展,多剂抗-cd38抗体或其抗原结合片段以约每四周一次的频率给予对象。
75.在一些实施方式中,该方法还包括给予一剂或多剂免疫调节药物。在一些实施方式中,免疫调节药物是免疫调节酰亚胺药物(imid)。在一些实施方案中,免疫调节药物是来那度胺或泊马度胺。
76.在一些实施方案中,免疫调节药物是泊马度胺。
77.在一些实施方式中,一剂或多剂免疫调节药物以约每天一次至约每周一次的频率独立地给予对象。在一些实施方式中,一剂或多剂免疫调节药物每天一次独立地给予对象。在一些实施方式中,一剂或多剂免疫调节药物在重复的28天周期的第1-21天每天一次独立地给予对象。
78.在一些实施方式中,每剂免疫调节药物为约1mg至约10mg。在一些实施方式中,每剂免疫调节药物为约2mg至约4mg。在一些实施方式中,每剂免疫调节药物为约4mg。
79.在一些实施方式中,当所述免疫调节药物剂量和特异性结合至bcma的抗体或抗原结合片段剂量在同一天给予,在特异性结合至bcma的抗体或抗原结合片段之前约1至约3小时给予所述免疫调节药物剂量。
80.在一些实施方式中,其中在28天周期的第1天和第15天给予对象特异性结合至bcma的抗体或抗原结合片段,在28天周期的第1、8、15和22天给予对象地塞米松,和在28天周期的第1-21天给予对象泊马度胺。
81.在一些实施方式中,在两个28周期的第1、8、15和22天各给予特异性结合至bcma的抗体或抗原结合片段的诱导剂量之一,在诱导期总计8个诱导剂量;在维持期中一个或多个后续28天的各自的第1天和第15天各给予特异性结合至bcma的抗体或抗原结合片段的维持剂量之一;
82.在一些实施方式中,在所述诱导期和维持期各自的28天周期的第1、8、15和22天各给予对象地塞米松。在一些实施方式中,在所述诱导期和维持期各自的28天周期的第1-21天各给予对象泊马度胺。
83.在一些实施方式中,当在同一天给予地塞米松的剂量和抗体或抗原结合片段的剂量,或在同一天给予泊马度胺的剂量和抗体或抗原结合片段的剂量时,在抗体或抗原结合片段的剂量之前约1至约3小时给予所述地塞米松的剂量或泊马度胺的剂量。
84.在一些实施方式中,方法还包括给予对象一剂或多剂γ分泌酶抑制剂。在一些实施方式中,γ-分泌酶抑制剂为semagacestat(ly450139)、ro4929097、mk-0752、avagacestat(bms-708163)、bms-986115、nirogacestat(pf-03084014)、crenigacestat(ly3039478)、bms-906024、dapt(gsi-ix)、二苯并氮杂(yo-01027)、ly411575、l-685458、ngp 555、mdl-28170或itanapraced(chf 5074)。一些γ分泌酶抑制剂描述于,例如,wo2019094626a1、us 9914774、u.s.6756511、us 6890956、us 6984626、us 7049296、us 7101895、us 7138400、us 7144910、us 7183303、us8377886、wo 2002/40451a2、us7468365b2、us20160354382、us2020179511a1、us2019367628a1、us2020085839a1、us10590087、us2020171020a1、us662510a、us4434171a、us2019367628a1、us2019367628a1、us 7244739、us2020087623a1、us10307388b2和ncbi网站的pubchem;其各自通过引用全文
纳入本文。
85.在本文所述任何方法的一些实施方式中,通过全身给药给予每剂抗体或抗原结合片段。
86.在本文所述任何方法的一些实施方式中,通过静脉内给予全身给药。
87.在本文所述任何方法的一些实施方式中,所述抗体或抗原结合片段的至少初始剂量是使用分步输注给予对象。
88.在本文所述任何方法的一些实施方式中,使用约50mg/小时至约400mg/小时的输注率进行所述分步输注。
89.在本文所述任何方法的一些实施方式中,在分步的输注期间,所述输注率每30分钟增加。
90.在本文所述任何方法的一些实施方式中,在分步的输注期间,所述输注率每30分钟增加不超过两倍。
91.在本文所述任何方法的一些实施方式中,所述对象是人对象。
92.在本文所述任何方法的一些实施方式中,所述对象先前经诊断为患有多发性骨髓瘤。
93.在本文所述任何方法的一些实施方式中,所述对象先前经诊断为患有复发性或难治性多发性骨髓瘤。
94.在本文所述任何方法的一些实施方式中,之前给予所述对象针对多发性骨髓瘤的一种或多种治疗剂或治疗。
95.在本文所述任何方法的一些实施方式中,之前给予针对多发性骨髓瘤的一种或多种治疗剂或治疗是不成功的。
96.在本文所述任何方法的一些实施方式中,在之前已经给予所述对象以下中至少一项:蛋白酶体抑制剂、免疫调节剂和抗-cd38抗体,或对上述不能耐受。
97.在本文所述任何方法的一些实施方式中,在之前已经给予所述对象治疗剂,其包括所有以下三项:蛋白酶体抑制剂、免疫调节剂和抗-cd38抗体,或对上述不能耐受。
98.在本文所述任何方法的一些实施方式中,在之前已经给予所述对象至少3项先前抗骨髓瘤治疗线,并且所述对象对以下各类别的至少一种治疗剂表现出难治性:蛋白酶体抑制剂、免疫调节剂和抗-cd38抗体。
99.在本文所述任何方法的一些实施方式中,所述对象在初始治疗之前满足以下标准的1、2或全部3项:血清单克隆副蛋白(m-蛋白)水平≥约0.5g/dl、尿液m-蛋白水平≥约200mg/24hr以及血清免疫球蛋白游离轻链≥约10mg/dl和血清免疫球蛋白κλ游离轻链比率异常。
100.在本文所述任何方法的一些实施方式中,该方法导致所述抗体或其抗原结合片段在对象血清中的稳态浓度为约1μg/ml至约200μg/ml。
101.在本文所述任何方法的一些实施方式中,该方法导致对象的血清中游离轻链(flc)的稳态浓度小于约50mg/dl。
102.在一些实施方式中,对象接受至少两项先前的抗骨髓瘤治疗线治疗(例如,包括至少2个连续周期的来那度胺和蛋白酶体抑制剂(例如分开给予的或组合给予的)),以及在两项先前的抗骨髓瘤治疗线完成时或60天内有记录的imwg(国际骨髓瘤工作组)疾病进展。
103.在本文所述任何方法的一些实施方式中,对象中的一种或多种治疗效果在给予抗体-药物偶联物后相对于基线得到改善。
104.在本文所述任何方法的一些实施方式中,一种或多种治疗效果选自下组:客观缓解率、完全缓解率、缓解持续时间、完全缓解持续时间、达到缓解时间、无进展生存期和总生存期。
105.在本文所述任何方法的一些实施方式中,客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
106.在本文所述任何方法的一些实施方式中,对象表现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
107.在本文所述任何方法的一些实施方式中,对象表现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
108.在本文所述任何方法的一些实施方式中,对所述治疗缓解或完全缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
109.还提供了试剂盒,其包含:(a)一剂或多剂药物组合物,其包括(i)抗体或其抗原结合片段,其特异性结合至b细胞成熟抗原(bcma),和(ii)药学上可接受的运载体,其中所述抗体或其抗原结合片段,包括:重链可变区,包括含有seq id no:1的cdr1、含有的seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域,包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3,和(b)进行本文所述任何方法的说明。
110.本文还提供了治疗患有多发性骨髓瘤的对象的方法,该方法包括给予对象一个或多个剂量的药物组合物,其包括(i)特异性结合至b细胞成熟抗原(bcma)的抗体或其抗原结合片段,和(ii)药学上可接受的运载体。
111.在本文所述任何方法的一些实施方式中,多发性骨髓瘤是复发的或难治性多发性骨髓瘤(rrmm)。在一些实施方式中,抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3。
112.在一些实施方式中,抗体是igg1抗体。在一些实施方式中,一剂或多剂约1600mg的抗体或其抗原结合片段以每两周一次的频率独立地给予对象。在一些实施方式中,一剂或多剂约800mg的抗体或其抗原结合片段以每周一次的频率独立地给予对象。在一些实施方式中,约1-2个诱导剂量的约1600mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对
象。在一些实施方式中,约1-2个诱导剂量约800mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对象。在一些实施方式中,在给予每剂抗体或其抗原结合片段之前约1至约3小时给予对象约40mg剂量的地塞米松。
113.在一些实施方式中,之前给予所述对象针对多发性骨髓瘤的一种或多种治疗剂或治疗。针对多发性骨髓瘤的一个或多个先前给予的治疗剂或治疗包括但不限于蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体。在一些实施方式中,针对多发性骨髓瘤的先前给予的治疗剂或治疗在治疗多发性骨髓瘤中无效。在一些实施方式中,对象具有一项或多项:血清单克隆副蛋白(m-蛋白)水平≥约0.5g/dl、尿液m-蛋白水平≥约200mg/24小时以及血清免疫球蛋白游离轻链≥约10mg/dl和血清免疫球蛋白κ对λ游离轻链比率异常。
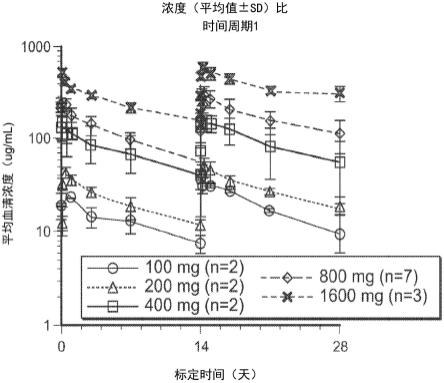
114.本文还提供了试剂盒,其包括或由以下组成:(a)一个或多个剂量的药物组合物,其包括(i)特异性结合至b细胞成熟抗原(bcma)的抗体或其抗原结合片段,和(ii)药学上可接受的运载体,其中所述抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3;以及任选地(b)进行如本文所述治疗方法的说明。
115.在一些实施方式中,该试剂盒还包括一剂或多剂地塞米松、一剂或多剂免疫调节酰亚胺药物、一剂或多剂γ分泌酶抑制剂和/或一剂或多剂抗-cd38抗体或其抗原结合片段。
116.在一些实施方式中,试剂盒还包括一剂或多剂地塞米松。
117.在一些实施方式中,试剂盒还包括一剂或多剂免疫调节酰亚胺药物。
118.在一些实施方式中,试剂盒还包括一剂或多剂地塞米松和一剂或多剂免疫调节酰亚胺药物。
119.在一些实施方式中,试剂盒还包括一剂或多剂γ分泌酶抑制剂。
120.在一些实施方式中,试剂盒还包括一剂或多剂抗-cd38抗体。
121.除非另外定义,本文使用的所有技术和科学术语的意义与本发明所属领域普通技术人员通常所理解的相同。本文描述了本发明中所用的方法和材料;也可以使用本领域已知的其它合适的方法和材料。所述材料、方法和实施例都仅是说明性的,不构成限制。本文中述及的所有出版物、专利申请、专利、序列、数据库条目和其它参考文献都通过引用其全文纳入本文。若有抵触,以本包括定义在内的本技术说明书为准。
122.从下文的详述、附图和所附权利要求中能够很容易地了解本发明的其它特征和优点。
附图说明
123.图1a是显示在被给予不同剂量sea-bcma的对象体内随时间变化的sea-bcma抗体平均血清浓度的图示。
124.图1b显示了图1a中描述的sea-bcma的药代动力学分析的结果。
125.图2a是显示了使用体外细胞结合能力试验的游离sea-bcma检测的示意图。
126.图2b显示使用图2a所描述的试验产生的标准曲线。
127.图3a是显示了使用被给予100mg、200mg或400mg剂量的sea-bcma的对象血清进行的体外膜bcma试验中膜结合bcma的百分比的图示,各线对应不同的对象。
128.图3b是显示了使用被给予800mg剂量的sea-bcma的对象血清进行的体外膜bcma试验中膜结合bcma的百分比的图示,各线对应不同的对象。
129.图3c是显示了使用被给予1,600mg剂量的sea-bcma的对象血清进行的体外膜bcma试验中膜结合bcma的百分比的图示。
130.图4是显示了恶性浆细胞表面上膜bcma的结合的柱状图。
131.图5显示了给予一个患者的先前治疗及用sea-bcma治疗之后的结果。
132.图6a是在给予1600mg剂量的sea-bcma之后,患者(患者a)体内血清游离轻链(sflc)水平的图示。
133.图6b显示了患者a体内基线处膜结合bcma的更高水平,相较于入组该研究的一些其他患者,其在图6a中观察到标志性的sflc减少。
134.图7显示了给予一个患者的先前治疗及用sea-bcma治疗之后的结果。
135.图8a.dapt处理后nci-h929细胞显示bcma表达增加。浅灰色:同种型对照;中灰色:未处理的细胞;深灰色:dapt处理的细胞。
136.图8b.dapt处理后molp-8细胞显示bcma表达增加。浅灰色:同种型对照;中灰色:未处理的细胞;深灰色:dapt处理的细胞。
137.图8c.由于fcγriii的接合,nfat信号转导的背景倍数。dapt(gsi)处理的nci-h929细胞相较于未处理细胞(n=3)。
138.图8d.由于fcγriii的接合,nfat信号转导的背景倍数。dapt(gsi)处理的molp-8细胞相较于未处理细胞(n=3)。
139.图9a.nirogacestat处理后molp-8细胞显示bcma表达增加。
140.深灰色:同种型对照;中灰色:未处理的细胞;浅灰色:nirogacestat处理的细胞。
141.图9b.相较于未处理细胞,nirogacestat处理的细胞的最大靶细胞裂解百分比(n=3)。higg1k是非结合抗体对照。
142.图10.nci-h929细胞的p65激活,与和不与sea-bcma结合,用或不用april处理,存在或不存在nirogacestat。
143.图11.植入发光molp-8细胞之后第18天起始给药后5只动物的平均发光绘图。发光是在100天内进行评估的。
144.图12a.与依洛珠单抗(elotuzumab)和wt-bcma作为基准相比,sea-bcma与泊马度胺组合在体外诱导更大的mm1r靶细胞杀伤。(n=2)
145.图12b.与达雷木单抗作为基准相比,sea-bcma与泊马度胺组合在体外诱导更大的mm1r靶细胞杀伤。(n=2)
具体实施方式
146.本文提供了治疗患有多发性骨髓瘤(mm)的对象的方法,所述方法包括给予对象一个或多个剂量的结合至b细胞成熟抗原(bcma)的抗体或其抗原结合片段。
147.在一些实施方式中,抗体是igg1抗体。在一些实施方式中,抗体是非岩藻糖基化抗体。在一些实施方式中,抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述
重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3。在一些实施方式中,一剂或多剂1600mg的抗体或其抗原结合片段以每两周一次的频率独立地给予对象。在一些实施方式中,一剂或多剂800mg的抗体或其抗原结合片段以每周一次的频率独立地给予对象。在一些实施方式中,约1-2个诱导剂量约1600mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对象。在一些实施方式中,约1-2个诱导剂量约800mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对象。
148.在一些实施方式中,多发性骨髓瘤是复发的或难治性多发性骨髓瘤(rrmm)。在一些实施方式中,之前给予所述对象针对多发性骨髓瘤的一种或多种治疗剂或治疗。针对多发性骨髓瘤的一个或多个先前给予的治疗剂或治疗包括但不限于蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体。在一些实施方式中,先前给予的一个或多个治疗剂或治疗在治疗多发性骨髓瘤中无效。在一些实施方式中,对象具有一项或多项(例如,两项、三项或四项):血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl、尿液m-蛋白水平≥200mg/24小时、血清免疫球蛋白游离轻链≥10mg/dl和/或血清免疫球蛋白κ对λ游离轻链比率异常。
149.在一些实施方式中,这些方法导致,例如以下一项或多项:治疗期望的对象血清中抗bcma抗体的稳态浓度,治疗期望的对象血清中游离轻链的稳态水平降低,以及治疗期望的对象中bcma饱和度。
150.如下文实施例中更详细所述的,本文所述的用非岩藻糖基化抗-bcma抗体例如sea-bcma抗体进行的临床试验的初始结果令人惊讶地表明可以高剂量(例如800mg或1600mg每剂)给予sea-bcma抗体同时仍然保持可耐受的安全性状况.这些初始结果进一步说明可以潜在地以灵活的给药方案给予这种抗体,包括标准或强化给药方案。能够以高剂量给予还表明了该抗体是用于与其他治疗剂组合给药的潜在的良好候选物,包括,例如,地塞米松。
151.多发性骨髓瘤
152.多发性骨髓瘤(mm)是一种在骨髓、外周血或其他髓外部位克隆性增殖的浆细胞的肿瘤性疾病。mm诊断需要国际骨髓瘤工作组(imwg)2014标准所定义的全身治疗(rajkumar,等(2014)lancet oncol,15(12):e538-48)。恶性浆细胞对骨髓微环境和邻近的骨骼产生直接的病理作用,导致贫血、溶骨性骨病变和高钙血症。在大多数情况下,恶性浆细胞也产生被称为m蛋白的异常单克隆免疫球蛋白,但在少数患者中,骨髓瘤细胞只产生单克隆游离轻链(flc)。m蛋白或flc的异常水平可导致疾病的临床表现,包括肾衰竭和对感染的易感性增加。
153.多发性骨髓瘤(mm)的常规治疗,例如组合化疗方案,不是治愈性的,大多数患者最终发生进展。此外,一些患者会初始治疗无缓解。
154.初始疾病缓解的持续时间仍然是mm最有力的预后因素之一,特别是在自体干细胞移植(asct)后。前期asct后的早期复发(《24个月)强烈预测较低的总生存期(os),尽管有过去20年取得的所有进展,该疾病的自然史仍然严重不变,早期复发的比例稳定在35-38%左右(参见,kumar等,leukemia 32:986
–
95,2018)。这些复发通常表现得很有侵袭性,与难治
性疾病糟糕的结果类似,定义为治疗中或停止治疗后60天内的进展。早期复发使得患者不能从最初的治疗中适当恢复,并会严重限制治疗选择。
155.几乎所有(如果不是全部)骨髓瘤患者最终都会复发,但早期复发通常具有侵袭性和糟糕的,而晚期复发(》24个月)一般具有更多的惰性过程。此外,患者通常会有时间恢复,先前的干预措施几乎没有残留的毒性,允许采取更积极的方法。在后线的治疗中,仍有大量的需求没有得到满足。对于那些对先前给予的pi、imid和抗cd38抗体治疗难治性的患者("三类"难治性对象)来说,这种未满足的需求是非常明显的。
156.本文提供了一种治疗患有多发性骨髓瘤(mm)的对象的方法。在一些实施方案中,多发性骨髓瘤选自下组:骨髓瘤前体、产生κ型轻链和/或λ型轻链的多发性骨髓瘤癌、侵袭性多发性骨髓瘤、难治性多发性骨髓瘤和耐药性多发性骨髓瘤。在一些实施方式中,多发性骨髓瘤是复发的或难治性多发性骨髓瘤(rrmm)。在一些实施方式中,对象具有一项或多项(例如,两项、三项或四项):血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl、尿液m-蛋白水平≥200mg/24小时、血清免疫球蛋白游离轻链≥10mg/dl和/或血清免疫球蛋白κ对λ游离轻链比率异常。
157.评估患有多发性骨髓瘤的对象的疗效的方法包括测量游离轻链、m蛋白、高钙血症的水平以及对象中骨髓瘤细胞的相对数量。
158.bcma
159.b细胞成熟抗原(bcma或bcm),也被称为肿瘤坏死因子受体超家族成员17(tnfrsf17),是一种在人中由tnfrsf17基因编码的蛋白质。bcma是既定的浆母细胞-和浆细胞-特异性蛋白,介导细胞的增殖和生存。bcma在大多数mm患者的肿瘤细胞上以中等至低水平表达(novak等,blood 103(2):689-694,2004;seckinger等,cancer cell 31(3):396-410,2017)。配体april和baff结合至bcma并介导促生存的细胞信号(moreaux等,blood 103(8):3148-3157,2004;novak等,blood 103(2):689-694,2004;o’connor等,j.exp.med.199(1):91-8,2004)。
160.除非另有说明,bcma指的是人bcma。野生型人bcma蛋白和野生型人bcma cdna的示例性序列如下所示。
161.野生型成熟人bcma蛋白(seq id no:9)
162.mlqmagqcsqneyfdsllhacipcqlrcssntppltcqrycnasvtnsvkgtnailwtclglsliislavfvlmfllrkinseplkdefkntgsgllgmanidleksrtgdeiilprgleytveectcedcikskpkvdsdhcfplpameegatilvttktndyckslpaalsateieksisar
163.野生型人bcma cdna(seq id no:10)
164.aagactcaaa cttagaaact tgaattagat gtggtattca aatccttagc tgccgcgaag
165.acacagacag cccccgtaag aacccacgaa gcaggcgaag ttcattgttc tcaacattct
166.agctgctctt gctgcatttg ctctggaatt cttgtagaga tattacttgt ccttccaggc
167.tgttctttct gtagctccct tgttttcttt ttgtgatcat gttgcagatg gctgggcagt
168.gctcccaaaa tgaatatttt gacagtttgt tgcatgcttg cataccttgt caacttcgat
169.gttcttctaa tactcctcct ctaacatgtc agcgttattg taatgcaagt gtgaccaatt
170.cagtgaaagg aacgaatgcg attctctgga cctgtttggg actgagctta ataatttctt
171.tggcagtttt cgtgctaatg tttttgctaa ggaagataaa ctctgaacca ttaaaggacg
172.agtttaaaaa cacaggatca ggtctcctgg gcatggctaa cattgacctg gaaaagagca
173.ggactggtga tgaaattatt cttccgagag gcctcgagta cacggtggaa gaatgcacct
174.gtgaagactg catcaagagc aaaccgaagg tcgactctga ccattgcttt ccactcccag
175.ctatggagga aggcgcaacc attcttgtca ccacgaaaac gaatgactat tgcaagagcc
176.tgccagctgc tttgagtgct acggagatag agaaatcaat ttctgctagg taattaacca
177.tttcgactcg agcagtgcca ctttaaaaat cttttgtcag aatagatgat gtgtcagatc
178.tctttaggat gactgtattt ttcagttgcc gatacagctt tttgtcctct aactgtggaa
179.actctttatg ttagatatat ttctctaggt tactgttggg agcttaatgg tagaaacttc
180.cttggtttca tgattaaact cttttttttc ctga
181.除非从上下文中可以看出,提及bmca是指bcma蛋白的至少胞外结构域。人bcma蛋白的示例性胞外结构域包括seq id no:9)的1-54氨基酸。在一些实施方式中,本文所述的抗bcma抗体或抗原结合片段可特异性结合至在癌细胞(如骨髓瘤细胞)表面表达的bcma。
182.抗体和抗原结合片段
183.本文以其最广泛的含义使用术语"抗体"并且包括蛋白质(例如单链多肽或多链多肽)其包含特异性结合至抗原或表位的一个或多个抗原结合结构域。完整抗体通常包括四个多肽—两个重链和两个轻链接合形成"y"形分子。在不同的抗体中,"y"尖端的氨基酸序列差异很大。该可变区域,例如,由110-130个氨基酸构成,使抗体具有结合抗原的特异性。该可变区域包括轻链和重链的末端。用蛋白酶处理抗体可以裂解这个区域,产生fab或抗原结合片段,其包括抗体的可变末端。可变区中直接与抗原表面的部分接触的区域是互补性决定区(cdr)。轻链可变区(vl)和重链可变区(vh)各包括三个cdr-cdr1、cdr2和cdr3。恒定区决定了用于破坏抗原的机制。根据其恒定区结构和免疫功能,抗体被分为五大类,igm、igg、iga、igd和ige。
184.在一些实施方式中,抗体具体包括,例如,完整的抗体(例如,完整的免疫球蛋白,例如,人igg(例如,人igg1、人igg2、人igg3、人igg4))和抗原结合的抗体片段。在一些实施方式中,抗体是人源化的igg1抗体。抗原结合结构域的一个实例是由v
h-v
l
二聚体形成的抗原结合结构域。本文描述了抗体的其他实例。抗体的其他例子在本领域中是已知的。
185.如本文所用,术语"抗原结合结构域"或"抗原结合片段"是一个或多个蛋白质结构域(例如,由单个多肽的氨基酸形成或由两个或更多个多肽(例如,相同或不同的多肽)的氨基酸形成),能够特异性地结合至一个或多个不同的抗原。在一些实施例中,抗原结合结构域可以结合至抗原或表位,其特异性和亲和力类似于天然存在的抗体。在一些实施方式中,抗原结合结构域可包括替代性支架。本文描述了抗原结合结构域的非限制性例子。抗原结合结构域的其他例子在本领域中是已知的。在一些例子中,抗原结合结构域可以结合至单一抗原。在一些实施方式中,本文所述方法中使用的抗体或抗原结合片段特异性结合至b细胞成熟抗原(bcma)。
186.本文所述的抗体或其抗原结合片段可以是单个多肽,或可以包括两个、三个、四个、五个、六个、七个、八个、九个或十个(相同或不同)多肽。在一些实施方式中,当抗体或其抗原结合片段为单一多肽时,抗体或抗原结合片段可以包括单一抗原结合结构域或两个抗原结合结构域。在一些实施方式中,当抗体或抗原结合片段是单一多肽并包括两个抗原结合结构域时,第一和第二抗原结合结构域可以彼此相同或不同(并且可以特异性地结合至
相同或不同的抗原或表位)。
187.在一些实施方式中,当抗体或抗原结合片段是单一多肽时,第一抗原结合结构域和第二抗原结合结构域(如果存在)可以各自独立地选自下组:vh结构域、vhh结构域、vnar结构域和scfv。在一些实施方式中,当抗体或抗原结合片段为单一多肽时,抗体或抗原结合片段可以是bite、(scfv)2、纳米抗体、纳米抗体-has、dart、tandab、scdiabody、scdiabody-ch3、scfv-ch-cl-scfv、has抗体、sc双抗体-has、串联-scfv、adnectin、darpin、纤连蛋白和dep偶联物。当抗体或抗原结合片段为单一多肽时,可使用的抗原结合结构域的其他例子是本领域已知的。
188.vhh结构域是单一的单体可变抗体结构域,可以在骆驼科动物中找到。v
nar
结构域是单一的单体可变抗体结构域,可以在软骨鱼中找到。vhh结构域和v
nar
结构域的非限制性方面描述于,例如cromie等,curr.top.med.chem.15:2543-2557,2016;de genst等,dev.comp.immunol.30:187-198,2006;de meyer等,trends biotechnol.32:263-270,2014;kijanka等,nanomedicine 10:161-174,2015;kovaleva等,expert.opin.biol.ther.14:1527-1539,2014;krah等,immunopharmacol.immunotoxicol.38:21-28,2016;mujic-delic等,trends pharmacol.sci.35:247-255,2014;muyldermans,j.biotechnol.74:277-302,2001;muyldermans等,trends biochem.sci.26:230-235,2001;muyldermans,ann.rev.biochem.82:775-797,2013;rahbarizadeh等,immunol.invest.40:299-338,2011;van audenhove等,ebiomedicine 8:40-48,2016;van bockstaele等,curr.opin.investig.drugs 10:1212-1224,2009;vincke等,methods mol.biol.911:15-26,2012;和wesolowski等,med.microbiol.immunol.198:157-174,2009。
189.在一些实施方式中,当抗体或抗原结合片段是单一多肽并包括两个抗原结合结构域时,第一抗原结合结构域和第二抗原结合结构域可以都是vhh结构域,或者至少一个抗原结合结构域可以是vhh结构域。在一些实施方式中,当抗体或抗原结合片段是单一多肽并包括两个抗原结合结构域时,第一抗原结合结构域和第二抗原结合结构域都是v
nar
结构域,或者至少一个抗原结合结构域是v
nar
结构域。在一些实施方式中,当抗体或抗原结合结构域是单一多肽时,第一抗原结合结构域是scfv结构域。在一些实施方式中,当抗体或抗原结合片段是单一多肽并包括两个抗原结合结构域时,第一抗原结合结构域和第二抗原结合结构域可以都是scfv结构域,或者至少一个抗原结合结构域可以是scfv结构域。
190.在一些实施方式中,抗体或抗原结合片段可包括两个或更多个多肽(例如,2、3、4、5、6、7、8、9或10个多肽)。在一些实施方式中,当抗体或抗原结合片段包括两个或更多个多肽时,两个或更多个多肽中的两个、三个、四个、五个或六个多肽可以是相同的。
191.在一些实施方式中,当抗体或抗原结合片段包括两个或更多多肽(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个多肽)时,抗体或抗原结合片段的两个或更多个多肽可以组装(例如,非共价组装)以形成一个或多个抗原结合结构域,例如,抗体的抗原结合片段(例如,任何本文所述的抗体的抗原结合片段),vhh-scab、vhh-fab、双scfab、f(ab’)2、双抗体、crossmab、daf(二合一)、daf(四合一)、dutamab、dt-igg、杵臼共有轻链、杵臼组合体、电荷配对、fab-臂交换、seed体、luz-y、fcab、κλ-体、正交fab、dvd-igg、igg(h)-scfv、scfv-(h)igg、igg(l)-scfv、scfv-(l)igg、igg(l,h)-fv、igg(h)-v、v(h)-igg、igg
(l)-v、v(l)-igg、kih igg-scfab、2scfv-igg、igg-2scfv、scfv4-ig、zy体、dvi-igg、双抗体-ch3、三体、小抗体、微型抗体、tribi微型抗体、scfv-ch3 kih、fab-scfv、f(ab’)
2-scfv2、scfv-kih、fab-scfv-fc、四价hcab、sc双抗体-fc、双抗体-fc、串联scfv-fc、vhh-fc、串联vhh-fc、vhh-fc kih、fab-vhh-fc、内抗体、对接和锁定(dock and lock)、immtac、igg-igg偶联物、cov-x-体、scfv1-peg-scfv2、adnectin、darpin、纤连蛋白和dep偶联物。参见,例如,spiess等,mol.immunol.67:95-106,2015,以其全文纳入此处用于说明这些元件。抗体的抗原结合片段的非限制性例子包括fv片段、fab片段、f(ab')2片段和fab'片段。抗体的抗原结合片段的其他例子是igg的抗原结合片段(例如,igg1、igg2、igg3或igg4的抗原结合片段)(例如,人或人源化的igg的抗原结合片段,例如,人或人源化的igg1、igg2、igg3或igg4);iga的抗原结合片段(例如,iga1或iga2的抗原结合片段)(例如,人或人源化的iga的抗原结合片段,例如,人或人源化的iga1或iga2);igd的抗原结合片段(例如,人或人源化的igd的抗原结合片段);ige的抗原结合片段(例如,人或人源化的ige的抗原结合片段);或igm的抗原结合片段(例如,人或人源化的igm的抗原结合片段)。
192."fv"片段包含一个重链可变结构域和一个轻链可变结构域非共价连接的二聚体。
193."fab"片段除了fv片段的重链和轻链可变结构域外包含轻链的恒定结构域和重链的第一恒定结构域(c
h1
)。
[0194]“f(ab')
2”片段包括接合的两个fab片段,靠近铰链区,通过二硫键。
[0195]“双可变结构域免疫球蛋白”或“dvd-ig”是指如所述的多价和多特异性结合蛋白,例如,在digiammarino等,methods mol.biol.899:145-156,2012;jakob等,mabs 5:358-363,2013;和美国专利号7,612,181;8,258,268;8,586,714;8,716,450;8,722,855;8,735,546;和8,822,645,其各自通过引用全文纳入本文。
[0196]
dart描述于,例如,garber,nature reviews drug discovery 13:799-801,2014。
[0197]
非岩藻糖基化或未岩藻糖化的单克隆抗体是指经工程改造使抗体fc区的低聚糖不含任何岩藻糖糖单位的单克隆抗体。在一些实施方式中,抗体的非岩藻糖基化增加了诸如抗体依赖的细胞毒性(adcc)的效果。如下文更详细地描述,在一些实施方式中,本文所述方法中使用的抗体是非岩藻糖基化的抗体。
[0198]
在一些实施方式中,本文所述抗体可以是igg1(例如,人或人源化的igg1)、igg2(例如,人或人源化的igg2)、igg3(例如,人或人源化的igg3)、igg4(例如,人或人源化的igg4)、iga1(例如,人或人源化的iga1)、iga2(例如,人或人源化的iga2)、igd(例如,人或人源化的igd)、ige(例如,人或人源化的ige)或igm(例如,人或人源化的igm)。
[0199]
人源化抗体是遗传工程改造的抗体,其中来自非人“供体”抗体的cdr被植入人“受体”抗体序列(参见例如queen,美国专利号5,530,101和5,585,089;winter,美国专利号5,225,539;carter,美国专利号6,407,213;adair,美国专利号5,859,205;和foote,美国专利号6,881,557)。受体抗体序列可以是,例如,成熟的人抗体序列,这种序列的组合,人类抗体序列的共有序列,或种系区域序列。对于人源化,重链的示例性受体序列是:种系vh外显子vh1-2,对于j外显子(jh),外显子jh-3。对于轻链,示例性受体序列是外显子vl1-12和j外显子jk5。
[0200]
因此,人源化抗体是至少四个cdr完全或基本来自非人供体抗体,而如存在时恒定区和可变区框架序列完全或基本来自人抗体序列的抗体。类似地,人源化重链至少有两个,
通常是全部三个cdr,完全或大部分来自供体抗体重链,以及重链可变区框架序列和重链恒定区,如存在时,基本上来自人重链可变区框架和恒定区序列。类似地,人源化轻链至少有两个和通常是全部三个cdr,完全或基本上来自供体抗体轻链,以及轻链可变区框架序列和轻链恒定区,如存在时,基本上来自人轻链可变区框架和恒定区序列。除纳米抗体和dab外,人源化抗体包含人源化重链和人源化轻链。人源化或人抗体中的cdr基本来自非人抗体中对应的cdr或基本与其相同,在各cdr之间有至少60%,85%,90%,95%或100%对应残基(如kabat定义)是相同的。当与kabat定义的对应残基有至少70%,80%,85%,90%,95%或100%相同时,抗体链的可变区框架序列或抗体链的恒定区基本分别来自人可变区框架序列或人恒定区。
[0201]
虽然人源化抗体通常包含全部6个来自小鼠抗体的cdr(优选由kabat定义),也可以用少于全部的(例如至少4或5)来自小鼠抗体的cdr制备(例如pascalis等,j.immunol.169:3076,2002;vajdos等,j.mol.biol.320:415-428,2002;iwahashi等,mol.immunol.36:1079-1091,1999;tamura等.,j.immunol.164:1432-1441,2000)。
[0202]
可选择人可变区框架残基的一些氨基酸基于其可能的对cdr构型和/或与抗原结合的影响进行取代。对这种可能的影响的调查是通过建模、检查特定位置的氨基酸的特征,或对特定氨基酸的取代或定点诱变的效果进行经验观察。
[0203]
例如,当氨基酸在鼠可变区框架残基和选定的人可变区框架残基之间存在差异时,人框架氨基酸可以被来自小鼠抗体的等同的框架氨基酸取代,当合理地预期该氨基酸会:
[0204]
(1)非共价地直接结合抗原,
[0205]
(2)邻近cdr区,
[0206]
(3)以其他方式与cdr区相互作用(例如在cdr区的约内);或
[0207]
(4)介导重链和轻链之间的相互作用。
[0208]
在本文所述任何抗体或抗原结合片段的一些实施方式中,抗体或抗原结合片段可包括:重链可变区和轻链可变区,所述重链可变区包括含有dyyih(seq id no:1)的cdr1、含有yinpnsgytnyaqkfqg(seq id no:2)的cdr2,和含有ymwervtgffdf(seq id no:3)的cdr3,以及轻链可变区包括含有lasedisddla(seq id no:5)的cdr1、含有ttsslqs(seq id no:6)的cdr2和含有qqtykfppt(seq id no:7)的cdr3。
[0209]
在本文所述的任何抗体或抗原结合片段的一些实施方式中,该抗体或抗原结合片段可包括重链可变区,所述重链可变区包含序列,所述序列与seq id no:4至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一),和/或轻链可变结构域,所述轻链可变结构域包括序列,所述序列与seq id no:8至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一)。
[0210]
在本文所述的任何抗体或抗原结合片段的一些实施方式中,该抗体或抗原结合片段可包括由核酸编码的重链可变区,所述核酸包含序列,所述序列与与seq id no:11至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同
一),和/或由核酸编码的轻链可变结构域,所述核酸包括序列,所述序列与seq id no:12至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一)。
[0211]
示例性重链可变结构域(seq id no:4)
[0212]
qvqlvqsgaevkkpgasvklsckasgytftdyyihwvrqapgqglewigyinpnsgytnyaqkfqgratmtadksintayvelsrlrsddtavyfctrymwervtgffdfwgqgtmvtvss
[0213]
编码示例性重链可变结构域的dna(seq id no:11)
[0214]
caagtgcagc tggtgcagtc cggagcggaa gtgaagaaac ctggggcgtc cgtgaagctc agctgcaagg cctccggcta cactttcacc gattactaca tccactgggt cagacaggca ccgggacagg gactggagtg gattggttac atcaacccca actccgggta caccaattac gcccagaagt tccagggtcg ggctacgatg accgccgaca agtcgatcaa cactgcctac gtggaactgt caaggctgcg gtccgatgac accgccgtgt acttctgtac ccgctatatg tgggagcgcg tgactggatt tttcgacttc tggggccaag gcaccatggt caccgtgtcg agc
[0215]
示例性轻链可变结构域(seq id no:8)
[0216]
diqmtqspssvsasvgdrvtitclasedisddlawyqqkpgkapkvlvyttsslqsgvpsrfsgsgsgtdftltisslqpedfatyfcqqtykfpptfgggtkveikr
[0217]
编码示例性轻链可变结构域的dna(seq id no:12)
[0218]
gacattcaga tgacccagtc cccctcgtcc gtgtccgctt ccgtgggaga tcgcgtgacc atcacttgtc ttgcgtccga ggatatctca gacgacctgg cctggtacca gcagaagcct ggaaaggccc cgaaggtcct ggtgtacact accagcagcc tccagtcggg cgtgccttca cggttctccg gttcggggtc tggcaccgac ttcaccctga ctattagctc cctgcaaccc gaggacttcg ccacctactt ttgccagcaa acctacaagt tcccgccaac gttcggaggg ggcaccaagg tcgaaatcaa acgt
[0219]
在本文所述的任何抗体或抗原结合片段的一些实施方式中,该抗体或抗原结合片段可包括重链,所述重链包含序列,所述序列与seq id no:13至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一),和/或轻链,所述轻链包括序列,所述序列与seq id no:15至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一)。
[0220]
在本文所述的任何抗体或抗原结合片段的一些实施方式中,该抗体或抗原结合片段可包括由核酸编码的重链,所述核酸包括与seq id no:14至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一)的序列,和/或由核酸编码的轻链,所述核酸包括与seq id no:16至少80%同一(例如至少82%同一、至少84%同一、至少86%同一、至少88%同一、至少90%同一、至少92%同一、至少94%同一、至少96%同一、至少98%同一、至少99%同一,或100%同一)的序列。
[0221]
示例性重链(seq id no:13)
[0222]
qvqlvqsgaevkkpgasvklsckasgytftdyyihwvrqapgqglewigyinpnsgytnyaqkfqgrat
cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt
[0229]
在本文所述任何抗体或抗原结合片段的一些实施方式中,该抗体是如us 2017/0233484(另见wo 2017/143069)所述的一种。在一个这种实施方式中,抗体或抗原结合片段包括hsg16.17 vh3抗体,其包括重链可变区和轻链可变结构域,所述重链可变区包括分别对应于seq id no:60-62的cdr1、cdr2和cdr3,如us 2017/0233484和wo 2017/143069所列,所述轻链可变结构域包括分别对应于seq id no:90-92的cdr1、cdr2和cdr3,如us 2017/0233484和wo 2017/143069中所列。分别对应于seq id no:13和19的hsg16.17 vh3的vh和vl结构域如us 2017/0233484和wo 2017/143069所列。
[0230]
人源化抗体的重链和轻链可变区可以连接至人恒定区的至少一部分。恒定区的选择部分取决于是否需要抗体依赖性细胞介导的细胞毒性,抗体依赖性细胞吞噬作用和/或补体依赖性细胞毒性。例如,人同种型igg1和igg3具有强烈补体依赖性细胞毒性,人同种型igg2具有弱补体依赖性细胞毒性而人igg4缺乏补体依赖性细胞毒性。人iggl和igg3也比人igg2和igg4诱导出更强的细胞介导的效应物功能。轻链恒定区可以是λ或κ。抗体可以表达为含有两条轻链和两条重链的四聚体,也可以表达为分离的重链、轻链,如fab、fab'、f(ab')2和fv,或者表达为单链抗体,其中重链和轻链可变结构域通过间隔子连接。
[0231]
在轻链和/或重链的氨基或羧基末端的一个或几个氨基酸,如重链的c-末端赖氨酸,可以在一部分或全部分子中缺失或衍生化。在恒定区中可进行取代以减少或增加效应物功能,例如补体介导的细胞毒性或adcc(见例如winter等美国专利号5,624,821;tso等,美国专利号5,834,597;和lazar等,proc.natl.acad.sci.u.s.a.103:4005,2006),或延长人中的半衰期(见例如hinton等,j.biol.chem.279:6213,2004)。
[0232]
示例性的取代包括在氨基酸234、235、237、239、267、298、299、326、330或332位上将天然氨基酸取代为半胱氨酸残基,优选人igg1重链中的s239c突变(编号根据eu索引(kabat,《免疫学感兴趣的蛋白质的序列》(sequences of proteins of immunological interest)(马里兰州贝塞斯达的国立卫生研究院,1987和1991);参见us 20100158909,其纳入本文参考文献)。重链可以包括s239c取代,包括和不包括c末端赖氨酸。额外半胱氨酸残基的存在允许链间二硫键的形成。这种链间二硫键的形成会造成空间位阻,从而降低fc区-fcγr结合相互作用的亲和力。在igg恒定区的fc区内或邻近引入的一个或多个半胱氨酸残基也可以作为与治疗剂偶联的位点(即使用硫醇特异性试剂(如药物的马来酰亚胺衍生物)偶联细胞毒性药物。治疗剂的存在会造成空间位阻,从而进一步降低fc区-fcγr结合相互作用的亲和力。在234、235、236和/或237的任何重链氨基酸位置上的其他取代会降低对fcγ受体的亲和力,特别是fcγri受体(参见,例如us专利号6,624,821,us专利号5,624,821)。重链氨基酸取代的优选组合是s239d、a330l和1332e,其增加了fc域对fcγriiia的亲和力,从而增加adcc。
[0233]
抗体的体内半衰期也会影响其效应物功能。抗体的半衰期可以增加或减少以改变其治疗活性。fcrn是一种结构上类似于mhc i类抗原的受体,与β2-微球蛋白非共价缔合。fcrn调节igg的分解代谢和其在组织间的转胞吞作用(ghetie和ward,annu.rev.immunol.18:739-766,2000;ghetie和ward,immunol.res.25:97-113,2002)。igg-fcrn的相互作用发生在ph 6.0(胞内囊泡的ph),而不是ph 7.4(血液的ph);这种相互
06/036291)。
[0238]
提到人恒定区包括具有任何天然同种异型的恒定区或在天然同种异型中占据多态位置的残基的任何排列。另外,相对于天然的人恒定区来说,可能存在多达1、2、5或10个突变,如上面提到的那些,以减少fcγ受体结合或增加与fcrn的结合。
[0239]
非岩藻糖基化抗体或抗原结合片段
[0240]
在一些实施方式中,本文所述的任何抗体或抗原结合片段具有减少的岩藻糖基化或非岩藻糖基化,可以在所提供的方法中使用。例如,在一些实施方式中,该抗体或抗原结合片段的核心岩藻糖基化减少。“核心岩藻糖基化”是指在n-连接的聚糖的还原末端将岩藻糖添加(“岩藻糖基化”)至n-乙酰葡萄糖胺(“glcnac”)。
[0241]“复合n-糖苷-连接的糖链”通常结合至天冬酰胺297(根据kabat的编号)。如本文所用,复合n-糖苷-连接的糖链具有双触角复合糖链,主要具有以下结构:
[0242][0243]
其中
±
表示糖分子可以存在或不存在,数字表示糖分子之间连接的位置。在上述结构中,结合至天冬酰胺的糖链末端被称为还原末端(右侧),而相反的一侧被称为非还原末端。岩藻糖通常结合至还原末端的n-乙酰葡萄糖胺(“glcnac”),通常通过α1,6键(glcnac的6位连接至岩藻糖的1位)。“gal”是指半乳糖,“man”是指甘露糖。
[0244]
一个“复合n-糖苷连接的糖链”包括:1)复合型,其中核心结构的非还原末端侧具有一个或多个半乳糖-n-乙酰葡萄糖胺(也被称为“gal-glcnac”)的分支,gal-glcnac的非还原末端侧任选地具有唾液酸、二等分n-乙酰葡萄糖胺或类似物;或2)杂交型,其中核心结构的非还原末端侧具有高甘露糖n-糖苷连接的糖链和复合n-糖苷连接的糖链的两个分支。在一些实施方式中,“复合n-糖苷-连接的糖链”包括复合型,其中核心结构的非还原末端侧具有零个、一个或多个半乳糖-n-乙酰葡萄糖胺(也称为“gal-glcnac”)的分支,并且gal-glcnac的非还原末端侧可任选地还具有例如唾液酸、二等分n-乙酰葡萄糖胺等结构。
[0245]
在某些实施方式中,通常只有少量的岩藻糖被纳入本文所公开的抗体或抗原结合片段的一个或多个复合n-糖苷连接的糖链中。例如,在各种实施方式中,少于约60%、少于约50%、少于约40%、少于约30%、少于约20%、少于约15%、少于约10%、少于约5%、或少于约3%的抗体分子具有岩藻糖的核心岩藻糖化。在一些实施方式中,约2%的抗体分子具有岩藻糖的核心岩藻糖基化。
[0246]
在一些实施方式中,只有少量的岩藻糖类似物(或岩藻糖类似物的代谢物或产物)被纳入一个或多个复合n-糖苷连接的糖链中。例如,在各种实施方式中,少于约60%、少于约50%、少于约40%、少于约30%、少于约20%、少于约15%、少于约10%、少于约5%、或少于约3%的抗体分子或抗原结合片段具有岩藻糖类似物或岩藻糖类似物的代谢物或产物的核心岩藻糖化。在一些实施方式中,约2%的抗体或抗原结合片段具有岩藻糖类似物或岩藻
糖类似物的代谢物或产物的核心岩藻糖化作用。
[0247]
在本文公开的任何一些实施方式中,该抗体是非岩藻糖基化抗体,意为在抗体的n297位(eu编号)不包含岩藻糖,或者说这样的抗体群体统称在这个位置上没有岩藻糖,或者只具有非常低的岩藻糖基化水平。例如,在某些实施方式中,抗体是》90%或》95%非岩藻糖基化的。在一些实施方式中,抗体是至少95-98%非岩藻糖基化,或至少98-99%非岩藻糖基化的。
[0248]
通过用岩藻糖类似物孵育产生抗体的细胞来制造非岩藻糖化抗体的方法,例如在wo2009/135181中所述。简言之,在岩藻糖类似物或岩藻糖类似物的胞内代谢物或产物存在的情况下,孵育已被工程改造为表达抗体或抗原结合片段的细胞。胞内代谢物可以是,例如,gdp修饰的类似物或完全或部分去酯化的类似物。产物可以是,例如,完全或部分去酯化的类似物。在一些实施方式中,岩藻糖类似物可以抑制岩藻糖补救途径中的一种或多种酶。例如,岩藻糖类似物(或岩藻糖类似物的胞内代谢物或产物)可以抑制岩藻激酶或gdp-岩藻糖-焦磷酸化酶的活性。在一些实施方式中,岩藻糖类似物(或岩藻糖类似物的细胞内代谢物或产物)抑制岩藻糖基转移酶(优选1,6-岩藻糖基转移酶,例如fut8蛋白)。在一些实施方式中,岩藻糖类似物(或岩藻糖类似物的胞内代谢物或产物)可以抑制岩藻糖从头合成途径中的酶的活性。例如,岩藻糖类似物(或岩藻糖类似物的胞内代谢物或产物)可以抑制gdp-甘露糖4,6-脱水酶或/或gdp-岩藻糖合成酶的活性。在一些实施方式中,岩藻糖类似物(或岩藻糖类似物的胞内代谢物或产物)可抑制岩藻糖转运体(例如gdp-岩藻糖转运体)。
[0249]
在某些实施方式中,岩藻糖类似物是2-氟岩藻糖(flurofucose)。在生长培养基中使用岩藻糖类似物的方法和其他岩藻糖类似物已公开,例如,在wo/2009/135181中。
[0250]
其他用于工程改造细胞系以减少核心岩藻糖基化的方法包括基因敲除、基因敲入和rna干扰(rnai)。在基因敲除中,编码fut8(α1,6-岩藻糖基转移酶)的基因被失活。fut8催化将岩藻糖残基从gdp-岩藻糖转移到n-聚糖的asn连接(n-连接)的glcnac的第6位。据报道,fut8是唯一负责将岩藻糖添加到asn297处的n-连接双触角碳水化合物的酶。基因敲入增加了编码酶的基因,如gntiii或高尔基α甘露糖苷酶ii。细胞中这种酶水平的增加使单克隆抗体从岩藻糖基化途径转向(导致核心岩藻糖基化减少),并使二等分n-乙酰葡萄糖胺的数量增加。rnai通常也靶向fut8基因的表达,导致mrna转录水平下降或完全敲除基因表达。任何这些方法都可以用来产生能够产生非岩藻糖基化抗体的细胞系。
[0251]
许多方法可用于确定抗体上岩藻糖基化的数量。方法包括,例如,通过plrp-s色谱的lc-ms和电喷雾电离四极tof ms。
[0252]
抗体和抗原结合片段的生产
[0253]
抗体和抗原结合片段通常是通过重组表达产生的。重组多核苷酸构建体通常包括与抗体链的编码序列可操作地连接的表达控制序列,包括天然相伴的或异源的启动子区。优选地,表达控制序列是能够转化或转染真核宿主细胞的载体中的真核启动子系统。一旦载体被纳入适当的宿主,宿主就被维持在适合核苷酸序列高水平表达的条件下,并收集和纯化产生的抗体或抗原结合片段。
[0254]
哺乳动物细胞是表达编码抗体和抗原结合片段的核苷酸区段的优选宿主。见winnacker,《从基因到克隆》(from genes to clones),(vch出版公司,ny,1987)。本领域已开发了许多能分泌完整异源蛋白质的合适宿主细胞系,包括cho细胞系(例如dg44)、各种
cos细胞系、hela细胞、hek293细胞、l细胞和非抗体产生的骨髓瘤(包括sp2/0和ns0)。优选地,细胞是非人的。这些细胞的表达载体可包括表达控制序列,例如复制起始点,启动子,增强子(queen等,immunol.rev.89:49,1986),和必需的加工信息位点,例如核糖体结合位点,rna剪切位点,聚腺苷酸化位点和转录终止子序列。优选的表达控制序列是源自内源性基因、巨细胞病毒、sv40、腺病毒、牛乳头瘤病毒等的启动子。参见co等,j.immunol.148:1149,1992。
[0255]
一旦表达,可根据本领域标准程序纯化抗体和抗原结合片段,包括hplc纯化、柱色谱、凝胶电泳等(一般见scopes,《蛋白质纯化》(protein purification)(施普林格出版社,ny,1982))。
[0256]
药物组合物
[0257]
在本文所述的任何方法中使用的药物组合物包括:(i)特异性结合至b细胞成熟抗原(bcma)的抗体或其抗原结合片段(例如,本文所述的任何示例性抗体或抗原结合片段),以及(ii)药学上可接受的运载体。
[0258]
产生药物组合物的方法在本领域是已知的,见,例如,《雷明顿:药物科学和实践》(remington:the science and practice of pharmacy),第21版,2005;和《药物与药物科学:教材与专著系列》(drugs and the pharmaceutical sciences:a series of textbooks and monographs)(dekker,ny)系列中的书籍。例如,用于肠胃外(例如静脉内)、皮内或皮下施用的溶液或悬浮液可以包括以下组分:无菌稀释剂,例如注射用水、盐水溶液、非挥发油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐;和调节张力的试剂例如氯化钠或右旋糖。ph可用酸或碱调节,例如盐酸或氢氧化钠。胃肠外制剂可封装在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
[0259]
适于注射应用的药物组合物包括无菌水溶液(水溶性时)或分散液,以及用于临时制备无菌注射溶液或分散液的无菌粉末。对于静脉内给药,合适的运载体包括生理盐水、抑菌水、cremophor eltm(巴斯夫(basf),新泽西州帕西潘尼)或磷酸盐缓冲盐水(pbs)。在一些实施方式中,药学上可接受的运载体是氯化钠溶液。在所有情况下,该组合物应是无菌的。该组合物应该在制造和储存条件下稳定,并且必须在保存过程中能够抵抗微生物如细菌和真菌的污染作用。运载体可以是包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物的溶剂或分散介质。可维持合适的流动性,例如通过使用诸如卵磷脂的包衣、分散情况下通过保持所需粒度以及通过使用表面活性剂来实现。也可通过各种抗菌剂和抗真菌剂(例如对羟基苯甲酸酯类、氯丁醇、酚、抗坏血酸、硫柳汞等)实现防止微生物的作用。在一些实施方式中,该组合物可以在组合物中包括等渗剂,例如,糖类、多元醇,如甘露醇、山梨糖醇和氯化钠。可在组合物中包含延迟吸收的试剂(例如单硬脂酸铝和明胶)以延长可注射组合物的吸收。
[0260]
可将所需量的活性化合物和一种上述组分或其组合根据需要掺入合适溶剂后过滤灭菌,从而制备无菌注射液。通常,将活性活化物掺入含有碱性分散介质和上述其它所需成分的无菌载剂中制备分散液。在用于制备无菌可注射液的无菌粉末情况中,可以使用的制备方法包括真空干燥和冷冻干燥,由其之前无菌过滤的溶液得到活性成分加上任何其它所需成分的粉末。
[0261]
在一些实施方式中,可使用运载体制备所述治疗性化合物,所述运载体会保护所述治疗性化合物不被身体快速清除,例如控释制剂,包括植入和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,例如乙烯-乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。这种制剂可以使用标准技术制备,或购自阿尔扎公司(alza corporation)和诺华制药股份有限公司(nova pharmaceuticals,inc.)。脂质体悬浮液(包含用单克隆抗体对细胞抗原靶向所选择的细胞的脂质体)还可以用作药学上可接受的运载体。这些可按本领域技术人员已知的方法制备,例如,如美国专利号4,522,811中所述。
[0262]
这些药物组合物可与给药说明书一同包括在容器、包装或分配器内。
[0263]
治疗方法
[0264]
本文提供了治疗患有多发性骨髓瘤(mm)的对象的方法,该方法包括给予对象一个或多个剂量的抗体或其抗原结合片段,该抗体或抗原结合片段特异性结合至b细胞成熟抗原(bcma)(例如,本文所述的任何示例性的抗体或抗原结合片段)。
[0265]
如本文所用,“对象”通常是指人对象,例如患有多发性骨髓瘤(mm)的人患者。在一些实施方式中,对象已被鉴定或诊断为患有骨髓瘤前体、产生κ型轻链和/或λ型轻链的多发性骨髓瘤癌症、侵袭性多发性骨髓瘤、难治性多发性骨髓瘤或耐药性多发性骨髓瘤。在一些实施方式中,对象已被鉴定或诊断为复发的或难治性多发性骨髓瘤(rrmm)。mm诊断需要国际骨髓瘤工作组(imwg)2014标准所定义的全身治疗(rajkumar,等(2014)lancet oncol,15(12):e538-48)。
[0266]
在一些实施方式中,评估对象以确定对象是否具有fcγrii和/或fcγrii的小核苷酸多态性。在一些实施方式中,fcγrii和fcγriii的小核苷酸多态性可以通过例如测试fcgriiia
–
158v/f,和/或fcgriia
–
131h/r的多态性来确定。因此,在一些实施方式中,对象具有fcγrii和/或fcγriii的小核苷酸多态性。
[0267]
在一些实施方式中,之前给予所述对象针对多发性骨髓瘤的一种或多种治疗剂或治疗。针对多发性骨髓瘤的一个或多个先前给予的治疗剂或治疗包括但不限于蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体。在一些实施方式中,先前给予的一种或多种(例如一种、两种或三种)治疗剂或治疗(例如,pi、imid和抗cd38抗体中的一种或多种)对治疗对象的多发性骨髓瘤无效。
[0268]
在一些实施方式中,对象具有一项或多项:血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl、尿液m-蛋白水平≥200mg/24小时、血清免疫球蛋白游离轻链水平≥10mg/dl和/或血清免疫球蛋白κ对λ游离轻链比率异常。
[0269]
在一些实施方式中,患有mm的对象中的癌细胞显示出可检测到的bcma水平,其为在蛋白质(例如,通过使用例举的抗体之一进行免疫测定)或mrna水平上测量的。在一些实施方式中,相对于相同类型的非癌组织,例如来自同一或类似患者的非癌组织,患有mm对象的癌细胞显示出bcma的水平升高。癌细胞上bcma的示例性水平可以是每个细胞5000-150000个bcma分子。任选地,在进行治疗之前,可以测量来自对象的癌细胞中bcma的水平。在一些实施方式中,本文所述的方法可进一步包括选择患有多发性骨髓瘤的对象的步骤。在一些实施方式中,特定的标准被应用于选择对象(例如,本文所述的任何纳入标准)。这种标准包括对象的特征,如年龄、性别、疾病的类型和阶段、先前的治疗史和其他医疗状况。在一些实施方式中,本文所述的方法可以进一步包括由于对象的状况而终止治疗(例如,使用
本文所述的任何终止标准)。
[0270]
本文还提供了使用本文描述的任何示例性排除标准中的一项或多项排除对象接受抗bcma抗体或抗原结合片段治疗的方法。
[0271]
a.一般给药
[0272]
在一些实施方式中,独立地给予对象一剂或多剂约400mg抗体或抗原结合片段至约2,000mg抗体或抗原结合片段(例如,约400mg至约1,950mg、约400mg至约1,900mg、约400mg至约1,850mg、约400mg至约1,800mg、约400mg至约1,750mg、约400mg至约1,700mg、约400mg至约1,650mg、约400mg至约1,600mg、约400mg至约1,550mg、约400mg至约1,500mg、约400mg至约1,450mg、约400mg至约1,400mg、约400mg至约1,350mg、约400mg至约1,300mg、约400mg至约1,250mg、约400mg至约1,200mg、约400mg至约1,150mg、约400mg至约1,100mg、约400mg至约1,050mg、约400mg至约1,000mg、约400mg至约950mg、约400mg至约900mg、约400mg至约900mg、约400mg至约850mg、约400mg至约800mg、约400mg至约750mg、约400mg至约700mg、约400mg至约650mg、约400mg至约600mg、约400mg至约550mg、约400mg至约500mg、约400mg至约450mg、约500mg至约2,000mg、约500mg至约1,950mg、约500mg至约1,900mg、约500mg至约1,850mg、约500mg至约1,800mg、约500mg至约1,750mg、约500mg至约1,700mg、约500mg至约1,650mg、约500mg至约1,600mg、约500mg至约1,550mg、约500mg至约1,500mg、约500mg至约1,450mg、约500mg至约1,400mg、约500mg至约1,350mg、约500mg至约1,300mg、约500mg至约1,250mg、约500mg至约1,200mg、约500mg至约1,150mg、约500mg至约1,100mg、约500mg至约1,050mg、约500mg至约1,000mg、约500mg至约950mg、约500mg至约900mg、约500mg至约900mg、约500mg至约850mg、约500mg至约800mg、约500mg至约750mg、约500mg至约700mg、约500mg至约650mg、约500mg至约600mg、约500mg至约550mg、约600mg至约2,000mg、约600mg至约1,950mg、约600mg至约1,900mg、约600mg至约1,850mg、约600mg至约1,800mg、约600mg至约1,750mg、约600mg至约1,700mg、约600mg至约1,650mg、约600mg至约1,600mg、约600mg至约1,550mg、约600mg至约1,500mg、约600mg至约1,450mg、约600mg至约1,400mg、约600mg至约1,350mg、约600mg至约1,300mg、约600mg至约1,250mg、约600mg至约1,200mg、约600mg至约1,150mg、约600mg至约1,100mg、约600mg至约1,050mg、约600mg至约1,000mg、约600mg至约950mg、约600mg至约900mg、约600mg至约900mg、约600mg至约850mg、约600mg至约800mg、约600mg至约750mg、约600mg至约700mg、约600mg至约650mg、约700mg至约2,000mg、约700mg至约1,950mg、约700mg至约1,900mg、约700mg至约1,850mg、约700mg至约1,800mg、约700mg至约1,750mg、约700mg至约1,700mg、约700mg至约1,650mg、约700mg至约1,600mg、约700mg至约1,550mg、约700mg至约1,500mg、约700mg至约1,450mg、约700mg至约1,400mg、约700mg至约1,350mg、约700mg至约1,300mg、约700mg至约1,250mg、约700mg至约1,200mg、约700mg至约1,150mg、约700mg至约1,100mg、约700mg至约1,050mg、约700mg至约1,000mg、约700mg至约950mg、约700mg至约900mg、约700mg至约900mg、约700mg至约850mg、约700mg至约800mg、约700mg至约750mg、约800mg至约2,000mg、约800mg至约1,950mg、约800mg至约1,900mg、约800mg至约1,850mg、约800mg至约1,800mg、约800mg至约1,750mg、约800mg至约1,700mg、约800mg至约1,650mg、约800mg至约1,600mg、约800mg至约1,550mg、约800mg至约1,500mg、约800mg至约1,450mg、约800mg至约1,400mg、约800mg至约1,350mg、约800mg至约1,300mg、约800mg至约1,250mg、约800mg至约1,200mg、约800mg至约1,150mg、约800mg
至约1,100mg、约800mg至约1,050mg、约800mg至约1,000mg、约800mg至约950mg、约800mg至约900mg、约800mg至约900mg、约800mg至约850mg、约900mg至约2,000mg、约900mg至约1,950mg、约900mg至约1,900mg、约900mg至约1,850mg、约900mg至约1,800mg、约900mg至约1,750mg、约900mg至约1,700mg、约900mg至约1,650mg、约900mg至约1,600mg、约900mg至约1,550mg、约900mg至约1,500mg、约900mg至约1,450mg、约900mg至约1,400mg、约900mg至约1,350mg、约900mg至约1,300mg、约900mg至约1,250mg、约900mg至约1,200mg、约900mg至约1,150mg、约900mg至约1,100mg、约900mg至约1,050mg、约900mg至约1,000mg、约900mg至约950mg、约1,000mg至约2,000mg、约1,000mg至约1,950mg、约1,000mg至约1,900mg、约1,000mg至约1,850mg、约1,000mg至约1,800mg、约1,000mg至约1,750mg、约1,000mg至约1,700mg、约1,000mg至约1,650mg、约1,000mg至约1,600mg、约1,000mg至约1,550mg、约1,000mg至约1,500mg、约1,000mg至约1,450mg、约1,000mg至约1,400mg、约1,000mg至约1,350mg、约1,000mg至约1,300mg、约1,000mg至约1,250mg、约1,000mg至约1,200mg、约1,000mg至约1,150mg、约1,000mg至约1,100mg、约1,000mg至约1,050mg、约1,100mg至约2,000mg、约1,100mg至约1,950mg、约1,100mg至约1,900mg、约1,100mg至约1,850mg、约1,100mg至约1,800mg、约1,100mg至约1,750mg、约1,100mg至约1,700mg、约1,100mg至约1,650mg、约1,100mg至约1,600mg、约1,100mg至约1,550mg、约1,100mg至约1,500mg、约1,100mg至约1,450mg、约1,100mg至约1,400mg、约1,100mg至约1,350mg、约1,100mg至约1,300mg、约1,100mg至约1,250mg、约1,100mg至约1,200mg、约1,100mg至约1,150mg、约1,200mg至约2,000mg、约1,200mg至约1,950mg、约1,200mg至约1,900mg、约1,200mg至约1,850mg、约1,200mg至约1,800mg、约1,200mg至约1,750mg、约1,200mg至约1,700mg、约1,200mg至约1,650mg、约1,200mg至约1,600mg、约1,200mg至约1,550mg、约1,200mg至约1,500mg、约1,200mg至约1,450mg、约1,200mg至约1,400mg、约1,200mg至约1,350mg、约1,200mg至约1,300mg、约1,200mg至约1,250mg、约1,300mg至约2,000mg、约1,300mg至约1,950mg、约1,300mg至约1,900mg、约1,300mg至约1,850mg、约1,300mg至约1,800mg、约1,300mg至约1,750mg、约1,300mg至约1,700mg、约1,300mg至约1,650mg、约1,300mg至约1,600mg、约1,300mg至约1,550mg、约1,300mg至约1,500mg、约1,300mg至约1,450mg、约1,300mg至约1,400mg、约1,300mg至约1,350mg、约1,400mg至约2,000mg、约1,400mg至约1,950mg、约1,400mg至约1,900mg、约1,400mg至约1,850mg、约1,400mg至约1,800mg、约1,400mg至约1,750mg、约1,400mg至约1,700mg、约1,400mg至约1,650mg、约1,400mg至约1,600mg、约1,400mg至约1,550mg、约1,400mg至约1,500mg、约1,400mg至约1,450mg、约1,500mg至约2,000mg、约1,500mg至约1,950mg、约1,500mg至约1,900mg、约1,500mg至约1,850mg、约1,500mg至约1,800mg、约1,500mg至约1,750mg、约1,500mg至约1,700mg、约1,500mg至约1,650mg、约1,500mg至约1,600mg、约1,500mg至约1,550mg、约1,600mg至约2,000mg、约1,600mg至约1,950mg、约1,600mg至约1,900mg、约1,600mg至约1,850mg、约1,600mg至约1,800mg、约1,600mg至约1,750mg、约1,600mg至约1,700mg、约1,600mg至约1,650mg、约1,700mg至约2,000mg、约1,700mg至约1,950mg、约1,700mg至约1,900mg、约1,700mg至约1,850mg、约1,700mg至约1,800mg、约1,700mg至约1,750mg、约1,800mg至约2,000mg、约1,800mg至约1,950mg、约1,800mg至约1,900mg、约1,800mg至约1,850mg、约1,900mg至约2,000mg或约1,900mg至约1,950mg)。
[0273]
在一些实施方式中,一剂或多剂约0.01mg/kg至约100mg/kg(例如,约0.03mg/kg至约50mg/kg;约0.1mg/kg至约20mg/kg;约1mg/kg至约10mg/kg;约1mg/kg至约5mg/kg;约0.1mg/kg至约5mg/kg;或约1mg/kg至约2mg/kg)的如本文所述的抗体或其抗原结合片段被给予对象。在一些实施方式中,如本文所述抗体或其抗原结合片段的剂量可以低于100mg/kg、低于50mg/kg、低于20mg/kg、低于10mg/kg、低于9mg/kg、低于8mg/kg、低于7mg/kg、低于6mg/kg、低于5mg/kg、低于4mg/kg、低于3mg/kg、低于2mg/kg、低于1mg/kg、低于0.5mg/kg或低于0.1mg/kg。在一些实施方式中,如本文所述的抗体或其抗原结合片段的剂量可以高于50mg/kg、高于20mg/kg、高于10mg/kg、高于9mg/kg、高于8mg/kg、高于7mg/kg、高于6mg/kg、高于5mg/kg、高于4mg/kg、高于3mg/kg、高于2mg/kg、高于1mg/kg、高于0.5mg/kg或高于0.1mg/kg。
[0274]
在本文所述任何方法的一些实施方式中,抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3。在本文提供的任何方法的一些实施方式中,抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:4,和所述轻链可变区包含seq id no:8。
[0275]
在一些实施方式中,给予对象两剂或更多(例如,3或更多、4或更多、5或更多、6或更多、7或更多、8或更多、9或更多、10或更多、11或更多、12或更多、13或更多、14或更多、15或更多、16或更多、17或更多、18或更多、19或更多、20或更多、21或更多、22或更多、23或更多、24或更多、25或更多、26或更多、27或更多、28或更多、29或更多、30或更多、31或更多、32或更多、33或更多、34或更多、35或更多、36或更多、37或更多、38或更多、39或更多、40或更多、41或更多、42或更多、43或更多、44或更多、45或更多、46或更多、47或更多、48或更多、49或更多或50或更多)剂药物组合物(例如任何药物组合物,其包含本文所述的任何抗体或抗原结合片段)。
[0276]
在一些实施方式中,给予对象1至约50剂(例如,1至约45剂、1至约40剂、1至约35剂、1至约30剂、1至约25剂、1至约20剂、1至约18剂、1至约16剂、1至约14剂、1至约12剂、1至约10剂、1至约8剂、1至约6剂、1至约4剂、1至约2剂、约2至约50剂、约2至约45剂、约2至约40剂、约2至约35剂、约2至约30剂、约2至约25剂、约2至约20剂、约2至约18剂、约2至约16剂、约2至约14剂、约2至约12剂、约2至约10剂、约2至约8剂、约2至约6剂、约2至约4剂、约4至约50剂、约4至约45剂、约4至约40剂、约4至约35剂、约4至约30剂、约4至约25剂、约4至约20剂、约4至约18剂、约4至约16剂、约4至约14剂、约4至约12剂、约4至约10剂、约4至约8剂、约4至约6剂、约6至约50剂、约6至约45剂、约6至约40剂、约6至约35剂、约6至约30剂、约6至约25剂、约6至约20剂、约6至约18剂、约6至约16剂、约6至约14剂、约6至约12剂、约6至约10剂、约6至约8剂、约8至约50剂、约8至约45剂、约8至约40剂、约8至约35剂、约8至约30剂、约8至约25剂、约8至约20剂、约8至约18剂、约8至约16剂、约8至约14剂、约8至约12剂、约8至约10剂、约10至约50剂、约10至约45剂、约10至约40剂、约10至约35剂、约10至约30剂、约10至约25剂、约10至约20剂、约10至约18剂、约10至约16剂、约10至约14剂、约10至约12剂、约12至约50剂、约12至约45剂、约12至约40剂、约12至约35剂、约12至约30剂、约12至约25剂、约12至约20剂、约12至约18剂、约12至约16剂、约12至约14剂、约14至约50剂、约14至约45剂、约14至约
40剂、约14至约35剂、约14至约30剂、约14至约25剂、约14至约20剂、约14至约18剂、约14至约16剂、约16至约50剂、约16至约45剂、约16至约40剂、约16至约35剂、约16至约30剂、约16至约25剂、约16至约20剂、约16至约18剂、约18至约50剂、约18至约45剂、约18至约40剂、约18至约35剂、约18至约30剂、约18至约25剂、约19至约20剂、约20至约50剂、约20至约45剂、约20至约40剂、约20至约35剂、约20至约30剂、约20至约25剂、约25至约50剂、约25至约45剂、约25至约40剂、约25至约35剂、约25至约30剂、约30至约50剂、约30至约45剂、约30至约40剂、约30至约35剂、约35至约50剂、约35至约45剂、约35至约40剂、约40至约50剂、约40至约45剂或约45至约50剂)药物组合物(例如,包含本文所述任何抗体或抗原结合片段的任何药物组合物)。
[0277]
在一些实施方式中,当给予对象(例如本文所述任何对象)两剂或更多剂药物组合物(例如包含本文所述任何抗体或抗原结合片段的任何药物组合物)时,可以以约一周至约两个月(例如,约一周至约7周、约一周至约6周、约一周至约5周、约一周至约4周、约一周至约3周、约一周至约2周、约2周至约2个月、约2周至约7周、约2周至约6周、约2周至约5周、约2周至约4周、约2周至约3周、约3周至约2个月、约3周至约7周、约3周至约6周、约3周至约5周、约3周至约4周、约4周至约2个月、约4周至约7周、约4周至约6周、约4周至约5周、约5周至约2个月、约5周至约7周、约5周至约6周、约6周至约2个月、约6周至约7周或约7周至约2个月)的频率给予任何两个连续的剂量。在一些实施方式中,在整个治疗期间(第一个给予的剂量和最后给予的剂量之间的时间段)任何两个剂量之间的频率保持相同。在一些实施方式中,任何两个剂量之间的频率可以在整个治疗期间变化。
[0278]
在一些实施方式中,每两周一次给予对象100mg抗体或抗原结合片段。在一些实施方式中,每两周一次给予对象200mg抗体或抗原结合片段。在一些实施方式中,每两周一次给予对象400mg抗体或抗原结合片段。在一些实施方式中,每两周一次给予对象800mg抗体或抗原结合片段。在一些实施方式中,每两周一次给予对象1,600mg抗体或抗原结合片段。在一些实施方式中,在重复的28天周期的第1天和第15天给予对象抗体或抗原结合片段。
[0279]
b.诱导和维持给药
[0280]
在一些实施方式中,本文所述方法包括给予对象一个或多个诱导剂量的本文所述的抗体或抗原结合片段。在一些实施方式中,本文所述方法还包括给予对象一剂或多剂维持剂量的本文所述的抗体或抗原结合片段。
[0281]
在一些实施方式中,所述一个或多个诱导剂量以约100,200,400,800或1,600mg抗体或抗原结合片段独立地给予对象。在一些实施方式中,一个或多个诱导剂量是800mg抗体或抗原结合片段。在其他实施方式中,一剂或多剂诱导剂量是1,600mg抗体或抗原结合片段。
[0282]
在某些实施方式中,独立地给予对象一个或多个诱导剂量约400mg抗体或抗原结合片段至约2,000mg抗体或抗原结合片段(例如,约400mg至约1,950mg、约400mg至约1,900mg、约400mg至约1,850mg、约400mg至约1,800mg、约400mg至约1,750mg、约400mg至约1,700mg、约400mg至约1,650mg、约400mg至约1,600mg、约400mg至约1,550mg、约400mg至约1,500mg、约400mg至约1,450mg、约400mg至约1,400mg、约400mg至约1,350mg、约400mg至约1,300mg、约400mg至约1,250mg、约400mg至约1,200mg、约400mg至约1,150mg、约400mg至约1,100mg、约400mg至约1,050mg、约400mg至约1,000mg、约400mg至约950mg、约400mg至约
900mg、约400mg至约900mg、约400mg至约850mg、约400mg至约800mg、约400mg至约750mg、约400mg至约700mg、约400mg至约650mg、约400mg至约600mg、约400mg至约550mg、约400mg至约500mg、约400mg至约450mg、约500mg至约2,000mg、约500mg至约1,950mg、约500mg至约1,900mg、约500mg至约1,850mg、约500mg至约1,800mg、约500mg至约1,750mg、约500mg至约1,700mg、约500mg至约1,650mg、约500mg至约1,600mg、约500mg至约1,550mg、约500mg至约1,500mg、约500mg至约1,450mg、约500mg至约1,400mg、约500mg至约1,350mg、约500mg至约1,300mg、约500mg至约1,250mg、约500mg至约1,200mg、约500mg至约1,150mg、约500mg至约1,100mg、约500mg至约1,050mg、约500mg至约1,000mg、约500mg至约950mg、约500mg至约900mg、约500mg至约900mg、约500mg至约850mg、约500mg至约800mg、约500mg至约750mg、约500mg至约700mg、约500mg至约650mg、约500mg至约600mg、约500mg至约550mg、约600mg至约2,000mg、约600mg至约1,950mg、约600mg至约1,900mg、约600mg至约1,850mg、约600mg至约1,800mg、约600mg至约1,750mg、约600mg至约1,700mg、约600mg至约1,650mg、约600mg至约1,600mg、约600mg至约1,550mg、约600mg至约1,500mg、约600mg至约1,450mg、约600mg至约1,400mg、约600mg至约1,350mg、约600mg至约1,300mg、约600mg至约1,250mg、约600mg至约1,200mg、约600mg至约1,150mg、约600mg至约1,100mg、约600mg至约1,050mg、约600mg至约1,000mg、约600mg至约950mg、约600mg至约900mg、约600mg至约900mg、约600mg至约850mg、约600mg至约800mg、约600mg至约750mg、约600mg至约700mg、约600mg至约650mg、约700mg至约2,000mg、约700mg至约1,950mg、约700mg至约1,900mg、约700mg至约1,850mg、约700mg至约1,800mg、约700mg至约1,750mg、约700mg至约1,700mg、约700mg至约1,650mg、约700mg至约1,600mg、约700mg至约1,550mg、约700mg至约1,500mg、约700mg至约1,450mg、约700mg至约1,400mg、约700mg至约1,350mg、约700mg至约1,300mg、约700mg至约1,250mg、约700mg至约1,200mg、约700mg至约1,150mg、约700mg至约1,100mg、约700mg至约1,050mg、约700mg至约1,000mg、约700mg至约950mg、约700mg至约900mg、约700mg至约900mg、约700mg至约850mg、约700mg至约800mg、约700mg至约750mg、约800mg至约2,000mg、约800mg至约1,950mg、约800mg至约1,900mg、约800mg至约1,850mg、约800mg至约1,800mg、约800mg至约1,750mg、约800mg至约1,700mg、约800mg至约1,650mg、约800mg至约1,600mg、约800mg至约1,550mg、约800mg至约1,500mg、约800mg至约1,450mg、约800mg至约1,400mg、约800mg至约1,350mg、约800mg至约1,300mg、约800mg至约1,250mg、约800mg至约1,200mg、约800mg至约1,150mg、约800mg至约1,100mg、约800mg至约1,050mg、约800mg至约1,000mg、约800mg至约950mg、约800mg至约900mg、约800mg至约900mg、约800mg至约850mg、约900mg至约2,000mg、约900mg至约1,950mg、约900mg至约1,900mg、约900mg至约1,850mg、约900mg至约1,800mg、约900mg至约1,750mg、约900mg至约1,700mg、约900mg至约1,650mg、约900mg至约1,600mg、约900mg至约1,550mg、约900mg至约1,500mg、约900mg至约1,450mg、约900mg至约1,400mg、约900mg至约1,350mg、约900mg至约1,300mg、约900mg至约1,250mg、约900mg至约1,200mg、约900mg至约1,150mg、约900mg至约1,100mg、约900mg至约1,050mg、约900mg至约1,000mg、约900mg至约950mg、约1,000mg至约2,000mg、约1,000mg至约1,950mg、约1,000mg至约1,900mg、约1,000mg至约1,850mg、约1,000mg至约1,800mg、约1,000mg至约1,750mg、约1,000mg至约1,700mg、约1,000mg至约1,650mg、约1,000mg至约1,600mg、约1,000mg至约1,550mg、约1,000mg至约1,500mg、约1,000mg至约1,450mg、约1,000mg至约1,400mg、约1,
000mg至约1,350mg、约1,000mg至约1,300mg、约1,000mg至约1,250mg、约1,000mg至约1,200mg、约1,000mg至约1,150mg、约1,000mg至约1,100mg、约1,000mg至约1,050mg、约1,100mg至约2,000mg、约1,100mg至约1,950mg、约1,100mg至约1,900mg、约1,100mg至约1,850mg、约1,100mg至约1,800mg、约1,100mg至约1,750mg、约1,100mg至约1,700mg、约1,100mg至约1,650mg、约1,100mg至约1,600mg、约1,100mg至约1,550mg、约1,100mg至约1,500mg、约1,100mg至约1,450mg、约1,100mg至约1,400mg、约1,100mg至约1,350mg、约1,100mg至约1,300mg、约1,100mg至约1,250mg、约1,100mg至约1,200mg、约1,100mg至约1,150mg、约1,200mg至约2,000mg、约1,200mg至约1,950mg、约1,200mg至约1,900mg、约1,200mg至约1,850mg、约1,200mg至约1,800mg、约1,200mg至约1,750mg、约1,200mg至约1,700mg、约1,200mg至约1,650mg、约1,200mg至约1,600mg、约1,200mg至约1,550mg、约1,200mg至约1,500mg、约1,200mg至约1,450mg、约1,200mg至约1,400mg、约1,200mg至约1,350mg、约1,200mg至约1,300mg、约1,200mg至约1,250mg、约1,300mg至约2,000mg、约1,300mg至约1,950mg、约1,300mg至约1,900mg、约1,300mg至约1,850mg、约1,300mg至约1,800mg、约1,300mg至约1,750mg、约1,300mg至约1,700mg、约1,300mg至约1,650mg、约1,300mg至约1,600mg、约1,300mg至约1,550mg、约1,300mg至约1,500mg、约1,300mg至约1,450mg、约1,300mg至约1,400mg、约1,300mg至约1,350mg、约1,400mg至约2,000mg、约1,400mg至约1,950mg、约1,400mg至约1,900mg、约1,400mg至约1,850mg、约1,400mg至约1,800mg、约1,400mg至约1,750mg、约1,400mg至约1,700mg、约1,400mg至约1,650mg、约1,400mg至约1,600mg、约1,400mg至约1,550mg、约1,400mg至约1,500mg、约1,400mg至约1,450mg、约1,500mg至约2,000mg、约1,500mg至约1,950mg、约1,500mg至约1,900mg、约1,500mg至约1,850mg、约1,500mg至约1,800mg、约1,500mg至约1,750mg、约1,500mg至约1,700mg、约1,500mg至约1,650mg、约1,500mg至约1,600mg、约1,500mg至约1,550mg、约1,600mg至约2,000mg、约1,600mg至约1,950mg、约1,600mg至约1,900mg、约1,600mg至约1,850mg、约1,600mg至约1,800mg、约1,600mg至约1,750mg、约1,600mg至约1,700mg、约1,600mg至约1,650mg、约1,700mg至约2,000mg、约1,700mg至约1,950mg、约1,700mg至约1,900mg、约1,700mg至约1,850mg、约1,700mg至约1,800mg、约1,700mg至约1,750mg、约1,800mg至约2,000mg、约1,800mg至约1,950mg、约1,800mg至约1,900mg、约1,800mg至约1,850mg、约1,900mg至约2,000mg或约1,900mg至约1,950mg)。在一些实施方式中,一个或多个1600mg诱导剂量的药物组合物独立地给予对象。在一些实施方式中,一个或多个800mg诱导剂量的药物组合物独立地给予对象。
[0283]
在一些实施方式中,给予对象1至约50个诱导剂量(例如,1至约45个剂量、1至约40个剂量、1至约35个剂量、1至约30个剂量、1至约25个剂量、1至约20个剂量、1至约18个剂量、1至约16个剂量、1至约14个剂量、1至约12个剂量、1至约10个剂量、1至约8个剂量、1至约6个剂量、1至约4个剂量、1至约2个剂量、约2至约50个剂量、约2至约45个剂量、约2至约40个剂量、约2至约35个剂量、约2至约30个剂量、约2至约25个剂量、约2至约20个剂量、约2至约18个剂量、约2至约16个剂量、约2至约14个剂量、约2至约12个剂量、约2至约10个剂量、约2至约8个剂量、约2至约6个剂量、约2至约4个剂量、约4至约50个剂量、约4至约45个剂量、约4至约40个剂量、约4至约35个剂量、约4至约30个剂量、约4至约25个剂量、约4至约20个剂量、约4至约18个剂量、约4至约16个剂量、约4至约14个剂量、约4至约12个剂量、约4至约10个剂
量、约4至约8个剂量、约4至约6个剂量、约6至约50个剂量、约6至约45个剂量、约6至约40个剂量、约6至约35个剂量、约6至约30个剂量、约6至约25个剂量、约6至约20个剂量、约6至约18个剂量、约6至约16个剂量、约6至约14个剂量、约6至约12个剂量、约6至约10个剂量、约6至约8个剂量、约8至约50个剂量、约8至约45个剂量、约8至约40个剂量、约8至约35个剂量、约8至约30个剂量、约8至约25个剂量、约8至约20个剂量、约8至约18个剂量、约8至约16个剂量、约8至约14个剂量、约8至约12个剂量、约8至约10个剂量、约10至约50个剂量、约10至约45个剂量、约10至约40个剂量、约10至约35个剂量、约10至约30个剂量、约10至约25个剂量、约10至约20个剂量、约10至约18个剂量、约10至约16个剂量、约10至约14个剂量、约10至约12个剂量、约12至约50个剂量、约12至约45个剂量、约12至约40个剂量、约12至约35个剂量、约12至约30个剂量、约12至约25个剂量、约12至约20个剂量、约12至约18个剂量、约12至约16个剂量、约12至约14个剂量、约14至约50个剂量、约14至约45个剂量、约14至约40个剂量、约14至约35个剂量、约14至约30个剂量、约14至约25个剂量、约14至约20个剂量、约14至约18个剂量、约14至约16个剂量、约16至约50个剂量、约16至约45个剂量、约16至约40个剂量、约16至约35个剂量、约16至约30个剂量、约16至约25个剂量、约16至约20个剂量、约16至约18个剂量、约18至约50个剂量、约18至约45个剂量、约18至约40个剂量、约18至约35个剂量、约18至约30个剂量、约18至约25个剂量、约19至约20个剂量、约20至约50个剂量、约20至约45个剂量、约20至约40个剂量、约20至约35个剂量、约20至约30个剂量、约20至约25个剂量、约25至约50个剂量、约25至约45个剂量、约25至约40个剂量、约25至约35个剂量、约25至约30个剂量、约30至约50个剂量、约30至约45个剂量、约30至约40个剂量、约30至约35个剂量、约35至约50个剂量、约35至约45个剂量、约35至约40个剂量、约40至约50个剂量、约40至约45个剂量或约45至约50个剂量)药物组合物(例如,包含本文所述任何抗体或抗原结合片段的任何药物组合物)。在一些实施方式中,给予对象约1至约3个诱导剂量的药物组合物(例如包含本文所述任何抗体或抗原结合片段的任何药物组合物)。
[0284]
在一些实施方式中,当给予对象(例如本文所述任何对象)两个或更多维持剂量的药物组合物(例如包含本文所述任何抗体或抗原结合片段的任何药物组合物)时,可以以约一周至约两个月(例如,约1周至约7周、约1周至约6周、约1周至约5周、约1周至约4周、约1周至约3周、约1周至约2周、约2周至约2个月、约2周至约7周、约2周至约6周、约2周至约5周、约2周至约4周、约2周至约3周、约3周至约2个月、约3周至约7周、约3周至约6周、约3周至约5周、约3周至约4周、约4周至约2个月、约4周至约7周、约4周至约6周、约4周至约5周、约5周至约2个月、约5周至约7周、约5周至约6周、约6周至约2个月、约6周至约7周或约7周至约2个月)的频率给予任何两个连续的诱导剂量。在一些实施方式中,在整个同一治疗期间任何两个剂量之间的频率仍然不变(第一个给予的剂量和最后给予的剂量之间的时间段)。在一些实施方式中,每周一次给予诱导剂量。在一些实施方式中,任何两个剂量之间的频率可以在整个治疗期间变化。
[0285]
在一些实施方式中,所述一个或多个维持剂量以约100、200、400、800或1,600mg抗体或抗原结合蛋白独立地给予对象。在一些实施方式中,一个或多个维持剂量是800mg抗体或抗原结合片段。在其他实施方式中,一个或多个维持剂量是1,600mg抗体或抗原结合片段。
[0286]
在某些实施方式中,独立地给予对象一个或多个维持剂量,以约400mg抗体或抗原
结合片段至约2,000mg抗体或抗原结合片段(例如,约400mg至约1,950mg、约400mg至约1,900mg、约400mg至约1,850mg、约400mg至约1,800mg、约400mg至约1,750mg、约400mg至约1,700mg、约400mg至约1,650mg、约400mg至约1,600mg、约400mg至约1,550mg、约400mg至约1,500mg、约400mg至约1,450mg、约400mg至约1,400mg、约400mg至约1,350mg、约400mg至约1,300mg、约400mg至约1,250mg、约400mg至约1,200mg、约400mg至约1,150mg、约400mg至约1,100mg、约400mg至约1,050mg、约400mg至约1,000mg、约400mg至约950mg、约400mg至约900mg、约400mg至约900mg、约400mg至约850mg、约400mg至约800mg、约400mg至约750mg、约400mg至约700mg、约400mg至约650mg、约400mg至约600mg、约400mg至约550mg、约400mg至约500mg、约400mg至约450mg、约500mg至约2,000mg、约500mg至约1,950mg、约500mg至约1,900mg、约500mg至约1,850mg、约500mg至约1,800mg、约500mg至约1,750mg、约500mg至约1,700mg、约500mg至约1,650mg、约500mg至约1,600mg、约500mg至约1,550mg、约500mg至约1,500mg、约500mg至约1,450mg、约500mg至约1,400mg、约500mg至约1,350mg、约500mg至约1,300mg、约500mg至约1,250mg、约500mg至约1,200mg、约500mg至约1,150mg、约500mg至约1,100mg、约500mg至约1,050mg、约500mg至约1,000mg、约500mg至约950mg、约500mg至约900mg、约500mg至约900mg、约500mg至约850mg、约500mg至约800mg、约500mg至约750mg、约500mg至约700mg、约500mg至约650mg、约500mg至约600mg、约500mg至约550mg、约600mg至约2,000mg、约600mg至约1,950mg、约600mg至约1,900mg、约600mg至约1,850mg、约600mg至约1,800mg、约600mg至约1,750mg、约600mg至约1,700mg、约600mg至约1,650mg、约600mg至约1,600mg、约600mg至约1,550mg、约600mg至约1,500mg、约600mg至约1,450mg、约600mg至约1,400mg、约600mg至约1,350mg、约600mg至约1,300mg、约600mg至约1,250mg、约600mg至约1,200mg、约600mg至约1,150mg、约600mg至约1,100mg、约600mg至约1,050mg、约600mg至约1,000mg、约600mg至约950mg、约600mg至约900mg、约600mg至约900mg、约600mg至约850mg、约600mg至约800mg、约600mg至约750mg、约600mg至约700mg、约600mg至约650mg、约700mg至约2,000mg、约700mg至约1,950mg、约700mg至约1,900mg、约700mg至约1,850mg、约700mg至约1,800mg、约700mg至约1,750mg、约700mg至约1,700mg、约700mg至约1,650mg、约700mg至约1,600mg、约700mg至约1,550mg、约700mg至约1,500mg、约700mg至约1,450mg、约700mg至约1,400mg、约700mg至约1,350mg、约700mg至约1,300mg、约700mg至约1,250mg、约700mg至约1,200mg、约700mg至约1,150mg、约700mg至约1,100mg、约700mg至约1,050mg、约700mg至约1,000mg、约700mg至约950mg、约700mg至约900mg、约700mg至约900mg、约700mg至约850mg、约700mg至约800mg、约700mg至约750mg、约800mg至约2,000mg、约800mg至约1,950mg、约800mg至约1,900mg、约800mg至约1,850mg、约800mg至约1,800mg、约800mg至约1,750mg、约800mg至约1,700mg、约800mg至约1,650mg、约800mg至约1,600mg、约800mg至约1,550mg、约800mg至约1,500mg、约800mg至约1,450mg、约800mg至约1,400mg、约800mg至约1,350mg、约800mg至约1,300mg、约800mg至约1,250mg、约800mg至约1,200mg、约800mg至约1,150mg、约800mg至约1,100mg、约800mg至约1,050mg、约800mg至约1,000mg、约800mg至约950mg、约800mg至约900mg、约800mg至约900mg、约800mg至约850mg、约900mg至约2,000mg、约900mg至约1,950mg、约900mg至约1,900mg、约900mg至约1,850mg、约900mg至约1,800mg、约900mg至约1,750mg、约900mg至约1,700mg、约900mg至约1,650mg、约900mg至约1,600mg、约900mg至约1,550mg、约900mg至约1,500mg、约900mg至约1,450mg、约900mg至约1,400mg、
约900mg至约1,350mg、约900mg至约1,300mg、约900mg至约1,250mg、约900mg至约1,200mg、约900mg至约1,150mg、约900mg至约1,100mg、约900mg至约1,050mg、约900mg至约1,000mg、约900mg至约950mg、约1,000mg至约2,000mg、约1,000mg至约1,950mg、约1,000mg至约1,900mg、约1,000mg至约1,850mg、约1,000mg至约1,800mg、约1,000mg至约1,750mg、约1,000mg至约1,700mg、约1,000mg至约1,650mg、约1,000mg至约1,600mg、约1,000mg至约1,550mg、约1,000mg至约1,500mg、约1,000mg至约1,450mg、约1,000mg至约1,400mg、约1,000mg至约1,350mg、约1,000mg至约1,300mg、约1,000mg至约1,250mg、约1,000mg至约1,200mg、约1,000mg至约1,150mg、约1,000mg至约1,100mg、约1,000mg至约1,050mg、约1,100mg至约2,000mg、约1,100mg至约1,950mg、约1,100mg至约1,900mg、约1,100mg至约1,850mg、约1,100mg至约1,800mg、约1,100mg至约1,750mg、约1,100mg至约1,700mg、约1,100mg至约1,650mg、约1,100mg至约1,600mg、约1,100mg至约1,550mg、约1,100mg至约1,500mg、约1,100mg至约1,450mg、约1,100mg至约1,400mg、约1,100mg至约1,350mg、约1,100mg至约1,300mg、约1,100mg至约1,250mg、约1,100mg至约1,200mg、约1,100mg至约1,150mg、约1,200mg至约2,000mg、约1,200mg至约1,950mg、约1,200mg至约1,900mg、约1,200mg至约1,850mg、约1,200mg至约1,800mg、约1,200mg至约1,750mg、约1,200mg至约1,700mg、约1,200mg至约1,650mg、约1,200mg至约1,600mg、约1,200mg至约1,550mg、约1,200mg至约1,500mg、约1,200mg至约1,450mg、约1,200mg至约1,400mg、约1,200mg至约1,350mg、约1,200mg至约1,300mg、约1,200mg至约1,250mg、约1,300mg至约2,000mg、约1,300mg至约1,950mg、约1,300mg至约1,900mg、约1,300mg至约1,850mg、约1,300mg至约1,800mg、约1,300mg至约1,750mg、约1,300mg至约1,700mg、约1,300mg至约1,650mg、约1,300mg至约1,600mg、约1,300mg至约1,550mg、约1,300mg至约1,500mg、约1,300mg至约1,450mg、约1,300mg至约1,400mg、约1,300mg至约1,350mg、约1,400mg至约2,000mg、约1,400mg至约1,950mg、约1,400mg至约1,900mg、约1,400mg至约1,850mg、约1,400mg至约1,800mg、约1,400mg至约1,750mg、约1,400mg至约1,700mg、约1,400mg至约1,650mg、约1,400mg至约1,600mg、约1,400mg至约1,550mg、约1,400mg至约1,500mg、约1,400mg至约1,450mg、约1,500mg至约2,000mg、约1,500mg至约1,950mg、约1,500mg至约1,900mg、约1,500mg至约1,850mg、约1,500mg至约1,800mg、约1,500mg至约1,750mg、约1,500mg至约1,700mg、约1,500mg至约1,650mg、约1,500mg至约1,600mg、约1,500mg至约1,550mg、约1,600mg至约2,000mg、约1,600mg至约1,950mg、约1,600mg至约1,900mg、约1,600mg至约1,850mg、约1,600mg至约1,800mg、约1,600mg至约1,750mg、约1,600mg至约1,700mg、约1,600mg至约1,650mg、约1,700mg至约2,000mg、约1,700mg至约1,950mg、约1,700mg至约1,900mg、约1,700mg至约1,850mg、约1,700mg至约1,800mg、约1,700mg至约1,750mg、约1,800mg至约2,000mg、约1,800mg至约1,950mg、约1,800mg至约1,900mg、约1,800mg至约1,850mg、约1,900mg至约2,000mg或约1,900mg至约1,950mg)。在一些实施方式中,一个或多个1600mg维持剂量的药物组合物独立地给予对象。
[0287]
在一些实施方式中,给予对象1至约50个维持剂量(例如,1至约45剂、1至约40剂、1至约35剂、1至约30剂、1至约25剂、1至约20剂、1至约18剂、1至约16剂、1至约14剂、1至约12剂、1至约10剂、1至约8剂、1至约6剂、1至约4剂、1至约2剂、约2至约50剂、约2至约45剂、约2至约40剂、约2至约35剂、约2至约30剂、约2至约25剂、约2至约20剂、约2至约18剂、约2至约
16剂、约2至约14剂、约2至约12剂、约2至约10剂、约2至约8剂、约2至约6剂、约2至约4剂、约4至约50剂、约4至约45剂、约4至约40剂、约4至约35剂、约4至约30剂、约4至约25剂、约4至约20剂、约4至约18剂、约4至约16剂、约4至约14剂、约4至约12剂、约4至约10剂、约4至约8剂、约4至约6剂、约6至约50剂、约6至约45剂、约6至约40剂、约6至约35剂、约6至约30剂、约6至约25剂、约6至约20剂、约6至约18剂、约6至约16剂、约6至约14剂、约6至约12剂、约6至约10剂、约6至约8剂、约8至约50剂、约8至约45剂、约8至约40剂、约8至约35剂、约8至约30剂、约8至约25剂、约8至约20剂、约8至约18剂、约8至约16剂、约8至约14剂、约8至约12剂、约8至约10剂、约10至约50剂、约10至约45剂、约10至约40剂、约10至约35剂、约10至约30剂、约10至约25剂、约10至约20剂、约10至约18剂、约10至约16剂、约10至约14剂、约10至约12剂、约12至约50剂、约12至约45剂、约12至约40剂、约12至约35剂、约12至约30剂、约12至约25剂、约12至约20剂、约12至约18剂、约12至约16剂、约12至约14剂、约14至约50剂、约14至约45剂、约14至约40剂、约14至约35剂、约14至约30剂、约14至约25剂、约14至约20剂、约14至约18剂、约14至约16剂、约16至约50剂、约16至约45剂、约16至约40剂、约16至约35剂、约16至约30剂、约16至约25剂、约16至约20剂、约16至约18剂、约18至约50剂、约18至约45剂、约18至约40剂、约18至约35剂、约18至约30剂、约18至约25剂、约19至约20剂、约20至约50剂、约20至约45剂、约20至约40剂、约20至约35剂、约20至约30剂、约20至约25剂、约25至约50剂、约25至约45剂、约25至约40剂、约25至约35剂、约25至约30剂、约30至约50剂、约30至约45剂、约30至约40剂、约30至约35剂、约35至约50剂、约35至约45剂、约35至约40剂、约40至约50剂、约40至约45剂或约45至约50剂)药物组合物(例如,包含本文所述任何抗体或抗原结合片段的任何药物组合物)。
[0288]
在一些实施方式中,当给予对象(例如本文所述任何对象)两个或更多维持剂量的药物组合物(例如包含本文所述任何抗体或抗原结合片段的任何药物组合物)时,可以以约一周至约两个月(例如,约1周至约7周、约1周至约6周、约1周至约5周、约1周至约4周、约1周至约3周、约1周至约2周、约2周至约2个月、约2周至约7周、约2周至约6周、约2周至约5周、约2周至约4周、约2周至约3周、约3周至约2个月、约3周至约7周、约3周至约6周、约3周至约5周、约3周至约4周、约4周至约2个月、约4周至约7周、约4周至约6周、约4周至约5周、约5周至约2个月、约5周至约7周、约5周至约6周、约6周至约2个月、约6周至约7周或约7周至约2个月)的频率给予任何两个连续的维持剂量。在一些实施方式中,在整个同一治疗期间任何两个剂量之间的频率仍然不变(第一个给予的剂量和最后给予的剂量之间的时间段)。在一些实施方式中,每两周给予维持剂量。在一些实施方式中,任何两个剂量之间的频率可以在整个治疗期间变化。
[0289]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或其抗原结合片段。例如,可以每两周一次给予对象至少或约800mg抗-bcma抗体或其抗原结合片段。在一些情况下,可以每两周一次给予对象至少或约1,600mg抗-bcma抗体或其抗原结合片段。
[0290]
在一些实施方式中,在前8周内每周一次给予对象本文所述的抗-bcma抗体或其抗原结合片段,然后每两周一次。例如,可以在前8周内每周一次给予对象至少或约800mg抗-bcma抗体或其抗原结合片段,然后每两周一次。在一些情况下,可以在前8周内每周一次给予对象至少或约1,600mg抗-bcma抗体或其抗原结合片段,然后每两周一次。
[0291]
在一些实施方式中,在两个28天周期内每周一次给予对象本文所述的抗-bcma抗
体或其抗原结合片段,然后在后续的28天周期内每两周一次。例如,可以在两个28天周期内每周一次给予对象至少或约800mg抗-bcma抗体或其抗原结合片段,然后在后续的28天周期内每两周一次。在一些情况下,可以在两个28天周期内每周一次给予对象至少或约1,600mg抗-bcma抗体或其抗原结合片段,然后在后续的28天周期内每两周一次。
[0292]
c.治疗期
[0293]
在一些实施方式中,治疗期可以是约1周至约5年(例如,约1周至约4.5年、约1周至约4年、约1周至约3.5年、约1周至约3年、约1周至约2.5年、约1周至约2年、约1周至约1.5年、约1周至约1年、约1周至约10个月、约1周至约8个月、约1周至约6个月、约1周至约4个月、约1周至约2个月、约1周至约1个月、约1周至约2周、约2周至约5年、约2周至约4.5年、约2周至约4年、约2周至约3.5年、约2周至约3年、约2周至约2.5年、约2周至约2年、约2周至约1.5年、约2周至约1年、约2周至约10个月、约2周至约8个月、约2周至约6个月、约2周至约4个月、约2周至约2个月、约2周至约1个月、约1个月至约5年、约1个月至约4.5年、约1个月至约4年、约1个月至约3.5年、约1个月至约3年、约1个月至约2.5年、约1个月至约2年、约1个月至约1.5年、约1个月至约1年、约1个月至约10个月、约1个月至约8个月、约1个月至约6个月、约1个月至约4个月、约1个月至约2个月、约2个月至约5年、约2个月至约4.5年、约2个月至约4年、约2个月至约3.5年、约2个月至约3年、约2个月至约2.5年、约2个月至约2年、约2个月至约1.5年、约2个月至约1年、约2个月至约10个月、约2个月至约8个月、约2个月至约6个月、约2个月至约4个月、约4个月至约5年、约4个月至约4.5年、约4个月至约4年、约4个月至约3.5年、约4个月至约3年、约4个月至约2.5年、约4个月至约2年、约4个月至约1.5年、约4个月至约1年、约4个月至约10个月、约4个月至约8个月、约4个月至约6个月、约6个月至约5年、约6个月至约4.5年、约6个月至约4年、约6个月至约3.5年、约6个月至约3年、约6个月至约2.5年、约6个月至约2年、约6个月至约1.5年、约6个月至约1年、约6个月至约10个月、约6个月至约8个月、约8个月至约5年、约8个月至约4.5年、约8个月至约4年、约8个月至约3.5年、约8个月至约3年、约8个月至约2.5年、约8个月至约2年、约8个月至约1.5年、约8个月至约1年、约8个月至约10个月、约10个月至约5年、约10个月至约4.5年、约10个月至约4年、约10个月至约3.5年、约10个月至约3年、约10个月至约2.5年、约10个月至约2年、约10个月至约1.5年、约10个月至约1年、约1年至约5年、约1年至约4.5年、约1年至约4年、约1年至约3.5年、约1年至约3年、约1年至约2.5年、约1年至约2年、约1年至约1.5年、约1.5年至约5年、约1.5年至约4.5年、约1.5年至约4年、约1.5年至约3.5年、约1.5年至约3年、约1.5年至约2.5年、约1.5年至约2年、约2年至约5年、约2年至约4.5年、约2年至约4年、约2年至约3.5年、约2年至约3年、约2年至约2.5年、约2.5年至约5年、约2.5年至约4.5年、约2.5年至约4年、约2/5年至约3.5年、约2.5年至约3年、约3年至约5年、约3年至约4.5年、约3年至约4年、约3年至约3.5年、约3.5年至约5年、约3.5年至约4.5年、约3.5年至约4年、约4年至约5年、约4年至约4.5年或约4.5年至约5年)。
[0294]
对象中多发性骨髓瘤的有效治疗是指减少疾病严重程度、降低发展速度,和/或减少对象中多发性骨髓瘤的症状的数量、频率、严重程度和/或持续时间中的一个或多个。在一些情况下,相较于历史对照或同一对象过去的经验,可以在对象身上观察到治疗的效果。在其他情况下,在临床前或临床试验中,经治疗的对象的群体相较于未接受治疗或安慰剂治疗的对象的对照群体,可以证明治疗效果。
[0295]
在一些实施方式中,以每两周一次的频率给予药物组合物(例如,包含本文所述的
任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,每周一次以1600mg固定剂量给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,每两周一次以1600mg固定剂量给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,每周一次以800mg固定剂量给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,每两周一次以800mg固定剂量给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。
[0296]
在一些实施方式中,本文还提供了治疗患有多发性骨髓瘤的对象的方法,该方法包括给予对象一个或多个剂量的药物组合物,其包括:(i)特异性结合至b细胞成熟抗原(bcma)的抗体或其抗原结合片段,和(ii)药学上可接受的运载体。在一些实施方式中,多发性骨髓瘤是复发的或难治性多发性骨髓瘤(rrmm)。在一些实施方式中,抗体或其抗原结合片段,包括:重链可变区和轻链可变结构域,所述重链可变区包括含有seq id no:1的cdr1、含有seq id no:2的cdr2和含有seq id no:3的cdr3,以及轻链可变结构域包括含有seq id no:5的cdr1、含有seq id no:6的cdr2和含有seq id no:7的cdr3。在一些实施方式中,抗体是igg1抗体。
[0297]
在一些实施方式中,一剂或多剂1600mg的抗体或其抗原结合片段以每两周一次的频率独立地给予对象。在一些实施方式中,一剂或多剂800mg的抗体或其抗原结合片段以每周一次的频率独立地给予对象。在一些实施方式中,约1-2个诱导剂量约1600mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对象。在一些实施方式中,约1-2个诱导剂量约800mg抗体或其抗原结合片段以每周的频率独立地给予对象,随后一个或多个维持剂量约1600mg抗体或其抗原结合片段以每两周的频率独立地给予对象。
[0298]
在一些实施方式中,之前给予所述对象针对多发性骨髓瘤的一种或多种治疗剂或治疗。针对多发性骨髓瘤的一个或多个先前给予的治疗剂或治疗包括但不限于蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体。
[0299]
具体地,蛋白酶体抑制剂是作用机制为抑制蛋白酶体的试剂。示例性蛋白酶体抑制剂包括但不限于硼替佐米、卡非佐米和伊沙佐米。免疫调节药物(imid)是沙利度胺类似物,其具有多效抗骨髓瘤特性,包括免疫调节、抗血管生成、抗炎和抗增殖作用。免疫调节酰亚胺药物(imid)是含有和“酰亚胺”基团的免疫调节剂。示例性的imid包括但不限于来那度胺、泊马度胺、沙利度胺和伊贝多胺(iberdomide)(cc-220,celgene)。示例性的抗-cd38抗体包括但不限于达雷木单抗和艾萨妥昔单抗(isatuximab)。
[0300]
在一些实施方式中,先前给予的一个或多个治疗剂或治疗在治疗多发性骨髓瘤中无效。在一些实施方式中,对象具有一项或多项可测量的疾病,包括:血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl、尿液m-蛋白水平≥200mg/24小时、血清免疫球蛋白游离轻链≥10mg/dl和/或血清免疫球蛋白κ对λ游离轻链比率异常。
[0301]
d.给药途径
[0302]
可以肠胃外给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,可以静脉内、皮下、动脉内、颅内、
鞘内、腹膜内或肌肉内给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。也可以直接肿瘤局部给药。通过静脉或皮下给予给药进入全身循环。在一些实施方式中,全身给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)。在一些实施方式中,全身给予药物组合物(例如,包含本文所述的任何抗体或抗原结合片段的本文所述的任何示例性药物组合物)是静脉内给予。
[0303]
例如,通过分步输注或单次推注注射进行静脉内给药。在一些实施方式中,进行分步输注是使用以下输注率:约20mg/小时至约500mg/小时(例如,约20mg/小时至约450mg/小时、约20mg/小时至约400mg/小时、约20mg/小时至约350mg/小时、约20mg/小时至约300mg/小时、约20mg/小时至约250mg/小时、约20mg/小时至约200mg/小时、约20mg/小时至约180mg/小时、约20mg/小时至约160mg/小时、约20mg/小时至约140mg/小时、约20mg/小时至约120mg/小时、约20mg/小时至约100mg/小时、约20mg/小时至约80mg/小时、约20mg/小时至约60mg/小时、约20mg/小时至约50mg/小时、约20mg/小时至约40mg/小时、约40mg/小时至约500mg/小时、约40mg/小时至约450mg/小时、约40mg/小时至约400mg/小时、约40mg/小时至约350mg/小时、约40mg/小时至约300mg/小时、约40mg/小时至约250mg/小时、约40mg/小时至约200mg/小时、约40mg/小时至约180mg/小时、约40mg/小时至约160mg/小时、约40mg/小时至约140mg/小时、约40mg/小时至约120mg/小时、约40mg/小时至约100mg/小时、约40mg/小时至约80mg/小时、约40mg/小时至约60mg/小时、约40mg/小时至约50mg/小时、约50mg/小时至约500mg/小时、约50mg/小时至约450mg/小时、约50mg/小时至约400mg/小时、约50mg/小时至约350mg/小时、约50mg/小时至约300mg/小时、约50mg/小时至约250mg/小时、约50mg/小时至约200mg/小时、约50mg/小时至约180mg/小时、约50mg/小时至约160mg/小时、约50mg/小时至约140mg/小时、约50mg/小时至约120mg/小时、约50mg/小时至约100mg/小时、约50mg/小时至约80mg/小时、约50mg/小时至约60mg/小时、约60mg/小时至约500mg/小时、约60mg/小时至约450mg/小时、约60mg/小时至约400mg/小时、约60mg/小时至约350mg/小时、约60mg/小时至约300mg/小时、约60mg/小时至约250mg/小时、约60mg/小时至约200mg/小时、约60mg/小时至约180mg/小时、约60mg/小时至约160mg/小时、约60mg/小时至约140mg/小时、约60mg/小时至约120mg/小时、约60mg/小时至约100mg/小时、约60mg/小时至约80mg/小时、约80mg/小时至约500mg/小时、约80mg/小时至约450mg/小时、约80mg/小时至约400mg/小时、约80mg/小时至约350mg/小时、约80mg/小时至约300mg/小时、约80mg/小时至约250mg/小时、约80mg/小时至约200mg/小时、约80mg/小时至约180mg/小时、约80mg/小时至约160mg/小时、约80mg/小时至约140mg/小时、约80mg/小时至约120mg/小时、约80mg/小时至约100mg/小时、约100mg/小时至约500mg/小时、约100mg/小时至约450mg/小时、约100mg/小时至约400mg/小时、约100mg/小时至约350mg/小时、约100mg/小时至约300mg/小时、约100mg/小时至约250mg/小时、约100mg/小时至约200mg/小时、约100mg/小时至约180mg/小时、约100mg/小时至约160mg/小时、约100mg/小时至约140mg/小时、约100mg/小时至约120mg/小时、约120mg/小时至约500mg/小时、约120mg/小时至约450mg/小时、约120mg/小时至约400mg/小时、约120mg/小时至约350mg/小时、约120mg/小时至约300mg/小时、约120mg/小时至约250mg/小时、约120mg/小时至约200mg/小时、约120mg/小时至约180mg/小时、约120mg/小时至约160mg/小时、约120mg/小时至约140mg/小时、约140mg/小时
至约500mg/小时、约140mg/小时至约450mg/小时、约140mg/小时至约400mg/小时、约140mg/小时至约350mg/小时、约140mg/小时至约300mg/小时、约140mg/小时至约250mg/小时、约140mg/小时至约200mg/小时、约140mg/小时至约180mg/小时、约140mg/小时至约160mg/小时、约160mg/小时至约500mg/小时、约160mg/小时至约450mg/小时、约160mg/小时至约400mg/小时、约160mg/小时至约350mg/小时、约160mg/小时至约300mg/小时、约160mg/小时至约250mg/小时、约160mg/小时至约200mg/小时、约160mg/小时至约180mg/小时、约180mg/小时至约500mg/小时、约180mg/小时至约450mg/小时、约180mg/小时至约400mg/小时、约180mg/小时至约350mg/小时、约180mg/小时至约300mg/小时、约180mg/小时至约250mg/小时、约180mg/小时至约200mg/小时、约200mg/小时至约500mg/小时、约200mg/小时至约450mg/小时、约200mg/小时至约400mg/小时、约200mg/小时至约350mg/小时、约200mg/小时至约300mg/小时、约200mg/小时至约250mg/小时、约250mg/小时至约500mg/小时、约250mg/小时至约450mg/小时、约250mg/小时至约400mg/小时、约250mg/小时至约350mg/小时、约250mg/小时至约300mg/小时、约300mg/小时至约500mg/小时、约300mg/小时至约450mg/小时、约300mg/小时至约400mg/小时、约300mg/小时至约350mg/小时、约350mg/小时至约500mg/小时、约350mg/小时至约450mg/小时、约350mg/小时至约400mg/小时、约400mg/小时至约500mg/小时、约400mg/小时至约450mg/小时或约450mg/小时至约500mg/小时)。
[0304]
在一些实施方式中,分步输注率约每10分钟增加。在一些实施方式中,分步输注率约每20分钟增加。在一些实施方式中,分步输注率约每30分钟增加。在一些实施方式中,分步输注率约每40分钟增加。在一些实施方式中,分步输注率约每50分钟增加。在一些实施方式中,分步输注率约每60分钟增加。在一些实施方式中,在分步输注期间,所述输注率约每30分钟增加不超过约两倍。
[0305]
e.药代动力学效应
[0306]
在一些实施方式中,使用本文所述的任何方法,给予本文所述药物组合物,导致抗体或其抗原结合片段稳态浓度,在对象的血清中,能够结合至至少50%、至少60%、至少70%、至少80%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的表达在对象肿瘤细胞表面的bcma。
[0307]
在某些实施方式中,在该剂量和输注率下给予抗体或抗原结合片段,使抗体或抗原结合片段的半衰期至少为4、5、6、7、8、9、10、11、12、13、14或15天。在其他实施方式中,半衰期为至少一周、至少两周、至少三周或至少四周。
[0308]
这些方法的一些实施方式导致对象血清中的抗体或其抗原结合片段的稳态浓度为约1μg/ml至约200μg/ml(例如,约1μg/ml至约180μg/ml、约1μg/ml至约160μg/ml、约1μg/ml至约140μg/ml、约1μg/ml至约120μg/ml、约1μg/ml至约100μg/ml、约1μg/ml至约90μg/ml、约1μg/ml至约80μg/ml、约1μg/ml至约70μg/ml、约1μg/ml至约60μg/ml、约1μg/ml至约50μg/ml、约1μg/ml至约40μg/ml、约1μg/ml至约30μg/ml、约1μg/ml至约20μg/ml、约1μg/ml至约10μg/ml、约10μg/ml至约200μg/ml、约10μg/ml至约180μg/ml、约10μg/ml至约160μg/ml、约10μg/ml至约140μg/ml、约10μg/ml至约120μg/ml、约10μg/ml至约100μg/ml、约10μg/ml至约90μg/ml、约10μg/ml至约80μg/ml、约10μg/ml至约70μg/ml、约10μg/ml至约60μg/ml、约10μg/ml至约50μg/ml、约10μg/ml至约40μg/ml、约10μg/ml至约30μg/ml、约10μg/ml至约20μg/ml、约20μg/ml至约200μg/ml、约20μg/ml至约180μg/ml、约20μg/ml至约160μg/ml、约20μg/ml至约
140μg/ml、约20μg/ml至约120μg/ml、约20μg/ml至约100μg/ml、约20μg/ml至约90μg/ml、约20μg/ml至约80μg/ml、约20μg/ml至约70μg/ml、约20μg/ml至约60μg/ml、约20μg/ml至约50μg/ml、约20μg/ml至约40μg/ml、约20μg/ml至约30μg/ml、约30μg/ml至约200μg/ml、约30μg/ml至约180μg/ml、约30μg/ml至约160μg/ml、约30μg/ml至约140μg/ml、约30μg/ml至约120μg/ml、约30μg/ml至约100μg/ml、约30μg/ml至约90μg/ml、约30μg/ml至约80μg/ml、约30μg/ml至约70μg/ml、约30μg/ml至约60μg/ml、约30μg/ml至约50μg/ml、约30μg/ml至约40μg/ml、约40μg/ml至约200μg/ml、约40μg/ml至约180μg/ml、约40μg/ml至约160μg/ml、约40μg/ml至约140μg/ml、约40μg/ml至约120μg/ml、约40μg/ml至约100μg/ml、约40μg/ml至约90μg/ml、约40μg/ml至约80μg/ml、约40μg/ml至约70μg/ml、约40μg/ml至约60μg/ml、约40μg/ml至约50μg/ml、约50μg/ml至约200μg/ml、约50μg/ml至约180μg/ml、约50μg/ml至约160μg/ml、约50μg/ml至约140μg/ml、约50μg/ml至约120μg/ml、约50μg/ml至约100μg/ml、约50μg/ml至约90μg/ml、约50μg/ml至约80μg/ml、约50μg/ml至约70μg/ml、约50μg/ml至约60μg/ml、约60μg/ml至约200μg/ml、约60μg/ml至约180μg/ml、约60μg/ml至约160μg/ml、约60μg/ml至约140μg/ml、约60μg/ml至约120μg/ml、约60μg/ml至约100μg/ml、约60μg/ml至约90μg/ml、约60μg/ml至约80μg/ml、约60μg/ml至约70μg/ml、约70μg/ml至约200μg/ml、约70μg/ml至约180μg/ml、约70μg/ml至约160μg/ml、约70μg/ml至约140μg/ml、约70μg/ml至约120μg/ml、约70μg/ml至约100μg/ml、约70μg/ml至约90μg/ml、约70μg/ml至约80μg/ml、约80μg/ml至约200μg/ml、约80μg/ml至约180μg/ml、约80μg/ml至约160μg/ml、约80μg/ml至约140μg/ml、约80μg/ml至约120μg/ml、约80μg/ml至约100μg/ml、约80μg/ml至约90μg/ml、约90μg/ml至约200μg/ml、约90μg/ml至约180μg/ml、约90μg/ml至约160μg/ml、约90μg/ml至约140μg/ml、约90μg/ml至约120μg/ml、约90μg/ml至约100μg/ml、约100μg/ml至约200μg/ml、约100μg/ml至约180μg/ml、约100μg/ml至约160μg/ml、约100μg/ml至约140μg/ml、约100μg/ml至约120μg/ml、约120μg/ml至约200μg/ml、约120μg/ml至约180μg/ml、约120μg/ml至约160μg/ml、约120μg/ml至约140μg/ml、约140μg/ml至约200μg/ml、约140μg/ml至约180μg/ml、约140μg/ml至约160μg/ml、约160μg/ml至约200μg/ml、约160μg/ml至约180μg/ml、or约180μg/ml至约200μg/ml)(例如,在给予对象第一剂抗体或抗原结合片段后持续约6小时至约1年(例如,约6小时至约11.5个月、约6小时至约11.0个月、约6小时至约10.5个月、约6小时至约10.0个月、约6小时至约9.5个月、约6小时至约9.0个月、约6小时至约8.5个月、约6小时至约8.0个月、约6小时至约7.5个月、约6小时至约7.0个月、约6小时至约6.5个月、约6小时至约6.0个月、约6小时至约5.5个月、约6小时至约5.0个月、约6小时至约4.5个月、约6小时至约4.0个月、约6小时至约3.5个月、约6小时至约3.0个月、约6小时至约2.5个月、约6小时至约2.0个月、约6小时至约1.5个月、约6小时至约5周、约6小时至约4周、约6小时至约3周、约6小时至约2周、约6小时至约1周、约6小时至约5天、约6小时至约3天、约6小时至约1天、约6小时至约18小时、约6小时至约12小时、约12小时至约1年、约12小时至约11.5个月、约12小时至约11.0个月、约12小时至约10.5个月、约12小时至约10.0个月、约12小时至约9.5个月、约12小时至约9.0个月、约12小时至约8.5个月、约12小时至约8.0个月、约12小时至约7.5个月、约12小时至约7.0个月、约12小时至约6.5个月、约12小时至约6.0个月、约12小时至约5.5个月、约12小时至约5.0个月、约12小时至约4.5个月、约12小时至约4.0个月、约12小时至约3.5个月、约12小时至约3.0个月、约12小时至约2.5个月、约12小时至约2.0个月、约12小时至约1.5个
月、约12小时至约5周、约12小时至约4周、约12小时至约3周、约12小时至约2周、约12小时至约1周、约12小时至约5天、约12小时至约3天、约12小时至约1天、约12小时至约18小时、约18小时至约1年、约18小时至约11.5个月、约18小时至约11.0个月、约18小时至约10.5个月、约18小时至约10.0个月、约18小时至约9.5个月、约18小时至约9.0个月、约18小时至约8.5个月、约18小时至约8.0个月、约18小时至约7.5个月、约18小时至约7.0个月、约18小时至约6.5个月、约18小时至约6.0个月、约18小时至约5.5个月、约18小时至约5.0个月、约18小时至约4.5个月、约18小时至约4.0个月、约18小时至约3.5个月、约18小时至约3.0个月、约18小时至约2.5个月、约18小时至约2.0个月、约18小时至约1.5个月、约18小时至约5周、约18小时至约4周、约18小时至约3周、约18小时至约2周、约18小时至约1周、约18小时至约5天、约18小时至约3天、约18小时至约1天、约1天至约1年、约1天至约11.5个月、约1天至约11.0个月、约1天至约10.5个月、约1天至约10.0个月、约1天至约9.5个月、约1天至约9.0个月、约1天至约8.5个月、约1天至约8.0个月、约1天至约7.5个月、约1天至约7.0个月、约1天至约6.5个月、约1天至约6.0个月、约1天至约5.5个月、约1天至约5.0个月、约1天至约4.5个月、约1天至约4.0个月、约1天至约3.5个月、约1天至约3.0个月、约1天至约2.5个月、约1天至约2.0个月、约1天至约1.5个月、约1天至约5周、约1天至约4周、约1天至约3周、约1天至约2周、约1天至约1周、约1天至约5天、约1天至约3天、约3天至约1年、约3天至约11.5个月、约3天至约11.0个月、约3天至约10.5个月、约3天至约10.0个月、约3天至约9.5个月、约3天至约9.0个月、约3天至约8.5个月、约3天至约8.0个月、约3天至约7.5个月、约3天至约7.0个月、约3天至约6.5个月、约3天至约6.0个月、约3天至约5.5个月、约3天至约5.0个月、约3天至约4.5个月、约3天至约4.0个月、约3天至约3.5个月、约3天至约3.0个月、约3天至约2.5个月、约3天至约2.0个月、约3天至约1.5个月、约3天至约5周、约3天至约4周、约3天至约3周、约3天至约2周、约3天至约1周、约3天至约5天、约5天至约1年、约5天至约11.5个月、约5天至约11.0个月、约5天至约10.5个月、约5天至约10.0个月、约5天至约9.5个月、约5天至约9.0个月、约5天至约8.5个月、约5天至约8.0个月、约5天至约7.5个月、约5天至约7.0个月、约5天至约6.5个月、约5天至约6.0个月、约5天至约5.5个月、约5天至约5.0个月、约5天至约4.5个月、约5天至约4.0个月、约5天至约3.5个月、约5天至约3.0个月、约5天至约2.5个月、约5天至约2.0个月、约5天至约1.5个月、约5天至约5周、约5天至约4周、约5天至约3周、约5天至约2周、约5天至约1周、约1周至约1年、约1周至约11.5个月、约1周至约11.0个月、约1周至约10.5个月、约1周至约10.0个月、约1周至约9.5个月、约1周至约9.0个月、约1周至约8.5个月、约1周至约8.0个月、约1周至约7.5个月、约1周至约7.0个月、约1周至约6.5个月、约1周至约6.0个月、约1周至约5.5个月、约1周至约5.0个月、约1周至约4.5个月、约1周至约4.0个月、约1周至约3.5个月、约1周至约3.0个月、约1周至约2.5个月、约1周至约2.0个月、约1周至约1.5个月、约1周至约5周、约1周至约4周、约1周至约3周、约1周至约2周、约2周至约1年、约2周至约11.5个月、约2周至约11.0个月、约2周至约10.5个月、约2周至约10.0个月、约2周至约9.5个月、约2周至约9.0个月、约2周至约8.5个月、约2周至约8.0个月、约2周至约7.5个月、约2周至约7.0个月、约2周至约6.5个月、约2周至约6.0个月、约2周至约5.5个月、约2周至约5.0个月、约2周至约4.5个月、约2周至约4.0个月、约2周至约3.5个月、约2周至约3.0个月、约2周至约2.5个月、约2周至约2.0个月、约2周至约1.5个月、约2周至约5周、约2周至约4周、约2周至约3周、约3周至约1年、约3周至约11.5个月、约3周至约11.0个月、约3周至约10.5个月、约
3周至约10.0个月、约3周至约9.5个月、约3周至约9.0个月、约3周至约8.5个月、约3周至约8.0个月、约3周至约7.5个月、约3周至约7.0个月、约3周至约6.5个月、约3周至约6.0个月、约3周至约5.5个月、约3周至约5.0个月、约3周至约4.5个月、约3周至约4.0个月、约3周至约3.5个月、约3周至约3.0个月、约3周至约2.5个月、约3周至约2.0个月、约3周至约1.5个月、约3周至约5周、约3周至约4周、约4周至约1年、约4周至约11.5个月、约4周至约11.0个月、约4周至约10.5个月、约4周至约10.0个月、约4周至约9.5个月、约4周至约9.0个月、约4周至约8.5个月、约4周至约8.0个月、约4周至约7.5个月、约4周至约7.0个月、约4周至约6.5个月、约4周至约6.0个月、约4周至约5.5个月、约4周至约5.0个月、约4周至约4.5个月、约4周至约4.0个月、约4周至约3.5个月、约4周至约3.0个月、约4周至约2.5个月、约4周至约2.0个月、约4周至约1.5个月、约4周至约5周、约5周至约1年、约5周至约11.5个月、约5周至约11.0个月、约5周至约10.5个月、约5周至约10.0个月、约5周至约9.5个月、约5周至约9.0个月、约5周至约8.5个月、约5周至约8.0个月、约5周至约7.5个月、约5周至约7.0个月、约5周至约6.5个月、约5周至约6.0个月、约5周至约5.5个月、约5周至约5.0个月、约5周至约4.5个月、约5周至约4.0个月、约5周至约3.5个月、约5周至约3.0个月、约5周至约2.5个月、约5周至约2.0个月、约5周至约1.5个月、约1.5个月至约1年、约1.5个月至约11.5个月、约1.5个月至约11.0个月、约1.5个月至约10.5个月、约1.5个月至约10.0个月、约1.5个月至约9.5个月、约1.5个月至约9.0个月、约1.5个月至约8.5个月、约1.5个月至约8.0个月、约1.5个月至约7.5个月、约1.5个月至约7.0个月、约1.5个月至约6.5个月、约1.5个月至约6.0个月、约1.5个月至约5.5个月、约1.5个月至约5.0个月、约1.5个月至约4.5个月、约1.5个月至约4.0个月、约1.5个月至约3.5个月、约1.5个月至约3.0个月、约1.5个月至约2.5个月、约1.5个月至约2.0个月、约2.0个月至约1年、约2.0个月至约11.5个月、约2.0个月至约11.0个月、约2.0个月至约10.5个月、约2.0个月至约10.0个月、约2.0个月至约9.5个月、约2.0个月至约9.0个月、约2.0个月至约8.5个月、约2.0个月至约8.0个月、约2.0个月至约7.5个月、约2.0个月至约7.0个月、约2.0个月至约6.5个月、约2.0个月至约6.0个月、约2.0个月至约5.5个月、约2.0个月至约5.0个月、约2.0个月至约4.5个月、约2.0个月至约4.0个月、约2.0个月至约3.5个月、约2.0个月至约3.0个月、约2.0个月至约2.5个月、约2.5个月至约1年、约2.5个月至约11.5个月、约2.5个月至约11.0个月、约2.5个月至约10.5个月、约2.5个月至约10.0个月、约2.5个月至约9.5个月、约2.5个月至约9.0个月、约2.5个月至约8.5个月、约2.5个月至约8.0个月、约2.5个月至约7.5个月、约2.5个月至约7.0个月、约2.5个月至约6.5个月、约2.5个月至约6.0个月、约2.5个月至约5.5个月、约2.5个月至约5.0个月、约2.5个月至约4.5个月、约2.5个月至约4.0个月、约2.5个月至约3.5个月、约2.5个月至约3.0个月、约3.0个月至约1年、约3.0个月至约11.5个月、约3.0个月至约11.0个月、约3.0个月至约10.5个月、约3.0个月至约10.0个月、约3.0个月至约9.5个月、约3.0个月至约9.0个月、约3.0个月至约8.5个月、约3.0个月至约8.0个月、约3.0个月至约7.5个月、约3.0个月至约7.0个月、约3.0个月至约6.5个月、约3.0个月至约6.0个月、约3.0个月至约5.5个月、约3.0个月至约5.0个月、约3.0个月至约4.5个月、约3.0个月至约4.0个月、约3.0个月至约3.5个月、约3.5个月至约1年、约3.5个月至约11.5个月、约3.5个月至约11.0个月、约3.5个月至约10.5个月、约3.5个月至约10.0个月、约3.5个月至约9.5个月、约3.5个月至约9.0个月、约3.5个月至约8.5个月、约3.5个月至约8.0个月、约3.5个月至约7.5个月、约3.5个月至约7.0个月、约3.5个月至约6.5个月、约
3.5个月至约6.0个月、约3.5个月至约5.5个月、约3.5个月至约5.0个月、约3.5个月至约4.5个月、约3.5个月至约4.0个月、约4.0个月至约1年、约4.0个月至约11.5个月、约4.0个月至约11.0个月、约4.0个月至约10.5个月、约4.0个月至约10.0个月、约4.0个月至约9.5个月、约4.0个月至约9.0个月、约4.0个月至约8.5个月、约4.0个月至约8.0个月、约4.0个月至约7.5个月、约4.0个月至约7.0个月、约4.0个月至约6.5个月、约4.0个月至约6.0个月、约4.0个月至约5.5个月、约4.0个月至约5.0个月、约4.0个月至约4.5个月、约4.5个月至约1年、约4.5个月至约11.5个月、约4.5个月至约11.0个月、约4.5个月至约10.5个月、约4.5个月至约10.0个月、约4.5个月至约9.5个月、约4.5个月至约9.0个月、约4.5个月至约8.5个月、约4.5个月至约8.0个月、约4.5个月至约7.5个月、约4.5个月至约7.0个月、约4.5个月至约6.5个月、约4.5个月至约6.0个月、约4.5个月至约5.5个月、约4.5个月至约5.0个月、约5.0个月至约1年、约5.0个月至约11.5个月、约5.0个月至约11.0个月、约5.0个月至约10.5个月、约5.0个月至约10.0个月、约5.0个月至约9.5个月、约5.0个月至约9.0个月、约5.0个月至约8.5个月、约5.0个月至约8.0个月、约5.0个月至约7.5个月、约5.0个月至约7.0个月、约5.0个月至约6.5个月、约5.0个月至约6.0个月、约5.0个月至约5.5个月、约5.5个月至约1年、约5.5个月至约11.5个月、约5.5个月至约11.0个月、约5.5个月至约10.5个月、约5.5个月至约10.0个月、约5.5个月至约9.5个月、约5.5个月至约9.0个月、约5.5个月至约8.5个月、约5.5个月至约8.0个月、约5.5个月至约7.5个月、约5.5个月至约7.0个月、约5.5个月至约6.5个月、约5.5个月至约6.0个月、约6.0个月至约1年、约6.0个月至约11.5个月、约6.0个月至约11.0个月、约6.0个月至约10.5个月、约6.0个月至约10.0个月、约6.0个月至约9.5个月、约6.0个月至约9.0个月、约6.0个月至约8.5个月、约6.0个月至约8.0个月、约6.0个月至约7.5个月、约6.0个月至约7.0个月、约6.0个月至约6.5个月、约6.5个月至约1年、约6.5个月至约11.5个月、约6.5个月至约11.0个月、约6.5个月至约10.5个月、约6.5个月至约10.0个月、约6.5个月至约9.5个月、约6.5个月至约9.0个月、约6.5个月至约8.5个月、约6.5个月至约8.0个月、约6.5个月至约7.5个月、约6.5个月至约7.0个月、约7.0个月至约1年、约7.0个月至约11.5个月、约7.0个月至约11.0个月、约7.0个月至约10.5个月、约7.0个月至约10.0个月、约7.0个月至约9.5个月、约7.0个月至约9.0个月、约7.0个月至约8.5个月、约7.0个月至约8.0个月、约7.0个月至约7.5个月、约7.5个月至约1年、约7.5个月至约11.5个月、约7.5个月至约11.0个月、约7.5个月至约10.5个月、约7.5个月至约10.0个月、约7.5个月至约9.5个月、约7.5个月至约9.0个月、约7.5个月至约8.5个月、约7.5个月至约8.0个月、约8.0个月至约1年、约8.0个月至约11.5个月、约8.0个月至约11.0个月、约8.0个月至约10.5个月、约8.0个月至约10.0个月、约8.0个月至约9.5个月、约8.0个月至约9.0个月、约8.0个月至约8.5个月、约8.5个月至约1年、约8.5个月至约11.5个月、约8.5个月至约11.0个月、约8.5个月至约10.5个月、约8.5个月至约10.0个月、约8.5个月至约9.5个月、约8.5个月至约9.0个月、约9.0个月至约1年、约9.0个月至约11.5个月、约9.0个月至约11.0个月、约9.0个月至约10.5个月、约9.0个月至约10.0个月、约9.0个月至约9.5个月、约9.5个月至约1年、约9.5个月至约11.5个月、约9.5个月至约11.0个月、约9.5个月至约10.5个月、约9.5个月至约10.0个月、约10.0个月至约1年、约10.0个月至约11.5个月、约10.0个月至约11.0个月、约10.0个月至约10.5个月、约10.5个月至约1年、约10.5个月至约11.5个月、约10.5个月至约11.0个月、约11.0个月至约1年、约11.0个月至约11.5个月或约11.5个月至约1年)。
[0309]
这些方法的一些实施方式导致游离轻链(flc)的稳态浓度,在对象血清中小于约50mg/dl、小于约45mg/dl、小于约40mg/dl、小于约35mg/dl、小于约30mg/dl、小于约25mg/dl、小于约20mg/dl、小于约18mg/dl、小于约16mg/dl、小于约14mg/dl、小于约12mg/dl、小于约10mg/dl、小于约8mg/dl、小于约6mg/dl、小于约4mg/dl、小于约2mg/dl或小于约1mg/dl(例如,在给予对象第一剂抗体或抗原结合片段之后,持续约6小时至约1年,或该范围内任何子范围)。
[0310]
这些方法的一些实施方式导致游离轻链(flc)的稳态浓度,在对象血清中为约0.1mg/dl至约50mg/dl(例如,约0.1mg/dl至约48mg/dl、约0.1mg/dl至约45mg/dl、约0.1mg/dl至约40mg/dl、约0.1mg/dl至约35mg/dl、约0.1mg/dl至约30mg/dl、约0.1mg/dl至约25mg/dl、约0.1mg/dl至约20mg/dl、约0.1mg/dl至约18mg/dl、约0.1mg/dl至约16mg/dl、约0.1mg/dl至约14mg/dl、约0.1mg/dl至约12mg/dl、约0.1mg/dl至约10mg/dl、约0.1mg/dl至约8mg/dl、约0.1mg/dl至约6mg/dl、约0.1mg/dl至约4mg/dl、约0.1mg/dl至约2mg/dl、约0.1mg/dl至约1.0mg/dl、约0.1mg/dl至约0.5mg/dl、约0.1mg/dl至约0.2mg/dl、约0.2mg/dl至约50mg/dl、约0.2mg/dl至约48mg/dl、约0.2mg/dl至约45mg/dl、约0.2mg/dl至约40mg/dl、约0.2mg/dl至约35mg/dl、约0.2mg/dl至约30mg/dl、约0.2mg/dl至约25mg/dl、约0.2mg/dl至约20mg/dl、约0.2mg/dl至约18mg/dl、约0.2mg/dl至约16mg/dl、约0.2mg/dl至约14mg/dl、约0.2mg/dl至约12mg/dl、约0.2mg/dl至约10mg/dl、约0.2mg/dl至约8mg/dl、约0.2mg/dl至约6mg/dl、约0.2mg/dl至约4mg/dl、约0.2mg/dl至约2mg/dl、约0.2mg/dl至约1.0mg/dl、约0.2mg/dl至约0.5mg/dl、约0.5mg/dl至约50mg/dl、约0.5mg/dl至约48mg/dl、约0.5mg/dl至约45mg/dl、约0.5mg/dl至约40mg/dl、约0.5mg/dl至约35mg/dl、约0.5mg/dl至约30mg/dl、约0.5mg/dl至约25mg/dl、约0.5mg/dl至约20mg/dl、约0.5mg/dl至约18mg/dl、约0.5mg/dl至约16mg/dl、约0.5mg/dl至约14mg/dl、约0.5mg/dl至约12mg/dl、约0.5mg/dl至约10mg/dl、约0.5mg/dl至约8mg/dl、约0.5mg/dl至约6mg/dl、约0.5mg/dl至约4mg/dl、约0.5mg/dl至约2mg/dl、约0.5mg/dl至约1.0mg/dl、约1.0mg/dl至约50mg/dl、约1.0mg/dl至约48mg/dl、约1.0mg/dl至约45mg/dl、约1.0mg/dl至约40mg/dl、约1.0mg/dl至约35mg/dl、约1.0mg/dl至约30mg/dl、约1.0mg/dl至约25mg/dl、约1.0mg/dl至约20mg/dl、约1.0mg/dl至约18mg/dl、约1.0mg/dl至约16mg/dl、约1.0mg/dl至约14mg/dl、约1.0mg/dl至约12mg/dl、约1.0mg/dl至约10mg/dl、约1.0mg/dl至约8mg/dl、约1.0mg/dl至约6mg/dl、约1.0mg/dl至约4mg/dl、约1.0mg/dl至约2mg/dl、约2mg/dl至约50mg/dl、约2mg/dl至约48mg/dl、约2mg/dl至约45mg/dl、约2mg/dl至约40mg/dl、约2mg/dl至约35mg/dl、约2mg/dl至约30mg/dl、约2mg/dl至约25mg/dl、约2mg/dl至约20mg/dl、约2mg/dl至约18mg/dl、约2mg/dl至约16mg/dl、约2mg/dl至约14mg/dl、约2mg/dl至约12mg/dl、约2mg/dl至约10mg/dl、约2mg/dl至约8mg/dl、约2mg/dl至约6mg/dl、约2mg/dl至约4mg/dl、约4mg/dl至约50mg/dl、约4mg/dl至约48mg/dl、约4mg/dl至约45mg/dl、约4mg/dl至约40mg/dl、约4mg/dl至约35mg/dl、约4mg/dl至约30mg/dl、约4mg/dl至约25mg/dl、约4mg/dl至约20mg/dl、约4mg/dl至约18mg/dl、约4mg/dl至约16mg/dl、约4mg/dl至约14mg/dl、约4mg/dl至约12mg/dl、约4mg/dl至约10mg/dl、约4mg/dl至约8mg/dl、约4mg/dl至约6mg/dl、约6mg/dl至约50mg/dl、约6mg/dl至约48mg/dl、约6mg/dl至约45mg/dl、约6mg/dl至约40mg/dl、约6mg/dl至约35mg/dl、约6mg/dl至约30mg/dl、约6mg/dl至约25mg/dl、约6mg/dl至约20mg/dl、约6mg/dl至约18mg/dl、约6mg/dl至约
16mg/dl、约6mg/dl至约14mg/dl、约6mg/dl至约12mg/dl、约6mg/dl至约10mg/dl、约6mg/dl至约8mg/dl、约8mg/dl至约50mg/dl、约8mg/dl至约48mg/dl、约8mg/dl至约45mg/dl、约8mg/dl至约40mg/dl、约8mg/dl至约35mg/dl、约8mg/dl至约30mg/dl、约8mg/dl至约25mg/dl、约8mg/dl至约20mg/dl、约8mg/dl至约18mg/dl、约8mg/dl至约16mg/dl、约8mg/dl至约14mg/dl、约8mg/dl至约12mg/dl、约8mg/dl至约10mg/dl、约10mg/dl至约50mg/dl、约10mg/dl至约48mg/dl、约10mg/dl至约45mg/dl、约10mg/dl至约40mg/dl、约10mg/dl至约35mg/dl、约10mg/dl至约30mg/dl、约10mg/dl至约25mg/dl、约10mg/dl至约20mg/dl、约10mg/dl至约18mg/dl、约10mg/dl至约16mg/dl、约10mg/dl至约14mg/dl、约10mg/dl至约12mg/dl、约12mg/dl至约50mg/dl、约12mg/dl至约48mg/dl、约12mg/dl至约45mg/dl、约12mg/dl至约40mg/dl、约12mg/dl至约35mg/dl、约12mg/dl至约30mg/dl、约12mg/dl至约25mg/dl、约12mg/dl至约20mg/dl、约12mg/dl至约18mg/dl、约12mg/dl至约16mg/dl、约12mg/dl至约14mg/dl、约14mg/dl至约50mg/dl、约14mg/dl至约48mg/dl、约14mg/dl至约45mg/dl、约14mg/dl至约40mg/dl、约14mg/dl至约35mg/dl、约14mg/dl至约30mg/dl、约14mg/dl至约25mg/dl、约14mg/dl至约20mg/dl、约14mg/dl至约18mg/dl、约14mg/dl至约16mg/dl、约16mg/dl至约50mg/dl、约16mg/dl至约48mg/dl、约16mg/dl至约45mg/dl、约16mg/dl至约40mg/dl、约16mg/dl至约35mg/dl、约16mg/dl至约30mg/dl、约16mg/dl至约25mg/dl、约16mg/dl至约20mg/dl、约16mg/dl至约18mg/dl、约18mg/dl至约50mg/dl、约18mg/dl至约48mg/dl、约18mg/dl至约45mg/dl、约18mg/dl至约40mg/dl、约18mg/dl至约35mg/dl、约18mg/dl至约30mg/dl、约18mg/dl至约25mg/dl、约18mg/dl至约20mg/dl、约20mg/dl至约50mg/dl、约20mg/dl至约48mg/dl、约20mg/dl至约45mg/dl、约20mg/dl至约40mg/dl、约20mg/dl至约35mg/dl、约20mg/dl至约30mg/dl、约20mg/dl至约25mg/dl、约25mg/dl至约50mg/dl、约25mg/dl至约48mg/dl、约25mg/dl至约45mg/dl、约25mg/dl至约40mg/dl、约25mg/dl至约35mg/dl、约25mg/dl至约30mg/dl、约30mg/dl至约50mg/dl、约30mg/dl至约48mg/dl、约30mg/dl至约45mg/dl、约30mg/dl至约40mg/dl、约30mg/dl至约35mg/dl、约35mg/dl至约50mg/dl、约35mg/dl至约48mg/dl、约35mg/dl至约45mg/dl、约35mg/dl至约40mg/dl、约40mg/dl至约50mg/dl、约40mg/dl至约48mg/dl、约40mg/dl至约45mg/dl、约45mg/dl至约50mg/dl、约45mg/dl至约48mg/dl或约48mg/dl至约50mg/dl)(例如,在给予对象第一剂抗体或抗原结合片段之后,持续约6小时至约1年,或该范围的任何子范围)。
[0311]
f.组合疗法
[0312]
本文所述的治疗方法可与其他治疗方法或其他治疗剂的使用组合,如化疗、放疗、干细胞治疗、手术等其他对多发性骨髓瘤(mm)有效的治疗。可与本文所述的任何药物组合物(例如,包括本文所述的任何抗体或抗原结合片段)一起给予的其他有用的试剂类别包括,例如,针对癌细胞上表达的其他受体的抗体、抗微管蛋白剂(如奥瑞他汀)、dna小沟粘合剂(例如,pbd)、dna复制抑制剂、烷基化剂(例如铂类复合物,如顺铂、单(铂)、双(铂)和三核铂复合物以及卡铂)、蒽环类、抗生素、抗叶酸剂类、抗代谢剂类、化疗增敏剂类、多卡霉素类(duocarmycins)、依托泊苷类、氟化嘧啶类、离子团类、来红毒素类(lexitropsins)、亚硝基脲类、顺铂类(platinols)、预成化合物类(pre-forming compound)、嘌呤抗代谢物类、嘌呤霉素类、放射增敏剂类、类固醇类、紫杉烷类、拓扑异构酶抑制剂类、长春花生物碱类等。
[0313]
在一些实施方式中,抗-bcma抗体或其抗原结合片段(如sea-bcma)与选自地塞米
松、imid剂(如泊马度胺)、抗-cd38抗体或其抗原结合片段(如达雷木单抗)和/或γ-分泌酶抑制剂的一种或多种治疗剂组合使用。
[0314]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)和一个或多个剂量的地塞米松。
[0315]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松和一个或多个剂量的imid剂(如泊马度胺)。
[0316]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松、一个或多个剂量的imid剂(如泊马度胺)和一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)。
[0317]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松、一个或多个剂量的imid剂(如泊马度胺)、一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)和一个或多个剂量的γ-分泌酶抑制剂。
[0318]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松和一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)。
[0319]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松、一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)和一个或多个剂量的γ-分泌酶抑制剂。
[0320]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的地塞米松和一个或多个剂量的γ-分泌酶抑制剂。
[0321]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)和一个或多个剂量的imid剂(如泊马度胺)。
[0322]
在一些实施方式中,给予对象如本文所述的一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的imid剂(如泊马度胺)和一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)。
[0323]
在一些实施方式中,给予对象如本文所述的一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的imid剂(如泊马度胺)、一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)和一个或多个剂量的γ-分泌酶抑制剂。
[0324]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的imid剂(如泊马度胺)和一个或多个剂量的γ-分泌酶抑制剂。
[0325]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)和一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单抗)。
[0326]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)、一个或多个剂量的抗-cd38抗体或其抗原结合片段(如达雷木单
抗)和一个或多个剂量的γ-分泌酶抑制剂。
[0327]
在一些实施方式中,给予对象如本文所述一个或多个剂量的抗-bcma抗体或其抗原结合片段(如sea-bcma)和一个或多个剂量的γ-分泌酶抑制剂。
[0328]
下表总结了这些治疗剂的组合。
[0329]
表1.
[0330][0331][0332]
在一些实施方式中,每两周一次给予对象这些组合疗法中的本文所述的抗-bcma抗体或其抗原结合片段(例如sea-bcma)。
[0333]
在一些实施方式中,在前8周内每周一次给予对象这些组合疗法中的本文所述的抗-bcma抗体或其抗原结合片段(例如sea-bcma),然后每两周一次。例如,在两个28天周期内每周一次给予对象本文所述的抗-bcma抗体或其抗原结合片段(例如sea-bcma),然后在后续的28天周期内每两周一次。
[0334]
(i)与地塞米松的组合治疗
[0335]
在一些实施方式中,本文所述的治疗方法与地塞米松的使用组合。在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,独立地给予对象一个或多个剂量的约5mg至约200mg(例如,约5mg至约150mg、约5mg至约100mg、约5mg至约90mg、约5mg至约80mg、约5mg至约70mg、约5mg至约60mg、约5mg至约50mg、约5mg至约40mg、约5mg至约30mg、约5mg至约20mg;约10mg至约200mg、约10mg至约150mg、约10mg至约100mg、约10mg至约90mg、约10mg至约80mg、约10mg至约70mg、约10mg至约60mg、约10mg至约50mg、约10mg至约40mg、约10mg至约30mg、约10mg至约20mg、约20mg至约200mg、约
20mg至约150mg、约20mg至约100mg、约20mg至约90mg、约20mg至约80mg、约20mg至约70mg、约20mg至约60mg、约20mg至约50mg、约20mg至约40mg)地塞米松。在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,独立地给予对象一个或多个剂量的约40mg地塞米松。在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,独立地给予对象一个或多个剂量的约20mg地塞米松。
[0336]
在一些实施方式中,与各个和每个剂量的本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,给予对象地塞米松。
[0337]
在一些实施方式中,给予每剂本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)之前约10分钟至约5小时(例如,约5分钟至约4.5小时、约5分钟至约4小时、约5分钟至约3.5小时、约5分钟至约3小时、约5分钟至约2.5小时、约5分钟至约2小时、约5分钟至约1.5小时、约5分钟至约1小时、约5分钟至约45分钟、约5分钟至约40分钟、约5分钟至约35分钟、约5分钟至约30分钟、约5分钟至约25分钟、约5分钟至约20分钟、约5分钟至约15分钟、约5分钟至约10分钟、约30分钟至约5小时、约30分钟至约4.5小时、约30分钟至约4小时、约30分钟至约3.5小时、约30分钟至约3小时、约30分钟至约2.5小时、约30分钟至约2小时、约30分钟至约1.5小时、约30分钟至约1小时、约30分钟至约45分钟、约1小时至约5小时、约1小时至约4.5小时、约1小时至约4小时、约1小时至约3.5小时、约1小时至约3小时、约1小时至约2.5小时、约1小时至约2小时、约1小时至约1.5小时)给予对象地塞米松。
[0338]
在一些实施方式中,给予每剂本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)之后约10分钟至约5小时(例如,约5分钟至约4.5小时、约5分钟至约4小时、约5分钟至约3.5小时、约5分钟至约3小时、约5分钟至约2.5小时、约5分钟至约2小时、约5分钟至约1.5小时、约5分钟至约1小时、约5分钟至约45分钟、约5分钟至约40分钟、约5分钟至约35分钟、约5分钟至约30分钟、约5分钟至约25分钟、约5分钟至约20分钟、约5分钟至约15分钟、约5分钟至约10分钟、约30分钟至约5小时、约30分钟至约4.5小时、约30分钟至约4小时、约30分钟至约3.5小时、约30分钟至约3小时、约30分钟至约2.5小时、约30分钟至约2小时、约30分钟至约1.5小时、约30分钟至约1小时、约30分钟至约45分钟、约1小时至约5小时、约1小时至约4.5小时、约1小时至约4小时、约1小时至约3.5小时、约1小时至约3小时、约1小时至约2.5小时、约1小时至约2小时、约1小时至约1.5小时)给予对象地塞米松。
[0339]
在一些实施方式中,在给予每剂本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)之前约1至约3小时,给予对象约40mg剂量的地塞米松。
[0340]
(ii)与imid剂的组合疗法
[0341]
免疫调节酰亚胺药物(imid)是含有“酰亚胺”基团的免疫调节剂。示例性的imid包括但不限于来那度胺、泊马度胺、沙利度胺和伊贝多胺(iberdomide)(cc-220,celgene)。imid可以增强nk细胞扩增和活性,并在与单克隆抗体组合时增加抗体依赖的细胞毒性(adcc)。
[0342]
在一些实施方式中,本文所述的治疗方法与imid(例如泊马度胺)组合使用。在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,独立地给予对象一个或多个剂量的约0.5mg至约50mg(例如,约1mg至约50mg、约1mg至约40mg、约1mg至约30mg、约1mg至约20mg、约1mg至约10mg、约1mg至约5mg、约2mg至约50mg、
bcma(nci)、艾基维仑赛(idecabtagene vicleucel)(bb2121)、bb21217、lcar-b38m、jnj-4528、ct053、p-bcma-101、cart-bcma(upenn/诺华(novartis))、ct103a、jcarh125、mcarh171、bcma car-t(hrain生物技术公司(hrain biotech))或kite-585。在一些实施方式中,bcma治疗剂是双特异性t细胞衔接子(bite)或三特异性t细胞衔接子(tite),例如,amg 420(安进公司(amgen))、cc-93269(celgene)、pf-06863135(辉瑞公司(pfizer))、regn5458(regeneron)、amg 701(安进公司)或tnb383b(teneobio)。这种试剂的具体例子描述于,例如yu等(2020)j.hematology&oncology 13:125,其通过引用全文纳入本文。
[0349]
在一些实施方式中,抗-cd38抗体或其抗原结合片段是达雷木单抗。达雷木单抗描述于,例如,美国专利号7,829,693,和us20170121414a1,这二者都通过引用全文纳入本文。在一些实施方式中,抗-cd38抗体或其抗原结合片段是mor03087(mor202)、jnj-54767414(humax cd38)、艾萨妥昔单抗(lsatuximab)sar650984、ab79等。许多这些抗-cd38抗体或抗原结合片段描述于,例如us-10494444b2,wo2020212914a1,morandi,fabio,等frontiers in immunology 9(2018):2722;lammerts van bueren,jeroen,等(2014):3474-3474;pillai,rathi n.,等jto clinical and research reports 2.2(2021):100104;和martin,thomas,等(2015):509-509;其各自通过引用全文纳入本文。
[0350]
在一些实施方式中,本文所述治疗方法与抗-cd38抗体或其抗原结合片段(例如达雷木单抗)的使用组合。在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的抗-bcma抗体或抗原结合片段)组合,独立地给予对象一个或多个剂量的约1mg/kg至约100mg/kg(例如,约1mg/kg至约50mg/kg;约4mg/kg至约30mg/kg;约10mg/kg至约50mg/kg;约10mg/kg至约30mg/kg;约10mg/kg至约20mg/kg;或约15mg/kg至约20mg/kg)的抗-cd38抗体或其抗原结合片段(例如达雷木单抗)。在一些实施方式中,抗-cd38抗体或其抗原结合片段(例如达雷木单抗)的剂量可以低于100mg/kg、低于20mg/kg、低于19mg/kg、低于18mg/kg、低于17mg/kg、低于16mg/kg、低于15mg/kg、低于14mg/kg、低于13mg/kg、低于12mg/kg、低于11mg/kg、低于10mg/kg、低于5mg/kg或低于1mg/kg。在一些实施方式中,抗-cd38抗体或其抗原结合片段(例如达雷木单抗)的剂量可以高于10mg/kg、高于9mg/kg、高于8mg/kg、高于7mg/kg、高于6mg/kg、高于5mg/kg、高于4mg/kg、高于3mg/kg、高于2mg/kg、高于1mg/kg、高于0.5mg/kg或高于0.1mg/kg。在一些实施方式中,抗-cd38抗体或其抗原结合片段(例如达雷木单抗)的剂量可以是约1mg/kg。其可以每周给药,例如,持续约5周。
[0351]
在一些实施方式中,与本文所述的药物组合物(例如包含本文所述的抗-bcma抗体或抗原结合片段)组合,独立地给予(例如口服给予)对象一个或多个剂量的约16mg/kg达雷木单抗。
[0352]
在一些实施方式中,给予对象抗-bcma抗体或其抗原结合片段、抗-cd38抗体或其抗原结合片段和地塞米松的组合。在一些实施方式中,给予对象抗-bcma抗体或其抗原结合片段、抗-cd38抗体或其抗原结合片段和imid的组合。在一些实施方式中,给予对象抗-bcma抗体或其抗原结合片段、抗-cd38抗体或其抗原结合片段、地塞米松和imid的组合。
[0353]
在一些实施方式中,以约每周一次至约每四周一次(例如,约每周一次,约两周一次,约三周一次,或约四周一次)的频率给予对象抗-cd38抗体或其抗原结合片段(例如达雷木单抗)。在一些实施方式中,在28天周期的第1天、第8天、第15天和第22天给予对象所述抗-cd38抗体或其抗原结合片段。
[0354]
在一些实施方式中,在第一阶段期间,抗-cd38抗体或其抗原结合片段以约每周一次的频率给予对象。在一些实施方式中,第一阶段是约2周至约20周(例如,约2周至约10周,约4周至约20周,约4周至约10周,约6周至约20周,约6周至约10周,或约7周至约9周)。在一些实施方式中,第一阶段约为或至少为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周。
[0355]
在一些实施方式中,在第二阶段期间,抗-cd38抗体或其抗原结合片段任选地以约每两周一次至约每三周一次的频率给予对象。在一些实施方式中,第二阶段是约2周至约24周(例如,约5周至约20周,约10周至约20周,约15周至约20周,或约15周至约16周)。在一些实施方式中,第二阶段约为或至少为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周。
[0356]
在一些实施方式中,在第三阶段期间,抗-cd38抗体或其抗原结合片段任选地以约每四周一次的频率给予对象。在一些实施方式中,第三阶段是约2周至约30周(例如,约2周至约10周,约4周至约20周,约4周至约10周,约6周至约20周,约6周至约10周,或约7周至约9周)。在一些实施方式中,第三阶段约为或至少为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25或30周。在一些实施方式中,连续地给予对象抗-cd38抗体或抗原结合片段,直到疾病被治愈或对象对治疗不再有反应。
[0357]
在一些实施方式中,在第1至8周以每周一次的频率给予对象抗-cd38抗体或抗原结合片段,在第9至24周以每两周一次的频率给予,然后从第25周起以每四周一次的频率给予,直到疾病进展。
[0358]
在一些实施方式中,在第1至9周以每周一次的频率给予对象抗-cd38抗体或抗原结合片段,在第10至24周以每三周一次的频率给予,然后从第25周起以每四周一次的频率给予,直到疾病进展。
[0359]
(iv)与γ-分泌酶抑制剂的组合疗法
[0360]
bcma可被遍在的γ-分泌酶(gs)复合物从肿瘤细胞表面裂解。裂解降低了肿瘤细胞上用于抗-bcma抗体识别的bcma密度,并释放能够干扰抗-bcma抗体与肿瘤细胞表面的bcma的结合的可溶性bcma(sbcma)片段。γ分泌酶抑制剂(gsi)可以阻断bcma的裂解,从而增加细胞表面的bcma靶密度,减少血浆中的sbcma的量。此外,gsi能增加bcma nf-kb信号转导。
[0361]
抗-bcma抗体或其抗原结合片段与gsi的组合可以增加抗-bcma抗体或其抗原结合片段的功效。在一些实施方式中,gsi为semagacestat(ly450139)、ro4929097、mk-0752、avagacestat(bms-708163)、nirogacestat(pf-03084014)、crenigacestat(ly3039478)、bms-906024、dapt(gsi-ix)、二苯并氮杂(yo-01027)、ly411575、l-685,458、ngp 555、mdl-28170或itanapraced(chf 5074)。
[0362]
在一些实施方式中,与各个且每个剂量的本文所述的药物组合物(例如包含本文所述的任何抗体或抗原结合片段)组合,给予对象gsi。在一些实施方式中,给予对象一个或多个剂量的gsi。
[0363]
在一些实施方式中,给予对象抗-bcma抗体或其抗原结合片段和gsi的组合。在一些实施方式中,还给予对象地塞米松、如本文所述抗-cd38抗体或其抗原结合片段和/或imid。
[0364]
此外,γ分泌酶抑制能诱导nf-κb信号转导增加,这可能会产生不期望的作用。如本文所述的抗-bcma抗体或其抗原结合片段(如sea-bcma)能部分抑制增加的nf-κb信号转导,从而进一步抑制肿瘤生长和/或控制骨髓瘤的进展。
[0365]
在一些实施方式中,给予每剂本文所述的药物组合物(例如包含本文所述的任何抗-bcma抗体或抗原结合片段)之前或之后约10分钟至约5小时(例如,约5分钟至约4.5小时、约5分钟至约4小时、约5分钟至约3.5小时、约5分钟至约3小时、约5分钟至约2.5小时、约5分钟至约2小时、约5分钟至约1.5小时、约5分钟至约1小时、约5分钟至约45分钟、约5分钟至约40分钟、约5分钟至约35分钟、约5分钟至约30分钟、约5分钟至约25分钟、约5分钟至约20分钟、约5分钟至约15分钟、约5分钟至约10分钟、约30分钟至约5小时、约30分钟至约4.5小时、约30分钟至约4小时、约30分钟至约3.5小时、约30分钟至约3小时、约30分钟至约2.5小时、约30分钟至约2小时、约30分钟至约1.5小时、约30分钟至约1小时、约30分钟至约45分钟、约1小时至约5小时、约1小时至约4.5小时、约1小时至约4小时、约1小时至约3.5小时、约1小时至约3小时、约1小时至约2.5小时、约1小时至约2小时、约1小时至约1.5小时)给予对象gsi。
[0366]
g.治疗效果
[0367]
本文所述方法的治疗效果可以通过患者样品中一个或多个生物标志物的表达水平来评估。示例性生物标志物评估包括测试血清游离轻链和修饰的血清蛋白电泳测试(spep)的水平,外周血免疫分型,如流式细胞术测量,包括但不限于表征nk细胞、单核细胞、t细胞和b细胞,评估循环可溶性bcma(sbcma)、增殖诱导配体(april)和b细胞活化因子(baff)的水平,细胞和循环生物标志物的回顾性分析、肿瘤组织的表征、骨髓免疫分型、通过肿瘤和非肿瘤细胞的rna测序评估肿瘤和肿瘤微环境中基因表达谱的基线和治疗相关的变化,以及评估骨髓血浆中可溶性靶标、配体和/或细胞因子/趋化因子的水平。
[0368]
本本文所述方法实现的治疗效果也可以包括,例如,疾病症状严重性降低、无疾病症状期的频率和持续时间增加、寿命增加、疾病缓解或预防由于疾病折磨引起的损伤或残疾。例如,用于治疗多发性骨髓瘤、侵袭性和/或耐药性和/或难治性多发性骨髓瘤,相对于未治疗的对象或接受不同治疗的对象,本文所述方法抑制细胞生长或肿瘤生长至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约95%。另外,本文所述方法可以导致至少稳定的疾病、部分缓解或完全缓解,如由who或recist标准的肿瘤缓解(natl.cancer.inst.91:523-8,1999;和cancer 47:207-14,1981)。在一些实施方式中,治疗效果是根据客观缓解、客观缓解率、完全缓解、完全缓解率、缓解持续时间、完全缓解持续时间、无进展生存期和总生存期确定的。
[0369]
本文所述的方法能够减少肿瘤大小或癌症负荷,或以其他方式改善对象的症状,或以其他方式支持如上述确定的部分或完全稳定的疾病和/或部分或完全缓解。
[0370]
用本文所述的任何药物组合物(例如,包括本文所述的任何抗体或抗原结合片段)治疗,任选地与本文所述的任何其他治疗剂或治疗组合,与相同的治疗(例如,化疗)但不给予包含本文所述任何抗-bcma抗体或抗原结合片段的任何药物组合物相比,可使癌症患者的中位无进展生存期或总生存时间增加,特别是在复发或难治性的情况下,至少增加30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、或至少95%。另外或可替代地,包括给予本文所述的任何药物组合物(例如,包括本文所述的任何抗-bcma抗体或抗原
结合片段)的治疗(例如标准化疗),与相同的治疗(例如,化疗)但不给予包含本文所述任何抗-bcma抗体或抗原结合片段的任何药物组合物相比,可使肿瘤患者的完全缓解率、部分缓解率或客观缓解率(完全+部分)增加至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少95%。
[0371]
通常,在临床试验(如ii期、ii/iii期或iii期试验)中,相对于单独接受标准疗法(或加安慰剂)的患者对照组,用标准疗法加任何包含本文所述的任何抗-bcma抗体或抗原结合片段的药物组合物治疗的患者的上述中位无进展生存期和/或缓解率的增加是统计学显著的,例如在p=0.05或0.01或0.001水平。完全和部分缓解率是由癌症临床试验中常用的客观标准确定的,例如,由美国国家癌症研究所和/或食品和药物管理局列出或接受的标准。
[0372]
如果根据2016年imwg的统一缓解标准,患者达到严格的完全缓解(scr)、完全缓解(cr)、非常好的部分缓解(vgpr)或部分缓解(pr),则确定为客观缓解(or)。客观缓解率(orr)被定义为每个研究者有or的患者比例。根据2016年imwg统一缓解标准,无法评估疾病缓解的患者在计算orr时被记为不可评估的。在计算orr时,没有基线后缓解评估的患者,或根据imwg标准缓解不可评估的患者被算作无缓解者。客观缓解(or)可以通过成像、实验室评估或体格检查来评估;或sd和每个研究者的疾病相关症状的临床改善。
[0373]
在本文所述的任何方法的一个实施方式中,给予本文所述抗体或抗原结合片段之后,客观缓解率(orr)为至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%。
[0374]
如果根据2016年imwg统一缓解标准,患者达到scr或cr,则确定为完全缓解(cr)。cr率被定义为每位研究者获得cr的患者比例。根据imwg统一缓解标准,无法评估疾病缓解的患者在计算cr率时被评为不可评估的。
[0375]
在本文所述的任何方法的一个实施方式中,给予本文所述抗体或抗原结合片段之后,完全缓解率(crr)为至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%。
[0376]
or的持续时间定义为从首次记录or(scr、cr、vgpr或pr)到首次记录疾病进展或因任何原因死亡的时间,以先到者为准。疾病进展包括肿瘤进展的客观证据(基于血清、尿液或骨髓评估)和/或每个研究者的临床进展。缓解的持续时间只计算达到scr、cr、vgpr或pr的患者亚组。
[0377]
在本文所述任何方法的一个实施方式中,对所述治疗客观缓解的持续时间或完全缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0378]
无进展生存期(pfs)定义为从治疗开始到首次记录疾病进展或因任何原因死亡的时间,以先发生者为准。疾病进展包括肿瘤进展的客观证据(基于血清、尿液或骨髓评估)和/或每个研究者的临床进展。对于没有疾病进展且在分析时仍在研究中的患者,或在记录肿瘤进展之前被从研究中移除的患者,pfs的审查日期为最后一次没有进展性疾病(pd)的
疾病评估记录。在记录pd之前已经开始新的抗肿瘤治疗的患者,将在开始新的治疗之前的最后一次疾病评估中进行审查。第一次给药后缺乏肿瘤缓解评估的患者,其事件时间审查为1天。
[0379]
在本文所述任何方法的一个实施方式中,对象表现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0380]
总生存期(os)定义为从任何研究治疗开始至因任何原因死亡的日期的时间。具体地,
[0381]
os=死亡日期-任何研究治疗的第一次给药日期+1。
[0382]
在本文所述任何方法的一个实施方式中,对象表现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0383]
h.示例性单药疗法和组合疗法
[0384]
在某些实施方式中,对象按照标准给药方案每两周一次(q2wk)接受单药疗法。在一些标准给药的单药疗法治疗中,每个剂量包含本文所述的800mg抗-bcma抗体或抗原结合片段。在其他标准给药的单药疗法治疗中,给予对象的每个剂量包含1600mg本文所述的抗-bcma抗体或抗原结合片段。
[0385]
在本文所述的任何方法的一些实施方式中,进行单药疗法强化给药。在某些实施方式中,单药疗法强化给药包括在治疗的前2个周期(即第1周期和第2周期)每周诱导给药(q1wk)任何本文所述的抗-bcma抗体或抗原结合片段持续8次。假设患者没有经历证实的疾病进展,在第3周期及以后在维持阶段期间,给予对象任何本文所述的抗-bcma抗体或抗原结合片段,剂量为q2wk。维持阶段期间通常是以标准单药疗法给药水平给药,即800mg或1600mg的抗体或抗原结合片段。
[0386]
因此,在一些实施方式中,强化给药单药疗法包括在第1周期和第2周期的第1天、第8天、第15天和第22天,以及后续周期的第1天和第15天,给予本文所述的800或1600mg抗-bcma抗体或抗原结合片段。
[0387]
在一些实施方式中,地塞米松与标准或强化单药疗法方案组合,作为组合疗法的一部分。在这种组合治疗的一些实施方式中,以40mg的剂量给予地塞米松,每周给药一次(即q1wk)。因此,例如,一些组合疗法实施方式涉及标准给药组合疗法,其中地塞米松与本文所述的抗-bcma抗体或抗原结合片段的标准给药方案组合给予,其中抗体或抗原结合片段以q2wk给予。例如,在一些标准给药组合治疗中,在每个28天周期的第1天和第15天给予本文所述的抗-bcma抗体或抗原结合片段(即根据标准给药方案),和每个28天周期的第1天、第8天、第15天和第22天给予地塞米松。在一些这些标准给药组合实施方式中,每剂抗体或抗原结合片段以800mg的剂量给药,每剂地塞米松以40mg的剂量给药。在其他这些实施方式中,每剂抗体或抗原结合片段以1600mg的剂量给药,每剂地塞米松以40mg的剂量给药。
[0388]
联合疗法实施方案的其他例子涉及强化给药组合疗法,其中地塞米松与本文所述的任何抗-bcma抗体或抗原结合片段的强化剂量方案组合给药,其中抗体或抗原结合片段
以q1wk给予8周,随后q2wk给药。例如,在一些强化给药组合中,在第1和第2周期的第1、第8、第15和第22天,以及后续周期的第1和第15天给予如本文所述抗-bcma抗体或抗原结合片段(即根据强化给药方案),在每个28天周期的第1、第8、第15和第22天给予地塞米松。在一些这些强化给药组合实施方式中,每剂抗体或抗原结合片段以800mg的剂量给予,每剂地塞米松以40mg的剂量给予。在其他这些实施方式中,每剂抗体或抗原结合片段以1600mg的剂量给予,每剂地塞米松以40mg的剂量给予。
[0389]
在任何一个示例性的组合疗法中,当都在同一天给予抗-bcma抗体或抗原结合片段和地塞米松时,在sea bcma输注前1至3小时给予地塞米松。
[0390]
在一些实施方式中,进一步将泊马度胺与本文所述的标准或强化单药治疗方案或组合治疗组合。在一些实施方式中,在重复的28天周期的第1-21天每天以4mg的剂量给予泊马度胺。
[0391]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或抗原结合片段(例如,每个28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),在重复28天周期的第1-21天每天给予泊马度胺。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如sea-bcma)(例如,每个28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),在重复28天周期的第1-21天每天给予4mg泊马度胺。
[0392]
在一些实施方式中,每周一次给予对象本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),在重复的28天周期的第1-21天每天给予泊马度胺。在一些实施方式中,每周一次给予对象1600mg抗-bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),在重复的28天周期的第1-21天每天给予4mg泊马度胺。
[0393]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或抗原结合片段(例如,每个28天周期的第1天和第15天),约每周一次至约每四周一次给予抗-cd38抗体或其抗原结合片段(例如,约每周一次、约每两周一次,或约每四周一次)。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如,sea-bcma)(例如,每个28天周期的第1天和第15天),约每周一次至约每四周一次给予16mg/kg抗-cd38抗体(例如,达雷木单抗)(例如,约每周一次、约每两周一次,或约每四周一次)。
[0394]
在一些实施方式中,每周一次给予对象本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,和后续的28天周期的第1天和第15天),约每周一次至约每四周一次给予抗-cd38抗体或其抗原结合片段(例如,约每周一次、约每两周一次,或约每四周一次)。在一些实施方式中,每周一次给予对象1600mg抗-bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),约每周一次至约每四周一次(例如,约每周一次,约每两周一次,或约每四周一次)给予16mg/kg抗-cd38抗体(例如达雷木单抗)。
[0395]
在一些实施方式中,每两周一次给予对象如本文所述的抗-bcma抗体或抗原结合片段(例如,每个28天周期的第1天和第15天),并以为对象适当确定的给药时间表给予对象gsi。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如sea-bcma)(例如,每个28天周期的第1天和第15天),并以为对象适当确定的给药时间表给予对象gsi。
[0396]
在一些实施方式中,每两周一次给予对象如本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),并以为对象适当确定的给药时间表给予对象gsi。在一些实施方式中,每周一次给予对象1600mg抗bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),并以为对象适当确定的给药时间表给予对象gsi。
[0397]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或抗原结合片段(例如,每个28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象imid。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如sea-bcma)(例如,每个28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象imid。
[0398]
在一些实施方式中,每周一次给予对象本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象imid。在一些实施方式中,每周一次给予对象1600mg抗-bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象imid。
[0399]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或抗原结合片段(例如,在每个28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天)和约每周一次至约每四周一次给予抗-cd38抗体或其抗原结合片段(例如,约每周一次、约每两周一次、或约每四周一次)。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如sea-bcma)(例如,每个28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天)和约每周一次至约每四周一次(例如,约每周一次,约每两周一次,或约每四周一次)给予16mg/kg抗-cd38抗体(例如达雷木单抗)。
[0400]
在一些实施方式中,每周一次给予对象本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,和后续的28天周期的第1天和第15天),约每周一次给予地塞米松(例如在每个28天周期的第1天、第8天、第15天和第22天)和约每周一次至约每四周一次给予抗-cd38抗体或其抗原结合片段(例如,约每周一次、约每两周一次,或约每四周一次)。在一些实施方式中,每周一次给予对象1600mg抗-bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一
次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天)和约每周一次至约每四周一次(例如,约每周一次、约每两周一次、或约每四周一次)给予16mg/kg的抗-cd38抗体(例如,达雷木单抗)。
[0401]
在一些实施方式中,每两周一次给予对象本文所述的抗-bcma抗体或抗原结合片段(例如,每个28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象gsi。在一些实施方式中,每两周一次给予对象1600mg抗-bcma抗体(例如sea-bcma)(例如,每个28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象gsi。
[0402]
在一些实施方式中,每周一次给予对象本文所述的抗-bcma抗体或抗原结合片段,持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象gsi。在一些实施方式中,每周一次给予对象1600mg抗-bcma抗体(例如sea-bcma),持续约8周,然后每两周一次(例如,在两个28天周期的第1天、第8天、第15天和第22天,以及后续的28天周期的第1天和第15天),每周一次给予40mg地塞米松(例如,在每个28天周期的第1天、第8天、第15天和第22天),并以为对象适当确定的给药时间表给予对象gsi。
[0403]
i.不同给药方案和组合疗法的患者选择。
[0404]
需要全身疗法的多发性骨髓瘤(mm)的诊断可以基于国际骨髓瘤工作组(imwg)2014年的标准。可测量的疾病可以由以下一项或多项来定义:
[0405]
a)血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl;
[0406]
对于iga或igd骨髓瘤患者,血清iga或血清igd≥0.5g/dl是可接受的
[0407]
b)尿液m-蛋白水平≥200mg/24hr
[0408]
c)血清免疫球蛋白flc≥10mg/dl和血清免疫球蛋白κλflc比率异常
[0409]
在一些实施方式中,在接受本文所述的治疗前,需要ecog表现状态评分为0或1。
[0410]
在一些实施方式中,在没有生长因子或血小板输注支持的情况下,必须满足血液学标准:
[0411]
a)根据肾病饮食的修正(modification of diet in renal disease,mdrd)方程式估算的肾小球过滤速率(egfr)≥30ml/分钟/1.73m2。
[0412]
b)绝对中性粒细胞计数≥1000/μl
[0413]
c)血小板计数≥75,000/μl。
[0414]
可以选择患者进行不同的给药方案或组合疗法。例如,可以给予某些患者标准给药(例如,q2wk,每个28天周期的第1天和第15天)。在一些实施方式中,这些患者必须没有其他已知可为mm提供临床益处的治疗方案。在一些实施方式中,患者之前的治疗线必须至少包括蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体,在治疗过程中以任何顺序进行。
[0415]
可以给予某些患者强化给药(例如,前两个28天的周期为q1wk,然后在后续的28天周期为q2wk)或与地塞米松的组合疗法。在一些实施方式中,这些患者必须没有其他已知可为mm提供临床益处的治疗方案。在一些实施方式中,这些患者必须已经接受了至少3种先前
的抗骨髓瘤治疗线,并且必须对以下各类别中的至少一种试剂是难治性的:pi、imid和抗-cd38抗体。当给予患者与地塞米松的组合疗法时,可以按照标准给药时间表或强化给药时间表给予本文所述的抗体或其抗原结合片段。
[0416]
在一些实施方式中,可以给予某些患者地塞米松和imid的组合疗法。在一些实施方式中,这些患者必须已经接受了至少2种先前的抗骨髓瘤治疗线,包括至少连续2个周期的来那度胺和蛋白酶体抑制剂(单独或组合给予),并且必须在最后一次治疗完成时或60天内有imwg疾病进展的记录。有自体sct(干细胞移植)病史的患者,如果移植日期在起始sea-bcma治疗前至少12周,则适格。
[0417]
试验
[0418]
通过本文所述方法治疗的对象的身体状况可以通过本领域已知的任何合适的试验来测量。非限制性的试验包括免疫组织化学试验、放射成像试验、体内成像、正电子发射断层扫描(pet)、单光子发射计算机断层扫描(spect)、磁共振成像(mri)、超声、光学成像、计算机断层扫描、放射免疫测定(ria)、elisa(酶联免疫吸附试验)、槽印迹、竞争结合试验、荧光成像试验、western印迹、facs等。
[0419]
在一些实施方式中,从对象身上收集生物样品用于试验。生物样品包括但不限于血液、血清、尿液、血浆、呼吸道、肠道和泌尿生殖道的外分泌物、脑脊液、腹膜液、胸膜液、囊液、支气管肺泡灌洗液、身体的任何其他部分或系统的灌洗液,以及任何器官的样品,包括分离的细胞或组织,其中细胞或组织可从选自但不限于肺、结肠、肾、胰腺、卵巢、前列腺、肝、皮肤、骨髓、淋巴结、乳房和/或血液组织的器官获得;粪便或组织样品,或其任何组合。在进行试验之前,可以任选地用合适的稀释剂稀释样品。在一些实施方式中,从样品中获得的细胞在进行试验前进行体外培养。
[0420]
在一些实施方式中,可以测量对象血清中的抗-bcma抗体的稳态浓度。
[0421]
一种示例性的体外细胞结合能力试验,以估计患者血清中的游离抗-bcma抗体,涉及将培养的mm1r细胞悬浮液沉淀,然后将沉淀重新悬浮在治疗中不同时间点收集的对象外周血的血清中。在室温下孵育0.5小时后,洗涤细胞,用饱和量的本文所述的偶联至荧光染料的抗-bcma抗体之一进行染色。在4℃黑暗中孵育0.5小时后,洗涤并固定细胞。染色细胞在invitrogen attune nxt流式细胞仪上进行分析。使用flowjo v10软件对有活力的细胞进行门控,并记录中值荧光强度(mfi)。graphpad prism 8用于分析。
[0422]
确定bcma表达和其配体与本文所述的抗-bcma抗体结合的一种示例性方法涉及在基线和治疗后或治疗期间收集对象的骨髓抽吸物,然后在收集后一天内用流式细胞仪测定样品。mm细胞检测可使用胞外生物标志物染色,例如cd138、cd38、cd45、cd56和cd28染色以及胞内κ和λ轻链染色。可以使用例如两种抗-bcma抗体对bcma的表达进行分析:使用标记的抗-bcma抗体检测可用于与抗-bcma抗体结合的bcma,该抗体与参考抗-bcma抗体(例如本文所述的其中一种抗体或抗原结合片段,如实施例中所述的sea-bcma抗体)和bcma配体(april等)以竞争方式结合bcma,而总胞外bcma则使用不同标记的抗-bcma抗体进行检测,该抗体结合bcma而不与参考抗体和bcma配体竞争。还可以检测与mm细胞表面的bcma结合的april。每个样品分成3个等分样品:一个等分样品只用mm门控抗原染色,但不使用抗-bcma或抗-april抗体(门控对照)、一个等分样品用mm门控抗原和两种标记的抗-bcma抗体染色,一个等分样品在37℃下与加标的bcma(例如,100μg/ml的加标的bcma)孵育,然后用mm门控
抗原、april和检测胞外bcma总量的标记的抗-bcma抗体染色。染色后,洗涤细胞,用2%的多聚甲醛固定,在流式细胞仪上分析细胞。
[0423]
试剂盒
[0424]
本文还提供了包括以下内容的试剂盒:(a)一个或多个剂量(例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或26剂)的药物组合物(例如本文所述的任何药物组合物),包括本文所述的任何抗体或其抗原结合片段,和(b)执行本文所述任何一种方法的说明或指示。
[0425]
在一些实施方式中,一个或多个剂量可以在注射装置中提供(例如,预装载注射装置)。在一些实施方式中,一个或多个剂量可以作为冻干固体组合物提供,该组合物可以使用药学上可接受的缓冲液或溶液(例如,生理盐水或磷酸盐缓冲盐水)进行重建。在一些实施方式中,一个或多个剂量可以作为液体组合物提供(例如,可以通过静脉内给药给予对象的液体组合物)。
[0426]
实施例
[0427]
实施例1.sea-bcma治疗多发性骨髓瘤的临床研究
[0428]
sea-bcma是非岩藻糖基化单克隆抗-bcma抗体,具有seq id no:13的重链氨基酸序列和seq id no:15的轻链氨基酸序列。
[0429]
sea-bcma的重链(seq id no:13)
[0430]
qvqlvqsgaevkkpgasvklsckasgytftdyyihwvrqapgqglewigyinpnsgytnyaqkfqgratmtadksintayvelsrlrsddtavyfctrymwervtgffdfwgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0431]
sea-bcma的轻链(seq id no:15)
[0432]
diqmtqspssvsasvgdrvtitclasedisddlawyqqkpgkapkvlvyttsslqsgvpsrfsgsgsgtdftltisslqpedfatyfcqqtykfpptfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0433]
sea-bcma包括:重链可变区和轻链可变区,所述重链可变区包括含有dyyih(seq id no:1)的cdr1、含有yinpnsgytnyaqkfqg(seq id no:2)的cdr2,和含有ymwervtgffdf(seq id no:3)的cdr3,以及轻链可变区包括含有lasedisddla(seq id no:5)的cdr1、含有ttsslqs(seq id no:6)的cdr2和含有qqtykfppt(seq id no:7)的cdr3。sea-bcma包括含有seq id no:4的重链可变区,和含有seq id no:8的轻链可变区。
[0434]
一项评估sea-bcma在疾病复发或对标准疗法为难治性,且仍无治疗选择的患者群体中的临床研究正在进行,初始数据表明,本文所述的治疗多发性骨髓瘤的方法提供了临床益处。
[0435]
sea-bcma的免疫特异性和抗肿瘤活性已经在体外和体内表达bcma的mm模型中得到证实。
[0436]
本研究评估了sea-bcma对rrmm患者的安全性和抗肿瘤活性。该研究的具体目标和相应的终点总结如下(表2)。
[0437]
表2:目标和相应的终点
[0438]
[0439][0440][0441]
研究设计总结
[0442]
单药疗法的剂量递增队列
[0443]
该试验的单药疗法的剂量递增部分在约25名患者中进行。
[0444]
该研究的入组是按队列进行的。每个剂量水平有多个队列接受治疗,每个队列最多有4名患者接受治疗。在每个队列完成后,与安全监测委员会(smc)协商决定剂量递增和后续队列规模。在下一队列患者入组前,对当前队列中的患者进行dlt期的全程观察。此外,作为一项预防措施,对于研究中的前2名患者,在下一个患者可以给药之前有72小时的观察期。在剂量水平高于第1剂量水平的情况下,在第一个患者接受第一剂sea-bcma后,需要有24小时的观察期,然后再给该剂量水平的后续患者用药。每个剂量水平至少治疗2名dlt可评估(de)患者,直到观察到第一个dlt,然后每个剂量水平最少需要3名de患者,才能递增到所有更高剂量。在第1周期中被认为无法评估dlt的患者被替换。在确定mtd或最佳剂量之前,在估计的mtd下最少要观察到6名de患者。mtd或最佳剂量是根据所有评估剂量的所有患者的数据来估计的。
[0445]
经与smc协商,可在任何时候进行递减到较低剂量水平。如果患者能耐受sea-bcma并达到疾病稳定(sd)或更优,可以允许患者内部剂量递增到显示为安全的剂量水平。
[0446]
患者继续接受治疗,直到疾病进展或出现不可接受的毒性,以先发生者为准。
[0447]
在4周的周期内,起初每2周给予一次(q2wk)sea-bcma,计划剂量见表3;探索了每4周一次(q4wk)的给药间隔。
[0448]
表3:剂量递增方案
[0449][0450]
单药疗法扩展队列
[0451]
为了进一步表征sea-bcma的安全性和抗肿瘤活性,入组了多达约40名患者的扩展队列。扩展队列的剂量和时间表是在与smc协商后确定的,其依据是剂量递增过程中表现出的累积安全性和活性,在测试剂量下以未超过mtd完成。
[0452]
单药疗法强化给药
[0453]
强化给药评估了sea-bcma在诱导阶段每周一次(q1wk)的安全性和耐受性(在治疗的前2个周期中持续8个剂量);在完成8周的诱导阶段后,尚未经历证实的疾病进展的患者继续在维持阶段接受q2wk给药的sea-bcma(第3周期及以后,按推荐的标准时间表单药疗法扩展剂量给药)。
[0454]
强化给药包括以推荐的sea bcma单药疗法扩展剂量(1600mg)进行安全磨合,按强化给药时间表给予(第1和第2周期的第1天、第8天、第15天和第22天,以及后续周期的第1和第15天)。正在对前6名患者的dlt进行评估。
[0455]
在剂量查询过程中被认为无法评估剂量限制性毒性(dlt)的患者将被替换,以确定sea-bcma与地塞米松组合的剂量。
[0456]
表4:单药疗法强化给药的剂量水平
[0457][0458]
地塞米松组合疗法队列
[0459]
为了表征sea-bcma与地塞米松组合的安全性和耐受性,每个任选的组合疗法队列初始将入组约20名患者。
[0460]
在鉴定了可耐受的sea-bcma单药剂量和时间表后,将起始组合疗法队列的入组工作。
[0461]
在任选的队列1中,sea-bcma将在每个28天周期的第1天和第15天给药(标准给药)。将在每个28天周期的第1天、第8天、第15天和第22天给予地塞米松。
[0462]
在任选的队列2中,将在第1和第2周期的第1天、第8天、第15天和第22天,以及后续周期的第1天和第15天给予sea-bcma(强化给药)。将在每个28天周期的第1天、第8天、第15天和第22天给予地塞米松。
[0463]
泊马度胺和地塞米松组合疗法队列
[0464]
泊马度胺和地塞米松组合疗法队列将在患者中,研究sea-bcma与泊马度胺和地塞米松的组合,所述患者之前至少接受过2种抗骨髓瘤治疗。将在每个28天周期的第1天和第15天给予sea-bcma(标准给药)。将在每个28天周期的第1天、第8天、第15天和第22天给予地塞米松。将在每个28天周期的第1-21天给予泊马度胺。
[0465]
组合疗法队列的安全磨合
[0466]
组合疗法队列将包括以推荐的sea bcma单药剂量和时间表进行的安全磨合。将对每个组合疗法队列中入组的前6名患者进行dlt评估。
[0467]
在剂量查询过程中被认为无法评估dlt的患者将被替换,以确定sea-bcma与地塞米松组合的剂量。
[0468]
剂量限制毒性(dlt)
[0469]
dlt评估期是治疗的第1个周期。根据美国国家癌症研究所不良事件通用术语标准(nci-ctcae)4.03版对dlt进行分级,并定义为dlt评估期间的任何下列事件。
[0470]
因毒性而延迟治疗超过7天
[0471]
任何不良事件(ae)≥3级,除非smc认为与sea-bcma明显无关,但以下ae除外,它们必须满足这些指定的标准才能被视为dlt:
[0472]
ο持续5天以上的4级中性粒细胞减少症
[0473]
ο血小板减少症≥4级,或3级血小板减少症并伴有临床上显著的出血
[0474]
ο贫血≥4级,与基础疾病无关
[0475]
ο任何≥3级的肿瘤裂解综合征,包括相关的实验室评估,临床上没有成功控制,并且在7天内无终末器官损伤的情况下,没有消退
[0476]
ο任何≥4级的输注相关反应(irr)或3级irr,在中断输注、降低输注率和/或标准支持性措施的情况下,24小时内不能消退到≤2级。如果有≥20%的患者出现3级irr(即前10名患者中有2名或更多),所有后续患者将需要根据smc的建议进行预用药和/或修改输液方式。对于接受预用药的患者,任何≥3级的irr将被视为dlt。
[0477]
ο任何≥3级的无症状实验室异常,其无论是否有干预措施,都不能在72小时内消退到≤1级或基线等级的问题
[0478]
ο任何与治疗相关的死亡
[0479]
停止标准
[0480]
如果出现任何以下情况,则停止研究:
[0481]
用药后30天内发生的与基础疾病无关的研究性毒性死亡率超过10%(起初,前20名患者中有2名或更多)
[0482]
与基础疾病无关的4级非血液学毒性发生率超过25%(起初,前20名患者中有5名或更多)
[0483]
标准治疗无法控制的≥4级过敏反应率超过15%(起初,前20名患者中有3名或更多)
[0484]
在整个研究过程中,停止标准由主办方持续监控。
[0485]
讨论和研究设计的基本原理
[0486]
sea-bcma的最初临床开发涉及对rrmm患者的评估,这些患者没有其他已知可提供临床益处的治疗选择,而且治疗医师认为他们是sea bcma治疗的候选者。先前的治疗必须至少包括蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体。一线治疗和首次复发的标准护理(soc)治疗预计在入组前对这些患者已经失败。尽管在这项1期研究中探索了靶标表达和结果之间的关系,由于bcma在mm患者中是广泛表达的肿瘤抗原,因此不需要根据bcma的表达来初步选择患者。
[0487]
研究的第一部分包括剂量递增,以估计sea-bcma的mtd和/或最佳剂量。剂量递增完成后,药物的安全性得到证明,入组约40名患者的扩展队列,以进一步评估sea-bcma在标准q2wk给药时间表下的安全性和抗肿瘤活性。扩展队列允许收集有关sea-bcma的安全性、耐受性和活性的额外信息。这些信息是确定sea-bcma的推荐单药剂量和时间表的基础。由于维持治疗已被证明可延长mm患者的缓解期,因此允许患者继续接受治疗,直到疾病进展(pd)或不可接受的毒性,以先发生者为准。此外,如果患者耐受sea-bcma并达到sd或更优,则允许患者内部剂量递增至显示为安全的剂量水平。
[0488]
研究人群
[0489]
所有患者符合所有的入组标准,以在参加这项研究和在第1周期第1天的研究药物给予前(给药的第1天内)适格。
[0490]
为了适格再治疗,所有患者都符合以下部分中概述的纳入和排除标准。
[0491]
纳入标准
[0492]
1.多发性骨髓瘤(mm)诊断需要国际骨髓瘤工作组(imwg)2014标准所定义的全身治疗(rajkumar,等,lancet oncol 15(12):e538-48,2014)。
[0493]
2.患者必须患有复发或难治性mm,并且必须没有其他已知可及的为mm提供临床益处的治疗方案,并且治疗医师认为是sea-bcma治疗的候选者。
[0494]
(a)入组剂量递增队列和剂量扩展队列的患者必须没有其他已知可及的为mm提供临床益处的治疗方案。入组剂量递增研究的患者之前的治疗线必须至少包括蛋白酶体抑制剂(pi)、免疫调节药物(imid)和抗-cd38抗体,在治疗过程中以任何顺序进行。允许不能耐受pi、imid或抗-cd38抗体的参与者。
[0495]
(b)入组单药强化给药或地塞米松组合疗法的患者必须没有其他已知可及的提供mm临床益处的治疗方案。患者必须已经接受了至少3种先前的抗骨髓瘤治疗线,并且必须对以下各类别中的至少一种试剂是难治性的:pi、imid和抗-cd38抗体。
[0496]
(c)入组泊马度胺和地塞米松组合疗法的患者必须已经接受了至少2种先前的抗骨髓瘤治疗线,包括至少连续2个周期的来那度胺和蛋白酶体抑制剂(单独或组合给予),并且必须在最后一次治疗完成时或60天内有imwg疾病进展的记录。有自体sct病史的患者,如果移植日期在起始sea-bcma治疗前至少12周,则适格。
[0497]
可测量的疾病,如以下一项或多项来定义:
[0498]
a.血清单克隆副蛋白(m-蛋白)水平≥0.5g/dl;对于iga或igd骨髓瘤患者,血清iga或血清igd≥0.5g/dl是可接受的
[0499]
b.尿液m-蛋白水平≥200mg/24hr
[0500]
c.血清免疫球蛋白游离轻链≥10mg/dl和血清免疫球蛋白κλ游离轻链比率异常
[0501]
年龄为18岁或以上。
[0502]
美国东部合作肿瘤学组(an eastern cooperative oncology group)(ecog)表现状态评分为0或1(例如使用karnofsky和lansky量表转换表现状态,如适用)。
[0503]
以研究者的意见,预期寿命大于3个月
[0504]
以下基线实验室数据(在没有生长因子或血小板输注支持的情况下,必须满足血液学标准):
[0505]
a.根据肾病饮食的修正(modified diet in renal disease)mdrd)方程式估算的肾小球过滤速率(egfr)≥30ml/分钟/1.73m2[0506]
b.绝对中性粒细胞计数(anc)≥1000/μl
[0507]
c.血小板计数≥75,000/μl
[0508]
在下述情况下有生育潜能的患者:
[0509]
a.在第一次给药sea-bcma之前7天内,必须有阴性的血清或尿液妊娠测试(最低灵敏度25miu/ml或同等单位的β-人绒毛膜促性腺激素[β-hcg])结果。具有假阳性结果且记录证明患者未怀孕的患者有资格参与。
[0510]
b.必须同意在研究期间和sea-bcma最终剂给药后至少6个月内不要尝试怀孕。
[0511]
c.必须同意从知情同意开始并持续到sea-bcma最终剂给药后的6个月不进行母乳喂养或捐献卵子。
[0512]
d.如果以可能导致怀孕的方式进行性生活,从知情同意开始持续整个研究并在研究药物最终剂后的6个月,必须持续使用2种高效节育方法。
[0513]
在下述情况下可以成为父亲的患者:
[0514]
a.必须同意从知情同意开始持续整个研究并在最终剂研究药物药后的6个月不捐献精子。
[0515]
b.如果以可能导致怀孕的方式与具有生育能力的人进行性生活,从知情同意开始
持续整个研究并在研究药物最终剂给药后的6个月,必须持续使用2种高效节育方法。
[0516]
c.如果与孕妇或母乳喂养的人进行性生活,从知情同意开始持续整个研究并在sea-bcma最终剂给药后的6个月,必须持续使用2种避孕选项之一。
[0517]
有生育能力的女性对象,入组涉及泊马度胺的组合疗法,患者必须满足以下条件:
[0518]
a.必须具有2次阴性的血清或尿液妊娠测试(最低灵敏度为25miu/ml或同等单位的hcg)。一次在研究药物开始前10-14天,一次在研究药物开始前24小时
[0519]
b.必须同意在研究期间和研究药物最终剂给药后至少6个月内不要尝试怀孕。
[0520]
c.必须同意从知情同意开始并持续到研究药物最终剂后的6个月不进行母乳喂养或捐献卵子。必须同意在研究治疗结束后至少90天内不献血
[0521]
d.如果以可能导致怀孕的方式进行性生活,必须在研究药物治疗开始前4周持续使用2种高效的避孕方法,并在整个研究过程中和最后一剂研究药物服用后至少6个月内继续使用。
[0522]
有生育能力的男性对象,入组涉及泊马度胺的组合疗法,患者必须满足以下条件:
[0523]
a.必须同意从知情同意开始持续整个研究并在最终剂研究药物后的6个月不捐献精子。必须同意在研究治疗结束后至少90天内不献血。
[0524]
b.如果以可能导致怀孕的方式与有生育能力的人,或正在怀孕或哺乳的人进行性生活,从知情同意开始持续整个研究并在研究药物最终剂给药后的6个月继续,必须持续使用2种高效的避孕方法,其中一种必须是乳胶或合成避孕套。
[0525]
此外,入组涉及泊马度胺的组合疗法的对象必须愿意并能够遵守风险评估和缓解策略(rems)计划。
[0526]
此外,患者必须提供书面知情同意书。
[0527]
排除标准
[0528]
先前暴露于任何其他bcma介导的治疗
[0529]
sea-bcma第一剂之前3年内其他恶性肿瘤的病史,或来自先前诊断为恶性肿瘤的残留疾病的证据。例外情况是转移或死亡风险可忽略不计的恶性肿瘤(例如,5年总存活率≥90%),例如充分治疗的子宫颈原位癌、非黑素瘤皮肤癌、局部前列腺癌、原位导管癌或i期子宫癌。
[0530]
与潜在恶性肿瘤有关的活动性脑/脑膜疾病。如果之前的中枢神经系统疾病已经得到治疗,则允许有与基础恶性肿瘤有关的脑/脑膜疾病史的患者。
[0531]
在第一剂sea-bcma前2周内,任何不受控制的3级或更高的(根据ncictcae,4.03版本)病毒、细菌或真菌感染。允许常规抗菌预防。
[0532]
通过表面抗原表达的乙型肝炎阳性。活动性丙型肝炎感染(聚合酶链反应阳性或在过去6个月内接受丙型肝炎的抗病毒治疗)。已经接受过丙型肝炎感染治疗的患者,如果他们有记录的持续病毒学缓解达12周,则是允许的。
[0533]
已知人免疫缺陷病毒(hiv)阳性。
[0534]
先前有同种异体干细胞移植(sct)的患者。
[0535]
对象在第一剂sea bcma前6个月内记录了符合纽约心脏协会(参见附录f),iii-iv级的脑血管事件(中风或短暂性脑缺血发作)、不稳定型心绞痛、心肌梗死或符合充血性心力衰竭的心脏症状的病史。对于与泊马度胺的组合疗法:在研究期间无法耐受血栓栓塞预
防。
[0536]
目前正在接受其他全身抗肿瘤剂或研究药剂的治疗
[0537]
在第一剂sea-bcma前4周(或者,如果正在进展,2周)未完成化疗、放疗、生物制剂、研究性药剂和/或其他有免疫疗法的抗肿瘤治疗和从与该治疗相关的临床显著毒性中恢复。第一剂sea-bcma前8周未完成car t细胞治疗。经医学监察员批准,允许对单一部位的疾病进行姑息性放疗。
[0538]
在入组后14天内使用皮质类固醇(每天》10mg强的松等效物)或其他免疫抑制药物进行全身治疗。允许吸入或局部使用类固醇和肾上腺替代类固醇剂量每天≤10mg强的松等效物。
[0539]
从知情同意开始直到研究药物最终剂给药后6个月哺乳、怀孕或计划怀孕的患者。
[0540]
对sea-bcma药物制剂中包含的任何赋形剂的已知过敏症。
[0541]
患有浆细胞白血病(按标准鉴别法,循环浆细胞》2.0
×
109/l)、瓦尔登斯特伦巨球蛋白血症、poems综合征(多发性神经病、器官肿大、内分泌病、单克隆蛋白和皮肤变化)或临床上显著的淀粉样变性的患者。
[0542]
中度或重度肝损伤,如以下任何一项所示:
[0543]
a.血清总胆红素》1.5x正常上限(uln)。对于吉尔伯特氏病(gilbert’s disease)患者,总胆红素》3x uln。
[0544]
b.丙氨酸转氨酶(alt)或天冬氨酸转氨酶(ast)》3x uln。
[0545]
研究者判断会使对象处于不适当的风险或干扰对sea-bcma的安全性和毒性进行适当评估的重大合并症或疾病。
[0546]
仅对于组合疗法:已知对皮质类固醇不耐受。
[0547]
仅对于组合疗法:任何未受控的精神疾病。
[0548]
对于与泊马度胺的组合疗法:使用泊马度胺治疗之前,或imid治疗(沙利度胺或来那度胺)之前的超敏反应史。
[0549]
仅对于组合疗法:≥2级的周围神经病变。
[0550]
仅对于组合疗法:
[0551]
可能显著改变泊马度胺吸收的胃肠道疾病。
[0552]
研究治疗的停止
[0553]
患者的研究治疗可因以下任何原因而停止:
[0554]
进展性疾病(pd)
[0555]
ae
[0556]
妊娠
[0557]
研究者决定
[0558]
患者决定,非-ae
[0559]
主办方终止研究
[0560]
其他,非-ae
[0561]
在单药疗法中,停止sea-bcma的患者被认为停止研究治疗。停止研究治疗的患者将继续接受研究随访,直到撤回知情同意、死亡或研究结束,以先发生者为准。
[0562]
在组合疗法中,停止sea bcma和地塞米松的患者将被认为停止研究治疗。接受地
塞米松治疗的患者,如果停止皮质类固醇治疗,经医学监察员批准,可继续接受sea-bcma作为单药治疗。停止sea-bcma的患者将被认为停止研究治疗。
[0563]
患者退出研究
[0564]
任何患者可以因为以下原因而停止研究:
[0565]
a)患者撤回知情同意;
[0566]
b)再治疗;
[0567]
c)主办方终止研究;
[0568]
d)丢失随访;
[0569]
e)死亡;
[0570]
f)其他。
[0571]
治疗
[0572]
sea-bcma是针对bcma的非岩藻糖基化单克隆抗体。
[0573]
本文描述了对那些有可能在剂量递增期间以分配的剂量水平的更高剂量上获得更大益处的患者进行患者内剂量递增的指导。
[0574]
说明
[0575]
sea-bcma是一种无菌的、不含防腐剂的、无色至淡黄色、透明至略带乳白色的溶液,无可见颗粒物。sea-bcma在单剂玻璃小瓶中供应。该药物产品溶液被稀释在无菌的0.9%氯化钠注射液中,美国药典(usp),或等效物,用于静脉内(iv)给药。
[0576]
sea-bcma药物产品标记为标定含量为100mg/小瓶。每瓶含有110mg sea-bcma,可按标记上的量提取使用。sea-bcma药物产品由sea-bcma(20mg/ml)、组氨酸、精氨酸、海藻糖和聚山梨醇酯80组成。该产品的ph约为6.5。
[0577]
剂量和给药
[0578]
sea-bcma以指定的剂量通过iv输注给予。sea-bcma不以iv推注或团注的方式给予。sea-bcma不与其他药物混合。
[0579]
在第1周期第1天,在剂量递增期间,研究治疗给药完成后,在诊所密切观察患者至少6小时。收集生命体征。在审查安全数据后,考虑对后续周期进行额外的监测。在审查了剂量递增队列的数据后,没有出现延迟发生的输注相关反应(irr)的情况,在单药疗法剂量扩展期间,在单药疗法强化给药和组合疗法队列中,第1周期第1天完成研究治疗给药后的观察时间减少到2小时。
[0580]
输注持续时间因输注给药的方法和sea bcma剂量而异。
[0581]
最初的sea-bcma给药方法是逐步输注。在逐步输注中,输注率按设定的时间间隔增加,直到达到规定的最大输注率。sea-bcma的第一次输注是以50mg/小时的速率开始的。如果前30分钟耐受良好,则在耐受的情况下每30分钟逐渐增加速率(速率增加不超过2倍),直到达到最大速率(400mg/小时)。在后续的输注中,可以在较短的时间间隔内更快地增加输注率;例如,在最初的15分钟后,可以根据耐受情况每15分钟逐渐增加速率(速率增加不超过2倍),直到达到最大速率。
[0582]
随着逐步输注的临床经验的发展,可以根据积累的安全数据和/或smc的建议增加或减少最大速率。此外,可根据smc的建议,评估sea-bcma给药的替代性方法,以管理潜在的安全信号,包括irr。这些方法可能包括全身实施以下策略:延长计划的输注持续时间、固定
持续时间输注(以固定的输注率给药)、分剂量给药或改变预用药。
[0583]
固定持续时间输注
[0584]
考虑一些关于固定持续时间输注的标准:
[0585]
如果实施固定持续时间输注,sea-bcma输注持续时间由医师确定。随着sea-bcma输注的临床经验的发展,可以根据积累的安全数据和/或smc的建议增加或减少输注持续时间。
[0586]
在个体患者中,如果患者不能耐受输注,可增加输注持续时间;经医学监察员批准,研究者可酌情增加后续输注的输注持续时间。反之,如果患者连续输注的irr不超过1级,经医学监护人批准,研究者可酌情缩短输注持续时间(即以更快的速率给药),其实施可能与特定剂量队列有关。
[0587]
如果实施固定输注速率,则以固定速率而不是以固定时间给予剂量。
[0588]
例如,对于50mg/小时的固定输注率,将2小时输注100mg的剂量。随着以固定输注率给药的临床经验的发展,可以根据积累的安全数据和/或smc的建议增加或减少速率。
[0589]
在个体患者中,如果患者不能耐受输注速率,经医学监察员批准,在后续输注中可以降低输注速率。反之,如果个别患者在连续输注中没有经历大于1级的irr,经医学监护人批准,研究者可酌情增加输注率。
[0590]
分剂量给药
[0591]
考虑一些关于分剂量给药的标准:
[0592]
如果实施分剂量给药,则在一个时间段内将剂量分开并分别给予。例如,剂量可分为两部分,其中前10%的剂量在大约45分钟内输注,随后30分钟观察期,患者留在输注椅上。如果研究者确定患者已经耐受初始的sea-bcma输注,则在大约45分钟内输注剩余的90%。
[0593]
剂量调整
[0594]
在每个患者的基础上,经医学监察员批准,允许由于毒性(包括dlt)延长给药间隔。在第1周期经历dlt的患者不接受sea bcma的进一步治疗,除非在充分管理毒性的情况下证明临床获益,并且得到医学监察员的批准。临床益处的例子包括通过成像、实验室评估或体格检查评估的客观缓解(or);或sd和每个研究者的疾病相关症状的临床改善。如果证明有临床益处,在与医学监察员讨论后,给药间隔延长50%-100%。观察到的ae的类型和严重程度也纳入考虑范围,为决策提供依据。对于以最低剂量水平治疗的患者,可以延长给药间隔,或停止治疗患者。
[0595]
如果患者在计划的给药日出现了临床显著的、未解决的ae,则给药延迟多至7天。由于其他原因或持续时间超过7天的给药延迟要与医学监察员讨论;在dlt期间,患者不接受sea-bcma的进一步治疗,除非在充分管理毒性的情况下证明临床益处,并且得到医学监察员的批准。对于因未解决的ae而需要延迟给药7天以上的患者,在与医学监察员讨论后,后续剂量被减少或用药间隔被延长50-100%。给药延迟超过两倍的给药间隔时间需要患者停止研究治疗。
[0596]
在每2周一次(q2wk)给药中,如果患者在第15天有临床显著的、未解决的ae而无法给药,第15天的访视将被延迟≤7天。在第七天,如果患者不能接受该给药,该周期的第二给药将被取消,第15天的方式将被跳过,将进行第22天的访视。如果第15天的给药被延迟≤7
天,第15-28天所需的研究评估将被延迟,延迟的天数与给药延迟的天数相同,下一周期的研究药物给予将被延迟至少相同的天数。
[0597]
在强化给药的每周诱导第1和第2周期中,如果患者有临床上显著的、未解决的ae,导致第8、15或22天无法给药,则可延迟≤3天给药。在第三天,如果患者不能接受该给药,将取消sea-bcma的给药,并跳过相应的访视;给药和访视时间表将在下一周恢复(例如如果第15天被跳过,在第22天)。然而,如果第8天、第15天或第22天的给药被延迟≤3天,同一周期内的后续研究评估将被延迟,延迟的天数与给药延迟的天数相同,而下一次给药的研究药物给予将被延迟至少相同的天数。
[0598]
在dlt期间(第1周期),不鼓励使用生长因子和输注支持,除非有医学指征;在此期间因dlt以外的原因接受生长因子(如g-csf或gm-csf)或输注支持(除用于mm相关贫血红细胞输注外)的患者可能无法评估dlt。在后续周期中,考虑生长因子支持以预防或治疗血细胞减少症(表5)。在剂量递增期间,4级中性粒细胞减少症的患者在评估5天后获得随访的全血细胞计数(cbc)及差值,以评估dlt。此外,3级电解质异常的患者在评估后72小时内随访化学组以评估dlt。血清化学和全血细胞计数(cbc)在因毒性导致的给药延迟期间每周时间表最少收集一次。
[0599]
表5描述了对研究治疗相关毒性的建议剂量调整。
[0600]
表5:对于sea-bcma-相关毒性的建议剂量调整
[0601][0602]a延迟治疗》7天,应与医学监察员讨论。
[0603]
在患者耐受至少1个周期的sea-bcma并达到sd或更优的情况下,允许患者内部剂量递增。额外的治疗周期可以以低于目前入组剂量水平的1个剂量水平给药进行剂量递增(或者如果已确定,则以mtd为准)。
[0604]
地塞米松
[0605]
将在每个28天周期的第1天、第8天、第15天和第22天给予地塞米松。将以iv输注或口服(po)的方式给予40mg剂量的地塞米松。对于≥75岁,或bmi《18.5,或已知不耐受40mg地塞米松的患者,地塞米松的剂量为20mg。在给予sea-bcma的日期,在sea-bcma输注前1至3小时给予地塞米松。
[0606]
剂量调整
[0607]
表6中列出了基于毒性的剂量调整和支持性护理。
[0608]
表6:地塞米松相关毒性的剂量调整
[0609]
[0610][0611]a进入研究的患者,如果在筛查时血红蛋白a1c(hba1c)(≥6.5%)或空腹血糖(≥126mg/dl)升高,必须在第1周期开始研究治疗前或1周内转到适当的医疗机构进行血糖管理。
[0612]
泊马度胺
[0613]
泊马度胺可在每个28天周期的第1-21天每天一次给予4mg剂量po。第1周期第1天,可在sea-bcma输注前1-3小时给予泊马度胺,以便适当把握pk分析的时机。后续可在每天大约同一时间服用泊马度胺,且不进食(每餐前至少2小时或后2小时)。胶囊可用水整粒吞服,
不要打开、打破或咀嚼。
[0614]
下表提供了给予毒性的建议剂量调整和支持性护理。
[0615]
表7:对于泊马度胺-相关毒性的建议剂量调整
[0616][0617][0618]
*
如果剂量减至1mg后出现毒性反应,停用泊马度胺。
[0619]
alt=丙氨酸转氨酶,ast=天冬氨酸转氨酶,cyp=细胞色素p,nci-ctcae=美国国家癌症研究所不良事件通用术语标准,po=口服。
[0620]
如果有必要在存在cyp3a4和p-糖蛋白强抑制剂的情况下共同给予cyp1a2强抑制剂,可考虑将泊马度胺的剂量减少50%。
[0621]
剂量调整指导基于泊马度胺的处方信息,其中包含泊马度胺给药的其他指导。
[0622]
不良反应管理
[0623]
1.sea-bcma输注反应的管理
[0624]
在输注单克隆抗体疗法(如sea-bcma)期间可能发生irr。如果发生irr,应在有适
当设备和人员的场所进行输注,以管理irr。在整个研究过程中,根据机构标准,提供符合最佳患者护理的所有支持措施。支持性措施可能包括延长输注时间和/或为irr给予药物。
[0625]
在剂量递增期间,可以探索其他缓解策略来管理irr。这些策略可在smc建议下实施,并可能包括但不限于以下任何或所有措施:
[0626]
减缓、中断或以其他方式调整sea-bcma的给药
[0627]
潜在的预先用药或后用药输注,例如:
[0628]
ο抗组胺药,如苯海拉明50mg iv或等效物,法莫替丁40mg iv或等效物
[0629]
ο退热剂,如对乙酰氨基酚500
–
1,000mg po
[0630]
ο止吐剂,如昂丹司琼
[0631]
οiv液体支持,如正常盐水
[0632]
ο抗寒战(anti-rigor)药物,例如哌替啶
[0633]
ο血管收缩剂
[0634]
ο皮质类固醇,如氢化可的松100mg iv或等效物,或甲基泼尼松龙40mg iv或等效物(对于不接受地塞米松组合疗法的患者)
[0635]
关于irr的管理建议详见表8。irr应根据nci-ctcae,4.03版指南进行分级。
[0636]
表8:输注相关反应管理
[0637]
[0638][0639]
根据nci-ctcae版本4.03
[0640]
如果发生过敏性方式,应立即并永久停止sea-bcma的给药。
[0641]
所有3级或4级的irr(在输注期间或输注后≤24小时内发作)或超敏反应(输注后》24小时内发作)事件必须立即报告给主办方或指定人员,无论与sea-bcma的关系如何。所有4级事件均为严重不良事件(sae),应在sae报告时限24小时内报告。
[0642]
出现≥3级irr或延迟超敏反应的患者必须进行输注/超敏反应(ihr)访视和ihr随访访视,以评估和收集血样,分析反应的作用机制。
[0643]
sea-bcma所需的预先用药和后用药
[0644]
在第一次给药sea-bcma之前,不应给予输注反应的常规预用药。然而,经历irr的患者在输注前至少30分钟接受预先用药的后续治疗,如抗组胺药(如苯海拉明50mg iv或等效物和法莫替丁40mg iv或等效物)、皮质类固醇(如氢化可的松100mg iv或等效物)或对乙酰氨基酚(如500-1,000mg po)。随着sea-bcma输注的临床经验的发展,可以按照smc的建议,在研究治疗的第一剂量之前进行常规预用药。
[0645]
sea-bcma不需要后用药。
[0646]
在强化给药队列、地塞米松组合疗法队列以及泊马度胺和地塞米松组合疗法队列中,必须在sea-bcma输注前按以下方案给予输液反应的常规预先用药,除非smc或医药监查员有其他禁忌或建议:
[0647]
退热剂+抗组胺药:在sea-bcma输注前约45至90分钟给予(需要所有患者在第1周
期和第2周期期间的所有剂量)
[0648]
(1)对乙酰氨基酚,口服,650至1000mg
[0649]
(2)苯拉海明,口服或iv,25至50mg(或等效的h1阻滞剂)
[0650]
如果在第1周期或第2周期没有经历irr(输注相关反应):从第3周期第1天的剂量开始,可以省略一种或两种预先用药。
[0651]
如果在使用对乙酰氨基酚+抗组胺药后仍发生irr
[0652]
根据症状用支持性护理进行治疗。
[0653]
对于单药疗法的患者(不接受地塞米松),添加:
[0654]
甲基泼尼松龙,iv,100mg(或等效剂量的中长效皮质类固醇),按所需在下次sea-bcma输注前1至3小时进行预用药。如果能耐受此次输注而无irr,甲基泼尼松龙剂量可减至60mg(或等效剂量的中长效皮质类固醇),在随后的剂量前口服或iv给予。
[0655]
可考虑使用其他预先用药(如h2阻滞剂或三烯抑制剂(leukotriene inhibitor))。
[0656]
对于组合的患者(接受地塞米松),添加:
[0657]
h2阻滞剂(法莫替丁40mg iv或等效物),按需在所有后续sea-bcma剂量前45至90分钟进行预用药
[0658]
可考虑使用其他预先用药(如三烯抑制剂(leukotriene inhibitor))。
[0659]
研究评估
[0660]
筛选/基线评估
[0661]
只有符合所有纳入和排除标准的患者才入组本研究。在获得患者签署的知情同意书后,开始进行评估。
[0662]
患者的病史包括对过去的重要病史、目前的状况、先前恶性肿瘤的任何治疗和对先前治疗的缓解,以及任何相伴的药物进行彻底审查。先前治疗线的数量是使用rajkumar等人建立的标准来确定的(rajkumar等,blood126(7):921-2,2015)。简言之:
[0663]
如果治疗方案因任何原因而停止,并开始使用不同的治疗方案,则被认为是新的治疗线。
[0664]
如果因任何原因在现有疗程中意外取代或增加1种或多种药物,也被认为是开始了新的治疗线。
[0665]
在经历》1次asct的患者(计划中的串联asct的情况除外)中,第一次移植后的每次移植都应被视为新的治疗线。
[0666]
计划中的疗程有多个阶段,例如诱导治疗,后续再进行第一次asct和维持疗法,则被认为是单线疗法。
[0667]
在筛查期间,仅在怀疑或已知的浆细胞瘤病例中进行基线浆细胞瘤扫描。在治疗期间,随时进行浆细胞瘤评估以确认缓解为pr或更优,或根据临床指示确认pd。
[0668]
作为基线访视的部分,需要进行骨髓抽吸(包括骨髓抽吸凝块)和活检。
[0669]
体检包括对以下身体部位/系统的评估:腹部、四肢、头部、心脏、肺部、颈部和神经系统。还测量了体重和身高;可以利用之前12个月内获得的身高测量结果。
[0670]
血液和尿液检查包括cbc与差值、血清化学组、血清学(乙肝和丙肝)、pt/ptt/inr、hba1c(对于组合队列中的患者)和尿液分析。对有生育能力的患者进行妊娠测试。如果尿液
分析结果异常,则需要进行显微镜检尿液分析。用于计算upc比率的点滴尿液就足够了;然而,如果upc》2,则需要额外收集24小时尿液来计算upc。
[0671]
采集血样用于药效动力学生物标志物评估。
[0672]
缓解/效力评估
[0673]
缓解评估包括spep/免疫固定法、upep/免疫固定法(在基线尿m蛋白≥200mg/24小时的患者中或用于评估vgpr或更好)、sflc、定量免疫球蛋白,以及通过影像学评估浆细胞瘤(在基线、每4个周期,以及如果临床上有指征,在其他时间点)。收集这些样品进行局部评估。此外,在中心实验室使用针对igg骨髓瘤患者的改良spep分析血液。
[0674]
作为基线方式的部分,以及在第1周期的第4天(仅在扩展队列中,取决于在剂量递增期间观察到的活动或在剂量扩展期间出现的活动)、第2周期的第22-28天,以及确认血液和尿液m蛋白阴性患者的cr,都需要进行骨髓抽吸,包括bm抽吸凝块和活检。在单药疗法强化给药和组合疗法中,在第6周期和此后的每6个周期还需要进行骨髓抽吸和活检。骨髓抽吸和活检样品都在局部位点进行临床评估(第1周期第4天的样品除外)。此外,对这些样品中央地进行生物标志物分析。在试验期间的任何其他时间收集的任何其他骨髓抽吸和活检,也可以提交中央评估。
[0675]
中央地测试骨髓样品,以评估对sea-bcma的缓解/抗性,可包括但不限于:评估bcma表达、免疫激活、疾病风险概况分析、基因表达概况分析和最小残留疾病(mrd)评估。
[0676]
抗肿瘤活性的确定是根据2016年imwg标准(kumar等,lancet oncol17(8):e328-46,2016)进行的缓解评估,研究者的治疗决定是基于这些评估。每次评估时,根据当地实验室(以及中心实验室为igg mm患者运行的改良spep)、放射学和临床评估,确定scr、cr、vgpr、pr、sd和pd的临床缓解。进展性疾病是基于imwg 2016标准和/或每个研究者的临床疾病进展。所有imwg缓解是确认的缓解。当适用时,免疫表型cr、mrd状态和最小缓解的确定是按照imwg 2016标准进行的。
[0677]
药代动力学和免疫原性评估
[0678]
收集血液和骨髓样本进行pk和ata评估。使用合格的试验来测量血清和骨髓中sea-bcma的浓度以及血清中ata的浓度。剩余的pk样品被存档,以备分析与sea bcma相关的物质。试验包括酶联免疫吸附试验(elisa)试验,以及其他试验,如果需要进一步的表征。
[0679]
合格的电化学发光试验被用来评估ata。
[0680]
生物标志物研究
[0681]
用于生物标志物分析的外周血和骨髓样品是在以下部分所列出的时间点收集的。除了方案规定的肿瘤样品采集外,由研究者决定采集的骨髓样品也可以提交给中央物标志物分析。对于所有的骨髓采集,研究机构提供骨髓抽吸物以及骨髓活检标本和骨髓抽吸物凝块样品作为福尔马林固定、石蜡包埋(ffpe)块。对于为soc采集的样本,如果没有骨髓活检或凝块的ffpe块,可以提交未染色的切片。样品被送到本文所述中心实验室进行分析,如实验室手册中所述。
[0682]
评估样品中bcma的表达以及可能与sea-bcma的活性和/或对治疗的缓解变化有关的相关生物标志物。肿瘤组织和外周血的分析也可包括与预后、缓解或耐药性有关的标志物。外周血免疫细胞亚群的变化被测量为潜在的药效动力学和安全性标志物。
[0683]
效应细胞的遗传概况分析
[0684]
对可能影响对sea-bcma反应的fcγrii和fcγriii的小核苷酸多态性进行测定,包括但不限于对以下多态性的测试:
[0685]
fcgriiia
–
158v/f
[0686]
fcgriia
–
131h/r
[0687]
血清游离轻链和改良的spep
[0688]
对患者血清中的κ和λ游离轻链进行量化,作为抗肿瘤活性的替代标志物。
[0689]
对于血清m蛋白spep水平较低的igg骨髓瘤患者,在没有sea-bcma干扰的情况下,采用反映性的改良spep试验来评估血清m蛋白的残留情况。
[0690]
外周血免疫分型
[0691]
收集外周血样,用流式细胞仪评估循环免疫细胞。循环免疫细胞亚群的变化被测量为sea-bcma活性的潜在药效动力学标志物。流式细胞仪测量包括但不限于表征nk细胞、单核细胞、t细胞和b细胞。
[0692]
血浆细胞因子/趋化因子
[0693]
循环细胞因子/趋化因子的水平可通过elisa和/或多重细胞因子/趋化因子试验来评估。
[0694]
可溶性靶标和配体
[0695]
循环的可溶性bcma(sbcma)、april和baff的水平可通过elisa或其他方法(如lc-ms或流式细胞术)评估。
[0696]
血浆生物标志物和pbmc
[0697]
采集血浆和pbmc,对与sea-bcma反应和/或耐药性相关的细胞和循环生物标志物进行回顾性分析。
[0698]
肿瘤组织的表征
[0699]
收集基线和治疗中的骨髓抽吸物和活检,以评估疾病相关的免疫亚群,表征肿瘤负荷,调查反应深度,确定预后特征和对治疗的反应。其他蛋白质、基因表达概况分析,以及对骨髓瘤疾病相关风险标志物的进一步分子表征,也可能被评估,以鉴定预测对sea-bcma反应或耐药性的生物标志物。
[0700]
骨髓免疫分型
[0701]
肿瘤浆细胞上bcma的表达,以及骨髓中免疫成分的存在和变化,可通过流式细胞术和/或免疫组化法进行评估。
[0702]
基因表达概况分析/ngs/fish
[0703]
肿瘤和肿瘤微环境中基因表达概况的基线和治疗相关的变化可以通过对骨髓抽吸物中纯化的肿瘤(cd138阳性)和非肿瘤(cd138阴性)细胞的rna测序进行评估,以确定预后疾病风险特征以及基线特征和可能与反应或耐药性相关的治疗变化。还可以对从基线收集的骨髓抽液中富集的cd138-阳性浆细胞进行细胞遗传学分析或dna测序,以进一步确定可能预测或与sea-bcma反应有关的遗传变化。
[0704]
mrd
[0705]
可以对相关样品进行mrd评估,使用mrd试验的适应性ngs(martinez-lopez et al.,blood 123(20):3073-9,2014),以了解sea-bcma的活性。
[0706]
骨髓血浆
[0707]
收集骨髓血浆,可测试可能影响对sea-bcma反应或与之相关的可溶性靶标、配体和/或细胞因子/趋化因子的水平。
[0708]
不良事件
[0709]
根据国际协调委员会(international council for harmonisation)(ich)e2a指南《快速报告的定义和标准(definitions and standards for expedited reporting)》和21cfr 312.32《ind安全性报告(ind safety reporting)》,ae是指患者或临床研究对象在被给予医药产品时发生的任何不良医学事件,且不一定与该治疗有因果关系。
[0710]
一般来说,实验室数值异常不应记录为ae,除非它与临床迹象或症状有关,需要干预,导致sae,或导致研究终止或研究治疗(sea-bcma和/或地塞米松)的中断/停止。当记录由实验室异常导致的ae时,应记录导致的医疗状况而非异常本身(例如,记录"贫血"而非"低血红蛋白")。
[0711]
严重不良事件
[0712]
如果ae符合以下标准之一,则被归类为sae:
[0713]
致命:该ae导致死亡
[0714]
危及生命的该ae使患者处于死亡的立即风险。该分类不适用于如果其更加严重假设可能导致死亡的ae。
[0715]
住院治疗:该ae导致住院或延长现有住院治疗。在这项研究中签署知情同意书或进行常规检查之前计划进行的选择性医疗或外科手术过程或治疗的住院治疗不是根据该标准不是sae。入住姑息性病房或安宁疗护设施不被视为住院。因基础癌症或研究目标疾病的预定治疗而住院或长期住院不需要作为sae被捕捉。
[0716]
致残/失能:导致患者持续或严重失能或严重破坏其进行正常生活功能的能力的ae。
[0717]
先天性畸形或出 妊娠前或妊娠期间暴露于分子或研究治疗方案的患者的
[0718]
生缺陷:儿童或胎儿的不良结果。
[0719]
有医学意义:该ae不满足上述任何标准,但可能危及患者并且可能需要进行医疗或外科手术干预以防止上述结果之一,或涉及疑似通过医药产品传播的传染性病原。潜在的药物诱导的肝损伤(dili)也被认为是一个医学上的有意义的事件。
[0720]
不良事件严重程度:
[0721]
ae严重程度采用nci-ctcae,4.03版进行分级。
[0722]
独立地评估ae严重程度和严重性。
‘
严重程度’表征了ae的强度。
‘
严重性’是一个监管定义,并作为主办方定义监管报告义务的指南。
[0723]
不良事件与研究治疗的关系
[0724]
每个ae与每个研究治疗(sea-bcma和/或地塞米松)的关系由研究者使用以下标准进行评估:
[0725]
相关的:有证据表明药物与ae之间存在因果关系,如:
[0726]
·
单次发生不常见的、已知与药物暴露密切相关的事件(如血管性水肿、肝损伤、stevens-johnson综合征)
[0727]
·
一次或多次发生与药物暴露通常不相关的事件,但在暴露于药物的人群中并不常见(如肌腱断裂)。
[0728]
不相关的:ae的另一个原因更合理(例如,由于潜在的疾病或在研究人群中常规发生),或不能确定ae的发生和研究治疗的给药,或认为因果关系在生物学上是不可靠的
[0729]
数据分析方法
[0730]
样品大小确定
[0731]
约有65名患者入组了sea-bcma单药疗法研究。这一数字是基于以下假设:约25名患者在剂量递增中接受评估,约40名患者在扩展队列中以mtd或最佳剂量接受评估,以进一步定义sea-bcma的安全性和抗肿瘤活性。
[0732]
模拟报告中介绍了该研究剂量递增部分的操作特点,包括在各种毒性情况下分配到每个剂量的平均患者人数。
[0733]
没有计划对扩展队列进行正式的假设测试。假设有30%的orr,在40名患者中,95%的精确置信区间(ci)是(17%,47%),80%的精确ci是(20%,41%)。
[0734]
没有计划对强化剂量单药疗法和组合疗法进行正式假设。假设观察到的orr在30%-50%之间,95%的二项式精确ci总结在下面的表9。
[0735]
表9:95%二项式精确ci
[0736][0737][0738]
客观缓解率
[0739]
如果根据2016年imwg统一缓解标准,患者达到scr、cr、vgpr或pr,则确定为or。orr被定义为每个研究者有or的患者比例。根据2016年imwg统一缓解标准,无法评估疾病缓解的患者在计算orr时被记为不可评估的。在计算orr时,没有基线后缓解评估的患者,或根据imwg标准缓解不可评估的患者被算作无缓解者。
[0740]
完全缓解率
[0741]
如果根据2016年imwg统一缓解标准,患者达到scr或cr,则确定为cr。cr率被定义为每位研究者获得cr的患者比例。根据imwg统一缓解标准,无法评估疾病缓解的患者在计算cr率时被评为不可评估的。
[0742]
客观缓解持续时间
[0743]
or的持续时间定义为从首次记录or(scr、cr、vgpr或pr)到首次记录疾病进展或因任何原因死亡的时间,以先到者为准。疾病进展包括肿瘤进展的客观证据(基于血清、尿液或骨髓评估)和/或每个研究者的临床进展。对于没有疾病进展且在分析时仍在研究中的患者,或在记录肿瘤进展之前被从研究中移除的患者,缓解持续时间的审查日期为最后一次没有pd的疾病评估记录。在记录pd之前已经开始新的抗肿瘤治疗的患者,在开始新的治疗之前的最后一次疾病评估中进行审查。
[0744]
缓解的持续时间只计算达到scr、cr、vgpr或pr的患者亚组。
[0745]
完全缓解持续时间
[0746]
cr的持续时间定义为从首次记录完全缓解(scr、cr)到首次记录疾病进展或因任何原因死亡的时间,以先到者为准。疾病进展包括肿瘤进展的客观证据(基于血清、尿液或骨髓评估)和/或每个研究者的临床进展。对于没有疾病进展且在分析时仍在研究中的患者,或在记录肿瘤进展之前被从研究中移除的患者,cr持续时间的审查日期为最后一次没有pd的疾病评估记录。在记录pd之前已经开始新的抗肿瘤治疗的患者,在开始新的治疗之前的最后一次疾病评估中进行审查。
[0747]
cr的持续时间只计算达到scr或cr的患者亚组。
[0748]
无进展生存
[0749]
pfs定义为从研究治疗开始到首次记录到疾病进展或任何原因所致死亡(视何者先发生)的时间。疾病进展包括肿瘤进展的客观证据(基于血清、尿液或骨髓评估)和/或每个研究者的临床进展。对于没有疾病进展且在分析时仍在研究中的患者,或在记录肿瘤进展之前被从研究中移除的患者,pfs的审查日期为最后一次没有进展性疾病(pd)的疾病评估记录。在记录pd之前已经开始新的抗肿瘤治疗的患者,在开始新的治疗之前的最后一次疾病评估中进行审查。第一次给药后缺乏肿瘤缓解评估的患者,其事件时间审查为1天。
[0750]
总体生存
[0751]
os定义为从任何研究治疗开始至任何原因所致死亡日期的时间。具体地:os=死亡日期-任何研究治疗的第一次给药日期+1。
[0752]
在最后一次接触时还活着的患者的os,包括那些失去随访的患者,在最后一次接触时审查。如果已知患者活着的最后记录日期是任何研究治疗的首次用药日期,则生存时间将在任何研究治疗的首次用药日期(即os持续时间的第1天)进行审查。
[0753]
mrd-阴性率
[0754]
mrd阴性率将在达到vgpr或更优的患者中报告。
[0755]
效力分析
[0756]
所有的效力分析都是使用所有治疗的患者集。选定的效力终点也使用ee分析集来表示。观察到的orr和cr率以及相应的95% ci来表示。疾病缓解无法评估的患者将被算作无缓解者。在实现缓解之前,具有患者内剂量递增的患者被算作初始剂量的非缓解者。
[0757]
缓解持续时间、pfs和os是用kaplan-meier方法估计的,并将提供kaplan-meier图。在可能的情况下,计算中位数。适当时还计算了95%的ci。
[0758]
药代动力学和免疫原性分析
[0759]
sea-bcma的pk是通过非室间分析进行评估的。在数据允许的情况下,确定以下pk参数:
[0760]
曲线下面积
[0761]
输注结束时的浓度(c
eoi
)或最大观察浓度(c
最大
)
[0762]
谷浓度(c
谷
)
[0763]
终末或表面终末半衰期(t
1/2
)
[0764]
稳定状态下的全身清除率和分布容积
[0765]
积累率
[0766]
生物标志物分析
[0767]
收集外周血和骨髓抽吸物和活检用于生物标志物评估。用这些样品进行的评估包
括但不限于骨髓瘤细胞监测和概况分析,包括bcma的表达和免疫细胞群的评估。此外,对骨髓样品进行分析,以鉴定基因表达概况、细胞遗传学异常、基因突变以及其他肿瘤和肿瘤微环境相关的生物标志物,这些生物标志物可定义疾病风险概况,预测对sea-bcma的反应,并阐明sea-bcma的作用机制。使用下一代测序(ngs)对选定的骨髓样品进行mrd分析。还收集了血浆和血清以量化药物活性的生物标志物,其中包括sflc、细胞因子/趋化因子、可溶性bcma和其他可溶性生物标志物。
[0768]
探究了生物标志物和药效动力学参数(如基线值、基线的绝对和相对变化)与效力、安全性和pk参数的关系。总结了被确定为有意义的关系和相关数据。
[0769]
实施例2.sea-bcma的药代动力学分析
[0770]
为了研究sea-bcma的药代动力学参数,给予不同剂量的sea-bcma,并在不同时间点评估血清浓度。具体地,在第0天注射100mg、200mg、400mg、800mg或1600mg的剂量的sea-bcma,并在注射后第14天重复注射。采用逐步iv输注给药,从50mg/小时(30分钟)开始,逐步增加(≤2倍)到最大速率400mg/小时。
[0771]
如图1a所示,在100mg-1600mg的评估范围内,sea-bcma的给药后血清浓度与剂量成比例。图1b显示了每个给予剂量的抗体的半衰期、最大浓度(c
最大
)和曲线下面积(auc)。药代动力学分析表示血清样品中的总循环sea-bcma。从这些图可以看出,这些研究中sea-bcma的半衰期约为10天,pk在第3周期达到稳定状态,q2w给药后约有70%的积累。在任何测试的样品中都没有发现抗-sea-bcma抗体。
[0772]
实施例3.使用体外细胞结合能力测定估计游离的sea-bcma
[0773]
开发了体外细胞结合能力测定,以补充总sea-bcma、总可溶性bcma的血清浓度测量,以及骨髓浆细胞上游离、未结合的bcma和总bcma的流式细胞术评估。该试验测量患者血清中游离的、未结合的sea-bcma(如未被sbcma结合)以在体外与bcma阳性细胞系上的bcma结合并饱和的能力。对已知的sea-bcma浓度进行滴定,允许评估患者血清中游离的、未结合的sea-bcma的浓度。再加上对细胞表面bcma结合百分比的测量,这提供了直接表明给予的sea-bcma与细胞膜结合的bcma结合和饱和的能力。
[0774]
如图2a所示,将培养的mm1r细胞悬浮液沉淀并重新悬浮在来自对象的外周血的血清中,这些血清是在第1周期,第1天(c1d1)给药前、c1d1 eoi(输注结束)、c1d2、c1d8、c1d15给药前、c1d15 eoi、c1d16、c1d22、c2d1 eoi、c2d15给药前以及c3d1给药前收集的。在室温下孵育1/2小时后,洗涤细胞,用饱和量的sea-bcma偶联至荧光染料染色。在4℃黑暗中孵育1/2小时后,洗涤并固定细胞。染色细胞在invitrogen attune nxt流式细胞仪上进行分析。使用flowjo v10软件对有活力的细胞进行筛选,并记录中值荧光强度(mfi)。graphpad prism 8用于分析。
[0775]
如图2b所示,能够结合膜bcma的游离sea-bcma的水平是用标准曲线估计的,该曲线显示了不同浓度的sea-bcma对细胞表面bcma的占用情况。
[0776]
记录的mfi被归一化,如下所示。归一化为0%的结合是指在没有sea-bcma存在的健康人血清中孵育的对照孔的mfi。归一化为100%的结合是指用浓度为200μg/ml sea-bcma加标的健康人血清中孵育的对照孔的mfi。健康人血清中sea-bcma的滴定可用于使用已知数量的sea-bcma生成标准曲线。
[0777]
实施例4.患者体内游离sea-bcma的维持情况
[0778]
研究了患者血清中能够在体外与表达bcma的细胞系的细胞表面bcma结合的游离sea-bcma的维持情况。具体地,给予每个患者两个剂量的100mg、200mg、400mg、800mg或1600mg的sea-bcma,并对细胞表面bcma的百分比占有率进行了评估。
[0779]
在第一个实验中,给予每个患者第一剂100mg、200mg或400mg的sea-bcma,随后在第一剂量的14天后,再给每个患者给予相同剂量的sea-bcma。
[0780]
如图3a所示,100mg-400mg血清水平的sea-bcma无法在体外通过所示给药间隔维持》95%结合的bcma。
[0781]
在第二个实验中,给予每个患者第一剂400mg或800mg sea-bcma,随后在第一剂量的14天后,再给予第二剂量的400mg或800mg sea-bcma。如图3b所示,在整个给药期间,大多数患者(6/8)给予800mg(或等同物),患者血清中保持高水平的游离sea-bcma。由于体重较低,一名患者的sea-bcma的药代动力学暴露量在800mg剂量治疗的患者范围内。一名患者由于输注相关反应(irr),第一剂量为800mg sea-bcma,第二剂量为400mg sea-bcma。
[0782]
在第三个实验中,给予每个患者第一剂量的1,600mg sea-bcma,随后在第一剂量的14天后,再给予第二剂量的1,600mg sea-bcma。如图3c所示,在整个给药期间,所有给药1600mg的患者(7/7)血清中的游离sea-bcma都保持较高的水平。
[0783]
这些数据表明,每两周给予1600mg sea-bcma的给药方案产生的血清sea-bcma水平能够支持表达bcma的细胞系的膜bcma的体外饱和,这表明在整个给药间隔期间,1600mg剂量的靶标bcma饱和可能在体内发生。
[0784]
实施例5.流式细胞仪评估在骨髓中bcma的表达和与mm细胞的接合情况
[0785]
设计了流式细胞仪试验,以鉴定患者骨髓抽吸物中的多发性骨髓瘤细胞,并测量mm细胞表面的bcma(未结合和总)和april的水平。检测未结合的膜bcma表明存在未被april、baff或sea-bcma结合的bcma,因此在治疗中没有完全靶接合。
[0786]
在基线期和治疗期(c2d22,确认cr,根据护理标准)从入组患者收集骨髓抽吸物,并在大多数情况下收集一天后用流式细胞仪测试。
[0787]
使用胞外cd138、cd38、cd45、cd56和cd28染色以及胞内κ和λ轻链染色进行mm细胞检测。使用2种抗-bcma的抗体对bcma表达进行概况分析:使用标记的16.17igg1(sea_bcma的母体抗体)检测可用于结合sea-bcma的bcma,而使用标记的16.16抗-bcma ab(seattle genetics)检测总的胞外bcma,该抗体不与sea-bcma或april竞争与bcma结合。还进行了april的检测,其很可能与mm细胞表面的bcma结合。
[0788]
每个样品分成3个等分样品:一个等分样品只用mm门控抗原染色,但不使用抗-bcma或抗-april抗体(门控对照)、一个等分样品用mm门控抗原和两种标记的抗-bcma抗体染色,一个等分样品在37℃下与加标的bcma(100μg/ml)孵育2小时后用mm门控抗原+april+标记的非竞争性抗-bcma 16.16抗体染色。染色、洗涤和用2%多聚甲醛固定后,在bd facscanto细胞仪上分析细胞,获得多达2x106个白细胞。用facs diva(q2)和flowjo(seattle genetics)进行数据分析。
[0789]
如图4所示,sea-bcma在剂量递增治疗的患者骨髓中与mm细胞上的bcma接合,并降低了恶性浆细胞上未结合的膜bcma水平。在800mg和1600mg剂量的可评估患者中观察到膜bcma的不完全饱和,而在至少一名以1600mg给药sea-bcma的患者中观察到完全饱和。
[0790]
实施例6.患者案例研究
[0791]
入组研究的一名患者是一名83岁的男性。该患者的具有ecog(东部合作肿瘤学小组,zubrod,世界卫生组织)表现状态为1,并患有iggλ骨髓瘤,有增益(1q21)。在使用sea-bcma治疗之前,患者已经接受了7种治疗线,具体见图5。在目前的研究开始时,患者具有以下状态:spep0.33,upep不可测量,bma 9%浆细胞,无浆细胞瘤,λflc 52.68mg/dl。在目前的研究中,患者接受了每两周1600mg sea-bcma的方案,持续至少两个月。
[0792]
血清游离轻链(sflc)的水平被评估为浆细胞紊乱的指数。如图6a所示,在第一剂1600mgsea-bcma一周后,患者的sflc水平显著下降了约90%,低于健康个体的范围上限水平。sflc的低水平至少维持到第一剂量后的第40天。如图6b所示,与入组研究的其他几位患者相比,该患者在基线时表现出较高的膜结合bcma水平。安全性和耐受性研究显示,患者在用sea-bcma治疗的第二个周期期间发展了2级斑丘疹。该患者在之前的治疗线中也有广泛的皮疹史。缓解评估证实,在sea-bcma治疗的第二个两周周期结束时,患者具有非常好的部分缓解(vgpr)。这些数据表明,sea-bcma能够对以前七种不同类型的治疗难治性的多发性骨髓瘤提供持续的非常好的部分缓解(vgpr)。
[0793]
实施例7.其他患者案例研究
[0794]
入组研究的另一名患者是一名75岁的男性。该患者的具有ecog(东部合作肿瘤学小组,zubrod,世界卫生组织)表现状态为1,并患有iggλ骨髓瘤。在使用sea-bcma治疗之前,患者已经接受了8种治疗线,具体见图7。在目前的研究开始时,患者具有以下状态:spep 3.29,upep不可测量,bma 40%浆细胞,无浆细胞瘤。在目前的研究中,患者在第1-3周期每两周接受200mg剂量的sea-bcma,第4-8周期每两周接受400mg剂量的sea-bcma,第9周期每两周接受800mg剂量的sea-bcma,第10周期接受1600mg剂量的sea-bcma。
[0795]
安全性和耐受性研究显示,患者对治疗的耐受性良好,没有任何与sea-bcma有关的不良反应。这些数据表明,sea-bcma能够成功地治疗八种先前治疗线难治性的对象的多发性骨髓瘤,包括在开始治疗10个月后仍保持疾病稳定。
[0796]
实施例8.临床试验内容
[0797]
在临床试验中,20名患者接受了5个剂量水平的治疗,从100mg平剂量到1600mg平剂量。治疗持续时间范围从1个周期到11个周期,治疗持续时间的中值为2.5个周期。入组研究的患者是经过重大预治疗的晚期骨髓瘤患者。患者的中位年龄为70岁。89%的患者的具有ecog(东部合作肿瘤学小组,zubrod,世界卫生组织)表现状况评分为1分。患者先前的治疗线的中位数为5。
[0798]
剂量递增研究已经达到了预先规定的最高剂量水平,即1600mg。sea-bcma的药代动力学约为剂量-比例(100-1600mg),抗体的半衰期约为10天。这些数据提供了单药疗法活性的初步证据。对于所有的剂量水平,在最少3个周期的治疗后,观察到稳定的疾病。在所有接受1600mg剂量sea-bcma治疗的患者中,以及在接受800mg剂量sea-bcma(或等同物)治疗的8名患者中的6个中,能够与膜bcma结合的高水平循环sea-bcma在整个q2wk的用药间隔内都得以维持。
[0799]
在用1600mg sea-bcma剂量治疗的3名可评估缓解的患者中,1名患者被确认为非常好的部分缓解(vgpr)。临床试验数据支持两周(q2wk)的间隔可能适合1600mg给药sea-bcma的剂量。
[0800]
可耐受的安全性概况显示,sea-bcma耐受良好,除1例剂量限制性毒性(dlt)(3级
bcma是一种非岩藻糖基化的抗体,与岩藻糖基化的抗-bcma抗体相比,它显示出增强的fcγriii结合亲和力和诱导的信号转导。增强信号转导是sea-bcma主要作用机制的第一步。这种信号转导可以通过adcc转化为增加抗-mm细胞的裂解。这些数据表明,gsi可以潜在地改进sea-bcma的临床活性。
[0809]
sea-bcma在有γ分泌酶抑制的情况下显示出增强的adcc
[0810]
确定了增强的fcγriii信号转导是否转化为sea-bcma对mm靶细胞的裂解增加。将molp-8 mm靶细胞与和不与0.2μm nirogacestat(购自selleckchem)孵育24小时。然后对细胞进行na2[
51
cr]o4标记,并加入sea-bcma的滴定,或同种型抗体对照。效应细胞,即从正常供者pbmc中富集的nk细胞,以10:1(50,000:5000)的效应物-比-靶细胞比例加入。供者nk细胞是高亲和力的fcγriii v/v基因型。抗体、nk细胞和靶细胞的组合在37℃下与和不与nirogacestat孵育4小时。然后测量释放到裂解的靶细胞的培养上清液中的放射性,并计算特异性细胞裂解的百分比。在与nirogacestat孵育后,u266用流式细胞仪显示bcma表达增加(图9a)。在gsi的存在下,观察到adcc的增加(图9b)。这是sea-bcma的主要作用机制,并转化为特定的增强的抗-mm裂解。预计,当sea-bcma与gsi组合时,这将转化为临床中抗-mm活性的改善。
[0811]
实施例11.sea-bcma部分阻滞由γ分泌酶抑制诱导的nf-κb信号传导
[0812]
sea-bcma的次要作用机制是阻滞bcma增殖细胞信号转导。来自gsi治疗的bcma增加,预计会诱导bcma信号转导增加。因此,测试了sea-bcma对这种增强的信号转导的阻滞。用和不用0.2μm nirogacestat(购自selleckchem),对表达bcma的nci-h929细胞进行血清饥饿16小时。然后,在有或没有0.2μm nirogacestat的情况下,将细胞与用和不用20μg/ml sea-bcma结合,并与和不与1μg/ml重组人april(r&d系统公司(r&d systems))在37℃孵育20分钟。用elisa(transam nfκb chemi p65,活性基序(active motif))测定1μg核提取物的nf-κb p65活性,一式两份。绘制相对发光单位(rlu),显示来自gsi、nirogacestat的nf-κb信号转导增加,这可以被sea-bcma部分阻滞(图10)。这些数据表明,sea-bcma可以在临床上有gsi的情况下继续阻滞mm的增殖信号转导。
[0813]
实施例12.sea-bcma与达雷木单抗的有效组合
[0814]
进行实验以测试sea-bcma是否能与达雷木单抗在播散性mm小鼠肿瘤异种移植物中有效组合。将molp-8荧光素酶细胞iv注射到scid动物体内,并允许其归巢至骨髓中。molp-8细胞表达2000个拷贝的bcma和323,000个拷贝的cd38(达雷木单抗靶标)。当观察到足够的发光时,用sea-bcma或sea非靶向对照以3mg/kg的剂量对动物进行一次ip给药。达雷木单抗每周给药5次,剂量为1mg/kg。发光中值作图,n=5。sea-bcma和达雷木单抗的组合使5只动物中的4只获得完全缓解。非靶向对照与达雷木单抗组合与达雷木单抗单独治疗相当。如图11所示,sea-bcma与达雷木单抗组合在患有mm肿瘤异种移植物的小鼠中诱导完全缓解。这些数据支持在临床上使用耐受性良好的、基于抗体的sea-bcma加达雷木单抗组合方案。
[0815]
实施例13.sea-bcma与imid、泊马度胺的有效组合
[0816]
通过将pbmc效应细胞与用泊马度胺和sea-bcma或抗体对照物处理的mm1r靶细胞组合起来,进行实验以测试sea-bcma在体外是否与泊马度胺有效组合。第一个实验(图12a)以mm标准疗法依洛珠单抗和非岩藻糖基化的bcma抗体为基准。第二个实验(图12b)是以mm
的标准治疗药物达雷木单抗为基准。mm1r靶细胞表达15,000个拷贝的bcma,12,000个拷贝cs1(依洛珠单抗靶标),和36,000个拷贝cd38(达雷木单抗靶标)。
[0817]
在第一个实验中(图12a),fcγriii v/f基因型的正常供体pbmc与cfse(英杰公司(invitrogen)目录号v12883)标记的mm1r骨髓瘤靶细胞以10:1的效应物-比-靶细胞比例混合。该混合物用一定剂量范围的下列抗体进行处理:sea-bcma、依洛珠单抗、wt-bcma(岩藻糖基化的母体抗体),或非结合的higg1k抗体对照(西格玛(sigma)目录号i5154),加上或不加上3μm泊马度胺(apex bio,目录号a4211)。48小时后,使用活力染料7-aad(bd生物科学公司(bd biosciences),目录号559925)通过流式细胞仪测定mm1r活细胞%。岩藻糖基化的bcma母体抗体的活性低于非岩藻糖基化的版本。除非加入泊马度胺,否则依洛珠单抗对细胞没有影响,higg1k对照抗体也没有影响。
[0818]
在第二个实验中(图12b),fcγriii v/f基因型的正常供体pbmc用或不用0.5μm泊马度胺(apex bio,目录号a4211)处理5天。然后洗涤所得的pbmc并与cfse(英杰公司目录号v12883)标记的mm1r骨髓瘤靶细胞混合,效应物-比-靶细胞的比率为10:1。然后该混合物用一定剂量范围的下列抗体的进行处理:sea-bcma、达雷木单抗、或非结合的higg1k抗体对照(西格玛(sigma)目录号i5154),加上或不加上0.5μm泊马度胺(apex bio,目录号a4211)并孵育过夜。使用活力染料7-aad(bd生物科学公司(bd biosciences),目录号559925)通过流式细胞仪测定mm1r活细胞%。与泊马度胺组合使用时,达雷木单抗显示出比sea-bcma更少的活性。higg1对照抗体无影响。
[0819]
结果显示,sea-bcma与imid的组合具有改善目标细胞的杀伤效果。这些数据表明,sea-bcma加imid的组合在临床上可以导致抗骨髓瘤活性的提高。依洛珠单抗和达雷木单抗已被证明在临床上与imid组合有成效。这些数据至少表明,sea-bcma能与imid有效组合,与依洛珠单抗或达雷木单抗相当或更好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1