用于核酸测序的方法、系统和组合物与流程
1.本公开一般涉及用于核酸测序应用的方法、系统、试剂盒和组合物。
背景技术:
2.核酸测序方法已从maxam和gilbert所使用的化学降解方法以及sanger所使用的链延长方法得到了显著发展。现今使用了允许在单个测序运行中并行处理数千个核酸的若干测序方法。执行此类方法的仪器通常是大型且昂贵的,因为当前方法通常依赖于大量昂贵的试剂和多组光学滤光器以记录核酸掺入到测序反应中。
3.已经清楚的是,对高通量、较小型、较便宜的dna测序技术的需求将有利于获得基因组测序带来的回报。个性化保健越来越前沿,并且将受益于此类技术。对个体的基因组进行测序以识别潜在的突变和异常,对于鉴别一个人是否患有特定疾病并在随后针对该个体定制后续疗法将是至关重要的。为了适应此类努力,测序技术不仅应该具有高通量能力,而且应该具有可扩展性。因此,现在需要在速度、错误读取和成本效益均有改进的新的测序方法。
技术实现要素:
4.本公开提供新一代测序方法、系统和组合物。本公开的一些实施方案涉及一种用于确定靶多核苷酸的序列的方法,该方法包括:
5.(a)使引物多核苷酸与包含四种不同类型的核苷酸缀合物中的一种或多种类型的核苷酸缀合物的混合物(即,掺入混合物)接触,其中第一类型的核苷酸缀合物包含第一标记,第二类型的核苷酸缀合物包含第二标记,并且第三类型的核苷酸缀合物包含第三标记,其中第一标记、第二标记和第三标记中的每一者在光谱上彼此不同,并且其中引物多核苷酸与靶多核苷酸的至少一部分互补;
6.(b)使来自混合物的核苷酸缀合物掺入引物多核苷酸中以产生延伸的引物多核苷酸;
7.(c)使用第一激发光源执行第一成像事件并且收集来自延伸的引物多核苷酸的第一发射信号;以及
8.(d)使用第二激发光源执行第二成像事件并且收集来自延伸的引物多核苷酸的第二发射信号;
9.其中第一激发光源和第二激发光源具有不同波长;并且其中第一发射信号和第二发射信号在单个发射检测通道/滤光器中检测或收集。在一些实施方案中,该方法不包括在第一成像事件之后并且在第二成像事件之前对混合物中的任何核苷酸缀合物的化学修饰。在一些实施方案中,混合物还包含第四类型的核苷酸缀合物,其中第四类型的核苷酸缀合物是未标记的或是用荧光部分标记的,该荧光部分不从第一成像事件或第二成像事件发出信号。在一些另外的实施方案中,掺入混合物中的四种不同类型的核苷酸缀合物中的一种或多种类型的核苷酸缀合物中的每一者含有3'羟基封端基团。
10.在本文所述的测序方法中,基于第一成像事件和第二成像事件的检测模式来确定每种掺入的核苷酸缀合物的同一性。例如,第一类型的核苷酸缀合物的掺入由第一成像事件中的信号态和第二成像事件中的暗态来确定。第二类型的核苷酸缀合物的掺入由第一成像事件中的暗态和第二成像事件中的信号态来确定。第三类型的核苷酸缀合物的掺入由第一成像事件和第二成像事件两者中的信号态来确定。第四类型的核苷酸缀合物的掺入由第一成像事件和第二成像事件两者中的暗态来确定。在一些实施方案中,步骤(a)中的混合物包含四种不同类型的核苷酸缀合物(a、c、g和t或u)。在一些另外的实施方案中,四种类型的核苷酸缀合物中的三种类型的核苷酸缀合物各自用荧光团(在光谱上与另一个荧光团不同)标记,并且核苷酸中的一种核苷酸未用荧光团标记。在另外的实施方案中,步骤(a)到步骤(d)在重复循环(例如,至少30、50、100、150、200、250或300次)中执行,并且该方法还包括依次确定每种掺入的核苷酸缀合物的同一性,从而确定单链多核苷酸的至少一部分的序列。
11.本公开的附加的实施方案涉及一种用于测序应用的试剂盒,该试剂盒包含:
12.含第一标记的第一类型的核苷酸缀合物;
13.含第二标记的第二类型的核苷酸缀合物;以及
14.含第三标记的第三类型的核苷酸缀合物;
15.其中第一标记、第二标记和第三标记中的每一者在光谱上彼此不同,第一标记和第三标记能够使用第一光源波长激发,第二标记和第三标记能够使用不同于该第一光源波长的第二光源波长激发;并且其中第一标记、第二标记和第三标记中的每一者具有能够在单个检测通道中检测的发射光谱。在一些实施方案中,试剂盒包含四种不同类型的核苷酸缀合物(a、c、g和t或u)。在一些另外的实施方案中,四种类型的核苷酸缀合物中的三种类型的核苷酸缀合物各自用荧光团(在光谱上与另一个荧光团不同)标记,并且核苷酸中的一种核苷酸未用荧光团标记。
附图说明
16.图1a示出针对标准illumina单通道合成测序(sbs)化学的流程图。
17.图1b示出来自标准单通道sbs的图像1和图像2如何由图像分析软件处理,以识别结合掺入了哪些碱基。
18.图2示出本文所述的测序方法的实施方案。
19.图3a示出用于本文所述的测序方法的检测系统的实施方案。
20.图3b示出本文所述的单个发射检测通道的实施方案。
21.图4示出根据本文所述的测序方法的实施方案在iseq
tm
100系统上获得的散点图。
具体实施方式
22.illumina的新一代测序系统iseq
tm
100使用基于互补金属氧化物半导体(cmos)的技术来实现简化的、易得到的台式测序解决方案。标准测序工作流如图1a和图1b所示,也称为单通道测序。每个测序循环包括两个化学步骤和两个成像步骤。在图1a中,第一化学步骤将流通池暴露于具有荧光标记的腺嘌呤和胸腺嘧啶的核苷酸的混合物。在第一成像步骤期间,由cmos传感器记录来自每个簇的光发射。第二化学步骤从腺嘌呤中去除荧光标记并将
荧光标记添加到胞嘧啶。在两个化学步骤中,鸟嘌呤是暗的(未标记)。记录第二图像。在图1b中,图像1和图像2的组合由图像分析软件处理以识别在每个簇位置处掺入哪些碱基。此测序循环重复“n”次以创建“n”个碱基的读段长度。与四通道sbs化学不同,其中测序仪针对每种核苷酸使用不同的染料,iseq
tm
100系统每个测序循环使用一种染料。在单通道化学中,腺嘌呤具有能够去除的标记并且仅在第一图像中进行标记。胞嘧啶具有可以结合标记并且仅在第二图像中进行标记的连接基基团。胸腺嘧啶具有持久荧光标记,并且因此在两个图像中进行标记,并且鸟嘌呤是永久暗的。核苷酸通过跨两个图像分析每个碱基的不同发射模式来识别。
23.本公开提供illumina的iseq
tm
100平台中描述的单通道测序的替代性和具有改善的解决方案。具体地,本公开提供用于使用两个成像步骤和一个发射检测滤光器/通道来确定核苷酸的掺入的同一性的方法。使用较少的滤光器允许在较小的占有面积上执行测序。此外,本公开的方法消除上述第二化学步骤。如本文所述的方法和系统降低器械硬件需求、减少器械的尺寸、试剂使用和成本,同时增加数据输出速度和准确度。例如,本文所述的方法可以用在illumina的iseq
tm
测序系统上,提供快速周转时间和有效的测序。
24.定义
25.除非另有定义,否则本文所用的所有技术和科学术语的含义与本领域的普通技术人员通常理解的含义相同。术语“包括”以及其他形式(诸如“包括(include/includes/included)”)的使用不是限制性的。术语“具有”以及其他形式(诸如“具有(have/has/had)”)的使用不是限制性的。如本说明书中所用,无论是在过渡短语中还是在权利要求的正文中,术语“包含(comprise(s))”和“包含(comprising)”都将被解释为具有开放式含义。即,上述术语应与短语“至少具有”或“至少包括”同义地解释。例如,当在过程的上下文中使用时,术语“包括”表示该过程至少包括所列举的步骤,但是也可包括额外步骤。当在化合物、组合物或设备的上下文中使用时,术语“包含”是指该化合物、组合物或设备至少包含所列举的特征或组分,但是也可包含额外特征或组分。
26.如本文所用,常见的有机缩写定义如下:
27.℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
温度(摄氏度)
28.datp
ꢀꢀꢀꢀꢀꢀꢀ
脱氧腺苷三磷酸
29.dctp
ꢀꢀꢀꢀꢀꢀꢀ
脱氧胞苷三磷酸
30.dgtp
ꢀꢀꢀꢀꢀꢀꢀ
脱氧鸟苷三磷酸
31.dttp
ꢀꢀꢀꢀꢀꢀꢀ
脱氧胸苷三磷酸
32.ddntp
ꢀꢀꢀꢀꢀꢀ
双脱氧核苷酸三磷酸
33.ffa
ꢀꢀꢀꢀꢀꢀꢀꢀ
完全官能化的a核苷酸
34.ffc
ꢀꢀꢀꢀꢀꢀꢀꢀ
完全官能化的c核苷酸
35.ffg
ꢀꢀꢀꢀꢀꢀꢀꢀ
完全官能化的g核苷酸
36.ffn
ꢀꢀꢀꢀꢀꢀꢀꢀ
完全官能化的核苷酸
37.fft
ꢀꢀꢀꢀꢀꢀꢀꢀ
完全官能化的t核苷酸
38.led
ꢀꢀꢀꢀꢀꢀꢀꢀ
发光二极管
39.sbs
ꢀꢀꢀꢀꢀꢀꢀꢀ
合成测序
40.如本文所用,术语“阵列”是指连接到一个或多个基底的一组不同探针分子,使得
这些不同探针分子可以根据相对位置彼此区分。阵列可以包括各自位于基底上的不同可寻址位置处的不同探针分子。另选地,或另外地,阵列可以包括各自带有不同探针分子的单独的基底,其中可根据基底在基底所连接到的表面上的位置或根据基底在液体中的位置来识别这些不同探针分子。其中单独的基底位于表面上的示例性阵列包括但不限于孔中包含珠粒的那些,如例如在美国专利号6,355,431b1、us 2002/0102578和pct公开wo 00/63437中所述。例如,在美国专利号6,524,793中描述了可以在本发明中使用以例如使用微流体装置,诸如荧光激活细胞分选器(facs)来区分液体阵列中的珠粒的示例性形式。可以在本发明中使用的阵列的另外的实例包括但不限于美国专利号5,429,807;5,436,327;5,561,071;5,583,211;5,658,734;5,837,858;5,874,219;5,919,523;6,136,269;6,287,768;6,287,776;6,288,220;6,297,006;6,291,193;6,346,413;6,416,949;6,482,591;6,514,751和6,610,482;以及wo 93/17126;wo 95/11995;wo 95/35505;ep 742 287;和ep 799 897中所描述的那些。
41.如本文所用,术语“共价连接的”或“共价键合的”是指形成特征在于原子之间共用电子对的化学键合。例如,共价连接的聚合物涂层是指与底物的官能化表面形成化学键的聚合物涂层,这与经由其他方式(例如,粘附或静电相互作用)粘附到该表面形成比较。应当理解,共价连接到表面的聚合物也可以经由除共价连接之外的方式键合。
42.在示出本文所述化合物的单一内消旋形式的每种情况下,同样设想了替代性的内消旋形式。
43.如本文所用,“核苷酸”包括含氮杂环碱基、糖以及一个或多个磷酸基团。它们是核酸序列的单体单元。在rna中,糖为核糖,并且在dna中为脱氧核糖,即,缺乏存在于核糖中的羟基基团的糖。含氮杂环碱基可以为嘌呤、脱氮嘌呤或嘧啶碱基。嘌呤碱基包括腺嘌呤(a)和鸟嘌呤(g)以及它们的修饰衍生物或类似物,诸如7-脱氮腺嘌呤或7-脱氮鸟嘌呤。嘧啶碱基包括胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u)以及它们的修饰衍生物或类似物。脱氧核糖的c-1原子与嘧啶的n-1或嘌呤的n-9键合。
44.如本文所用,“核苷酸缀合物”通常是指用荧光部分标记的核苷酸,任选地通过如本文所述的裂解连接基标记。在一些实施方案中,当核苷酸缀合物被描述为未标记的核苷酸缀合物时,此类核苷酸不包含荧光部分。在一些另外的实施方案中,未标记的核苷酸缀合物也不具有可裂解的连接基。
45.如本文所用,“核苷”在结构上类似于核苷酸,但缺少磷酸部分。核苷类似物的一个示例是其中标记与碱基连接并且没有磷酸基团连接到糖分子的核苷类似物。术语“核苷”在本文中以本领域技术人员所理解的常规含义使用。示例包括但不限于包含核糖部分的核糖核苷和包含脱氧核糖部分的脱氧核糖核苷。经修饰的戊糖部分是其中氧原子已被碳取代和/或碳已被硫或氧原子取代的戊糖部分。“核苷”是可以具有取代的碱基和/或糖部分的单体。另外,核苷可以掺入较大的dna和/或rna聚合物和低聚物中。
46.术语“嘌呤碱基”在本文中以本领域技术人员所理解的普通含义使用,并且包括其互变异构体。类似地,术语“嘧啶碱基”在本文中以本领域技术人员所理解的普通含义使用,并且包括其互变异构体。任选地取代的嘌呤碱基的非限制性列表包括嘌呤、腺嘌呤、鸟嘌呤、脱氮嘌呤、7-脱氮腺嘌呤、7-脱氮鸟嘌呤、次黄嘌呤、黄嘌呤、别黄嘌呤、7-烷基鸟嘌呤(例如7-甲基鸟嘌呤)、可可碱、咖啡因、尿酸和异鸟嘌呤。嘧啶碱基的示例包括但不限于胞
嘧啶、胸腺嘧啶、尿嘧啶、5,6-二氢尿嘧啶和5-烷基胞嘧啶(例如5-甲基胞嘧啶)。
47.如本文所用,当寡核苷酸或多核苷酸被描述为“包含”本文所述的核苷或核苷酸时,这意味着本文所述的核苷或核苷酸与寡核苷酸或多核苷酸形成共价键。类似地,当核苷或核苷酸被描述为寡核苷酸或多核苷酸的一部分,诸如“掺入到”寡核苷酸或多核苷酸中时,这意味着本文所述的核苷或核苷酸与寡核苷酸或多核苷酸形成共价键。在一些此类实施方案中,共价键在寡核苷酸或多核苷酸的3'羟基与在本文中描述为寡核苷酸或多核苷酸的3'碳原子与核苷酸的5'碳原子之间的磷酸二酯键的核苷酸的5'磷酸基团之间形成。
48.如本文所用,术语“可裂解的连接基”并不意在暗示需要去除整个连接基。裂解位点可以位于连接基上确保该连接基的一部分在裂解后保持连接到可检测的标记和/或核苷或核苷酸部分的某个位置处。
49.如本文所用,“衍生物”或“类似物”意指具有修饰的碱基部分和/或修饰的糖部分的合成核苷酸或核苷衍生物。此类衍生物和类似物在例如scheit,nucleotide analogs(john wiley&son,1980)和uhlman等人,chemical reviews 90:543-584,1990中进行了讨论。核苷酸类似物还可以包括经修饰的磷酸二酯键,包括硫代磷酸酯键、二硫代磷酸酯键、烷基膦酸酯键、苯胺磷酸酯键和氨基磷酸酯键。如本文所用,“衍生物”、“类似物”和“修饰的”可以互换使用,并且由本文定义的术语“核苷酸”和“核苷”涵盖。
50.如本文所用,术语“磷酸酯”以本领域技术人员所理解的普通含义使用,并且包括其质子化形式(例如,)。如本文所用,术语“单磷酸”、“二磷酸”和“三磷酸”以本领域技术人员所理解的其普通含义使用,并且包括质子化形式。
51.如本领域普通技术人员所理解的,本文所述的化合物(诸如核苷酸缀合物)可以以离子化形式存在,例如,含有-co2ˉ
、-so3ˉ
或-o
ˉ
。如果化合物含有带正电荷或带负电荷的取代基基团,则其还可以含有带负电荷或带正电荷的抗衡离子,使得该化合物整体为中性的。在其他方面,该化合物可以以盐形式存在,其中抗衡离子由共轭酸或碱提供。
52.如本文所用,术语“定相”是指sbs中的现象,该现象是由3'终止子和荧光团的不完全去除以及/或未能通过在给定测序循环下通过聚合酶完成簇内dna链的一部分的掺入所引起的。预定相是由掺入不具有有效3'终止子的核苷酸引起的,其中掺入事件由于终止失败而提前1个循环。定相和预定相导致特定循环的测量信号强度由来自当前循环的信号以及来自前一个和后一个循环的噪声组成。随着循环的数量增加,受到定相和预定相影响的每个簇的序列的分数增加,妨碍对正确碱基的识别。预定相可以由在合成测序(sbs)期间存在痕量的未保护的或未封端的3'-oh核苷酸引起。未保护的3'-oh核苷酸可以在制造过程期间或可能在储存和试剂处理过程期间产生。
53.测序方法
54.本公开的一些方面涉及一种用于确定靶多核苷酸(例如单链靶多核苷酸)的序列的方法,该方法包括:
55.(a)使引物多核苷酸与包含四种不同类型的核苷酸缀合物中的一种或多种类型的核苷酸缀合物的混合物接触,其中第一类型的核苷酸缀合物包含第一标记,第二类型的核苷酸缀合物包含第二标记,并且第三类型的核苷酸缀合物包含第三标记,其中第一标记、第
二标记和第三标记中的每一者在光谱上彼此不同,并且其中引物多核苷酸与靶多核苷酸的至少一部分互补;
56.(b)使来自混合物的核苷酸缀合物掺入引物多核苷酸中以产生延伸的引物多核苷酸;
57.(c)使用第一激发光源执行第一成像事件并且检测/收集来自延伸的引物多核苷酸的第一发射信号;
58.(d)使用第二激发光源执行第二成像事件并且检测/收集来自延伸的引物多核苷酸的第二发射信号;
59.其中第一激发光源和第二激发光源具有不同波长;并且其中第一发射信号和第二发射信号在单个发射检测通道中检测或收集。
60.在本文所述的测序方法的一些实施方案中,掺入混合物还包含第四类型的核苷酸,其中第四类型的核苷酸是未标记的或是用荧光部分标记的,该荧光部分不从第一成像事件或第二成像事件发出可检测的信号。在该方法的一些实施方案中,第一发射信号包含来自第一类型的核苷酸缀合物的第一标记或第三类型的核苷酸缀合物的第三标记的信号。在该方法的一些实施方案中,第二发射信号包含来自第二类型的核苷酸缀合物的第二标记或第三类型的核苷酸缀合物的第三标记的信号。在一些实施方案中,第一类型的核苷酸缀合物的掺入由第一成像事件中的信号态和第二成像事件中的暗态来确定。在一些实施方案中,第二类型的核苷酸缀合物的掺入由第一成像事件中的暗态和第二成像事件中的信号态来确定。在一些实施方案中,第三类型的核苷酸缀合物的掺入由第一成像事件和第二成像事件两者中的信号态来确定。在一些实施方案中,第四类型的核苷酸缀合物的掺入由第一成像事件和第二成像事件两者中的暗态来确定。在一个实施方案中,第一类型的核苷酸缀合物的掺入由第一成像事件中的信号态和第二成像事件中的暗态来确定;第二类型的核苷酸缀合物的掺入由第一成像事件中的暗态和第二成像事件中的信号态来确定;第三类型的核苷酸缀合物的掺入由第一成像事件和第二成像事件中的信号态来确定;并且第四类型的核苷酸缀合物的掺入通过第一成像事件和第二成像事件中的暗态来确定。
61.当参考成像事件使用时,术语“信号态”是指标记的核苷酸缀合物的状态,其中特定发射信号通过此类成像事件产生,并且发射信号在本文所述的单个检测通道/滤光器(即,单通道检测)中检测或收集。例如,核苷酸缀合物中的荧光部分可以由在特定波长处的光源(例如,激光)激发,并且发射在单个发射检测通道/滤光器中收集或检测的荧光信号,指示此类成像事件中的“信号态”。
62.当参考成像事件使用时,术语“暗态”是指标记的核苷酸缀合物的状态,其中没有特定发射信号通过此类成像事件产生,或者在单个发射检测通道/滤光器中没有收集或检测到发射信号。核苷酸缀合物的“暗态”可以由各种情况引起。在一种场景下,此类核苷酸缀合物不含荧光部分,并且因此,该核苷酸缀合物不发射任何荧光信号。在另一种场景下,核苷酸缀合物用荧光部分标记,该荧光部分不能由在特定波长处的光源激发,并且因此不能发射任何信号或发射最小限度的荧光(例如,红色发射染料可能不能够在蓝色或紫色区域中的波长处激发)。在第三种场景下,核苷酸缀合物用荧光部分标记,并且由于成像事件而发射信号。然而,此类发射信号的波长在单个检测通道之外,并且因此不能被检测到(例如,染料发射蓝色信号,但检测通道在绿色到红色区域中)。暗态检测也可以包括可能存在/不
存在荧光标记的任何背景荧光。例如,当在某些波长处被激发时,一些反应组分可以表现出最小限度的荧光。因此,即使不存在荧光部分,也可能有来自此类组分的背景荧光。此外,背景荧光可能是由于光散射,例如来自相邻的测序反应,该背景荧光可以由检测器检测。此外,背景荧光可以由不纯簇引起(例如,由于簇扩增、定相或预定相事件期间的多模板接种)。因此,“暗态”可以包括此类背景荧光,如当未明确包含荧光部分时,诸如当不含荧光标记的核苷酸用于本文所述方法中时。然而,设想此类背景荧光可以与信号态区分,并且未标记的核苷酸(或“暗的”核苷酸)的此类核苷酸掺入仍然是可识别的。
63.在本文所述的方法的一个示例中,“t”核苷酸缀合物由第一成像事件中的信号态和第二成像事件中的暗态来确定;“c”核苷酸缀合物由第一成像事件中的暗态和第二成像事件中的信号态来确定;“a”核苷酸缀合物由第一成像事件中的信号态和第二成像事件中的信号态来确定;并且“g”核苷酸缀合物由第一成像事件中的暗态和第二成像事件中的暗态来确定。又如,“c”核苷酸缀合物由第一成像事件中的信号态和第二成像事件中的暗态来确定;“t”核苷酸缀合物由第一成像事件中的暗态和第二成像事件中的信号态来确定;“a”核苷酸缀合物由第一成像事件中的信号态和第二成像事件中的信号态来确定;并且“g”核苷酸缀合物由第一成像事件中的暗态和第二成像事件中的暗态来确定。下表a中示出了非限制性示例。在每个示例中,“t”也可以被“u”替代。
64.表a:基于第一成像事件和第二成像事件的核苷酸缀合物的同一性
65.[0066][0067]
在本文所述的方法的一些实施方案中,步骤(a)中的混合物中的核苷酸缀合物包含选自由以下项组成的组的核苷酸类型:a、c、g、t和u以及它们的非天然核苷酸类似物。在另外的实施方案中,步骤(a)中的混合物包含四种不同类型的核苷酸缀合物(a、c、g和t或u)或它们的非天然核苷酸类似物。在另外的实施方案中,四种不同类型的核苷酸缀合物为datp、dctp、dgtp和dttp或dutp或它们的非天然核苷酸类似物。在一些另外的实施方案中,四种类型的核苷酸缀合物中的三种类型的核苷酸缀合物各自用荧光团(在光谱上与另一个荧光团不同)标记,并且核苷酸缀合物中的一种核苷酸缀合物未用荧光团标记,或用荧光团标记,但无法在第一成像事件或第二成像事件中激发并且发射信号。在另外的实施方案中,掺入混合物中的四种类型的核苷酸缀合物中的每一种类型核苷酸缀合物含有3'羟基封端基团。
[0068]
在本文所述的方法的一些实施方案中,该方法还包括步骤(e):在下一个测序循环之前(例如,在第二成像事件之后,并且在开始下一个测序循环之前)从掺入的核苷酸缀合物裂解或去除荧光标记。在另外的实施方案中,掺入的核苷酸缀合物具有3'羟基封端基团,并且该3'羟基封端基团在下一个测序循环之前也被去除。在一些此类实施方案中,标记和3'羟基封端基团在单个步骤中(例如,在相同化学反应条件下)被去除。在其他实施方案中,标记和3'羟基封端基团在两个单独的步骤中被去除(例如,标记和3'封端基团在两种单独的化学反应条件下被去除)。在一些另外的实施方案中,在标记和3'封端基团被去除之后,使用裂解洗涤后步骤、。在另外的实施方案中,步骤(a)至步骤(e)在重复循环(例如,至少30、50、100、150、200、250、300、400或500次)中执行,并且该方法还包括基于每种相继掺入的核苷酸缀合物的同一性依次确定靶多核苷酸的至少一部分的序列。在一些此类实施方案中,步骤(a)至步骤(e)重复至少50个循环。在一些此类实施方案中,四种不同类型的核苷酸缀合物同时地存在并且在每个循环期间竞争掺入。在一些另外的实施方案中,核苷酸缀合物的掺入通过聚合酶(例如,dna聚合酶)执行。示例性聚合酶包括但不限于pol812、pol 1901、pol 1558或pol 963。例如,在美国专利公开2020/0131484a1和2020/0181587a1中描述了pol 812、pol 1901、pol 1558或pol 963dna聚合酶的氨基酸序列,这些公开均以引用方式并入本文。
[0069]
在本文所述的方法的一些实施方案中,在第一成像事件中使用的第一激发光源和在第二成像事件中使用的第二激发光源中的每一者包括激光、发光二极管(led)或它们的
组合。在一些实施方案中,第一激发光源相比第二激发光源具有更短的波长。在一些此类实施方案中,第一激发光源具有约400nm至约480nm、约420nm至约470nm或约450nm至约460nm的波长(即“蓝光”)。在一个实施方案中,第一激发光源具有约450nm的波长。第二激发光源具有约490nm至约550nm、约500nm至约540nm或约510nm至约530nm的波长(即“绿光”)。在一个实施方案中,第二激发光源具有约520nm的波长。在其他实施方案中,第一激发光源相比第二激发光源具有更长的波长。在一些此类实施方案中,第一激发光源具有约490nm至约550nm、约500nm至约540nm或约510nm至约530nm的波长(即,“绿光”)。在一个实施方案中,第二激发光源具有约520nm的波长。第二激发光源具有约400nm至约480nm、约420nm至约470nm或约450nm至约460nm的波长(即“蓝光”)。在一个实施方案中,第二激发光源具有约450nm的波长。
[0070]
在本文所述的方法的一些实施方案中,单个发射检测通道具有超过约560nm、超过约570nm、超过约580nm、超过约590nm或超过约600nm的检测光谱范围。在另外的实施方案中,单个发射检测具有小于约700nm、小于约690nm、小于约680nm、小于约670nm、小于约660nm或小于约650nm的检测光谱范围。在一些另外的实施方案中,单个发射检测通道具有约560nm至约690nm、约570nm至约680nm或约580nm至约650nm的检测光谱范围。如本文所用,术语“单个发射检测通道”是指仅允许检测光谱的某一区域的或某一波长范围内的光,而不会检测到此类光谱区域之外的任何发射的检测通道或滤光器。具体地,第一标记、第二标记和第三标记中的每一者具有在某一波长范围处重叠的发射光谱,使得来自第一标记、第二标记和第三标记中的任一者的发射可以由相同的检测通道或滤光器检测到。在一些此类实施方案中,单个发射检测通道可以检测到约560nm至约690nm、约570nm至约680nm或约580nm至约650nm的发射光谱。
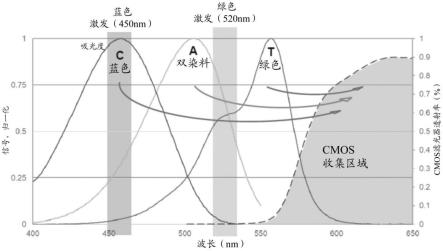
[0071]
图2示出在测序方法中描述的成像事件的实施方案。掺入混合物含有四种核苷酸:用第一染料(ffc)标记的dctp,该第一染料能够由具有波长在约450nm处的蓝色光源激发;用第二染料(fft)标记的dttp,该第二染料能够由具有波长在约520nm处的绿色光源激发;用第三染料(ffa)标记的datp,该第三染料能够由在450nm处的蓝色光源和在540nm处的绿色光源两者激发(“双染料”);以及未标记的dgtp(ffg)。ffc、fft和ffa的发射光谱在超过560nm(例如,约570nm至约650nm)的cmos收集区域中被检测到。当第一成像事件使用蓝色光源并且第二成像事件使用绿色光源时,掺入的核苷酸缀合物的同一性可以如下确定:
[0072]
核苷酸的同一性第一成像事件第二成像事件c信号态暗态t暗态信号态a信号态信号态g暗态暗态
[0073]
类似地,当第一成像事件使用绿色光源并且第二成像事件使用蓝色光源时,掺入的核苷酸缀合物的同一性可以如下确定:
[0074]
核苷酸的同一性第一成像事件第二成像事件t信号态暗态c暗态信号态a信号态信号态
g暗态暗态
[0075]
本文所述的双激发单通道检测测序方法需要荧光染料不仅具有强荧光和化学稳定性,而且还具有专门设置的吸收和长斯托克斯位移。在一些实施方案中,具有能够在第一光源和第二光源两者(例如,450nm和520nm,或520nm和450nm)处激发的双染料的核苷酸缀合物具有约480nm至510nm或约490nm至500nm的吸光度最大值(a
最大
)。具有仅能够在较短波长(第一光源或第二光源)处激发的染料的核苷酸缀合物具有约450nm至460nm的a
最大
。具有仅能够在较长波长(第一光源或第二光源)处激发的染料的核苷酸缀合物具有在520nm之上的a
最大
。在另外的实施方案中,具有双染料的核苷酸缀合物的发射最大值(e
最大
)大于550nm或大于560nm。此类标记的核苷酸缀合物的斯托克斯位移大于60nm。在一些另外的实施方案中,具有仅能够在较短波长处激发的染料(波长较短的光源示出信号态,波长较长的光源示出暗态)的核苷酸缀合物的e
最大
大于560nm。此类标记的核苷酸缀合物的斯托克斯位移大于100nm。在一些另外的实施方案中,具有仅能够在较长波长处激发的染料的核苷酸缀合物的e
最大
大于560nm。此类核苷酸缀合物的斯托克斯位移大于约30nm或大于约40nm。可以在本文所述的测序方法中使用的具有在450nm至460nm、480nm至510nm或490nm至500nm之间的a
最大
的香豆素染料的非限制性示例包括在美国公开2018/0094140a1、2018/0201981a1、2020/0277529a1和2020/0277670a1以及美国系列号63/057,758中公开的那些,这些文献以引用方式并入。可以在本文所述的测序方法中使用的具有大于520nm的a
最大
的聚甲炔染料的非限制性实例包括国际专利公开wo 2013/041117、wo 2014/135221、wo 2015/170102、wo 2016/189287和wo 2017/051201中公开的那些。
[0076]
在一些实施方案中,通过图像分析软件处理来自第一成像事件和第二成像事件的发射检测的组合,以确定在每个固定的引物多核苷酸/靶多核苷酸复合物位置处掺入的碱基的同一性。在一些此类实施方案中,在重复的掺入循环之后(在至少50、100、150、200、250或300次运行之后)处理图像分析。在另外的实施方案中,对多个固定的引物多核苷酸/靶多核苷酸复合物(簇)进行检测和并行测序。
[0077]
图3a示出用于单通道检测的系统的透视图。固体载体(例如,流通池)含有固定在表面上的成簇靶多核苷酸模板和与模板的至少一部分杂交的引物多核苷酸,形成成簇引物多核苷酸/靶多核苷酸复合物。流动通道包括离散纳米孔,每个纳米孔含有固定的引物多核苷酸/靶多核苷酸复合物,其中掺入的核苷酸缀合物分别暴露于绿色光源和蓝色光源激发。取决于连接到掺入的核苷酸缀合物的荧光部分,该荧光部分可以吸收蓝光/绿光中的任一者、蓝光/绿光两者、或蓝色/绿光两者均不(例如,当掺入的核苷酸缀合物不含荧光部分时)。在单个检测通道中检测荧光部分的发射(例如,红光)。简化工作流使之仅用于示出成像事件和检测机制。该工作流不包括本文所述的测序方法的附加步骤,例如在第二成像事件之后裂解荧光部分,以及任选的裂解洗涤后步骤。
[0078]
图3b为在本文所述的测序方法中使用的示例性测序和检测机制300的透视图。300可以整合进本文所述的固体载体中。首先,图案化流通池310包括由空隙区域隔开的多个离散纳米孔315。在这些纳米孔中的每个纳米孔内执行测序反应(例如,核苷酸掺入、掺入的核苷酸缀合物的3'封端的脱保护、检测后裂解标记)。流通池还可以含有透明的保护表面,允许蓝光和绿光光照通过。320为多个光学滤光器,该多个光学滤光器嵌入到挡光元件325中,使得仅由掺入的核苷酸缀合物生成的在特定波长范围内的发射信号可以通过并且被cmos
图像传感器检测到。
[0079]
在本文所述的方法的任何实施方案中,靶多核苷酸,例如单链靶多核苷酸,可以固定到固体载体。在一些此类实施方案中,固体载体包含多个固定的靶多核苷酸,例如单链靶多核苷酸。在另外的实施方案中,每个靶多核苷酸与引物多核苷酸(与靶多核苷酸的至少一部分互补)杂交,并且因此形成引物核苷酸/靶核苷酸复合物。固体载体可以包含成簇引物核苷酸/靶核苷酸复合物。在一些实施方案中,固体载体包括流通池,例如,包括多个纳米孔的图案化流通池,每个纳米孔彼此隔开。在一些另外的实施方案中,每个纳米孔在其中包含一个固定的簇。在一些实施方案中,固体载体还包括cmos芯片。例如,图案化流通池被构造在cmos芯片的顶部上,由多个光学滤光器和挡光元件隔开,使得由成像事件生成的发射信号通过光学滤光器过滤并且被coms图像传感器检测到。在又一些另外的实施方案中,多个纳米孔中的每个纳米孔对准每个cmos光电二极管(像素)正上方。
[0080]
在本文所述的方法的任何实施方案中,该方法不包括在第一成像事件之后并且在第二成像事件之前对混合物中任何核苷酸缀合物的任何化学修饰。化学修饰可以利用化学试剂,诸如裂解试剂、结合配偶体-荧光部分缀合物或可以直接或间接导致从第一成像事件到第二成像事件的能够识别和能够测量的荧光变化的其他试剂。例如,化学修饰可以包括从一种或多种类型的核苷酸缀合物中裂解标记和/或将标记添加到一种或多种不同类型的核苷酸缀合物。具体地,本文所述的方法消除了iseq
tm
100测序仪所需的第二化学步骤,该第二化学步骤去除来自一种核苷酸缀合物的荧光标记并且将荧光标记添加到不同类型的核苷酸缀合物。因此,本文所述的测序方法使得循环时间大幅缩减并且减少所需试剂(例如,thp试剂和洗涤溶液)的体积。在一些实施方案中,与illumina的iseq
tm
100上使用一种染料(如图1a中所描述的一种检测方法)的标准循环时间相比,本文所述的测序方法使得循环时间缩减至少5%、10%、15%、20%、25%或30%。
[0081]
下文描述了附加的例示性实施方案。
[0082]
在一些实施方案中,用于对核酸进行测序的方法包括使用一种荧光标记来直接或间接检测三种不同核苷酸类型和不是通过荧光信号的存在来检测而是通过不含或不存在荧光信号来检测的一种核苷酸类型。在一些实施方案中,用于对核酸进行测序的方法包括使用包含相同或相似的激发/发射光谱的两种或更多种不同的荧光标记来直接或间接检测三种不同核苷酸类型和不是通过荧光信号的存在来检测而是通过不含或不存在荧光信号来检测的一种核苷酸类型。相同或相似的激发和发射光谱使得光源激发两种或更多种不同的荧光标记,并且光学滤光器捕获这些荧光标记发射的荧光信号。通过荧光的检测来确定核酸样本的序列是在时间空间中进行的,例如在测序反应期间的不同时间(即,在反应条件(诸如酶促裂解、环境ph变化、添加附加的试剂)变化前后),提供荧光的模式(诸如荧光跃迁模式),其累积模式确定核酸靶的序列。因此,本文所述的方法具有时间和成本效益,并且允许简化相关的测序仪器。
[0083]
利用时间空间荧光模式差异来确定靶核酸序列的示例性应用是合成测序(sbs)方法和技术。因此,如本文所述的实施方案在合成测序荧光应用中找到了特别的效用。即使如本文所述的实施方案是荧光测序的示例性创新方法,所公开的实施方案也找到了对于多种其他应用的效用,在这些其他应用中,期望检测样本中的多于一种分析物(即,核苷酸、蛋白质或它们的片段)。
[0084]
在一些实施方案中,在基底(诸如玻璃、塑料、半导体芯片或复合材料来源的基底)上执行测序。在一些实施方案中,在基底上提供一个核酸种类,例如用于单靶测序。在其他实施方案中,测序也可以呈多重形式,其中对多个核酸靶进行检测和平行测序,例如以流通池或阵列类型的形式。当实践平行测序或大规模平行测序时,本文所述的实施方案是特别有利的。实践荧光平行测序的平台包括但不限于illumina,inc.(例如,genome分析仪、miseq
tm
、miniseq
tm
、nextseq
tm
、iseq
tm
和novaseq
tm
平台)、life technologies(例如,solid)、helicos biosciences(例如,heliscope)、454/roche life sciences(branford,conn.)和pacific biosciences(例如,smart)所提供的那些。可以容纳多个核酸种类的流通池、芯片和其他类型的表面是用于平行测序的示例性基底。在其中对多个核酸种类进行平行测序的多重形式中,克隆扩增的靶序列(例如,通过乳液pcr(empcr)或桥式扩增)通常共价固定在基底上。例如,当实践乳液pcr时,感兴趣的靶固定在珠粒上,而克隆扩增的靶固定在流通池的通道或者阵列或芯片上的特定位置中。
[0085]
与如本文所述的组合物和方法一起使用的流通池可以以多种方式用于测序。例如,可以将dna样本(诸如dna文库)应用于包含一个或多个蚀刻的流动通道的流通池或流体装置,其中流通池还可以包含与该流通池的表面共价连接的一组探针分子。连接在流通池通道中的探针有利地定位于通道中的不同可寻址位置处,并且dna文库分子可以添加到其中可以结合互补序列的流通池通道(如本文所述,还如wo 2012/096703中所述,该专利全文以引用方式并入本文)。用于本技术的流通池的另一示例包括,如美国专利号8,906,320和9,990,381(这些专利全文以引用方式并入本文)中所述的cmos流通池。可以如本文所述进行桥式扩增,然后通过如本文所述的方法和组合物合成测序。用于产生和利用流通池以进行测序的方法在本领域中是已知的;本文提供参考文献并且所有这些文献全文以引用方式并入本文。预期如本文所述的方法和组合物不限于流通池定向测序方法中的任何特定制造或方法。
[0086]
利用本文所述的方法和组合物的测序也可以在微量滴定板中进行,例如在高密度反应板或载玻片中(margulies等人,2005,nature 437(7057):376-380,其全文以引用方式并入本文)。例如,可以通过empcr技术制备基因组靶。反应板或载玻片可以由能够捕获和记录由反应(例如由荧光或发光反应)生成的光的光纤材料产生。可以蚀刻芯材料以提供能够固定至少一种empcr反应珠粒的离散反应孔。此类载玻片/板可以含有超过160万个孔。所产生的载玻片/板可以载有靶测序反应empcr珠粒并且安装到提供测序试剂并且发生测序的仪器。
[0087]
当实践在芯片或载玻片上包含dna纳米球的图案化基底(如由complete genomics(mountain view,calif.)所执行的)时,提供用于利用本文所公开的组合物和方法对靶进行测序的排列状基底的示例。如drmanac等人,2010,science 327(5961):78-81中所述,硅晶片可以与二氧化硅和钛层叠,并且随后使用光刻法和干蚀刻技术进行图案化。可用hmds处理晶片并且用光致抗蚀剂层对其进行涂覆,以限定用于硅烷化和随后共价连接dna纳米球以用于测序的离散区域。技术人员将会知道,存在许多方法用于产生具有用于固定核酸以在测序方法中使用的离散位置的载玻片/芯片,并且本发明方法不受制备用于测序的基底的方法限制。
[0088]
出于例证的目的并且不旨在限制如本文所述的实施方案,可以通过一系列步骤来
描述一般策略测序循环。以下示例基于合成测序的测序反应,然而,如本文所述的方法不限于任何特定的测序反应方法。
[0089]
另选地,本文所述的测序方法还可以如下进行:使用未标记的核苷酸,同时采用上述相同的两个成像事件和单通道发射检测。例如,在步骤(a)的掺入混合物中,四种不同类型的核苷酸(例如,datp、dctp、dgtp和dttp或dutp)中的一种、两种、三种或每一种类型的核苷酸可以未标记。四种类型的核苷酸中的每一种类型的核苷酸(例如,dntp)具有3'羟基封端基团,以确保仅单个碱基可以通过聚合酶添加到引物多核苷酸的3'端。在步骤(b)中掺入未标记的核苷酸后,洗掉其余的未掺入的核苷酸。然后引入亲和力试剂,该亲和力试剂特异性地识别并结合到掺入的dntp以提供包含掺入的dntp的标记的延伸产物。已在wo 2018/129214和wo2020/097607中公开了未标记的核苷酸和亲和力试剂在合成测序中用途。使用未标记的核苷酸的本公开的修改的测序方法可以包括以下步骤:
[0090]
(a')使引物多核苷酸与包含四种不同类型的未标记的核苷酸中的一种或多种类型的未标记的核苷酸的混合物接触,其中该引物多核苷酸与单链靶多核苷酸的至少一部分互补;
[0091]
(b')使来自混合物的一种未标记的核苷酸掺入引物多核苷酸中以产生延伸的引物多核苷酸;
[0092]
(c')在其中一种亲和力试剂特异性地结合到掺入的未标记的核苷酸的条件下使延伸的引物多核苷酸与一组不同的亲和力试剂接触以提供标记的延伸的引物多核苷酸;
[0093]
(d')使用第一激发光源执行第一成像事件并且检测来自标记的延伸的引物多核苷酸的第一发射信号;
[0094]
(e')使用第二激发光源执行第二成像事件并且检测来自标记的延伸的引物多核苷酸的第二发射信号;
[0095]
其中第一激发光源和第二激发光源具有不同波长;并且其中第一发射信号和第二发射信号在单个发射滤光器或通道中检测或收集。在本文所述的修改的测序方法的一些实施方案中,掺入混合物中的未标记的核苷酸中的每一种核苷酸含有3'羟基封端基团。在另外的实施方案中,在下一测序循环之前去除掺入的核苷酸的3'羟基封端基团。在又一些另外的实施方案中,该方法还包括从掺入的核苷酸中去除亲和力试剂。在又一些另外的实施方案中,在相同反应中去除3'羟基封端基团和亲和力试剂。在一些实施方案中,该组亲和力试剂可以包括特异性结合到第一类型的核苷酸的第一亲和力试剂、特异性结合到第二类型的核苷酸的第二亲和力试剂和特异性结合到第三类型的核苷酸的第三亲和力试剂。在一些另外的实施方案中,第一亲和力试剂、第二亲和力试剂和第三亲和力试剂中的每一者包含可检测的标记。在一些实施方案中,亲和力试剂包括蛋白质标签、抗体(包括但不限于抗体的结合片段、单链抗体、双特异性抗体等)、核酸适体(aptamer)、打结素(knottin)、非抗体纤维蛋白原结合蛋白(affimer)或任何其他以合适的特异性和亲和力结合掺入的核苷酸的已知试剂。在一个实施方案中,亲和力试剂为蛋白质标签或抗体。在另一个实施方案中,亲和力试剂为蛋白质标签或包含一种或多种可检测的标记的抗体,该可检测的标记为荧光标记。
[0096]
四种核苷酸类型a、c、t和g通常是设计用于具有3'羟基封端基团的测序反应的经修饰的核苷酸,其中四种类型中的三种类型被荧光标记,与其他反应组分一起被同时添加
到感兴趣的模板序列(也可互换使用感兴趣的靶多核苷酸序列)所在的位置,并且发生测序反应(例如,流通池、芯片、载玻片等)。在基于靶序列将核苷酸掺入生长的序列核酸链中之后,将反应暴露于光并且捕获和记录任何发射信号;这构成第一成像事件和第一荧光检测模式。在第一成像事件之后,用来自第一光源的具有不同波长的第二光照射样本,并且再次光射反应位置以及捕获和记录荧光的任何变化;构成第二成像事件(即,第二荧光检测模式)。在第二成像事件后,去除并且与其他试剂一起洗掉掺入的核苷酸上的3'封端基团,为下一个测序循环做准备。在一些实施方案中,本公开的方法不涉及使用任何可以直接导致从第一成像事件到第二成像事件的能够识别和能够测量的荧光变化的化学试剂。比较来自两个成像事件的荧光模式,并且针对该特定循环,确定核苷酸掺入,以及因此确定靶核酸的序列。
[0097]
在一个实施方案中,通过聚合酶的作用将至少一种核苷酸在合成步骤中掺入到多核苷酸(如本文所述的单链引物多核苷酸)中。然而,可以使用将核苷酸接合到多核苷酸的其他方法,诸如,化学寡核苷酸合成或者将标记的寡核苷酸与未标记的寡核苷酸连接。因此,当术语“掺入”关于核苷酸和多核苷酸使用时,可以涵盖通过化学方法以及酶促方法进行的多核苷酸合成。
[0098]
在一个具体的实施方案中,进行了合成步骤并且该合成步骤可以任选地包括将模板或靶多核苷酸链与包含本公开的荧光标记的核苷酸的反应混合物一起温育。还可以在允许在退火到模板或靶多核苷酸链的多核苷酸链上的游离3'oh基团和标记的核苷酸上的5'磷酸基团之间形成磷酸二酯键的条件下提供聚合酶。因此,合成步骤可以包括通过核苷酸与模板/靶链的互补碱基配对来指导多核苷酸链的形成。
[0099]
在这些方法的所有实施方案中,检测步骤可以在向其中掺入了标记的核苷酸的多核苷酸链退火到靶链时进行,或者在其中将两条链分开的变性步骤之后进行。在合成步骤和检测步骤之间可以包括另外的步骤,例如化学反应步骤或酶促反应步骤,或者纯化步骤。具体地,可以分离或纯化掺入了标记的核苷酸的多核苷酸链,然后将其进一步加工或用于后续的分析。以举例的方式,在合成步骤中掺入了如本文所述的标记的核苷酸的多核苷酸链随后可以用作标记的探针或引物。在其他实施方案中,本文示出的合成步骤的产物可以经受进一步的反应步骤,并且如果需要,这些后续步骤的产物被纯化或分离。
[0100]
用于合成步骤的合适条件将为熟悉标准分子生物学技术的人员所熟知。在一个实施方案中,合成步骤可以类似于标准引物延伸反应,该标准引物延伸反应在合适的聚合酶的存在下使用核苷酸前体(包括如本文所述的标记的核苷酸)形成与靶链互补的延伸的多核苷酸链(引物多核苷酸链)。在其他实施方案中,合成步骤本身可以形成产生标记的双链扩增产物的扩增反应的一部分,该标记的双链扩增产物由来源于引物靶多核苷酸链的拷贝的退火互补链组成。其他示例性合成步骤包括切口平移、链置换聚合、随机引发的dna标记等。用于合成步骤的特别有用的聚合酶是能够催化如本文示出的标记的核苷酸的掺入的聚合酶。可以使用多种天然存在的或突变的/经修饰的聚合酶。以举例的方式,热稳定聚合酶可以用于使用热循环条件进行的合成反应,而热稳定聚合酶可能不是等温引物延伸反应所期望的。能够掺入根据本公开的标记的核苷酸的合适的热稳定聚合酶包括在wo 2005/024010或wo06120433中描述的那些,这些专利各自以引用方式并入本文。在较低温度诸如37℃进行的合成反应中,聚合酶不必是热稳定聚合酶,因此对聚合酶的选择将取决于许多
因素,诸如反应温度、ph、链置换活性等。
[0101]
在具体的非限制性实施方案中,本公开涵盖以下的方法:核酸测序、重新测序、全基因组测序、单核苷酸多态性评分、涉及当用本文示出的染料标记的经修饰的核苷酸或核苷掺入到多核苷酸中时对其进行检测的任何其他应用。
[0102]
在一个特定实施方案中,本公开提供包含根据本公开的染料部分的标记的核苷酸在多核苷酸合成测序反应中的用途。合成测序通常涉及使用聚合酶或连接酶在5'至3'方向上将一个或多个核苷酸或寡核苷酸顺序添加至生长的多核苷酸链,以便形成与待测序的模板/靶核酸互补的延伸多核苷酸链。存在于一个或多个添加的核苷酸中的碱基的同一性可以在检测或“成像”步骤中确定。添加的碱基的身份可以在每个核苷酸掺入步骤之后测定。然后可以使用常规的watson-crick碱基配对规则来推断模板的序列。使用用本文示出的染料标记的核苷酸来确定单个碱基的同一性可能是有用的,例如,在单核苷酸多态性的评分中,并且此类单碱基延伸反应在本公开的范围内。
[0103]
在本公开的一个实施方案中,靶多核苷酸的序列通过检测连接到掺入的核苷酸的荧光标记,检测一个或多个核苷酸掺入到与待测序的靶多核苷酸互补的新生链中来确定。靶多核苷酸的测序可以用合适的引物(或制备成发夹构建体,其将含有引物作为发夹的一部分)来引发,并且新生链通过在聚合酶催化的反应中向引物的3'端添加核苷酸而以逐步方式延伸。
[0104]
在特定实施方案中,不同的核苷酸三磷酸(a、t、g和c)中的每一种可以用独特的荧光团进行标记,并且还在3'位置处包含封端基团以防止不受控制的聚合。替代性地,四种核苷酸中的一种可以是未标记的(暗色)。聚合酶将核苷酸掺入到与模板/靶多核苷酸互补的新生链中,并且封端基团防止核苷酸的进一步掺入。任何未掺入的核苷酸都可以被洗掉,并且来自每种掺入的核苷酸的荧光信号模式可以通过合适的装置(诸如使用激发和合适的发射滤光器的电荷耦合器件)以光学方式“读取”。然后可以(同时或顺序地)去除(裂解)3'-封端基团和荧光染料化合物,以暴露新生链用于进一步的核苷酸掺入。通常,将在每个掺入步骤之后确定所掺入的核苷酸的身份,但这不是严格必需的。类似地,美国专利号5,302,509(其以引用方式并入本文)公开了一种对固定在固体载体上的多核苷酸进行测序的方法。
[0105]
如上文所例示,该方法利用了在dna聚合酶的存在下将荧光标记的3'-封端的核苷酸a、g、c和t掺入到与固定的多核苷酸互补的生长链中。聚合酶掺入与靶多核苷酸互补的碱基,但是被3'羟基封端基团防止进一步添加。然后可以确定掺入的核苷酸的标记,并且通过化学裂解除去封闭基团以允许发生进一步的聚合。在合成测序反应中待测序的核酸模板可以是期望测序的任何多核苷酸。用于测序反应的核酸模板将通常包含具有游离的3'oh基团的双链区域,该双链区域充当用于在测序反应中添加另外的核苷酸的引物或起始点。待测序模板的该区域将在互补链上悬垂该游离的3'oh基团。待测序模板的悬垂区域可以是单链的,但也可以是双链的,前提条件是在与待测序的靶链互补的链上“存在切口”,以提供用于引发测序反应的游离的3'oh基团。在此类实施方案中,测序可以通过链置换进行。在某些实施方案中,可以添加带有游离的3'oh基团的引物,作为与待测序模板的单链区域杂交的单独组分(例如,短寡核苷酸)。替代性地,待测序的引物和模板链可以各自形成能够形成分子内双链体(诸如发夹环结构)的部分自身互补核酸链的一部分。发夹多核苷酸及可以用于将其连接到固体载体的方法在pct公开wo 01/57248和wo 2005/047301中公开,这些公开各自
以引用方式并入本文。核苷酸可以被连续地添加到生长引物,导致在5'至3'方向上合成多核苷酸链。可以确定已添加的碱基的性质,特别是但不必在每次添加核苷酸之后,从而提供核酸模板的序列信息。因此,通过经由与核苷酸的5'磷酸基团形成磷酸二酯键而将核苷酸接合到核酸链的游离的3'oh基团,从而将该核苷酸掺入到核酸链(或多核苷酸)中。
[0106]
待测序的核酸模板可以是dna或rna,或者甚至是由脱氧核苷酸和核糖核苷酸组成的杂合分子。核酸模板可以包含天然存在的和/或非天然存在的核苷酸以及天然或非天然的骨架键,前提条件是这些不阻止测序反应中模板的复制。
[0107]
在某些实施方案中,待测序的靶多核苷酸可以经由本领域已知的任何合适的连接方法(例如经由共价连接)连接到固体载体。在某些实施方案中,靶多核苷酸可以直接连接到固体载体(例如,基于二氧化硅的载体)。然而,在本公开的其他实施方案中,固体载体的表面可以以某种方式修饰,以便允许靶多核苷酸的直接共价连接,或者通过水凝胶或聚电解质多层来固定该靶多核苷酸,该多层本身可以非共价地连接到固体载体。
[0108]
其中多核苷酸已直接连接到载体(例如,基于二氧化硅的载体)的阵列为诸如在wo 00/06770(以引用方式并入本文)中所公开的那些,其中通过玻璃上的环氧侧基与多核苷酸上的内部氨基基团之间的反应将多核苷酸固定在玻璃载体上。此外,可以通过硫基亲核物质与固体载体的反应将多核苷酸连接到固体载体,例如,如wo 2005/047301中所述(以引用方式并入本文)。固体支撑的靶多核苷酸的又一个示例是,其中模板多核苷酸连接到支撑在基于二氧化硅的固体载体或其他固体载体上的水凝胶,例如,如wo 00/31148、wo 01/01143、wo 02/12566、wo03/014392、美国专利号6,465,178和wo 00/53812中所述,这些专利各自以引用方式并入本文。
[0109]
模板多核苷酸可以固定于其上的特定表面是聚丙烯酰胺水凝胶。聚丙烯酰胺水凝胶描述于上文引用的参考文献和wo2005/065814(其以引用方式并入本文)中。可以使用的特定水凝胶包括wo 2005/065814和美国公开2014/0079923中所描述的那些。在一个实施方案中,水凝胶为pazam(聚(n-(5-叠氮基乙酰氨基戊基)丙烯酰胺-共-丙烯酰胺))。
[0110]
dna模板分子可以连接到珠粒或微粒,例如,如美国专利号6,172,218(其以引用方式并入本文)中所描述。与珠粒或微粒的附接可以用于测序应用。可以制备珠粒文库,其中每个珠粒包含不同的dna序列。示例性文库及其产生方法在nature,437,376-380(2005);science,309,5741,1728-1732(2005)中描述,这些文献中的每一篇均以引用方式并入本文。使用本文示出的核苷酸对此类珠粒的阵列进行测序在本公开的范围内。
[0111]
待测序的模板可以形成固体载体上的“阵列”的一部分,在这种情况下,阵列可以采取任何方便的形式。因此,本公开的方法适用于所有类型的高密度阵列,包括单分子阵列、成簇阵列和珠粒阵列。用本公开的染料化合物标记的核苷酸可以用于对基本上任何类型的阵列上的模板(包括但不限于通过将核酸分子固定在固体载体上而形成的那些)进行测序。
[0112]
然而,用本公开的染料化合物标记的核苷酸在对成簇阵列进行测序的背景中是特别有利的。在成簇阵列中,阵列上的不同区域(通常称为位点或特征)包含多个多核苷酸模板分子。一般来讲,所述多个多核苷酸分子不能通过光学手段单独地分辨,而是作为整体被检测到。取决于阵列的形成方式,阵列上的每个位点可以包含一个单独多核苷酸分子的多个拷贝(例如,该位点对于特定的单链核酸种类或双链核酸种类是同质的)或甚至少量不同
多核苷酸分子的多个拷贝(例如,两个不同核酸种类的多个拷贝)。核酸分子的成簇阵列可以使用本领域中公知的技术产生。以举例的方式,wo 98/44151和wo 00/18957(其中的每一篇均并入本文)描述了扩增核酸的方法,其中模板和扩增产物均保持固定在固体载体上,以便形成由固定的核酸分子的簇或“集落”组成的阵列。根据这些方法制备的成簇阵列上存在的核酸分子是使用用本公开的染料化合物标记的核苷酸进行测序的合适模板。
[0113]
用本公开的染料化合物标记的核苷酸也可用于对单分子阵列上的模板进行测序。如本文所用的术语“单分子阵列”或“sma”,是指分布(或排列)在固体载体上的多核苷酸分子群,其中任何单独的多核苷酸与该分子群的所有其他多核苷酸的间距使得有可能单独地分辨单独的多核苷酸分子。因此,在一些实施方案中,固定到固体载体的表面上的靶核酸分子能够通过光学手段分辨。这意味着一个或多个不同的信号(每个信号代表一种多核苷酸)将出现在所用的特定成像装置的可分辨区域内。
[0114]
可以实现单分子检测,其中阵列上的相邻多核苷酸分子之间的间距为至少100nm,更具体地讲至少250nm,还更具体地讲至少300nm,甚至更具体地讲至少350nm。因此,每个分子能够作为单分子荧光点来单独地分辨和检测,并且来自所述单分子荧光点的荧光也表现出单步光漂白。
[0115]
术语“单独分辨的”和“单独分辨”在本文中用于规定,当可视化时,有可能将阵列上的一个分子与其相邻分子区分开。阵列上各个分子之间的间隔将部分地通过用于分辨各个分子的特定技术来确定。通过参考已公开的申请wo 00/06770和wo 01/57248将理解单分子阵列的一般特征,这些申请中的每件申请以引用方式并入本文。虽然本公开的标记的核苷酸的一种用途是用于合成测序反应中,但此类核苷酸的效用却不限于此类方法。事实上,本文所述的标记的核苷酸可以有利地用于需要检测连接到掺入到多核苷酸中的核苷酸的荧光标记的任何测序方法中。
[0116]
具体地,用本公开的染料化合物标记的核苷酸缀合物可以用于自动化荧光测序方案,尤其是基于sanger和同事的链终止测序方法的荧光染料-终止子循环测序。此类方法通常使用酶和循环测序将荧光标记的双脱氧核苷酸掺入引物延伸测序反应中。所谓的sanger测序方法和相关方案(sanger型)利用带有标记的双脱氧核苷酸的随机化链终止。
[0117]
试剂盒
[0118]
本公开的一些方面涉及用于本文所述的测序方法的试剂盒。具体地,试剂盒可以包含:包含第一荧光部分(即,第一标记)的第一类型的核苷酸缀合物;包含第二荧光部分(即,第二标记)的第二类型的核苷酸缀合物;和包含第三荧光部分(即,第三标记)的第三类型的核苷酸缀合物;其中第一标记、第二标记和第三标记中的每一者在光谱上彼此不同,第一标记和第三标记能够通过第一光源激发,第二标记和第三标记能够通过第二光源激发;其中第一光源和第二光源具有不同的激发波长;并且其中第一标记、第二标记和第三标记中的每一者具有能够在单个检测通道中检测的发射光谱。在另外的实施方案中,试剂盒还包含第四类型的核苷酸缀合物。在一些此类实施方案中,第四类型的核苷酸缀合物未标记。四种不同类型的核苷酸缀合物为a、c、g和t或u或它们的非天然核苷酸类似物。在另外的实施方案中,四种不同类型的核苷酸缀合物为datp、dctp、dgtp和dttp或dutp或它们的非天然核苷酸类似物。在一些实施方案中,第一激发光源具有约490nm至约550nm、约510nm至约540nm或约520nm至约530nm(例如,520nm)的波长。第二光源具有约400nm至约480nm、约
420nm至约470nm或450nm至约460nm(例如,450nm)的激发波长。在另选的实施方案中,第一光源具有约400nm至约480nm、约420nm至约470nm或450nm至约460nm(例如,450nm)的激发波长。第二激发光源具有约490nm至约550nm、约500nm至约540nm或约510nm至约530nm(例如,520nm)的波长。在另外的实施方案中,第一标记、第二标记和第三标记中的每一者具有大于550nm或560nm的发射光谱,可以在单个发射滤光器或通道中进行收集。在另外的实施方案中,单个发射检测通道具有超过560nm和/或小于700nm(例如,约565nm至约690nm、约570nm至约670nm或约580nm至约650nm)的检测范围。
[0119]
本文示出的化合物、核苷酸缀合物或试剂盒可以用于检测、测量或识别生物系统(包括,例如,其过程或组分)。可以采用化合物、核苷酸或试剂盒的示例性技术包括测序、表达分析、杂交分析、遗传分析、rna分析、细胞测定(例如,细胞结合或细胞功能分析)或蛋白质测定(例如,蛋白质结合测定或蛋白质活性测定)。该用途可以是在用于执行特定技术的自动化仪器(诸如自动化测序仪器)上。测序仪器可以含有在不同波长处操作的两个光源(即,第一激发光源和第二激发光源)。
[0120]
在一个特定实施方案中,本文所述的标记的核苷酸缀合物可以与未标记的或天然的核苷酸或它们的任何组合联合供应。核苷酸的组合可以作为独立的单独组分(例如,每个容器或管一个核苷酸类型)或作为核苷酸混合物(例如,在同一容器或管中混合的两种或更多种核苷酸)提供。在另外的实施方案中,核苷酸混合物可以含有所有四种类型的核苷酸。
[0121]
如本文所用,术语“在光谱上不同的”荧光染料或标记是指吸收在不同波长处的光能和/或具有不同斯托克斯位移的荧光染料,当两种或更多种此类染料存在于一个样本中时,该荧光染料可以通过荧光检测设备区分。当以试剂盒形式供应两种标记的核苷酸缀合物时,一些实施方案的特征在于在光谱上不同的荧光染料能够在不同的波长处激发,例如通过两个不同的光源。当以试剂盒形式供应用荧光染料化合物标记的四种核苷酸时,一些实施方案的特征在于在光谱上不同的荧光染料中的两种在光谱上不同的荧光染料均可以以一个波长激发,并且两种在光谱上不同的染料均可以以另一个波长激发。染料的特定激发波长在450nm至460nm、490nm至500nm,或520nm或以上(例如,532nm)。
[0122]
在本文所述的试剂盒的一些实施方案中,具有仅能够由第一光源激发的第一标记的核苷酸缀合物具有约450nm至460nm的吸光度最大值(a
最大
)。具有仅能够由第二光源激发的第二标记的核苷酸缀合物具有在520nm之上的a
最大
。具有能够在第一光源和第二光源(例如,450nm和520nm,或520nm和450nm)处激发的第三标记的核苷酸缀合物具有约480nm至510nm或约490nm至500nm的a
最大
。另选地,具有仅能够由第一光源能够激发的第一标记的核苷酸缀合物具有在520nm之上的a
最大
。具有仅能够由第二光源激发的第二标记的核苷酸缀合物具有约450nm至460nm的a
最大
。具有能够在第一光源和第二光源(例如,450nm和520nm,或520nm和450nm)处激发的第三标记的核苷酸缀合物具有约480nm至510nm或约490nm至500nm的a
最大
。在另外的实施方案中,具有第三标记的核苷酸缀合物的发射最大值(e
最大
)大于550nm或大于560nm,并且此类标记的核苷酸缀合物的斯托克斯位移大于60nm。具有第一标记的核苷酸缀合物的e
最大
大于560nm,并且此类标记的核苷酸缀合物的斯托克斯位移大于100nm。具有第二标记的核苷酸缀合物的e
最大
大于560nm,并且此类核苷酸缀合物的斯托克斯位移大于30nm或大于约40nm。另选地,具有第三标记的核苷酸缀合物的e
最大
大于550nm或大于560nm,并且此类标记的核苷酸缀合物的斯托克斯位移大于60nm。具有第一标记的核苷酸缀合物的e最大
大于560nm,并且此类核苷酸缀合物的斯托克斯位移大于约30nm或大于约40nm。具有第二标记的核苷酸缀合物的e
最大
大于560nm,并且此类标记的核苷酸缀合物的斯托克斯位移大于100nm。
[0123]
在一个示例中,第一光源具有450nm至460nm的激发波长,并且第二光源具有520nm的激发波长。在另一示例中,第一光源具有520nm的激发波长,并且第二光源具有450nm至460nm的激发波长。在一些此类实施方案中,第一类型的核苷酸缀合物为c核苷酸(dctp),第二类型的核苷酸缀合物为t核苷酸(dttp),第三类型的核苷酸缀合物为a核苷酸(datp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。在一些其他实施方案中,第一类型的核苷酸缀合物为t核苷酸(dttp),第二类型的核苷酸缀合物为c核苷酸(dctp),第三类型的核苷酸缀合物为a核苷酸(datp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。在一些其他实施方案中,第一类型的核苷酸缀合物为c核苷酸(dctp),第二类型的核苷酸缀合物为a核苷酸(datp),第三类型的核苷酸缀合物为t核苷酸(dttp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。在又一些其他实施方案中,第一类型的核苷酸缀合物为a核苷酸(datp),第二类型的核苷酸缀合物为c核苷酸(dctp),第三类型的核苷酸缀合物为t核苷酸(dttp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。在又一些其他实施方案中,第一类型的核苷酸缀合物为a核苷酸(datp),第二类型的核苷酸缀合物为t核苷酸(dttp),第三类型的核苷酸缀合物为c核苷酸(dctp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。在又一些其他实施方案中,第一类型的核苷酸缀合物为t核苷酸(dttp),第二类型的核苷酸缀合物为a核苷酸(datp),第三类型的核苷酸缀合物为c核苷酸(dctp),并且第四类型的核苷酸为未标记的g核苷酸(dgtp)。另选地,可以用本文所述的在光谱不同的标记来标记g或dgtp核苷酸,并且其他三种核苷酸缀合物中的一种核苷酸缀合物可以未标记。
[0124]
尽管本文以具有用不同染料化合物标记的不同核苷酸的构型为例来说明试剂盒,但是应当理解,试剂盒可以包括具有相同染料化合物的2种、3种、4种或更多种不同核苷酸。
[0125]
除了标记的核苷酸之外,试剂盒还可以一起包含至少一种附加组分。所述另外的组分可以是在本文示出的方法中或在下文的实施例部分中识别的组分中的一种或多种组分。可以结合到本公开的试剂盒中的组分的一些非限制性示例在下文示出。在一些实施方案中,试剂盒进一步包含dna聚合酶(诸如突变型dna聚合酶)和一种或多种缓冲液组合物。一种缓冲液组合物可以包含抗氧化剂,诸如抗坏血酸或抗坏血酸钠,该抗氧化剂可以用于在检测期间保护染料化合物免受光损坏。附加的缓冲液组合物可以包含能够用于裂解3'封端基团和/或可裂解的连接基的试剂。例如,由过渡金属和至少部分水溶性的配体形成水溶性膦或水溶性过渡金属催化剂(诸如钯络合物)。试剂盒的各种组分可以以要在使用之前稀释的浓缩形式提供。在此类实施方案中,还可以包括合适的稀释缓冲液。同样,在本文示出的方法中识别的组分中的一种或多种组分可以被包括在本公开的试剂盒中。
[0126]
在本文所述的试剂盒的一些实施方案中,荧光染料化合物可以经由核苷酸碱基共价连接到核苷酸。在一些此类实施方案中,标记的核苷酸可以具有任选地通过连接基部分连接到嘧啶碱基的c5位置或7-脱氮嘌呤碱基的c7位置的染料。例如,核碱基可以为7-脱氮腺嘌呤,并且染料任选地通过连接基在c7位置处连接到7-脱氮腺嘌呤。核碱基可以为7-脱氮鸟嘌呤,并且染料任选地通过连接基在c7位置处连接到7-脱氮鸟嘌呤。核碱基可以为胞嘧啶,并且染料任选地通过连接基在c5位置处连接到胞嘧啶。又如,核碱基可以为胸腺嘧啶
或尿嘧啶,并且染料任选地通过连接基在c5位置处连接到胸腺嘧啶或尿嘧啶。在本文所述的核苷酸或核苷酸缀合物的任何实施方案中,核苷酸或核苷酸缀合物可以含有3'羟基封端基团。
[0127]
3'羟基封端基团
[0128]
用于掺入混合物的标记的核苷酸缀合物还可以具有共价连接到核苷酸的核糖或脱氧核糖的封端基团。该封端基团可以连接在核糖或脱氧核糖上的任何位置处。在特定实施方案中,该封端基团位于核苷酸的核糖或脱氧核糖的3'oh位置处。在wo2004/018497和wo2014/139596中公开了各种3'oh封端基团,这些专利特此以引用方式并入本文。例如,封端基团可以为叠氮甲基(-ch2n3)或取代的叠氮甲基(例如,-ch(chf2)n3或ch(ch2f)n3)、或连接至核糖或脱氧核糖部分的3'氧原子的烯丙基。在一些实施方案中,3'封端基团为叠氮甲基,与核糖或脱氧核糖的3'碳形成3'-och2n3。
[0129]
在一些其他实施方案中,3'封端基团和3'氧原子形成共价连接到核糖或脱氧核糖的3'碳的结构的缩醛基团,其中:
[0130]r1a
和r
1b
各种独立地为h、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、氰基、卤素、任选地取代的苯基或任选地取代的芳烷基;
[0131]r2a
和r
2b
各种独立地为h、c
1-c6烷基、c
1-c6卤代烷基、氰基或卤素;
[0132]
替代地,r
1a
和r
2a
与其所连接的原子一起形成任选地取代的五至八元杂环基基团;
[0133]
rf为h、任选地取代的c
2-c6烯基、任选地取代的c
3-c7环烯基、任选地取代的c
2-c6炔基或任选地取代的(c
1-c6亚烷基)si(r
3a
)3;以及
[0134]
每个r
3a
独立地为h、c
1-c6烷基或任选地取代的c
6-c
10
芳基。
[0135]
附加的3'oh封端基团公开于美国公开2020/0216891a1中,该公开全文以引用方式并入。缩醛封端基团的非限制性示例为(aom)、(aom)、各自共价连接到核糖或脱氧核糖的3'碳。
[0136]
3'-oh封端基团的脱保护
[0137]
在一些实施方案中,可以通过使用水溶性膦试剂去除或脱保护叠氮甲基3'羟基保护基团。非限制性示例包括三(羟甲基)膦(thmp)、三(羟乙基)膦(thep)或三(羟丙基)膦(thp或thpp)。本文所述的3'-缩醛封端基团可以在各种化学条件下去除或裂解。对于含有乙烯基或烯基部分的缩醛封端基团非限制性裂解条件包括在膦配体,例如三(羟甲基)膦(thmp)或三(羟丙基)膦(thp或thpp)的存在下的pd(ii)络合物,诸如pd
(oac)2或烯丙基氯化pd(ii)二聚体。对于含有炔基基团(例如,乙炔基)的那些封端基团,其也可以通过在膦配体(例如,thp或thmp)的存在下的pd(ii)络合物(例如,pd(oac)2或烯丙基氯化pd(ii)二聚体)去除。
[0138]
钯裂解试剂
[0139]
在一些实施方案中,本文所述的3'羟基封端基团可以被钯催化剂裂解。在一些此类实施方案中,pd催化剂是水溶性的。在一些此类实施方案中,为pd(0)络合物(例如,三(3,3',3
″‑
次膦基三(苯磺酸基)钯(0)九钠盐九水合物)。在一些情况下,pd(0)络合物可以通过试剂诸如烯烃、醇、胺、膦或金属氢化物还原pd(ii)络合物而原位产生。合适的钯源包括na2pdcl4、pd(ch3cn)2cl2、(pdcl(c3h5))2、[pd(c3h5)(thp)]cl、[pd(c3h5)(thp)2]cl、pd(oac)2、pd(ph3)4、pd(dba)2、pd(acac)2、pdcl2(cod)和pd(tfa)2。在一个此类实施方案中,pd(0)络合物由na2pdcl4原位产生。在另一个实施方案中,钯源是烯丙基氯化钯(ii)二聚体[(pdcl(c3h5))2]。在一些实施方案中,pd(0)络合物通过将pd(ii)络合物与膦混合而在水溶液中产生。合适的膦包括水溶性膦,诸如三(羟丙基)膦(thp)、三(羟甲基)膦(thmp)、1,3,5-三氮杂-7-磷杂金刚烷(pta)、双(对磺酸基苯基)苯基膦二水合物钾盐、三(羧乙基)膦(tcep)和三苯基膦-3,3',3'-三磺酸三钠盐。
[0140]
在一些实施例中,pd(0)通过将pd(ii)络合物[(pdcl(c3h5))2]与thp原位混合来制备。pd(ii)络合物和thp的摩尔比可以为约1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10。在一些另外的实施方案中,可以添加一种或多种还原剂,诸如抗坏血酸或其盐(例如,抗坏血酸钠)。在一些实施方案中,裂解混合物可以含有另外的缓冲液试剂,诸如伯胺、仲胺、叔胺、碳酸盐、磷酸盐或硼酸盐,或它们的组合。在一些另外的实施方案中,缓冲液试剂包括乙醇胺(ea)、三(羟甲基)氨基甲烷(tris)、甘氨酸、碳酸钠、磷酸钠、硼酸钠、2-二甲基乙醇胺(dmea)、2-二乙基乙醇胺(deea)、n,n,n
′
,n
′‑
四甲基乙二胺(temed)或n,n,n
′
,n
′‑
四乙基乙二胺(teeda)或它们的组合。在一个实施方案中,缓冲剂是deea。在另一个实施方案中,缓冲剂含有一种或多种无机盐,诸如碳酸盐、磷酸盐或硼酸盐,或它们的组合。在一个实施方案中,无机盐为钠盐。
[0141]
连接基
[0142]
荧光标记可以经由可裂解的连接基共价连接到核苷酸。使用术语“可裂解的连接基”并不意在暗示需要除去整个连接基。裂解位点可以位于连接基上确保该连接基的一部分在裂解后保持连接到染料和/或底物部分的某个位置处。以非限制性示例的方式,可裂解的连接基可以是亲电可裂解的连接基、亲核可裂解的连接基、可光裂解的连接基、在还原条件下可裂解的(例如含有二硫化物或叠氮化物的连接基)、在氧化条件下可裂解的、通过使用安全捕获连接基可裂解的,以及通过消除机制可裂解的。使用可裂解的连接基将染料化合物连接到底物部分确保了如果需要的话,可以在检测后移除标记,从而避免下游步骤中的任何干扰信号。
[0143]
可用的连接基基团可以见于pct公开wo 2004/018493(以引用方式并入本文)中,其示例包括可以使用水溶性膦或由过渡金属和至少部分水溶性的配体形成的水溶性过渡金属催化剂裂解的连接基。在水性溶液中,后者形成至少部分水溶性的过渡金属络合物。此类可裂解的连接基可以用于将核苷酸的碱基连接到标记,诸如本文所示的染料。
[0144]
特定的连接基包括pct公开wo 2004/018493(以引用方式并入本文)中所公开的那
些,诸如包括下式的部分的那些:
[0145][0146]
(其中x选自包括o、s、nh和nq的组,其中q为c1-10取代或未取代的烷基基团,y选自包括o、s、nh和n(烯丙基)的组,t为氢或c
1-c
10
取代或未取代的烷基基团,并且*指示所述部分与核苷酸或核苷的其余部分连接的位置)。在一些方面,连接基将核苷酸的碱基连接到标记,诸如,本文所述的染料化合物。
[0147]
连接基的附加示例包括美国公开2016/0040225(以引用方式并入本文)中所公开的那些,诸如包括下式的部分的那些:
[0148][0149][0150]
(其中*指示所述部分与核苷酸或核苷的其余部分连接的位置)。本文所展示的连接基部分可以包括核苷酸/核苷与标记之间的全部或部分连接基结构。本文所展示的连接基部分可以包括核苷酸/核苷与标记之间的全部或部分连接基结构。
[0151]
连接基的附加的示例包括下式的部分:
[0152][0152]
其中b是核碱基;z是
–
n3(叠
氮基)、
–
o-c
1-c6烷基、
–
o-c
2-c6烯基或
–
o-c
2-c6炔基;并且fl包括染料部分,所述染料部分可以含有另外的连接基结构。本领域普通技术人员理解,本文所述的染料化合物通过使染料化合物的官能团(例如,羧基)与连接基的官能团(例如,氨基)反应而共价键合到连接基。在一个实施方案中,可裂解连接基包含(“aol”连接基部分),其中z为
–
o-烯丙基。可裂解的连接基的另外的实施方案公开于美国申请号17/353512中,该申请据此全文以引用方式并入。
[0153]
在特定实施方案中,荧光染料(荧光团)和鸟嘌呤碱基之间的连接基的长度可以改变,例如,通过引入聚乙二醇间隔基团,从而与通过本领域已知的其他键连接到鸟嘌呤碱基的相同荧光团相比增加了荧光强度。示例性连接基及其特性在pct公开wo 2007/020457(以引用方式并入本文)中示出。连接基的设计,尤其是其增加的长度,可以允许当掺入到多核苷酸(诸如dna)中时,改善连接到鸟苷核苷酸的鸟嘌呤碱基的荧光团的亮度。因此,当染料用于需要检测连接到含有鸟嘌呤的核苷酸的荧光染料标记的任何分析方法中时,有利的是连接基包含式
–
((ch2)2o)n–
的间隔基团,其中n为介于2和50之间的整数,如wo 2007/020457中所述。
[0154]
染料可以例如通过连接基附接到核苷酸碱基上的任何位置。在特定实施方案中,仍然可以对所得的类似物进行watson-crick碱基配对。特定的核碱基标记位点包括嘧啶碱基的c5位置或7-脱氮嘌呤碱基的c7位置。如上所述,连接基基团可以用于将染料共价连接到核苷或核苷酸。
[0155]
用本文所述的染料标记的核苷酸可以具有下式:
[0156][0157]
其中染料为本文所述的染料化合物(标记)部分(在染料的官能团与连接基“l”的官能团之间共价键合后);b为核碱基,诸如尿嘧啶、胸腺嘧啶、胞嘧啶、腺嘌呤、7-脱氮腺嘌呤、鸟嘌呤、7-脱氮鸟嘌呤等;l为可以存在或可以不存在的任选的连接基;r'可以为h,或-or'为单磷酸根、二磷酸根、三磷酸根、硫代磷酸根、磷酸酯类似物、连接至反应性含磷基团的
–o–
,或者被封端基团保护的
–o–
;并且r
″
为h或oh;并且r
″′
为h,本文所述的3'oh封端基团或-or
″′
形成亚磷酰胺。其中-or
″′
为亚磷酰胺,r'为酸可裂解的羟基保护基团,其允许随后在自动化合成条件下进行单体偶联。在一些另外的实施方案中,b包括
或它们的任选地取代的衍生物和类似物。在一些另外的实施方案中,标记的核碱基包括结构
[0158]
在一个特定实施方案中,封端基团是与染料化合物分开的并且独立于染料化合物,即,不与后者连接。另选地,染料可以包含3'oh封端基团的全部或部分。因此,r
″′
可以为可以构成或可以不构成染料化合物的3'oh封端基团。
[0159]
在又一个另选的实施方案中,戊糖的3'碳上不存在封端基团,并且连接到碱基的染料(或染料和连接基构建体)例如可以具有足以充当掺入另外的核苷酸的障碍的尺寸或结构。因此,该障碍可以归因于空间位阻或可以归因于尺寸、电荷和结构的组合,无论染料是否连接到糖的3'位置。
[0160]
在还有一个另选的实施方案中,该封端基团存在于戊糖的2'或4'碳上,并且可以具有足以充当掺入另外的核苷酸的障碍的尺寸或结构。
[0161]
使用封端基团允许对聚合进行控制,诸如当掺入标记的核苷酸时通过停止延伸来控制。如果封闭效应是可逆的,例如,以非限制性示例的方式,则通过改变化学条件或通过除去化学障碍,可以在某些点处停止延伸,然后允许其继续。
[0162]
在一个特定实施方案中,连接基(在染料和核苷酸之间)和封端基团均存在并且为单独的部分。在特定实施方案中,连接基和封端基团在相同或基本上类似的条件下都是可裂解的。因此,脱保护和脱封闭过程可能更有效,因为只需要单一处理就可以除去染料化合物和封闭基团这两者。然而,在一些实施方案中,连接基和封端基团不需要在类似条件下可裂解,而是在不同条件下可单独裂解。
[0163]
本公开还涵盖掺入了染料化合物的多核苷酸。此类多核苷酸可以为分别由以磷酸二酯键接合的脱氧核糖核苷酸或核糖核苷酸组成的dna或rna。多核苷酸可以包含与如本文示出的至少一种经修饰的核苷酸(例如,用染料化合物标记)组合的天然存在的核苷酸、除本文所述的标记的核苷酸之外的非天然存在的(或经修饰的)核苷酸或它们的任何组合。根据本公开的多核苷酸还可以包括非天然的骨架键和/或非核苷酸化学修饰。还设想了由包含至少一种标记的核苷酸的核糖核苷酸和脱氧核糖核苷酸的混合物组成的嵌合结构。
[0164]
如本文所述的非限制性示例性标记的核苷酸缀合物包括:
[0165][0166]
其中:l表示连接基,并且r表示如上所述的核糖或脱氧核糖部分,或具有被单磷酸根、二磷酸根或三磷酸根取代的5'位置的核糖或脱氧核糖部分。
[0167]
在一些实施方案中,包含可裂解的连接基和荧光部分的非限制性示例性完全官能化的核苷酸缀合物如下所示:
[0168]
[0169]
[0170][0171]
其中pg代表本文所述的3'oh封端基团;p为整数1、2、3、4、5、6、7、8、9或10;并且k为0、1、2、3、4或5。在一个实施方案中,
–o–
pg是aom。在另一个实施方案中,
–o–
pg为
–o–
叠氮甲基。在一个实施方案中,n为5。在一些另外的实施方案中,p为1、2或3;并且k为5。是指作为连接基部分的氨基与染料的羧基基团之间的反应的结果的染料与可裂解连接基的连接点。在本文所述的标记的核苷酸的任何实施方案中,核苷酸为核苷酸三磷酸。
[0172]
实施例
[0173]
在以下实施例中更详细地公开了附加的实施方案,这些实施例并非旨在以任何方式限制权利要求书的范围。
[0174]
实施例1:在illuminaiseq
tm
100仪器上的测序实验
[0175]
在该实施例中,本文所述的双通道激发和单通道检测测序方法在illumina iseq
tm
100仪器上使用,该仪器已被设置为用绿色激发光(约520nm)获得第一图像以及用蓝色激发光(约450nm)获得第二图像。修改测序配方以便执行标准sbs循环(掺入,之后进行成像,之后进行裂解),达到1
×
300个循环。掺入混合物包含以下四种ffn:用色烯喹啉(chromenoquinoline)染料a(能够用在520nm处的绿光和在450nm处的蓝光激发)标记的ffa;用香豆素染料b(能够用在450nm处的蓝光激发)标记的ffc;用聚甲炔染料c(能够用绿光激发)标记的fft以及在50mm乙醇胺缓冲液,ph 9.6、50mm nacl、1mm edta、0.2% chaps、4mm mgso4和dna聚合酶中的未标记的ffg(暗的dgtp)。ffc、ffa、fft和ffg的结构如下所示:
iseq
tm
100仪器上使用,该仪器已被设置为用绿色激发光(约520nm)获得第一图像以及用蓝色激发光(约450nm)获得第二图像。使用标准测序配方来执行sbs循环(掺入,之后进行成像,之后进行裂解),达到2
×
300个循环。掺入混合物包含以下四种ffn:用色烯喹啉(chromenoquinoline)染料a(能够用在520nm处的绿光和在450nm处的蓝光激发)标记的ffa;用香豆素染料b(能够用在450nm处的蓝光激发)标记的ffc;用聚甲炔染料c(能够用绿光激发)标记的fft以及在50mm甘氨酸缓冲液ph 9.8、50mm nacl、1mm edta、0.2% chaps、4mm mgso4和dna聚合酶中的未标记的ffg(暗的dgtp)。这些实验中使用的裂解溶液含有100mm二乙基乙醇胺缓冲液ph 9.5、100mm三(羟丙基)膦、10mm[烯丙基氯化钯(allylpdcl)]2、10mm抗坏血酸钠、1m nacl、0.1%吐温20。ffc、ffa、fft和ffg的结构如下所示:
[0183][0184]
表2示出了使用该实施例中描述的ffn组在illumina iseq
tm
100仪器上运行2
×
150个循环和运行2
×
300个循环的循环时间、定相、预定相、phix错误率和%q30量度。据观察,使用这组ffn有可能将2
×
150运行的循环时间缩减到60秒,与标准iseq
tm
盒和配方(大约141秒)相比大约缩减2倍,同时保持良好的测序量度。另外,与标准iseq
tm
100配方(1-ex化学)相比,具有这组ffn的测序配方使用的洗涤缓冲液和扫描缓冲液的体积减半。这些特征允许使用与搭配标准iseq
tm
盒的标准iseq
tm
100配方中使用的循环时间相当的循环时间,以低错误
率和高%q30值来实现2
×
300个循环的延伸读段长度。在iseq
tm
100上使用这组ffn运行完整的2
×
300个循环的总时间约为28小时,与使用标准试剂和配方在illumina 上运行2
×
300个循环的总时间(大约56小时)相比缩减2倍。
[0185]
表2:iseq
tm
100测序量度(2
×
150个循环和2
×
300个循环)
[0186][0187]
表3示出了使用在该实施例中描述的ffn组在illumina iseq
tm
100仪器上运行2
×
150个循环的循环时间、定相、预定相、phix错误率和%q30度量,其中流通池像素大小已经从1.75μm减小到1μm。流通池像素大小的变化使得能够以较小的节距和较短的光管获得更好的信号,但也具有低信号、高背景噪音和高串扰的潜在问题。据观察,测序量度在1μm流通池上具有总体非常好的质量,并且与从1.75μm流通池获得的测序量度相当。
[0188]
表3:在1μm流通池上的iseq
tm
100测序量度(2
×
150个循环)
[0189]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1