管式填装床细胞培养容器、系统和相关方法与流程
管式填装床细胞培养容器、系统和相关方法
1.本技术根据35u.s.c.
§
119,要求2020年6月30日提交的美国临时申请系列第63/046,080号的优先权权益,本文以其内容作为基础并将其全文通过引用结合于此。
技术领域
2.本公开内容大体上涉及用于培养细胞的容器和系统以及细胞培养方法。具体来说,本公开内容涉及细胞培养容器和结合于其中的基材,以及采用此类容器和基材的细胞培养方法。
背景技术:
3.在生物加工行业,出于生产激素、酶、抗体、疫苗和细胞疗法的目的进行大规模细胞培养。细胞和基因治疗市场正在快速增长,有希望的治疗进入临床试验并迅速走向商业化。然而,一次细胞治疗剂量可能需要数十亿个细胞或数万亿个病毒。由此,能够在短时间内提供大量细胞生产对于临床成功是至关重要的。
4.生物加工中使用的大部分细胞都依赖于锚点,这意味着细胞需要表面来粘附从而进行生长和发挥功能。传统上,粘附细胞的培养是在二维(2d)细胞粘附表面上进行的,所述细胞粘附表面整合在多种容器形式中的一种,例如:t型瓶、培养皿、细胞工厂、细胞堆叠容器、辊瓶以及康宁容器。这些方案会具有明显缺陷,包括难以实现高到足以使得可用于治疗或细胞的大规模生产的细胞密度。
5.已经建议有替代方法来增加培养细胞的体积密度。这些包括搅拌罐中进行的微载体培养。在这种方案中,附着到微载体的壁的细胞经受恒定剪切应力,导致对增殖和培养性能的明显影响。高密度细胞培养系统的另一个例子是空心纤维生物反应器,其中,当他们在纤维空间之间的空间中增殖时,细胞可以形成大的三维聚集体。然而,由于缺乏营养物,细胞生长和性能受到明显抑制。为了缓解这个问题,将这些生物反应器制造成小的并且不适合大规模生产。
6.用于锚定依赖细胞的高密度培养系统的另一个例子是填装床生物反应器系统。在这种类型的生物反应器中,使用细胞基材来提供粘附细胞的附着表面。介质沿表面或通过半多孔基材灌注,以提供细胞生长所需的营养物和氧气。例如,先前的美国专利第4,833,083号、第5,501,971号以及第5,510,262号已经公开了含有支撑或基材系统的填装床来俘获细胞的填装床生物反应器系统。填装床基质通常是采用多孔颗粒作为基材或者聚合物的非织造微纤维来制造得到的。此类生物反应器起到了再循环流通式生物反应器的功能。明显问题之一在于,此类生物反应器在填装床内的细胞分布不是均匀的。基本上来说,这些填装床起到了深度过滤器的功能,细胞主要俘获在入口区域处,导致接种步骤期间的细胞分布的梯度。此外,由于无规纤维填装,填装床的横截面的流动阻力以及细胞俘获效率不是均匀的。例如,介质快速流动通过具有低的细胞填装密度的区域,而缓慢流动通过由于较高数量的俘获细胞导致较高阻力的区域。这产生了通道效应,其中,营养物和氧气被更有效地传递到具有较低体积细胞密度的区域,而具有较高细胞密度的区域则维持在非最优培养条件
下。
7.现有的填装床系统的另一个明显缺陷在于,无法在培养过程结束时高效地收获完整的活细胞。如果最终产品是细胞或者如果生物反应器被用作“接种序列”的一部分(其中,细胞群体在一个容器中生长,然后转移到另一个容器以使得群体进一步生长)的话,那么细胞的收获是至关重要的。美国专利第9,273,278号公开了改善细胞收获步骤期间从填装床回收细胞的效率得到改善的生物反应器设计。其基于疏松填装床基材以及填装床颗粒的振动或搅拌来实现多孔基质碰撞并由此分离细胞。然而,这种方案是费力的,并且可能导致明显细胞破坏,从而降低了整体细胞存活率。
8.目前市场上的填装床生物反应器的例子是pall有限公司生产的icellis使用由以非织造布置的无规取向纤维构成的细胞基材材料的小条。将这些条填装到容器中以产生填装床。然而,如同市场上类似的解决方案那样,这种类型的填装床基材存在缺陷。具体来说,基材条的非均匀填装产生了填装床内视觉可见的通道,导致优先和非均匀的介质流动以及填装床的营养物分布。对的研究已经注意到“细胞的系统性非均质分布,它们的数量从固定床的顶部到底部发生增加”以及“营养物梯度
……
导致限制了细胞生长和生产”,这全都导致“可能影响转染效率的细胞的不均分布”。(rational plasmid design and bioprocess optimization to enhance recombinant adeno-associated virus(aav)productivity in mammalian cells(合理的质粒设计和生物过程优化,以提高哺乳动物细胞中重组腺相关病毒(aav)的生产力),生物技术期刊,2016年11月,290-297页)。研究注意到填装床的振动可以改善分布,但是会具有其他缺陷(即,“在接种和转染过程中为了更好地分散而进行的必要搅拌会诱发剪切应力的增加,这进而导致细胞活力降低”,同上)。的另一项研究注意到:细胞的不均匀分布使得使用生物量传感器监测细胞群体是困难的(
“……
如果细胞分布不均匀,则顶部载体上细胞的生物量信号可能无法显示整个生物反应器的全貌”。process development of adenoviral vector production in fixed bed bioreactor:from bench to commercial scale(固定床生物反应器中腺病毒载体生产的工艺开发:从实验室到商业规模),人类基因治疗,第26卷,第8期,2015年)。
9.此外,由于纤维在基材条中的无规排布以及的一个填装床与另一个之间的条填装中的变化,消费者可能难以预测细胞培养性能,因为培养之间的基材是不同的。此外,的填装基材非常难以或不可能高效地收获细胞,因为相信细胞被填装床所俘获。
10.辊瓶具有数项优势,例如:易于搬运以及能够对附着表面上的细胞进行监测。然而,从生产角度而言,主要缺点在于,虽然辊瓶构造占据了大面积的制造底板空间,但是表面积-体积比是低的。使用各种方案来增加辊瓶形式中可用于粘附细胞的表面积。商业产品中已经采纳了一些解决方案,但是仍然存在甚至进一步增加辊瓶生产力的改善空间。传统上来说,通过吹塑工艺生产作为个体结构的辊瓶。此类制造简单性使得辊瓶在生物加工工业中具有经济可行性。一些辊瓶可以实现经过改进以增加可用于细胞培养的表面积而没有改变制造工艺;然而,仅获得了改进辊瓶表面积的边际增加。辊瓶设计的其他改进明显增加了制造工艺复杂度,使得其在生物加工行业中不具有经济可行性。因此,希望提供具有增加的表面积和生物加工生产力的辊瓶,同时对其制造使用相同的吹塑工艺。
11.利用现有技术将小型生物反应器规模化到更大规格(例如,中试生产线开发或生产水平)也被证明是困难或低效的。因此,会希望提供能够以各种规格以可预测且一致结果实现细胞培养的系统或平台。
12.虽然利用现有平台可以制造用于早期临床试验的病毒载体,但是需要能够以更大数量生产高质量产品的平台,以达到后期商业制造规模。
13.存在对于能够以高密度形式、均匀细胞分布和便于获得且增加收获产率的方式对细胞进行培养的细胞培养基质、系统和方法。
技术实现要素:
14.根据本公开内容的实施方式,提供了细胞培养系统。系统包括生物反应器容器,其具有限定了细胞培养空间的内空穴,与细胞培养空间的第一端部流体连接的入口,以及与细胞培养空间的第二端部流体连接的出口。系统还包括布置在细胞培养空间中的至少一个细胞生长元件。细胞生长元件包括围绕支撑元件的细胞培养基材,以从细胞培养空间的第一端部到第二端部的方向延伸。
15.根据上述实施方式的各种方面,细胞培养系统包括细胞培养基材材料的片材,其缠绕(wrap)或卷绕(wind)支撑元件。细胞培养基材可以包括织造基材材料,其具有多根交织纤维,表面构造成使得细胞与其粘附。系统还可以包括多个细胞生长元件,其布置在细胞培养空间中并且以从细胞培养空间的第一端部到第二端部的方向对齐。所述多个细胞生长元件可以可去除的方式附连到细胞培养空间,从而细胞培养系统在细胞培养过程中可以容纳各种数量的细胞生长元件。
16.根据实施方式的一些方面,中心支撑体是管状的,具有围绕空心芯体的外周壁。外周壁包括多个穿孔,其将中心支撑体的内部流体连接到中心支撑体的外部。中心支撑体的空心芯体流体连通到入口,以及细胞培养系统包括流体流动路径,其包括从入口开始流动,然后通过空心芯体,然后经由所述多个穿孔从中心支撑体径向向外流动,然后穿过细胞培养基材,以及然后流出出口。
17.系统还可以包括入口增压室(inlet plenum),其流体连接到且布置在入口与细胞培养空间之间。在一些实施方式中,系统还包括布置在入口增压室与细胞培养空间之间的打孔入口板。打孔入口板包括多个穿孔,其将入口增压室直接流体连接到中心支撑体的第一端部处的空心芯体。系统还可以包括出口增压室(outlet plenum),其流体连接到且布置在细胞培养空间与出口之间。打孔出口板可以布置在细胞培养空间与出口增压室之间,其中,打孔出口板包括多个穿孔,其将具有中心支撑体的外部的细胞培养空间的一部分流体连接到出口增压室。作为实施方式的方面,中心支撑体附连到中心支撑体的第二端部。空心芯体在中心支撑体的第二端部不是开放的,从而空心芯体没有经由中心支撑体的第二端部直接流体连接到出口增压室。
18.作为上述实施方式的另一个方面,系统还包括布置在入口增压室中的入口歧管。入口歧管流体连接到入口并且构造成使得流体在整个入口增压室是均匀分布的或者均匀分布到打孔入口板。可以在出口增压室中布置出口歧管。出口增压室流体连接到出口并且构造成引导流体离开细胞培养空间达到出口。
19.所述至少一个细胞培养元件可以具有圆柱形形状。在实施方式中,所述至少一个
细胞培养元件具有用于将细胞培养基材附连到中心支撑体的附连装置。在各种实施方式中,细胞培养空间具有如下体积:至少约50ml,至少约100ml,至少约200ml,至少约300ml,至少约500ml,至少约1l,至少约2l,至少约3l,至少约10l,至少约20l,至少约30l,至少约40l,至少约50l,约50ml至约500ml,约1l至约10l,或者约10l至约50l。细胞培养系统可以包括约7个细胞培养元件至约130个细胞培养元件。在一些实施方式中,细胞培养基材包括细胞培养基材的堆叠或卷,在细胞培养基材的相邻层之间没有任何其他固体材料。
20.根据本公开内容的另一个实施方式,提供了细胞培养容器。容器包括生物反应器容器,其具有限定了细胞培养空间的内空穴,与细胞培养空间的第一端部流体连接的入口,以及与细胞培养空间的第二端部流体连接的出口。容器还包括:入口增压室,其流体连接到且布置在入口与细胞培养空间之间;出口增压室,其流体连接到且布置在细胞培养空间与出口之间;以及布置在入口增压室与细胞培养空间之间的打孔入口板,所述打孔入口板具有至少一个穿孔。细胞培养空间布置成在其中容纳至少一个细胞生长元件,所述至少一个细胞生长元件具有围绕打孔中心管的多孔细胞培养基材,以及打孔入口板的所述至少一个穿孔将入口增压室直接流体连接到打孔中心管的空心中心(当所述至少一个细胞培养元件布置在细胞培养空间中的时候)。
21.根据一些实施方式的方面,容器还包括布置在细胞培养空间与出口增压室之间的打孔出口板,所述打孔出口板具有至少一个穿孔。打孔出口板的所述至少一个穿孔流体连接了包含打孔中心管的外部的细胞培养空间的一部分(当所述至少一个细胞生长元件布置在细胞培养空间中的时候)。打孔出口板可以包括用于附连所述至少一个细胞培养元件的至少一个附连位点。容器还可以包括布置在入口增压室中的入口歧管,所述入口歧管流体连接到入口并且构造成使得流体在整个入口增压室是均匀分布的或者均匀分布到打孔入口板。根据一些实施方式,容器还包括布置在出口增压室中的出口歧管,所述出口歧管流体连接到出口并且构造成引导流体离开细胞培养空间到达出口。细胞培养容器构造成在装纳任意各种数量的细胞培养元件的时候运行细胞培养。细胞培养空间可以具有如下体积:至少约50ml,至少约100ml,至少约200ml,至少约300ml,至少约500ml,至少约1l,至少约2l,至少约3l,至少约10l,至少约20l,至少约30l,至少约40l,至少约50l,约50ml至约500ml,约1l至约10l,或者约10l至约50l。在一些实施方式中,细胞培养空间布置成装纳约7个细胞培养元件至约130个细胞培养元件。
附图说明
22.图1是根据本公开内容一个或多个实施方式的细胞培养系统的等距视图,其具有多个细胞培养元件的细胞培养容器。
23.图2是根据本公开内容一个或多个实施方式的图1的细胞培养系统的横截面图。
24.图3是根据本公开内容一个或多个实施方式的细胞培养元件的中心支撑元件。
25.图4是根据本公开内容一个或多个实施方式的包含中心支撑体和细胞培养基材材料的细胞培养元件的部分透视等距视图。
26.图5是根据本公开内容一个或多个实施方式的生物反应器系统的入口增压室和歧管的细节图。
27.图6是根据本公开内容一个或多个实施方式的生物反应器系统的出口增压室和歧
管的细节图。
28.图7是根据本公开内容一个或多个实施方式的进入和穿过细胞培养空间的流动路径的细节图。
29.图8是根据本公开内容一个或多个实施方式的穿过和离开细胞培养空间的流动路径的细节图。
30.图9是根据本公开内容一个或多个实施方式的从入口增压室进入细胞培养元件的流动矢量的模拟。
31.图10是根据本公开内容一个或多个实施方式的进入和穿过细胞培养空间的流动路径的另一个细节图。
32.图11是根据一些实施方式的穿过和离开细胞培养空间的流动路径的另一个细节图。
33.图12是根据实施方式的打孔出口板的平面图。
34.图13是根据本公开内容另一个实施方式的细胞培养系统的等距视图。
35.图14的横截面图显示根据本公开内容一个或多个实施方式的穿过系统的流动路径。
36.图15显示根据本公开内容一个或多个实施方式的堆叠布置的多个容器。
37.图16显示不同尺寸的生物反应器容器,作为根据本公开内容一个或多个实施方式的可规模化的例子。
38.图17是图16的最小容器的视图。
39.图18是根据一个或多个实施方式的图16的容器的视图,去除了外覆盖以显示被细胞培养空间所装纳的细胞培养元件。
40.图19是图19的容器的横截面图。
41.图20显示图17-19的容器的建模流动特性,体积为200ml。
42.图21显示图17-19的靠近容器的入口处的建模流动特性。
43.图22显示例如根据一个或多个实施方式的细胞培养基材材料的卷的等距视图。
44.图23显示根据一个或多个实施方式的卷型圆柱形构造的细胞培养基材。
45.图24显示根据本公开内容一个或多个实施方式的三维织造细胞培养基材的立体图。
46.图25是图24的基材的平面图。
47.图26是图25中的基材沿线a-a的横截面。
48.图27a显示根据一些实施方式的第一尺寸的细胞培养基材的例子。
49.图27b显示根据一些实施方式的第二尺寸的细胞培养基材的例子。
50.图27c显示根据一些实施方式的第三尺寸的细胞培养基材的例子。
51.图28a显示根据一个或多个实施方式的多层细胞培养基材的立体图。
52.图28b显示根据一个或多个实施方式的多层细胞培养基材的平面图。
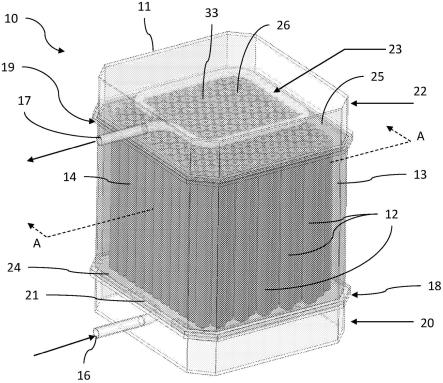
53.图29显示根据一个或多个实施方式的图28b的多层细胞培养基材沿线b-b的横截面图。
54.图30是根据一个或多个实施方式的细胞培养系统的示意性代表。
55.图31是根据一个或多个实施方式的细胞培养系统的示意性细节。
56.图32显示根据一个或多个实施方式的在细胞培养系统上进行细胞培养的工艺流程图。
57.图33显示根据一个或多个实施方式控制细胞培养系统的灌注流速的操作。
58.图34是根据本公开内容一个或多个实施方式的接种序列过程的示意图。
具体实施方式
59.下面参考附图(如果有的话)对本公开内容的各个实施方式进行详细描述。参考各个实施方式不限制本发明的范围,本发明的范围仅受所附权利要求书的范围限制。此外,在本说明书中列出的任何实例都不是限制性的,并且仅列出了要求保护的本发明的诸多可能的实施方式中的一些实施方式。
60.本公开内容的实施方式涉及细胞培养系统(包含生物反应器容器和细胞培养基材)以及使用此类基材和生物反应器系统的细胞培养方法。
61.在常规大规模细胞培养生物反应器中,使用了不同类型的填装床生物反应器。通常来说,这些填装床含有多孔基质来保留粘附或悬浮的细胞以及来支撑生长和增殖。填装床基质提供了高的表面积-体积比,所以细胞密度会高于其他系统。然而,填装床常常起到深度过滤器的作用,其中,细胞被物理俘获或卷入基材的纤维中。因而,由于细胞接种物的线性流动穿过填装床,细胞在填装床内经受非均质分布,导致穿过填装床的深度或宽度上的细胞密度的变化。例如,细胞密度可能在生物反应器的入口区域较高,而在更靠近生物反应器的出口处明显更低。这种填装床内的细胞的非均匀分布明显阻碍了生物加工制造中的此类生物反应器的规模化和可预测性,并且甚至会导致每单位表面积或体积的填装床的细胞或病毒载体生产的生长效率下降。
62.现有技术公开的填装床生物反应器遭遇的另一个问题是通道效应。由于填装的非织造纤维的无规特性,填装床的任意给定横截面处的局部纤维密度是不均匀的。介质在具有低纤维密度(高床可渗透性)区域中快速流动,而在高纤维密度(较低床可渗透性)区域中流动要慢得多。作为结果,填装床上的非均匀介质灌注产生通道效应,其自身表现为明显的营养物和代谢产物梯度,这对整体细胞培养和生物反应器性能产生负面影响。位于低介质灌注区域中的细胞会挨饿,并且非常普遍地由于缺乏营养物或代谢产物中毒而死亡。细胞挨饿是当使用填装了非织造纤维状歧管的生物反应器时遭遇的另一个问题。由于填装床起到深度过滤器的功能,在细胞培养过程结束时释放的细胞被俘获在填装床内,并且细胞回收是非常低的。这明显限制了此类生物反应器在活细胞是产物的生物加工中的应用。因此,非均匀性导致具有不同的流体和剪切暴露的区域,有效地降低了可用的细胞培养面积,导致非均匀培养,并且干扰了转染效率和细胞释放。
63.为了解决现有细胞培养方案的这些和其他问题,本公开内容的实施方式提供了细胞生长基材、此类基材的基质和/或使用此类基材的填装床细胞培养容器和系统,它们实现了对于锚点依赖性细胞和细胞产品(例如,蛋白质、抗体、病毒颗粒)的高效和高产率细胞培养。本文所述的细胞培养系统使用离散型细胞培养元件,具有细胞生长基材和流动路径、通道或管,来帮助细胞培养介质在整个细胞培养基材体积中的分布。细胞培养元件的离散特性提供了可量化且均匀单位的细胞培养基材,其可以单独使用或者多个使用来实现所需的细胞培养或细胞培养产物的产率,实现了可规模化和可预测的系统。本文公开的细胞培养
系统设计实现单个细胞培养元件的充分且均匀的接种、培养和/或收获。
64.细胞培养基材的实施方式包括由多孔基材材料的有序且规则阵列制造的多孔细胞培养基材,其实现了均匀的细胞接种以及介质/营养物灌注,以及高效的细胞收获。实施方式还实现了具有基材和生物反应器的可规模化细胞培养解决方案,能够对细胞进行接种和生长和/或细胞产品的收获,从工艺开发规格到完全生产尺寸规格,而没有牺牲细胞培养系统的均匀性能。例如,在一些实施方式中,生物反应器可以容易地从工艺开发规格规模化至生产规格,在生产规格上具有相当的每单位基材表面积的病毒基因组(vg/cm2)。本文实施方式的可收获性和可规模化使得它们能够用于高效接种序列用于在与相同细胞基材上的多倍规模进行细胞种群生长。此外,本文实施方式提供了具有高表面积的细胞培养基材,其结合本文所述的其他特征实现了高产率的细胞培养解决方案。例如,在一些实施方式中,本文所讨论的细胞培养基材和/或生物反应器可以产生每批次10
16
至10
18
个病毒基因组(vg)。
65.在一个实施方式中,提供的基材具有结构限定的表面区域用于粘附细胞来进行附着和增殖,其具有良好的机械强度并且当装配到填装床或其他生物反应器中的时候形成高度均匀多样性的互连流体网络。在具体实施方式中,机械稳定的不可降解的织造网可以用作基材来支撑粘附的细胞生产。本文公开的细胞培养基材支撑了具有高体积密度形式的锚定依赖性细胞的附着和增殖。此类基材能够实现均匀细胞接种,以及细胞或生物反应器的其他产物的高效收获。此外,本公开内容的实施方式支撑细胞培养来提供接种步骤期间的均匀细胞分布并实现所公开的基材上的粘附细胞的汇合单层或多层,并且可以避免形成具有有限营养物扩散和代谢产物浓度增加的大型和/或不可控3d细胞聚集体。因此,基材消除了生物反应器运行期间的扩散限制。此外,基材能够从生物反应器进行简单且高效的细胞收获。一个或多个实施方式的结构限定的基材实现了从生物反应器的填装床的完全细胞回收和一致细胞收获。根据本公开内容的一个或多个实施方式的细胞培养基材在相关的美国专利申请第16/781,685号中具有更完整描述,其全文通过引用结合入本文。
66.根据一些实施方式,还提供了使用具有细胞培养基材的生物反应器来进行细胞培养的方法,用于治疗蛋白、抗体、病毒疫苗或病毒载体的生物加工生产。
67.如图1所示,根据本公开内容一个或多个实施方式的细胞培养系统10包含生物反应器容器11和至少一个细胞生长元件12。生物反应器容器11具有内空穴,其限定了用于装纳所述至少一个细胞生长元件12的细胞培养空间13。细胞培养空间13可以在细胞培养过程中容纳多个细胞培养元件12。因此,细胞培养空间13尺寸调节至容纳对于所需应用而言合适数量的细胞培养元件12。然而,一个或多个实施方式的方面实现了向生物反应器容器11增加或去除细胞培养元件12的数量。这种细胞培养元件12的数量灵活性实现了给定生物反应器容器11的产率的规模化。此外,在细胞培养过程中,一个或多个细胞培养元件12可以作为整体或者部分去除,从而实现取样。对于希望了解它们的培养进展情况的用户而言,取样是重要特性。细胞培养元件12自身包含围绕支撑元件15的细胞培养基材14,如下文更详细描述。每个细胞培养元件12布置成从细胞培养空间13的第一端部18延伸到细胞培养空间13的第二端部19,并且基本平行于介质通过细胞培养空间13的整体流动方向f。
68.细胞培养空间13流体连接到入口1164和出口17。入口16构造成向细胞培养空间提供细胞、细胞培养介质和细胞营养物中的至少一种,以及细胞、细胞培养介质和细胞营养物
中的至少一种可以经由出口17离开细胞培养系统10。此外,取决于系统设计,细胞副产物或者收获的细胞可以通过入口16或出口17收回。如图1所示,根据一些实施方式,生物反应器容器11可以包括布置在入口16与细胞培养空间13之间的入口增压室20。入口增压室20可以帮助在介质进入细胞培养空间13之前使得介质在生物反应器容器11的宽度上的均匀分布。通过这种方式,可以使得介质均匀分布到每个细胞培养元件12。为了帮助介质和/或细胞的均匀分布,可以在入口增压室20中提供入口歧管21。入口歧管21流体连接到入口16,并且包括多个间隔开的开口或连接件用于将流体从入口16分布到入口增压室20或细胞培养空间13的一个或多个区域。类似地,生物反应器容器11还可以包括布置在细胞培养空间13与出口17之间的出口增压室22。出口增压室22任选地包含用于将流体、细胞或副产物引导到出口17的出口歧管23。
69.如下文更详细讨论的那样,生物反应器容器11还可以包括打孔入口板24和打孔出口板25中的至少一个,它们分别将细胞培养空间13与入口增压室20和出口增压室22分隔开。打孔入口板和出口板24、25中的穿孔可以分别构造成使得流体流动进入和离开细胞培养空间13并且还用于细胞培养元件12的附连或对齐。例如,在图1中,可以看到每个细胞培养元件12的顶凸缘16位于打孔出口板25的顶部上。
70.图2显示沿线a-a的图1的生物反应器容器11的横截面图。上文所描述的生物反应器容器11的部分可以清楚地在图2的横截面中看到。此外,横截面揭示了细胞培养元件12中的一些的横截面图,揭示了细胞培养基材14内的支撑元件15。每个支撑元件15在支撑元件15的外壁28中具有多个穿孔27。这些穿孔27允许介质从支撑元件15的空心内部空间29流到支撑元件15的外部空间30。如所示,支撑元件26延伸穿过打孔出口板25到达支撑元件26的顶凸缘26位于打孔出口板25的顶部上的地方。任选地,支撑元件26还可以延伸进入或者穿过打孔入口板24中的穿孔,从而保持细胞培养元件的适当对齐以及允许介质从入口增压室20流到细胞培养元件12的内部空间29。
71.图3和图4更详细显示细胞培养元件12的组件。具体来说,图3显示支撑元件15,包括穿孔27和顶凸缘26。在图4中,显示细胞培养基材14围绕支撑元件15。任选地,可以使用带材31或者其他附连机制将细胞培养基材14紧密或牢固地保持到支撑元件15。在顶凸缘26的顶部上,可以提供对齐杆33,其可以插入到打孔出口板25中以固定细胞培养元件12。
72.图5是从入口歧管21和/或入口增压室20到细胞培养元件12的流体流动的细节图。具体来说,支撑元件15插入到打孔入口板24中从而使得内部空间29与入口增压室20(并进而与入口16)流体连接。打孔入口板24中的每个穿孔流体连接到细胞培养元件的内部空间29,从而高效地引导流体流动(显示为箭头)进入到细胞培养元件12的内部。一旦在内部空间29中以及在细胞培养空间13内,流体则可以流动通过支撑元件的穿孔27并通过细胞培养基材14铺展。在流动穿过细胞培养基材14之后,流体进入细胞培养元件12之间的填隙空间32。如图6所示,打孔出口板25中的穿孔朝向这个填隙空间32是开放的,从而允许介质离开细胞培养空间13并流动到出口增压室22或出口17。虽然打孔出口板25的一些穿孔朝向填隙空间32是开放的,但是其他穿孔用于固定支撑元件15的对齐杆33。根据实施方式,顶凸缘25密封了内部空间的顶部从而介质没有从支撑元件的顶端流出,而是被引导径向向外穿过支撑元件15的外壁28中的穿孔27。
73.图7和8显示当流体从支撑元件15径向向外流动并穿过细胞培养基材14时的流体
流动(如箭头所示)的替代视图。在图9中,这个流动图案是模拟的,并且显示流动穿过含细胞培养基材14的区域的流体是非常均匀的,直到其离开细胞培养基材14并朝向出口17向上流动。图10和图11显示穿过细胞培养基材14的流体流动的另一视图,其中,作为水平流动通过细胞培养基材的替代,其是向上呈角度的。可以通过穿孔27的设计来实现这种流体引导。
74.如上文所讨论的那样,打孔出口板25包括多个穿孔,其中的一些插入了对齐杆13,以及其中的一些起到流体从填隙空间32流动到出口增压室22的路径的作用。图12显示了穿孔布置的例子。
75.图13显示上文所讨论的细胞培养系统10的改进实施方式。具体来说,类似于细胞培养系统10,细胞培养系统40包含生物反应器容器41和至少一个细胞生长元件12。图13中的不同之处在于,生物反应器容器41具有布置在靠近生物反应器容器41的底部的出口47,从而位置使得离开细胞培养空间顶部并在细胞培养空间的侧面上流动进入到溢出空间52中的排出介质至少部分围绕了细胞培养空间,在那里,介质将溢出空间52填充至填充水平53。图14显示细胞培养系统40的横截面图。图14还显示了流体连接到入口16和出口47的泵42。因此,泵42可以使得流体在循环通过细胞培养空间。虽然上图中未示出,但是预期此类泵可以用于本公开内容的多个实施方式,包括上文所述的那些。
76.如上文所讨论的那样,细胞培养元件的模块化设计允许细胞培养系统的规模化以满足各种要求。根据一些实施方式,细胞培养系统的另一个优点在于,可以堆叠多个生物反应器容器11从而在较小占地面积中提供甚至更大的细胞培养产率,如图15所示。在图15的堆叠中,每个入口可以被分开的泵驱动,或者它们可以一起管理。类似地,出口可以一起管理,或者它们可以分别流动到分开的介质调节容器以实现每个容器水平上的介质调节。
77.容器的尺寸以及对应的细胞培养元件的数量也是可规模化的,如图16所示。预期生物反应器容器55可以具有例如200ml的运行体积;生物反应器容器56可以具有3l的体积;以及生物反应器容器57可以具有50l的体积。生物反应器的规模化而且不仅仅是细胞培养元件12的数量的规模化的优点在于降低了容器的体积,例如还降低了需要灌注的介质量。然而,因为每个个体细胞培养元件构造类似且具有均匀结构,所以细胞培养系统的性能是可预测和可规模化的。图17、18和19中更详细显示了较小的生物反应器容器55。容器55的尺寸调节至容纳最多7个细胞培养元件12,但是任意其他操作类似于上文所讨论的实施方式。
78.进行生物反应器容器55的流动行为的建模,并且结果如图20和21所示。在图20中,流动矢量显示主要为径向向外流出细胞培养元件。在支撑元件的穿孔处存在一些提升的速度,但是这快速消散,这对于维持健康粘附的细胞是有利的。在图21中,显示入口区的细节图。每个细胞培养元件的介质分布是基本均匀的,这有助于细胞、营养物和介质的均匀分布。
79.本文公开实施方式的一项独特优势在于使用多个细胞培养元件。所述多个细胞培养元件相比于使用一个或少量的较大的基材材料的本体堆叠的设计将提供更均匀的细胞生长和流域。还容易在容器中构建和部署细胞生长元件。管式元件的几何形貌可以对性能进行优化,并且能够以直截了当的方式规模化至大尺寸或小尺寸。
80.细胞培养基材
81.图22显示细胞培养基材材料的卷材的例子。如本文所讨论的那样,在一些优选实施方式中,基材材料可以是织造聚合物材料。然而,实施方式不限于这种构造。例如,材料可
以是:3d打印的、注塑的、戳印(stamp)的、由较小的丝线片熔合的或者根据本领域已知的其他方法生产得到的。根据这些方法中的一些,基材可以形成为平片然后辊制。或者,基材可以例如通过3d打印形成为三维圆柱体。
82.图23显示基材的实施方式,其中,基材形成为圆柱体卷材350。例如,将包含网状基材352的基材材料片绕着中心纵轴y辊制成圆柱体。圆柱体卷材350具有沿着垂直于中心纵轴y的维度的宽度w以及沿着垂直于中心纵轴y的方向的高度h。在一个或多个优选实施方式中,圆柱体卷材350设计成在生物反应器容器中使得中心纵轴y平行于流体通过装纳圆柱体卷材的生物反应器或培养室的本体流动f的方向。在一些实施方式中,支撑元件可以包含一个或多个附连点位用于在圆柱体卷材的内部部件处固定细胞培养基材352的一个或多个部分。这些附连点位可以是钩子、夹扣、柱子、夹具或者将网片附连到支撑元件的其他装置。或者,基材可以通过围绕卷材的带材或者其他固定件进行限制,或者它可以附连到打孔入口板或打孔出口板中的一个或两个。
83.不同于用于细胞培养生物反应器的现有细胞培养基材(即,无序纤维的非织造基材),本公开内容的实施方式包括具有受限或有序结构的细胞培养基材。受限和有序结构实现了一致且可预测的细胞培养结果。此外,基材具有开放多孔结构,其防止了细胞捕获和实现了均匀流动通过填装床。这种构造实现了改进的细胞接种、营养物传递、细胞生长和细胞收获。根据一个或多个具体实施方式,基材由基材材料形成,所述基材材料具有薄片状构造,具有被较小的厚度分隔开的第一与第二侧,从而片厚度相对于基材的第一和第二侧的宽度和/或长度是小的。此外,形成了穿过基材厚度的多个孔或开口。开口之间的基材材料的尺寸和几何形貌允许细胞粘附到基材材料的表面,仿佛是近似二维(2d)表面那样,同时允许绕着基材材料和穿过开口的充分的流体流动。在一些实施方式中,基材是:基于聚合物的材料并且可以形成为模制聚合物片;具有压孔穿过厚度的开口的聚合物片;许多丝线,它们熔合成网状层;3d打印基材;或者织造成网状层的多根丝线。基材的物理结构具有高的表面-体积比,用于培养锚定依赖性细胞。根据各种实施方式,基材可以以本文所讨论的某些方式那样布置成或者填装到生物反应器中,用于均匀细胞接种和生长、均匀介质灌注以及高效细胞收获。
84.本公开内容的实施方式可以实现实用规模的病毒载体平台,其可以产生如下规格的病毒基因组:每批次大于约10
14
个病毒基因组;每批次大于约10
15
个病毒基因组;每批次大于约10
16
个病毒基因组;每批次大于约10
17
个病毒基因组;或者最高至每批次大于约10
16
个病毒基因组。在一些实施方式中,每批次产生约10
15
至约10
18
或更多的病毒基因组。例如,在一些实施方式中,病毒基因组产率可以是:每批次约10
15
至约10
16
个病毒基因组;或者每批次约10
16
至约10
19
个病毒基因组;或者每批次约10
16
至约10
18
个病毒基因组;或者每批次约10
17
至约10
19
个病毒基因组;或者每批次约10
18
至约10
19
个病毒基因组;或者每批次约10
18
或更多个病毒基因组。
85.此外,本文公开的实施方式不仅能够实现细胞培养基材的细胞附着和生长,并且还能够实现培养细胞的存活收获。无法收获活细胞是目前平台的明显缺陷,并且这导致难以建立和维持足够数量的细胞以实现生产能力。根据本公开内容实施方式的方面,可以从细胞培养基材收获活细胞,包含80%至100%存活率,或者约85%至约99%存活率,或者约90%至约99%存活率。例如,对于收获的细胞,是至少80%存活率,至少85%存活率,至少
90%存活率,至少91%存活率,至少92%存活率,至少93%存活率,至少94%存活率,至少95%存活率,至少96%存活率,至少97%存活率,至少98%存活率,或者至少99%存活率。可以采用例如胰蛋白酶、tryple或accutase从细胞培养基材释放细胞。
86.图24和25分别显示根据本公开内容一个或多个实施方式的示例性细胞培养基材的细胞培养基材100的三维(3d)立体图和二维(2d)平面图。细胞培养基材100是由沿第一方向的第一组多根纤维102和沿第二方向的第二组多根纤维104制造得到的织造网状层。基材100的织造纤维形成多个开口106,其可以由一个或多个宽度或直径(例如,d1、d2)所限定。开口的尺寸和形状可以基于编织类型(例如,数量、丝线的形状和尺寸;以及相交丝线之间的角度等)发生变化。织造网可以表征为宏观二维片或层。然而,对织造网的仔细检查揭示了由于网的相交纤维的上升和下降所导致的三维结构。因此,如图26所示,织造网100的厚度t可以比单纤维的厚度(例如t1)更厚。如本文所用,厚度t是织造网的第一侧108与第二侧110之间的最大厚度。不希望受限于理论,相信基材100的三维结构是有利的,因为这提供了大的表面积来培养粘附的细胞,并且网的结构刚性可以提供实现了均匀流体流动的一致且可预测的细胞培养基材结构。
87.在图25中,开口106具有直径d1(定义为相对纤维102之间的距离)以及直径d2(定义为相对纤维104之间的距离)。取决于编织几何形貌,d1和d2可以是相等或者不等的。对于d1和d2是不相等的情况,较大的那个可以被称作主直径,而较小的那个被称作次直径。在一些实施方式中,开口的直径可以被称作开口的最宽部分。除非另有说明,否则如本文所用的开口直径会表示开口的相对侧上的平行纤维之间的距离。
88.给定的多根纤维102的纤维具有厚度t1,以及给定的多根纤维104的纤维具有厚度t2。在如图24所示的圆形横截面或者其他三维横截面纤维的情况下,厚度t1和t2是纤维横截面的最大直径或厚度。根据一些实施方式,所述多根纤维102全都具有相同的厚度t1,而所述多根纤维104全都具有相同的厚度t2。此外,t1和t2可以是相等的。然而,在一个或多个实施方式中,t1和t2是不等的,例如当所述多根纤维102不同于所述多根纤维104的时候。此外,所述多根纤维102和所述多根纤维104可以分别含有两种或更多种不同厚度的纤维(例如,t
1a
、t
1b
等,以及t
2a
、t
2b
等)。根据实施方式,厚度t1和t2相对于其上培养的细胞的尺寸是大的,从而纤维提供了相对于细胞角度而言近似平坦表面,这相比于其中的纤维尺寸是小的的其他解决方案(例如,规格为细胞直径)可以实现更好的细胞附着和生长。由于织造网的三维特性,如图24-26所示,纤维的可用于细胞附着和增殖的2d表面积超过了等价平坦2d表面上用于附着的表面积。
89.在一个或多个实施方式中,纤维可以具有如下直径范围:约50μm至约1000μm,约100μm至约750μm,约125μm至约600μm,约150μm至约500μm,约200μm至约400μm,约200μm至约300μm,或者约150μm至约300μm。对于微观水平而言,由于纤维相比于细胞的规格(例如,纤维直径大于细胞),单丝线纤维的表面以近似2d平面呈现用于粘附细胞的附着和增殖。可以将纤维织造成开口范围约为100μm x 100μm至约为1000μm x 1000μm的网。在一些实施方式中,纤维可以具有如下直径:约50μm至约1000μm,约100μm至约750μm,约125μm至约600μm,约150μm至约500μm,约200μm至约400μm,或者约200μm至约300μm。这些丝线直径和开口直径的范围是一些实施方式的例子,但是并不旨在对根据所有实施方式的网的可能的特征尺寸进行限制。对纤维直径和开口直径的组合进行选择以提高穿过基材的高效且均匀流体流动,
例如当细胞培养基材包含多个相邻网状层(例如,单体层的堆叠或者卷起来的网状层)的时候。
90.诸如纤维直径、开口直径和织造类型/图案之类的因素会决定可用于细胞附着和生长的表面积。此外,当细胞培养基材包括堆叠、卷材或者重叠基材的其他布置时,细胞培养基材的填装密度会影响填装床基材的表面积。填装密度会随着基材材料的填装厚度(例如,基材的层所需的空间)发生变化。例如,如果细胞培养基材的堆叠具有一定的高度,则可以将堆叠中的每一层认为具有填装厚度,其通过将堆叠的总高度除以堆叠中的层数来确定。填装密度会基于纤维直径和编织发生变化,但是也会基于堆叠中的相邻层的对齐发生变化。例如,由于织造层的三维特性,存在一定量的相邻层基于它们的相互对齐所能够容纳的互锁或重叠。在第一对齐中,相邻层可以紧密贴合在一起;但是在第二对齐中,相邻层可以具有零重叠,例如当上层的最低点与下层的最高点直接接触时。对于某些应用,可能希望提供具有较低密度的层填装(例如,当高的可渗透性具有优先级时)或者较高密度的层填装(例如,当最大化基材表面积具有优先级时)的细胞培养基材。根据一个或多个实施方式,填装厚度可以是:约50μm至约1000μm,约100μm至约750μm,约125μm至约600μm,约150μm至约500μm,约200μm至约400μm,约200μm至约300μm。
91.上述结构因素可以确定细胞培养基材的表面积,无论是细胞培养基材的单层的表面积还是具有多层基材的细胞培养基材的表面积。例如,在具体实施方式中,具有圆形形状和6cm直径的织造网基材的单层可以具有约68cm2的有效表面积。如本文所用,“有效表面积”是基材材料的可用于细胞附着和生长的部分中的纤维的总表面积。除非另有说明,否则涉及的“表面积”指的是这个有效表面积。根据一个或多个实施方式,直径为6cm的单层织造网基材可以具有如下有效表面积:约50cm2至约90cm2,约53cm2至约81cm2,约68cm2,约75cm2,或者约81cm2。提供的这些有效表面积范围仅仅是举例,并且一些实施方式可以具有不同的有效表面积。细胞培养基材还可以以孔隙度进行表征。
92.可以从与细胞培养应用相容的聚合物材料的单丝线或多丝线纤维制造基材网,包括例如:聚苯乙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯、聚乙烯吡咯烷酮、聚丁二烯、聚氯乙烯、环氧乙烷、聚吡咯和环氧丙烷。网状基材可以具有不同的图案或织造,包括例如:针织、经编(warp-knitted)或机织(woven)(例如,平纹、斜纹、荷兰纹、五针编织)。
93.可以需要对网状丝线的表面化学性进行改性以提供所需的细胞粘附性质。可以通过网的聚合物材料的化学处理或者通过丝线表面接枝细胞粘附分子来进行此类改性。或者,网可以涂覆证实了细胞粘附性质的生物相容性水凝胶的薄层,包括例如胶原蛋白或或者,网的丝线纤维的表面可以通过各种类型的等离子体、加工气体和/或行业中已知的化学品的处理工艺赋予细胞粘附性质。然而,在一个或多个实施方式中,网能够在没有表面处理的情况下提供高效的细胞生长表面。
94.图27a、27b和27c显示根据本公开内容一些预期实施方式的织造网的不同例子。下表1总结了这些网的纤维直径和开口尺寸,以及通过相应的网的单层所提供的相对于相当的2d表面的细胞培养表面积的近似增加大小。在表1中,网a指的是图27a的网,网b指的是图27b的网,以及网c指的是图27c的网。表1的这三种网几何形貌仅仅是举例,并且本公开内容的实施方式不限于这些具体例子。因为网c提供了最高的表面积,所以其对于实现细胞粘附和增殖的高密度并进而提供最高效的基材用于细胞培养可以是有利的。然而,在一些实施
方式中,细胞培养基材包含具有较低表面积的网(例如,网a或网b)或者不同表面积的网组合对于例如实现培养室内所需的细胞分布或流动特性可能是有利的。
[0095][0096]
表1:图27a-27c中的网对比,以及所得到的相比于2d表面的细胞培养表面积增加
[0097]
如上表所示,网的三维质量相比于相当尺寸的平坦2d表面提供了增加的表面积用于细胞附着和增殖。这种表面积增加有助于通过本公开内容的实施方式实现可规模化性能。对于工艺发展和工艺验证研究,通常需要小规格的生物反应器来节约试剂成本和增加实验产出。本公开内容的实施方式可适用于此类小规格研究,但是也可以放大规格至工业或生产规模。例如,如果将2.2cm直径圆圈形式的100层的网c填装成2.2cm内直径的圆柱体填装床,则可用于细胞附着和增殖的总表面积等于约935cm2。为了使得此类生物反应器放大10倍,可以使用类似的设定:具有7cm内直径和100层相同网的圆柱体填装床。在此类情况下,总表面积会等于9,350cm2。在一些实施方式中,可用的表面积约为99,000cm2/l或更大。因为填装床中的塞式灌注流,以ml/分钟/cm2横截面填装床表面积表示的相同流速可用于较小规模和较大规模的生物反应器。类似地,在本文公开的细胞培养系统中,可改变细胞培养元件的长度和数量来调节可用的表面积。此外,出于相同目的,考虑可用改变给定细胞培养元件上的基材量(例如,细胞培养基材的卷材厚度)。较大的表面积实现了较高的接种密度和较高的细胞生长密度。根据一个或多个实施方式,本文所述的细胞培养基材证实具有最高至22,000个细胞/cm2或更高的细胞接种密度。作为参考,康宁的二维表面上的接种密度约为20,000个细胞/cm2。
[0098]
较高表面积和高的细胞接种或生长密度的另一个优点在于,本文公开实施方式的成本可等于或低于竞争解决方案。具体来说,每个细胞产品(例如,每个细胞或每个病毒基因组)的成本可等于或低于其他填装床生物反应器。
[0099]
在下文讨论的本公开内容的另一个实施方式中,可以以圆柱形卷材形式将织造网基材填装到生物反应器内。在此类实施方式中,可以通过增加(未卷绕的)网带的整体长度和/或其宽度(例如,卷材高度)实现填装床生物反应器的可规模化。用于这种圆柱形卷材构造的网的量可以基于所需的填装床填装密度发生变化。例如,可以将圆柱形卷材致密地填装成紧密卷或者疏松地填装成疏松卷。填装密度通常会取决于所需的给定应用或规格所要求的细胞培养基材表面积。在一个实施方式中,可以通过采用如下方程式从填装床生物反应器直径计算所需的网长度:
[0100]
l=π(r
2-r2)/t
ꢀꢀꢀꢀꢀꢀꢀ
等式1
[0101]
式中,l是填装生物反应器所需的网的总长度(即,图34中的h),r是填装床培养室的内半径,r是绕其进行卷绕的网的内支撑体的半径,以及t是一层网的厚度。在此类构造中,可以通过增加填装床圆柱形卷材的直径或宽度(即,图34中的w)和/或增加填装床圆柱
形卷材的高度h来实现生物反应器的可规模化,从而提供了更多的基材表面积用于接种和生长粘附细胞。
[0102]
通过使用结构限定的充分强度的培养基材,可以实现基材或填装床上的高流动抗性均匀性。根据各种实施方式,可以以单层或多层形式部署基材。这种灵活性消除了扩散限制并且提供了对于附着到基材的细胞的均匀的营养物和氧传递。此外,开放基材缺乏填装床构造中的任何细胞俘获区域,实现了在培养结束时具有高存活率的完全细胞收获。基材还为填装床传递了填装均匀性并且实现了从工艺发展单元到大规模工业生物加工单元的直接可规模化。能够从填装床直接收获细胞的能力消除了对于将基材重新悬浮到搅拌或机械振荡容器中的需求,这会增加复杂度并且会使得细胞遭受有害的剪切应力。此外,细胞培养基材的高填装密度得到了工业规模上体积可管理的高的生物加工生产能力。
[0103]
图28a显示包含多层基材200的细胞培养基材的实施方式,以及图28b是同一多层基材200的平面图。多层基材200包括第一网基材层202和第二网基材层204。尽管第一与第二基材层202和204是重叠的,但是网的几何形貌(例如,开口直径与纤维直径之比)使得第一与第二基材层202和204的开口重叠并为流体提供流动通过多层基材200的总厚度的路径,如图28b中的无丝线开口206所示。基材的这些重叠层可以包括分开的基材材料片或者绕其自身折叠或卷绕的单片材料,如本文所述的细胞培养元件的情况。
[0104]
图40显示图28b中的线b-b处的多层基材200的横截面图。箭头208显示通过第二基材层204中的开口然后绕着第一基材层202中的丝线的可能的流体流动路径。将网基材层的几何形貌设计成允许高效且均匀的流动通过一个或多个基材层。此外,基材200的结构可以容纳以多取向通过基材的流体流动。例如,如图29所示,本体流体流动的方向(如箭头208所示)垂直于第一与第二基材层202和204的主侧表面。然而,基材也可以相对于流动取向成使得基材的侧面平行于本体流动方向。
[0105]
根据本公开内容的实施方式,所提供的细胞培养基材至少部分由于它们的均匀和开放结构展现出穿过基材的基本上各向同性的介质、细胞和营养物等的流动。相反地,现有的生物反应器中的用于粘附细胞的基材不展现出这种行为,作为替代,它们的填装床倾向于产生优先流动通道并且具有各向异性渗透性的基材材料。本公开内容的基材的灵活性使得其能够用于各种应用以及生物反应器或容器设计,同时实现整个生物反应器容器的更好且更均匀的渗透性。
[0106]
根据一些实施方式,用于市售可得细胞培养系统的典型非织造基材具有约为7.5x10-12
m2的低得多的渗透性,这会是根据本公开内容实施方式的开放和/或织造基材上的渗透性的约1/50。例如,当将非织造基材材料切割成更小的条并随机填装时,渗透性会极大地增加并变得类似于开放织造网。然而,相信这种渗透性的增加是由于上文所讨论的通道效应所导致的流动主要绕着网条旁路通过的结果。换言之,其他填装床的渗透性增加的代价是均匀性。
[0107]
在开放织造网的情况下,开放结构允许液体容易地流动通过网并且没有在开放网层后面产生死区。相信织造网的规则结构还对穿过每层的基材材料的均匀流动分布具有贡献作用。这进而实现了流入通过整个填装床的均匀流动。
[0108]
渗透性和残留时间实验显示用于现有生物反应器中的非织造无规细胞培养基材类型具有比根据本公开内容实施方式的基材低得多的渗透性。取决于相对于非织造基材的
流动方向,这些非织造或无规基材还具有不同的渗透性或流速,而本公开内容的基材展现出基本上各向同性的流动行为。相比于本公开内容一些实施方式中的开放均匀基材,由于非织造基材的非均匀流动和较低的停留时间,营养物和转染反应物会需要更久才能到达基材表面上的细胞或者达到基材层的另一侧。除此之外,无规填装的非织造基材的渗透性更高,这表明存在强烈的通道效应并由此导致细胞或营养物的不均匀传递。
[0109]
培养系统
[0110]
图30显示根据一个或多个实施方式的细胞培养系统400。系统400包括根据本文公开的一个或多个实施方式,装纳了细胞培养元件的生物反应器402。生物反应器402可以流体连接到介质调理容器404,以及系统能够将调理容器404中的细胞培养介质406供给到生物反应器402。介质调理容器404可以包括传感器和控制组件,包括但不限于:溶解氧(do)传感器、ph传感器、氧生成器/气体喷射装置、温度探针以及营养物添加端口和碱添加端口。可以通过用于n2、o2和co2气体的气流控制器来控制供给到喷射单元的气体混合物。介质调理容器404还含有用于介质混合的叶轮(未示出)。通过上文列出的传感器进行测量的所有介质参数都可以通过介质调理控制单元418进行控制,所述介质调理控制单元418与介质调理容器404联通且能够测量和/或调节细胞培养介质406的状态至所需水平。如图30所示,介质调理容器404提供成与生物反应器容器402分开的容器。这对于能够在与细胞进行培养的地方分开处调理介质然后将经过调理的介质供给到细胞培养空间而言是有利的。然而,在一些实施方式中,可以在生物反应器容器402中(例如,在入口增压室或者容器内的其他隔室中)进行介质调理。
[0111]
将来自介质406调理容器404的介质经由入口传递到生物反应器402,所述入口也可以包括用于细胞接种液对细胞进行接种和开始培养的注入端口。生物反应器容器402还可以包括一个或多个出口410,细胞培养介质406通过所述出口410离开容器402。此外,细胞或者细胞产物可以通过出口410和/或入口408输出。为了对来自生物反应器402的流出流的内含物进行分析,可以在生产线中提供一个或多个传感器412。在一些实施方式中,系统400包括用于控制进入到生物反应器402中的流的流动控制单元414。例如,流动控制单元414可以接收来自一个或多个传感器412(例如,o2传感器)的信号,并且基于信号通过向位于生物反应器402的入口408的上游的泵416(例如,蠕动泵)传递信号来调节进入到生物反应器402中的流。因此,基于通过传感器412测得的一个参数或者参数组合,泵416可以控制进入到生物反应器402中的流动从而获得所需的细胞培养条件。
[0112]
通过信号加工单元414控制介质灌注速率,所述信号加工单元414收集并对比来自介质调理容器404的传感器信号与位于填装床生物反应器出口410处的传感器。因为穿过填装床生物反应器402的介质灌注的填装流动特性,沿着填装床建立起了营养物、ph和氧梯度。可以通过根据图44中的流程图以操作方式连接到蠕动泵416的流动控制单元414来自动控制生物反应器的灌注流速。
[0113]
图31显示根据一个或多个实施方式的细胞培养系统420的更细节的示意图。系统420的基础构建类似于图30的系统400,填装床生物反应器422具有含有一个或多个细胞培养元件(具有细胞培养基材材料,例如pet织造网)的容器以及分开的介质调理容器424。然而,不同于系统400,系统420显示了系统的细节,包括传感器、用户界面和控制,以及用于介质和细胞的各种入口和出口。根据一些实施方式,介质调理容器424通过控制器426进行控
制以提供合适的温度、ph、o2和营养物。虽然在一些实施方式中,生物反应器422也可以通过控制器426进行控制,但是在其他实施方式中,以分开的灌注线路428提供生物反应器422,其中,使用泵基于生物反应器422的出口处或出口附近的o2检测来控制通过灌注线路428的介质流速。
[0114]
根据一个或多个实施方式,图30和31的系统可以根据工艺步骤运行。如图32所示,这些工艺步骤可以包括:工艺准备(s1)、细胞接种和附着(s2a、s2b)、细胞膨胀(s3)、转染(s4a、s4b)、病毒载体的生产(s5a、s5b)以及细胞释放和收获(s6a、s6b)。
[0115]
图33显示用于控制灌注生物反应器系统(例如,图30或31的系统400)的流动的方法450的例子。根据方法450,在步骤s21,通过生物反应器优化运行预先确定系统400的某些参数。通过这些优化运行,可以确定ph1、po1、[葡萄糖]1、ph2、po2、[葡萄糖]2以及最大流速的数值。在步骤s22,测量生物反应器402的细胞培养室内的ph1、po1和[葡萄糖]1的数值,以及在步骤s23,在生物反应器容器402的出口处通过传感器412测量ph2、po2和[葡萄糖]2的数值。基于s22和s23的这些值,灌注泵控制单元在s24确定来维持或调节灌注速率。例如,如果满足以下至少一项:ph2≥ph
2最小值
、po2≥po
2最小值
以及[葡萄糖]2≥[葡萄糖]
2最小值
,则可以以目前的速率继续细胞培养介质到细胞培养室的灌注流速(s25)。如果现有流速小于或等于细胞培养系统的预定最大流速,则增加灌注速率(s27)。此外,如果现有流速没有小于或等于细胞培养系统的预定最大流速,则细胞培养系统的控制器可以对以下至少一项进行重新评估:(1)ph
2最小值
、po
2最小值
以及[葡萄糖]
2最小值
;(2)ph1、po1以及[葡萄糖]1;以及(3)生物反应器容器的高度(s26)。
[0116]
如本文所用,“细胞培养室”或者“限定的培养空间”指的是培养室内被细胞培养元件占据并且其中要进行细胞接种和/或培养的空间。限定的培养空间可以填充近似整个培养室,或者可以占据培养室内的一部分空间。如本文所用,“本体(bulk)流动方向”定义为在细胞培养过程中和/或在培养介质流入或流出培养室的过程中,流体或培养介质的本体质量(bulk mass)流动穿过细胞培养基材或在细胞培养基材上方流动的方向。
[0117]
生物反应器容器任选地包括能够附连到入口和/或出口装置的一个或多个出口。通过所述一个或多个出口,液体、介质或细胞可以被供给到室或者从室去除。容器中的单个端口可以起到入口或出口这两者的作用,或者可以提供多个端口作为专门的入口和出口。
[0118]
一个或多个实施方式的填装床细胞培养基材可以由织造细胞培养网基材构成,没有布置在细胞培养基材中或者与细胞培养基材穿插的任何其他形式的细胞培养基材。也就是说,本公开内容实施方式的织造细胞培养网基材是有效的细胞培养基材,不需要用于现有方案中的无规非织造基材类型。这实现了简化设计和构建的细胞培养系统,同时提供了具有本文讨论的涉及流动均匀性、可收获性等的其他优点的高密度细胞培养基材。根据一些实施方式,细胞培养元件包括细胞培养基材的卷起来的层或者堆叠层,产生了层状细胞培养基材,并且没有(在相邻层之间)布置其他固体材料(例如,间隔物和/或其他细胞培养材料)。
[0119]
如本文所讨论的那样,提供的细胞培养基材和生物反应器系统提供了许多优点。例如,本公开内容的实施方式可以支撑任意多种病毒载体的产生(例如aav(所有血清型)和慢病毒),并且可以用于体内和体外基因治疗应用。均匀的细胞接种和分布使得每个容器的病毒载体产率最大化,并且设计实现了存活细胞的收获,这对于采用同一平台的多膨胀阶
段构成的接种序列会是有用的。此外,本文的实施方式可以从工艺发展规格到生产规格是可规模化的,这最终节约了开发时间和成本。本文公开的方法和系统还实现了细胞培养工艺的自动化和控制,以使得载体产率最大化并改善可重复性。最后,达到病毒载体生产水平规格(例如,每批次10
16
至10
18
aav vg)所需的容器数量可以相比于其他细胞培养方案得到极大减少。
[0120]
本文公开的实施方式相比于用于细胞培养和病毒载体生产的现有平台具有优势。要注意的是,本公开内容的实施方式可用于生产许多类型的细胞和细胞副产物,包括例如:粘附或半粘附细胞,人类胚胎肾(hek)细胞(例如hek23),包括转染细胞、病毒载体,例如慢病毒(干细胞,car-t)和腺相关病毒(aav)。这些是如本文所公开的生物反应器或细胞培养基材的一些常见应用的例子,但是并不旨在限制所公开的实施方式的用途或应用,因为本领域技术人员会理解实施方式对于其他用途的适用性。
[0121]
如上文所讨论的那样,本公开内容实施方式的一个优点在于穿过细胞培养基材的流动均匀性。不希望受限于理论,相信细胞培养基材的规则或均匀结构提供了介质可以流动通过的一致且均匀的主体。相反的,现有平台主要依赖于无规或随机基材,例如毡状或非织造纤维状材料。
[0122]
实施例
[0123]
实施例1
[0124]
表2显示一些实施方式的实施例基材,其中,基材由各种构造的织造pet网制得。
[0125][0126][0127]
表2:实施例网基材
[0128]
实施例2
[0129]
如本文所讨论的那样,本公开内容的实施方式提供了细胞培养基材、生物反应器系统以及细胞或细胞副产物的培养方法,它们是可规模化的并且可以用于提供细胞接种序列来逐渐增加细胞种群。现有细胞培养方案中的一个问题在于无法将给定的生物反应器系统技术作为接种序列的一部分。相反地,细胞种群通常在各种细胞培养基材上规模化。这会
对细胞种群产生负面影响,因为相信细胞变得适应某些表面并且转移到不同类型的表面会导致效率低下。因此,会希望使得细胞培养基材或技术之间的此类转染最小化。通过在接种序列上使用相同的细胞培养基材(通过本公开内容的实施方式那样实现),增加了细胞种群的规模化的效率。图34显示一个或多个实施方式的例子,其中,本技术的织造细胞培养基材用作接种序列的一部分来实现较小的生物反应器接种到较大的生物反应器。具体来说,如图34所示,接种序列可以从接种到第一容器(例如来自康宁公司的t175烧瓶)中的起始细胞的小瓶开始,然后接种到第二容器(例如来自康宁公司的)中,然后进入根据本发明实施方式的工艺开发规模的生物反应器系统(基材的有效表面积约为20,000cm2),以及然后进入根据本发明实施方式的更大的生物反应器中试系统(基材的有效表面积约为300,000cm2)。在这个接种序列的最后,细胞可以接种到根据本公开内容实施方式的生产规模生物反应器容器,表面积是例如约5,000,000cm2。然后,当完成细胞培养时,可以进行收获和纯化步骤。如图34所示,可以通过用洗涤剂(例如triton x-100)进行原位细胞裂解或通过机械裂解来完成收获;并且可以根据需要执行进一步的下游加工。
[0130]
在接种序列中(例如,从工艺开发水平到中试水平,或者甚至到生产水平)使用相同的细胞培养基材的益处包括:在接种序列和生产阶段中细胞习惯于相同表面所获得的效率;在接种序列阶段过程中减少手动打开操作的数量;由于如本文所述的均匀细胞分布和流体流动,更高效地使用填装床;以及在病毒载体收获过程中使用机械或化学裂解的灵活性。
[0131]
示意性执行方式
[0132]
以下是本文公开主题的执行方式的各种方面的描述。每个方面可以包括本文公开主题的各种特征、特性或优点中的一个或多个。执行方式旨在阐述本文公开主题的一些方面,并且不应该视为所有可行执行方式的综合性或排他性描述。
[0133]
方面1属于细胞培养系统,其包括:生物反应器容器,所述生物反应器容器包含:内部空穴,其限定了细胞培养空间;流体连接到细胞培养空间的第一端部的入口;以及流体连接到细胞培养空间的第二端部的出口;以及布置在细胞培养空间中的至少一个细胞生长元件,所述细胞生长元件包含围绕支撑元件以从细胞培养空间的第一端部到第二端部的方向延伸的细胞培养基材。
[0134]
方面2属于方面1的细胞培养系统,其中,细胞培养基材包括细胞培养基材材料的片材,其缠绕(wrap)或卷绕(wind)支撑元件。
[0135]
方面3属于方面1或方面2的细胞培养系统,其中,细胞培养基材包括织造基材材料,其包含多根交织纤维,表面构造成使得细胞与其粘附。
[0136]
方面4属于方面1-3中任一项的细胞培养系统,其还包括布置在细胞培养空间中并且以从细胞培养空间的第一端部到第二端部的方向对齐的多个细胞生长元件。
[0137]
方面5属于方面4的细胞培养系统,其中,所述多个细胞生长元件以可去除的方式附连到细胞培养空间使得细胞培养系统在细胞培养过程中可以容纳各种数量的细胞生长元件。
[0138]
方面6属于方面1-5中任一项的细胞培养系统,其中,中心支撑体是管式的,具有围绕空心芯体的周壁,所述周壁包含将中心支撑体的内部流体连接到中心支撑体的外部的多个穿孔。
[0139]
方面7属于方面6的细胞培养系统,其中,中心支撑体的空心芯体流体连接到入口,以及细胞培养系统包括流体流动路径,其包括从入口开始流动,然后通过空心芯体,然后经由所述多个穿孔从中心支撑体径向向外流动,然后穿过细胞培养基材,以及然后流出出口。
[0140]
方面8属于方面1-7中任一项的细胞培养系统,其还包括入口增压室,所述入口增压室流体连接到且布置在入口与细胞培养空间之间。
[0141]
方面9属于方面8的细胞培养系统,其还包括布置在入口增压室与细胞培养空间之间的打孔入口板,所述打孔入口板包括多个穿孔,其将入口增压室直接流体连接到中心支撑体的第一端部处的空心芯体。
[0142]
方面10属于方面1-9中任一项的细胞培养系统,其还包括出口增压室,所述出口增压室流体连接到且布置在细胞培养空间与出口之间。
[0143]
方面11属于方面10的细胞培养系统,其还包括布置在细胞培养空间与出口增压室之间的打孔出口板,所述打孔出口板包括多个穿孔,其将细胞培养空间包含中心支撑体的外部的一部分流体连接到出口增压室。
[0144]
方面12属于方面11的细胞培养系统,其中,中心支撑体附连到中心支撑体的第二端部。
[0145]
方面13属于方面12的细胞培养系统,其中,空心芯体在中心支撑体的第二端部不是开放的,从而空心芯体没有经由中心支撑体的第二端部直接流体连接到出口增压室。
[0146]
方面14属于方面8-13中任一项的细胞培养系统,其还包括布置在入口增压室中的入口歧管,所述入口歧管流体连接到入口并且构造成使得流体在整个入口增压室是均匀分布的或者均匀分布到打孔入口板。
[0147]
方面15属于方面10-14中任一项的细胞培养系统,其还包括布置在出口增压室中的出口歧管,所述出口歧管流体连接到出口并且构造成引导流体离开细胞培养空间达到出口。
[0148]
方面16属于方面1-15中任一项的细胞培养系统,其中,所述至少一个细胞培养元件具有圆柱体形状。
[0149]
方面17属于方面1-16中任一项的细胞培养系统,其中,所述至少一个细胞培养元件包括用于将细胞培养基材附连到中心支撑体的附连机制。
[0150]
方面18属于方面1-17中任一项的细胞培养系统,其中,细胞培养空间具有如下体积:至少约50ml,至少约100ml,至少约200ml,至少约300ml,至少约500ml,至少约1l,至少约2l,至少约3l,至少约10l,至少约20l,至少约30l,至少约40l,至少约50l,约50ml至约500ml,约1l至约10l,或者约10l至约50l。
[0151]
方面19属于方面1-18中任一项的细胞培养系统,其包括约7个细胞培养元件至约130个细胞培养元件。
[0152]
方面20属于方面1-19中任一项的细胞培养系统,其中,细胞培养基材包括细胞培养基材材料的堆叠或卷材,在细胞培养基材的相邻层之间没有任何其他固体材料。
[0153]
方面21属于细胞培养系统,其包括:生物反应器容器,包含限定了细胞培养空间的内部空穴,流体连接到细胞培养空间的第一端部的入口,以及流体连接到细胞培养空间的第二端部的出口;入口增压室,其流体连接到且布置在入口与细胞培养空间之间;出口增压室,其流体连接到且布置在细胞培养空间与出口之间;以及布置在入口增压室与细胞培养
空间之间的打孔入口板,所述打孔入口板包括至少一个穿孔,其中,细胞培养空间构造成在其中容纳至少一个细胞生长元件,所述至少一个细胞生长元件包含围绕打孔中心管的多孔细胞培养基材,以及其中,当至少一个细胞生长元件布置在细胞培养空间中的时候,打孔入口板的所述至少一个穿孔将入口增压室直接流体连接到打孔中心管的空心中心。
[0154]
方面22属于方面21的细胞培养系统,其还包括布置在细胞培养空间与出口增压室之间的打孔出口板,所述打孔出口板包含至少一个穿孔,其中,当所述至少一个细胞生长元件布置在细胞培养空间中的时候,打孔出口板的所述至少一个穿孔流体连接了细胞培养空间的包含打孔中心管的外部的一部分。
[0155]
方面23属于方面22的细胞培养系统,其中,打孔出口板包含至少一个附连点位用于附连所述至少一个细胞培养元件。
[0156]
方面24属于方面21-23中任一项的细胞培养系统,其还包括布置在入口增压室中的入口歧管,所述入口歧管流体连接到入口并且构造成使得流体在整个入口增压室是均匀分布的或者均匀分布到打孔入口板。
[0157]
方面25属于方面22-24中任一项的细胞培养系统,其还包括布置在出口增压室中的出口歧管,所述出口歧管流体连接到出口并且构造成引导流体离开细胞培养空间达到出口。
[0158]
方面26属于方面21-25中任一项的细胞培养系统,其中,细胞培养容器构造成容纳任意各种数量的细胞培养元件的同时运行细胞培养。
[0159]
方面27属于方面21-26中任一项的细胞培养系统,其中,细胞培养空间具有如下体积:至少约50ml,至少约100ml,至少约200ml,至少约300ml,至少约500ml,至少约1l,至少约2l,至少约3l,至少约10l,至少约20l,至少约30l,至少约40l,至少约50l,约50ml至约500ml,约1l至约10l,或者约10l至约50l。
[0160]
方面28属于方面21-27中任一项的细胞培养系统,其中,细胞培养空间构造成容纳约7个细胞培养元件至约130个细胞培养元件。
[0161]
方面29属于使用方面1-20中任一项的细胞培养系统来培养细胞或细胞产物的方法。
[0162]
方面30属于方面29的方法,该方法包括:提供细胞培养系统;在细胞培养基材上接种细胞;使得细胞培养介质流动通过细胞培养系统来培养细胞;以及收获细胞培养的产物。
[0163]
方面31属于方面30的方法,其中,使得细胞培养介质流动通过细胞培养系统包括:使得细胞培养介质经由入口流入细胞培养空间中;使得细胞培养介质从入口流到支撑元件的内部;使得细胞培养介质从支撑元件的内部径向向外流动并穿过细胞培养基材到细胞培养空间相对于细胞培养元件外部的一部分;以及使得细胞培养介质从该部分的细胞培养空间通过出口流出。
[0164]
方面32属于方面29-31中任一项的方法,其中,细胞培养产物的收获包括:每批次收获大于约10
14
个病毒基因组;每批次收获大于约10
15
个病毒基因组;每批次收获大于约10
16
个病毒基因组;每批次收获大于约10
17
个病毒基因组;每批次收获最高至约10
16
个病毒基因组;每批次收获约10
15
至约10
18
个病毒基因组;每批次收获约10
15
至约10
16
个病毒基因组;每批次收获约10
16
至约10
19
个病毒基因组;每批次收获约10
16
至约10
18
个病毒基因组;每批次收获约10
17
至约10
19
个病毒基因组;每批次收获约10
18
至约10
19
个病毒基因组;或者每批
次收获约10
18
个或更多的病毒基因组。
[0165]
定义
[0166]“全合成”或“完全合成”是指完全由合成源材料组成且不含任何源自动物或动物源材料的细胞培养制品,例如微载体或培养容器表面。所公开的全合成细胞培养制品消除了异种污染的风险。
[0167]“包括”、“包含”或类似术语意为包括但不限于,即内含而非排他。
[0168]“用户”是指使用本文公开的系统、方法、制品或试剂盒的那些人,包括培养细胞以收获细胞或细胞产品的那些人,或者使用根据本文实施方式培养和/或收获的细胞或细胞产物的那些人。
[0169]
本文所述的实施方式中用来对例如组合物中成分的量、浓度、体积、加工温度、加工时间、产率、流速、压力、粘度和类似数值及其范围或者组件的尺寸以及类似数值及其范围进行修饰的“约”是指可能发生的数值量的改变,例如,源自制备材料、组合物、复合体、浓缩物、组件部件、制品或使用制剂所用的常规测量和操作过程;源自这些过程中的偶然性误差;源自用来实施所述方法的起始材料或成分的制造、来源或纯度的差异;以及类似因素。术语“约”还包括由于具有特定初始浓度或混合物的组合物或制剂的老化而不同的量,以及由于混合或加工具有特定初始浓度或混合物的组合物或制剂而不同的量。
[0170]“任选的”或“任选地”表示随后描述的事件或情形会或不会发生,而且该描述包括事件或情形发生的实例和事件或情形不发生的实例。
[0171]
除非另外说明,否则本文所用的不定冠词“一个”或“一种”及其相应的定冠词“该”表示至少一(个/种),或者一(个/种)或多(个/种)。
[0172]
可采用本领域技术人员熟知的缩写(例如,表示小时的“h”或“hr”,表示克的“g”或“gm”,表示毫升的“ml”以及表示室温的“rt”,表示纳米的“nm”以及类似缩写)。
[0173]
在组分、成分、添加剂、尺度、条件和类似方面公开的具体和优选的数值及其范围仅用于说明,它们不排除其他限定数值或限定范围内的其他数值。本公开内容的系统、试剂盒以及方法可以包括本文所述的任何数值或数值、具体数值、更具体的数值和优选数值的任何组合,包括明示或暗示的中间值和范围。
[0174]
除非另有表述,否则都不旨在将本文所述的任意方法理解为需要使其步骤以具体顺序进行。因此,当方法权利要求实际上没有陈述为其步骤遵循一定的顺序或者其没有在权利要求书或说明书中以任意其他方式具体表示步骤限于具体的顺序,都不旨在暗示该任意特定顺序。
[0175]
对本领域的技术人员而言,显而易见的是可以在不背离所示实施方式的精神或范围的情况下作出各种修改和变动。因为本领域的技术人员可以想到所揭示的实施方式的融合了实施方式的精神和实质的各种改良、组合、子项组合和变化,应认为所揭示的实施方式包括所附权利要求书范围内的全部内容及其等同内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1