用于治疗冠状病毒感染的具有共价修饰的SARS-COV-2抑制剂的制作方法
用于治疗冠状病毒感染的具有共价修饰的sars-cov-2抑制剂
相关申请的交叉引用
1.本技术要求2020年4月30日提交的美国临时专利申请第63/017,878号、2020年7月30日提交的美国临时专利申请第63/059,095号和2020年11月10日提交的美国临时专利申请第63/112,087号的权益,所述美国临时专利申请通过引用以它们的全文并入本文。
技术领域
2.本公开内容涉及用作潜在sars-cov-2抑制剂的化合物和/或材料。
背景技术:
3.sars-cov-2(也被称为2019-ncov或covid-19)在2019年首次出现。与该疾病相关联的症状包括发热、肌痛、咳嗽、呼吸困难和疲劳(huang等人,2020)。当前,没有可用于sars-cov-2的治疗。然而,提出了用熟知药物诸如氯喹(chloroquine)或研究性药物诸如瑞德西韦(remdesivir)进行的治疗用于这个疾病(colson等人,2020;wang等人,2020)。人免疫缺陷病毒(hiv)药物洛匹那韦(lopinavir)/利托那韦(ritonavir)的混合物也正在作为用于sars-cov-2的疗法进行研究,因为它们在体外展现抗冠状病毒作用(que等人,2003;chu等人,2004;chan等人,2015;li和de clercq,2020)。
4.sars-cov-2是一种β-冠状病毒,并且是包含最大的正义单链rna病毒的冠状病毒科(coronaviridae)的成员。(cui等人,2019)。病毒含有四种非结构蛋白:木瓜蛋白酶(papain)样(pl
pro
)和3-胰凝乳蛋白酶(chymotrypsin)样(3cl
pro
)蛋白酶、rna聚合酶和解旋酶(zumla等人,2016)。两种蛋白酶(pl
pro
和3cl
pro
)均涉及病毒的转录并复制。在四种类型之中,3cl
pro
被认为主要涉及于病毒的复制中(de wit等人,2016)。3clpro在冠状病毒复制期间水解病毒多聚蛋白pp1a和pp1ab以产生功能性蛋白质。一项研究报道sars-cov-2的半胱氨酸蛋白酶3cl
pro
显示与sars-cov的半胱氨酸蛋白酶3cl
pro
的96%序列类似性(xu等人,2020)。由于它的高度保守的序列和必需的功能性质,3cl
pro
已被证实为开发用以治疗sars-cov-2的药物的潜在靶标。
5.因为仍然难以找到可行的治疗,所以存在对用于抑制sars-cov-2以及用于治疗受sars-cov-2感染的对象的化合物和/或方法的需要。
技术实现要素:
6.在一个方面,本文提供了一种包含式(x)的化合物或其药学上可接受的盐或溶剂化物:
其中,b1和b各自独立地是键、c
1-c4亚烷基、c
1-c4亚杂烷基或c
3-c6亚环基接头,其中所述亚烷基、亚杂烷基或亚环基任选地被取代;r1是卤代乙酰基、乙醛酰基、杂环酰基、氰化乙酰基、乙烯基磺酰基、乙烯基亚磺酰基或丙烯酰基;r3是任选地被取代的杂芳基;r4是c
1-c6烷基、芳基、杂芳基、环烷基或杂环烷基,其各自任选地被取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代;r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;其中任选地,r
15a
和r
11
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;或其中任选地,r
15a
和r
15b
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;r
16
是h、c
1-c6烷基或c
1-c3卤代烷基;并且r
20
是氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、环烷基砜、烷基砜和芳基砜。
7.在一些实施方案中,化合物具有式(xa)的结构,或其药学上可接受的盐或溶剂化物:
8.在另一方面,本文描述了一种具有式(xb)的结构的化合物或其药学上可接受的盐或溶剂化物:
9.在另一方面,本文描述了一种具有式(xi)的结构的化合物或其药学上可接受的盐或溶剂化物:其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是芳基、杂芳基、环烷基或杂环烷基,其各自任选地被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r20
取代;每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、环烷基砜、烷基砜和芳基砜。
10.在另一方面,本文描述了一种具有式(xi)的结构的化合物或其药学上可接受的盐或溶剂化物:其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是被取代的环烷基或任选地被取代的杂环烷基,其中当被取代时,其各自被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
11.在一些实施方案中,化合物具有式(xi)的结构,或其药学上可接受的盐或溶剂化物:
其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是芳基、杂芳基、环烷基或杂环烷基,其各自任选地被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是环烷基、杂环烷基、芳基或杂芳基,其中所述环烷基、杂环烷基、芳基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
12.在一些实施方案中,化合物具有式(xia)的结构,或其药学上可接受的盐或溶剂化物:
13.在一些实施方案中,b或b1独立地是c
1-c4亚烷基或c
3-c6亚环基接头。在一些实施方案中,b或b1独立地是c2或c3亚烷基接头。在一些实施方案中,b和b1是键。在一些实施方案中,r3是含有1至3个n原子的6元杂芳基。在一些实施方案中,6元杂芳基是吡啶、嘧啶、吡嗪或哒嗪。
14.在一些实施方案中,化合物具有式(xii)的结构,或其药学上可接受的盐或溶剂化物:
其中,y1、y2、y3和y4各自独立地是ch或n,前提是y1、y2、y3或y4中的至少一者是ch。
15.在一些实施方案中,y2是n;并且y1、y3和y4各自是ch。在一些实施方案中,y2和y4各自是n;并且y1和y3是ch。在一些实施方案中,y1和y4是n;并且y2和y3是ch。在一些实施方案中,y2和y3是n;并且y1和y4是ch。在一些实施方案中,r5是c
1-c6烷基。在一些实施方案中,r5是h。
16.在一些实施方案中,化合物具有式(xiia)的结构,或其药学上可接受的盐或溶剂化物:
17.在一些实施方案中,化合物具有式(xiib)的结构,或其药学上可接受的盐或溶剂化物:
18.在一些实施方案中,化合物具有至少80%的立体化学纯度。
19.在一些实施方案中,r
15a
是h;并且r
15b
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基。在一些实施方案中,r
15a
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基;并且r
15b
是h。
在一些实施方案中,r
15a
和r
15c
各自是h。在一些实施方案中,r
11
是杂芳基,任选地被一个、两个或三个r
17
取代。在一些实施方案中,杂芳基是5元杂芳基。在一些实施方案中,杂芳基是呋喃、噻吩、噁唑、噻唑、异噁唑、三唑、噁二唑或噻二唑。在一些实施方案中,r
11
是未被取代的杂芳基。在一些实施方案中,r4是任选地被一个、两个或三个r
19
取代的杂环烷基。在一些实施方案中,r4是环烷基,任选地被一个、两个或三个r
19
取代。在一些实施方案中,环烷基是环丁基、环戊基、环己基或螺[3,3]庚烷基。在一些实施方案中,每个r
19
独立地是卤素、氧代基、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。在一些实施方案中,每个r
19
独立地是卤素。在一些实施方案中,r1是卤代乙酰基、杂环酰基或丙烯酰基。在一些实施方案中,卤代乙酰基是单取代的卤代乙酰基或二取代的卤代乙酰基。
[0020]
在另一方面,本文描述了一种化合物或其互变异构体、多晶型物、溶剂化物或组合,所述化合物包含式a、其衍生物、其前药、其盐或其立体异构体中的一者的结构,或在任何手性中心处具有任何手性:其中:r1是亲电子部分;r2、r3、r4和r5是除氢以外的取代基;并且x是杂原子。
[0021]
在另一方面,本文描述了一种化合物或其互变异构体、多晶型物、溶剂化物或组合,所述化合物包含式a、其衍生物、其前药、其盐或其立体异构体中的一者的结构,或在任何手性中心处具有任何手性:其中,r1是亲电子部分;r2、r3和r4是除氢以外的取代基;并且x是杂原子。
[0022]
在一些实施方案中,r1是能够与在sars-cov-2主要蛋白酶的位置145处的半胱氨酸残基形成共价键的亲电子部分;r2是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基;r3是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基;x是nh、o、s或键;并且r4是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基。
[0023]
在一些实施方案中,r1的可任选地有支链的可用于共价修饰的亲电子部分可基于:(a)迈克尔受体(michael acceptor)(α,β-不饱和羰基和磺酰基)形态(例如丙烯酰基、乙烯基磺酰基);(b)α-卤代酰基(例如α-氯乙酰基);(c)α,β-环氧酰基;(d)乙醛酰基;(e)β,γ
–
二酮基酰基;(f)3,4-二氧代烷基3,4-二氧代烷基;(g)2,3-二氧代烷基;和(h)α-酮基酰基(例如丙酮酰基)。
[0024]
在另一方面,本文提供了一种化合物或其互变异构体、多晶型物、溶剂化物或组合,所述化合物包含式(i)、式(ii)、式(iii)或式(iv)、其衍生物、其前药、其盐或其立体异构体中的一者的结构,或在任何手性中心处具有任何手性:其中:r1、r2、r3、r4、r5或r7是化学部分;x是nh、o、s、ch2或键;每个a单独地是ch或n;并且b是键或接头。
[0025]
在一些实施方案中,r5和/或r6独立地选自h、ch3、c2h5或cf3。
[0026]
在一些实施方案中,hal是卤素,诸如f、cl、br或i。
[0027]
在一些实施方案中,r2、r3、r4、r7和/或r8各自独立地选自h、ch3、cf3、chf2、ch2f、c2h5、hal、-cn或任选地被取代的选自以下的部分:c
3-c
12
烷基、c
3-c
12
烯基、环烷基、环烯基、杂环烷基、杂环烯基、芳基、杂芳基、稠合杂环、稠合芳基、稠合杂环-芳基、螺环或其组合。
[0028]
在一些实施方案中,化合物或其药学上可接受的盐或溶剂化物选自表1。
[0029]
在另一方面,本文提供了一种包含本文所述的化合物和药学上可接受的载体或赋形剂的药物组合物。
[0030]
在另一方面,本文提供了一种治疗或预防有需要的患者的sars-cov-2感染的方法,所述方法包括向所述患者施用本文所述的化合物或本文所述的药物化合物。在一些实施方案中,将化合物或药物组合物施用至患者直至感染减轻或消除。在一些实施方案中,方法包括治疗有需要的患者的sars-cov-2的一种或多种症状。
[0031]
在另一方面,本文提供了一种抑制sars-cov-2的蛋白酶的体内方法,所述方法包括使所述蛋白酶与如本文所述的化合物接触。在一些实施方案中,化合物结合至蛋白酶的
半胱氨酸残基。在一些实施方案中,化合物可逆地或不可逆地结合至半胱氨酸残基。在一些实施方案中,蛋白酶是3cl蛋白酶。在一些实施方案中,半胱氨酸是3cl蛋白酶的半胱氨酸145。
[0032]
本文所述的组合和方法的其他目标、特征和优势将根据以下详细描述而变得显而易见。然而,应了解,尽管指示具体实施方案,但详细描述和具体实施例仅通过说明的方式给出,因为在本公开内容的精神和范围内的各种变化和修改将根据这个详细描述而变得对本领域技术人员来说显而易见。通过引用的并入
[0033]
本说明书中提及的所有出版物、专利和专利申请都通过引用并入本文,所述引用的程度就好像已具体地和单独地指出将每个单独的出版物、专利或专利申请通过引用并入一样。
附图说明
[0034]
本公开内容的各个方面具体阐述于随附权利要求中。通过参考阐述其中利用本公开内容的原理的说明性实施方案的以下详细描述以及以下附图,将获得对本公开内容的特征和优势的更充分了解。
[0035]
图1显示用于治疗病毒性感染的共价3cl蛋白酶抑制剂的示意图。
[0036]
图2显示inscov-614(1b)在口服、sq和iv施用时的pk概况。
[0037]
图3显示inscov-614a(2a)在口服、sq和iv施用时的pk概况。
[0038]
图4显示与sars-cov-2m
pro
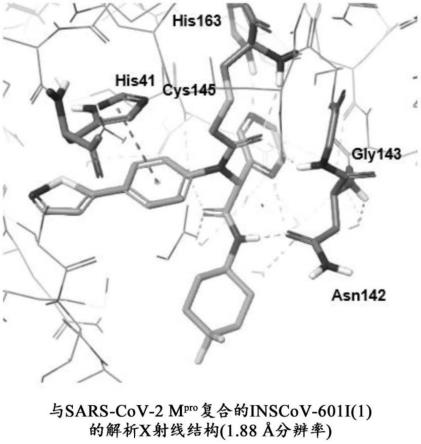
复合的inscov-601i(1)的x射线结构(1.88埃(angstrom)分辨率)。
具体实施方式
[0039]
在以下详细描述中,参考了形成其一部分的附图。除非上下文另外指示,否则在附图中,类似符号通常标识类似组分。详细描述、附图和权利要求中所述的说明性实施方案不意图是限制性的。在不脱离本文呈现的主题的精神或范围的情况下,可利用其他实施方案,并且可作出其他变化。将易于了解的是,如本文一般地描述以及在附图中说明的本公开内容的方面可以广泛多种不同配置进行排列、替代、组合、分离和设计,所述配置全都在本文中被明确地考虑。
[0040]
本公开内容包括用作sars-cov-2抑制剂以及用于治疗受sars-cov-2感染的对象的化合物和/或材料。这些化合物包括本文提供的与化合物标识符inscov(例如inscov-编号)相关联的化学结构及其衍生物。化合物具有已鉴定为抑制sars-cov-2的各种化学结构。化合物
[0041]
在一方面,本文提供了一种化合物或其互变异构体、多晶型物、溶剂化物或组合,所述化合物包含式a*、其衍生物、其前药、其盐或其立体异构体中的一者的结构,或在任何手性中心处具有任何手性:
其中:r1是亲电子部分;r2、r3、r4和r5是除氢以外的取代基;并且x是杂原子。
[0042]
在一方面,本文提供了一种化合物或其互变异构体、多晶型物、溶剂化物或组合,所述化合物包含式a、其衍生物、其前药、其盐或其立体异构体中的一者的结构,或在任何手性中心处具有任何手性:其中:r1是亲电子部分;r2、r3和r4是除氢以外的取代基;并且x是杂原子。
[0043]
在一些实施方案中,变量定义如下:r1是能够与在sars-cov-2主要蛋白酶的位置145处的半胱氨酸残基形成共价键的亲电子部分;r2是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基;r3是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基;x是ch2、nh、o、s或键;并且r4是任选地被取代的c
3-c
12
烷基、烯基、环烷基、环烯基、杂环(杂环族)、芳基或杂芳基。
[0044]
在一些实施方案中,r1是可用于共价修饰的亲电子部分。在一些实施方案中,r1是:(a)迈克尔受体(α,β-不饱和羰基和磺酰基)形态(例如丙烯酰基、乙烯基磺酰基),(b)α-卤代酰基(例如a-氯乙酰基),(c)α,β-环氧酰基,(d)乙醛酰基,(e)β,γ-二酮基酰基,
(f)3,4-二氧代烷基,(g)2,3-二氧代烷基,和(h)α-酮基酰基(例如丙酮酰基)。
[0045]
在一些实施方案中,共价修饰用迈克尔受体(α,β-不饱和羰基和磺酰基)形态(例如丙烯酰基、乙烯基磺酰基)进行。在一些实施方案中,共价修饰用α-卤代酰基(例如a-氯乙酰基)进行。在一些实施方案中,共价修饰用α,β-环氧酰基进行。在一些实施方案中,共价修饰用乙醛酰基进行。在一些实施方案中,共价修饰用β,γ-二酮基酰基进行。在一些实施方案中,共价修饰用3,4-二氧代烷基进行。在一些实施方案中,共价修饰用2,3-二氧代烷基进行。在一些实施方案中,共价修饰用α-酮基酰基(例如丙酮酰基)进行。
[0046]
在一些实施方案中,化合物具有式(i)、式(ii)、式(iii)或式(iv)中、或其衍生物、其前药、其盐或其立体异构体的结构,或在任何手性中心处具有任何手性,或其互变异构体、多晶型物、溶剂化物或组合:其中:r1、r2、r3、r4、r5或r7独立地是化学部分;x是nh、o、s、ch2或键;每个a独立地是ch或n;并且b是键或接头。
[0047]
在一些实施方案中,化合物具有式(i)或其药学上可接受的盐或溶剂化物的结构。
[0048]
在一些实施方案中,化合物具有式(ii)或其药学上可接受的盐或溶剂化物的结构。
[0049]
在一些实施方案中,化合物具有式(iii)或其药学上可接受的盐或溶剂化物的结构。
[0050]
在一些实施方案中,化合物具有式(iv)或其盐或溶剂化物的结构。
[0051]
在一些实施方案中,每个a独立地是ch或n。在一些实施方案中,每个a独立地是ch。在一些实施方案中,每个a独立地是n。
[0052]
在一些实施方案中,x选自nh、o、s、ch2或键。在一些实施方案中,x是nh。在一些实施方案中,x是o。在一些实施方案中,x是s。在一些实施方案中,x是ch2。在一些实施方案中,x是键。
[0053]
在一个方面,本文提供了一种包含式(ix)的化合物或其药学上可接受的盐或溶剂化物:
其中,b1和b各自独立地是键、c
1-c4亚烷基、c
1-c4亚杂烷基或c
3-c6亚环基接头,其中所述亚烷基、亚杂烷基或亚环基任选地被取代;r1是r2是任选地被取代的杂芳基、任选地被取代的芳基、任选地被取代的环烷基或任选地被取代的杂环烷基;r3是任选地被取代的杂芳基、任选地被取代的芳基、任选地被取代的环烷基或任选地被取代的杂环烷基;r4是c
1-c6烷基、芳基、杂芳基、环烷基或杂环烷基,其各自任选地被取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基,其中所述烷基或卤代烷基任选地被取代;r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代;并且r
16
是h、c
1-c6烷基或c
1-c3卤代烷基,其中所述烷基或卤代烷基任选地被取代。
[0054]
在一些实施方案中,r2是任选地被取代的环烷基或杂环烷基。在一些实施方案中,r2是任选地被取代的螺环烷基或螺杂环烷基。
[0055]
在一些实施方案中,r2是任选地被取代的芳基。在一些实施方案中,r2是任选地被取代的苯基。在一些实施方案中,r2是任选地被取代的杂芳基。在一些实施方案中,r2是任选地被取代的5元杂芳基。在一些实施方案中,r2是任选地被取代的6元杂芳基。在一些实施方案中,r2是其中r
11
、r
15a
、r
15b
、r
15c
和r
15d
具有它们的在以下指定的含义。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、杂烷基、烷基、烯基、炔基、卤代烷基、烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述杂烷基、烷基、烯基、烷氧基、环烷基、杂环烷基、芳基或杂芳基任选地被取代。在一些实施方案中,r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代。
[0056]
在一个方面,本文提供了一种包含式(x)的化合物或其药学上可接受的盐或溶剂化物:
其中,b1和b各自独立地是键、c
1-c4亚烷基、c
1-c4亚杂烷基或c
3-c6亚环基接头,其中所述亚烷基、亚杂烷基或亚环基任选地被取代;r1是亲电子部分;r3是任选地被取代的杂芳基;r4是c
1-c6烷基、芳基、杂芳基、环烷基或杂环烷基,其各自任选地被取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基,其中所述烷基或卤代烷基任选地被取代;r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代;r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、杂烷基、烷基、烯基、炔基、卤代烷基或烷氧基,其中所述杂烷基、烷基、烯基或炔基任选地被取代;其中任选地,r
15a
和r
11
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;或其中任选地,r
15a
和r
15b
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;并且r
16
是h、c
1-c6烷基或c
1-c3卤代烷基,其中所述烷基或卤代烷基任选地被取代。
[0057]
在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被取代。
[0058]
在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代,其中r
20
是氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、环烷基砜、烷基砜和芳基砜。
[0059]
在一些实施方案中,r1被配置来与3cl蛋白酶相互作用。在一些实施方案中,r1是酰基,诸如卤代乙酰基、乙醛酰基、杂环酰基、氰化乙酰基或丙烯酰基。在一些实施方案中,r1是磺酰基或亚磺酰基,诸如乙烯基磺酰基或乙烯基亚磺酰基。
[0060]
在另一方面,本文提供了一种具有式(x)的结构的化合物或其药学上可接受的盐
或溶剂化物:其中,b1和b各自独立地是键、c
1-c4亚烷基、c
1-c4亚杂烷基或c
3-c6亚环基接头,其中所述亚烷基、亚杂烷基或亚环基任选地被取代;r1是卤代乙酰基、乙醛酰基、杂环酰基、氰化乙酰基、乙烯基磺酰基、乙烯基亚磺酰基或丙烯酰基;r3是任选地被取代的杂芳基;r4是c
1-c6烷基、芳基、杂芳基、环烷基或杂环烷基,其各自任选地被取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代;r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;其中任选地,r
15a
和r
11
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;或其中任选地,r
15a
和r
15b
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环;r
16
是h、c
1-c6烷基或c
1-c3卤代烷基;并且r
20
是氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、环烷基砜、烷基砜和芳基砜。
[0061]
在一些实施方案中,化合物具有式(xa)或其药学上可接受的盐或溶剂化物的结构:
[0062]
在一些实施方案中,化合物具有式(xb)或其药学上可接受的盐或溶剂化物的结构:
[0063]
在一些实施方案中,化合物具有式(xi)或其药学上可接受的盐或溶剂化物的结构:其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是芳基、杂芳基、环烷基或杂环烷基,其各自任选地被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;
每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、环烷基砜、烷基砜和芳基砜。
[0064]
在一些实施方案中,化合物具有式(xi)或其药学上可接受的盐或溶剂化物的结构:其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是被取代的环烷基或任选地被取代的杂环烷基,其中当被取代时,其各自被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
[0065]
在一些实施方案中,化合物具有式(xi)或其药学上可接受的盐或溶剂化物的结构:
其中,b是键、c
1-c4亚烷基或c
3-c6亚环基接头;r1是卤代乙酰基、乙醛酰基、杂环酰基或丙烯酰基;r3是任选地被一个、两个或三个r
18
取代的杂芳基;r4是芳基、杂芳基、环烷基或杂环烷基,其各自任选地被一个、两个、三个或四个r
19
取代;r5是h、c
1-c6烷基或c
1-c3卤代烷基;r
11
是环烷基、杂环烷基、芳基或杂芳基,其中所述环烷基、杂环烷基、芳基或杂芳基中的每一者任选地被一个、两个或三个r
17
取代;r
15a
和r
15c
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代;每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
[0066]
在一些实施方案中,化合物具有式(xia)或其药学上可接受的盐或溶剂化物的结构:
[0067]
在一些实施方案中,化合物具有式(xib)或其药学上可接受的盐或溶剂化物的结构:
[0068]
在一些实施方案中,b或b1独立地是接头。在一些实施方案中,b或b1独立地是c
1-c4亚烷基、c
1-c4亚杂烷基或c
3-c6亚环基接头。
[0069]
在一些实施方案中,b或b1独立地选自:键、键、键、其中每个a单独地是ch或n;并且x是nh、o或s。
[0070]
在一些实施方案中,b是任选地被取代的c
1-c4亚烷基接头。在一些实施方案中,b是c2或c3亚烷基接头。在一些实施方案中,b是-ch
2-、-ch
2-ch
2-或-ch
2-ch
2-ch
2-。在一些实施方案中,b1是c
1-c4亚烷基接头。在一些实施方案中,b1是c2或c3亚烷基接头。在一些实施方案中,b1是-ch
2-、-ch
2-ch
2-或-ch
2-ch
2-ch
2-。
[0071]
在一些实施方案中,b是c
3-c6亚环基接头。在一些实施方案中,b是c3、c4、c5或c6亚环基接头。在一些实施方案中,b是b是在一些实施方案中,b1是c
3-c6亚环基接头。在一些实施方案中,b1是c3、c4、c5或c6亚环基接头。在一些实施方案中,b1是
[0072]
在一些实施方案中,b是键。在一些实施方案中,b1是键。
[0073]
在一些实施方案中,r3是任选地被取代的杂芳基。在一些实施方案中,r3是任选地被一个、两个或三个r
18
取代的杂芳基。在一些实施方案中,r3是未被取代的杂芳基。
[0074]
在一些实施方案中,r3是单环或双环杂芳基。
[0075]
在一些实施方案中,r3是含有1至3个n原子的6元杂芳基。在一些实施方案中,r3是吡啶、嘧啶、吡嗪或哒嗪。在一些实施方案中,r3是吡啶。r3是嘧啶。在一些实施方案中,r3是吡嗪。在一些实施方案中,r3是吡嗪。在一些实施方案中,r3是哒嗪。
[0076]
在一些实施方案中,化合物具有式(xii)或其药学上可接受的盐或溶剂化物的结构:其中,y1、y2、y3和y4各自独立地是ch或n,前提是y1、y2、y3或y4中的至少一者是ch。
[0077]
在一些实施方案中,y2是n;并且y1、y3和y4各自是ch。在一些实施方案中,y2和y4各自是n;并且y1和y3是ch。在一些实施方案中,y1和y4是n;并且y2和y3是ch。在一些实施方案中,y2和y3是n;并且y1和y4是ch。
[0078]
在一些实施方案中,r5是h、c
1-c6烷基或c
1-c3卤代烷基。在一些实施方案中,r5是c
1-c6烷基。在一些实施方案中,r5是h、甲基、乙基、正丙基或异丙基。在一些实施方案中,r5是甲基或乙基。在一些实施方案中,r5是乙基。在一些实施方案中,r5是甲基。在一些实施方案中,r5是h。在一些实施方案中,r5是c
1-c3卤代烷基。在一些实施方案中,r5是-cf3。
[0079]
在一些实施方案中,化合物具有式(xiia)或其药学上可接受的盐或溶剂化物的结构:
[0080]
在一些实施方案中,化合物具有式(xiib)或其药学上可接受的盐或溶剂化物的结构:
[0081]
在一些实施方案中,化合物具有至少80%、85%、90%、95%的ee。在一些实施方案中,化合物具有至少80%的ee。在一些实施方案中,化合物具有至少85%的ee。在一些实施方案中,化合物具有至少90%的ee。在一些实施方案中,化合物具有至少95%的ee。
[0082]
在一些实施方案中,化合物具有约80%至约99%的ee。在一些实施方案中,化合物具有约80%、约85%、约90%或约95%的ee。在一些实施方案中,化合物具有约90%、约91%、约92%、约93%、约94%、约96%、约97%、约98%或约99%的ee。
[0083]
在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基,其中所述烷基、烯基或炔基任选地被一个、两个或三个r
20
取代。
[0084]
在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是c
1-c6烷基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是甲基或叔丁基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是叔丁基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是c
1-c6卤代烷基或c
1-c6烷氧基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是-ocf3。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是-och3。
[0085]
在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、-nh2、br、f、cl、i、-cn、-oh、-ocf3、-cf3、-ch2cf3、-och3、甲基、乙基或叔丁基。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是h、f、br、cl或i。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是br。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是cl。在一些实施方案中,r
15a
、r
15b
、r
15c
和r
15d
各自独立地是f。
[0086]
在一些实施方案中,r
15a
是h。在一些实施方案中,r
15b
是h。在一些实施方案中,r
15c
是h。在一些实施方案中,r
15d
是h。
[0087]
在一些实施方案中,r
15a
和r
11
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环。
[0088]
在一些实施方案中,r
15a
和r
15b
与它们所连接的碳原子组合形成5-6元被取代的或未被取代的环。
[0089]
在一些实施方案中,r
15a
是h;并且r
15b
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基。在一些实施方案中,r
15a
是h;并且r
15b
是-nh2、f、br、cl、i、-cn、-oh、-ocf3、-och3、-cf3、-ch2cf3、甲基、乙基或叔丁基。
[0090]
在一些实施方案中,r
15a
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6卤代烷基或c
1-c6烷氧基;并且r
15b
是h。在一些实施方案中,r
15a
是-nh2、f、br、cl、
i、-cn、-oh、-ocf3、-och3、-cf3、-ch2cf3、甲基、乙基或叔丁基;并且r
15b
是h。
[0091]
在一些实施方案中,r
11
是氨基、卤素、-cn、-oh、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、环烷基、杂环烷基、芳基或杂芳基,其中所述烷基、烷氧基、芳基、环烷基、杂环烷基或杂芳基中的每一者任选地被取代。在一些实施方案中,r
11
是氨基、卤素、-cn、-oh、-ocf3、c
1-c6烷基、c
1-c6卤代烷基或c
1-c6烷氧基,任选地被一个、两个或三个r
17
取代。
[0092]
在一些实施方案中,r
11
是c
1-c6烷基、c
1-c6卤代烷基或c
1-c6烷氧基。
[0093]
在一些实施方案中,r
11
是-ocf3、-och3、甲基、乙基或叔丁基。在一些实施方案中,r
11
是甲基。在一些实施方案中,r
11
是叔丁基。在一些实施方案中,r
11
是-ocf3。在一些实施方案中,r
11
是-och3。在一些实施方案中,r
11
是苯基。在一些实施方案中,r
11
是杂环烷基。在一些实施方案中,r
11
是含有1-2个n、1个o和/或1个s的3至6元杂环烷基。在一些实施方案中,r
11
是卤素。
[0094]
在一些实施方案中,r
11
是-nh2、br、cl、i、f、-cn、-oh、-ocf3、-och3、-cf3、-ch2cf3、甲基、乙基或叔丁基。
[0095]
在一些实施方案中,r
11
不是甲基。在一些实施方案中,r
11
不是叔丁基。
[0096]
在一些实施方案中,当r
15a
与r
15c
均是h时;那么r
11
不是叔丁基。
[0097]
在一些实施方案中,r
11
是任选地被取代的杂芳基。在一些实施方案中,r
11
是杂芳基,任选地被一个、两个或三个r
17
取代。在一些实施方案中,r
11
是未被取代的杂芳基。
[0098]
在一些实施方案中,杂芳基是5元杂芳基。在一些实施方案中,r
11
是呋喃、噻吩、噁唑、噻唑、异噁唑、三唑、噁二唑或噻二唑。在一些实施方案中,r
11
是呋喃。在一些实施方案中,r
11
是噻吩。在一些实施方案中,r
11
是噁唑。在一些实施方案中,r
11
是噻唑。在一些实施方案中,r
11
是异噁唑。在一些实施方案中,r
11
是三唑。在一些实施方案中,r
11
是噁二唑或噻二唑。
[0099]
在一些实施方案中,r4是c
1-c6烷基、芳基、杂芳基、环烷基或杂环烷基,其各自任选地被取代。在一些实施方案中,r4是芳基、杂芳基、环烷基或杂环烷基,其各自任选地被一个、两个、三个或四个r
19
取代。在一些实施方案中,r4是被取代的环烷基或任选地被取代的杂环烷基,其中当被取代时,其各自被一个、两个、三个或四个r
19
取代。
[0100]
在一些实施方案中,r4是环烷基,任选地被一个、两个或三个r
19
取代。在一些实施方案中,环烷基是螺环烷基或稠合环烷基。
[0101]
在一些实施方案中,r4是螺环烷基。在一些实施方案中,r4是c
5-c9螺环烷基。在一些实施方案中,r4是任选地被取代的螺[2.2]戊烷。在一些实施方案中,r4是任选地被取代的螺[2.5]辛烷。在一些实施方案中,r4是任选地被取代的螺[3.5]壬烷。在一些实施方案中,r4是桥接环烷基。在一些实施方案中,r4是c
7-c9桥接环烷基。在一些实施方案中,r4是稠合环烷基。在一些实施方案中,r4是c
7-c9稠合环烷基。在一些实施方案中,r4是稠合环烷基。在一些实施方案中,r4是3-5稠合环烷基。在一些实施方案中,r4是被取代的。在一些实施方案中,环烷基任选地被一个或两个选自cl、br或f的卤素取代。在一些实施方案中,环烷基被两个f取代。在一些实施方案中,环烷基是环丁基、环戊基、环己基或螺[3,3]庚烷基。在一些实施方案中,r4是任选地被取代的环丁基。在一些实施方案中,r4是环戊基。在一些实施方案中,r4是环己基。在一些实施方案中,r4是螺[3,3]庚烷基。
[0102]
在一些实施方案中,r4不是未被取代的环烷基。在一些实施方案中,r4不是环己基。
[0103]
在一些实施方案中,当r
11
是叔丁基时,r4不是环己基。
[0104]
在一些实施方案中,r4是任选地被一个、两个或三个r
19
取代的杂环烷基。在一些实施方案中,r4是包含1、2个n、1个o或1个s原子或其组合的3至7元杂环烷基。
[0105]
在一些实施方案中,r4是任选地被取代的杂芳基(例如c
5-c9杂芳基)。在一些实施方案中,r4是单环杂芳基。在一些实施方案中,r4是稠合杂芳基。在一些实施方案中,r4是任选地被取代的芳基(例如c
6-c
10
芳基)。在一些实施方案中,r4是任选地被取代的苯基。在一些实施方案中,r4是任选地被取代的萘基。
[0106]
在一些实施方案中,每个r
19
独立地是卤素、氧代基、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
[0107]
在一些实施方案中,每个r
19
独立地是-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。在一些实施方案中,每个r
19
独立地是-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、苯基、5或6元杂芳基。在一些实施方案中,每个r
19
独立地是c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基或c
1-6
氟代烷氧基。在一些实施方案中,每个r
19
独立地是-ocf3、-och3、甲基或乙基。在一些实施方案中,每个r
19
独立地是卤素。在一些实施方案中,每个r
19
独立地是cl、br、f或i。在一些实施方案中,每个r
19
是f。
[0108]
在一些实施方案中,r4选自:
[0109]
在一些实施方案中,r4选自:
[0110]
在一些实施方案中,r4是在一些实施方案中,r4是在一些实施方案中,r4是在一些实施方案中,r4是
[0111]
在一些实施方案中,r1也可包括前述取代基,前提是r1的化学部分是能够与半胱氨酸残基形成共价键的亲电子部分。在一些实施方案中,键是可逆的。在一些实施方案中,键是不可逆的。在一些实施方案中,r1是迈克尔受体。r1的具体实例包括丙烯酰胺、乙烯基砜、α-氯酮、α-酮酰胺或本文所述的其他共价修饰剂。
[0112]
在一些实施方案中,r1是卤代乙酰基、乙醛酰基、杂环酰基、氰化乙酰基、乙烯基磺酰基、乙烯基亚磺酰基或丙烯酰基。在一些实施方案中,r1是卤代乙酰基。在一些实施方案中,卤代乙酰基是单取代的或二取代的。在一些实施方案中,卤代乙酰基是单取代的。在一些实施方案中,卤代乙酰基是二取代的。在一些实施方案中,r1是乙酰氯。在一些实施方案中,r1是乙酰氟。在一些实施方案中,r1是乙醛酰基。在一些实施方案中,r1是杂环酰基。在一些实施方案中,r1是氰化乙酰基。在一些实施方案中,r1是乙烯基磺酰基或乙烯基亚磺酰基。在一些实施方案中,r1是丙烯酰基。
[0113]
在一些实施方案中,r1可包括以下中的一者:可包括以下中的一者:其中hal1和hal2是不同的卤素。
[0114]
在一些实施方案中,r1是:
其中hal1和hal2是不同的卤素。
[0115]
在一些实施方案中,hal是卤素,诸如f、cl、br或i。在一些实施方案中,卤素是f或cl。在一些实施方案中,卤素是f。在一些实施方案中,卤素是cl。在一些实施方案中,卤素是br。在一些实施方案中,卤素是i。
[0116]
在一些实施方案中,r1选自选自在一些实施方案中,r1是在一些实施方案中,r1是在一些实施方案中,r1是在一些实施方案中,r1是
[0117]
在一些实施方案中,r
16
是h、c
1-c6烷基或c
1-c3卤代烷基。在一些实施方案中,r
16
是c
1-c6烷基。在一些实施方案中,r
16
是甲基或乙基。在一些实施方案中,r
16
是c
1-c3卤代烷基。在一些实施方案中,r
16
是cf3或ch2cf3。在一些实施方案中,r
16
是h。
[0118]
在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地选自氧代基、卤素、-cn、-nh2、-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-oh、-co2h、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
1-c6烷基、c
1-c6卤代烷基、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。
[0119]
在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是-nh(c
1-6
烷基)、-n(c
1-6
烷基)2、-co
2-c
1-6
烷基、-c(=o)nh2、-c(=o)nh(c
1-6
烷基)、-c(=o)n(c
1-6
烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-6
烷基)、-s(=o)2n(c
1-6
烷基)2、c
3-8
环烷基、c
1-c6杂烷基、c
1-c6烷氧基、c
1-6
氟代烷氧基、c
2-7
杂环烷基、芳基、杂芳基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜。在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基或c
1-6
氟代烷氧基。在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是-ocf3、-och3、甲基或乙基。在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是卤素。在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是cl、br、f或i。在一些实施方案中,每个r
17
、r
18
、r
19
和r
20
独立地是cl、br或f。
[0120]
在一些实施方案中,在结构上显示的r1、r2、r3、r4、r5、r6和/或r7取代基可各自单独地被以下取代基取代,所述取代基独立地是氢、烷基、烯基、炔基、芳基、烷芳基、芳烷基、卤基、羟基、巯基、烷氧基、烯基氧基、炔基氧基、芳基氧基、酰基、烷基羰基、芳基羰基、酰基氧基、烷氧基羰基、芳基氧基羰基、卤代羰基、烷基碳酸根离子基、芳基碳酸根离子基、羧基、羧酸根离子基、氨基甲酰基、单(烷基)取代的氨基甲酰基、二(烷基)取代的氨基甲酰基、单取代的芳基氨基甲酰基、硫代氨基甲酰基、脲基、氰基、异氰基、氰氧基、异氰酸基、异硫氰基、
叠氮基、甲酰基、硫代甲酰基、氨基、单(烷基)和二(烷基)取代的氨基、单(芳基)和二(芳基)取代的氨基、烷基酰胺基、芳基酰胺基、亚氨基、烷基亚氨基、芳基亚氨基、硝基、亚硝基、磺基、磺酸根离子基、烷基硫烷基、芳基硫烷基、烷基亚磺酰基、芳基亚磺酰基、烷基磺酰基、芳基磺酰基、膦酰基、膦酸根离子基、次膦酸根离子基、二氧磷基、膦基、具有或不具有杂原子的任何取代基、其衍生物及其组合。
[0121]
在一些实施方案中,在结构上显示的r1、r2、r3、r4、r5、r6和/或r7取代基可各自单独地被以下取代基取代,所述取代基独立地是氢、卤素、羟基、烷氧基、直链脂族、支链脂族、环状脂族、被取代的脂族、未被取代的脂族、饱和脂族、不饱和脂族、芳族、多环芳族、被取代的芳族、杂芳族、胺、伯胺、仲胺、叔胺、脂族胺、羰基、羧基、酰胺、酯、氨基酸、肽、多肽、其衍生物,被取代或未被取代,或其组合以及其他熟知的化学取代基。
[0122]
在一些实施方案中,在结构上显示的r1、r2、r3、r4、r5、r6和/或r7取代基可各自单独地被以下取代基取代,所述取代基独立地是氢、烷基、烯基、炔基、芳基、烷芳基、芳烷基、卤基、羟基、巯基、烷氧基、烯基氧基、炔基氧基、芳基氧基、酰基、烷基羰基、芳基羰基、酰基氧基、烷氧基羰基、芳基氧基羰基、卤代羰基、烷基碳酸根离子基、芳基碳酸根离子基、羧基、羧酸根离子基、氨基甲酰基、单(烷基)取代的氨基甲酰基、二(烷基)取代的氨基甲酰基、单取代的芳基氨基甲酰基、硫代氨基甲酰基、脲基、氰基、异氰基、氰氧基、异氰酸基、异硫氰基、叠氮基、甲酰基、硫代甲酰基、氨基、单(烷基)和二(烷基)取代的氨基、单(芳基)和二(芳基)取代的氨基、烷基酰胺基、芳基酰胺基、亚氨基、烷基亚氨基、芳基亚氨基、硝基、亚硝基、磺基、磺酸根离子基、烷基硫烷基、芳基硫烷基、烷基亚磺酰基、芳基亚磺酰基、烷基磺酰基、芳基磺酰基、膦酰基、膦酸根离子基、次膦酸根离子基、二氧磷基、膦基、具有或不具有杂原子的任何取代基、包括直链的任何取代基、包括支链的任何取代基和包括环的任何取代基、其衍生物及其组合。
[0123]
在一些实施方案中,在结构上显示的r1、r2、r3、r4、r5、r6和/或r7取代基可各自单独地被以下取代基取代,所述取代基独立地是选自以下的取代基中的任何一者或多者:氢、c
1-c
24
烷基、c
2-c
24
烯基、c
2-c
24
炔基、c
5-c
20
芳基、c
6-c
24
烷芳基、c
6-c
24
芳烷基、卤基、羟基、巯基、c
1-c
24
烷氧基、c
2-c
24
烯基氧基、c
2-c
24
炔基氧基、c
5-c
20
芳基氧基、酰基(包括c
2-c
24
烷基羰基(—co-烷基)和c
6-c
20
芳基羰基(—co-芳基))、酰基氧基(—o-酰基)、c
2-c
24
烷氧基羰基(—(co)—o-烷基)、c
6-c
20
芳基氧基羰基(—(co)—o-芳基)、卤代羰基(—co)—x,当x是卤基时)、c
2-c
24
烷基碳酸根离子基(—o—(co)—o-烷基)、c
6-c
20
芳基碳酸根离子基(—o—(co)—o-芳基)、羧基(—cooh)、羧酸根离子基(—coo-)、氨基甲酰基(—(co)—nh2)、单(c
1-c
24
烷基)取代的氨基甲酰基(—(co)—nh(c
1-c
24
烷基))、二(c
1-c
24
烷基)取代的氨基甲酰基(—(co)—n(c
1-c
24
烷基)2)、单取代的芳基氨基甲酰基(—(co)—nh-芳基)、二取代的芳基氨基甲酰基(—(co)—nh-芳基)2、硫代氨基甲酰基(—(cs)—nh2)、单(c
1-c
24
烷基)取代的硫代氨基甲酰基(—(cs)—nh(c
1-c
24
烷基))、二(c
1-c
24
烷基)取代的硫代氨基甲酰基(—(cs)—n(c
1-c
24
烷基)2)、单取代的芳基硫代氨基甲酰基(—(cs)—nh-芳基)、二取代的芳基硫代氨基甲酰基(—(cs)—nh-芳基)2、脲基(—nh—(co)—nh2)、单(c
1-c
24
烷基)取代的脲基(—nh—(co)—nh(c
1-c
24
烷基))、二(c
1-c
24
烷基)取代的脲基(—nh—(co)—n(c
1-c
24
烷基)2)、单取代的芳基脲基(—nh—(co)—nh-芳基)、二取代的芳基脲基(—nh—(co)—n-(芳基)2)、氰基(—c≡n)、异氰基(—n
+
≡c-)、氰氧基(—o—c≡n)、异氰酸基(—o—n
+
≡c-)、氰硫基
(—s—c≡n)、异硫氰基(—s—n
+
≡c-)、叠氮基(—n
═n+
═
n-)、甲酰基(—(co)—h)、硫代甲酰基(—(cs)—h)、氨基(—nh2)、单(c
1-c
24
烷基)和二(c
1-c
24
烷基)取代的氨基、单(c
6-c
20
芳基)和二(c
6-c
20
芳基)取代的氨基、c
2-c
24
烷基酰胺基(—nh—(co)-烷基)、c
5-c
20
芳基酰胺基(—nh—(co)-芳基)、亚氨基(—cr=nh,其中r是氢、c
1-c
24
烷基、c
5-c
20
芳基、c
6-c
24
烷芳基、c
6-c
24
芳烷基等)、烷基亚氨基(—cr=n(烷基),其中r=氢、c
1-c
24
烷基、芳基、烷芳基、芳烷基等)、芳基亚氨基(—cr
═
n(芳基),其中r=氢、烷基、芳基、烷芳基等)、硝基(—no2)、亚硝基(—no)、磺酸(—so2—oh)、磺酸根离子基(—so2—o-)、c
1-c
24
烷基硫烷基(—s-烷基;也被称为“烷基硫基”)、c
5-c
20
芳基硫烷基(—s-芳基;也被称为“芳基硫基”)、c
1-c
24
烷基亚磺酰基(—(so)-烷基)、c
5-c
20
芳基亚磺酰基(—(so)-芳基)、c
1-c
24
烷基磺酰基(—so
2-烷基)、c
5-c
20
芳基磺酰基(—so
2-芳基)、膦酰基(—p(o)(oh)2)、膦酸根离子基(—p(o)(o-)2)、次膦酸根离子基(-p(o)(o-))、二氧磷基(—po2)、膦基(—ph2)、具有或不具有杂原子(例如n、o、p、s或其他杂原子)的任何取代基,其中所述杂原子可取代碳(例如杂原子取代链或环中的碳)或除此之外进行交换(例如杂原子添加至碳链或环中),包括直链的任何取代基、包括支链的任何取代基和包括环的任何取代基、其衍生物及其组合。
[0124]
在一些实施方案中,r2、r3、r4、r7和/或r8各自独立地选自h、ch3、cf3、chf2、ch2f、c2h5、hal、-cn或任选地被取代的选自以下的部分:c
3-c
12
烷基、c
3-c
12
烯基、环烷基、环烯基、杂环烷基、杂环烯基、芳基、杂芳基、稠合杂环(杂环族)、稠合芳基(例如多芳基)、稠合杂环-芳基、螺环(螺环烷基、螺杂环)或其组合。
[0125]
本文考虑以上对于各种变量所述的基团的任何组合。在整篇说明书中,基团及其取代基由本领域技术人员选择以提供稳定部分和化合物。
[0126]
在一些实施方案中,以下实施例中制备的化合物由外消旋起始物料(和/或中间体)制备,并且通过手性色谱法分离成单个对映异构体作为最终产物或中间体。除非另外陈述,否则应了解分离的中间体和最终化合物的如所绘制的绝对构型是任意指定的而非测定的。
[0127]
本文所述的化合物或药学上可接受的盐或溶剂化物的非限制性实例呈现于表1中。表1.
化合物的其他形式
[0128]
在另一方面,本文所述的化合物具有一个或多个立体中心,并且每个立体中心独立地以r构型或s构型存在。本文提供的化合物包括所有非对映异构形式、对映异构形式和差向异构形式以及它们的适当混合物。本文提供的化合物和方法包括所有顺式(cis)、反式(trans)、顺(syn)、反(anti)、反式(e)和顺式(z)异构体以及它们的适当混合物。在某些实施方案中,本文所述的化合物通过以下方式制备成它们的单个立体异构体:使化合物的外消旋混合物与光学活性拆分剂反应以形成一对非对映异构化合物/盐,分离非对映异构体,以及回收光学纯对映异构体。在一些实施方案中,使用本文所述的化合物的共价非对映异构衍生物进行对映异构体的拆分。在另一实施方案中,基于溶解性差异,通过分离/拆分技术分离非对映异构体。在其他实施方案中,通过色谱法或通过形成非对映异构盐并通过重结晶或色谱法或其任何组合加以分离来进行立体异构体的分离。jean jacques,andre collet,samuel h.wilen,“enantiomers,racemates and resolutions”,john wiley and sons,inc.,1981。在一个方面,通过立体选择性合成获得立体异构体。
[0129]
在一些实施方案中,本文所述的化合物被制备成前药。“前药”是指在体内转化成母体药物的药剂。前药经常是有用的,因为在一些情况下,它们可比母体药物更容易施用。它们可例如通过口服施用达成生物可用,而母体药物不行。与母体药物相比,前药还可在药物组合物中具有改善的溶解性。在一些实施方案中,前药的设计增加有效水溶性。在不加限制下,前药的一实例是本文所述的化合物,其以酯(“前药”)形式施用以有助于跨越细胞膜(在细胞膜中,水溶性对于移动性是有害的)进行传送,但接着其一旦在细胞内部(在细胞内部中,水溶性是有益的),即被代谢水解成羧酸,即活性实体。前药的另一实例可为键合于酸
基团的短肽(聚氨基酸),其中所述肽被代谢以显露活性部分。在某些实施方案中,在体内施用后,前药被化学转化成化合物的生物活性、药物活性或治疗活性形式。在某些实施方案中,前药通过一个或多个步骤或过程被酶促代谢成化合物的生物活性、药物活性或治疗活性形式。
[0130]
在一个方面,前药被设计来改变药物的代谢稳定性或运输特征,掩蔽副作用或毒性,改善药物的风味,或改变药物的其他特征或性质。借助于对体内药物代谢动力学、药物效应动力学过程和药物代谢的认识,一旦得知药物活性化合物,设计所述化合物的前药就是可能的。(参见例如nogrady(1985)medicinal chemistry a biochemical approach,oxford university press,new york,第388-392页;silverman(1992),the organic chemistry of drug design and drug action,academic press,inc.,san diego,第352-401页,rooseboom等人,pharmacological reviews,56:53-102,2004;aesop cho,“recent advances in oral prodrug discovery”,annual reports in medicinal chemistry,第41卷,395-407,2006;t.higuchi和v.stella,pro-drugs as novel delivery systems,a.c.s.研讨会系列(a.c.s.symposium series)的第14卷)。
[0131]
在一些情况下,本文所述的化合物中的一些可为另一衍生物或活性化合物的前药。
[0132]
在一些实施方案中,本文所述的化合物的芳族环部分上的位点易经受各种代谢反应。因此,在芳族环结构上并有适当取代基将降低、最小化或消除这个代谢途径。在具体实施方案中,仅举例来说,用以降低或消除芳族环对代谢反应的易感性的适当取代基是卤素或烷基。
[0133]
在另一实施方案中,本文所述的化合物经同位素标记(例如用放射性同位素)或通过另外其他手段标记,包括但不限于使用发色团或荧光部分、生物发光标记或化学发光标记。
[0134]
本文所述的化合物包括经同位素标记化合物,其与本文提供的各种式和结构中叙述的那些化合物相同,例外之处是一个或多个原子被原子质量或质量数不同于通常在自然界中发现的原子质量或质量数的原子替换。可掺入本发明化合物中的同位素的实例包括氢、碳、氮、氧、硫、氟和氯的同位素,诸如像2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
35
s、
18
f和
36
cl。在一个方面,本文所述的经同位素标记化合物,例如向其中掺入放射性同位素诸如3h和
14
c的那些,可用于药物和/或底物组织分布测定中。在一个方面,用同位素诸如氘进行取代会提供由较大代谢稳定性所致的某些治疗优势,诸如像体内半衰期增加或剂量需求降低。
[0135]
在某些实施方案中,对于一些或所有1h原子,本文公开的化合物中2h原子的丰度是富集的。在一些实施方案中,本文公开的化合物含有一个氘原子。在另一实施方案中,本文公开的化合物含有两个氘原子。在另一实施方案中,本文公开的化合物含有三个氘原子。在另一实施方案中,本文公开的化合物含有四个氘原子。在另一实施方案中,本文公开的化合物含有五个氘原子。在另一实施方案中,本文公开的化合物含有六个氘原子。在另一实施方案中,本文公开的化合物含有超过六个氘原子。在另一实施方案中,本文公开的化合物完全被氘原子取代,并且不含有不可交换的1h氢原子。在一些实施方案中,氘掺入的水平由其中氘化合成砌块用作起始物料的合成方法决定。
[0136]
在额外或其他实施方案中,本文所述的化合物在施用至有需要的生物体后被代谢
以产生代谢物,其接着用于产生所需作用,包括所需治疗作用。
[0137]
如本文所用的“药学上可接受”是指诸如载体或稀释剂的材料不消除化合物的生物活性或性质,并且是相对无毒的,即所述材料可施用至个体而不导致不合需要的生物作用或以有害方式与它含于其中的组合物的任何组分相互作用。
[0138]
术语“药学上可接受的盐”是指化合物的制剂,其不导致对它所施用的生物体的显著刺激,并且不消除所述化合物的生物活性和性质。在一些实施方案中,通过使本文所述的化合物与酸反应获得药学上可接受的盐。还通过使本文所述的化合物与碱反应以形成盐来获得药学上可接受的盐。
[0139]
本文所述的化合物可被形成为药学上可接受的盐,并且/或者以药学上可接受的盐形式使用。药学上可接受的盐的类型包括但不限于:(1)酸加成盐,其通过使化合物的游离碱形式与药学上可接受的:无机酸诸如像盐酸、氢溴酸、硫酸、磷酸、偏磷酸等;或与有机酸诸如像乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、丁二酸、苹果酸、顺丁烯二酸、反丁烯二酸、三氟乙酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲烷磺酸、乙烷磺酸、1,2-乙烷二磺酸、2-羟基乙烷磺酸、苯磺酸、甲苯磺酸、2-萘磺酸、4-甲基双环-[2.2.2]辛-2-烯-1-甲酸、葡庚糖酸、4,4
’‑
亚甲基双-(3-羟基-2-烯-1-甲酸)、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡萄糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸、丁酸、苯基乙酸、苯基丁酸、丙戊酸等反应来形成;(2)当存在于母体化合物中的酸性质子被金属离子例如碱金属离子(例如锂、钠、钾)、碱土金属离子(例如镁或钙)或铝离子替换时形成的盐。在一些情况下,本文所述的化合物可与有机碱诸如但不限于乙醇胺、二乙醇胺、三乙醇胺、缓血酸胺、n-甲基还原葡糖胺、二环己胺、三(羟甲基)甲胺配位。在其他情况下,本文所述的化合物可与氨基酸诸如但不限于精氨酸、赖氨酸等形成盐。用于与包括酸性质子的化合物形成盐的可接受的无机碱包括但不限于氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠、氢氧化钠等。
[0140]
药学上可接受的盐的实例包括通过本文所述的化合物与矿物酸、有机酸或无机碱的反应制备的那些盐,此类盐包括乙酸盐、丙烯酸盐、己二酸盐、海藻酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、亚硫酸氢盐、溴化物、丁酸盐、丁炔-1,4-二酸盐、樟脑酸盐、樟脑磺酸盐、己酸盐、辛酸盐、氯苯甲酸盐、氯化物、柠檬酸盐、环戊烷丙酸盐、癸酸盐、二葡萄糖酸盐、磷酸二氢盐、二硝基苯甲酸盐、十二烷基硫酸盐、乙烷磺酸盐、甲酸盐、反丁烯二酸盐、葡萄糖庚酸盐、甘油磷酸盐、乙醇酸盐、半硫酸盐、庚酸盐、己酸盐、己炔-1,6-二酸盐、羟基苯甲酸盐、γ-羟基丁酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙烷磺酸盐、碘化物、异丁酸盐、乳酸盐、顺丁烯二酸盐、丙二酸盐、甲烷磺酸盐、扁桃酸盐、偏磷酸盐、甲烷磺酸盐、甲氧基苯甲酸盐、甲基苯甲酸盐、磷酸一氢盐、1-萘磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、扑酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐、丙酸盐、焦硫酸盐、焦磷酸盐、丙炔酸盐、邻苯二甲酸盐、苯基乙酸盐、苯基丁酸盐、丙烷磺酸盐、水杨酸盐、丁二酸盐、硫酸盐、亚硫酸盐、丁二酸盐、辛二酸盐、癸二酸盐、磺酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一酸盐和二甲苯磺酸盐。
[0141]
此外,本文所述的化合物可制备成通过使化合物的游离碱形式与药学上可接受的无机或有机酸反应形成的药学上可接受的盐,所述药学上可接受的无机或有机酸包括但不限于无机酸,诸如盐酸、氢溴酸、硫酸、硝酸、磷酸、偏磷酸等;以及有机酸,诸如乙酸、丙酸、
己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、丁二酸、苹果酸、顺丁烯二酸、反丁烯二酸、对甲苯磺酸、酒石酸、三氟乙酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、芳基磺酸、甲烷磺酸、乙烷磺酸、1,2-乙烷二磺酸、2-羟基乙烷磺酸、苯磺酸、2-萘磺酸、4-甲基双环-[2.2.2]辛-2-烯-1-甲酸、葡庚糖酸、4,4
’‑
亚甲基双-(3-羟基-2-烯-1-甲酸)、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡萄糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸和粘康酸。
[0142]
在一些实施方案中,包含游离酸基团的本文所述的那些化合物与药学上可接受的金属阳离子的适合碱,诸如氢氧化物、碳酸盐、碳酸氢盐或硫酸盐;与氨;或与药学上可接受的有机伯胺、仲胺、叔胺或季胺反应。代表性盐包括碱金属或碱土金属盐,如锂、钠、钾、钙以及镁和铝盐等。碱的说明性实例包括氢氧化钠、氢氧化钾、氢氧化胆碱、碳酸钠、n
+
(c
1-4
烷基)4等。
[0143]
可用于形成碱加成盐的代表性有机胺包括乙胺、二乙胺、乙二胺、乙醇胺、二乙醇胺、哌嗪等。应了解,本文所述的化合物还包括它们含有的任何碱性含氮基团的季铵化。在一些实施方案中,通过这种季铵化获得水或油可溶性或可分散性产物。
[0144]
应了解提及药学上可接受的盐包括溶剂加成形式,特别是溶剂化物。溶剂化物含有化学计算量或非化学计算量的溶剂,并且可在结晶过程期间与药学上可接受的溶剂诸如水、乙醇等一起形成。当溶剂是水时,形成水合物,或当溶剂是醇时,形成醇化物。本文所述的化合物的溶剂化物可在本文所述的过程期间方便地制备或形成。此外,本文提供的化合物可以未溶剂化形式以及溶剂化形式存在。一般来说,出于本文提供的化合物和方法的目的,溶剂化形式被视为等效于未溶剂化形式。
[0145]
在一些实施方案中,本文所述的化合物以溶剂化物形式存在。本公开内容提供了通过施用此类溶剂化物来治疗疾病的方法。本公开内容还提供了通过以药物组合物形式施用此类溶剂化物来治疗疾病的方法。
[0146]
溶剂化物含有化学计算量或非化学计算量的溶剂,并且在一些实施方案中,在结晶过程期间与药学上可接受的溶剂诸如水、乙醇等一起形成。当溶剂是水时,形成水合物,或当溶剂是醇时,形成醇化物。本文所述的化合物的溶剂化物可在本文所述的过程期间方便地制备或形成。此外,本文提供的化合物可以未溶剂化形式以及溶剂化形式存在。一般来说,出于本文提供的化合物和方法的目的,溶剂化形式被视为等效于未溶剂化形式。因此,本公开内容的一个方面涉及如本文所述的本公开内容的化合物和/或它们的药学上可接受的盐的水合物和溶剂化物,所述水合物和溶剂化物可加以分离并通过本领域中已知的方法来表征,所述方法诸如是热解重量分析(tga)、tga-质谱分析法、tga-红外光谱法、粉末x射线衍射(pxrd)、卡尔费歇尔(karl fisher)滴定、高分辨率x射线衍射等。治疗方法
[0147]
在另一方面,本文提供了一种治疗或预防有需要的患者的sars-cov-2感染的方法,所述方法包括向所述患者施用本文所述的化合物或包含化合物的药物组合物,所述化合物例如是式a*、a、x、ix、xi、xii、i、ii、iii或iv化合物。
[0148]
在一些实施方案中,将本文公开的化合物预防性地施用至对象。在一些实施方案中,对象在诊断sars-cov-2感染之前被怀疑患有sars-cov-2感染。
[0149]
在一些实施方案中,将本公开内容的化合物施用至对象直至感染得到治疗、抑制
或减轻。在一些实施方案中,将化合物施用至对象直至sars-cov-2感染的一种或多种症状减轻。
[0150]
在另一方面,本文提供了一种抑制病毒性感染的方法,所述方法包括对所述感染提供本文公开的化合物以便抑制所述病毒性感染。在一些实施方案中,病毒性感染由sars-cov-2引起。
[0151]
在另一方面,本文提供了一种通过与其蛋白质结合来抑制sars-cov-2的方法,所述方法包括对sars-cov-2提供本文公开的化合物以便抑制所述sars-cov-2。在一些实施方案中,sars-cov-2结合至sars-cov-2上的蛋白酶。在一些实施方案中,本文公开的化合物与主要蛋白酶的半胱氨酸残基结合,由此抑制sars-cov-2。在一些实施方案中,半胱氨酸残基在主要蛋白酶的位置145处。在一些实施方案中,蛋白酶是3cl。施用和药物组合物
[0152]
本文所述的化合物可用于用以抑制sars-cov-2的药物组合物中以抑制sars-cov-2感染。本文所述的化合物可被配制用于通过如本文所述的任何适合途径施用至患有或被怀疑患有sars-cov-2感染的对象。本文所述的化合物可用于通过抑制sars-cov-2来治疗对象。
[0153]
在一些实施方案中,提供了一种药物组合物,所述药物组合物包括用于治疗疾患的有效量的inscov化合物的任何实施方案的化合物(或其药学上可接受的盐);其中所述疾患是sars-cov-2感染。
[0154]“有效量”是指化合物或组合物的为产生所需作用所需的量。有效量的一个实例包括产生对于治疗(药物)用途来说可接受的毒性和生物利用度水平的量或剂量,所述治疗(药物)用途包括但不限于治疗被称为covid-19的sars-cov-2(2019-ncov)感染。
[0155]
如本文所用的术语“有效量”或“治疗有效量”是指所施用的剂或化合物的足够量,所述足够量将在一定程度上缓解所治疗的疾病或疾患的一种或多种症状。结果可为疾病的体征、症状或病因的减轻和/或缓和,或生物系统的任何其他所需改变。举例来说,用于治疗用途的“有效量”是包含如本文公开的化合物的组合物的为提供疾病症状的临床显著减轻所需的量。有效量的一个实例包括产生对于治疗(药物)用途来说可接受的毒性和生物利用度水平的量或剂量,所述治疗(药物)用途包括但不限于治疗被称为covid-19的sars-cov-2(2019-ncov)感染。“减轻”一种或多种症状(以及这个短语的语法等效形式)意指降低所述一种或多种的严重性或频率,或消除所述一种或多种症状。药物的“预防有效量”是药物的在施用至对象时,将具有预定预防作用的量,所述预防作用例如是预防或延迟损伤、疾病、病变或疾患的发作(或复发),或降低损伤、疾病、病变或疾患或它们的症状的发作(或复发)的可能性。通过施用一次剂量未必会发生完全预防作用,而是可能只有在施用一系列剂量之后发生。因此,可以一次或多次施用来施用预防有效量。如本文所用的“活性降低量”是指相对于不存在拮抗剂,降低酶的活性所需的拮抗剂的量。如本文所用的“功能破坏量”是指相对于不存在拮抗剂,破坏酶或蛋白质的功能所需的拮抗剂的量。精确量将取决于治疗目的,并且将可由本领域技术人员使用已知技术确定(参见例如lieberman,pharmaceutical dosage forms(第1-3卷,1992);lloyd,the art,science and technology of pharmaceutical compounding(1999);pickar,dosage calculations(1999);以及remington:the science and practice of pharmacy,第20版,2003,gennaro编,
williams&wilkins1999),所述文献通过引用并入本文用于此公开内容。
[0164]
如本文所用的药物组合物是指本文公开的化合物与其他化学组分(即药学上可接受的非活性成分)的混合物,所述其他化学组分诸如是载体、赋形剂、粘合剂、填充剂、助悬剂、调味剂、甜味剂、崩解剂、分散剂、表面活性剂、润滑剂、着色剂、稀释剂、增溶剂、湿润剂、增塑剂、稳定剂、渗透增强剂、润湿剂、消泡剂、抗氧化剂、防腐剂或其一种或多种组合。药物组合物有助于化合物向生物体的施用。
[0165]
本文所述的药物制剂可通过多种施用途径以多种方式施用至对象,所述施用途径包括但不限于口服、胃肠外(例如静脉内、皮下、肌肉内、髓内注射、鞘内、直接室内、腹膜内、淋巴内、鼻内注射)、鼻内、经颊、表面或经皮施用途径。本文所述的药物制剂包括但不限于水性液体分散液、自乳化分散液、固溶体、脂质体分散液、气雾剂、固体剂型、粉剂、立即释放制剂、控制释放制剂、快速熔融制剂、片剂、胶囊、丸剂、延迟释放制剂、延长释放制剂、脉冲释放制剂、多颗粒制剂和混合立即释放和控制释放制剂。
[0166]
在一些实施方案中,口服(po)施用本文公开的化合物。在一些实施方案中,以片剂、胶囊或丸剂形式口服施用本文公开的化合物。
[0167]
在一些实施方案中,通过吸入施用本文公开的化合物。在一些实施方案中,本文公开的化合物被配制用于鼻内施用。此类制剂包括鼻喷剂、鼻喷雾等。
[0168]
在一些实施方案中,本文公开的化合物被制备成经皮剂型。
[0169]
在一些实施方案中,本文公开的化合物被配制成适于肌肉内、皮下或静脉内注射的药物组合物。在一些实施方案中,肌肉内施用化合物。在一些实施方案中,皮下(sq)施用化合物。在一些实施方案中,静脉内(iv)施用化合物。
[0170]
在任何以上提及的方面是包括单次施用有效量的化合物的其他实施方案,包括以下其他实施方案:其中(i)一次施用化合物;(ii)在一天的跨度内多次将化合物施用至对象;(iii)频繁地施用;或(iv)连续地施用。在一些实施方案中,一天一次、一天两次(bid)或一天三次(tid)施用化合物。
[0171]
在任何以上提及的方面是包括多次施用有效量的化合物的其他实施方案,包括以下其他实施方案:其中(i)连续地或间歇地施用化合物:如以单次剂量;(ii)多次施用之间的时间是每6小时;(iii)每8小时将化合物施用至哺乳动物;(iv)每12小时将化合物施用至哺乳动物;(v)每24小时将化合物施用至哺乳动物。在其他或替代性实施方案中,方法包括休药期,其中暂时中止化合物的施用,或暂时降低所施用的化合物的剂量;在所述休药期结束时,重新开始化合物的给药。在一个实施方案中,休药期的时长从2天至1年变化。
[0172]
在一些实施方案中,施用化合物直至sars-cov-2得到治疗。在一些实施方案中,施用化合物直至sars-cov-2的一种或多种症状减轻或消退。定义
[0173]
在以下描述中,阐述某些具体细节以提供对各种实施方案的彻底了解。然而,本领域技术人员将了解本发明可在没有这些细节的情况下加以实践。在其他情况下,熟知的结构尚未详细显示或描述以避免不必要地使实施方案的描述费解。除非上下文另外要求,否则在整篇说明书和随后的权利要求中,词语“包含(comprise)”及其变化形式诸如“包含(comprises)”和“包含(comprising)”应以开放、包括性的意义解释,也就是说,解释为“包括但不限于”。此外,本文提供的标题仅为了方便起见,并且不阐释要求保护的本发明的范
(c
1-c4烷基)、-c(=o)nh2、-c(=o)nh(c
1-c4烷基)、-c(=o)n(c
1-c4烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-c4烷基)、-s(=o)2n(c
1-c4烷基)2、c
1-c4烷基、c
3-c6环烷基、c
1-c4氟代烷基、c
1-c4杂烷基、c
1-c4烷氧基、c
1-c4氟代烷氧基、-sc
1-c4烷基、-s(=o)c
1-c4烷基和-s(=o)2(c
1-c4烷基)。在一些实施方案中,任选的取代基独立地选自d、卤素、-cn、-nh2、-oh、-nh(ch3)、-n(ch3)2、-nh(环丙基)、-ch3、-ch2ch3、-cf3、-och3和-ocf3。
[0180]
术语氨基是指总体带电荷或净不带电荷的化学基团,其中r基团可为取代基,诸如本文所述的取代基。
[0181]
如本文所用的术语“烷基”或“脂族”是指通常但未必含有1至约24个碳原子的支链或无支链饱和烃基团,诸如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、辛基、癸基等,以及环烷基,诸如环戊基、环己基等。通常,但同样未必,本文中的烷基含有1至约18个碳原子,或1至约12个碳原子。术语“低级烷基”意指具有1至6个碳原子的烷基。标识为“c
1-c6烷基”或“低级烷基”的取代基含有1至3个碳原子,并且此类取代基含有1或2个碳原子(即甲基和乙基)。“被取代的烷基”是指被一个或多个取代基团取代的烷基,并且术语“含有杂原子的烷基”和“杂烷基”是指其中至少一个碳原子被杂原子替换的烷基,如下文更详细所述。如果不另外指示,那么术语“烷基”和“低级烷基”分别包括直链、支链、环状、未被取代、被取代和/或含有杂原子的烷基或低级烷基。
[0182]
如本文所用的术语“烯基”是指含有至少一个双键的具有2至约24个碳原子的直链、支链或环状烃基团,诸如乙烯基、正丙烯基、异丙烯基、正丁烯基、异丁烯基、辛烯基、癸烯基、十四碳烯基、十六碳烯基、二十碳烯基、二十四碳烯基等。通常,但同样未必,本文中的烯基含有2至约18个碳原子,或2至12个碳原子。术语“低级烯基”意指具有2至6个碳原子的烯基,并且专用术语“环烯基”意指环状烯基或具有5至8个碳原子。术语“被取代的烯基”是指被一个或多个取代基团取代的烯基,并且术语“含有杂原子的烯基”和“杂烯基”是指其中至少一个碳原子被杂原子替换的烯基。如果不另外指示,那么术语“烯基”和“低级烯基”分别包括直链、支链、环状、未被取代、被取代和/或含有杂原子的烯基和低级烯基。
[0183]
如本文所用的术语“炔基”是指含有至少一个三键的具有2至24个碳原子的直链或支链烃基团,诸如乙炔基、正丙炔基等。通常,但同样未必,本文中的炔基含有2至约18个碳原子,或2至12个碳原子。术语“低级炔基”意指具有2至6个碳原子的炔基。术语“被取代的炔基”是指被一个或多个取代基团取代的炔基,并且术语“含有杂原子的炔基”和“杂炔基”是指其中至少一个碳原子被杂原子替换的炔基。如果不另外指示,那么术语“炔基”和“低级炔基”分别包括直链、支链、未被取代、被取代和/或含有杂原子的炔基和低级炔基。
[0184]
如本文所用的术语“烷氧基”意指通过单一末端醚键结合的烷基;也就是说,“烷氧基”可表示为—o-烷基,其中烷基如上所定义。“低级烷氧基”意指含有1至6个碳原子的烷氧基,并且包括例如甲氧基、乙氧基、正丙氧基、异丙氧基、叔丁基氧基等。本文中的标识为“c
1-c6烷氧基”或“低级烷氧基”的取代基含有1至3个碳原子,并且此类取代基含有1或2个碳原子(即甲氧基和乙氧基)。除非另外陈述,否则“烷氧基”可任选地被取代,例如被以上陈述的取代基团取代。在一些实施方案中,烷氧基被一个或多个卤素取代。
[0185]
如本文所用,术语“环烷基”是指碳原子链,其一部分形成环。环烷基可指稳定的部分或完全饱和单环或多环碳环,其可包括稠合(当与芳基或杂芳基环稠合时,环烷基通过非芳族环原子键合)、桥接或螺环系统。应了解,在包括环烷基的实施方案中,这些实施方案的
说明性变化形式包括低级环烷基,诸如c3-c8环烷基、环丙基、环己基、3-乙基环戊基等。代表性环烷基包括但不限于具有三至十五个碳原子(c
3-c
15
环烷基)、三至十个碳原子(c
3-c
10
环烷基)、三至八个碳原子(c
3-c8环烷基)、三至六个碳原子(c
3-c6环烷基)、三至五个碳原子(c
3-c5环烷基)或三至四个碳原子(c
3-c4环烷基)的环烷基。在一些实施方案中,环烷基是3至6元环烷基。在一些实施方案中,环烷基是5至6元环烷基。单环环烷基包括例如环丙基、环丁基、环戊基、环己基、环庚基和环辛基。多环环烷基或碳环包括例如金刚烷基、降冰片基、十氢萘基、双环[3.3.0]辛烷、双环[4.3.0]壬烷、顺式-十氢化萘、反式-十氢化萘、双环[2.1.1]己烷、双环[2.2.1]庚烷、双环[2.2.2]辛烷、双环[3.2.2]壬烷以及双环[3.3.2]癸烷和7,7-二甲基-双环[2.2.1]庚烷基。部分饱和的环烷基包括例如环戊烯基、环己烯基、环庚烯基和环辛烯基。除非在说明书中另外具体陈述,否则环烷基任选地被取代,例如被氧代基、卤素、氨基、腈、硝基、羟基、烷基、烯基、炔基、卤代烷基、烷氧基、芳基、环烷基、杂环烷基、杂芳基等取代。在一些实施方案中,环烷基任选地被氧代基、卤素、甲基、乙基、-cn、-cf3、-oh、-ome、-nh2或-no2取代。在一些实施方案中,环烷基任选地被氧代基、卤素、甲基、乙基、-cn、-cf3、-oh或-ome取代。在一些实施方案中,环烷基任选地被卤素取代。
[0186]
如本文所用,术语“环烯基”是指不饱和碳原子链,其一部分形成环。应了解,在包括环烯基的实施方案中,这些实施方案的说明性变化形式包括低级环烯基,诸如c
3-c8、c
3-c6环烯基。
[0187]
如本文所用,术语“亚烷基”是指饱和碳原子链,其可任选地有支链。应了解,在包括亚烷基的实施方案中,这些实施方案的说明性变化形式包括低级亚烷基,诸如c
2-c4亚烷基、亚甲基、亚乙基、亚丙基、3-甲基亚戊基等。
[0188]“杂烷基”是指其中烷基的一个或多个骨架原子选自除碳以外的原子例如氧、氮(例如-nh-、-n(烷基)-)、硫或其组合的烷基。杂烷基在所述杂烷基的碳原子处连接于分子的其余部分。在一个方面,杂烷基是c
1-c6杂烷基,其中所述杂烷基包含1至6个碳原子和一个或多个除碳以外的原子,例如氧、氮(例如-nh-、-n(烷基)-)、硫或其组合,其中所述杂烷基在所述杂烷基的碳原子处连接于分子的其余部分。这种杂烷基的实例是例如-ch2och3、-ch2ch2och3、-ch2ch2och2ch2och3或-ch(ch3)och3。除非在说明书中另外具体陈述,否则杂烷基任选地例如被氧代基、卤素、氨基、腈、硝基、羟基、烷基、烯基、炔基、卤代烷基、烷氧基、芳基、环烷基、杂环烷基、杂芳基等取代。在一些实施方案中,杂烷基任选地被氧代基、卤素、甲基、乙基、-cn、-cf3、-oh、-ome、-nh2或-no2取代。在一些实施方案中,杂烷基任选地被氧代基、卤素、甲基、乙基、-cn、-cf3、-oh或-ome取代。在一些实施方案中,杂烷基任选地被卤素取代。
[0189]
如本文所用,术语“杂环族”或“杂环”是指碳和杂原子的链,其中所述杂原子选自氮、氧和硫,并且所述链的一部分(至少一个杂原子)形成环。术语“杂环”可包括“芳族杂环”与“非芳族杂环”两者。杂环包括4-7元单环和8-12元稠环、诸如咪唑基、噻唑基、噁唑基、噁嗪基、噻嗪基、二硫杂环己烷基、二氧杂环己烷基、异噁唑基、异噻唑基、三唑基、呋喃基、四氢呋喃基、二氢呋喃基、吡喃基、四唑基、吡唑基、吡嗪基、哒嗪基、咪唑基、吡啶基、吡咯基、二氢吡咯基、吡咯烷基、哌啶基、哌嗪基、嘧啶基、吗啉基、四氢噻吩基、噻吩基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丙烷基、氧杂环丙烷基、氮杂环丙烷基、吲哚基等。“杂环”可任选地在能够携带氢原子的任何一个或多个位置处被取代。
[0190]
除非在说明书中另外具体陈述,否则杂环或杂环基可为单环、双环、三环或四环环系统,其任选地包括稠合、桥接或螺环环系统。杂环或杂环基中的杂原子任选地被氧化。如果存在,那么一个或多个氮原子任选地被季铵化。杂环或杂环基可为部分或完全饱和的。杂环或杂环基可通过一个或多个环的任何原子连接于分子的其余部分。此类杂环或杂环基的实例包括但不限于二氧杂环戊烷基、噻吩基[1,3]二硫杂环己烷基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三硫杂环己烷基、四氢吡喃基、硫代吗啉基、噻吗啉基、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在说明书中另外具体陈述,否则术语杂环或杂环基包括任选地被一个或多个取代基取代的那些,所述一个或多个取代基选自烷基、烯基、炔基、卤基、氟代烷基、氧代基、硫代基、氰基、硝基、任选地被取代的芳基、任选地被取代的芳烷基、任选地被取代的芳烯基、任选地被取代的芳炔基、任选地被取代的碳环基、任选地被取代的碳环基烷基、任选地被取代的杂环基、任选地被取代的杂环基烷基、任选地被取代的杂芳基、任选地被取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-cn、-r
b-o-r
e-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t是1或2)、-r
b-s(o)
t
ra(其中t是1或2)、-r
b-s(o)
t
ora(其中t是1或2)和-r
b-s(o)
t
n(ra)2(其中t是1或2),其中每个ra独立地是氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟代烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地是直接键或直链或支链亚烷基或亚烯基链,并且re是直链或支链亚烷基或亚烯基链,并且其中除非另外指示,否则以上取代基中的每一者是未被取代的。
[0191]
如本文所用,并且除非另外指定,否则术语“芳基”是指含有单一芳族环或稠合在一起、直接连接或间接连接(以致不同芳族环结合于共同基团诸如亚甲基或亚乙基部分)的多个芳族环的芳族取代基。芳基的实例含有5至20个碳原子,并且芳基含有5至14个碳原子。示例性芳基含有一个芳族环或两个稠合或连接的芳族环,例如苯基、萘基、联苯、二苯基醚、二苯基胺、二苯甲酮等。“被取代的芳基”是指被一个或多个取代基团取代的芳基部分,并且术语“含有杂原子的芳基”和“杂芳基”是指其中至少一个碳原子被杂原子替换的芳基取代基,如将在下文更详细描述。如果不另外指示,那么术语“芳基”包括未被取代、被取代和/或含有杂原子的芳族取代基。术语“芳基”包括单环和多环芳族碳环基团,其各自可任选地被取代。术语“任选地被取代的芳基”是指碳原子的芳族单环或多环,诸如苯基、萘基等,其可任选地被一个或多个独立选择的取代基取代,所述取代基诸如是卤基、羟基、氨基、烷基或烷氧基、烷基磺酰基、氰基、硝基等。
[0192]
术语“杂芳基”或“芳族杂环”可包括被取代的或未被取代的芳族单环结构,在一些实施方案中5至7元环,以及在一些实施方案中5至6元环,其环结构包括至少一个杂原子,优选是一至四个杂原子,更优选是一个或两个杂原子。术语“杂芳基”还可包括具有一个或两
个环的环系统,其中至少一个环是杂芳族,例如其他环可为环烷基、环烯基、环炔基、芳族碳环、杂芳基和/或杂环。杂芳基包括例如吡咯、呋喃、噻吩、咪唑、噁唑、噻唑、异噁唑、吡唑、吡啶、吡嗪、哒嗪、吲哚、苯并呋喃、苯并噁唑、苯并噻唑、苯并咪唑和嘧啶。
[0193]
示例性杂芳基可包含一个或多个碳原子和一个或多个选自氮、氧、磷和硫的环杂原子,以及至少一个芳族环。在一些实施方案中,杂芳基是包含一至十三个碳原子、一至六个选自氮、氧、磷和硫的杂原子的5至14元环系统基团。杂芳基可为单环、双环、三环或四环环系统,其可包括稠合(当与环烷基或杂环烷基环稠合时,杂芳基通过芳族环原子键合)或桥接环系统;并且杂芳基中的氮、碳或硫原子可任选地被氧化;氮原子可任选地被季铵化。在一些实施方案中,杂芳基是5至10元杂芳基。在一些实施方案中,杂芳基是5至6元杂芳基。实例包括但不限于氮杂环庚三烯基、吖啶基、苯并咪唑基、苯并噻唑基、苯并吲哚基、苯并间二氧杂环戊烯基、苯并呋喃基、苯并噁唑基、苯并噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂环庚烯基、1,4-苯并二噁烷基、苯并萘并呋喃基、苯并噁唑基、苯并间二氧杂环戊烯基、苯并二氧杂环己二烯基、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并噻吩基(benzothienyl/benzothiophenyl)、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、吲哚啉基、异吲哚啉基、异喹啉基、吲哚嗪基、异噁唑基、萘啶基、噁二唑基、2-氧代氮杂环庚三烯基、噁唑基、氧杂环丙烷基、1-氧负离子基吡啶基、1-氧负离子基嘧啶基、1-氧负离子基吡嗪基、1-氧负离子基哒嗪基、1-苯基-1h-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基、喹啉基、奎宁环基、异喹啉基、四氢喹啉基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基和噻吩基(thiophenyl)(即噻吩基(thienyl))。除非在说明书中另外具体陈述,否则杂芳基任选地被取代,例如被卤素、氨基、腈、硝基、羟基、烷基、烯基、炔基、卤代烷基、烷氧基、芳基、环烷基、杂环烷基、杂芳基等取代。在一些实施方案中,杂芳基任选地被卤素、甲基、乙基、-cn、-cf3、-oh、-ome、-nh2或-no2取代。在一些实施方案中,杂芳基任选地被卤素、甲基、乙基、-cn、-cf3、-oh或-ome取代。在一些实施方案中,杂芳基任选地被卤素取代。
[0194]
应了解,烷基、环烷基、烯基、环烯基、亚烷基和杂环中的每一者可任选地被独立选择的基团取代,所述独立选择的基团诸如是烷基、卤代烷基、羟基烷基、氨基烷基、羧酸及其衍生物(包括酯、酰胺和腈)、羟基、烷氧基、酰基氧基、氨基、烷基和二烷基氨基、酰基氨基、硫基等以及其组合。
[0195]
术语“螺”或“螺环”是指具有一个原子作为两个环的唯一共同成员的化合物或部分。
[0196]
如本文所用的术语“芳基氧基”是指通过单一末端醚键结合的芳基,其中“芳基”如上所定义。“芳基氧基”可表示为—o-芳基,其中芳基如上所定义。芳基氧基的实例含有5至20个碳原子,并且芳基氧基含有5至14个碳原子。芳基氧基的实例包括但不限于苯氧基、邻卤基-苯氧基、间卤基-苯氧基、对卤基-苯氧基、邻甲氧基-苯氧基、间甲氧基-苯氧基、对甲氧基-苯氧基、2,4-二甲氧基-苯氧基、3,4,5-三甲氧基-苯氧基等。
[0197]
术语“烷芳基”是指具有烷基取代基的芳基,并且术语“芳烷基”是指具有芳基取代基的烷基,其中“芳基”和“烷基”如上所定义。芳烷基的实例含有6至24个碳原子,并且芳烷
基含有6至16个碳原子。芳烷基的实例包括但不限于苯甲基、2-苯基-乙基、3-苯基-丙基、4-苯基-丁基、5-苯基-戊基、4-苯基环己基、4-苯甲基环己基、4-苯基环己基甲基、4-苯甲基环己基甲基等。烷芳基包括例如对甲基苯基、2,4-二甲基苯基、对环己基苯基、2,7-二甲基萘基、7-环辛基萘基、3-乙基-环戊二烯并-1,4-二烯等。
[0198]
术语“环族”是指脂环族或芳族取代基,其可或可不被取代和/或含有杂原子,并且可为单环、双环或多环的。
[0199]
术语“卤基”和“卤素”以常规意义用于指代氯基、溴基、和氟基或碘基取代基。
[0200]
如“含有杂原子的烷基”(也被称为“杂烷基”)或“含有杂原子的芳基”(也被称为“杂芳基”)中的术语“含有杂原子的”是指其中一个或多个碳原子被除碳以外的原子(例如氮、氧、硫、磷或硅,通常是氮、氧或硫)替换的分子、键联或取代基。类似地,术语“杂烷基”是指含有杂原子的烷基取代基,术语“杂环族”是指含有杂原子的环状取代基,术语“杂芳基”和“杂芳族”分别是指含有杂原子的“芳基”和“芳族”取代基,以此类推。杂烷基的实例包括烷氧基芳基、烷基硫烷基取代的烷基、n-烷基化氨基烷基等。杂芳基取代基的实例包括吡咯基、吡咯烷基、吡啶基、喹啉基、吲哚基、嘧啶基、咪唑基、1,2,4-三唑基、四唑基等,并且含有杂原子的脂环族基团的实例是吡咯烷子基、吗啉代基、哌嗪子基、哌啶子基等。
[0201]
术语“烃基”是指含有1至约30个碳原子、或1至约24个碳原子、或1至约18个碳原子、或约1至12个碳原子的单价烃基,包括直链、支链、环状、饱和和不饱和种类,诸如烷基、烯基、芳基等。“被取代的烃基”是指被一个或多个取代基团取代的烃基,并且术语“含有杂原子的烃基”是指其中至少一个碳原子被杂原子替换的烃基。除非另外指示,否则术语“烃基”应解释为包括被取代和/或含有杂原子的烃基部分。
[0202]
如本文所用的术语“任选地被取代”或“任选地有支链”或“任选的取代基”意指所讨论的基团未被取代或被指定的取代基中的一者或多者取代。当所讨论的基团被超过一个取代基取代时,取代基可相同或不同。此外,当使用术语“独立地”、“独立地是”和“独立选自”时,意指所讨论的基团可相同或不同。某些本文定义的术语可在结构中出现超过一次,并且在这种出现后,每个术语应独立于其他术语加以定义。在一些实施方案中,术语“任选地被取代”或“被取代”意指提及的基团可被一个或多个单独地和独立地选自以下的额外基团取代:烷基、卤代烷基、环烷基、芳基、杂芳基、杂环烷基、-oh、烷氧基、芳基氧基、烷基硫基、芳基硫基、烷基亚砜、芳基亚砜、烷基砜、芳基砜、-cn、炔烃、c
1-c6烷基炔烃、卤素、酰基、酰基氧基、-co2h、-co2烷基、硝基和氨基,包括单取代和二取代的氨基(例如-nh2、-nhr、-nr2),及其经保护衍生物。在一些实施方案中,任选的取代基独立地选自烷基、烷氧基、卤代烷基、环烷基、卤素、-cn、-nh2、-nh(ch3)、-n(ch3)2、-oh、-co2h和-co2烷基。在一些实施方案中,任选的取代基独立地选自氟基、氯基、溴基、碘基、-ch3、-ch2ch3、-cf3、-och3和-ocf3。在一些实施方案中,被取代的基团被先前基团中的一者或两者取代。在一些实施方案中,脂族碳原子(无环或环状)上的任选的取代基包括氧代基(=o)。
[0203]
如本文所用,c
1-c
x
(或c
1-x
)包括c
1-c2、c
1-c3...c
1-c
x
。仅举例来说,指定为“c
1-c
4”的基团指示在部分中存在一至四个碳原子,即基团含有1个碳原子、2个碳原子、3个碳原子或4个碳原子。因此,仅举例来说,“c
1-c4烷基”指示在烷基中存在一至四个碳原子,即烷基选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。此外,举例来说,c
0-c2亚烷基包括直接键、-ch
2-和-ch2ch
2-键联。
[0204]“互变异构体”是指质子从分子的一个原子移动至同一分子的另一原子。本文提供的化合物可以互变异构体形式存在。互变异构体是可通过氢原子的迁移来互相转化的化合物,所述迁移伴有单键和相邻双键的转换。在其中有可能发生互变异构的键合排列中,将存在互变异构体的化学平衡。考虑本文公开的化合物的所有互变异构形式。互变异构体的精确比率取决于若干因素,包括温度、溶剂和ph。互变异构互相转化的一些实例包括:
[0205]
所有其他化学术语都如本领域中所知来定义。
[0206]
本领域技术人员将了解,对于本文公开的这个和其他过程和方法,在过程和方法中执行的功能可按不同顺序实施。此外,概述的步骤和操作仅作为实例提供,并且在不有损于公开的实施方案的本质的情况下,一些步骤和操作可为任选的,合并成较少步骤和操作,或扩展成额外步骤和操作。
[0207]
就本技术中所述的意图作为各个方面的说明的特定实施方案而言,本公开内容将不受限制。如将对本领域技术人员来说显而易见,可在不脱离本技术的精神和范围的情况下作出许多修改和变化。除本文列举的那些方法和设备之外,在本公开内容的范围内的功能等效方法和设备将根据先前描述而对本领域技术人员来说显而易见。此类修改和变化意图属于随附权利要求的范围。本公开内容将仅受随附权利要求的条款以及此类权利要求有权享有的等效物的全部范围限制。应了解,本公开内容不限于特定方法、试剂、化合物组合物或生物系统,其当然可变化。还应了解本文所用的术语仅出于描述特定实施方案的目的,并且不意图是限制性的。
[0208]
关于本文中基本上任何复数和/或单数术语的使用,本领域技术人员可在适于上下文和/或应用时从复数转换成单数,以及/或者从单数转换成复数。为明晰起见,各种单数/复数排列可在本文中被明确阐述。
[0209]
本领域人员将了解,一般来说,在本文中,并且尤其是在随附权利要求(例如随附权利要求的主体)中所用的术语通常意图作为“开放”术语(例如术语“包括”应解释为“包括但不限于”,术语“具有”应解释为“至少具有”,术语“包括”应解释为“包括但不限于”,等等)。本领域人员将进一步了解,如果意图表示具体数目的所引入的权利要求叙述物,那么此种意图将在权利要求中明确叙述,并且在不存在这种叙述下,不存在这种意图。举例来说,作为对理解的辅助,以下随附权利要求可含有引导性短语“至少一个(种)”和“一个(种)或多个(种)”的使用以引入权利要求叙述物。然而,此类短语的使用不应解释为暗示通过不定冠词“一个(种)(a/an)”引入权利要求叙述物将含有这样的所引入的权利要求叙述物的任何特定权利要求限于仅含有一个(种)这样的叙述物的实施方案,即使当同一权利要求包括引导性短语“一个(种)或多个(种)”或“至少一个(种)”和不定冠词诸如“一个(种)(a/
an)”时(例如“一个(种)(a/an)”应解释为意指“至少一个(种)”或“一个(种)或多个(种)”;这也适用于用于引入权利要求叙述物的定冠词的使用)。此外,即使明确叙述具体数目的所引入的权利要求叙述物,本领域技术人员也将认识到这种叙述应解释为意指至少所叙述数目(例如在无其他修饰语的情况下单纯叙述“两个(种)叙述物”意指至少两个(种)叙述物,或两个(种)或更多个(种)叙述物)。此外,在其中使用与“a、b和c等中的至少一者”类似的惯例的那些情况下,一般来说,此种结构意图在本领域技术人员将理解所述惯例的意义上(例如“具有a、b和c中的至少一者的系统”将包括但不限于具有单独a、单独b、单独c、a和b一起、a和c一起、b和c一起和/或a、b和c一起的系统,等等)。在其中使用与“a、b或c等中的至少一者”类似的惯例的那些情况下,一般来说,此种结构意图在本领域技术人员将理解所述惯例的意义上(例如“具有a、b或c中的至少一者的系统”将包括但不限于具有单独a、单独b、单独c、a和b一起、a和c一起、b和c一起和/或a、b和c一起的系统,等等)。本领域人员将进一步了解,实际上任何呈现两个或更多个替代性术语的转折词语和/或短语,无论在说明书、权利要求还是附图中,都应被理解为考虑包括所述术语中的一者、所述术语中的任一者或两个术语的可能性。举例来说,短语“a或b”应被理解为包括“a”或“b”或“a和b”的可能性。
[0210]
此外,当以马库什群组(markush group)描述本公开内容的特征或方面时,本领域技术人员将认识到本公开内容还由此以马库什群组的任何单个成员或成员的子组描述。
[0211]
如将由本领域技术人员所了解,出于任何和所有目的,诸如就提供书面描述而言,本文公开的所有范围都还涵盖其任何和所有可能的子范围以及子范围的组合。任何所列范围都可被容易地认为是充分描述和使得能够达成所述范围分解成至少相等的两份、三份、四份、五份、十份等。作为一非限制性实例,本文讨论的每个范围可容易地分解成下三分之一、中三分之一和上三分之一等。如也将由本领域技术人员所了解,诸如“至多”、“至少”等的所有措辞都包括所叙述数值,并且是指可随后分解成如上讨论的子范围的范围。最后,如将由本领域技术人员所了解,范围包括每个单独的成员。因此,举例来说,具有1-3个单元的群组是指具有1、2或3个单元的群组。类似地,具有1-5个单元的群组是指具有1、2、3、4或5个单元的群组,以此类推。
[0212]
如本文所用的术语“共同施用”等意图涵盖将所选治疗剂施用至单一患者,并且意图包括其中通过相同或不同施用途径或在相同或不同时间施用药剂的治疗方案。
[0213]
如本文所用的术语“药物组合”意指由混合或组合超过一种活性成分所产生的产品,并且包括活性成分的固定组合与非固定组合两者。术语“固定组合”意指活性成分,例如式(i)化合物和共同药剂,均以单一实体或剂量的形式同时施用至患者。术语“非固定组合”意指活性成分,例如式(i)化合物和共同药剂,以单独实体形式同时、并行或依序在无特定居间时限下施用至患者,其中这种施用在患者的身体内提供有效水平的两种化合物。后者也适用于鸡尾酒疗法,例如施用三种或更多种活性成分。
[0214]
如本文所用的术语“治疗(treat/treating/treatment)”包括预防性地和/或治疗性地缓和、减弱或改善疾病或疾患的至少一种症状;预防额外症状;抑制疾病或疾患,例如遏止疾病或疾患的发展;减轻疾病或疾患;导致疾病或疾患的消退;减轻由疾病或疾患引起的状况;或停止疾病或疾患的症状。
[0215]
术语“方案”是指施用用于治疗本文所述的疾病、病症或疾患的一种或多种疗法(例如本文所述的组合或另一活性剂诸如像本文所述的抗癌剂)的给药和时间选择方案。方
案可包括如本领域中所知的积极施用时期和停药时期。
[0216]
根据前述内容,应了解本公开内容的各种实施方案已出于说明的目的在本文中加以描述,并且可在不脱离本公开内容的范围和精神的情况下作出各种修改。因此,本文公开的各种实施方案不意图是限制性的,真正的范围和精神由权利要求指示。
[0217]
本文叙述的所有参考文献都通过具体引用以它们的全文并入本文:u.s.2011/0269834、u.s.2017/0313685;和wo 2010/022455。实施例
[0218]
应了解以下实施例意图说明而非限制本公开内容。在不脱离本公开内容的精神和范围的情况下,各种其他实施例和对先前描述和实施例的修改将在阅读本公开内容之后对本领域技术人员来说显而易见,并且意图所有此类实施例或修改都包括在随附权利要求的范围内。本文提及的所有出版物和专利都在此通过引用以它们的全文并入本文。
[0219]
实施例1.一般性合成方法
[0220]
在其他实施方案中,用于本文所述的化合物的合成的起始物料和试剂是合成的,或从商业来源诸如但不限于sigma-aldrich、fisher scientific(fisher chemicals)和acros organics获得。
[0221]
本文所述的化合物和具有不同取代基的其他相关化合物使用本文所述的技术和材料以及本领域中认可的那些技术和材料合成,这些技术和材料诸如描述在例如以下中:fieser and fieser’s reagents for organic synthesis,第1-17卷(john wiley and sons,1991);rodd’s chemistry of carbon compounds,第1-5卷和增刊(elsevier science publishers,1989);organic reactions,第1-40卷(john wiley and sons,1991),larock’scomprehensive organic transformations(vch publishers inc.,1989),march,advanced organic chemistry第4版,(wiley 1992);carey和sundberg,advanced organic chemistry第4版,第a和b卷(plenum 2000,2001),以及green和wuts,protective groups in organic synthesis第3版,(wiley 1999)(其全都通过引用并入本文用于这种公开)。用于制备如本文公开的化合物的一般性方法可源于反应,并且反应可通过使用适当试剂和条件来修改,以引入见于如本文提供的式中的各种部分。作为指导,可利用以下合成方法。
[0222]
本文报告的产率是指纯化产物(除非指定)。分析型tlc在merck硅胶60f
254
铝背衬板上进行。通过紫外光使化合物显现,并且/或者用碘、茚三酮或高锰酸钾溶液染色,随后加热。快速柱色谱法在硅胶上进行。在具有5mm dul(双)
13
c探头的bruker 400mhz avance ii波谱仪和具有bbfo(宽带氟观察)探头的bruker 400mhz avance iii hd波谱仪上记录1h-nmr图谱。化学位移(δ)以百万分率(ppm)指示,以在其中制备样品的氘化溶剂峰为参考。裂分形态指定为s(单峰)、d(双重峰)、t(三重峰)、q(四重峰)、m(多重峰)和br s(宽单峰)。
[0223]
以下溶剂、试剂或科学术语可通过它们的缩写来提及:dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷dea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二乙胺etoac或ea
ꢀꢀꢀꢀꢀꢀ
乙酸乙酯etoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱法
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱法-质谱测定法mecn或acn
ꢀꢀꢀꢀꢀꢀ
乙腈meoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇mtbe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基叔丁基醚pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚sfc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
超临界流体色谱法thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃tlc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄层色谱法ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升mmol
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫摩尔h
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟g
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
克mg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫克eq
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
当量rt或rt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
室温(25)cf3ch2oh
ꢀꢀꢀꢀꢀꢀꢀꢀ
2,2,2-三氟甲醇ticl4ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
氯化钛(v)tea或et3n
ꢀꢀꢀꢀꢀꢀ
三乙胺ipa或i-proh
ꢀꢀꢀꢀ
异丙醇
[0224]
在一个方面,本文所述的化合物按照方案1中的用于制备inscov系列的所例示乌吉(ugi)型反应合成。
[0225]
方案1
[0226]
用于制备inscov系列的一般性程序。在25℃下,向2-氯乙酸(1.00eq)和异腈(1.00eq)在2,2,2-三氟乙醇(7ml/mmol)中的溶液中添加胺(1.00eq)和醛(1.00eq)。在25℃下将混合物搅拌1h。lc-ms显示胺完全消耗,并且检测到一个具有所需质量的主峰。减压蒸发溶剂以产生残余物。一般性纯化方法在以下列出。
[0227]
纯化a:将残余物通过制备型hplc来纯化。
[0228]
纯化b:将残余物溶解于10ml etoac中,并且用10ml水洗涤,接着分离,并且将有机相经无水na2so4干燥,过滤。将有机相真空浓缩以产生粗产物。将粗产物从溶剂进行研磨。
[0229]
在一些实施方案中,以下实施例中制备的化合物由外消旋起始物料(和/或中间体)制备,并且通过手性色谱法分离成单个对映异构体作为最终产物或中间体。除非另外陈述,否则应了解分离的中间体和最终化合物的如所绘制的绝对构型是任意指定的而非测定
的。在一些实施方案中,对映异构体的如所绘制的绝对立体化学是任意指定的。在一些实施方案中,合成两种对映异构体。
[0230]
在一些实施方案中,基于建模和活性数据指定立体化学。从建模视角来看,r-异构体倾向于更容易结合蛋白酶,而s-异构体可由于姿势不良而是非活性的。对于某些化合物,手性构型通过x射线研究或通过手性合成来确认。举例来说,通过结合模式的x射线确认inscov-601i(1)呈r-构型。举例来说,以下化合物的第二手性中心基于手性起始物料来指定:inscov-600b(1)、600b(2)、600c(1)、600c(2)、601q、601r和601s。作为另一实例,来自inscov-601q的异腈组分的第二手性中心基于手性起始物料来指定。
[0231]
实施例2.inscov-517a、inscov-517(1a)和inscov-517a(1b)的合成
[0232]
方案2
[0233]
步骤1:在0℃下,在惰性氛围下,向2-氨基-5-(三氟甲氧基)苯甲腈1(20g,98.90mmol)和嘧啶-5-甲醛2(11.80g,109mmol)在二氯甲烷(2l)中的搅拌溶液中添加三乙胺(30g,297mmol)和ticl4(9.38g,49.50mmol)。在室温下将反应混合物搅拌2h。在反应完成(tlc监测)之后,将反应混合物用冰冷的水(2l)稀释并用二氯甲烷(2
×
2l)萃取。将合并的有机层用盐水溶液(3l)洗涤,经na2so4干燥,过滤并减压蒸发以得到粗制(e)-2-((嘧啶-5-基亚甲基)氨基)-5-(三氟甲氧基)苯甲腈7,将其通过快速色谱法(硅胶,120g snap)来纯化,使用5%乙酸乙酯/庚烷洗脱剂,以得到呈淡黄色固体的所需产物(18g,56%)。
[0234]1h nmr(400mhz,dmso d6):δ9.38(s,1h),9.30(s,2h),8.87(s,1h),8.10(s,1h),7.88-7.86(d,j=8.8hz,1h)和7.66-7.64(d,j=9.2hz,1h。lcms=[m+h]
+
:(293.05),纯度=93%。
[0235]
步骤2:在室温下,在惰性氛围下,向2-氯乙酸5(4.85g,51.3mmol)在cf3ch2oh(50ml)中的搅拌溶液中添加(e)-2-((嘧啶-5-基亚甲基)氨基)-5-(三氟甲氧基)苯甲腈7(5.0g,17.1mmol)和1,1-二氟-4-异氰基环己烷8(4.97g,34.2mmol)。在室温下将反应混合物搅拌48h。在反应完成(tlc监测)之后,将反应混合物用水(50ml)稀释,并且用乙酸乙酯(2
×
250ml)萃取。将合并的有机层用盐水溶液(250ml)洗涤,经na2so4干燥,过滤并减压蒸发以
得到粗产物,将其通过柱色谱法(硅胶,100-200目)来纯化,使用35%乙酸乙酯/庚烷洗脱剂,以获得呈棕色固体的2-氯-n-(2-氰基-4-(三氟甲氧基)苯基)-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)乙酰胺(inscov-517a)(350mg,74%纯度)。将获得的化合物通过反相纯化来进一步纯化以得到呈白色固体的所需产物inscov-517a(150mg,2%)。
[0236]1h nmr(400mhz,dmso d6):δ9.15-8.78(m,1h),8.47(s,2h),8.37-8.35(d,j=7.2hz,1h),8.27-8.25(d,j=8.0hz,1h),7.92-7.81(m,2h),6.19-6.04(m,1h),4.23-4.05(m,2h),3.82-3.62(m,1h),2.02-1.95(m,1h),1.92-1.79(m,4h),1.71-1.64(m,1h),1.55-1.46(m,1h)和1.34-1.22(m,1h)。lcms=[m+h]
+
:(532.16),纯度=99.60%。
[0237]
步骤3:inscov-517a的手性hplc纯化:inscov-517a(1a)和inscov-517a(1b)。将2-氯-n-(2-氰基-4-(三氟甲氧基)苯基)-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)乙酰胺(inscov-517a,180mg)通过手性hplc来纯化,使用(柱:chiralpak ig(250*21)mm,5μm;流动相:a-i-proh(25%)和b-己烷(75%);流动模式:等度,上样量:5mg/进样,运行时间:20min,波长:234nm,样品制备:乙腈和i-proh),以产生呈白色固体的inscov-517a(1a)(65mg,72%)和inscov-517a(1b)(80mg,80%)。
[0238]
inscov-517a(1a):1h nmr(400mhz,dmso d6):δ9.15-8.78(m,1h),8.48(s,2h),8.36-8.34(d,j=7.2hz,1h),8.27-8.25(d,j=8.0hz,1h),7.91-7.82(m,2h),6.29-6.07(m,1h),4.23-4.05(m,2h),3.82-3.62(m,1h),2.02-1.95(m,1h),1.92-1.79(m,4h),1.71-1.64(m,1h),1.55-1.46(m,1h),1.34-1.22(m,1h)。lcms=[m+h]
+
:(532.16),纯度=97.20%。手性纯度:99.2%ee。
[0239]
inscov-517a(1b):1h nmr(400mhz,dmso d6):δ9.15-8.78(m,1h),8.46(s,2h),8.36-8.34(d,j=7.2hz,1h),8.27-8.25(d,j=8.0hz,1h),7.92-7.81(m,2h),6.29-6.07(m,1h),4.23-4.05(m,2h),3.82-3.62(m,1h),2.02-1.95(m,1h),1.92-1.79(m,4h),1.71-1.64(m,1h),1.55-1.46(m,1h),1.34-1.22(m,1h)。lcms=[m+h]
+
:(532.16),纯度=97.8%。手性纯度:99.70%ee。
[0240]
实施例3.inscov-517c、inscov-517c(1)、inscov-517c(2)、inscov-517c(3)和inscov-517c(4)的合成
[0241]
方案3
[0242]
步骤1:在室温下,在惰性氛围下,向2-氯-2-氟乙酸6(5.39g,47.9mmol)在cf3ch2oh(50ml)中的搅拌溶液中添加(e)-2-((嘧啶-5-基亚甲基)氨基)-5-(三氟甲氧基)苯甲腈3(7.0g,47.9mmol)和1,1-二氟-4-异氰基环己烷4(6.95g,47.9mmol)。在室温下将反应混合物搅拌48h。在反应完成(tlc监测)之后,将反应混合物用水(250ml)稀释,并且用乙酸乙酯(2
×
250ml)萃取。将合并的有机层用盐水溶液(300ml)洗涤,经na2so4干燥,过滤并减压蒸发以得到粗产物,将其通过柱色谱法(硅胶,100-200目)来纯化,使用25%乙酸乙酯/庚烷洗脱剂,以得到呈棕色固体的所需产物(1.40g,72%纯度),将其通过反相纯化来进一步纯化以得到呈白色固体的所需产物inscov-517c(非对映异构体的混合物)(822mg,6.27%)。
[0243]1h nmr(400mhz,dmso d6):δ9.17-8.79(m,1h),8.45-8.40(m,2h),8.38-8.36(m,1h),8.30-8.17(m,1h),7.94-7.88(m,2h),6.89-6.75(m,1h),6.24-6.00(m,1h),3.81(br s,1h),1.99-1.66(m,6h),1.48-1.36(m,1h),1.26-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=99.09%
[0244]
步骤2:inscov-517c的非对映异构分离以得到inscov-517c(d1)和inscov-517c(d2)。将2-氯-n-(2-氰基-4-(三氟甲氧基)苯基)-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-2-氟乙酰胺(inscov-517c,822mg)通过反相纯化来纯化,并且分离出两种非对映异构体inscov-517c(d1)[305mg,74%]和inscov-517c(d2)[317mg,77%]。
[0245]
inscov-517c(d1):1h nmr(400mhz,dmso d6):δ9.24-8.79(m,1h),8.45(s,2h),8.38-8.36(d,j=7.2hz,1h),8.30-8.28(d,j=7.2hz,1h),7.95-7.92(m,2h),6.89-6.72(m,1h),6.11(s,1h),3.77(br s,1h),1.98-1.68(m,6h),1.52-1.45(m,1h),1.41-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=99.72%。
[0246]
inscov-517c(d2):1h nmr(400mhz,dmso d6):δ9.24-8.84(m,1h),8.44(s,2h),8.41-8.39(d,j=7.2hz,1h),8.28-8.26(d,j=7.2hz,1h),7.95-7.88(m,2h),6.87-6.56(m,1h),6.24(s,1h),3.83(br s,1h),1.98-1.68(m,6h),1.52-1.45(m,1h),1.41-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=98.8%。
[0247]
步骤3:inscov-517c(d1)的手性分离:inscov-517c(1)和inscov-517c(2)。使用(柱:chiralpak ig(250*30)mm,5μm;流动相:a-etoh(15%)和b-0.1%甲酸己烷溶液(85%);流动模式:等度,上样量:20mg/进样,运行时间:35min,波长:230nm,样品制备:乙腈
和i-proh)进行inscov-517c(d1)[305mg]的手性hplc纯化以产生呈白色固体的inscov-517c(1)[88mg,58%]和inscov-517c(2)[55mg,35%]。
[0248]
inscov-517c(1):1h nmr(400mhz,dmso d6):δ9.22-8.88(m,1h),8.45(s,2h),8.38-8.36(d,j=7.2hz,1h),8.30-8.28(d,j=7.2hz,1h),7.95-7.63(m,2h),6.89-6.72(m,1h),6.11(s,1h),3.77(br s,1h),1.98-1.87(m,6h),1.70-1.66(m,1h),1.51-1.45(m,1h)。lcms=[m+h]
+
:(550.18),纯度=99.8%。手性纯度:99.4%ee。
[0249]
inscov-517c(2):1h nmr(400mhz,dmso d6):δ9.17-8.79(m,1h),8.45(s,2h),8.38-8.36(d,j=7.2hz,1h),8.30-8.28(d,j=7.2hz,1h),7.95-7.88(m,2h),6.89-6.72(m,1h),6.11(s,1h),3.77(br s,1h),1.98-1.68(m,6h),1.52-1.45(m,1h),1.41-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=98.8%。手性纯度:99.7%ee。
[0250]
步骤4:inscov-517c(d2)的手性分离:inscov-517c(3)和inscov-517c(4)。使用(柱:chiralpak ig(250*30)mm,5μm;流动相:a-etoh(20%)和b-0.1%甲酸己烷溶液(80%);流动模式:等度,上样量:20mg/进样,运行时间:20min,波长:230nm,样品制备:乙腈和i-proh)进行inscov-517c(d2)[317mg]的手性hplc纯化以产生呈白色固体的inscov-517c(3)[110mg,70%]和inscov-517c(4)[105mg,66%]。
[0251]
inscov-517c(3):1h nmr(400mhz,dmso d6):δ9.17-8.84(m,1h),8.44(s,2h),8.40-8.38(d,j=7.2hz,1h),8.28-8.26(d,j=7.2hz,1h),7.94-7.88(m,2h),6.87-6.68(m,1h),6.27(s,1h),3.82(br s,1h),1.98-1.68(m,6h),1.52-1.45(m,1h),1.41-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=97.41%。手性纯度:98.5%ee。
[0252]
inscov-517c(4):1h nmr(400mhz,dmso d6):δ9.24-8.87(m,1h),8.44(s,2h),8.41-8.39(d,j=7.2hz,1h),8.28-8.26(d,j=7.2hz,1h),7.95-7.88(m,2h),6.87-6.68(m,1h),6.24(s,1h),3.81(br s,1h),1.98-1.68(m,6h),1.52-1.45(m,1h),1.41-1.23(m,1h)。lcms=[m+h]
+
:(550.18),纯度=98.90%。手性纯度:99.82%ee。
[0253]
实施例4. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-501a)的合成
[0254]
方案4
[0255]
在25℃下,向2-氯乙酸(87mg,0.925mmol)和异氰基环己烷(101mg,0.925mmol)在2,2,2-三氟乙醇(7ml)中的溶液中添加4-(噁唑-5-基)苯胺(148mg,0.925mmol)和嘧啶-5-甲醛(100mg,0.925mmol)。在25℃下将混合物搅拌1h。lc-ms显示4-(噁唑-5-基)苯胺完全消耗,并且检测到一个具有所需质量的主峰。减压蒸发溶剂以产生残余物。将粗产物用meoh(15ml)研磨,并且用meoh(3ml
×
3)洗涤。将滤饼真空浓缩。将残余物用水(10ml)稀释并冻干以产生产物。获得了呈白色固体的inscov-501a(264.74mg,574.76μmol,62.13%产率)。
[0256]1h nmr(400mhz,dmso-d6)δ=8.95(s,1h),8.51-8.40(m,3h),8.20(d,j=7.6hz,1h),7.72(s,1h),7.67-7.61(m,2h),7.49-7.43(m,1h),6.10(s,1h),4.15-3.94(m,2h),
3.68-3.52(m,1h),1.81-1.46(m,5h),1.35-0.94(m,5h)。lcms:m/z 454.3[m+h]
+
,纯度=98.5%
[0257]
实施例5. 2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-501i)的合成
[0258]
根据用于制备inscov-501a(实施例4)的程序合成2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺。将粗产物用mtbe(20ml
×
2)研磨并过滤。接着将它用meoh(6ml)研磨并过滤。获得了呈灰白色固体的inscov-501i(214.09mg,426.40μmol,46.09%产率)。
[0259]1h nmr:(400mhz,dmso-d6)δ=8.96(s,1h),8.49(s,2h),8.45(s,1h),8.31(d,j=7.6hz,1h),7.71(s,1h),7.65-7.63(m,2h),7.43(br s,1h),6.07(s,1h),4.11-3.97(m,2h),3.90-3.74(m,1h),2.05-1.71(m,6h),1.59-1.30(m,2h)。lcms:m/z 490.3[m+h]
+
,纯度=98.9%。
[0260]
实施例6.inscov-600j、inscov-600j(1)和inscov-600j(2)的合成
[0261]
方案5
[0262]
步骤1:根据用于制备inscov-501a(实施例4)的程序合成2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(异噁唑-5-基)苯基)乙酰胺。将粗产物用mtbe(20ml
×
2)研磨并过滤。获得了呈黄色固体的inscov-600j(165.79mg,338.42μmol,36.58%产率)。
[0263]1h nmr:(400mhz,dmso-d6)δ=8.97(s,1h),8.66(d,j=2.0hz,1h),8.50(s,2h),8.34(d,j=7.6hz,1h),7.82-7.80(m,2h),7.50-7.49(m,2h),7.06(d,j=1.9hz,1h),6.09(s,1h),4.16-4.00(m,2h),3.92-3.75(m,1h),2.06-1.72(m,6h),1.61-1.45(m,1h),1.43-1.29(m,1h)。lcms:m/z 490.2[m+h]
+
,纯度=100%。
[0264]
步骤2:inscov-600j的手性sfc纯化:inscov-600j(1)和inscov-600j(2)。通过手性sfc(柱:daicel chiralpak ig(250*30mm,10μm);流动相:[neu-meoh];b%:40%-40%,6.2;60min)分离inscov-600j.(100mg,204.12μmol,1eq),并且真空浓缩。获得了呈黄色固体的第一峰inscov-600j(1)(28.97mg,59.13μmol,28.97%产率)。获得了呈黄色固体的第二峰inscov-600j(2)(22.10mg,45.11μmol,22.10%产率)。
[0265]
inscov-600j(1):1h nmr:(400mhz,dmso-d6)δ=8.97(s,1h),8.66(d,j=2.0hz,
1h),8.50(s,2h),8.33(d,j=7.4hz,1h),7.82-7.79(m,2h),7.50(br s,2h),7.05(d,j=1.8hz,1h),6.09(s,1h),4.15-3.99(m,2h),3.89-3.78(m,1h),2.04-1.73(m,6h),1.59
ꢀ‑
1.47(m,1h),1.42-1.30(m,1h)。lcms:m/z 490.3[m+h]
+
,纯度=96.3%。手性纯度:98.5%ee。
[0266]
inscov-600j(2):1h nmr:(400mhz,dmso-d6)δ=8.97(s,1h),8.66(d,j=2.0hz,1h),8.50(s,2h),8.33-8.31(m,1h),7.82-7.79(m,2h),7.61-7.35(m,2h),7.05(d,j=1.8hz,1h),6.09(s,1h),4.13-3.97(m,2h),3.91-3.77(m,1h),2.02-1.72(m,6h),1.59
ꢀ‑
1.47(m,1h),1.43-1.32(m,1h)。lcms:m/z 490.3[m+h]
+
,纯度=99.6%。手性纯度:99.0%ee。
[0267]
实施例7.inscov-600k、inscov-600k(1)和inscov-600k(2)的合成
[0268]
方案6
[0269]
步骤1:向4-碘苯胺(216.16mg,986.95μmol,1eq)和5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)噻唑(250mg,1.18mmol,1.2eq)在二噁烷(7.5ml)和h2o(2.5ml)中的溶液中添加na2co3(261.51mg,2.47mmol,2.5eq)和pd(pph3)4(57.02mg,49.35μmol,0.05eq)。在80℃下,在n2下,将混合物搅拌12h。lcms显示检测到一个具有所需质量的峰。tlc(pe/ea=3/1)显示4-碘苯胺被消耗,并且形成三个新斑点。将反应混合物用水(20ml)稀释,并且用etoac(20ml*3)萃取。将合并的有机层经无水na2so4干燥,过滤并减压浓缩以产生残余物。将残余物通过柱色谱法(sio2,pe:ea=20:1至2:1)来纯化。获得了呈黄色固体的4-(噻唑-5-基)苯胺(0.15g,92.1%纯度,79.5%产率)。
[0270]
lcms:m/z 177.2[m+h]
+
,纯度=92.1%。
[0271]
步骤2:向2-氯乙酸(188.82mg,2.00mmol,224.79μl,1.2eq)和嘧啶-5-甲醛(0.18g,1.67mmol,1eq)在cf3ch2oh(10ml)中的溶液中添加1,1-二氟-4-异氰基环己烷(241.70mg,1.67mmol,1eq)和4-(噻唑-5-基)苯胺(293.46mg,1.67mmol,1eq)。在25℃下将反应混合物搅拌1h。lcms显示4-(噻唑-5-基)苯胺完全消耗,并且检测到一个具有所需质量的新峰。将反应混合物真空浓缩。将反应混合物用mtbe(20ml)研磨,并且用mtbe(10ml*3)洗涤。将滤饼真空浓缩。将残余物用mtbe(20ml)稀释,并且用mtbe(10ml*3)洗涤。将滤饼真空浓缩。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噻唑-5-基)苯基)乙酰胺inscov-600k(177.26mg,332.75μmol,19.98%产率)。
[0272]1h nmr(400mhz,dmso-d6)δ=9.09(s,1h),8.97(s,1h),8.50(s,2h),8.37-8.28(m,2h),7.64(d,j=8.8hz,2h),7.51-7.09(m,2h),6.07(s,1h),4.12-3.97(m,2h),3.90-3.78(m,1h),2.04-1.70(m,6h),1.58-1.25(m,2h)。lcms:m/z 506.3[m+h]
+
,纯度=93.0%。
[0273]
步骤3:inscov-600k的手性sfc纯化:inscov-600k(1)和inscov-600k(2)。将inscov-600k(49mg)通过sfc分离(柱:daicel chiralpak ad(250mm*30mm,10μm);流动相:[neu-meoh];b%:50%-50%,4min;20min)来纯化,并且真空浓缩(《35℃)。获得了呈黄色固体的第一峰inscov-600k(1)(13mg,24.49μmol,25%产率,95.32%纯度)。获得了呈黄色固体的第二峰inscov-600k(2)(10mg,19.11μmol,19.7%产率,96.71%纯度)。
[0274]
inscov-600k(1):1h nmr(400mhz,dmso-d6)δ=9.19-8.84(m,2h),8.51(s,2h),8.33(s,2h),7.64(d,j=6.4hz,2h),7.40(s,2h),6.08(s,1h),4.09-4.01(m,2h),3.83(d,j=1.6hz,1h),2.05-1.71(m,6h),1.61-1.29(m,2h)。lcms:m/z 506.3[m+h]
+
,纯度=99.1%。手性纯度:100%ee。
[0275]
inscov-600k(2):1h nmr(400mhz,dmso-d6)δ=9.18-8.87(m,2h),8.51(s,2h),8.40-8.24(m,2h),7.63(d,j=8.4hz,2h),7.40(s,2h),6.08(s,1h),4.20-3.96(m,2h),3.92-3.72(m,1h),2.05-1.68(m,6h),1.62-1.47(m,1h),1.43-1.30(m,1h)。lcms:m/z 506.2[m+h]
+
,纯度=100%。手性纯度:100%ee。
[0276]
实施例8.inscov-601g、inscov-601g(1)和inscov-601g(2)的合成
[0277]
方案7
[0278]
步骤1:向4-(噻唑-5-基)苯胺(150mg,851.12μmol,1eq)和4,4-二氟环己烷-1-甲腈(123.54mg,851.12μmol,1eq)在cf3ch2oh(4ml)中的溶液中添加2-氯乙酸(80.43mg,851.12μmol,95.75μl,1eq)和吡嗪-2-甲醛(92.00mg,851.12μmol,1eq)。在25℃下将反应混合物搅拌1h。lcms显示反应物被消耗,并且检测到一个具有所需质量的峰。将反应真空浓缩。将粗产物用mtbe(20ml)研磨并过滤。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(吡嗪-2-基)乙基)-n-(4-(噻唑-5-基)苯基)乙酰胺inscov-601g(303.51mg,584.83μmol,68.71%产率)。
[0279]1h nmr(400mhz,dmso-d6):δ=9.09(d,j=0.6hz,1h),8.52(d,j=1.2hz,1h),8.49-8.48(m,1h),8.44(d,j=2.4hz,1h),8.34-8.26(m,2h),7.60-7.58(m,2h),7.55-7.30(m,2h),6.23(s,1h),4.21-3.98(m,2h),3.88-3.68(m,1h),2.01
ꢀ‑
1.82(m,4h),1.80-1.70(m,2h),1.53-1.37(m,2h)。lcms:m/z 506.0[m+h]
+
,纯度=100%。
[0280]
步骤2:inscov-601g的手性sfc纯化:inscov-601g(1)和inscov-601g(2)。通过手性sfc(柱:daicel chiralpak ad(250mm*30mm,10μm);流动相:[neu-meoh];b%:55%-55%,4.4min;45min)分离inscov-601g(100mg,197.64μmol,1eq),并且真空浓缩。获得了呈棕色固体的第一峰inscov-601g(1)(34.34mg,62.33μmol,31.54%产率,91.837%纯度)。获得了呈棕色固体的第二峰inscov-601g(2)(28.63mg,52.47μmol,26.55%产率,92.721%纯度)。
[0281]
inscov-601g(1):1h nmr:(400mhz,dmso-d6)δ=9.08(d,j=0.6hz,1h),8.55-8.47(m,2h),8.43(d,j=2.6hz,1h),8.34-8.24(m,2h),7.60-7.58(m,2h),7.53-7.28(m,2h),6.23(s,1h),4.19-3.98(m,2h),3.85-3.74(m,1h),2.02-1.83(m,4h),1.79-1.70(m,2h),1.52-1.35(m,2h)。lcms:m/z 506.3[m+h]
+
,纯度=100%。手性纯度:100%ee。
[0282]
inscov-601g(2):1h nmr:(400mhz,dmso-d6)δ=9.08(s,1h),8.52(d,j=1.2hz,1h),8.49-8.48(m,1h),8.43(d,j=2.4hz,1h),8.33-8.27(m,2h),7.60-7.58(m,2h),7.52-7.33(m,2h),6.23(s,1h),4.19-4.00(m,2h),3.88-3.73(m,1h),1.99-1.81(m,4h),1.80-1.70(m,2h),1.52-1.37(m,2h)。lcms:m/z 506.2[m+h]
+
,纯度=100%。手性纯度:86.5%ee。
[0283]
实施例9.inscov-601h的合成
[0284]
方案8
[0285]
向4-(异噁唑-5-基)苯胺(148.17mg,925.09μmol,1eq)和4,4-二氟环己烷-1-甲腈(134.28mg,925.09μmol,1eq)在cf3ch2oh(4ml)中的溶液中添加2-氯乙酸(87.42mg,925.09μmol,104.07μl,1eq)和吡嗪-2-甲醛(100mg,925.09μmol,1eq)。在25℃下将反应混合物搅拌1h。lcms显示反应物被消耗,并且检测到一个具有所需质量的峰。将反应真空浓缩。将粗产物用mtbe(20ml)研磨并过滤。获得了呈灰白色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(吡嗪-2-基)乙基)-n-(4-(异噁唑-5-基)苯基)乙酰胺inscov-601h(398.64mg,797.28μmol,86.18%产率)。
[0286]1h nmr(400mhz,dmso-d6):δ=8.65(d,j=2.0hz,1h),8.54(d,j=0.8hz,1h),8.50-8.46(m,1h),8.43(d,j=2.4hz,1h),8.31(d,j=7.6hz,1h),7.78-7.76(m,2h),7.54(br s,2h),7.04(d,j=2.0hz,1h),6.25(s,1h),4.23-4.01(m,2h),3.85-3.72(m,1h),2.02-1.81(m,4h),1.80-1.70(m,2h),1.52-1.36(m,2h)。lcms:m/z 490.3[m+h]
+
,纯度=98.23%。
[0287]
实施例10.inscov-601i、inscov-601i(1)和inscov-601i(2)的合成
[0288]
方案9
[0289]
步骤1:向4-碘苯胺(432.33mg,1.97mmol,1eq)和5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)异噻唑(0.5g,2.37mmol,1.2eq)在二噁烷(24ml)和h2o(8ml)中的溶液中添加pd(pph3)4(228.09mg,197.39μmol,0.1eq)和na2co3(523.03mg,4.93mmol,2.5eq)。在80℃下,在n2下,将混合物搅拌12h。lcms显示4-碘苯胺(r
t
=0.866min)有剩余,并且检测到一个具有所需质量的峰(r
t
=0.809min)。tlc(pe:ea=5:1)显示4-碘苯胺(rf=0.6)有剩余,并且形成两个斑点(rf=0.9,rf=0.4)。将反应混合物用水(10ml)稀释,并且用ea(20ml
×
3)萃取。将合并的有机相真空浓缩。将残余物通过快速硅胶色谱法(20g二氧化硅快速柱,洗脱剂:0~50%乙酸乙酯/石油醚,在60ml/min下)来纯化。将合并的有机相真空浓缩。获得了呈白色固体的4-(异噻唑-5-基)苯胺(0.1g,567.41μmol,28.75%产率)。
[0290]1h nmr(400mhz,dmso-d6):δ=8.44(d,j=1.6hz,1h),7.49(d,j=2.0hz,1h),7.43-7.36(m,2h),6.67-6.55(m,2h),5.63(s,2h)。
[0291]
步骤2:根据用于制备inscov-601h(实施例9)的程序合成化合物。将mtbe(20ml)添加至反应混合物中,过滤并用mtbe(10ml
×
3)洗涤以得到粗产物。将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈白色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(吡嗪-2-基)乙基)-n-(4-(异噻唑-5-基)苯基)乙酰胺inscov-601i(166.44mg,322.55μmol,58.11%产率)。
[0292]1h nmr(400mhz,dmso-d6):δ=8.59(d,j=1.8hz,1h),8.54(d,j=1.2hz,1h),8.52-8.46(m,1h),8.44(d,j=2.4hz,1h),8.29(d,j=7.6hz,1h),7.78(d,j=1.6hz,1h),7.66(d,j=8.8hz,2h),7.50(s,2h),6.24(s,1h),4.22-4.01(m,2h),3.87-3.75(m,1h),2.06-1.68(m,6h),1.54-1.34(m,2h)。lcms:m/z 506.2[m+h]
+
,纯度=100%。
[0293]
步骤3:inscov-601i的手性sfc纯化:inscov-601i(1)和inscov-601i(2)。通过手性sfc(柱:daicel chiralp akad(250mm
×
30mm,10μm);流动相:[neu-meoh];b%:45%-45%,4min;20min)分离2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(吡嗪-2-基)乙基)-n-(4-(异噻唑-5-基)苯基)乙酰胺inscov-601i(0.1g,197.64μmol)以产生呈黄色固体的第一峰inscov-601i(1)(23.1mg,44.66μmol,22.59%产率,97.81%纯度)。获得了呈黄色固体的第二峰inscov-601i(2)(9.94mg,19.52μmol,9.87%产率,99.346%纯度)。
[0294]
inscov-601i(1):1h nmr(400mhz,dmso-d6):δ=8.61-8.57(m,1h),8.54(d,j=
1.2hz,1h),8.52-8.46(m,1h),8.44(d,j=2.4hz,1h),8.29(d,j=7.6hz,1h),7.78(d,j=1.6hz,1h),7.66(d,j=8.8hz,2h),7.61-7.39(m,2h),6.24(s,1h),4.23-4.01(m,2h),3.85-3.73(m,1h),1.98-1.71(m,6h),1.54-1.35(m,2h)。lcms:m/z 506.3[m+h]
+
,纯度=100%。手性纯度:97.2%ee。
[0295]
inscov-601i(2):1h nmr(400mhz,dmso-d6)δ=8.59(d,j=1.8hz,1h),8.54(d,j=1.2hz,1h),8.52-8.46(m,1h),8.44(d,j=2.4hz,1h),8.29(d,j=7.6hz,1h),7.78(d,j=1.6hz,1h),7.66(d,j=8.8hz,2h),7.58-7.42(m,2h),6.24(s,1h),4.22-4.02(m,2h),3.88-3.75(m,1h),2.05-1.71(m,6h),1.56-1.34(m,2h)。lcms:m/z 506.2[m+h]
+
,纯度=100%。手性纯度:91.76%ee。
[0296]
实施例11.inscov-601k、inscov-601k(1)和inscov-601k(2)的合成
[0297]
方案10
[0298]
步骤1:根据用于制备inscov-601h(实施例9)的程序合成化合物。将混合物真空浓缩。将粗品溶解于mtbe(10ml)中,搅拌片刻,并且将滤饼真空浓缩。接着将它溶解于etoac(10ml)中,搅拌片刻,并且将滤饼真空浓缩。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噻唑-5-基)苯基)乙酰胺inscov-601k(100mg,181.83μmol,19.66%产率)。
[0299]1h nmr(400mhz,dmso-d6):δ=8.98(s,1h),8.60(d,j=1.8hz,1h),8.51(s,2h),8.33(d,j=7.6hz,1h),7.81(d,j=1.7hz,1h),7.71(br d,j=8.8hz,2h),7.55-7.30(m,2h),6.09(s,1h),4.14-4.09(m,2h),3.93-3.76(m,1h),2.07
ꢀ‑
1.72(m,6h),1.63-1.21(m,2h)。lcms:m/z506.1[m+h]
+
,纯度=92.0%。
[0300]
步骤2:inscov-601k的手性sfc纯化:inscov-601k(1)和inscov-601k(2)。通过手性sfc(柱:daicel chiralpak ig(250*30mm,10μm);流动相:[neu-meoh];b%:60%-60%,4.7;35min)分离inscov-601k(102mg)。获得了呈黄色固体的第一峰inscov-601k(1)(9.97mg,18.94μmol,9.4%产率,96.138%纯度)。获得了呈黄色固体的第二峰inscov-601k(2)(54.54mg,104.52μmol,51.8%产率,96.965%纯度)。
[0301]
inscov-601k(1):1h nmr(400mhz,dmso-d6)δ=8.98(s,1h),8.59(d,j=1.8hz,1h),8.51(s,2h),8.32(br d,j=7.5hz,1h),7.80(d,j=1.8hz,1h),7.70(br d,j=8.7hz,2h),7.46(br d,j=1.8hz,2h),6.08(s,1h),4.12-4.03(m,2h),3.91-3.75(m,1h),3.17(d,j=5.3hz,1h),2.08-1.73(m,7h),1.61-1.48(m,1h),1.45-1.30(m,1h)。lcms:m/z 506.1[m
+h]
+
,纯度=97.97%。手性纯度:87.96%ee。
[0302]
inscov-601k(2):1h nmr(400mhz,dmso-d6)δ=8.97(s,1h),8.58(d,j=1.8hz,1h),8.50(s,2h),8.31(br d,j=7.5hz,1h),7.79(d,j=1.8hz,1h),7.70(br d,j=8.7hz,2h),7.45(br s,2h),6.08(s,1h),4.14-4.03(m,2h),3.91-3.76(m,1h),3.16(d,j=5.0hz,1h),2.09-1.71(m,7h),1.61-1.34(m,2h)。lcms:m/z 506.1[m+h]
+
,纯度=96.12%。手性纯度:97.71%ee。
[0303]
实施例12.inscov-601n、inscov-601n(1)和inscov-601n(2)的合成
[0304]
方案11
[0305]
步骤1:在0℃下,在n2下,向1-(吡嗪-2-基)乙-1-酮(500mg,4.09mmol,1eq)和4-异噻唑-5-基苯胺(649.40mg,3.68mmol,2.33ml,0.9eq)在dcm(8ml)中的溶液中添加tea(1.24g,12.28mmol,1.71ml,3eq)和ticl4(1m,2.05ml,0.5eq),在0℃下将混合物搅拌1h,接着升温至30℃并在30℃下搅拌11h。lcms显示4-异噻唑-5-基苯胺被消耗,并且检测到62%的所需质量。将混合物用nh4cl(10ml)稀释,用etoac(10ml
×
2)萃取并用盐水(30ml)洗涤。将有机层用无水na2so4干燥,过滤并真空浓缩。将粗产物通过al2o3色谱法来纯化,用dcm/乙酸乙酯=1:0-0:1洗脱。获得了呈黄色固体的n-(4-(异噻唑-5-基)苯基)-1-(吡嗪-2-基)乙-1-亚胺(0.9g,1.64mmol,39.99%产率,51%纯度)。
[0306]1h nmr(400mhz,氯仿-d):δ=9.50(br s,1h),8.82-8.58(m,3h),7.66(d,j=8.4hz,2h),6.93(d,j=8.4hz,2h),6.72(br d,j=8.4hz,1h),2.39(s,3h)。
[0307]
步骤2:在0℃下,向n-(4-(异噻唑-5-基)苯基)-1-(吡嗪-2-基)乙-1-亚胺(0.9g,3.21mmol,1eq)在cf3ch2oh(10ml)中的溶液中添加1,1-二氟-4-异氰基-环己烷(465.97mg,3.21mmol,1eq)和2-氯乙酸(0.42g,4.44mmol,500.00μl,1.38eq),在0℃下将混合物搅拌1h。lcms显示n-(4-(异噻唑-5-基)苯基)-1-(吡嗪-2-基)乙-1-亚胺被消耗,并且检测到25%的所需产物。将混合物用水(10ml)稀释,用etoac(10ml
×
2)萃取并用盐水(20ml)洗涤。将有机层用无水na2so4干燥,过滤并真空浓缩。将残余物通过硅胶色谱法(柱高:250mm,直径:100mm,100-200目硅胶,石油醚/乙酸乙酯=10/1,1/1)来纯化。获得了呈黄色固体的2-(2-氯-n-(4-(异噻唑-5-基)苯基)乙酰胺基)-n-(4,4-二氟环己基)-2-(吡嗪-2-基)丙酰胺inscov-601n(283.73mg,529.92μmol,16.51%产率,97.119%纯度)。
[0308]1h nmr(400mhz,dmso-d6):δ=9.06(d,j=1.2hz,1h),8.69-8.53(m,3h),8.25(d,j=8.0hz,1h),7.97-7.79(m,4h),7.58(br d,j=8.0hz,1h),4.13-3.94(m,2h),3.87(br d,
j=7.2hz,1h),2.11-1.50(m,8h),1.42(s,3h)。lcms:m/z 520.1[m+h]
+
,纯度=98.61%。
[0309]
步骤3:inscov-601n的手性sfc纯化:inscov-601n(1)和inscov-601n(2)。将inscov-601n(200mg)通过sfc(柱:daicel chiralcel od(250mm
×
30mm,10μm);流动相:[neu-ipa];b%:40%-40%,4.0min;25min)来纯化以产生两个峰。获得了呈灰白色固体的第一峰inscov-601n(1)(52.24mg,91.42μmol,23.77%产率,91%纯度)。获得了呈灰白色固体的第二峰inscov-601n(2)(51.09mg,92.36μmol,24.01%产率,94%纯度)。
[0310]
inscov-601n(1):1h nmr(400mhz,dmso-d6):δ=9.06(d,j=1.2hz,1h),8.68-8.59(m,2h),8.57(d,j=2.4hz,1h),8.25(d,j=8.0hz,1h),7.96-7.80(m,4h),7.58(d,j=8.0hz,1h),4.12-3.94(m,2h),3.87(br d,j=7.6hz,1h),2.14-1.51(m,8h),1.42(s,3h)。lcms:m/z520.1[m+h]
+
,纯度=94.81%。手性纯度:100%ee。
[0311]
inscov-601n(2):1h nmr(400mhz,dmso-d6):δ=9.06(d,j=1.2hz,1h),8.68-8.60(m,2h),8.57(d,j=2.5hz,1h),8.25(d,j=8.0hz,1h),7.94-7.80(m,4h),7.58(br d,j=8.0hz,1h),4.09-3.95(m,2h),3.88(br d,j=7.2hz,1h),2.11-1.52(m,8h),1.42(s,3h)。lcms:m/z520.1[m+h]
+
,纯度=100%。手性纯度:100%ee。
[0312]
实施例13.inscov-601p、inscov-601p(1a)和inscov-601p(1b)的合成
[0313]
方案12
[0314]
步骤1:在0℃下,向4-(异噁唑-5-基)苯胺(2.6g,16.23mmol,1eq)和1-(嘧啶-5-基)乙-1-酮(2.38g,19.48mmol,1.2eq)在dcm(26ml)中的溶液中添加tea(4.93g,48.70mmol,6.78ml,3eq)和ticl4(1m,8.12ml,0.5eq)。在25℃下,在n2下,将反应混合物搅拌12h。lcms显示反应物完全消耗,并且检测到一个具有所需质量的峰(r
t
=0.884min)。将反应混合物经硅藻土垫过滤,并且用dcm(40ml*2)洗涤。将滤液真空浓缩。残余物不经进一步纯化即用于下一步骤中。获得了呈黄色固体的n-(4-(异噻唑-5-基)苯基)-1-(吡嗪-2-基)乙-1-亚胺(4.5g,粗品)。
[0315]
lcms:m/z 265.2[m+h]
+
,纯度=63.77%。
[0316]
步骤2:向2-氯乙酸(1.93g,20.43mmol,2.30ml,1.2eq)和n-(4-(异噻唑-5-基)苯基)-1-(吡嗪-2-基)乙-1-亚胺(4.5g,17.03mmol,1eq)在cf3ch2oh(15ml)中的溶液中添加1,1-二氟-4-异氰基环己烷(2.47g,17.03mmol,1eq)。在25℃下将反应混合物搅拌12h。lcms显示检测到一个具有所需质量的峰(r
t
=0.929min)。将反应真空浓缩。将残余物通过制备型
hplc(柱:phenomenex luna c18(250*70mm,15μm);流动相:[水(0.05%hcl)-acn];b%:35acn%-65acn%,22min)来纯化,用水(800ml)稀释并通过冻干来干燥以得到粗产物。将残余物通过正相hplc(柱:welch ultimate xb-sioh 250*50*10μm;流动相:[己烷-etoh];b%:1%-40%,20min)来纯化,并且真空浓缩。获得了呈黄色固体的2-(2-氯-n-(4-(异噁唑-5-基)苯基)乙酰胺基)-n-(4,4-二氟环己基)-2-(嘧啶-5-基)丙酰胺(inscov-601p)(0.2g,360.54μmol,2.12%产率)。
[0317]1h nmr(400mhz,dmso-d6):δ=9.04(s,1h),8.89-8.83(m,2h),8.69(d,j=2.0hz,1h),8.03-7.79(m,3h),7.66-7.59(m,1h),7.37(d,j=7.6hz,1h),7.13(d,j=2.0hz,1h),4.07-3.91(m,2h),3.90-3.81(m,1h),2.07-1.56(m,11h)。lcms:m/z 504.2[m+h]
+
,纯度=97.55%。
[0318]
步骤3:inscov-601p的手性sfc纯化:inscov-601p(1a)和inscov-601p(1b)。通过手性sfc(柱:daicel chiralpak ad(250mm*30mm,10μm);流动相:[neu-etoh];b%:45%-45%,5.2;40min)分离inscov-601p(0.2g,396.88μmol,1eq),并且真空浓缩。接着分别通过手性sfc(柱:daicel chiralpak ig(250mm*50mm,10μm);流动相:[neu-meoh];b%:40%-40%,4.3min;25min)和手性sfc(柱:daicel chiral pak ig(250*30mm,10μm);流动相:[meoh-acn];b%:50%-50%,4.1;40min)分离两个峰,并且真空浓缩。获得了呈黄色固体的第一峰inscov-601p(1a)(45.6mg,85.98μmol,22%产率)。获得了呈橙色固体的第二峰inscov-601p(1b)(53.71mg,97.77μmol,25%产率)。
[0319]
inscov-601p(1a):1h nmr(400mhz,氯仿-d)δ=9.17(s,1h),8.86(s,2h),8.35(d,j=2.0hz,1h),7.92(s,2h),7.57-7.34(m,2h),6.63(d,j=1.6hz,1h),6.51(d,j=7.2hz,1h),4.10-3.94(m,1h),3.88-3.73(m,2h),2.18-1.86(m,9h),1.66-1.57(m,2h)。lcms:m/z 504.2[m+h]
+
,纯度=96.07%。手性纯度:100%ee。
[0320]
inscov-601p(1b):1h nmr(400mhz,氯仿-d)δ=9.13(s,1h),8.82(s,2h),8.34(d,j=2.0hz,1h),7.90(s,2h),7.56-7.30(m,2h),6.62(d,j=2.0hz,1h),6.50(d,j=7.6hz,1h),4.01-3.95(m,1h),3.85-3.73(m,2h),2.23-1.83(m,9h),1.60(d,j=10.0hz,2h)。lcms:m/z 504.1[m+h]
+
,纯度=97.39%。手性纯度:100%ee。
[0321]
实施例14.inscov-601q、inscov-601q(1a)和inscov-601q(1b)的合成
[0322]
方案13
[0323]
步骤1:向(s)-四氢呋喃-3-胺(4g,32.37mmol,1eq,hcl)在甲酸乙酯(36.84g,
497.31mmol,40.00ml,15.36eq)中的溶液中添加tea(9.83g,97.10mmol,13.52ml,3eq)。在80℃下将混合物搅拌17h。tlc(dcm:meoh=10:1)显示(s)-四氢呋喃-3-胺(rf=0.4)被消耗,并且形成新斑点(rf=0.6)。将混合物真空浓缩。将残余物溶解于dcm(80ml)中,用h2o(30ml*3)洗涤。将有机层经无水na2so4干燥,过滤并真空浓缩。粗品不经进一步纯化即直接用于下一步骤中。获得了呈黄色油状物的(s)-n-(四氢呋喃-3-基)甲酰胺(3.8g,粗品)。
[0324]1h nmr(400mhz,氯仿-d):δ=8.06(s,1h),6.85(br s,1h),4.56-4.46(m,1h),3.93-3.83(m,1h),3.81-3.70(m,2h),3.67-3.56(m,1h),2.30-2.15(m,1h),1.87-1.72(m,1h)。
[0325]
步骤2:向(s)-n-(四氢呋喃-3-基)甲酰胺(4g,34.74mmol,1eq)在dcm(40ml)中的溶液中添加pph3(9.11g,34.74mmol,1eq)、ccl4(5.34g,34.74mmol,3.34ml,1eq)和tea(3.87g,38.22mmol,5.32ml,1.1eq)。在45℃下,在n2下,将混合物搅拌17h。tlc(pe:ea=5:1)显示(s)-n-(四氢呋喃-3-基)甲酰胺被消耗,并且形成新斑点(rf=0.5)。将混合物真空浓缩。将残余物溶解于et2o(300ml)中,搅拌30min,过滤,并且将滤饼用et2o(100ml*3)洗涤。将合并的有机层真空浓缩。获得了呈黄色油状物的(s)-3-异氰基四氢呋喃(4g,粗品)。
[0326]1h nmr(400mhz,氯仿-d):δ=4.16(br d,j=4.0hz,1h),4.00(q,j=7.9hz,1h),3.95-3.84(m,2h),2.24-2.17(m,1h),1.92(br s,2h)。
[0327]
步骤3:向(s)-3-异氰基四氢呋喃(179.68mg,1.85mmol,1eq)、4-(异噁唑-5-基)苯胺(296.35mg,1.85mmol,1eq)在cf3ch2oh(6ml)中的溶液中添加吡嗪-2-甲醛(0.2g,1.85mmol,1eq)、2-氯乙酸(174.84mg,1.85mmol,208.14μl,1eq)。在30℃下将混合物搅拌1h。lcms显示反应物被消耗,并且检测所需质量。向混合物中添加30ml mtbe,搅拌30min,过滤,并且将滤饼真空浓缩。向混合物中添加30ml mtbe,搅拌30min,过滤,并且将滤饼真空浓缩。获得了呈黄色固体的2-氯-n-(4-(异噁唑-5-基)苯基)-n-(2-氧代-1-(吡嗪-2-基)-2-(((s)-四氢呋喃-3-基)氨基)乙基)乙酰胺(inscov-601q)(461.14mg,990.78μmol,53.55%产率)。
[0328]1h nmr(400mhz,dmso-d6):δ=8.65(d,j=2.0hz,1h),8.59-8.52(m,2h),8.50-8.46(m,1h),8.42(d,j=2.4hz,1h),7.77(br d,j=7.7hz,2h),7.57-7.50(m,1h),7.03(d,j=1.8hz,1h),6.26(d,j=2.1hz,1h),4.33-4.23(m,1h),4.18
ꢀ‑
4.02(m,2h),3.87(dq,j=6.6,9.7hz,1h),3.77-3.61(m,3h),2.06(td,j=7.5,12.7hz,1h),1.75-1.59(m,1h)。lcms:m/z 442.2[m+h]
+
,纯度=85.55%。
[0329]
步骤4:inscov-601q的手性sfc纯化:inscov-601q(1a)和inscov-601q(1b)。将化合物inscov-601q(103mg)通过sfc(柱:cellucoat 50
×
4.6mm i.d.,3μm,流动相:相a是co2,并且相b是meoh(0.05%dea);梯度洗脱:5%至40%meoh(0.05%dea)/co2;流速:3ml/min;检测器:pda;柱温:35℃;背压:100巴)来纯化。将溶液真空浓缩。获得了呈黄色固体的第一峰inscov-601q(1a)(10.30mg,22.43μmol,9.91%产率,96.243%纯度)。获得了呈黄色固体的第二峰inscov-601q(1b)(28.04mg,60.92μmol,26.92%产率,96.007%纯度)。
[0330]
inscov-601q(1a):1h nmr(400mhz,dmso-d6):δ=8.65(d,j=2.0hz,1h),8.58-8.53(m,2h),8.50-8.46(m,1h),8.42(d,j=2.4hz,1h),7.77(br d,j=8.7hz,2h),7.65-7.38(m,2h),7.03(d,j=1.8hz,1h),6.26(s,1h),4.29-4.22(m,1h),4.18-4.03(m,2h),3.76-3.63(m,3h),3.42-3.38(m,1h),2.08-1.99(m,1h),1.73-1.63(m,1h)。lcms:m/z442.2
[m+h]
+
,纯度=96.27%。手性纯度:69.84%ee。
[0331]
inscov-601q(1b):1h nmr(400mhz,dmso-d6):δ=8.65(d,j=2.0hz,1h),8.59-8.54(m,2h),8.48(dd,j=1.5,2.4hz,1h),8.43(d,j=2.6hz,1h),7.78(br d,j=8.8hz,2h),7.67-7.41(m,2h),7.04(d,j=1.8hz,1h),6.27(s,1h),4.33-4.25(m,1h),4.18-4.03(m,2h),3.76-3.62(m,2h),3.41(dd,j=3.5,9.0hz,1h),2.08-2.02(m,1h),1.71-1.62(m,1h)。lcms:m/z 442.2[m+h]
+
,纯度=98.23%。手性纯度:74.77%ee。
[0332]
实施例15.inscov-614、inscov-614(1a)、inscov-614(1b)、inscov-614(2a)和inscov-614(2b)的合成
[0333]
方案14
[0334]
步骤1:向2-氯-2-氟乙酸乙酯(1g,7.12mmol,826.45μl,1eq)在thf(4ml)、meoh(4ml)和h2o(2ml)中的溶液中添加naoh(426.92mg,10.67mmol,1.5eq)。在25℃下将反应混合物搅拌12h。tlc(pe:ea=5:1)显示形成一个新斑点。将反应混合物真空浓缩,通过1n hcl溶液调整ph=2,并且用etoac(50ml*3)萃取。将合并的有机相经无水na2so4干燥并真空浓缩。反应混合物不经进一步纯化即直接用于下一步骤中。获得了呈无色油状物的2-氯-2-氟乙酸(0.6g,粗品)。
[0335]1h nmr(400mhz,dmso-d6):δ=7.03-6.65(m,1h)。
[0336]
步骤2:根据用于制备inscov-601h(实施例9)的程序合成化合物。将mtbe(20ml)添加至反应混合物中,并且冷却至0℃,持续12h。将混合物过滤,并且用mtbe(10ml*3)洗涤。将滤饼真空浓缩。获得了呈橙色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-2-氟-n-(4-(噻唑-5-基)苯基)乙酰胺inscov-614(0.5g,910.33μmol,32.75%产率)。
[0337]1h nmr(400mhz,dmso-d6):δ=9.11(d,j=0.8hz,1h),9.10(d,j=0.8hz,1h),8.99(s,1h),8.96(s,1h),8.53(s,2h),8.51(s,1h),8.39-8.35(m,1h),8.34(d,j=4.4hz,2h),7.64(s,4h),6.66-6.52(m,1h),6.51-6.40(m,1h),6.09(s,1h),6.03(s,1h),3.89-3.83(m,
2h),2.13-1.64(m,12h),1.60-1.46(m,2h),1.42-1.26(m,2h)。lcms:m/z 524.1[m+h]
+
,纯度=100%。
[0338]
步骤3:inscov-614的手性sfc纯化:inscov-614(1a)、inscov-614(1b)、inscov-614(2a)和inscov-614(2b)。通过手性sfc(柱:daicel chiralpak ig(250*30mm,10μm);流动相:[neu-meoh];b%:40%-40%,5.6;90min)分离化合物inscov-614(0.4g,763.42μmol,1eq),并且真空浓缩。获得了呈黄色固体的第一峰inscov-614(1a)(50.34mg,93.52μmol,12.25%产率)。获得了呈黄色固体的第二峰inscov-614(1b)(66.09mg,119.03μmol,15.59%产率)。获得了呈黄色固体的第三峰inscov-614(2a)(33.89mg,60.34μmol,7.90%产率)。获得了呈黄色固体的第四峰inscov-614(2b)(72.98mg,133.83μmol,17.53%产率)。
[0339]
inscov-614(1a):1h nmr(400mhz,dmso-d6):δ=9.11(s,1h),8.99(s,1h),8.53(s,2h),8.38-8.31(m,2h),7.68-7.62(m,3h),7.49-7.24(m,1h),6.72-6.38(m,1h),6.03(s,1h),3.89-3.76(m,1h),2.01-1.71(m,6h),1.59-1.45(m,1h),1.43-1.28(m,1h)。lcms:m/z 524.1[m+h]
+
,纯度=97.28%。手性纯度:100%ee。
[0340]
inscov-614(1b):1h nmr(400mhz,dmso-d6):δ=9.09(s,1h),8.96(s,1h),8.51(s,2h),8.38(d,j=7.6hz,1h),8.33(s,1h),7.74-7.55(m,3h),7.48-7.11(m,1h),6.59-6.38(m,1h),6.09(s,1h),3.85(d,j=6.4hz,1h),2.04-1.73(m,6h),1.62-1.44(m,1h),1.42-1.25(m,1h)。lcms:m/z 524.1[m+h]
+
,纯度=98.36%。手性纯度:96.75%ee。
[0341]
inscov-614(2a):1h nmr(400mhz,dmso-d6):δ=9.10(s,1h),8.96(s,1h),8.51(s,2h),8.36(d,j=7.6hz,1h),8.34(s,1h),7.66-7.60(m,3h),7.49-7.22(m,1h),6.58-6.41(m,1h),6.09(s,1h),3.89-3.83(m,1h),2.03-1.71(m,6h),1.60-1.45(m,1h),1.41-1.25(m,1h)。lcms:m/z 524.1[m+h]
+
,纯度=98.01%。手性纯度:100%ee。
[0342]
inscov-614(2b):1h nmr(400mhz,dmso-d6):δ=9.12(s,1h),9.00(s,1h),8.55(s,2h),8.45-8.32(m,2h),7.69-7.63(m,3h),7.27-7.06(m,1h),6.73-6.41(m,1h),6.04(s,1h),3.93-3.73(m,1h),2.06-1.70(m,6h),1.61-1.45(m,1h),1.43-1.26(m,1h)。lcms:m/z 524.1[m+h]
+
,纯度=98.39%。手性纯度:99.26%ee。
[0343]
根据建模和活性数据,预期inscov-614(1b)具有的结构。
[0344]
实施例16.inscov-614a、inscov-614a(1a)、inscov-614a(1b)、inscov-614a(2a)和inscov-614a(2b)的合成
[0345]
方案15
[0346]
步骤1:向2-氯-2-氟乙酸(421mg,3.74mmol,1.2eq)和嘧啶-5-甲醛(338mg,3.13mmol,1.00eq)在cf3ch2oh(10ml)中的溶液中添加4-(异噁唑-5-基)苯胺(500mg,3.12mmol,1eq)和1,1-二氟-4-异氰基环己烷(453mg,3.12mmol,1eq)。在25℃下将混合物搅拌1h。lcms显示起始物料完全消耗,并且检测到约72%的所需产物。将反应混合物减压浓缩以产生粗产物。将残余物通过快速硅胶色谱法(25g二氧化硅快速柱,洗脱剂:0~85%乙酸乙酯/石油醚,在40ml/min下)来纯化。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-2-氟-n-(4-(异噁唑-5-基)苯基)乙酰胺(inscov-614a)(1.05g,1.96mmol,63%产率)。
[0347]1h nmr(400mhz,dmso-d6):δ=9.02-8.92(m,1h),8.72-8.63(m,1h),8.56-8.48(m,2h),8.43-8.32(m,1h),7.81(brs,2h),7.69-7.19(m,2h),7.12-7.02(m,1h),6.68-6.43(m,1h),6.14-6.00(m,1h),3.86(br s,1h),2.12-2.00(m,1h),1.96-1.68(m,5h),1.62-1.45(m,1h),1.40-1.25(m,1h)。lcms:m/z 508.2[m+h]
+
,纯度=100%。
[0348]
步骤2:inscov-614a的手性sfc纯化:inscov-614a(1a)、inscov-614a(1b)、inscov-614a(2a)和inscov-614a(2b)。通过手性sfc(phenomenex-纤维素-2(250mm*50mm,10μm);流动相:a:超临界co2,b:neu-etoh;等度:a:b=70:30;流速:200ml/min)分离化合物inscov-614a(1.05g,1.96mmol,95%纯度,1eq),并且真空浓缩以提供四个级分。获得了呈黄色固体的第一峰inscov-614a(1b):(112mg,216.54μmol,98.194%纯度,11%产率)。获得了呈白色固体的第二峰inscov-614a(1a):(144mg,280.18μmol,98.82%纯度,14.3%产率)。获得了呈黄色固体的第三峰inscov-614a(2b)(120mg,231.17μmol,97.841%纯度,11.8%产率)。获得了呈黄色固体的第四峰inscov-614a(2a)(202mg,389.26μmol,97.872%纯度,19.9%产率)。
[0349]
inscov-614a(1a):1h nmr(400mhz,dmso-d6):8.98(s,1h),8.67(d,j=1.6hz,1h),8.53(s,2h),8.36(d,j=7.6hz,1h),7.83(d,j=6.8hz,2h),7.74-7.18(m,2h),7.08(d,j=1.6hz,1h),6.69-6.47(m,1h),6.04(s,1h),3.91-3.75(m,1h),2.05-1.71(m,6h),1.60-1.45(m,1h),1.40-1.27(m,1h)。lcms:m/z 508.1[m+h]
+
,纯度=100%。手性纯度:95.48%ee。
[0350]
inscov-614a(1b):1h nmr(400mhz,dmso-d6):8.97(s,1h),8.67(d,j=2.0hz,1h),8.53(s,2h),8.36(d,j=7.6hz,1h),7.90-7.75(m,2h),7.74-7.17(m,2h),7.07(d,j=1.6hz,1h),6.69-6.49(m,1h),6.04(s,1h),3.91-3.76(m,1h),2.06-1.68(m,6h),1.59-1.43(m,1h),1.39-1.26(m,1h)。lcms:m/z 508.0[m+h]
+
,纯度=100%。手性纯度:98.72%ee。
[0351]
inscov-614a(2a):1h nmr(400mhz,dmso-d6):8.95(s,1h),8.67(d,j=2.0hz,1h),8.51(s,2h),8.39(d,j=7.6hz,1h),7.95-7.75(m,2h),7.73-7.14(m,2h),7.06(d,j=1.8hz,1h),6.67-6.40(m,1h),6.11(s,1h),3.87(br s,1h),2.07-1.71(m,6h),1.60-1.45(m,1h),1.42-1.25(m,1h)。lcms:m/z 508.1[m+h]
+
,纯度=96.46%。手性纯度:95.82%ee。
[0352]
inscov-614a(2b):1h nmr(400mhz,dmso-d6):8.95(s,1h),8.66(d,j=2.0hz,1h),8.51(s,2h),8.39(d,j=7.6hz,1h),7.97-7.75(m,2h),7.74-7.24(m,2h),7.06(d,j=1.6hz,1h),6.63-6.42(m,1h),6.11(s,1h),3.94-3.79(m,1h),2.04-1.72(m,6h),1.60-1.45(m,1h),1.41-1.25(m,1h)。lcms:m/z 508.1[m+h]
+
,纯度=97.34%。手性纯度:92.96%ee。
[0353]
根据建模,预期inscov-614a(2a)具有的结构。
[0354]
实施例17.inscov-110a、inscov-110a(1)和inscov-110a(2)的合成
[0355]
方案16
[0356]
向2-氯乙酸(88.22mg,933.62μmol,105.03μl,1eq)和异氰基环己烷(101.92mg,933.62μmol,116.08μl,1eq)在75-89-8(5ml)中的溶液中添加4-叔丁基苯胺(139.33mg,933.62μmol,147.44μl,1eq)和吡啶-3-甲醛(0.1g,933.62μmol,87.72μl,1eq)。在15℃下将反应混合物搅拌1h。lcms显示sm被消耗,并且形成dp。减压蒸发溶剂。将粗产物与pe/ea(10/1,50ml)一起回流并过滤以产生呈白色固体的2-(4-叔丁基-n-(2-氯乙酰基)苯胺基)-n-环己基-2-(3-吡啶基)乙酰胺(0.4g,904.99μmol,96.93%产率)。
[0357]
通过sfc拆分inscov-110a获得了呈黄色固体的inscov-110a(1):(511.15mg,1.16mmol,34.08%产率),其通过hnmr、lcms、sfc和hplc来确认。
[0358]
lcms:保留时间:1.537min,[m+h
+
]=442.2。hplc:保留时间:2.778min。sfc:保留时间:1.163min。1h nmr(400mhz,dmso-d6):δ=8.30(dd,j=1.6,4.8hz,1h),8.26(d,j=1.9hz,1h),8.05(d,j=7.6hz,1h),7.29(td,j=1.9,7.9hz,1h),7.21(br d,j=6.6hz,2h),7.09(dd,j=4.8,7.8hz,1h),6.01(s,1h),4.00-3.86(m,2h),3.61-3.50(m,1h),1.78-1.47(m,5h),1.34-0.91(m,16h)。
[0359]
通过sfc拆分inscov-110a获得了呈白色固体的inscov-110a(2):(76.78mg,173.71μmol,19.19%产率,100%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0360]
lcms:保留时间:1.509min,[m+h
+
]=442.2,1。hplc:保留时间:2.080min。sfc:保留时间:2.087min。1h nmr(400mhz,dmso-d6):δ=8.47-8.36(m,2h),8.16-8.05(m,1h),7.61-7.49(m,1h),7.35-7.28(m,1h),7.28-7.22(m,2h),7.22-7.08(m,1h),6.07-6.04(m,1h),4.02-3.90(m,2h),1.75-1.48(m,5h),1.28-1.00(m,17h)。
[0361]
实施例18.inscov-110b、inscov-110b(1)和inscov-110b(2)的合成
[0362]
方案17
[0363]
向丙烯酸(67.28mg,933.62μmol,64.08μl,1eq)和异氰基环己烷(101.92mg,933.62μmol,116.08μl,1eq)在75-89-8(5ml)中的溶液中添加4-叔丁基苯胺(139.33mg,933.62μmol,147.44μl,1eq)和吡啶-3-甲醛(0.1g,933.62μmol,87.72μl,1eq)。在15℃下将反应混合物搅拌1h。lcms显示sm被消耗,并且形成dp。减压蒸发溶剂。将粗产物通过制备型hplc(tfa)来纯化以产生呈白色固体的inscov-110b(0.23g,548.20μmol,58.72%产率)。
[0364]
lcms:保留时间:0.902min,[m+h
+
]=420.0。hplc:保留时间:2.779min,1。1h nmr(400mhz,dmso-d6):δ=8.47-8.25(m,2h),8.08(d,j=7.7hz,1h),7.39(br d,j=7.9hz,1h),7.23(br d,j=8.3hz,2h),7.17(dd,j=4.8,7.9hz,1h),7.09(br d,j=2.2hz,1h),6.26-6.10(m,2h),5.86(dd,j=10.3,16.8hz,1h),5.66
ꢀ‑
5.48(m,1h),3.62-3.52(m,1h),1.81-1.45(m,5h),1.32-0.92(m,15h)。
[0365]
通过sfc拆分inscov-110b获得了呈白色固体的inscov-110b(1):(56.13mg,133.78μmol,24.40%产率),其通过hnmr、lcms、sfc和hplc来确认。
[0366]
lcms:保留时间:0.909min,[m+h
+
]=420.0。hplc:保留时间:3.011min。sfc:保留时间:0.946min。1h nmr(400mhz,dmso-d6):δ=8.36-8.24(m,2h),8.06(br d,j=7.7hz,1h),7.33(br d,j=6.5hz,1h),7.21(br d,j=7.3hz,2h),7.15-6.97(m,2h),6.22-6.09(m,2h),5.92-5.78(m,1h),5.56(br d,j=10.6hz,1h),3.62-3.51(m,1h),1.77-1.47(m,5h),1.32-0.95(m,15h)。
[0367]
通过sfc拆分inscov-110b获得了呈白色固体的inscov-110b(2):(59.71mg,142.32μmol,25.96%产率),其通过hnmr、lcms、sfc和hplc来确认。
[0368]
lcms:保留时间:0.905min,[m+h
+
]=442.2。hplc:保留时间:3.029min。sfc:保留时间:1.905min,1hnmr:(400mhz,dmso-d6):δ=8.40-8.28(m,2h),8.07(br d,j=7.7hz,1h),7.39(br d,j=7.9hz,1h),7.22(br d,j=8.1hz,2h),7.17(br dd,j=5.0,7.6hz,1h),7.13-7.01(m,1h),6.22-6.10(m,2h),5.92-5.79(m,1h),5.62-5.51(m,1h),3.56(br s,1h),1.73-1.50(m,5h),1.32-0.97(m,16h)。
[0369]
实施例19.inscov-110、inscov-110-1和inscov-110-2的合成
[0370]
方案18
[0371]
在0℃下,向化合物4(200mg,547.18μmol,1eq)和tea(166.11mg,1.64mmol,228.48μl,3eq)在dcm(8ml)中的溶液中逐滴添加乙烯磺酰氯(138.50mg,1.09mmol,2.0eq),在20℃下将反应搅拌2h。lcms显示化合物4被消耗,并且检测到所需质量作为主峰。将反应混合物浓缩。将残余物通过快速硅胶色谱法(25g二氧化硅快速柱,0~45%乙酸乙酯/石油醚梯度的洗脱剂,在50ml/min下)来纯化。获得了呈灰白色固体的化合物6(inscov-110)(110mg,229.60μmol,41.96%产率,95.1%纯度),其通过lcms来确认。
[0372]
lcms:保留时间:0.929min,(m+h)=456.1
[0373]
通过制备型sfc(柱:daicel chiralcel od(250mm*30mm,10um);流动相:[0.1%nh3h2o meoh];b%:30%-30%,4.7min;35min)分离化合物6(inscov-110)(110mg,241.43μmol,1eq)。
[0374]
获得了呈白色固体的inscov-110-1:(15mg,32.04μmol,13.27%产率,97.304%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0375]
lcms:保留时间:1.085min,(m+h)=456.5。hplc:保留时间:2.738min。1h nmr(400mhz,氯仿-d):δ=8.49(dd,j=1.7,4.8hz,1h),8.40(d,j=2.2hz,1h),7.39-7.32(m,1h),7.24-7.16(m,2h),7.10(dd,j=4.9,7.9hz,1h),7.07-6.98(m,2h),6.82(dd,j=9.9,16.6hz,1h),6.11(d,j=16.6hz,1h),5.93(d,j=9.9hz,1h),5.89-5.80(m,2h),3.92-3.72(m,1h),2.06-1.93(m,1h),1.93-1.82(m,1h),1.81-1.68(m,2h),1.48-0.97(m,16h)。
[0376]
获得了呈白色固体的inscov-110-2:(20mg,42.90μmol,17.77%产率,97.721%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0377]
lcms:保留时间:1.085min,(m+h)=456.5。hplc:保留时间:2.742min。1h nmr(400mhz,氯仿-d):δ=8.50(dd,j=1.6,4.8hz,1h),8.40(d,j=2.2hz,1h),7.35(td,j=1.9,8.0hz,1h),7.24-7.17(m,2h),7.10(dd,j=4.8,7.9hz,1h),7.06-7.00(m,2h),6.82(dd,j=9.9,16.5hz,1h),6.11(d,j=16.6hz,1h),5.93(d,j=9.9hz,1h),5.84(s,1h),3.91-3.75(m,1h),1.98(br d,j=8.6hz,1h),1.88(br d,j=11.0hz,1h),1.79-1.69(m,2h),1.47-1.02(m,17h)。
[0378]
实施例20. 2-氯-n-(2-((1,1-二氧代四氢-2h-噻喃-4-基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-501b)的合成
[0379]
根据用于inscov系列的一般性程序获得inscov-501b,并且通过以下纯化b来纯化:将粗产物用mtbe(20ml
×
2)研磨并过滤。接着用meoh(6ml)研磨并过滤。获得了呈橙色固体的inscov-501b(8.64mg,16.26μmol,2.59%产率,94.862%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0380]
lcms:保留时间:0.581min,(m+h)=504.0,hplc:保留时间:1.332min,sfc:保留时间:1.718min,2.024min,1h nmr(400mhz,dmso-d6):δ=8.98(s,1h),8.51(s,2h),8.46(s,1h),8.43(d,j=7.8hz,1h),7.72(s,1h),7.66-7.64(m,2h),7.42-7.41(m,1h),6.04(s,1h),4.10-3.96(m,3h),3.28-3.19(m,2h),3.13-3.04(m,1h),3.03-2.94(m,1h),2.12-1.90(m,3h),1.86-1.73(m,1h)。
[0381]
实施例21. 2-氯-n-(4-(噁唑-5-基)苯基)-n-(2-氧代-1-(嘧啶-5-基)-2-((1-甲苯磺酰基乙基)氨基)乙基)乙酰胺(inscov-501c(2))的合成
[0382]
根据用于inscov系列的一般性程序合成inscov-501c(2),并且通过以下纯化a方法来纯化:将残余物溶解于meoh(2ml)中,并且通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:32%-52%,6.5min)来纯化并浓缩以移除mecn,将液体冻干以产生产物。获得了呈黄色固体的inscov-501c(2)(28.59mg,47.35μmol,5.12%产率,91.759%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0383]
lcms:保留时间:0.831min,(m+h)=554.2,hplc:保留时间:1.982min,sfc:保留时间:1.802min,2.474min,1h nmr(400mhz,dmso-d6):δ=9.32(d,j=9.2hz,1h),8.94(s,1h),8.47-8.43(m,1h),8.34(s,2h),7.80(d,j=8.2hz,2h),7.75-7.70(m,1h),7.60(d,j=6.8hz,2h),7.49-7.26(m,3h),6.21(s,1h),5.25-5.19(m,1h),3.94(s,2h),2.42(s,3h),1.35(d,j=7.0hz,3h)。
[0384]
实施例22.inscov-501g的合成
[0385]
方案19
[0386]
步骤1:向化合物1(3g,18.17mmol,1eq)和化合物2(4.26g,21.80mmol,1.2eq)在meoh(70ml)中的溶液中添加k2co3(5.02g,36.33mmol,2eq)。在70℃下,在n2下,将反应混合物搅拌1h。tlc(pe:ea=4:1)显示化合物1(rf=0.8)完全消耗,并且形成两个新斑点(rf=0.4,rf=0.0)。将反应混合物真空浓缩。将残余物用nahco3溶液(20ml)稀释,并且用ea(30ml
×
2)萃取。将合并的有机相用水(30ml)洗涤,用无水na2so4干燥并真空浓缩。将残余物通过快速硅胶色谱法(80g二氧化硅快速柱,0~50%乙酸乙酯/石油醚梯度的洗脱剂,在100ml/min下)来纯化,并且真空浓缩。获得了呈黄色固体的化合物3(3.5g,16.93mmol,93.22%产率,98.79%纯度),其通过lcms和hnmr来确认。
[0387]
lcms:保留时间:0.930min,(m+h)=205.2。1h nmr(400mhz,dmso-d6)δ=8.58(d,j=1.2hz,1h),8.11(d,j=8.6hz,1h),7.94(d,j=1.2hz,1h),7.88(s,1h),7.79(d,j=8.8hz,1h),2.58(s,3h)。
[0388]
步骤2:向化合物3(1.5g,7.35mmol,1eq)在meoh(15ml)中的溶液中添加pd/c(1.5g,7.35mmol,10%纯度,1eq)。在25℃下,在h2(15psi)下,将反应混合物搅拌12h。lcms显示化合物3完全消耗,并且检测到一个具有所需质量的峰(rt=0.827min)。将反应混合物经硅藻土垫过滤,并且用meoh(20ml
×
2)洗涤。将滤液真空浓缩。反应用于下一步骤而不进行纯化。获得了呈灰白色固体的化合物4(1g,粗品)。
[0389]
步骤3:根据用于inscov系列的一般性程序获得inscov-501g,并且通过以下纯化b来纯化:将mtbe(20ml)添加至反应混合物中,并且冷却至0℃,持续1h。将混合物过滤,并且用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈黄色固体的inscov-501g(192.57mg,409.06μmol,29.48%产率,99.403%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0390]
lcms:保留时间:0.933min,(m+h)=468.3。hplc:保留时间:2.126min。sfc:保留时间:1.002min,1.136min。1h nmr(400mhz,dmso-d6)δ=8.93(s,1h),8.48(s,2h),8.45(s,1h),7.99(d,j=8.4hz,1h),7.74-7.67(m,1h),7.67-7.61(m,1h),7.42(d,j=1.6hz,1h),6.04(s,1h),4.02-3.86(m,2h),3.63-3.51(m,1h),1.89(s,3h),1.83-1.74(m,1h),1.72-1.65(m,1h),1.60-1.48(m,3h),1.33-1.12(m,4h),0.99-0.87(m,1h)。
[0391]
实施例23.inscov-501h的合成
[0392]
方案20
[0393]
步骤1:在0℃下,向化合物1(40g,199.72mmol,1eq)和dipea(77.44g,599.17mmol,104.36ml,3eq)在dcm(600ml)中的溶液中添加化合物2(33.69g,239.67mmol,1.2eq)。在20℃下将混合物搅拌16h。tlc(pe:ea=1:1)显示化合物1(rf=0.05)被消耗,并且观察到新斑点(rf=0.5)。将混合物倾倒至饱和nahco3(400ml)中,接着用dcm(200ml
×
2)萃取。将合并的有机层用水(200ml)、盐水(100ml)洗涤,经na2so4干燥,过滤并真空浓缩以产生残余物。将残余物用mtbe(400ml)研磨。将滤饼用mtbe(100ml
×
2)洗涤,接着真空干燥。获得了呈白色固体的化合物3(56g,183.97mmol,92.11%产率),其通过hnmr来确定。
[0394]1h nmr(400mhz,氯仿-d):δ=4.59-4.37(m,1h),3.76(br d,j=12.2hz,2h),3.57(br s,1h),2.92(br t,j=11.1hz,2h),2.26(tt,j=4.8,8.0hz,1h),2.10-1.96(m,2h),1.56-1.38(m,11h),1.21-1.11(m,2h),1.04-0.93(m,2h)。
[0395]
步骤2:在0℃下,将tfa(15ml)添加至化合物3(10g,32.85mmol,1eq)在dcm(100ml)中的溶液中。在25℃下将反应搅拌5h。tlc(pe:ea=3:1,i2)指示化合物3(rf=0.3)完全消耗,并且形成三个新斑点(rf=0.05,rf=0.6,rf=0.8)。在25℃下,将反应混合物添加至100ml h2o中,并且用dcm(100ml
×
2)萃取。通过饱和nahco3将水相的ph调整至9,并且将它用dcm(100ml
×
6)萃取。将合并的有机层经na2so4干燥,过滤并减压浓缩以产生粗品。粗产物不经进一步纯化即用于下一步骤中。获得了呈白色固体的化合物4(1g,4.90mmol,14.90%产率),其通过hnmr来核实。
[0396]1h nmr(400mhz,氯仿-d):δ=3.69(td,j=3.2,12.4hz,2h),2.90-2.70(m,3h),2.19(tt,j=4.8,8.0hz,1h),1.55-1.30(m,6h),1.12-1.03(m,2h),0.94-0.84(m,2h)。
[0397]
步骤3:在25℃下,将hcooh(261.02mg,5.43mmol,3.0eq)和ac2o(221.88mg,2.17mmol,203.56μl,1.2eq)的混合物搅拌10min。将化合物4(370mg,1.81mmol,1eq)在dcm(5ml)中的溶液缓慢添加至以上混合物中。在25℃下将混合物搅拌15h。tlc(meoh:dcm=1:10,i2)显示化合物4(rf=0)被消耗,并且观察到新斑点(rf=0.3)。在10℃下,将混合物缓慢倾倒至饱和nahco3(100ml)中,接着用dcm(80ml
×
2)萃取。将合并的有机层用盐水(40ml)洗涤,经na2so4干燥,过滤并真空浓缩以产生粗品。粗产物不经进一步纯化即用于下一步骤中。获得了呈浅黄色固体的化合物5(370mg,1.59mmol,87.94%产率),其通过hnmr来核实。
[0398]1h nmr(400mhz,氯仿-d):δ=8.23-8.05(m,1h),5.73(br s,1h),4.14-3.97(m,1h),3.89-3.74(m,2h),3.09-2.84(m,2h),2.37-2.20(m,1h),2.12-2.00(m,2h),
[0399]
步骤4:在0℃下,向化合物5(350mg,1.51mmol,1eq)和et3n(457.38mg,4.52mmol,629.14μl,3.0eq)在dcm(30ml)中的溶液中逐滴缓慢添加pocl3(693.06mg,4.52mmol,420.03μl,3.0eq)。在0℃下将混合物搅拌1h。tlc(dcm:meoh=10:1)显示化合物5(rf=0)有剩余,并且观察到新斑点(rf=0.3)。在10℃下,将混合物缓慢倾倒至饱和nahco3(60ml)中,接着用dcm(45ml
×
2)萃取。将合并的有机层用盐水(20ml
×
2)洗涤,经na2so4干燥,过滤并真空浓缩以产生粗品。将粗产物通过硅胶色谱法来纯化,用石油醚/乙酸乙酯=1:1洗脱。获得了呈黄色固体的化合物6(220mg,1.03mmol,68.14%产率),其通过hnmr来核实。
[0400]1h nmr(400mhz,氯仿-d):δ=3.93(br s,1h),3.56-3.45(m,2h),3.44-3.29(m,2h),2.28(tt,j=4.9,8.0hz,1h),2.03-1.91(m,4h),1.23-1.14(m,2h),1.07-0.97(m,2h)。
[0401]
步骤5:根据用于inscov系列的一般性程序获得inscov-501h,并且通过以下纯化b来纯化:将反应真空浓缩。将粗品溶解于乙酸乙酯(6ml)中,搅拌片刻并过滤,并且将滤饼真空浓缩。获得了呈黄色固体的inscov-501h(102.99mg,174.30μmol,37.35%产率,94.609%纯度),其通过hnmr、lcms和hplc来确认。
[0402]
lcms:保留时间:0.793min,(m+h)=559.1/561.1;保留时间;0.787min,(m+h)=559.1/561.1。hplc:保留时间:1.784min。1h nmr(400mhz,dmso-d6):δ=8.98(s,1h),8.51(s,2h),8.46(s,1h),8.38(d,j=7.5hz,1h),7.72(s,1h),7.66(br d,j=8.4hz,2h),7.53-7.26(m,2h),6.10(s,1h),4.10-4.00(m,2h),3.86-3.75(m,1h),3.60-3.46(m,2h),3.01-2.87(m,2h),2.62-2.52(m,2h),1.93-1.73(m,2h),1.57-1.40(m,1h),1.32(dt,j=8.3,11.2hz,1h),1.00-0.89(m,4h)。
[0403]
实施例24.inscov-501h(1)的合成
[0404]
方案21
[0405]
步骤1:在0℃下,向化合物1(10g,49.93mmol,1eq)和et3n(7.58g,74.90mmol,10.42ml,1.5eq)在dcm(60ml)中的溶液中添加乙烷磺酰氯(7.06g,54.92mmol,5.19ml,1.1eq)。在25℃下将混合物搅拌1h。tlc(pe:ea=1:1,茚三酮)指示化合物1(rf=0.2)完全消耗,并且形成两个新斑点(rf=0.7,rf=0.4)。在0℃下,将反应混合物通过添加100ml h2o来淬灭,并且用dcm(100ml
×
3)萃取。将合并的有机层用盐水(40ml
×
3)洗涤,经na2so4干燥,过滤并减压浓缩以产生残余物。在25℃下,将粗产物用ea(100ml)研磨20min,接着过滤以产生白色固体。获得了呈白色固体的化合物2(12g,41.04mmol,82.20%产率),其通过hnmr来核实。
[0406]1h nmr(400mhz,氯仿-d):δ=4.68-4.29(m,1h),3.78(br d,j=12.3hz,2h),3.68-3.50(m,1h),3.01-2.87(m,4h),2.03(br dd,j=2.7,12.8hz,2h),1.55-1.49(m,1h),1.55-1.48(m,1h),1.46(s,9h),1.37(t,j=7.5hz,3h)。
[0407]
步骤2:在0℃下,向化合物2(8g,27.36mmol,1eq)在dcm(50ml)中的溶液中添加tfa(7.5ml)。在25℃下将反应搅拌5h。tlc(pe:ea=1:1,茚三酮)指示化合物2完全消耗,并且形成一个新斑点。在0℃下,将反应混合物通过添加80ml h2o来淬灭。将反应混合物用dcm(100ml
×
10)萃取。将合并的有机层经na2so4干燥,过滤并减压浓缩以产生残余物。获得了呈浅黄色油状物的化合物3(3.5g,18.20mmol,66.53%产率),其通过hnmr来核实。
[0408]1h nmr(400mhz,氯仿-d):δ=3.65(br dd,j=2.8,12.2hz,2h),2.96-2.69(m,5h),1.88-1.74(m,2h),1.57
ꢀ‑
1.42(m,2h),1.39-1.21(m,4h),1.22-1.12(m,1h)。
[0409]
步骤3:在25℃下,将hcooh(1.50g,31.20mmol,3.0eq)和ac2o(1.27g,12.48mmol,1.17ml,1.2eq)的混合物搅拌10min。将化合物3(2.0g,10.40mmol,1eq)在dcm(20ml)中的溶液缓慢添加至以上混合物中。在25℃下将混合物搅拌3h。tlc(meoh:dcm=1:10,i2)显示化合物3(rf=0)被消耗,并且观察到新斑点(rf=0.3)。在10℃下,将混合物缓慢倾倒至饱和nahco3(100ml)中,接着用dcm(80ml
×
2)萃取。将合并的有机层用盐水(40ml)洗涤,经na2so4干燥,过滤并真空浓缩以产生粗品。粗产物不经进一步纯化即用于下一步骤中。获得了呈浅黄色固体的化合物4(2.25g,10.21mmol,98.20%产率),其通过hnmr来核实。
[0410]1h nmr(400mhz,氯仿-d):δ=8.15(s,1h),5.82-5.56(m,1h),4.17-3.94(m,1h),3.83(br d,j=12.8hz,2h),3.05-2.82(m,4h),2.12-1.99(m,2h),1.62-1.49(m,2h),1.37(t,j=7.4hz,3h)。
[0411]
步骤4:在0℃下,向化合物4(0.3g,1.36mmol,1eq)和et3n(413.41mg,4.09mmol,
568.66μl,3.0eq)在dcm(30ml)中的溶液中逐滴缓慢添加pocl3(626.45mg,4.09mmol,379.66μl,3.0eq)。在0℃下将混合物搅拌1h。tlc(pe:ea=1:1,i2)显示化合物4(rf=0)被消耗,并且观察到新斑点(rf=0.45)。在10℃下,将混合物缓慢倾倒至饱和nahco3(100ml)中,接着用dcm(60ml
×
2)萃取。将合并的有机层用盐水(30ml
×
2)洗涤,经na2so4干燥,过滤并真空浓缩以产生粗品。将粗产物通过硅胶色谱法来纯化,用石油醚/乙酸乙酯=1:1洗脱以产生所需产物。获得了呈无色油状物的化合物5(165mg,815.73μmol,59.90%产率),其通过hnmr来核实。
[0412]1h nmr(400mhz,氯仿-d):δ=3.94(br s,1h),3.63-3.46(m,2h),3.46-3.30(m,2h),2.98(q,j=7.4hz,2h),2.04-1.89(m,4h),1.38(t,j=7.4hz,3h)。
[0413]
步骤5:根据用于inscov系列的一般性程序获得inscov-501h(1),并且进行以下纯化b:将反应真空浓缩。将粗品溶解于乙酸乙酯(2ml)中,搅拌片刻并过滤,并且将滤饼真空浓缩。获得了呈橙色固体的inscov-501h(1)(83.93mg,144.18μmol,46.19%产率,93.968%纯度),其通过lcms、hplc和hnmr来确认。
[0414]
lcms:保留时间:0.652min,(m+h)=547.1;保留时间;0.790min,(m+h)=547.1hplc:保留时间:1.752min。1h nmr(400mhz,dmso-d6):δ=8.97(s,1h),8.49(s,2h),8.46(s,1h),8.36(d,j=7.5hz,1h),7.73-7.70(m,1h),7.65(br d,j=8.6hz,2h),7.49-7.33(m,2h),6.08(s,1h),4.05(br d,j=6.2hz,2h),3.84-3.74(m,1h),3.60-3.39(m,3h),3.07-3.01(m,2h),2.95-2.86(m,2h),1.88-1.74(m,2h),1.50-1.40(m,1h),1.33-1.25(m,1h),1.21-1.17(m,3h)。
[0415]
实施例25. 2-氯-n-(2-((1,1-二氧代四氢-2h-噻喃-4-基)氨基)-2-氧代-1-(吡嗪-2-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-501m)的合成
[0416]
根据用于inscov系列的一般性程序合成inscov-501m,并且进行以下纯化a:将残余物通过制备型hplc(柱:phenomenex luna c18 150
×
25mm
×
10μm;流动相:[水(0.225%fa)-acn];b%:18%-48%,11min)来纯化,并且通过冻干来干燥。获得了呈黄色固体的inscov-501m(9.55mg,18.40μmol,6.63%产率,97.122%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0417]
lcms:保留时间:0.807min,(m+h)=504.3;保留时间;0.808min,(m+h)=504.2。hplc:保留时间:1.351min。sfc:保留时间:1.815min,2.285min。1h nmr(400mhz,dmso-d6):δ=8.74-8.33(m,5h),8.13(s,1h),7.69(s,1h),7.65-7.36(m,4h),6.23(s,1h),4.28-3.62(m,3h),3.12-2.92(m,2h),2.10-1.81(m,4h)。
[0418]
实施例26. 2-氯-n-(4-(噁唑-5-基)苯基)-n-(2-氧代-1-(吡嗪-2-基)-2-((甲苯磺酰基甲基)氨基)乙基)乙酰胺(inscov-501o)的合成
[0419]
根据用于inscov系列的一般性程序获得inscov-501o,并且进行以下纯化a:将残余物溶解于meoh(2ml)中,并且通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:30%-50%,6.5min)来纯化并浓缩以移除mecn,将液体冻干以产生产物。获得了呈黄色固体的inscov-501o(274.41mg,486.27μmol,52.56%产率,95.689%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0420]
lcms:保留时间:0.873min,(m+h)=540.1;保留时间;0.864min,(m+h)=540.1,hplc:保留时间:1.830min。sfc:保留时间:0.846min,1.337min。1h nmr(400mhz,dmso-d6):
n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-501s)的合成
[0431]
根据用于inscov系列的一般性程序获得inscov-501s。纯化a:将反应混合物真空浓缩以产生残余物。将残余物通过制备型hplc(柱:phenomenex synergi c18 150
×
25mm
×
10μm;流动相:[水(0.1%tfa)-acn];b%:35%-65%,10min)来纯化以产生呈黄色固体的inscov-501s(100mg,204μmol,29%产率,99.9%纯度),其通过lcms、hplc和hnmr来确认。
[0432]
lcms:保留时间:0.842min,(m+h)=490.4。hplc:保留时间:1.796min。1h nmr(400mhz,cdcl3):δ=8.75(s,1h),8.54(m,1h),8.51(m,1h),7.95(s,1h),7.67(s,1h),7.65(s,1h),7.45-7.44(m,2h),7.41(s,1h),7.33(d,j=7.6hz,1h),5.89(s,1h),3.98-3.87(m,3h),2.10-1.97(m,3h),1.94-1.79(m,3h),1.63-1.47(m,2h)。
[0433]
实施例31. 2-氯-n-(3-氯-4-甲氧基苯基)-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)乙酰胺(inscov-509)的合成
[0434]
根据用于inscov系列的一般性程序获得inscov-509。纯化a:将残余物通过制备型hplc(柱:phenomenex luna c18 150
×
25mm
×
10um;流动相:[水(0.225%fa)-acn];b%:36%-66%,10min)来纯化以得到溶液。将粗产物通过制备型hplc(柱:phenomenex luna c18 150
×
25mm
×
10um;流动相:[水(0.225%fa)-acn];b%:36%-66%,10min)来纯化以得到溶液2。将溶液1和溶液2合并,并且通过冻干来干燥。获得了呈白色固体的inscov-509(162.68mg,353.59μmol,27.86%产率,97.886%纯度),其通过lcms、hplc和hnmr来确认。
[0435]
lcms:保留时间:0.696min,[m+h]=450.0;保留时间;0.858min,[m+h]=450.2。hplc:保留时间:1.882min。1h nmr(400mhz,dmso-d6):δ=8.40-8.24(m,2h),8.14(d,j=7.2hz,1h),8.00-7.54(m,1h),7.41-7.30(m,1h),7.23-7.13(m,1h),7.11-6.68(m,2h),6.10-5.97(m,1h),4.09-3.90(m,2h),3.86-3.71(m,3h),3.66-3.52(m,1h),1.79-1.49(m,5h),1.31-0.94(m,5h)。
[0436]
实施例32. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(2,4-二甲氧基苯基)乙酰胺(inscov-512)的合成
[0437]
根据用于inscov系列的一般性程序获得inscov-512。纯化a:将粗产物通过反相hplc(0.1%fa条件)来纯化并真空浓缩以移除mecn,并且通过冻干来干燥。获得了呈黄色固体的inscov-512(255.93mg,553.41μmol,59.28%产率,96.427%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0438]
lcms:保留时间:0.737min,[m+h]=446.0;保留时间;0.831min,[m+h]=446.1。hplc:保留时间:1.682min。sfc:保留时间:1.143min和1.441min。1h nmr(400mhz,dmso-d6):δ=8.28-8.27(m,1h),8.20(d,j=1.8hz,1h),7.99(d,j=7.8hz,1h),7.61(d,j=8.8hz,1h),7.30-7.28(m,1h),7.10-7.08(m,1h),6.48-6.45(m,1h),6.23(d,j=2.8hz,1h),5.88(s,1h),3.96(d,j=14.2hz,1h),3.79(d,j=14.2hz,1h),3.67(s,3h),3.60-3.52(m,1h),3.45(s,3h),1.79-1.52(m,5h),1.25-0.93(m,5h)。
[0439]
实施例33.inscov-517b的合成
[0440]
方案22
[0441]
步骤1:在0℃下,在n2下,向化合物1(500mg,2.47mmol,1eq)和化合物2(267.39mg,2.47mmol,1eq)在dcm(0.5ml)中的溶液中添加ticl4(1m,1.24ml,0.5eq)、tea(750.91mg,7.42mmol,1.03ml,3eq)。在0℃下将混合物搅拌1h。接着将混合物升温至30℃,并且搅拌11h。lcms显示化合物1被消耗,并且检测到所需质量。将混合物溶解于dcm(50ml)中并用饱和nh4cl(50ml)淬灭,分离,并且将水相用dcm(3
×
20ml)萃取。将有机层用盐水洗涤,经无水na2so4干燥,过滤并真空浓缩。获得了呈黄色油状物的化合物3(210mg,粗品)。将它直接用于下一步骤。
[0442]
lcms:保留时间:0.961/0.989min,(m+h)=293.1。
[0443]
步骤2:通过用于inscov系列的一般性方法制备inscov-517b。纯化b:将混合物真空浓缩。将残余物溶解于metb(8ml)中,搅拌15min,过滤,并且将滤饼溶解于乙酸乙酯(8ml)中,搅拌15min,过滤,并且将滤饼真空浓缩。获得了呈灰白色固体的inscov-517b(65.13mg,115.00μmol,16.69%产率,93.909%纯度)。其通过hnmr、fnmr、lcms和hplc来证实。
[0444]
lcms:保留时间:1.000min,(m+h)=532.3;保留时间;0.903min,(m+h)=532.3。hplc:保留时间:2.219min。1h nmr(400mhz,dmso-d6):δ=8.75-8.60(m,2h),8.48(d,j=2.4hz,1h),8.39-8.33(m,1h),8.23(br d,j=3.5hz,1h),8.13(br s,1h),7.88-7.72(m,2h),6.32(s,1h),4.14(br d,j=2.1hz,2h),3.87-3.57(m,1h),2.04-1.62(m,8h),1.53-1.27(m,2h)。
19
f nmr(377mhz,dmso-d6):δ=-93.00
‑‑
94.10(m,1f),-96.71
‑‑
98.22(m,1f)。1h nmr(400mhz,dmso-d6,t=50):δ=8.60-8.52(m,1h),8.45-8.39(m,1h),8.31(br s,1h),8.22-8.14(m,1h),8.13-8.08(m,1h),8.06-7.95(m,1h),7.79-7.66(m,2h),6.29(s,1h),4.20-3.98(m,2h),3.82-3.70(m,1h),1.99-1.65(m,8h),1.50-1.30(m,2h)。
19
f nmr(376mhz,dmso-d6,t=50):δ=-93.35
‑‑
94.20(m,1f),-96.66
‑‑
97.90(m,1f)。
[0445]
实施例34.n-(叔丁基)-2-(n-(4-(叔丁基)苯基)-2-氯乙酰胺基)-2-(吡啶-3-基)乙酰胺(inscov-534)的合成
[0446]
根据用于inscov系列的一般性程序获得inscov-534。纯化a:将残余物通过制备型hplc(柱:phenomenex luna c18 150
×
40mm
×
15μm;流动相:[水(0.225%fa)-acn];b%:37%-67%,10min)来纯化。获得了呈白色固体的n-叔丁基-2-(4-叔丁基-n-(2-氯乙酰基)苯胺基)-2-(3-吡啶基)乙酰胺(50.79mg,121.23μmol,11.46%产率,99.286%纯度),其通过hnmr、lcms和hplc来确认。
[0447]
hplc:保留时间:1.912min。lcms:保留时间:0.886min,(m+h)=416.4;保留时间;0.870min,(m+h)=416.3。1h nmr(400mhz,dmso-d6):δ=8.33-8.24(m,2h),7.84(s,1h),7.38-7.01(m,5h),6.00(s,1h),4.00-3.89(m,2h),1.21(s,9h),1.17(s,9h)。
[0448]
实施例35.n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-1-(5-羟基吡啶-3-基)-2-氧代乙基)乙酰胺(inscov-535)的合成
[0449]
根据用于inscov系列的一般性程序获得inscov-535。纯化a:将粗品通过制备型hplc(柱:phenomenex luna c18 150
×
40mm
×
15um;流动相:[水(0.225%fa)-acn];b%:30%-60%,10min)和制备型hplc(柱:welchμltimate xb-sioh 250
×
50
×
10μm;流动相:[己烷-etoh(0.1%nh3·
h2)];b%:1%-30%,15min)来纯化。获得了呈白色固体的2-(4-叔丁基-n-(2-氯乙酰基)苯胺基)-n-环己基-2-(5-羟基-3-吡啶基)乙酰胺(16.39mg,33.43μmol,3.16%产率,93.404%纯度),其通过hnmr、lcms和hplc来确认。
[0450]
hplc:保留时间:2.238min。lcms:保留时间:0.799min,(m+h)=458.3;保留时间;0.883min,(m+h)=458.1。1h nmr(400mhz,dmso-d6):δ=9.71(s,1h),8.04(br d,j=7.2hz,1h),7.85(d,j=2.4hz,1h),7.77(d,j=1.2hz,1h),7.24(br d,j=6.0hz,4h),6.71(s,1h),5.95(s,1h),4.01-3.85(m,2h),3.63-3.50(m,1h),1.79-1.48(m,5h),1.28-1.05(m,14h)。
[0451]
实施例36.n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(嘧啶-5-基)乙基)乙酰胺(inscov-536)的合成
[0452]
根据用于inscov系列的一般性程序获得inscov-536。纯化a:将粗品通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.1%tfa)-acn];b%:57%-87%,7min)来纯化。获得了呈黄色固体的inscov-536(45.49mg,97.79μmol,9.24%产率,95.224%纯度),其通过lcms、hplc和hnmr来确认。
[0453]
hplc:保留时间:2.451min。lcms:保留时间:0.998min,(m+h)=443。1h nmr(400mhz,dmso-d6):δ=8.95(s,1h),8.43(s,2h),8.13(br d,j=7.2hz,1h),7.39-7.11(m,4h),6.03(s,1h),4.06-3.91(m,2h),3.65-3.49(m,1h),1.78-1.54(m,5h),1.35-1.13(m,14h)。
[0454]
实施例37.n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(哒嗪-4-基)乙基)乙酰胺(inscov-537)的合成
[0455]
根据用于inscov系列的一般性程序获得inscov-537。纯化a:将粗品通过制备型hplc(柱:phenomenex luna c18 150
×
40mm
×
15μm;流动相:[水(0.225%fa)-acn];b%:45%-75%,10min)和制备型hplc(柱:welchμltimate xb-cn 250
×
70
×
10um;流动相:[己烷-etoh(0.1%nh3·
h2o)];b%:10%-50%,15min)来纯化,获得了呈白色固体的inscov-537(15.87mg,34.62μmol,3.27%产率,96.637%纯度),其通过hnmr、lcms和hplc来确认。
[0456]
hplc:保留时间:2.595min。lcms:保留时间:0.973min,(m+h)=443.2。1h nmr(400mhz,dmso-d6):δ=9.07-9.02(m,1h),9.00(s,1h),8.18(br d,j=7.2hz,1h),7.40-7.20(m,5h),5.99(s,1h),4.09-3.94(m,2h),3.59-3.48(m,1h),1.64(br d,j=4.8hz,4h),1.53(br d,j=12.0hz,1h),1.21(s,10h),1.16-1.00(m,3h)。
[0457]
实施例38. 2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(哒嗪-4-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(inscov-537i)的合成
[0458]
根据用于inscov系列的一般性程序合成inscov-537i。纯化b:将粗品用etoh(2ml)研磨,将它过滤,将滤饼用pe(5ml)洗涤,真空干燥。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(哒嗪-4-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(194.18mg,364.45μmol,43.05%产率,91.948%纯度),其通过hnmr、lcms和hplc来确认。
[0459]
hplc:保留时间:2.064min。lcms:保留时间:0.771min,(m+h)=490.2;保留时间;
0.842min,(m+h)=490.0。1h nmr(400mhz,dmso-d6):δ=9.15-8.98(m,2h),8.46(s,1h),8.38(br d,j=6.8hz,1h),7.79-7.60(m,1h),7.81-7.57(m,2h),7.55-7.32(m,1h),7.57-7.31(m,1h),6.06(s,1h),4.20-3.99(m,2h),3.94-3.75(m,1h),2.13-1.68(m,7h),1.60-1.30(m,2h)。
[0460]
实施例39. 2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(哒嗪-4-基)乙基)-n-(4-(异噁唑-5-基)苯基)乙酰胺(inscov-537k)的合成
[0461]
根据用于inscov系列的一般性程序合成inscov-537k。纯化b:将粗品用etoh(2ml)研磨,将它过滤,将滤饼用pe(5ml)洗涤,真空干燥。获得了呈黄色固体的2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(哒嗪-4-基)乙基)-n-(4-(噁唑-5-基)苯基)乙酰胺(194.18mg,364.45μmol,43.05%产率,91.948%纯度),其通过hnmr、lcms和hplc来确认。
[0462]
hplc:保留时间:2.064min。lcms:保留时间:0.771min,(m+h)=490.2;保留时间;0.842min,(m+h)=490.0。1h nmr(400mhz,dmso-d6):δ=9.15-8.98(m,2h),8.46(s,1h),8.38(br d,j=6.8hz,1h),7.79-7.60(m,1h),7.81-7.57(m,2h),7.55-7.32(m,1h),7.57-7.31(m,1h),6.06(s,1h),4.20-3.99(m,2h),3.94-3.75(m,1h),2.13-1.68(m,7h),1.60-1.30(m,2h)。
[0463]
实施例40.n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡嗪-2-基)乙基)乙酰胺(inscov-538)的合成
[0464]
根据用于inscov系列的一般性程序合成inscov-538。纯化a:将粗品用mtbe(5ml)研磨,将它过滤,将滤饼用etoh(2ml)研磨,将它过滤,将滤饼真空干燥。获得了呈白色固体的n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡嗪-2-基)乙基)乙酰胺(272.7mg,599.17μmol,56.62%产率,97.330%纯度),其通过hnmr、lcms和hplc来确认。
[0465]
hplc:保留时间:2.804min。lcms:保留时间:1.029min,(m+h)=443.2,保留时间:1.014min,(m+h)=443.2。1h nmr(400mhz,dmso-d6):δ=8.58-8.36(m,3h),8.14(br d,j=7.2hz,1h),7.28(br s,4h),6.13(s,1h),4.13-3.92(m,2h),3.58-3.42(m,1h),1.73-1.44(m,5h),1.21(s,11h),1.13-0.97(m,3h)。
[0466]
实施例41.n-(4-(叔丁基)苯基)-2-氯-n-(1-(5-氰基吡啶-3-基)-2-(环己基氨基)-2-氧代乙基)乙酰胺(inscov-539)的合成
[0467]
根据用于inscov系列的一般性程序合成inscov-539。纯化b:将混合物倾倒至etoh(5ml)中。将混合物过滤。将滤饼用etoh(1ml)和mtbe(1ml)洗涤,将它真空干燥。获得了呈白色固体的inscov-539(309.39mg,648.42μmol,61.27%产率,97.874%纯度),其通过hnmr、lcms和hplc来确认。
[0468]
hplc:保留时间:2.895min。lcms:保留时间:1.029min,(m+h)=467.1。1h nmr(400mhz,dmso-d6):δ=8.84(d,j=1.8hz,1h),8.57(d,j=2.0hz,1h),8.13(d,j=8.0hz,1h),7.75(t,j=2.0hz,1h),7.43-7.03(m,4h),6.06(s,1h),4.01(s,2h),3.61-3.48(m,1h),1.76-1.47(m,5h),1.31-1.05(m,14h)。
[0469]
实施例42.n-(4-(叔丁基)苯基)-2-氯-n-(1-(6-氰基吡啶-3-基)-2-(环己基氨基)-2-氧代乙基)乙酰胺(inscov-539a)的合成
[0470]
根据用于inscov系列的一般性程序合成inscov-539a。纯化b:在25℃下,将粗产物用acn研磨30min。获得了呈白色固体的化合物(2r)-2-(4-叔丁基-n-(2-氯乙酰基)苯胺
基)-2-(6-氰基-3-吡啶基)-n-环己基-乙酰胺(350.65mg,737.50μmol,55.03%产率,98.222%纯度)。1hnmr、lcms和hplc确认了正确结构。
[0471]
lcms:保留时间:1.102min,(m+h)=467.2。hplc:保留时间:2.939min。1h nmr(400mhz,氯仿-d):δ=8.55(s,1h),7.65(br d,j=8.1hz,1h),7.48(s,1h),7.37-7.29(m,2h),7.27(s,1h),7.09-6.79(m,1h),6.22-6.14(m,1h),6.09(s,1h),3.87-3.84(m,2h),3.84-3.77(m,1h),2.00(br d,j=10.8hz,1h),1.88(br dd,j=1.7,10.8hz,1h),1.80-1.66(m,2h),1.61(s,5h),1.46-1.33(m,2h),1.29(s,9h),1.19(br d,j=12.2hz,3h)。
[0472]
实施例43.inscov-549的合成
[0473]
方案23
[0474]
根据用于inscov系列的一般性程序合成inscov-549。纯化b:将混合物倾倒至水(20ml)中,并且添加dcm(20ml),将有机层用盐水(20ml)洗涤,经na2so4干燥并真空浓缩。将粗品用mtbe(5ml)研磨,将它过滤,将滤饼用etoh(2ml)研磨,将它过滤,将滤饼真空干燥。获得了呈白色固体的inscov-549(154.05mg,309.88μmol,29.28%产率,96.763%纯度),其通过hnmr、lcms和hplc来确认。
[0475]
hplc:保留时间:2.462min。lcms:保留时间:0.937min,(m+h)=481.2。1h nmr(400mhz,dmso-d6):δ=11.46(br s,1h),8.07(d,j=4.0hz,1h),7.81(br d,j=78.0hz,1h),7.55(br d,j=8.0hz,1h),7.24-6.77(m,4h),6.30(s,1h),4.01-3.85(m,2h),3.66-3.52(m,1h),1.82-1.46(m,5h),1.34-0.94(m,14h)。
[0476]
实施例44.n-(4-(叔丁基)-2-(3-吗啉代基丙-1-炔-1-基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)乙酰胺(inscov-553)的合成
[0477]
根据用于inscov系列的一般性程序合成inscov-553。纯化b:将残余物用mecn(3ml)研磨,接着过滤。将滤饼用mecn(2ml
×
2)洗涤,并且真空干燥。获得了呈白色固体的inscov-553(72.6mg,123μmol,33.6%产率,96.0%纯度),其通过hnmr、lcms和hplc来确认。
[0478]
lcms:保留时间:1.025min,[m+h
+
]=565.3。hplc:保留时间:2.741min。1h nmr(400mhz,dmso-d6):δ=8.31(d,j=2.1hz,1h),8.27(dd,j=1.2,4.8hz,1h),8.08(d,j=7.6hz,1h),7.85(d,j=8.4hz,1h),7.45-7.40(m,1h),7.27(d,j=8.1hz,1h),7.14(d,j=2.4hz,1h),7.03(dd,j=4.8,8.0hz,1h),6.02(s,1h),4.02-3.92(m,1h),3.90-3.81(m,1h),3.63(t,j=4.8hz,4h),3.60-3.54(m,1h),3.50(d,j=2.8hz,2h),3.31(s,2h),1.85-1.73(m,1h),1.73-1.65(m,1h),1.63-1.44(m,3h),1.28-1.12(m,13h),1.11-0.86(m,2h)。
[0479]
实施例45.inscov-557a的合成
[0480]
方案24
[0481]
步骤1:向化合物1(3g,18.50mmol,1eq)和化合物2(1.91g,22.20mmol,1.2eq)在dce(120ml)中的溶液中添加nahco3(3.11g,37.00mmol,1.44ml,2eq)、cu(oac)2(3.36g,18.50mmol,1eq)和2-(2-吡啶基)吡啶(2.89g,18.50mmol,1eq)。在25℃下,在o2(15psi)下,将反应搅拌4天。接着在o2(15psi)下将混合物加热至60℃,持续24h。lcms显示化合物1有剩余,并且检测到一个具有所需质量的新峰(rt=0.917min)。tlc(pe:ea=5:1)显示化合物1(rf=0.2)有剩余,并且形成两个新斑点(rf=0.02,rf=0.7)。将混合物用水(50ml)稀释,并且用dcm(70ml
×
3)萃取。将有机层用无水na2so4干燥,过滤并真空浓缩。将残余物通过快速硅胶色谱法(80g二氧化硅快速柱,0~30%乙酸乙酯/石油醚梯度的洗脱剂,在100ml/min下)来纯化,并且真空浓缩。获得了呈黄色固体的化合物3(1.6g,7.91mmol,42.77%产率),其通过hnmr来确认。
[0482]
lcms:保留时间:0.972min,(m+h)=203.1。1h nmr(400mhz,dmso-d6)δ=8.13-8.07(m,2h),7.78-7.72(m,1h),7.43-7.37(m,1h),6.98(d,j=3.2hz,1h),3.62-3.56(m,1h),1.18-1.07(m,2h),1.07-0.95(m,2h)。
[0483]
步骤2:向化合物3(1g,4.95mmol,1eq)在meoh(20ml)中的溶液中添加pd/c(0.1g,2.97mmol,10%纯度,0.6eq)。在25℃下,在h2(50psi)下,将反应混合物搅拌24h。lcms显示化合物3完全消耗,并且检测到一个具有所需质量的新峰(rf=0.903min)。tlc(pe:ea=5:1)显示化合物3(rf=0.5)完全消耗,并且形成一个新斑点(rf=0.3)。将反应混合物合并以进行后处理。通过nh3·
h2o将反应混合物调整至ph=10,经硅藻土垫过滤,并且用meoh(40ml
×
2)洗涤。将滤液真空浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~80%乙酸乙酯/石油醚梯度的洗脱剂,在80ml/min下)来纯化。将合并的有机相真空浓缩。获得了呈红色油状物的化合物4(0.9g,5.23mmol,105.67%产率),其通过hnmr来确认。
[0484]
lcms:保留时间:0.903min,(m+h)=173.2。1h nmr(400mhz,dmso-d6)δ=7.03(d,j=3.3hz,1h),6.88-6.80(m,1h),6.73(d,j=8.0hz,1h),6.45(d,j=2.8hz,1h),6.20
–
6.14(m,1h),5.17(s,2h),3.31-3.27(m,1h),1.04-0.95(m,2h),0.90-0.82(m,2h)。
[0485]
步骤3:根据用于inscov系列的一般性程序合成inscov-557a。纯化a:将反应真空浓缩。将粗产物通过反相hplc(0.1%fa)来纯化并真空浓缩以移除mecn。将水相冻干以产生
粗产物。将残余物溶解于dmf(2ml)中,并且通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:35%-65%,8min)来纯化并用水(30ml)稀释,将液体冻干以产生产物。获得了呈黄色固体的inscov-557-a(7.16mg,13.79μmol,1.49%产率,96.703%纯度),其通过lcms、hplc、sfc、hnmr和fnmr来确认。
[0486]
lcms:保留时间:0.913min,(m+h)=502.0。hplc:保留时间:2.196min。sfc:保留时间:3.036min,3.281min。1h nmr(400mhz,dmso-d6)δ=8.88(s,1h),8.72(s,1h),8.52(s,1h),8.41(s,2h),8.25-8.11(m,1h),7.53(d,j=7.6hz,1h),7.48(d,j=8.4hz,1h),7.42(d,j=3.2hz,1h),7.24(d,j=3.2hz,1h),7.22-7.14(m,1h),7.04-6.98(m,1h),6.86-6.77(m,1h),6.24(d,j=3.2hz,1h),6.10(s,1h),5.88-5.78(m,1h),5.82(s,1h),4.07-3.67(m,5h),3.49-3.42(m,1h),2.08-1.47(m,11h),1.39-1.22(m,2h),1.08-0.77(m,7h)。
19
f nmr(377mhz,dmso-d6)δ=-92.05
‑‑
95.13(m,1f),-96.91
‑‑
99.42(m,1f)。
[0487]
实施例46. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(3-氟苯乙基)乙酰胺(inscov-558)的合成
[0488]
根据用于inscov系列的一般性程序合成inscov-558。纯化b:在4℃下,将粗产物通过acn(10ml)来研磨以产生以白色固体形式获得的纯净产物2-[(2-氯乙酰基)-[2-(3-氟苯基)乙基]氨基]-n-环己基-2-(3-吡啶基)乙酰胺(105.75mg,236.21μmol,16.44%产率,96.477%纯度)。获得了呈白色固体的化合物2-[(2-氯乙酰基)-[2-(3-氟苯基)乙基]氨基]-n-环己基-2-(3-吡啶基)乙酰胺(105.75mg,236.21μmol,16.44%产率,96.477%纯度)。lcms、hplc、1hnmr和fnmr核实了正确结构。
[0489]
lcms:保留时间:0.970min,(m+h)=432.1。hplc:保留时间:2.482min。1h nmr(400mhz,氯仿-d):δ=8.71-8.61(m,2h),7.89(br d,j=7.7hz,1h),7.38(dd,j=4.8,7.9hz,1h),7.26-7.16(m,1h),6.92(br t,j=8.1hz,1h),6.82(br d,j=7.7hz,1h),6.73(br d,j=9.5hz,1h),6.02(br d,j=6.2hz,1h),5.80(s,1h),3.99(s,2h),3.90-3.77(m,1h),3.60(br t,j=7.6hz,2h),2.88-2.75(m,1h),2.58-2.45(m,1h),1.99-1.88(m,2h),1.74-1.66(m,2h),1.61-1.56(m,1h),1.44-1.31(m,2h),1.23-1.08(m,3h)。
[0490]
实施例47. 2-氯-n-(2-((1,1-二氧代四氢-2h-噻喃-4-基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(3-氟苯乙基)乙酰胺(inscov-558a)的合成
[0491]
根据用于inscov系列的一般性程序合成inscov-558a。纯化a:将粗产物通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:24%-54%,10min)来纯化。获得了呈白色固体的2-[(2-氯乙酰基)-[2-(3-氟苯基)乙基]氨基]-n-(1,1-二氧代硫杂环己烷-4-基)-2-嘧啶-5-基-乙酰胺(5.7mg,10.81μmol,1.77%产率,91.597%纯度),其通过lcms、hplc和hnmr来检测。
[0492]
lcms:保留时间:0.861min,[m+h+]=483.2。hplc:保留时间:1.896min。1h nmr:(400mhz,dmso-d6):δ=9.14(s,1h),8.74(s,2h),8.05(br d,j=7.8hz,1h),7.42-7.20(m,1h),7.15-6.88(m,3h),5.68(s,1h),4.60-4.50(m,2h),4.14-3.97(m,1h),3.58(br t,j=8.3hz,2h),3.27-3.20(m,2h),3.11-2.98(m,3h),2.92-2.75(m,1h),2.64-2.59(m,1h),2.03-1.88(m,4h)。
[0493]
实施例48. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(4-氟苯乙基)乙酰胺(inscov-559)的合成
[0494]
根据用于inscov系列的一般性程序合成inscov-559。纯化a:将残余物通过制备型hplc(柱:phenomenex synergi c18 150
×
25mm
×
10um;流动相:[水(0.1%tfa)-acn];b%:25%-55%,10min)来纯化,接着lcms核实,并且检测到73%的所需质量。将粗品通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:39%-69%,9min)来再纯化,接着lcms核实,并且检测到77%的所需质量。将粗品通过制备型hplc(柱:phenomenex gemini-nx c18 75
×
30mm
×
3um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:31%-61%,11.5min)来再纯化,接着lcms核实,并且检测到100%的所需质量。获得了呈白色固体的化合物2-[(2-氯乙酰基)-[2-(4-氟苯基)乙基]氨基]-n-环己基-2-(3-吡啶基)乙酰胺(15.23mg,35.26μmol,4.91e-1%产率)。1hnmr核实了结构。
[0495]
lcms:保留时间:0.978min,(m+h)=432.1。hplc:保留时间:2.498min。1h nmr(400mhz,氯仿-d):δ=8.71-8.61(m,2h),7.93-7.83(m,1h),7.41-7.33(m,1h),7.02-6.93(m,4h),6.02-5.93(m,1h),5.81-5.75(m,1h),4.01-3.93(m,2h),3.87-3.78(m,1h),3.64-3.52(m,2h),2.86-2.71(m,1h),2.57-2.42(m,1h),2.01-1.86(m,2h),1.78-1.64(m,3h),1.46-1.30(m,3h),1.23-1.10(m,4h)。
[0496]
实施例49. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(2-甲氧基苯乙基)乙酰胺(inscov-560a)的合成
[0497]
根据用于inscov系列的一般性程序合成inscov-560a。将残余物从meoh(10ml)进行研磨以产生呈白色固体的纯净产物2-[(2-氯乙酰基)-[2-(2-甲氧基苯基)乙基]氨基]-n-环己基-2-(3-吡啶基)乙酰胺(800mg,1.80mmol,27.25%产率,100%纯度)。获得了呈白色固体的化合物2-[(2-氯乙酰基)-[2-(2-甲氧基苯基)乙基]氨基]-n-环己基-2-(3-吡啶基)乙酰胺(800mg,1.80mmol,27.25%产率,100%纯度)。lcms、hplc和1hnmr核实了正确化合物。
[0498]
lcms:保留时间:0.980min,(m+h)=444.2。hplc:保留时间:2.522min。1h nmr(400mhz,氯仿-d):δ=8.70-8.62(m,2h),7.92-7.86(m,1h),7.39-7.33(m,1h),7.24-7.17(m,1h),6.83(d,j=5.1hz,2h),6.12-6.04(m,1h),5.92-5.89(m,1h),4.28(d,j=9.0hz,2h),3.84(s,4h),3.66-3.55(m,1h),3.55-3.44(m,1h),2.84-2.73(m,1h),2.37-2.27(m,1h),1.98-1.87(m,2h),1.67(br d,j=3.5hz,1h),1.69(br s,1h),1.63-1.55(m,1h),1.44-1.29(m,2h),1.23-1.08(m,3h)。
[0499]
实施例50.n-(4-(叔丁基)苯基)-2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)丙烯酰胺(inscov-570)的合成
[0500]
根据用于inscov系列的一般性程序合成inscov-570。纯化b:在20℃下,将粗产物用etoac(1ml)和石油醚(15ml)研磨60min。获得了呈白色固体的inscov-570(142mg,297μmol,44.36%产率,95.204%纯度)。通过lcms、hplc和1hnmr来核实。
[0501]
lcms:保留时间:1.070min,[m]=456.2;保留时间;3.029min,[m]=456.2.hplc:保留时间:2.939min。1h nmr(400mhz,dmso-d6):δ=8.34-8.24(m,2h),8.01(dd,j=7.6,15.2hz,1h),7.69-6.98(m,5h),5.98(d,j=17.6hz,1h),4.18(qd,j=6.6,13.6hz,1h),3.63-3.48(m,1h),1.78-1.41(m,8h),1.32-0.87(m,15h)。
[0502]
实施例51. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(3-(三氟甲基)苯甲基)乙酰胺(inscov-574)的合成
[0503]
根据用于inscov系列的一般性程序合成inscov-574。纯化b:将粗产物通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:36%-69%,9min)来纯化。获得了呈白色固体的inscov-574(153.85mg,327.55μmol,28.69%产率,99.62%纯度),其通过lcms、hplc、hnmr和fnmr来检测。
[0504]
lcms:保留时间:0.974min,[m+h
+
]=468.2;保留时间;2.449min,[m+h
+
]=468.2.hplc:保留时间:2.715min。1h nmr(400mhz,dmso-d6,t=80):δ=8.50-8.34(m,2h),7.93(br d,j=6.8hz,1h),7.66(br d,j=8.0hz,1h),7.54-7.10(m,5h),6.08-5.83(m,1h),4.96(d,j=17.2hz,1h),4.67(br d,j=17.0hz,1h),4.50-4.25(m,2h),3.66-3.51(m,1h),1.78
ꢀ‑
1.50(m,5h),1.31-1.09(m,5h)。
19
f nmr(400mhz,dmso-d6):-61.52(s,3f)。
[0505]
实施例52. 2-氯-n-(2-(环己基氨基)-2-氧代-1-(吡啶-3-基)乙基)-n-(2-(三氟甲基)苯甲基)乙酰胺(inscov-574a)的合成
[0506]
根据用于inscov系列的一般性程序合成inscov-574a。纯化b:将粗产物通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:38%-68%,9min)来纯化。获得了呈黄色固体的inscov-574a(254.01mg,533.37μmol,46.71%产率,98.252%纯度),其通过lcms、hplc、hnmr和fnmr来检测。
[0507]
lcms:保留时间:0.974min,[m+h
+
]=468.2.hplc:保留时间:2.705min。1h nmr(400mhz,dmso-d6,t=80):δ=8.64-8.26(m,2h),8.21-7.89(m,1h),7.79-7.04(m,6h),6.24-5.91(m,1h),5.16
ꢀ‑
4.67(m,2h),4.62-4.23(m,2h),3.76-3.38(m,1h),1.88-1.43(m,5h),1.33-1.08(m,5h)。
19
f nmr:(400mhz,dmso-d6):-60.52(s,3f)。
[0508]
实施例53.inscov-575的合成
[0509]
方案25
[0510]
根据用于inscov系列的一般性程序合成inscov-575。纯化b:将残余物倾倒至acn(5ml)中并搅拌5min,通过抽吸过滤收集结晶固体。将滤液调整至ph=7~8并丢弃。获得了呈白色固体的inscov-575(365.95mg,785.73μmol,63.33%产率,97.47%纯度),其通过lcms、hplc和hnmr来检测。
[0511]
lcms:保留时间:1.005min,[m+h
+
]=454.2.hplc:保留时间:2.777min。1h nmr(400mhz,dmso-d6):δ=8.39-8.22(m,2h),8.11(br d,j=6.7hz,1h),8.02-7.55(m,1h),7.47-7.29(m,1h),7.22-7.00(m,2h),7.00-6.46(m,1h),6.07(s,1h),4.11-3.82(m,2h),3.68-3.51(m,1h),2.33(br s,3h),2.19-1.85(m,3h),1.83-1.46(m,5h),1.38-0.86(m,5h)。
[0512]
实施例54.inscov-576的合成
[0513]
方案26
[0514]
步骤1:在25℃下,在n2下,向2-羟基-4-硝基-苯甲醛(2g,11.97mmol,1eq)和2-溴丙二酸二乙酯(2.86g,11.97mmol,2.04ml,1eq)在2-丁酮(50ml)中的混合物中一次性添加k2co3(4.96g,35.90mmol,3eq),接着加热至90℃并搅拌16小时。lcms显示反应完成。将混合物倾倒至冰水(100ml)中并搅拌5min。将水相用乙酸乙酯(100ml
×
3)萃取,用无水na2so4干燥,过滤并真空浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~100%乙酸乙酯/石油醚梯度的洗脱剂,在60ml/min下)来纯化。tlc(pe:ea=2:1,rf=0.6)。获得了呈浅黄色固体的6-硝基苯并呋喃-2-甲酸乙酯(2.7g,10.91mmol,91.13%产率,95%纯度),其通过lcms和1hnmr来检测。
[0515]
lcms:保留时间:0.909min,[m+h+]=236.2:保留时间:1.207min,[m+h+]=236.2。1h nmr(400mhz,氯仿-d):δ=8.53-8.47(m,1h),8.25(dd,j=2.0,8.8hz,1h),7.83(d,j=8.4hz,1h),7.61(d,j=1.0hz,1h),4.49(q,j=7.2hz,2h),1.58(s,3h)。
[0516]
步骤2:在25℃下,在n2下,向6-硝基苯并呋喃-2-甲酸乙酯(2g,8.50mmol,1eq)在etoh(20ml)中的混合物中一次性添加koh(715.65mg,12.76mmol,1.5eq),接着加热至70℃并搅拌1小时。lcms和hplc显示反应完成。减压蒸发溶剂,并且将残余物溶解于水(10ml)中并用浓盐酸酸化至ph 4。通过过滤收集所得沉淀,用水洗涤并干燥。获得了呈浅黄色固体的6-硝基苯并呋喃-2-甲酸(1.6g,粗品),其通过1hnmr来检测。
[0517]
lcms:保留时间:0.200min,[m+h
+
]=208.1。hplc:保留时间:0.249min。1h nmr(400mhz,dmso-d6):δ=8.67(s,1h),8.37-8.15(m,1h),8.03(br d,j=8.7hz,1h),7.83(s,1h)。
[0518]
步骤3:在室温下,在氮气下,向6-硝基苯并呋喃-2-甲酸(500mg,2.41mmol,1eq)在dmso(5ml)中的混合物中添加ag2co3(332.80mg,1.21mmol,54.74μl,0.5eq)和acoh(14.50mg,241.38μmol,13.81μl,0.1eq)。在120℃下将反应混合物搅拌3小时。lc-ms显示反应完成,并且得到所需产物。将混合物过滤。将混合物倾倒至冰水(20ml)中。将水相用乙酸乙酯(50ml
×
3)萃取,用无水na2so4干燥,过滤并真空浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~100%乙酸乙酯/石油醚梯度的洗脱剂,在60ml/min下)来纯化。tlc(pe/ea=3:1,rf=0.5)。获得了呈白色固体的6-硝基苯并呋喃(390mg,2.22mmol,92.11%产率,93%纯度),其通过1hnmr来检测。
[0519]
lcms:保留时间:0.915min,[m+h
+
]=164.1。1h nmr(400mhz,氯仿-d):δ=8.44(s,1h),8.20(dd,j=2.0,8.6hz,1h),7.90(d,j=2.4hz,1h),7.71(d,j=8.6hz,1h),6.92(dd,j=0.9,2.1hz,1h)。
[0520]
步骤4:将6-硝基苯并呋喃(350mg,2.15mmol,1eq)溶解于meoh(20ml)和thf(20ml)的混合溶剂中,接着向其中添加pd/c(350mg,10%纯度)。在25℃下,在h2(50psi)下,将反应混合物搅拌3小时。lc-ms显示反应完成,并且得到所需产物。在过滤和减压浓缩之后,获得了呈棕色油状物的2,3-二氢苯并呋喃-6-胺(270mg,粗品)。
[0521]
lcms:保留时间:0.777min,[m+h
+
]=136.2。
[0522]
步骤5:在25℃下,在n2下,向2,3-二氢苯并呋喃-6-胺(250mg,1.85mmol,1eq)在二噁烷(10ml)中的混合物中一次性添加ddq(461.86mg,2.03mmol,1.1eq),接着加热至90℃并搅拌2小时。lc-ms显示剩余39%的2,3-二氢苯并呋喃-6-胺,并且有14%的所需化合物。将混合物过滤并真空浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~100%乙酸乙酯/石油醚梯度的洗脱剂,在50ml/min下)来纯化。tlc(pe/ea=3/1,rf=0.5)。获得了呈棕色油状物的苯并呋喃-6-胺(120mg,865.21μmol,46.78%产率,96%纯度),其通过lcms来检测。
[0523]
lcms:保留时间:0.703min,[m+h
+
]=134.2。
[0524]
步骤6:根据用于inscov系列的一般性程序合成inscov-576。纯化a:将粗产物通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:36%-66%,8min)来纯化。获得了呈白色固体的inscov-576 2-[苯并呋喃-6-基-(2-氯乙酰基)氨基]-n-环己基-2-(3-吡啶基)乙酰胺(80.51mg,184.23μmol,30.66%产率,97.46%纯度),其通过lcms、hplc和hnmr来检测。
[0525]
lcms:保留时间:0.920min,[m+h
+
]=426.2。hplc:保留时间:2.452min。1h nmr(400mhz,dmso-d6):δ=8.44-8.23(m,2h),7.92(d,j=2.1hz,1h),7.83-7.54(m,1h),7.82-7.51(m,1h),7.51-7.37(m,2h),7.21-7.00(m,2h),6.86(dd,j=0.9,2.2hz,1h),6.14(s,1h),4.07-3.78(m,2h),3.71-3.49(m,1h),1.94
ꢀ‑
1.46(m,5h),1.41-1.00(m,5h)。
[0526]
实施例55.inscov-600a的合成
[0527]
方案27
[0528]
步骤1:在70℃下,在n2下,将化合物1(5.0g,49.43mmol,1eq)和化合物2(46.05g,621.64mmol,50ml,12.58eq)的混合物搅拌12h。tlc(pe/ea=3/1)指示化合物1(rf=0.0)被消耗,并且形成一个小斑点(rf=0.1)。将混合物真空浓缩。反应用于下一步骤而不进行纯
化。获得了呈白色固体的化合物3(7.0g,粗品)。
[0529]1h nmr(400mhz,氯仿-d):δ=8.14(s,1h),5.79-5.17(m,1h),4.19-4.05(m,1h),4.03-3.92(m,2h),3.52-2.46(m,2h),2.02-1.89(m,2h),1.56-1.41(m,2h)。
[0530]
步骤2:向化合物3(1.0g,7.74mmol,1eq)和tea(783.46mg,7.74mmol,1.08ml,1.0eq)在dcm(10ml)中的溶液中添加pph3(2.23g,8.52mmol,1.1eq)。在45℃下,在n2下,将混合物搅拌12h。tlc(pe/ea=3/1)指示化合物3(rf=0.1)被消耗,并且形成一个小斑点(rf=0.6)。将所得混合物真空蒸发(《20℃)。在20℃下,在n2下,将残余物悬浮于et2o(100ml)中,持续12h。将固体过滤,用et2o(100ml
×
2)洗涤,并且将滤液真空浓缩(《20℃)。将合并的有机相真空浓缩(《20℃)。反应用于下一步骤而不进行纯化。获得了呈棕色油状物的化合物4(0.8g,7.20mmol,92.97%产率),结构通过1h nmr来确认。
[0531]1h nmr(400mhz,氯仿-d):δ=3.90-3.71(m,3h),3.58-3.45(m,2h),1.99-1.86(m,2h),1.83-1.73(m,2h)。
[0532]
步骤3:根据用于inscov系列的一般性程序合成inscov-600a。纯化b:向残余物中添加mtbe(20ml),将悬浮液过滤并用mtbe(10ml
×
3)洗涤以得到粗产物。将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈黄色固体的inscov-600a(147.51mg,305.05μmol,32.97%产率,94.278%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0533]
lcms:保留时间:0.737min,(m+h)=456.1。hplc:保留时间:1.460min。sfc:保留时间:1.469min,1.796min。1h nmr(400mhz,dmso-d6):δ=9.09-9.00(m,2h),8.45(s,1h),8.39(d,j=7.6hz,1h),7.71(s,1h),7.63(d,j=8.8hz,2h),7.54-7.42(m,2h),7.40-7.34(m,1h),6.07(s,1h),4.11-4.05(m,2h),3.87-3.74(m,3h),3.34(s,1h),3.32-3.26(m,1h),1.75-1.61(m,2h),1.48-1.21(m,2h)。
[0534]
实施例56. 2-氯-n-(4-(噁唑-5-基)苯基)-n-(2-氧代-1-(吡啶-3-基)-2-((四氢-2h-吡喃-4-基)氨基)乙基)乙酰胺(inscov-600a(1))的合成
[0535]
根据用于inscov系列的一般性程序合成inscov-600a(1)。纯化b:将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈白色固体的inscov_600a(1)(123.82mg,267.11μmol,28.61%产率,98.136%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0536]
lcms:保留时间:0.693min,(m+h)=455.1。hplc:保留时间:1.251min。sfc:保留时间:1.452min,1.678min。1h nmr(400mhz,dmso-d6):δ=8.43(s,1h),8.36-8.24(m,3h),7.69(s,1h),7.66-7.44(m,3h),7.41-7.35(m,1h),7.18-7.12(m,1h),6.08(s,1h),4.10-3.94(m,2h),3.87-3.70(m,3h),3.40-3.35(m,1h),3.32-3.28(m,1h),1.77-1.71(m,1h),1.66-1.60(m,1h),1.52-1.37(m,1h),1.31-1.16(m,1h)。
[0537]
实施例57. 2-氯-n-(4-(噁唑-5-基)苯基)-n-(2-氧代-1-(嘧啶-5-基)-2-((四氢-2h-吡喃-4-基)氨基)乙基)乙酰胺(inscov-600a(2))的合成
[0538]
根据用于inscov系列的一般性程序合成inscov-600a(2)。纯化b:将mtbe(20ml)添加至反应混合物中,过滤并用mtbe(10ml
×
3)洗涤以得到粗产物。将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈黄色固体的inscov_600a(2)(202.45mg,435.58μmol,47.09%产率,98.087%纯度),其通过hnmr、lcms、sfc和hplc来确
认。
[0539]
lcms:保留时间:0.743min,(m+h)=456.1。hplc:保留时间:1.455min。sfc:保留时间:0.515min,0.945min。1h nmr(400mhz,dmso-d6):δ=8.97(s,1h),8.53-8.44(m,3h),8.34(d,j=7.2hz,1h),7.72(s,1h),7.68-7.62(m,2h),7.44(d,j=3.6hz,2h),6.10(s,1h),4.16-3.99(m,2h),3.88-3.68(m,3h),3.36(d,j=2.0hz,1h),3.30(d,j=2.0hz,1h),1.81-1.59(m,2h),1.52-1.38(m,1h),1.34-1.20(m,1h)。
[0540]
实施例58. 2-氯-n-(4-(噁唑-5-基)苯基)-n-(2-氧代-1-(吡嗪-2-基)-2-((四氢-2h-吡喃-4-基)氨基)乙基)乙酰胺(inscov-600a(3))的合成
[0541]
根据用于inscov系列的一般性程序合成inscov-600a(3)。纯化a:将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈灰白色固体的inscov_600a(3)(177.52mg,375.02μmol,40.54%产率,96.309%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0542]
lcms:保留时间:0.746min,(m+h)=456.1。hplc:保留时间:1.502minsfc:保留时间:1.720min,2.182min。1h nmr(400mhz,dmso-d6):δ=8.49(s,2h),8.46-8.40(m,2h),8.32(d,j=7.6hz,1h),7.70(s,1h),7.61(d,j=8.4hz,2h),7.50-7.44(m,1h),6.23(s,1h),4.21-4.00(m,2h),3.87-3.71(m,3h),3.35(d,j=2.8hz,1h),3.30(d,j=3.2hz,1h),1.66(d,j=11.2hz,2h),1.45-1.24(m,2h)。
[0543]
实施例59.inscov-600b的合成
[0544]
方案28
[0545]
步骤1:在80℃下,将3,3-二氟环戊胺盐酸盐(1g,6.35mmol,1eq)和tea(1.28g,12.69mmol,1.77ml,2eq)在甲酸乙酯(2.35g,31.73mmol,2.55ml,5eq)中的混合物搅拌16h。tlc(ea:etoh=3:1)显示起始物料(rf=0.3)完全消耗。并且检测到新斑点(rf=0.7)。将混合物减压浓缩。粗化合物不经进一步纯化即用于下一步骤中。获得了呈黄色油状物的化合物2(940mg,6.30mmol,99.33%产率),通过1hnmr来核实。
[0546]1h nmr:(400mhz,cdcl3):δ=8.17-8.06(m,1h),4.59-4.40(m,1h),2.56-2.47(m,2h),1.57(br t,j=7.2hz,2h),1.24(br t,j=7.2hz,2h)。
[0547]
步骤2:在-10℃下,在n2下,向化合物2(500mg,3.35mmol,1eq)和diea(2.17g,16.7mmol,2.92ml,5eq)在dcm(100ml)中的混合物中一次性添加pocl3(616.86mg,4.02mmol,373.86μl,1.2eq),接着加热至20℃并搅拌2小时。tlc(板1,pe:ea=1:1)显示化
合物2(rf=0.1)被消耗,并且观察到新斑点(rf=0.8)。在0℃下,将混合物缓慢倾倒至饱和nahco3(500ml)中,接着用dcm(300ml
×
2)萃取,经na2so4干燥。在25℃下将混合物减压浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~50%乙酸乙酯/石油醚梯度的洗脱剂,在50ml/min下)来纯化。在25℃下将混合物减压浓缩。tlc(板2,pe:ea=1:1,rf=0.1)。获得了呈无色油状物的化合物3(200mg,1.53mmol,45.5%产率)。
[0548]
步骤3:根据用于inscov系列的一般性程序合成inscov-600b。纯化b和纯化a:在25℃下,将残余物用mecn(5ml)研磨30min并过滤。将滤饼通过制备型hplc(柱:welchμltimate xb-cn 250
×
50
×
10um;流动相:[己烷-ipa];b%:25%-65%,15min)来再纯化,并且真空浓缩以产生所需化合物。将滤液真空浓缩以产生残余物。将残余物通过制备型hplc(柱:welchμltimate xb-cn 250
×
50
×
10um;流动相:[己烷-ipa];b%:25%-65%,15min)来再纯化,但这未能产生所需化合物。获得了呈黄色固体的2-(n-(2-氯乙酰基)-4-噁唑-5-基-苯胺基)-n-(3,3-二氟环戊基)-2-嘧啶-5-基-乙酰胺(73.31mg,148μmol,15.8%产率,96.04%纯度),其通过hnmr、fnmr、lcms和hplc来核实。
[0549]
lcms:保留时间:0.812min,(m+h)=442.2。hplc:保留时间:1.560min。1h nmr:(400mhz,dmso-d6):δ=8.98(d,j=2.0hz,1h),8.60-8.51(m,1h),8.51-8.48(m,2h),8.46(s,1h),7.75-7.70(m,1h),7.66(br d,j=8.4hz,2h),7.53-7.31(m,2h),6.07(d,j=2.4hz,1h),4.31-4.18(m,1h),4.13-3.99(m,2h),3.82-3.72(m,1h),2.46-2.35(m,1h),2.25-1.80(m,4h),1.75-1.63(m,1h)。
19
f nmr(377mhz,dmso-d6):δ=-88.33(s,1f),-88.47
‑‑
88.63(m,1f)。
[0550]
实施例60.inscov-600c的合成
[0551]
方案29
[0552]
步骤1:在80℃下,将四氢呋喃-3-胺(2g,22.96mmol,1eq)在甲酸乙酯(8.50g,114.78mmol,9.23ml,5eq)中的混合物搅拌16h。tlc(ea:etoh=3:1)显示起始物料(rf=0.3)完全消耗。并且检测到新斑点(rf=0.7)。将混合物减压浓缩。粗化合物不经进一步纯化即用于下一步骤中。获得了呈黄色油状物的n-四氢呋喃-3-基甲酰胺(2.5g,21.71mmol,94.59%产率),通过1h nmr来核实。
[0553]1h nmr(400mhz,cdcl3):δ=8.10(s,1h),6.53-6.25(m,1h),4.61-4.53(m,1h),3.83-3.76(m,2h),3.74
ꢀ‑
3.62(m,2h),2.42-2.12(m,2h)。
[0554]
步骤2:在-10℃下,在n2下,向n-四氢呋喃-3-基甲酰胺(1.5g,13.03mmol,1eq)和
diea(8.42g,65.1mmol,11.4ml,5eq)在dcm(100ml)中的混合物中一次性添加pocl3(2.40g,15.63mmol,1.45ml,1.2eq),接着加热至20℃并搅拌2小时。tlc(pe:ea=1:1)显示n-四氢呋喃-3-基甲酰胺(rf=0.1)被消耗,并且观察到新斑点(rf=0.8)。在0℃下,将混合物缓慢倾倒至饱和nahco3(500ml)中,接着用dcm(300ml
×
2)萃取,经na2so4干燥。在25℃下将混合物减压浓缩。将残余物通过快速硅胶色谱法(40g二氧化硅快速柱,0~50%乙酸乙酯/石油醚梯度的洗脱剂,在50ml/min下)来纯化。在25℃下将混合物减压浓缩。获得了呈无色油状物的化合物3(500mg,5.15mmol,39.52%产率),并且它直接用于下一步骤。
[0555]
步骤3:根据用于inscov系列的一般性程序合成inscov-600c。纯化b:在25℃下,将粗产物用mecn(5ml)研磨30min。获得了呈灰白色固体的inscov-600c(198.49mg,438.65μmol,35.1%产率,97.65%纯度),其通过hnmr、lcms和hplc来核实。
[0556]
lcms:保留时间:0.812min,(m+h)=442.2。hplc:保留时间:1.560min。1h nmr(400mhz,dmso-d6):δ=9.02(s,1h),8.66(dd,j=4.0,6.4hz,1h),8.59-8.44(m,3h),7.77(s,1h),7.66(br s,1h),7.70(br d,j=8.4hz,1h),7.61-7.33(m,2h),6.13(s,1h),4.34(tdd,j=3.6,6.4,10.0hz,1h),4.18-3.99(m,2h),3.87-3.63(m,3h),3.56(dd,j=3.6,9.0hz,1h),2.28-2.02(m,1h),1.93-1.56(m,1h)。
[0557]
实施例61.inscov-600d的合成
[0558]
方案30
[0559]
步骤1:在70℃下,在n2下,将化合物1(5g,34.83mmol,1eq,hcl)在甲酸乙酯(46.05g,621.64mmol,50ml,17.85eq)和tea(7.05g,69.66mmol,9.70ml,2eq)中的混合物搅拌12h。tlc(ea/pe=1/1)指示化合物1(rf=0.0)被消耗,并且形成一个新斑点(rf=0.1)。将混合物过滤,用pe(10ml
×
3)洗涤。将滤液真空浓缩。反应用于下一步骤而不进行纯化。获得了呈白色固体的化合物2(5g,粗品)。
[0560]1h nmr(400mhz,氯仿-d):δ=8.11(s,1h),6.92(s,1h),4.40-4.24(m,1h),3.01-2.91(m,2h),2.63-2.46(m,2h)。
[0561]
步骤2:向化合物2(2.0g,14.80mmol,1eq)和tea(1.50g,14.80mmol,2.06ml,1.0eq)在dcm(20ml)中的溶液中添加pph3(4.27g,16.28mmol,1.1eq)和ccl4(2.28g,14.80mmol,1.42ml,1.0eq)。在45℃下,在n2下,将混合物搅拌12h。tlc(pe/ea=3/1)指示化合物2(rf=0.1)被消耗,并且形成一个小斑点(rf=0.6)。将所得混合物真空蒸发(《20℃)。
在20℃下,在n2下,将残余物悬浮于et2o(100ml)中,持续12h。将混合物过滤,用et2o(50ml
×
2)洗涤,并且将滤液真空浓缩(《20℃)。反应用于下一步骤而不进行纯化。获得了呈黄色油状物的化合物3(1.0g,粗品)。
[0562]1h nmr(400mhz,dmso-d6)δ=4.39-4.20(m,1h),3.22-3.06(m,2h),3.00-2.83(m,2h)。
[0563]
步骤3:根据用于inscov系列的一般性程序合成inscov-600d。纯化b:将mtbe(20ml)添加至反应混合物中,并且冷却至0℃,持续12h。将混合物过滤并用mtbe(10ml
×
3)洗涤以得到产物。将滤饼真空浓缩。获得了呈黄色固体的inscov_600d(181.18mg,382.10μmol,41.30%产率,97.402%纯度),其通过hnmr、fnmr、lcms、sfc和hplc来确认。
[0564]
lcms:保留时间:0.869min,(m+h)=462.2。hplc:保留时间:1.657min。sfc:保留时间:1.255min,1.487min。1h nmr(400mhz,dmso-d6):δ=8.99(s,1h),8.78(d,j=6.0hz,1h),8.51(s,2h),8.46(s,1h),7.72(s,1h),7.66(d,j=8.8hz,2h),7.42(s,2h),6.05(s,1h),4.15-3.97(m,3h),3.01-2.82(m,2h),2.63-2.51(m,2h)。
19
f nmr(377mhz,dmso-d6):δ=-82.27(d,j=194.6hz,1f),-95.79(d,j=197.4hz,1f)。
[0565]
实施例62.inscov-600e的合成
[0566]
方案31
[0567]
步骤1:在90℃下,将3-甲基氧杂环丁烷-3-胺(1g,11.48mmol,1eq)在甲酸乙酯(3g,40.50mmol,3.26ml,3.53eq)中的混合物搅拌16h。tlc(pe:ea=1:1)显示起始物料(rf=0.4)完全消耗,并且观察到新斑点(rf=0.2)。将混合物减压浓缩。获得了呈棕色固体的n-(3-甲基氧杂环丁烷-3-基)甲酰胺(1.3g,11.29mmol,98.37%产率),其通过hnmr来检测。
[0568]1h nmr(400mhz,氯仿-d):δ=8.14(d,j=0.9hz,1h),7.27(s,1h),4.81(d,j=6.4hz,2h),4.51(d,j=6.6hz,2h),1.69(s,3h)。
[0569]
步骤2:在-10℃下,在n2下,向n-(3-甲基氧杂环丁烷-3-基)甲酰胺(1g,8.69mmol,1eq)和diea(5.61g,43.43mmol,7.56ml,5eq)在dcm(100ml)中的混合物中一次性添加pocl3(2.00g,13.03mmol,1.21ml,1.5eq),接着加热至25℃并搅拌2小时。tlc(板1,pe:ea=1:1)显示起始物料(rf=0.2)完全消耗,并且观察到新斑点(rf=0.8)。在0℃下,将混合物倾倒至冰-饱和碳酸氢钠溶液(w/w=1/1)(100ml)中,并且搅拌10min。将水相用dcm(100ml
×
2)萃取,用无水na2so4干燥。在20℃下将混合物减压浓缩。将残余物通过快速硅胶色谱法(
40g二氧化硅快速柱,0~50%乙酸乙酯/石油醚梯度的洗脱剂,在50ml/min下)来纯化。在20℃下将混合物减压浓缩。tlc(板2,pe:ea=1:1,rf=0.8)。获得了呈无色油状物的3-异氰基-3-甲基-氧杂环丁烷(350mg,3.60mmol,41.49%产率)。
[0570]
步骤3:根据用于inscov系列的一般性程序合成inscov-600e。纯化a:将粗产物通过制备型hplc(柱:welchμltimate xb-cn 250
×
50
×
10um;流动相:[己烷-ipa];b%:30%-70%,15min)来纯化。获得了呈黄色固体的2-(n-(2-氯乙酰基)-4-噁唑-5-基-苯胺基)-n-(3-甲基氧杂环丁烷-3-基)-2-嘧啶-5-基-乙酰胺(105.94mg,228.59μmol,24.41%产率,95.342%纯度),其通过lcms、hplc和hnmr来检测。
[0571]
lcms:保留时间:0.750min,[m+h
+
]=442.2。hplc:保留时间:1.580min。1h nmr(400mhz,dmso-d6):δ=8.99(s,1h),8.84(s,1h),8.52(s,2h),8.47(s,1h),7.73(s,1h),7.66(br d,j=8.6hz,2h),7.54-7.33(m,2h),6.06(s,1h),4.56(dd,j=6.2,15.8hz,2h),4.33-4.27(m,2h),4.18-4.00(m,2h),1.50(s,3h)。
[0572]
实施例63.n-(4-(1h-咪唑-5-基)苯基)-2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)乙酰胺(inscov-600i)的合成
[0573]
根据用于inscov系列的一般性程序合成inscov-600i。纯化a:将残余物溶解于meoh(2ml)中,并且通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:12%-32%,6.5min)来纯化并浓缩以移除mecn,将液体冻干以产生粗产物。将残余物溶解于dmf(2ml)中,并且通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:13%-33%,6.5min)来纯化并浓缩以移除mecn,将液体冻干以产生粗产物。获得了呈黄色固体的inscov-600i(13.3mg,25.58μmol,2.76%产率,94.024%纯度),其通过lcms、hplc、hnmr和fnmr来确认。
[0574]
lcms:保留时间:0.840min,(m+h)=489.2;保留时间;0.724min,(m+h)=489.0。hplc:保留时间:1.767min。1h nmr(400mhz,甲醇-d4):δ=9.02(d,j=1.2hz,1h),8.94(s,1h),8.57(s,2h),7.96(d,j=1.2hz,1h),7.84-7.21(m,4h),6.15(s,1h),4.08-3.81(m,3h),2.12-1.80(m,6h),1.72-1.41(m,2h)。
19
f nmr(376mhz,甲醇-d4):δ=-88.44
‑‑
112.41(m,1f)。
[0575]
实施例64.inscov-600l的合成
[0576]
方案32
[0577]
步骤1:向4-氯嘧啶(500mg,3.31mmol,1eq,hcl)和n-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]乙酰胺(1.04g,3.97mmol,1.2eq)在二噁烷(5ml)和h2o(1ml)中的溶液中添加pd(dppf)cl2(242.30mg,331.14μmol,0.1eq)和nahco3(834.57mg,9.93mmol,386.38μl,3.0eq),将它充n2三次并在100℃下搅拌16h。lcms显示4-氯嘧啶被消耗,并且检测到所需质量。添加水(20ml)和ea(20ml),将有机层用盐水(20ml)洗涤,经na2so4干燥并真空浓缩。将粗品通过柱色谱法(sio2,pe:ea 10:1~1:2)来纯化。获得了呈黄色固体的n-(4-嘧啶-4-基苯基)乙酰胺(400mg,1.83mmol,55.29%产率,97.596%纯度),其通过hnmr和lcms来确认。
[0578]
lcms:保留时间:0.602min,(m+h)=214.1。1h nmr(400mhz,氯仿-d):δ=9.16(d,j=1.1hz,1h),8.66(d,j=5.4hz,1h),8.06-7.95(m,2h),7.67-7.56(m,3h),7.44(br s,1h),2.15(s,3h)。
[0579]
步骤2:在25℃下,向n-(4-嘧啶-4-基苯基)乙酰胺(350mg,1.64mmol,1eq)在meoh(10ml)中的溶液中添加hcl(10ml)(2m),在70℃下将它搅拌2h。lcms显示n-(4-嘧啶-4-基苯基)乙酰胺被消耗,并且检测到所需质量。将它倾倒至水(50ml)中,通过固体na2co3将混合物的ph调整至9,添加ea(50ml),将有机层用盐水(50ml)洗涤,经na2so4干燥并真空浓缩。粗品直接用于下一步骤中。获得了呈黄色固体的4-嘧啶-4-基苯胺(280mg,1.64mmol,99.64%产率),其通过hnmr来确认。
[0580]
lcms:保留时间:0.702min,(m+h)=172.3。1h nmr(400mhz,dmso-d6):δ=9.03(d,j=1.3hz,1h),8.62(d,j=5.6hz,1h),7.99-7.90(m,2h),7.82(dd,j=1.4,5.5hz,1h),6.72-6.61(m,2h),5.81(s,2h)。
[0581]
步骤3:根据用于inscov系列的一般性程序合成inscov-600l。纯化b:将粗品用etoh(1ml)研磨并过滤,将滤饼用pe(1ml)洗涤并真空干燥。获得了呈黄色固体的2-(n-(2-氯乙酰基)-4-嘧啶-4-基-苯胺基)-n-(4,4-二氟环己基)-2-嘧啶-5-基-乙酰胺(144.91mg,279.56μmol,26.42%产率,96.640%纯度),其通过lcms、hplc、hnmr和fnmr来确认。
[0582]
lcms:保留时间:0.850min,(m+h)=501.1。hplc:保留时间:1.769min。1h nmr(400mhz,dmso-d6)δ=9.24(s,1h),8.96(s,1h),8.87(d,j=5.3hz,1h),8.51(s,2h),8.33(br d,j=7.3hz,1h),8.24-8.02(m,3h),7.53(br s,2h),6.19-6.05(m,1h),4.16-4.00(m,2h),3.85(br s,1h),2.07-1.69(m,6h),1.62-1.46(m,1h),1.46-1.29(m,1h),1.17(t,j=7.2hz,1h)。
[0583]
实施例65.inscov-600m的合成
[0584]
方案33
[0585]
步骤1:在60℃下,将1-甲基哌啶-4-胺(2g,17.51mmol,1eq)在甲酸乙酯(12.97g,175.15mmol,14.09ml,10eq)中的混合物搅拌16h。lc-ms显示反应完成,并且得到所需产物。将混合物减压浓缩。获得了呈棕色油状物的n-(1-甲基-4-哌啶基)甲酰胺(2.45g,粗品)。
[0586]
lcms:保留时间:0.197min,[m+h
+
]=143.3。
[0587]
步骤2:在0℃下,向n-(1-甲基-4-哌啶基)甲酰胺(1g,7.03mmol,1eq)和tea(2.13g,21.10mmol,2.94ml,3eq)在dcm(50ml)中的溶液中添加pocl3(3.23g,21.10mmol,1.96ml,3eq)。在20℃下将混合物搅拌2h。lcms显示反应完成,并且得到所需产物。在0℃下,将混合物倾倒至饱和碳酸氢钠(50ml)中。将水相用乙酸乙酯(100ml
×
3)萃取,用无水na2so4干燥,过滤并真空浓缩。获得了呈棕色油状物的4-异氰基-1-甲基-哌啶(120mg,粗品),其通过lcms来检测。
[0588]
lcms:保留时间:0.697min,[m+h
+
]=125.2。
[0589]
步骤3:根据用于制备inscov系列的一般性程序合成inscov-600m。将粗产物通过制备型hplc(柱:welchμltimate xb-cn250
×
50
×
10um;流动相:[己烷-ipa];b%:35%-75%,15min)来纯化。获得了呈黄色固体的2-(n-(2-氯乙酰基)-4-噁唑-5-基-苯胺基)-n-(1-甲基-4-哌啶基)-2-嘧啶-5-基-乙酰胺(22.04mg,44.07μmol,4.71%产率,93.756%纯度),其通过lcms、hplc和hnmr来检测。
[0590]
lcms:保留时间:0.824min,[m+h
+
]=469.2。hplc:保留时间:1.646min。1h nmr(400mhz,dmso-d6):δ=9.01-8.92(m,1h),8.57-8.43(m,3h),8.42-8.33(m,1h),7.71(s,1h),7.68-7.59(m,2h),7.57-7.33(m,2h),6.07(s,1h),4.04(d,j=8.1hz,2h),3.73-3.63(m,1h),3.09-2.78(m,2h),2.69-2.64(m,1h),2.70-2.62(m,1h),2.42-2.34(m,3h),1.89-1.67(m,2h),1.61-1.45(m,1h),1.42-1.28(m,1h)。
[0591]
实施例66.inscov-600o的合成
[0592]
方案34
(176mg,1.15mmol,107μl,1.00eq)。在20℃下将混合物搅拌1h。tlc(pe:ea=1:1)显示3-氯-4-甲酰胺基-n,5-二甲基-苯甲酰胺(rf=0.1)被消耗,并且观察到新斑点(rf=0.7)。将混合物用dcm(50ml)稀释,接着倾倒至nahco3(50ml)中。通过分液漏斗分离所得混合物。将有机层经na2so4干燥,过滤并真空浓缩以产生残余物。将残余物通过硅胶色谱法(pe:ea=10:1-5:1)来纯化。获得了呈黄色固体的3-氯-4-异氰基-n,5-二甲基-苯甲酰胺(60.0mg,288μmol,25.1%产率),其通过hnmr来确定。
[0600]1h nmr(400mhz,dmso-d6):δ=8.66(d,j=4.0hz,1h),7.92(d,j=1.2hz,1h),7.84(s,1h),2.78(d,j=4.4hz,3h),2.46(s,3h)。
[0601]
步骤5:根据用于inscov系列的一般性程序合成inscov-600o。纯化c:将残余物通过硅胶色谱法(pe:ea=10:1-0:1)来纯化。获得了呈黄色固体的3-氯-4-[[2-(n-(2-氯乙酰基)-4-噁唑-5-基-苯胺基)-2-嘧啶-5-基-乙酰基]氨基]-n,5-二甲基-苯甲酰胺(15.54mg,25.55μmol,13.33%产率,91%纯度),其通过hnmr、lcms和hplc来确定。
[0602]
lcms:保留时间:0.823min,[m+h
+
]=554.9。hplc:保留时间:1.585min。1h nmr(400mhz,dmso-d6):δ=10.20(s,1h),9.00(s,1h),8.62(s,2h),8.57-8.51(m,1h),8.46(s,1h),7.81-7.63(m,5h),7.55-7.32(m,2h),6.33(s,1h),4.10(s,2h),2.78(d,j=4.4hz,3h),2.33-2.23(m,3h)。
[0603]
实施例67.inscov-600r(2)、138.inscov-600r(2a)和139.inscov-600r(2b)的合成
[0604]
方案35
[0605]
步骤1:向化合物1(0.5g,4.90mmol,1eq)在thf(2ml)、meoh(2ml)和h2o(1ml)中的溶液中添加lioh*h2o(411.05mg,9.80mmol,2eq)。在25℃下将反应混合物搅拌1h。tlc(pe:ea=3:1)显示形成一个新斑点(rf=0.0)。将反应混合物真空浓缩以移除meoh和thf。接着通过1n hcl溶液将混合物调整至ph=2,并且用ea(50ml
×
3)萃取。将合并的有机相真空浓缩(《25℃)。反应混合物用于下一步骤而不进行纯化。获得了呈无色油状物的化合物2(0.3g,3.41mmol,69.56%产率),其通过hnmr来确认。
[0606]1h nmr(400mhz,dmso-d6):δ=3.41-3.85(m,1h),2.93-2.87(m,1h),2.82-2.76(m,1h)。
[0607]
步骤2:根据用于inscov系列的一般性程序合成inscov-600r(2)。将反应真空浓缩。将粗产物用mtbe(20ml)研磨,并且用mtbe(10ml
×
2)洗涤。将残余物用mtbe(20ml)稀释,
用mtbe(10ml
×
2)洗涤并真空浓缩。获得了呈黄色固体的inscov-600r(2)(212.57mg,400.82μmol,43.33%产率,91.161%纯度),其通过hnmr、fnmr、lcms、sfc和hplc来确认。
[0608]
lcms:保留时间:0.878min,(m+h)=484.3。sfc:保留时间:1.492min,2.151min。1h nmr(400mhz,dmso-d6)δ=8.97(d,j=8.8hz,1h),8.51(d,j=5.6hz,2h),8.45(d,j=0.8hz,1h),8.42-8.27(m,1h),7.76-7.61(m,3h),7.52-7.36(m,2h),6.24-5.96(m,1h),3.93-3.75(m,1h),3.17-3.08(m,1h),2.87-2.75(m,1h),2.75-2.69(m,1h),2.05-1.69(m,6h),1.61-1.29(m,2h)。
19
f nmr(377mhz,dmso-d6)δ=-87.22-103.36(m,1f)
[0609]
步骤3:用于制备inscov-600r(2a)和inscov-600r(2b的一般性程序。通过手性sfc(柱:daicel chiralpak ad(250mm
×
30mm,10um);流动相:[0.1%nh3·
h2o meoh];b%:40%-40%,4.3min;45min)分离inscov-600r(2)(0.1g,206.84μmol,1eq),并且真空浓缩。获得了呈黄色固体的inscov-600r(2a)(21.32mg,41.08μmol,19.86%产率,93.149%纯度),其通过hnmr、fnmr、lcms、sfc和hplc来确认。获得了呈黄色固体的inscov-600r(2b)(10.33mg,20.82μmol,10.07%产率,97.456%纯度),其通过hnmr、fnmr、lcms、sfc和hplc来确认。
[0610]
inscov-600r(2a):lcms:保留时间:0.876min,(m+h)=484.3,hplc:保留时间:1.601min,sfc:保留时间:1.533min,1h nmr(400mhz,dmso-d6)δ=8.96(d,j=1.2hz,1h),8.50(s,2h),8.45(d,j=1.2hz,1h),8.36(d,j=7.6hz,1h),7.71(s,1h),7.67(d,j=8.0hz,2h),7.47(s,2h),6.14(s,1h),3.90-3.80(m,1h),3.13-3.08(m,1h),2.87-2.81(m,1h),2.77-2.71(m,1h),2.01-1.75(m,6h),1.62-1.47(m,1h),1.45-1.31(m,1h),
19
f nmr(377mhz,dmso-d6)δ=91.06
ꢀ‑
95.14(m,1f),-96.46-100.47(m,1f)。
[0611]
inscov-600r(2a):lcms:保留时间:0.874min,(m+h)=484.3,hplc:保留时间:1.593min,sfc:保留时间:2.139min,1h nmr(400mhz,dmso-d6)δ=8.98(s,1h),8.51(s,2h),8.45(s,1h),8.31(d,j=7.6hz,1h),7.71(s,1h),7.67(d,j=8.8hz,2h),7.44(d,j=7.2hz,2h),6.08(s,1h),3.84-3.78(m,1h),3.13(s,1h),2.81-2.75(m,1h),2.75-2.69(m,1h),2.01-1.73(m,6h),1.56-1.44(m,1h),1.40-1.30(m,1h),
19
f nmr(37mhz,dmso-d6)δ=-93.34(d,j=234.6hz,1f),-96.19
‑‑
99.53(m,1f)。
[0612]
根据建模和活性数据,预期inscov-600r(2a)具有的结构。
[0613]
实施例68.inscov-600x的合成
[0614]
方案36
[0615]
步骤1:向化合物1(2g,9.80mmol,1eq)和化合物2(2.41g,11.76mmol,1.2eq)在二噁烷(20ml)中的溶液中添加cs2co3(9.58g,29.41mmol,3eq)和pd(dppf)cl2(1.43g,1.96mmol,0.2eq)。在80℃下,在n2下,将反应混合物搅拌12h。lcms显示化合物1完全消耗,并且检测到一个具有所需质量的峰(rt=1.063min)。tlc(pe:ea=1:1)显示化合物1(rf=0.8)完全消耗,并且形成三个新斑点(rf=0.02,rf=0.3,rf=0.5)。将混合物用水(30ml)稀释,并且用etoac(80ml
×
2)萃取。将有机层用无水na2so4干燥,过滤并真空浓缩。将残余物通过快速硅胶色谱法(80g二氧化硅快速柱,0~60%乙酸乙酯/石油醚梯度的洗脱剂,在100ml/min下)来纯化,并且真空浓缩。获得了呈黄色固体的化合物3(3.5g,粗品),其通过hnmr和fnmr来确认。
[0616]
lcms:保留时间:1.063min,(m+h)=203.1,1h nmr(400mhz,dmso-d6):δ=8.81(d,j=2.4hz,1h),8.47
–
8.41(m,1h),7.99
–
7.83(m,1h),7.41
–
7.35(m,1h),7.34
–
7.28(m,1h),7.24(s,1h),5.10(s,2h),2.19(s,3h),
19
f nmr(377mhz,dmso-d6):δ=-134.656(m,1f)。
[0617]
步骤2:在25℃下,在n2下,将hcooh(2.41g,50.19mmol,3.5eq)和ac2o(1.76g,17.21mmol,1.61ml,1.2eq)的混合物搅拌10min。在0℃下,将化合物3(2.9g,14.34mmol,1eq)在dcm(30ml)中的溶液添加至混合物中。在25℃下将所得混合物搅拌3h。lcms显示化合物3完全消耗,并且检测到一个具有所需质量的峰(rt=0.797min)。tlc(pe:ea=1:2)显示化合物3(rf=0.7)有剩余,并且形成一个斑点(rf=0.5)。将反应混合物用水(20ml)稀释,并且用dcm(30ml
×
3)萃取。将合并的有机相通过无水na2so4来干燥,并且真空浓缩。将残余物通过快速硅胶色谱法(80g二氧化硅快速柱,0~100%乙酸乙酯/石油醚梯度的洗脱剂,在100ml/min下)来纯化。将合并的有机相通过无水na2so4来干燥,并且真空浓缩。获得了呈白色固体的化合物4(1.5g,6.52mmol,45.43%产率),其通过hnmr来确认。
[0618]
lcms:保留时间:0.797min,(m+h)=231.2,1h nmr(400mhz,dmso-d6):δ=9.77(s,1h),8.93(d,j=1.8hz,1h),8.62-8.56(m 1h),8.31(s,1h),8.14-8.08(m,1h),7.56-7.46(m,3h),2.28(s,3h)。
[0619]
步骤3:向化合物4(1.2g,5.21mmol,1eq)在dcm(12ml)中的溶液中添加tea(527.40mg,5.21mmol,725.45μl,1eq)、pph3(1.50g,5.73mmol,1.1eq)和ccl4(801.73mg,
5.21mmol,501.08μl,1eq)。在45℃下,在n2下,将反应混合物搅拌12h。lcms显示化合物4有剩余(rt=0.807min),并且未检测到所需质量。tlc(pe:ea=1:1)显示形成三个新斑点(rf=0.2,rf=0.3,rf=0.7)。将混合物用水(10ml)稀释,并且用dcm(20ml
×
3)萃取。将有机层用无水na2so4干燥,过滤并真空浓缩。将残余物通过快速硅胶色谱法(80g二氧化硅快速柱,0~80%乙酸乙酯/石油醚梯度的洗脱剂,在100ml/min下)来纯化,并且真空浓缩。获得了呈白色固体的化合物5(1g,4.71mmol,90.41%产率),其通过hnmr和fnmr来确认。
[0620]
lcms:保留时间:0.805min,(m+h)=231.1,1h nmr(400mhz,dmso-d6):δ=8.97(d,j=2.4hz,1h),8.66-8.60(m,1h),8.19-8.13(m,1h),7.80(d,j=10.8hz,1h),7.73(s,1h),7.55-7.49(m,1h),2.49(s,3h),
19
f nmr(377mhz,dmso-d6):δ=-119.049(m,1f)。
[0621]
步骤4:根据用于制备inscov系列的一般性程序合成inscov-600x。纯化b:将mtbe(20ml)添加至反应混合物中,过滤并用mtbe(10ml
×
3)洗涤以得到粗产物。将残余物用mtbe(20ml)研磨,过滤并用mtbe(10ml
×
3)洗涤。将滤饼真空浓缩。获得了呈黄色固体的inscov-600x(301.95mg,517.73μmol,55.97%产率,95.5%纯度),其通过hnmr、fnmr、lcms、sfc和hplc来确认。
[0622]
lcms:保留时间:0.774min,(m+h)=557.1,hplc:保留时间:1.522min,sfc:保留时间:1.106min,3.019min,1h nmr(400mhz,dmso-d6):δ=10.04(s,1h),9.02(s,1h),8.94(d,j=1.8hz,1h),8.62(s,2h),8.62
–
8.56(m,1h),8.46(s,1h),8.15
–
8.09(m,1h),7.73(s,1h),7.67(d,j=8.4hz,2h),7.61-7.38(m,5h),6.38(s,1h),4.10(s,2h),2.28(s,3h),
19
f nmr(377mhz,dmso-d6):δ=-119.55(s,1f)。
[0623]
实施例69.n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(嘧啶-5-基)乙基)-n-(4-(异噁唑-5-基)苯基)氧杂环丙烷-2-甲酰胺(inscov-600y)的合成
[0624]
根据用于inscov系列的一般性程序合成inscov-600y。纯化a:将残余物溶解于dmf(2ml)中,并且通过制备型hplc(柱:waters xbridge 150
×
25mm
×
5μm;流动相:[水(10mm nh4hco3)-acn];b%:20%-50%,9min)来纯化并用水(20ml)稀释,将液体冻干以产生产物。将残余物溶解于dmf(2ml)中,并且通过制备型hplc(柱:3_phenomenex luna c18 75
×
30mm
×
3μm;流动相:[水(0.05%hcl)-acn];b%:28%-48%,6.5min)来纯化并用水(20ml)稀释,将液体冻干以产生粗产物(在酸中不稳定),其通过lcms来确认。获得了呈白色固体的inscov-600y(31.65mg,59.87μmol,6.47%产率,91.460%纯度),其通过lcms、hplc、hnmr和fnmr来确认。
[0625]
lcms:保留时间:0.893min,(m+h)=484.3,hplc:保留时间:1.724min,1h nmr(400mhz,dmso-d6):δ=9.04-8.90(m,1h),8.69-8.63(m,1h),8.58-8.47(m,2h),8.42-8.27(m,1h),7.86-7.80(m,2h),7.65-7.34(m,2h),7.08-6.99(m,1h),6.19-6.07(m,1h),3.93-3.69(m,1h),3.15-3.09(m,1h),2.89-2.70(m,1h),2.03-1.71(m,6h),1.62-1.27(m,2h),
19
f nmr(377mhz,dmso-d6):δ=-87.29-105.18(m,1f)。
[0626]
实施例70. 2-氯-n-(2-((4,4-二氟环己基)氨基)-2-氧代-1-(哒嗪-4-基)乙基)-n-(4-(噻唑-5-基)苯基)乙酰胺(inscov-601f)的合成
[0627]
向化合物4(150mg,851.12μmol,1eq)和化合物2(123.54mg,851.12μmol,1eq)在
cf3ch2oh(6ml)中的溶液中添加化合物1(80.43mg,851.12μmol,95.75μl,1eq)和化合物3(92.00mg,851.12μmol,1eq)。在25℃下将反应混合物搅拌1h。lcms显示反应物1被消耗,并且检测到一个具有所需质量的峰。将反应真空浓缩。将粗产物用pe/ea=20/1(20ml*3)研磨并过滤。获得了呈棕色固体的inscov-601f(224.12mg,417.59μmol,49.06%产率,94.273%纯度),其通过hnmr、fnmr、lcms、hplc和sfc来确认。
[0628]
lcms:保留时间:0.880min,(m+h)=506.3,hplc:保留时间:1.899min,sfc:保留时间:0.499min,1.259min,1h nmr(400mhz,dmso-d6):δ=9.10(d,j=0.6hz,1h),9.08-9.04(m,1h),9.15-8.98(m,1h),8.37(d,j=7.8hz,1h),8.33(d,j=0.6hz,1h),7.63(d,j=8.8hz,2h),7.46-7.37(m,3h),6.06(s,1h),4.16-4.01(m,2h),3.89-3.77(m,1h),1.97-1.86(m,4h),1.80-1.76(m,2h),1.55-1.48(m,1h),1.41-1.40(m,1h),
19
f nmr(377mhz,dmso-d6):δ=-87.22
‑‑
104.30(m,1f)。
[0629]
实施例71.inscov-601j和inscov-601j(2)的合成
[0630]
方案37
[0631]
步骤1:根据用于inscov系列的一般性程序合成inscov-601j。纯化b:将混合物真空浓缩。将粗品溶解于metb(10ml)中,搅拌片刻,并且将滤饼真空浓缩。获得了呈黄色固体的inscov-601j(250mg,427.35μmol,46.20%产率,86.489%纯度),其通过hnmr、lcms、sfc和hplc来确认。
[0632]
lcms:保留时间:0.844min,(m+h)=506.1,hplc:保留时间:2.000min,sfc:保留时间:峰:0.491min,峰2:1.545min,1h nmr(400mhz,dmso-d6):δ=9.19-9.02(m,2h),8.60(d,j=1.8hz,1h),8.39(d,j=7.6hz,1h),7.80(d,j=1.8hz,1h),7.70(d,j=8.8hz,2h),7.57-7.37(m,3h),6.07(s,1h),4.17-4.09(m,1h),3.85-3.74(m,1h),2.07-1.70(m,8h),1.57-1.40(m,2h)。
[0633]
步骤2:将inscov-601j(100mg,197.64μmol,1eq)通过sfc进行手性化。将溶液真空浓缩。获得了呈黄色固体的inscov-601j(2)(54.54mg,104.52μmol,52.88%产率,96.965%纯度)。其通过hnmr、fnmr、lcms、hplc来确认;sfc显示ee%=83.00%。
[0634]
lcms:保留时间:0.832min,(m+h)=506.1,sfc:保留时间:1.564min,ee%=83.00%,hplc:保留时间:1.994min,1h nmr(400mhz,dmso-d6):δ=9.14-9.04(m,2h),8.59(d,j=1.8hz,1h),8.38(br d,j=7.5hz,1h),7.80(d,j=1.8hz,1h),7.70(br d,j=8.8hz,2h),7.49(br d,j=7.3hz,2h),7.39(dd,j=2.5,5.3hz,1h),6.07(s,1h),4.21-4.02(m,2h),3.82(br dd,j=2.5,3.4hz,1h),2.09-1.68(m,8h),1.55-1.37(m,2h)。
19
f nmr(376mhz,dmso-d6):δ=-92.54
‑‑
94.15(m,1f),-96.48
‑‑
98.66(m,1f)。
[0635]
实施例72.inscov-612的合成
[0636]
方案38
[0637]
根据用于inscov系列的一般性程序合成inscov-612。纯化b:向混合物中添加h2o(75ml),并且用ea(30ml
×
3)萃取。将有机相用盐水(50ml)洗涤,经无水na2so4干燥,真空浓缩以产生黄色残余物。在25℃下,将粗产物用etoh(10ml)研磨30min以产生以黄色固体形式获得的inscov-612(170mg,342.38μmol,37.01%产率,100%纯度)。
[0638]
lcms:保留时间:0.752min,(m+h)=497.1,hplc:保留时间:2.495min,1h nmr(400mhz,dmso-d6):δ=9.10(s,1h),8.99(s,1h),8.55-8.50(m,2h),8.37-8.31(m,2h),7.65(br d,j=8.6hz,2h),7.38(br s,2h),6.14-6.07(m,1h),3.90-3.82(m,1h),3.65(s,2h),2.07-2.01(m,1h),1.97-1.81(m,4h),1.80-1.71(m,1h),1.60-1.50(m,1h),1.45-1.33(m,1h),1.18(t,j=7.1hz,1h),
19
f nmr:(377mhz,dmso-d6):δ=-92.63
‑‑
93.92(m,1f),-97.01
‑‑
99.16(m,1f)。药物组合物
[0639]
实施例a-1:胃肠外药物组合物
[0640]
为制备适于通过注射(例如皮下、静脉内)施用的胃肠外药物组合物,将本文所述的化合物或其药学上可接受的盐或溶剂化物的1-1000mg水溶性盐溶解于无菌水中,接着与10ml的0.9%无菌盐水混合。任选地添加适合缓冲剂以及任选的酸或碱以调整ph。将混合物并入适于通过注射(即皮下sc注射)施用的剂量单位形式中。
[0641]
实施例a-2:口服溶液
[0642]
为制备用于口服递送的药物组合物,将足量的本文所述的化合物或其药学上可接受的盐添加至水(具有任选的一种或多种增溶剂、任选的一种或多种缓冲剂和掩味赋形剂)中以提供20mg/ml溶液。
[0643]
实施例a-3:口服片剂
[0644]
通过混合按重量计20-50%的本文所述的化合物或其药学上可接受的盐、按重量计20-50%的微晶纤维素、按重量计1-10%的低取代羟丙基纤维素和按重量计1-10%的硬脂酸镁或其他适当赋形剂制备片剂。通过直接压制制备片剂。压制片剂的总重量维持在100-500mg下。
[0645]
实施例a-4:口服胶囊
[0646]
为制备用于口服递送的药物组合物,将1-1000mg的本文所述的化合物或其药学上可接受的盐与淀粉或其他适合粉末掺合物混合。将混合物并入适于口服施用的口服剂量单位诸如硬质明胶胶囊中。
[0647]
在另一实施方案中,将1-1000mg的本文所述的化合物或其药学上可接受的盐放置至4号胶囊或1号胶囊(羟丙甲纤维素或硬质明胶)中,并且将胶囊封闭。
生物学实施例
[0648]
实施例b-1:体外测定(sars-cov-2 m
pro
酶法测定)
[0649]
克隆c-his6标签化sars-cov-2m
pro
(nc_045512),在大肠杆菌(e.coli)中表达,并且由wuxi纯化。底物dabcyl-ktsavlq||sgfrkme-(edans)由genscript合成。测定缓冲液含有20mm的tris-hcl(ph=7.3)、100mm的nacl、1mm的edta、5mm的tcep和0.1%bsa。在m
pro
酶法测定中,m
pro
蛋白和底物的最终浓度分别是25nm和25μm。参考化合物gc376由wuxi apptec提供,并且被包括在每个板中以确保测定稳健性。以单剂量或10剂量滴定,一式两份测试测试化合物。使用echo将化合物添加至测定板(384孔形式)的一式两份孔中。对于单剂量实验,最终浓度是10μm。就全剂量响应实验而言,从25um开始将样品进行3倍连续稀释以获得10种剂量,并且添加至测定板的一式两份孔中。每种化合物的最终浓度(μm)是25、8.33、2.778、0.926、0.309、0.103、0.034、0.011、0.0038和0.0013。使用multidrop将m
pro
蛋白(25μl,30nm)添加至含有测试化合物的测定板中。在室温下,将测试化合物和m
pro
蛋白预孵育30min。接着,将底物(5μl,150μm)添加至测定板中。对于100%抑制对照(hpe,高百分比作用),添加1μm的gc376。对于无抑制对照(zpe,零百分比作用),添加相同体积的dmso。最终dmso浓度是1%。每个活性测试点具有不含酶的相关背景对照以移除化合物的荧光干扰。在30℃下孵育60min之后,使用酶标仪m2e(spectramax)在e
x
/em=340nm/490nm下检测荧光信号(rfu)。
[0650]
使用下式计算抑制活性,使用抑制%数据计算ic
50
值。抑制%=((cpd-bg
hpe
)-(zpe-bg
zpe
))/((hpe-bg
hpe
)-(zpe-bg
zpe
))
×
100其中,hpe是高百分比作用对照(1μm的gc376+酶+底物);zpe是零百分比有效对照(酶+底物,无化合物);cpd是化合物活性测试孔(化合物+酶+底物);并且bg是背景对照孔(无酶)。
[0651]
用graphpad prism软件,使用log(抑制剂)相对于响应-可变斜率(四个参数)的非线性回归模型计算化合物的ic
50
值。
[0652]
代表性生物化学数据呈现于表2中,代表性生物化学曲线显示于图2中。表2.体外效能数据
[0653]
实施例b-2:基于细胞的体外抗病毒测定(活体sars-cov-2 ifa)
[0654]
sars-cov-2由韩国疾病控制和预防中心(korea centers for disease control and prevention,kcdc)提供。vero细胞从atcc获得,并且在补充以10%fbs和1%抗生素-抗真菌剂溶液的杜贝卡氏改良依格氏培养基(dulbecco’s modified eagle’s medium,dmem)中维持。补充以2%fbs和1%抗生素-抗真菌剂溶液的dmem用作测定培养基。用于这个测定中的主要试剂是抗sars-cov-2n蛋白抗体、alexa fluor 488山羊抗兔igg(h+l)二级抗体和hoechst 33342。产生每种化合物的十点剂量-响应曲线(drc)。在实验之前24h,将vero细胞以1.2
×
104个细胞/孔接种在黑色384孔μclear板(greiner bio-one)中。对于病毒性感染,以~0.0125的感染复数(moi)添加sars-cov-2。在24hpi,将细胞用4%多聚甲醛固定,并且通过免疫荧光来分析。使用软件分析获得的图像以定量细胞数目和感染率,并且将抗病毒活性以每个测定板中的阳性(模拟)和阴性(0.5%dmso)对照作归一化。使用xlfit 4软件或
prism,采用以下方程,通过s形剂量-响应模型来拟合drc:y=底部+(顶部-底部)/(1+(ic
50
/x)希尔斜率)
[0655]
计算ec
50
和cc
50
值,并且表示在表3中。表3.基于细胞的活体sars-cov-2体外测定结果。2体外测定结果。
[0656]
计算了在作为阳性对照的瑞德西韦的情况下的ec
50
和cc
50
。瑞德西韦的结构在以下列出。
[0657]
实施例b-3:adme表征
[0658]
微粒体稳定性评估
[0659]
如下评估来自表4的化合物的微粒体稳定性:制备测试化合物和对照化合物(睾酮(testosterone)、双氯芬酸(diclofenac)和普罗帕酮(propafenone))的工作溶液。将适量的nadph粉末(β-烟酰胺腺嘌呤二核苷酸磷酸还原形式,四钠盐,nadph
·
4na,目录号00616;chem-impex international)称重,并且稀释至mgc12(10mm)溶液中(工作溶液浓度,10单位/毫升;反应体系中的最终浓度,1单位/毫升)。用100mm pb制备适当浓度的微粒体工作溶液(人:hlm,目录号452117,corning;cd-1小鼠:mlm,目录号m1000,xenotech)。包括作为内
部标准物(is)的100ng/ml甲苯磺丁脲(tolbutamide)和100ng/ml拉贝洛尔(labetalol)的冷acn用于终止溶液。将化合物或对照工作溶液(10μl/孔)添加至所有板(t0、t5、t10、t20、t30、t60和ncf60)中,除基质空白之外。通过apricot将经分配的微粒体溶液(80μl/孔)添加至每个板中,并且在37℃下,将微粒体溶液和化合物的混合物孵育约10min。在预热之后,通过apricot将经分配的nadph再生系统(10μl/孔)添加至每个板中以开始反应。接着在37℃下孵育溶液。接着添加终止溶液(300μl/孔,4℃)以终止反应。将取样板振荡约10分钟。在4℃下,在4,000rpm下,将样品离心20min。当离心时,将新的8
×
96孔板装载以300μl hplc水,接着转移100μl上清液并混合以进行液相色谱法
–
串联质谱测定法(lc/ms/ms)。
[0660]
cyp抑制测定
[0661]
以下试剂/反应物用于测定中:水通过elga lab纯化系统来纯化,缓冲溶液:pb(100mm),mgcl2(33mm),有机溶剂是ar或hplc等级,cyp底物:非那西汀(phenacetin)(10μm,25μl,1a2),双氯芬酸(5μm,25μl,2c9),s-美芬妥英(s-mephenytoin)(30μm,75μl,2c19),右美沙芬(dextromethorphan)(5μm,12,5,2d6)和咪达唑仑(midazolam)(2μm,10μl,3a4),储备溶液在meoh中制备(分别是20、10、20、20和10mm)。阳性对照:α-萘黄酮(α-naphthoflavone)、磺胺苯吡唑(sulfaphenazole)、(+)-n-3-苯甲基尼凡诺((+)-n-3-benzylnirvanol)、奎尼丁(quinidine)和酮康唑(ketoconazole),最终浓度是3μm在meoh(90μl)中,储备溶液在dmso中制备(对于所有抑制剂都是3mm)。使用在15-5,000μm的范围内的五个浓度点评估测试化合物。人肝微粒体(目录号452117,corning)以0.253mg/ml的浓度(pb:44,431ml;微粒体的体积:569ml)使用,而nadph(目录号00616,chem-impex international)以10mm的浓度(mgcl2:20,0ml,33mm)使用。主要程序:制备测试化合物和标准抑制剂的工作溶液(100
×
),将微粒体从
–
80℃冷冻器取出以在冰上解冻,标注日期,并且在使用之后即刻将它放回到冷冻器。将底物(20μl)和pb(20μl)分别添加至相应孔和空白孔中。将测试化合物(2μl)和阳性对照工作溶液添加至相应孔中,接着将溶剂(2μl)添加至无抑制剂孔和空白孔中。将hlm工作溶液(158μl)添加至孵育板的所有孔中。在水浴中,在37℃下,将板预热约10min,接着将nadph(20μl)添加至所有孵育孔中。混合cyp,并且在水浴中,在37℃下孵育10min。在时间点时,通过添加400μl冷终止溶液(200ng/ml甲苯磺丁脲和拉贝洛尔,在acn中)来终止反应。在4000rpm下将样品离心20分钟以使蛋白质沉淀。将上清液(200μl)转移至100μl hplc水中并振荡10min,接着使样品经受lc/ms/ms分析。xl fit用于将媒介物对照的百分比相对于测试化合物浓度进行绘图,并且用于数据的非线性回归分析。使用3或4参数逻辑方程确定ic
50
值。当在最高浓度(50μm)下的抑制%小于50%时,ic
50
值报告为“》50μm”。
[0662]
代表性cyp p450数据描述于表4中。表4.代谢(微粒体)稳定性(mlm和hlm)和小型cyp p450考核盘(panel)评估。
[0663]
实施例b-4:渗透性研究
[0664]
caco-2渗透性
[0665]
将从atcc购买的caco-2细胞以1
×
105个细胞/cm2接种至96孔corning插件板中的聚乙烯膜(pet)上。每4~5天更新培养基直至第21至第28天,以形成汇合的细胞单层。运输缓冲液是在ph=7.40
±
0.05下的具有10mm hepes的hbss。双向一式两份测试测试化合物(2.00μm)和地高辛(digoxin)(10.0μm),同时也在2.00μm下在a至b的方向上一式两份测试纳多洛尔(nadolol)和美托洛尔(metoprolol)。将最终dmso浓度调整至小于1%。在co2孵育器中,在37
±
1℃下,在5%co2下,在饱和湿度下,在不振荡下,将板孵育2h。接着将所有样品与含有内部标准物的乙腈混合,并且在3200
×
g下离心10min。对于纳多洛尔和美托洛尔,将100μl上清液溶液用300μl蒸馏水稀释以进行lc-ms/ms分析。对于地高辛和测试化合物,将100μl上清液溶液用100μl蒸馏水稀释以进行lc-ms/ms分析。通过lc-ms/ms方法,使用分析物/内部标准物的峰面积比来定量起始溶液、供体溶液和接收体溶液中测试和对照化合物的浓度。在运输测定之后,应用萤光黄(lucifer yellow)排斥测定来测定caco-2细胞单层完整性。使用以下方程计算表观渗透系数papp(cm/s):p
app
=(dcr/dt)
×vr
/(a
×
c0)其中dcr/dt是随时间变化的接收体室中化合物的累积浓度(μm/s);vr是接收体室中的溶液体积(在顶侧上是0.075ml,在基底侧上是0.25ml);a是运输表面积,即单层的面积是0.0804cm2;c0是供体室中的初始浓度(μm)。
[0666]
使用以下方程计算流出比:流出比=p
app
(ba)/p
app
(ab)
其中vd是供体室中的体积(在顶侧上是0.075ml,在基底侧上是0.25ml);cd和cr分别是供体室和接受体室中运输化合物的最终浓度。
[0667]
以类似于对于cyp抑制测定所述的程序的方式进行数据分析,并且显示于表5中。
[0668]
pampa渗透性测定
[0669]
将2.6g kh2po4和18.5g k3pho4×
3h2o溶解于1000ml的超纯水中,充分混合。使用1m氢氧化钠或1m盐酸将ph调整至7.40
±
0.05。通过用dmso稀释10mm储备溶液来制备0.2mm工作溶液。通过用380μl pbs稀释20μl的工作溶液来制备10μm供体溶液(5%dmso)。将150μl的10μm供体溶液添加至供体板的每个孔中,所述孔的pvdf膜经5μl的1%卵磷脂/十二烷混合物预包被。一式两份进行制备。将300μl的pbs添加至ptfe受体板的每个孔中。将供体板和受体板组合在一起,并且在室温下,在以300rpm振荡下孵育4h。t0样品的制备:将20μl供体溶液转移至新孔中,随后添加250μl pbs(df:13.5)、130μl acn(含有内部标准物),作为t0样品。受体样品的制备:将板从孵育器移除。从每个受体孔转移270μl溶液,并且与130μlacn(含有内部标准物)混合,作为受体样品。供体样品的制备:从每个供体孔转移20μl溶液,并且与250μl pbs(df:13.5)、130μl acn(含有内部标准物)混合,作为供体样品。受体样品和供体样品全都通过lc-ms/ms来分析。用于测定渗透速率(pe)的方程显示如下:[药物]
平衡
=([药物]
供体
×vd
+[药物]
受体
×va
)/(vd+va),vd=0.15ml;va=0.30ml;面积=0.28cm2;时间=14400s,[药物]
受体
=(aa/ai×
df)
受体
;[药物]
供体
=(aa/ai×
df)
供体
,其中:aa/a:分析物和内部标准物的峰面积比;df:稀释因子。
[0670]
代表性渗透性数据显示于表5中。表5.渗透性和溶解性评估数据。
[0671]
实施例b-5:血浆稳定性
[0672]
溴化丙胺太林(propantheline bromide)用作这个测定中的参考化合物。在实验之前,在水浴中,在37℃下,将汇合的冷冻血浆解冻。在4000rpm下将血浆离心5min,并且如果有的话,那么将凝块移除。如果需要,那么ph将调整至7.4
±
0.1。
[0673]
化合物的制备:通过用90μl dmso稀释10μl的储备溶液来制备1mm中间溶液;通过用90μl超纯水稀释10μl的储备溶液来制备阳性对照丙胺太林的1mm中间溶液。对于测试化合物,通过用90μldmso稀释10μl的中间溶液(1mm)来制备100μm给药溶液。对于阳性对照,通过用90μl 45%meoh/h2o稀释10μl的中间溶液(1mm)来制备100μm给药溶液。一式两份地将98μl的空白血浆外加以2μl的给药溶液(100μm)以实现2μm的最终浓度,并且在水浴中,在37℃下孵育样品。在每个时间点(0、10、30、60和120min),添加400μl的终止溶液(200ng/ml甲苯磺丁脲和200ng/ml拉贝洛尔,在100%acn中)以使蛋白质沉淀,并且充分混合。在4,000rpm下将样品板离心10min。从每个孔转移上清液的等分试样(50μl),并且与100μl超纯水混合。在800rpm下将样品振荡约10min,随后提交进行lc-ms/ms分析。使用以下方程计算在血浆中孵育之后的剩余测试化合物%:
剩余%=100
×
(在指定孵育时间时的par/在t0时间时的par)其中par是分析物相对于内部标准物(is)的峰面积比。
[0674]
代表性血浆稳定性数据显示于表6中。表6.血浆蛋白质结合(ppb)和血浆稳定性评估。
[0675]
实施例b-6:在小鼠中的药物代谢动力学概况
[0676]
用化合物5{55}-sr溶解于含0.5%吐温80(tween80)的10mm pbs(ph 7.4)中的溶液(均质浑浊悬浮液,5mg/ml)以20mg/kg的施用剂量(皮下)处理雄性cd-1小鼠(n=3/组,龄期:7-9周)。在施用之后0.083、0.25、0.5、1、2、4、8和24h收集血液样品(每个时间点约0.025ml)。所有血液样品都转移至预冷却的商业edta-k2管中,并且放置在湿冰上直至离心。遵循标准程序获得血清样品,并且通过lc-ms/ms分析上清液中化合物的浓度。通过用4体积(w:v)的均质化溶液(15mm pbs:meoh=2:1)将组织均质化来制备肺组织匀浆。
[0677]
使用96孔板的蛋白质沉淀(ppt)(血浆)
[0678]
将6μl未知样品、校正标准物样品、质量控制样品、稀释质量控制样品、单空白样品和双空白样品的等分试样添加至96孔板中。将每种样品(除双空白之外)分别用180μl is1淬灭(将双空白样品用180μlacn淬灭),接着在800rpm下将混合物涡旋混合10min,并且在3220g(4000rpm)、4℃下离心15min。将60μl上清液转移至另一洁净96孔板中并在3220g、4℃下离心5min,接着将上清液直接进样以进行lc-ms/ms分析。
[0679]
使用1.5ml管的蛋白质沉淀(ppt)(肺匀浆)
[0680]
将30μl未知样品、校正标准物样品、单空白样品和双空白样品的等分试样添加至1.5ml管中。将每种样品(除双空白之外)分别用900μl is1淬灭(将双空白样品用900μl acn
淬灭),接着用涡旋器将混合物充分涡旋混合(至少15s),并且在12000g、4℃下离心15min。将60μl上清液转移至96孔板中并在3220g、4℃下离心5min,接着将上清液直接进样以进行lc-ms/ms分析。
[0681]
表7显示同类化合物inscov-600k(1)和inscov-614(1b)的adme概况。表7.化合物inscov-600k(1)和inscov-614(1b)的总体概要614(1b)的总体概要a在pampa人工膜测定中的渗透性,b在人肝微粒体中测量的内在清除率c在小鼠肝微粒体中测量的内在清除率
[0682]
发现化合物inscov-600k(1)在血浆中不稳定,并且发现其不可为进一步pk研究所接受。插入氟原子和α-氯乙酰胺弹头导致同类化合物inscov-614(1b)在血浆中的稳定性显著改善。进一步评估化合物inscov-614(1b)在小鼠中的pk性质。
[0683]
图2和图3分别提供inscov-614(1b)和inscov-614a(2a)的pk概要。
[0684]
实施例b-7:共价结合于sars-cov-2 m
pro
的cys145残基的inscov-601i(1)的晶体结构
[0685]
观察到inscov-601i(1)具有先前尚未报道的独特结合模式。因此,类似于公开的共价m
pro
抑制剂,超分子相互作用如下:氯乙酰胺弹头的α-原子共价连接于保守性cys145,异噻唑位于由his41、cys44、met49、met165形成的深疏水性子口袋内,并且一个吡嗪受体通过氢键与his163相互作用,配体的苯基片段和异噻唑部分分别通过平面的和位移的π堆积与his41相互作用。新型结合通过以下实现:a)弹头羰基氧与多肽骨架的gly143和cys145 nh质子的三重h键合界面,b)配体的酰胺质子与asn142的侧链羰基原子形成h键(这个相互作用先前已针对从基于片段的广泛筛选活动输出的若干片段进行报道),c)第二吡嗪受体和酰胺羰基原子与水分子形成h键,以及d)4-二氟环己烷放置在口袋的出口处。尤其应注
意,酰胺羰基原子与asn142相互作用,而在许多报道的抑制剂中,这个空间环境中的酰胺键与glu166形成h键。
[0686]
共价结合于sars-cov-2m
pro
的cys145残基的inscov-601i(1)的晶体结构显示于图4中。这证明本文公开的化合物共价修饰cys145。
[0687]
应了解本文所述的实施例和实施方案仅出于说明目的,并且根据其的各种修改或变化将为本领域技术人员所想起,并将包括在本技术的精神和界限以及随附权利要求的范围内。本文引用的所有出版物、专利和专利申请都在此出于所有目的通过引用以它们的全文并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1