合成表达系统的制作方法
本公开涉及包括转录单元的合成表达系统、包括合成表达系统的宿主细胞以及用于甲醇非依赖性生物产生蛋白质和其它期望分子的方法。
背景技术:
1、在生物产物(例如,蛋白质、核酸、小分子等)的产生中已使用了某些甲基营养型酵母细胞,这部分是由于甲基营养型酵母细胞的天然启动子系统的强大且可调节的特性。例如,在巴斯德毕赤酵母(p.pastoris)中已成功产生了许多重组蛋白质,所述巴斯德毕赤酵母是甲基营养型酵母,其中重组蛋白质产生通常是由其内源性甲醇调节的aox1启动子,p(aox1)驱动的。尽管基于p(aox1)的产生系统得到良好表征、优化、强大且在工业史上有广泛用途,但p(aox1)的甲醇依赖性限制了巴斯德毕赤酵母表达系统对限制性过程条件的使用。这在大规模产生环境中是特别严重的问题,因为甲醇在大规模下是高度毒性且易燃的化合物,危险且不期望。
技术实现思路
1、需要一种匹配或超过现有工业规模的甲醇依赖性表达系统的产生能力的解决方案。本公开描述了转录单元和合成表达系统、包括转录单元和合成表达系统的宿主细胞以及促进蛋白质和分子(包括在甲醇非依赖性条件下)的高产率合成的方法。
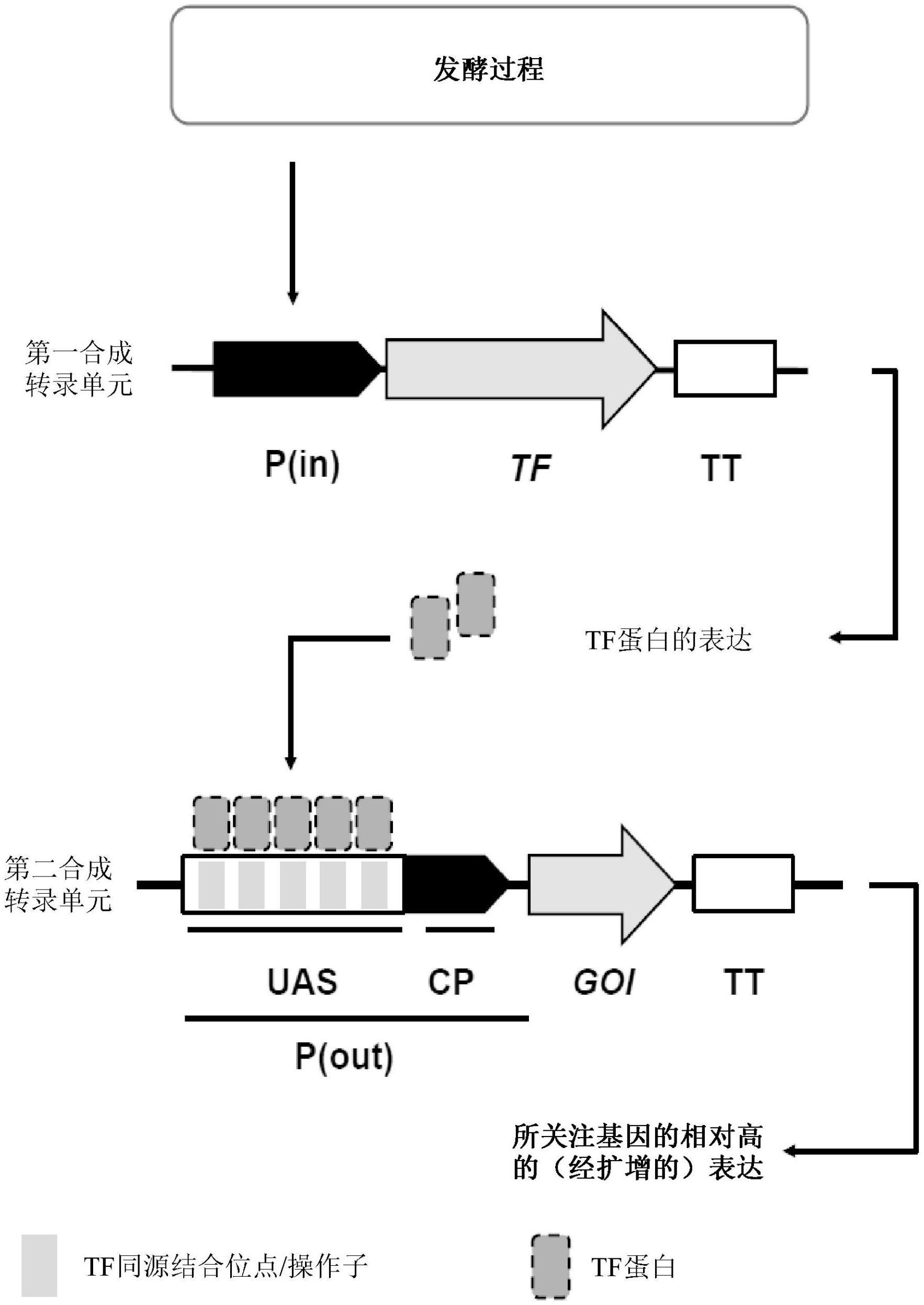
2、本公开的各方面涉及一种甲基营养型宿主细胞,其包括合成表达系统,所述合成表达系统包括以下元件:(1)第一转录单元,所述第一转录单元包括输入启动子和编码合成转录因子的至少一种组分的多核苷酸,所述输入启动子包括上游激活序列(uas)和核心启动子元件,其中所述合成转录因子包括dna结合结构域(dbd)和转录激活结构域(tad),其中所述dbd和所述tad对于所述甲基营养型宿主细胞来说不是天然的;以及(2)第二转录单元,所述第二转录单元包括与所关注基因可操作地连接的合成输出启动子,其中所述合成转录因子为所述合成输出启动子的激活子,其中所述所关注基因是在不存在外源提供的甲醇的情况下表达的。在一些实施例中,所述输入启动子驱动所述合成转录因子的所述至少一种组分的表达。
3、在一些实施例中,所述第一转录单元的所述多核苷酸编码所述转录因子的所有组分。
4、在一些实施例中,所述输入启动子是天然存在的。在一些实施例中,所述输入启动子与天然存在的启动子具有至少90%序列同一性。在一些实施例中,所述输入启动子是合成的。在一些实施例中,所述输入启动子为组成型启动子。
5、在一些实施例中,所述输入启动子为可调节的输入启动子。在一些实施例中,所述可调节的输入启动子为诱导型的。在一些实施例中,所述可调节的输入启动子为阻遏型的。在一些实施例中,所述可调节的输入启动子响应于同源培养过程中的营养物添加、限制或耗竭。在一些实施例中,所述可调节的输入启动子响应于硫胺素耗竭。在一些实施例中,所述可调节的输入启动子响应于甘油限制。在一些实施例中,所述可调节的输入启动子响应于单糖限制。在一些实施例中,所述可调节的输入启动子响应于碳源、糖、淀粉、半乳糖、麦芽糖、葡萄糖、山梨醇、肌醇、甘油、维生素、类固醇、氮源、硝酸盐、亚硝酸盐、铵、氨基酸、甲硫氨酸、重金属、铜、苯甲酸、过氧化氢、含钙化合物和/或磷酸盐的限制。在一些实施例中,所述可调节的输入启动子响应于不存在外源提供的甲醇的情况。在一些实施例中,所述可调节的输入启动子响应于任何两种或更多种营养物的组合的限制或耗竭。在一些实施例中,所述可调节的输入启动子的活性由于存在外源提供的甲酸而提高。在一些实施例中,所述可调节的输入启动子可在不存在外源提供的甲醇的情况下调节。在一些实施例中,所述输入启动子不是甲醇诱导型的。
6、在一些实施例中,所述输入启动子的所述上游激活序列(uas)和/或所述核心启动子元件对于所述甲基营养型宿主细胞来说不是天然的。
7、在一些实施例中,所述输入启动子为p(jen1)、p(gq6704499)、p(gq6700926)、p(hgt1)、p(fdh1)、p(aox2)、p(rgi2)、p(thi13)_短、p(thi13)_长或p(thi4)。在一些实施例中,所述输入启动子为p(jen1)。在一些实施例中,所述输入启动子为p(gq6704499)。在一些实施例中,所述输入启动子为p(gq6700926)。在一些实施例中,所述输入启动子为p(hgt1)。在一些实施例中,所述输入启动子为p(fdh1)。在一些实施例中,所述输入启动子为p(aox2)。在一些实施例中,所述输入启动子为p(rgi2)。在一些实施例中,所述输入启动子为p(thi13)_短。在一些实施例中,所述输入启动子为p(thi13)_长。在一些实施例中,所述输入启动子为p(thi4)。
8、在一些实施例中,所述输入启动子为与seq id no:16-25中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸。在一些实施例中,所述输入启动子为具有seq id no:16-25中的任一项的核酸序列的多核苷酸。
9、在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为bm3r1、tetr、phlf_am或vanr_am。在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为bm3r1。在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为tetr。在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为phlf_am。在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为vanr_am。
10、在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为b112_tad、b42_tad、gal4_tad、minivpr_tad、mxr1_tad、ph_tad、vp16_tad、vp64_tad、vp64v2_tad、vph_tad或vpr_tad。在一些实施例中,所述转录激活结构域为所述合成转录因子b112_tad的(tad)。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为b42_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为gal4_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为minivpr_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为mxr1_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为ph_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为vp16_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为vp64_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为vp64v2_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为vph_tad。在一些实施例中,所述合成转录因子的所述转录激活结构域(tad)为vpr_tad。
11、在一些实施例中,所述合成转录因子的所述dna结合结构域(dbd)为bm3r1、tetr、phlf_am或vanr_am,并且所述合成转录因子的所述转录激活结构域(tad)为b112_tad、b42_tad、gal4_tad、minivpr_tad、mxr1_tad、ph_tad、vp16_tad、vp64_tad、vp64v2_tad、vph_tad或vpr_tad。
12、在一些实施例中,所述合成转录因子不是所述输入启动子的激活子。
13、在一些实施例中,所述合成转录因子为单组分合成转录因子。在一些实施例中,所述合成转录因子为双组分合成转录因子。在一些实施例中,所述合成转录因子为多组分合成转录因子。
14、在一些实施例中,所述合成转录因子包括核定位信号。在一些实施例中,所述核定位信号为sv40核定位信号。
15、在一些实施例中,所述合成转录因子包括接头。
16、在一些实施例中,所述双组分合成转录因子或所述多组分合成转录因子包括生物缀合蛋白质产物部分1(bpp1)和生物缀合蛋白质部分2(bpp2)。在一些实施例中,所述bpp1为spytag002,并且所述bpp2为spycatcher002。
17、在一些实施例中,所述合成转录因子包括自切割多肽。在一些实施例中,所述自切割多肽为2a肽。在一些实施例中,所述自切割多肽为erbv_1_p2a。
18、在一些实施例中,所述合成转录因子包括寡聚化结构域。在一些实施例中,所述寡聚化结构域为仅_用于_寡聚化_的接头;三聚化_结构域;或七聚化_结构域。
19、在一些实施例中,所述第一转录单元包括具有seq id no:26-40或182-185中的任一项的核酸序列的多核苷酸或由其组成。在一些实施例中,所述合成转录因子包括具有seqid no:41-55中的任一项的氨基酸序列的多肽或由其组成或由具有seq id no:182-185中的任一项的核酸序列的多核苷酸编码。
20、在一些实施例中,所述合成输出启动子不是甲醇诱导型的。
21、在一些实施例中,所述合成输出启动子包括上游激活序列和核心启动子元件。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)对于所述甲基营养型宿主细胞来说不是天然的。
22、在一些实施例中,所述合成输出启动子的所述核心启动子元件具有长度不超过300个碱基对的核酸序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件具有长度为约6个碱基对至约300个碱基对、约25个碱基对至约250个碱基对、约75个至约225个碱基对或约100个碱基对至约175个碱基对的核酸序列。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)的3'端与所述核心启动子元件的5'端之间的距离的长度为0个至200个碱基对。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)的3'端与所述核心启动子元件的5'端之间的距离为具有长度为约6个碱基对至约200个碱基对、约6个碱基对至约53个碱基对、约20个碱基对至约150个碱基对、约50个碱基对至约125个碱基对或约50个碱基对至约100个碱基对的核酸序列。
23、在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与天然存在的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与来自p(aox1)(seq id no:162)、p(das2)(seq id no:163)、p(hhf2)(seq id no:164)或p(pmp20)(seq id no:165)的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与来自p(aox1)的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与来自p(das2)的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与来自p(hhf2)的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。在一些实施例中,所述合成输出启动子的所述核心启动子元件包括与来自p(pmp20)的核心启动子序列至少90%、至少95%或100%相同的核心启动子序列。
24、在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)包括bmo、teto、phlo或vano。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)包括bmo。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)包括teto。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)包括phlo。在一些实施例中,所述合成输出启动子的所述上游激活序列(uas)包括vano。
25、在一些实施例中,所述合成输出启动子进一步包括一个或多个操作子。在一些实施例中,所述合成输出启动子的所述一个或多个操作子对所述甲基营养型宿主细胞来说不是天然的。
26、在一些实施例中,所述合成转录因子包括所述dna结合结构域(dbd)bm3r1,并且所述合成输出启动子的所述上游激活序列(uas)包括bmo的一个或多个拷贝。在一些实施例中,所述合成转录因子包括所述dna结合结构域(dbd)phlf_am,并且所述合成输出启动子的所述上游激活序列(uas)包括phlo的一个或多个拷贝。在一些实施例中,所述合成转录因子包括所述dna结合结构域(dbd)tetr,并且所述合成输出启动子的所述上游激活序列(uas)包括teto的一个或多个拷贝。在一些实施例中,所述合成转录因子包括所述dna结合结构域(dbd)vanr_am,并且所述合成输出启动子的所述上游激活序列(uas)包括vano的一个或多个拷贝。
27、在一些实施例中,所述合成输出启动子包括具有seq id no:56-70或186-193中的任一项的核酸序列的多核苷酸或由其组成。
28、在一些实施例中,所述所关注基因表达为rna。在一些实施例中,所述所关注基因编码蛋白质。在一些实施例中,所述所关注基因编码酶、结构蛋白、信号传导蛋白、调节蛋白、运输蛋白、传感蛋白、马达蛋白、防御蛋白或储存蛋白。在一些实施例中,所述蛋白质对分子进行合成、修饰或转化。在一些实施例中,所述分子为血红素或血红素生物合成通路中的中间体。在一些实施例中,所述蛋白质为血红素结合蛋白。在一些实施例中,所述血红素结合蛋白为血红蛋白、神经球蛋白、细胞球蛋白、豆血红蛋白或肌红蛋白。在一些实施例中,所述蛋白质为牛痘病毒加帽酶、t7聚合酶或o-甲基转移酶。在一些实施例中,所述蛋白质为血红素生物合成通路的酶。在一些实施例中,所述血红素生物合成通路的酶为细胞色素p450、9-腺苷酸环化酶、可溶性鸟苷酸环化酶、过氧化物酶、过氧化氢酶和/或细胞色素氧化酶。
29、在一些实施例中,所述甲基营养型宿主细胞进一步包括在所述第二转录单元中的编码分泌标签的多核苷酸。在一些实施例中,所述分泌标签为α-淀粉酶分泌标签、sc mfα1分泌标签或前菊粉酶分泌标签。在其中所述第二转录单元进一步包括分泌标签并且其中所述所关注基因编码蛋白质的一些实施例中,所述蛋白质是从所述甲基营养型宿主细胞中分泌的。在一些实施例中,所分泌的蛋白质为α-淀粉酶、β-乳球蛋白或卵清蛋白。
30、在一些实施例中,所述第一转录单元和/或所述第二转录单元进一步包括转录终止子。在一些实施例中,所述第一转录单元和/或所述第二转录单元的所述转录终止子是天然存在的。在一些实施例中,所述第一转录单元和/或所述第二转录单元的所述转录终止子是合成的。在一些实施例中,所述第一转录单元和/或所述第二转录单元的所述转录终止子来自编码核糖体蛋白的基因。在一些实施例中,所述基因编码所述核糖体蛋白s2(rps2)。
31、在一些实施例中,所述转录终止子包括具有seq id no:146或147的核酸序列的多核苷酸或由其组成。
32、在一些实施例中,所述第一转录单元和所述第二转录单元被间隔子分开。
33、在一些实施例中,所述第一转录单元和/或所述第二转录单元在所述甲基营养型宿主细胞中以多个拷贝存在。在一些实施例中,所述第一转录单元与所述第二转录单元的拷贝数比率为1:1。在一些实施例中,所述第一转录单元与所述第二转录单元的拷贝数比率为至少2:1、至少4:1或至少10:1。在一些实施例中,所述第二转录单元与所述第一转录单元的拷贝数比率为至少2:1、至少4:1或至少10:1。
34、在一些实施例中,所述第一转录单元以单个拷贝存在,并且所述第二转录单元以多个拷贝存在。在一些实施例中,所述多个第二转录单元中的至少两个第二转录单元包括不同的所关注基因。在一些实施例中,所述第一转录单元的所述合成转录因子为所述多个第二转录单元的每个合成输出启动子的激活子。
35、在一些实施例中,所述合成表达系统包括一个或多个对于所述甲基营养型宿主细胞来说内源性的序列。
36、在一些实施例中,所述第一转录单元和所述第二转录单元位于单个质粒上。在一些实施例中,所述第一转录单元和所述第二转录单元位于不同质粒上。在一些实施例中,所述第一转录单元和/或所述第二转录单元整合到所述甲基营养型宿主细胞的基因组中。在一些实施例中,所述第一转录单元和所述第二转录单元位于所述甲基营养型宿主细胞基因组中的同一染色体上。在一些实施例中,所述第一转录单元和所述第二转录单元被定向在相同方向上。在一些实施例中,所述第一转录单元和所述第二转录单元被定向在不同方向上。在一些实施例中,所述第一转录单元和所述第二转录单元位于所述甲基营养型宿主细胞基因组中的不同染色体上。
37、在一些实施例中,所述甲基营养型宿主细胞为甲基营养型酵母细胞。在一些实施例中,所述甲基营养型宿主细胞来自选自以下的属:毕赤酵母属(pichia)、驹形氏酵母属(komagataella)、汉逊酵母属(hansenula)或假丝酵母属(candida)。在一些实施例中,所述甲基营养型宿主细胞为巴斯德毕赤酵母、假巴斯德毕赤酵母(pichia pseudopastoris)、法夫驹形氏酵母(komagataella phaffii)、树干毕赤酵母(pichia stipitis)、膜醭毕赤酵母(pichia membranifaciens)、假巴斯德驹形氏酵母(komagataella pseudopastoris)、巴斯德驹形氏酵母(komagataella pastoris)、库茨玛驹形氏酵母(komagataellakurtzmanii)、蒙达维奥鲁姆驹形氏酵母(komagataella mondaviorum)、多形汉逊酵母(hansenula polymorpha)、博伊丁假丝酵母(candida boidinii)或甲醇毕赤酵母(pichiamethanolica)。在一些实施例中,所述甲基营养型宿主细胞为巴斯德毕赤酵母。
38、在一些实施例中,所述合成表达系统提供了以比在对照宿主细胞(即,不包括同一合成表达系统的宿主细胞)中产生的生物产物的水平更高的水平产生由所述所关注基因编码的所述生物产物。在一些实施例中,所述对照宿主细胞为与所述甲基营养型宿主细胞相同的物种的细胞。在一些实施例中,所述对照宿主细胞为巴斯德毕赤酵母。在一些实施例中,所述对照宿主细胞具有天然输入启动子。在一些实施例中,所述对照宿主细胞具有与所关注基因可操作地连接的甲醇诱导型启动子。在一些实施例中,所述对照宿主细胞的所述甲醇诱导型启动子为巴斯德毕赤酵母的p(aox1)。在一些实施例中,所述对照宿主细胞是在存在外源添加的甲醇的情况下培养的。在一些实施例中,由所述对照宿主细胞编码的所述所关注基因是同一与包括所述合成表达系统的由所述甲基营养型宿主细胞编码的所关注基因。
39、在一些实施例中,所述甲基营养型宿主细胞是在包括生长期和产生期的条件下培养的。在一些实施例中,在所述产生期在所述甲基营养型宿主细胞中产生的所述所关注基因的转录物的数量比在所述生长期在所述甲基营养型宿主细胞中产生的所述所关注基因的转录物的数量高至少100%。在一些实施例中,在所述产生期在所述甲基营养型宿主细胞中产生的所述所关注基因的转录物的数量比在所述生长期在所述甲基营养型宿主细胞中产生的所述所关注基因的转录物的数量高至少200%、至少300%、至少400%或至少500%。
40、在一些实施例中,所述合成表达系统提供了以比在对照宿主细胞中产生的生物产物的水平高至少200%的水平产生由所述所关注基因编码的所述生物产物。在一些实施例中,所述合成表达系统提供了以比在对照宿主细胞中产生的生物产物的水平高至少600%、至少900%、至少1200%、至少1500%、至少1800%、至少2100%、至少2400%、至少2700%、至少3000%、至少5000%或至少10,000%的水平产生由所述所关注基因编码的所述生物产物。在一些实施例中,所述合成表达系统提供了以比在对照宿主细胞中产生的生物产物的水平高多于10,000%的水平产生由所述所关注基因编码的所述生物产物。在一些实施例中,所述合成表达系统提供了以比在对照宿主细胞中产生的生物产物的水平高约300%至约600%、约500%至约1000%、约800%至约1500%、约1000%至约2000%、约1200%至约2000%、约1800%至约2500%、约2000%至约2500%、约2200%至约3000%、约3000%至约5000%或约5000%至约10,000%的水平产生由所述所关注基因编码的所述生物产物。
41、本发明的一些方面描述了一种针对蛋白质表达对宿主细胞进行工程化的方法,所述方法包括用根据本公开的任何实施例的合成表达系统转化所述宿主细胞。
42、其它方面设想了一种表达所关注基因的方法,所述方法包括培养甲基营养型宿主细胞,所述甲基营养型宿主细胞包括如本文档中所述的合成表达系统、转录单元或其组分。在一些实施例中,所述所关注基因编码血红素结合蛋白或血红素生物合成通路的一种或多种酶。在一些实施例中,所述血红素结合蛋白为血红蛋白、肌红蛋白、神经球蛋白、细胞球蛋白或豆血红蛋白。在一些实施例中,所述血红素结合蛋白为肌红蛋白。在一些实施例中,所述血红素生物合成通路的一种或多种酶为细胞色素p450、9-腺苷酸环化酶、可溶性鸟苷酸环化酶、过氧化物酶、过氧化氢酶和/或细胞色素氧化酶。在一些实施例中,所述所关注基因编码牛痘病毒加帽酶、t7聚合酶或o-甲基转移酶。
43、本发明的某些方面描述了一种制造所关注分子的方法,所述方法包括培养甲基营养型宿主细胞并且从生物质或培养物中获得所述所关注分子,所述甲基营养型宿主细胞包括如本文档中所述的合成表达系统、转录单元或其组分。在一些实施例中,所述所关注分子是从生物质中提取的。在一些实施例中,所述分子是从培养物、培养基、不含细胞的用过的培养基和/或含有细胞的培养基中收集的。在其中所述所关注基因编码酶的一些实施例中,所述方法包括:(1)对由所述所关注基因编码的所述酶进行纯化;以及(2)使用经纯化的酶来将底物生物转化为所述所关注分子。在一些实施例中,所述所关注分子为血红素。
44、其它方面设想了一种表达所关注基因或产生所关注分子的方法,所述方法包括以下步骤:(a)根据本公开的方法在合适的培养基中培养宿主细胞一段时间以允许细胞生长;以及(b)改变一种或多种培养条件以促进所述所关注基因的表达或所述所关注分子的产生。
45、在一些实施例中,改变一种或多种培养条件包括改变所述培养基的组成。在一些实施例中,步骤(b)包括限制、添加和/或耗竭营养物。在一些实施例中,步骤(b)包括硫胺素耗竭。在一些实施例中,步骤(b)包括甘油限制。在一些实施例中,步骤(b)包括单糖限制。在一些实施例中,步骤(b)包括甲酸添加。在一些实施例中,步骤(b)包括限制任何碳源、糖、淀粉、半乳糖、麦芽糖、葡萄糖、山梨醇、肌醇、甘油、维生素、类固醇、氮源、硝酸盐、亚硝酸盐、铵、氨基酸、甲硫氨酸、重金属、铜、苯甲酸、过氧化氢、含钙化合物和/或磷酸盐。在一些实施例中,步骤(b)包括限制任何两种营养物的组合。在一些实施例中,步骤(b)包括限制葡萄糖并耗竭硫胺素。
46、在一些方面,合成表达系统包括与seq id no:1-15中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸或由其组成。在一些实施例中,所述合成表达系统包括输入启动子或由其组成,所述输入启动子包括与seq id no:16-25中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸。在一些实施例中,所述合成表达系统包括编码合成转录因子的至少一种组分的多核苷酸或由其组成。在一些实施例中,所述多核苷酸包括与seq id no:26-40或182-185中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸或由其组成。在一些实施例中,经编码的合成转录因子包括与seq id no:41-55中的任一项的氨基酸序列具有至少90%、至少95%或至少99%同一性的多肽或由其组成。在一些实施例中,所述合成表达系统包括合成输出启动子或由其组成,所述合成输出启动子包括与seq id no:56-70或186-193中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸。
47、在一些方面,合成表达系统包括与seq id no:16-25中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸或由其组成。
48、在一些方面,合成表达系统包括与seq id no:56-70或186-193中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性的多核苷酸或由其组成。
49、在一些方面,合成表达系统包括由多核苷酸编码的合成转录因子或由其组成,所述多核苷酸与seq id no:26-40或182-185中的任一项的核酸序列具有至少90%、至少95%或至少99%同一性。
50、在一些方面,合成表达系统编码或包括合成转录因子,所述合成转录因子包括与seq id no:41-55中的任一项的氨基酸序列具有至少90%、至少95%或至少99%同一性的多肽或由其组成。
51、本发明的一些方面描述了一种合成表达系统,其包括:(1)第一转录单元,所述第一转录单元包括编码转录因子的一种或多种组分的多核苷酸;以及(2)第二转录单元,所述第二转录单元包括合成输出启动子。在一些实施例中,所述转录因子为所述合成输出启动子的激活子。
52、在一些实施例中,所述合成表达系统供甲基营养型宿主细胞,如甲基营养型酵母中使用。在一些实施例中,所述合成表达系统在甲基营养型宿主细胞中表达。在一些实施例中,所述合成表达系统在甲基营养型酵母中表达。在一些实施例中,所述合成表达系统供甲基营养型宿主细胞中使用或在甲基营养型宿主细胞中表达。在一些实施例中,所述甲基营养型宿主细胞为毕赤酵母属或驹形氏酵母属的酵母细胞。在一些实施例中,所述合成表达系统为供甲基营养型宿主细胞中使用或在甲基营养型宿主细胞中表达的甲醇非依赖性表达系统。在一些实施例中,所述合成表达系统为供甲基营养型酵母中使用或在甲基营养型酵母中表达的甲醇非依赖性表达系统。在一些实施例中,所述酵母属于毕赤酵母属或驹形氏酵母属。
53、本发明的一些方面描述了一种合成表达系统,其包括:(1)第一转录单元,所述第一转录单元包括编码转录因子的至少一种组分的多核苷酸;以及(2)第二转录单元,所述第二转录单元包括合成输出启动子。在一些实施例中,所述转录因子为所述合成输出启动子的激活子。
54、本发明的一些方面描述了一种合成的甲醇非依赖性表达系统,其包括:(1)第一转录单元,所述第一转录单元包括编码转录因子的一种或多种组分的多核苷酸;以及(2)第二转录单元,所述第二转录单元包括合成输出启动子。在一些实施例中,所述转录因子为所述合成输出启动子的激活子。
55、本发明的一些方面描述了一种合成的甲醇非依赖性表达系统,其包括:(1)第一转录单元,所述第一转录单元包括编码转录因子的一种或多种组分的多核苷酸;以及(2)第二转录单元,所述第二转录单元包括合成输出启动子。在一些实施例中,所述转录因子为所述合成输出启动子的激活子。在一些实施例中,所述合成的甲醇非依赖性表达系统在毕赤酵母属或驹形氏酵母属的宿主细胞中表达。
56、本发明的每个特征都可以被本发明的各个方面所涵盖。设想了涉及任何一个元件或元件组合的本发明的每个特征都可以包括在本发明的每个实施例中。本发明的应用不限于以下说明书中阐述的或附图中示出的构造细节和组分布置。本发明能够具有其它实施例并且能够以不同的方式实践或执行。
- 还没有人留言评论。精彩留言会获得点赞!