制备氨基呋喃的方法与流程
制备氨基呋喃的方法
1.本发明涉及一种制备通式(i)的4-氨基呋喃及其盐的新方法。
2.通式(i)的4-氨基呋喃(特别是r1=coome)是农业化学活性成分(参见wo2018/228985)和药物活性成分(如dna结合剂:woods,craig r.等人,bioorganic&medicinal chemistry letters,12(18),2647-2650;2002)的重要前体。
3.通式(i)的4-氨基呋喃可作为制备四氢呋喃羧酸和二氢呋喃羧酸及其酯的起始原料。迄今为止,这些式(i)的化合物是通过多阶段合成来制备的,包括溴化、脱卤、偶联反应和脱保护。(参见f.brucoli等人,bioorganic&medicinal chemistry,20(6),2019-2024;2012)。
4.方案1:
[0005][0006]
a)br2,alcl3;b)zn,nh4cl;c)cui/(ch3nhch2)2,boc-nh2,k2co3;d)去除boc保护基团
[0007]
上述的合成方法有诸多缺点,如原子经济性低(溴化和脱卤),使用重金属(如锌),以及使用保护基团(如boc-胺)。此外,bioorganic&medicinal chemistry,20(6),2019-2024;2012中描述的方法还需要使用含金属的(例如碘化铜(i))催化剂。
[0008]
这些缺点使得制备通式(i)的化合物的方法不经济,因此非常昂贵。
[0009]
f.wolter等人在(organic letters,11(13),2804-2807;2009)中描述了另一种制备通式(i)的氨基呋喃的方法,具体是通过使用(pho3)2p(o)n3使呋喃-2,4-二甲酸二甲酯发生curtius重排。由于有机叠氮化物的高爆炸性,该方法不适合工业应用。
[0010]
european journal of organic chemistry 2018,3853-3861中描述了几种通式(i)的化合物,例如其中r1=cf3和r2=nh芳基。然而,这种化合物是在几种成分的混合物中检测到的。
[0011]
鉴于上述现有技术,本发明的目的是找到一种制备指定化合物的方法,该方法具有成本效益并可在工业规模上使用。还希望能以高产率和高纯度获得这些化合物,使它们不必再进行任何复杂的提纯。
[0012]
上述目标——简单、具有成本效益和大规模的生产——是通过一种制备通式(i)的化合物及其盐的方法实现的
[0013][0014]
其中
[0015]
r1为cf3、cf2h、c2f5、cf2cl、ccl3、coo(c
1-c4)烷基、cooh,
[0016]
r2为h、ch3co、ccl3co、cf3co、苯基-co、ch3oco、(ch3)3coco、苯基、苯基-ch2、(二苯基)ch,
[0017]
其特征在于,在第一步中,在通式为r
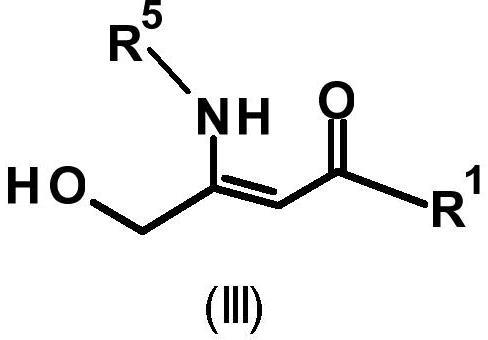
5-nh2(v)的胺的辅助下,通式(ii)的化合物转化为通式(iii)的化合物:
[0018][0019]
其中
[0020]
r3和r4各自独立地为h和c
1-c4烷基
[0021]
并且
[0022]
r1具有上文所述定义,
[0023][0024]
其中
[0025]
r5为h、苯基、苯基-ch2、(二苯基)ch,
[0026]
并且在第二反应步骤中,这些化合物在脱水试剂的存在下进行反应,得到通式(i)的化合物。
[0027]
优选的通式(i)、(ii)、(iii)、(iv)和(v)的化合物的基团的定义如下:
[0028]
r1为cf3、cf2h、cf2cl、c2f5、ccl3、cooch3、cooc2h5,
[0029]
r2为h、cf3co、ch3co、ccl3co、苯基、苯基-ch2、(二苯基)ch、ch3oco、(ch3)3coco,
[0030]
r3和r4各自独立地为h或ch3,
[0031]
r5为h、苯基、苯基-ch2、(二苯基)ch。
[0032]
特别优选的通式(i)、(ii)、(iii)、(iv)和(v)的化合物的基团的定义如下:
[0033]
r1为cf3、cf2h、ccl3、cooch3、cooc2h5,
[0034]
r2为h、cocf3、coch3、coccl3、苯基-ch2、(二苯基)ch、ch3oco、(ch3)3coco,
[0035]
r3和r4各自独立地为h或ch3,
[0036]
r5为h。
[0037]
特别优选的通式(i)、(ii)、(iii)、(iv)和(v)的化合物的基团的定义如下:
[0038]
r1为cf3、cooch3、cooc2h5,
[0039]
r2为h、cocf3、(ch3)3coco,
[0040]
r3和r4为ch3,
[0041]
r5为h。
[0042]
进一步特别优选的通式(i)、(ii)、(iii)、(iv)和(v)的化合物的基团的定义如下:
[0043]
r1为cooch3、cooc2h5,
[0044]
r2为h,
[0045]
r3和r4为ch3,
[0046]
r5为h。
[0047]
进一步特别优选的通式(i)、(ii)、(iii)、(iv)和(v)的化合物的基团的定义如下:
[0048]
r1为cooch3,
[0049]
r2为h,
[0050]
r3和r4为ch3,
[0051]
r5为h。
[0052]
制备式(i)的化合物的反应顺序如方案2所示:
[0053]
方案2
[0054][0055]
在第一反应步骤中,式(ii)的化合物与氨或胺(通式(v)的化合物)反应,形成通式(iii)的化合物,然后,通式(iii)的化合物在第二反应步骤中转化为通式(i)的化合物。已
知有几种通式(ii)和(iii)的化合物,其中r1、r3、r4和r5具有上述定义。这些化合物可以通过wo 2011/073100、wo 2011/073101和european journal of organic chemistry(2018),2018(27-28),3853-3861中已知的方法制备。
[0056]
举例来说,可以提及以下式(ii)的化合物:
[0057][0058]
3-(2,2-二甲基-1,3-二氧戊环-4-亚基)-1,1,1-三氟丙-2-酮
[0059]
3-(1,3-二氧戊环-4-亚基)-1,1,1-三氟丙-2-酮
[0060]
3-(2,2-二甲基-1,3-二氧戊环-4-亚基)-2-氧代丙酸甲酯
[0061]
3-(2,2-二甲基-1,3-二氧戊环-4-亚基)-2-氧代丙酸乙酯
[0062]
举例来说,可以提及以下式(iii)的化合物:
[0063][0064]
4-氨基-1,1,1-三氟-5-羟基戊-3-烯-2-酮
[0065]
4-氨基-1,1-二氟-5-羟基戊-3-烯-2-酮
[0066]
4-氨基-1,1,1-三氯-5-羟基戊-3-烯-2-酮
[0067]
4-氨基-5-羟基-2-氧代-3-戊烯酸甲酯
[0068]
4-氨基-5-羟基-2-氧代戊-3-烯酸乙酯
[0069]
4-苄基氨基-5-羟基-2-氧代戊-3-烯酸甲酯。
[0070]
在第二反应步骤中,式(iii)的化合物被环化。环闭是在脱水试剂如socl2、pocl3、pcl3、光气、二光气、三光气、clcococl、(cf3co)2、p4o
10
、so2f2、原甲酸三甲酯和原甲酸三乙酯和hcl存在下进行的。优选的脱水试剂是socl2、pocl3、pcl3、光气、二光气、三光气和clcococl。特别优选的脱水试剂是socl2、pocl3、clcococl和光气。
[0071]
使用诸如socl2、pocl3、pcl3、光气、二光气、三光气和clcococl的试剂,可以得到式(i)的化合物,其中r2=h、ch3、苯基、苯基-ch2和(二苯基)ch。所述化合物是以其盐酸的形式形成的。
[0072]
如果通式(i)的化合物以其盐的形式获得,例如以盐酸盐的形式,则无盐形式可以通过用碱,例如三乙胺处理该盐而获得(参见实施例2)。
[0073]
使用如(cf3co)2o的试剂,可得到式(i)的化合物,其中r2=cf3co。
[0074]
式(iii)化合物与环化试剂的摩尔比约为1:0.1至1:5,最好为1:0.5至1:3。
[0075]
反应步骤2通常在0℃至40℃的温度范围内进行,并且任选地在溶剂或稀释剂的存在下进行。该反应优选在大约室温(rt)下在溶剂中进行。
[0076]
优选的溶剂是甲醇、乙醇、异丙醇、丁醇、乙腈、n,n-二甲基乙酰胺、甲苯、氯苯。
[0077]
方法和中间体的说明
实施例
[0078]
本发明通过下面的实施例更详细地阐明,但并不将本发明局限于这些实施例。
[0079]
测量方法
[0080]
产品通过1h nmr光谱和/或lc-ms(液相色谱质谱)进行表征。
[0081]
nmr光谱是使用装有流动探针头(体积60微升)的bruker avance400测定的。在个别情况下,nmr光谱是用bruker avance ii 600测量的。
[0082]
实施例1
[0083]
4-氨基呋喃-2-甲酸甲酯盐酸盐(式(i)的盐)
[0084]
将15.9g(0.1mol)4-氨基-5-羟基-2-氧代戊-3-烯酸甲酯悬浮在50ml甲醇中,将混合物冷却至0℃。在0℃下持续2小时向其中加入17.7g
[0085]
(0.15mol)socl2。混合物在10℃下再搅拌5小时,滤出沉淀物,用5ml甲醇洗涤并干燥。这得到了16.8g,95%的浅米色晶体。
[0086]1h-nmr(400mhz,cdcl3):δ10.07(3h,s,br.);8.10(1h,d);7.32(1h,d);3.83(3h,s)ppm。
[0087]
13
c-nmr 158.0(s);143.6(s);140.2(d);121.8(s);114.5(d);52.3(q)ppm。
[0088]
实施例2
[0089]
将4-氨基呋喃-2-甲酸甲酯盐酸盐(式(i)的盐)转化为4-氨基呋喃-2-甲酸甲酯(式(i)的无盐产物)
[0090]
将9.2g 4-氨基呋喃-2-甲酸甲酯盐酸盐悬浮在50ml乙酸乙酯中,并加入15.7g et3n。混合物在rt搅拌3小时,滤出沉淀物,并且在在真空下将乙酸乙酯充分浓缩。这得到了6.96g,95%的米色晶体,熔点为79-81℃。
[0091]1h-nmr(400mhz,cdcl3):δ:7.24(1h,d);6.8(1h,d);4.3(2h,s);3.75(3h,s)ppm。
[0092]
实施例3
[0093]
4-[(2,2,2-三氟乙酰基)氨基]呋喃-2-甲酸甲酯
[0094]
将1.59g(0.01mol)4-氨基-5-羟基-2-氧代戊-3-烯酸甲酯悬浮在50ml二氯甲烷中,并将混合物冷却到0℃。在0℃下持续2小时向其中加入2ml(cf3co)2o。混合物在10℃下再搅拌5小时,加入20毫升水。混合物在室温(rt)下搅拌5小时,然后分离两相。浓缩有机相。沉淀物与5ml二异丙基醚搅拌并过滤出来。这得到了1mg产物,为米色固体。
[0095]1h-nmr(400mhz,cdcl3):δ11.76(1h,s,br.);8.26(1h,d);7.24(1h,d);3.76(3h,s)ppm。
[0096]
13
c-nmr 158.2(s);154.1(s,q);142.5(s);137.4(d);124.7(s);115.8(s);112.1(d);52.3(q)ppm。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1