用于检测莫能菌素的侧向流测定的制作方法
用于检测莫能菌素的侧向流测定
1.优先权要求
2.本技术要求于2020年12月11日提交的美国临时申请号63/124,551的优先权,其全部公开通过引用并入本文。
3.发明背景
4.莫能菌素(monensin)是与冠醚有关的聚醚类抗生素离子载体,优先与诸如li
+
、na
+
、k
+
、rb
+
、ag
+
和tl
+
的单价阳离子形成络合物。莫能菌素能够在电中性(即非去极化)交换中将这些阳离子转运穿过细胞的脂质膜,作为na
+
/h
+
逆向转运体发挥重要作用。最近的研究已经显示,莫能菌素可以以产生电和电中性两种方式转运钠离子通过细胞膜。这种方法不仅解释母体莫能菌素而且解释其不具备羧基的衍生物的离子载体能力以及因此地抗菌特性。其阻断细胞内蛋白转运,并且展现出抗生素、抗疟疾和其他生物活性。莫能菌素及其衍生物的抗菌特性是它们转运金属阳离子通过细胞和亚细胞膜的能力的结果。
5.莫能菌素广泛地用于动物健康行业,以加药品于牛和家禽的饲料。然而,由于它的离子载体活性,其防止生长中的动物内有害的细菌和原生动物的活动,它也可以对哺乳动物膜具有有害影响。莫能菌素中毒在动物健康加药饲料中得到良好记录,并且要非常小心地以确保莫能菌素含量对于使用加药饲料的动物来说不会太高(参见例如,chalmers(1981)can.vet.j.22:21-22;potter et al.(1984)j.anim.sci.58:1499-1511;gonzalez et al.(2005)can.vet.j.46:910-912)。根据动物的物种、年龄和生产利用(production utilization),莫能菌素的浓度通常在几克/短吨至最多几百克/短吨饲料的范围内利用。例如,奶牛需要与肉牛不同剂量的莫能菌素。类似地,用于雏鸡的起始配给量与用于生长中的肉鸡或蛋鸡的起始配给量非常不同。因此,工业上用于生产加药饲料的饲料厂需要测量饲料中莫能菌素的精确量。此外,当出于不同的生产目的使动物远离莫能菌素时,饲料厂必须注意确保其研磨设备不含莫能菌素,以确保饲料中的莫能菌素不会对动物或动物产品诸如牛奶或鸡蛋的安全产生有害影响。
6.目前用于测量饲料中莫能菌素的一种方法是高效液相色谱法(hplc),其可能成本高、耗时,并且中断饲养程序的安排和劳动力/设备的使用。因此,需要一种快速、可靠、有成本效益且劳动高效的方法来测定饲料中莫能菌素的存在。
7.发明概述
8.本公开提供了用于检测例如动物饲料中的莫能菌素的竞争性侧向流测定(lfa)的方法和装置。本公开的方法和装置提供了用于检测莫能菌素的快速、有成本效益和劳动高效的方法,同时还允许非常灵敏的检测,例如,动物饲料中低至10ppm(或甚至更低)的莫能菌素的检测下限。此外,该方法和装置允许莫能菌素的定量测量以及定性检测,从而允许动物饲料使用者在使用用于调节饲料中莫能菌素水平的lfa方法和装置时具有非常精确的控制。
9.因此,在一方面,本公开涉及用于检测液体样品中的莫能菌素的竞争性侧向流测定(lfa)条装置,该装置包含:
10.样品垫;
20和10%乙醇的磷酸盐缓冲盐水(pbs)。在一个实施方案中,液体提取缓冲液是水性缓冲液,例如具有1%吐温-20的磷酸盐缓冲盐水(pbs)。
31.在一个实施方案中,提取缓冲液与m或c抗体是相容的,或对于允许在液体样品移动穿过测试条时与m或c抗体的结合是最佳的。
32.在一个实施方案中,将动物饲料与提取缓冲液接触20分钟或更少以获得液体样品。在一个实施方案中,将动物饲料与提取缓冲液接触5分钟以获得液体样品。
33.在该方法的一个实施方案中,使用定量读取器(例如,对lfa条装置的测试线处生成的光密度(od)进行定量的读取器)定量地读取lfa条装置。
34.附图简述
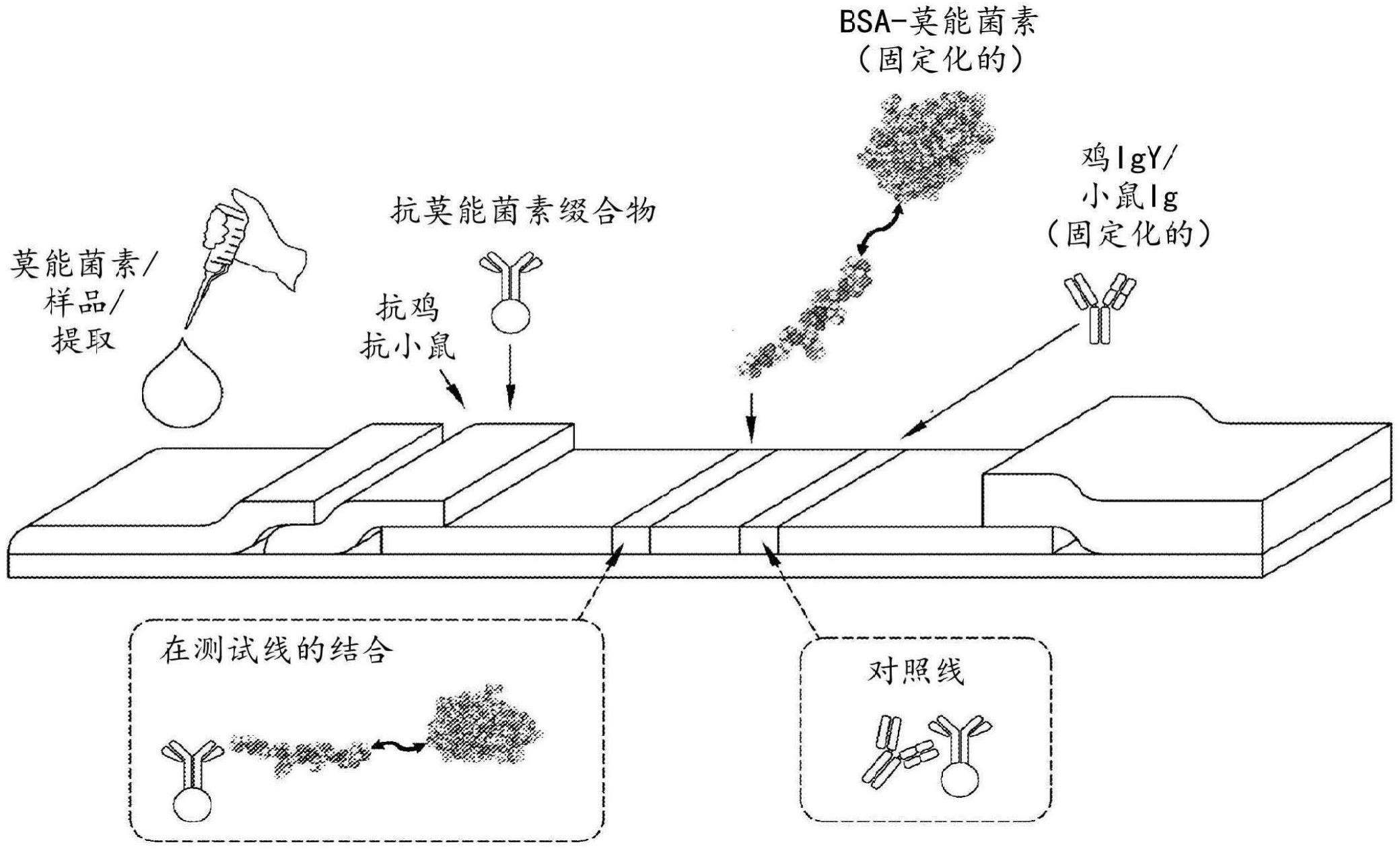
35.图1是用于检测莫能菌素的代表性竞争性lfa条装置的示意图。
36.图2是显示在抑制elisa中检测各种稀释度的未标记的莫能菌素的图。
37.图3是显示抑制elisa的莫能菌素标准曲线的图。
38.图4是显示通过抑制elisa检测乙醇提取的动物饲料中的莫能菌素的图。
39.图5是显示通过抑制elisa检测pbs提取的动物饲料中的莫能菌素的图。
40.图6a-d是加载有30ug/ml(图6a、6b)或40ug/ml(图6c、6d)的抗莫能菌素缀合物并用从含有6g莫能菌素/短吨饲料(图6a、6c)或9g莫能菌素/短吨饲料(图第6b、6d)的饲料提取的样品测试的lfa条的照片。
41.图7是显示使用lfa条检测的莫能菌素水平的图,该lfa条具有含有0、6、9或12克莫能菌素/短吨饲料的饲料样品。对于每种浓度的样品,使用定量od读取器以光密度的单位描述结果。
42.图8a-8b是显示使用lfa条检测的莫能菌素水平的图,该lfa条具有含有0、6、9或12克莫能菌素/短吨饲料的饲料样品,其中将饲料样品提取5分钟(图8a)或20分钟(图8b)。对于每种浓度的样品,使用定量od读取器以光密度的单位描述结果。
43.图9是用从含有0、2、5、10和15ppm莫能菌素的饲料提取的样品测试的lfa条的照片。
44.发明详述
45.本公开提供了用于检测例如动物饲料中的莫能菌素的竞争性侧向流测定(lfa)的方法和装置。图1中示意性地说明lfa条装置的代表性实例。lfa条装置包含样品垫(其上应用有例如从动物饲料提取的液体样品(本文中称为“饲料样品”))、缀合物垫(其加载有用于竞争测定的相关抗体)和膜表面(其具有加载有用于竞争测定的相关抗原的测试线和对照线)。液体样品从样品垫流过缀合物垫,允许液体样品与加载到缀合物垫上的抗体相互作用。液体样品然后进一步流到膜表面上,穿过测试线和对照线,允许液体样品/缀合物混合物与加载到测试线和对照线上的抗原相互作用。
46.lfa基于液体样品中的莫能菌素和固定化在lfa条装置的测试线上的莫能菌素之间对于与加载到缀合物垫上的抗莫能菌素抗体缀合物的结合的竞争。抗莫能菌素特异性抗体(本文称为“m抗体”)缀合至可检测标记物,使得m抗体缀合物与固定化在测试线上的莫能菌素的结合导致可检测信号。因此,m抗体缀合物与液体样品中的莫能菌素的结合减少可用于与膜表面上的测试线处的固定化莫能菌素结合的游离m抗体缀合物的量,导致在测试线处显影的可检测信号的量的随之减少。
47.还将对照抗体缀合物(本文称为“c抗体”)加载到缀合物垫上,并且对照测试线加载有与c抗体结合的抗原。c抗体缀合物与其固定化抗原的结合导致在膜表面上的对照线处的可检测信号。这充当用于液体样品沿着lfa条装置的适当流动的内部对照。此外,可以使用检测和定量可检测信号的lfa条装置读取器读取测试和对照线,从而允许对于测定的定量结果。
48.本公开的各个方面将在以下小节和实施例中进一步详细描述。提供描述以帮助本领域技术人员实践本发明。即使如此,该详细描述不应被解释为不适当地限制本发明,因为本领域普通技术人员可以在不背离本创造性发现的精神或范围的情况下对本文讨论的实施方案进行修改和变化。
49.本技术中引用的所有出版物、专利、专利申请、数据库和其他参考文献通过引用其整体并入本文,就像每个单独的出版物、专利、专利申请、数据库或其他参考文献具体地和单独地表明通过引用并入。
50.lfa条装置
51.本公开的lfa条装置的代表性实例的制备在实施例2中详细描述。
52.该装置的样品垫的材料针对其孔隙度、吸光度、宽度、芯吸和其他特性进行选择,这些特性允许液体样品的应用使得将样品吸收到垫中,同时允许样品从样品垫到缀合物垫的高效流动。在一个实施方案中,样品垫是聚酯纤维垫。在一个实施方案中,样品垫是聚酯等级6614垫(ahlstrom helsinki,finland),其包含聚酯纤维和粘合剂,具有75g/m2的基重、0.42mm的厚度、5s/2cm的芯吸率和57mg/cm2的吸水性,尽管具有可比特性的垫也是合适的。测试中使用的饲料样品的体积使得根据样品垫的吸水和吸水特性,它将允许液体从样品垫流到缀合物垫(通常是x ul到x ul的饲料样品)。样品垫放置在装置中,使得其与缀合物垫进行物理接触,使得应用于样品垫的液体可以经由物理接触的接合流入缀合物垫中。样品垫也放置于装置中,使得其不与膜表面进行直接物理接触;更确切地说,缀合物垫放置在样品垫和膜表面之间。
53.放置该装置的缀合物垫以与样品垫物理接触,使得应用于样品垫的液体可以经由物理接触的接合流入缀合物垫中。还放置缀合物垫以与膜表面进行物理接触,使得来自缀合物垫的液体经由物理接触的接合流到膜表面上。缀合物垫的材料还针对其孔隙度、吸光度、宽度、芯吸和其他特性进行选择,以允许液体样品从样品垫流入,以及液体样品流出到膜表面上。在一个实施方案中,缀合物垫是玻璃垫。在一个实施方案中,缀合物垫是短切玻璃垫。在一个实施方案中,缀合物垫是微纤维玻璃垫。在一个实施方案中,缀合物垫是玻璃等级8951垫(ahlstrom helsinki,finland),其包含短切玻璃和粘合剂,具有75g/m2的基重、0.38mm的厚度、5s/2cm的芯吸率和63mg/cm2的吸水性,尽管具有可比特性的垫也是合适的。
54.放置该装置的膜表面以与缀合物垫物理接触,使得来自缀合物垫的液体经由物理接触的接合流到膜表面上,并穿过所述膜表面上的测试和控制线。还将膜表面放置于装置中,使得其不与样品垫进行直接物理接触;更确切地说,将缀合物垫放置于样品垫和膜表面之间。膜表面的材料针对其加载在测试线和对照线处固定化的抗原的能力,以及其孔隙度、吸光度、芯吸性和与液体样品穿过其的流动有关的其他特性进行选择。在一个实施方案中,膜表面包含硝化纤维素膜。在一个实施方案中,膜表面是25mm cn95硝化纤维素膜
(sartorius,germany),尽管具有可比特性的膜也是合适的。
55.如实施例2所述,样品垫、缀合物垫和膜表面可以与另外的背衬和/或芯吸垫或膜组装,以对lfa条装置提供结构和稳定性。此外,lfa条装置可以组装到外壳(例如,塑料外壳)中,诸如卡或棒(量油尺(dipstick)),其允许将液体样品(例如,使用移液管或滴管)应用于样品垫上或将装置浸入液体样品中,使得液体样品与样品垫接触。
56.缀合物垫加载有抗莫能菌素(m)抗体和对照(c)抗体的混合物,其中每一种均可检测地标记。通常,m抗体缀合物包含90-95%的应用的抗体混合物,并且c抗体缀合物包含5-10%的应用的混合物。
57.可以调节加载到缀合物垫上的m抗体的浓度,以调节检测液体样品中莫能菌素的灵敏度。在各种实施方案中,加载到缀合物垫上的m抗体的浓度为20-160ug/ml、20-120ug/ml、20-80ug/ml、20-60ug/ml或25-50ug/ml。在一个实施方案中,加载到缀合物垫上的m抗体的浓度为30-40ug/ml。在一个实施方案中,加载到缀合物垫上的m抗体的浓度为30ug/ml。如实施例3中所述,以30ug/ml的浓度加载到缀合物垫上的m抗体足以有效地检测液体饲料样品中的莫能菌素,下至低至2ppm(2gm/短吨)的检测水平。在各种实施方案中,检测水平低至10ppm、9ppm、8ppm、7ppm、6ppm、5ppm、4ppm、3ppm或2ppm。
58.m抗体特异性结合至莫能菌素(本领域也称为莫能菌素a,cas 17090-79-8)。如本文所用,对莫能菌素具有“特异性”结合的抗体包括与莫能菌素衍生物结合的抗体,该衍生物共享与抗体在莫能菌素上结合的表位相同的表位。在一个实施方案中,m抗体是单克隆抗体(mab)。在一个实施方案中,m抗体不是多克隆抗莫能菌素抗体制剂。在一个实施方案中,m抗体是结合莫能菌素的单克隆抗体(mab),并且还可以结合共享与mab结合的表位的莫能菌素衍生物。合适的m抗体的非限制性实例是市售的小鼠抗莫能菌素mab(creative diagnostics,目录号hmabpy056,本文称为mab hmabpy056),尽管具有类似结合特性(例如,与hmabpy056交叉竞争结合莫能菌素)的其他mab也适合使用。因此,在一个实施方案中,m抗体是mab hmabpy056。在另一个实施方案中,m抗体是与hmabpy056交叉竞争与莫能菌素的结合的抗莫能菌素特异性mab。
59.c抗体是结合对照抗原并且不与莫能菌素交叉反应的抗体,优选单克隆抗体(mab)。合适的c抗体的非限制性实例是市售的山羊抗鸡igy mab(lampire,目录号7455207),用于与鸡igy对照抗原一起使用,尽管结合其他对照抗原的其他mab也是合适的。与c抗体结合的鸡igy抗原也是市售的(lampire,目录号9401400)。在其他实施方案中,c抗体是抗小鼠igg mab,用于与小鼠igg对照抗原一起使用。
60.用作m和c抗体的抗体通常储存在无菌条件下(例如,无菌盐水),并且具有允许它们在本公开的lfa装置和方法中的使用中的一致性的纯度。例如,在各种实施方案中,m和/或c抗体是单克隆抗体,其相对于制剂中存在的其他蛋白质具有至少90%的纯度,并且更优选至少95%或更大的纯度。
61.m抗体和c抗体各自用可检测标记物标记,通常用相同的可检测标记物标记。当缀合的抗体在测试或对照线处结合至其抗原时,可检测标记物允许测试线和/或对照线的目视检测。在一个实施方案中,可检测标记物包含金纳米颗粒。例如,可以使用市售的bioready金纳米壳(nanocomposix,目录号gsxr150-100m)将抗体缀合至金纳米颗粒,如实施例2中所述。虽然基于胶体金的可检测标记物(例如,金纳米颗粒)对于易于使用和检测是
优选的,但适于在侧向流测定中使用的其他可检测标记物在本领域中是已知的,并且可以用于本公开的lfa方法和装置中,其非限制性实例包含时间分辨荧光纳米珠、荧光亚微球和量子点(参见例如,hu et al.(2017)biosensors and bioelectronics,91:95-103)。
62.表面膜的测试线加载有作为抗原的莫能菌素,使得莫能菌素固定化在(即附着于)测试线处。通常,莫能菌素与载体蛋白连接以促进测试线处的固定化。在一个实施方案中,载体蛋白是白蛋白,形成莫能菌素-白蛋白缀合物作为测试线处使用的抗原。可以用作载体蛋白的合适的白蛋白的非限制性实例包括血清白蛋白(例如,牛血清白蛋白(bsa)或人血清白蛋白(hsa))、卵白蛋白、α乳白蛋白或伴白蛋白。在一个实施方案中,莫能菌素抗原是bsa-莫能菌素。具有已知纯度和使用一致性的合适的bsa-莫能菌素试剂是市售的(creative diagnostics,目录号daga-050b)。
63.类似地,表面膜的对照线加载有与c抗体结合的抗原,使得对照抗原固定化在(即附着于)对照线处。当使用抗鸡igy作为c抗体时,合适的鸡igy抗原试剂是市售的(lampire,目录号9401400)。在其他实施方案中,c抗体是抗小鼠igg,并且对照抗原是小鼠igg。合适的试剂在本领域中是市售的。
64.实施例2中详细描述了分别在测试线和对照线处加载莫能菌素抗原和对照抗原,从而将它们在那些线上固定化。优选地,使用气溶胶分配器(aerosol dispenser)诸如biodot airjet
tm nanoliter aerosol dispenser或等同物,以将测试和对照线“条纹化(stripe)”到膜表面上,例如使用实施例2中所阐述的参数。
65.液体样品制备
66.为了使用本公开的lfa方法和装置检测莫能菌素,莫能菌素必须在可以应用于lfa条装置的样品垫的液体样品中。因此,对于固体动物饲料,必须使用液体提取缓冲液进行液体提取。在实施例1-3中进一步描述了从动物饲料中制备液体样品和对其有用的提取缓冲液。
67.液体提取缓冲液可以是水性缓冲液、有机溶剂缓冲液或结合水性和有机溶剂的缓冲液。由于莫能菌素更易溶于有机溶剂中,为了最高效的提取,使用包含有机溶剂的提取缓冲液可能是优选的。或者,为了便于使用,水性提取缓冲液(即,缺乏任何有机溶剂)可能是优选的。在一个实施方案中,提取缓冲液包含醇,其非限制性实例包括甲醇、乙醇、丁醇和异丙醇。在一个实施方案中,提取缓冲液包含乙醇,通常以至少10%的浓度。提取缓冲液可以包含包括缓冲剂和表面活性剂的其他组分。在一个实施方案中,提取缓冲液包含具有0.5%吐温-20和10%乙醇的磷酸盐缓冲盐水(pbs)。在一个实施方案中,提取缓冲液是具有1%吐温-20的磷酸盐缓冲盐水(pbs)。
68.液体样品可以从怀疑含有莫能菌素的任何类型的动物饲料中制备,包括牛、家禽和马饲料。通常,将动物饲料的等分试样(例如,5克)与液体提取缓冲液的等分试样(例如,30ml,或以大致等同的比率)组合,可以允许混合物浸泡(例如,浸泡达特定的时间),然后涡旋并允许沉降。提取时间通常为5-20分钟。如实施例3所示,使用具有0.5%吐温-20和10%乙醇的pbs提取缓冲液的5分钟的提取时间足以允许检测液体饲料样品中的莫能菌素,下至约6ppm的较低检测水平。
69.检测莫能菌素的方法
70.lfa条装置和液体样品(例如,液体饲料样品)用于本公开的用于检测莫能菌素的
方法中,该方法是通过将液体样品应用于lfa条装置的样品垫,从而允许液体样品流入缀合物垫并沿着膜表面流动(从而穿过测试和对照线),将lfa条显影至少3分钟(例如,5-10分钟),并目视读取或定量测量lfa条装置(即,测试和对照线处的可检测信号),从而检测液体样品中莫能菌素的存在。如实施例中5所示,三分钟的显影时间对于lfa条装置的准确读取是足够的,尽管也可以准确地使用更长的显影时间。
71.可以通过将液体滴到垫上(例如,使用移液管或滴管)或通过将lfa条装置(例如,量油尺)浸入液体样品中使得液体与装置的样品垫接触,将液体样品应用于样品垫上。通常,其需要80-100ul(例如,80ul)的饲料样品,以充分流穿样品垫进入缀合物垫和样品以进行目视或定量读取。
72.相对于缺乏任何莫能菌素的液体样品,测试饲料样品中莫能菌素的存在导致测试线处可检测信号的强度的减少。lfa条装置的测试线可以定性读取(例如,通过目视检查)或定量读取(例如,通过在定量读取器中读取)。例如,测试动物饲料样品的测试线的强度可以与由已知不含莫能菌素(0ppm)的样品和/或已知含有已知量的莫能菌素(例如,10ppm或更大)的样品所展现的强度进行比较。如本文所述,由于测定是竞争性lfa,因此随着样品中莫能菌素浓度的增加,测试线处的可检测信号减少。在一个实施方案中,对照lfa条装置可以与具有已知量的莫能菌素的样品一起使用,其中对照lfa条装置与测试动物饲料样品平行运行。另外或替代地,可以将用于测试动物饲料样品的测试线的强度与标准化测试线强度进行比较,该标准化测试线强度指示例如无莫能菌素存在和/或已知特定量的莫能菌素存在。对于特定量的莫能菌素的此类标准化测试线强度可以与lfa条装置一起提供,用于目视比较的目的,例如,代表装置的最终用户与测试饲料样品显影的强度进行比较的特定量的莫能菌素的强度水平的图片。
73.本公开的lfa条装置对于检测莫能菌素是高度灵敏的,具有检测下至约2ppm的下限的莫能菌素的能力(参见实施例3)。检测下限(灵敏度)可以以百万分率(parts per million,ppm)表示,其中1ppm等于每100万克(1000kg)动物饲料有1克莫能菌素。检测下限(灵敏度)也可以以克莫能菌素/短吨动物饲料(gm/短吨)表示。由于1000kg中有2204磅,而每短吨有2000磅,因此10ppm对应9gm/短吨。类似地,12gm/短吨对应13.2ppm,6gm/短吨对应6.6ppm,并且3gm/短吨对应3.3ppm。如实施例3所述和图9所示,本发明的lfa条装置和方法可以检测液体样品中的莫能菌素,下至低至约6ppm(6gm莫能菌素/短吨动物饲料)并且甚至低至2ppm的浓度。在各种实施方案中,lfa条装置和方法对于检测莫能菌素具有6-10ppm、6.6-10ppm或6-9gm/短吨饲料的灵敏度下限。在各种实施方案中,lfa条装置和方法对于检测莫能菌素具有2ppm、3ppm、4ppm、5ppm、6ppm、6.6ppm、7ppm、8ppm、9ppm或10ppm的灵敏度下限。在各种实施方案中,lfa条装置和方法对于检测莫能菌素具有2gm/短吨、3gm/短吨、4gm/短吨、5gm/短吨、6gm/短吨、7gm/短吨、8gm/短吨、9gm/短吨、10gm/短吨、11gm/短吨或12gm/短吨的灵敏度下限。
74.对于定量结果,lfa条装置可以在检测和定量所用可检测标记物(例如,金纳米颗粒)的侧向流测定读取器中读取,例如通过测量测试线处的光密度(od)使用。此类lfa读取器是市售的,其非限制性实例包括leelu
tm
读取器(lumos diagnostics;sarasota,fl),以及由genprime(spokane,wa),abingdon health(york,uk)和now diagnostics(springdale,ar)的lfa读取器系统。
实施例
75.以下实施例旨在提供本发明的应用的说明。以下实施例不旨在完全定义或以其他方式限制本发明的范围。
76.实施例1:通过elisa检测饲料样品中的莫能菌素
77.在本实施例中,进行了预备性研究以确定是否可以在抑制elisa测定中使用抗莫能菌素抗体检测动物饲料中的莫能菌素。简言之,在抑制elisa测定中,通过信号干扰检测莫能菌素的浓度。将捕获抗体(绵羊抗莫能菌素)包被到elisa板上。在温育期间,将已知量的标记的莫能菌素与含有未标记的莫能菌素(如果存在)的测试样品或标准品的稀释物组合。将这些标记的/未标记的莫能菌素混合物添加到包被的封闭板中。标记的莫能菌素和未标记的测试样品/标准品莫能菌素竞争与捕获抗体的结合。这意味着混合物中的未标记莫能菌素越多,能够与捕获抗体结合的标记的莫能菌素就越少。温育后,清洗板,并添加底物。底物在标记物(辣根过氧化物酶[hrp]酶)的存在下改变颜色。较高水平的标记的莫能菌素存在导致较大的颜色改变,表明测试样品中较低水平的未标记的莫能菌素。较低水平的标记的莫能菌素导致较低的颜色改变量(信号抑制),表明测试样品中较高水平的未标记的莫能菌素。
[0078]
抗体和抗原稀释度的测定
[0079]
运行初始测定以确定导致将允许检测未标记的莫能菌素的信号(颜色变化)所需的绵羊抗莫能菌素抗体(fitzgerald industries,目录号20-1215,批号p17122113)和hrp标记的莫能菌素(fitzgerald industries,目录号80-1221,批号c19120303)的适当水平。稀释分析的结果显示于表1中:
[0080]
表1:捕获抗体和标记的抗原稀释度的确定
[0081][0082]
*m=标记的莫能菌素稀释度
[0083]
结果表明,1:1000的捕获抗体稀释度和1:200的标记的莫能菌素稀释度是适当的,具有约1.5的o.d.读数(以粗体显示)。
[0084]
未标记莫能菌素的检测
[0085]
确定的条件用于评估检测未标记的莫能菌素(invitrogen,目录号00-455-51)的测定的适用性。对于该评估,以1:1000稀释用绵羊抗莫能菌素包被板。将标记的莫能菌素(1:200最终稀释)和未标记的莫能菌素(各种浓度)的混合物组合。清洗并封闭包被板后,将标记的/未标记的莫能菌素的混合物添加至板孔。温育和清洗后,添加hrp底物。停止反应后,读取板的颜色显影。结果如图2所示。由于这是抑制elisa,信号的缺乏表明存在高水平的莫能菌素;较高的信号表明存在较低水平的莫能菌素。结果表明,在这些条件下,莫能菌
素可以在约为0.5-50ng/ml的范围内定量。
[0086]
用莫能菌素标准曲线完成第二次测定,以更精确地确定可检测的莫能菌素范围。结果如图3所示。结果证实0.781
–
50ng/ml的莫能菌素的范围。
[0087]
饲料提取物制备
[0088]
通过将1g的饲料(具有或不具有莫能菌素)的等分试样与5ml乙醇或磷酸盐缓冲盐水(pbs)组合来制备饲料提取物。将样品剧烈涡旋并在室温下温育,直到饲料沉降。从每个样品中除去液体,并以约13,000x g离心10分钟,以沉淀碎片。将澄清的提取物用作抑制elisa中的测试样品。
[0089]
饲料提取物中莫能菌素的检测
[0090]
在如上所述的抑制elisa中评估如上所述制备的饲料提取物。将澄清提取物的稀释物与已知标准量的标记的莫能菌素组合。作为对照,以与提取物相同的稀释度测试单独的乙醇或单独的pbs。使用莫能菌素标准曲线,测定每种提取物中莫能菌素的浓度。结果如图4和图5(分别对于乙醇和水性提取物)所示,并汇总在下表2中:
[0091]
表2:饲料提取物中莫能菌素的检测
[0092]
样品检测到的莫能菌素的量(ng/ml)具有莫能菌素的饲料,乙醇提取3764.9不具有莫能菌素的饲料,乙醇提取215.4仅乙醇未检测到具有莫能菌素的饲料,pbs提取164.8不具有莫能菌素的饲料,pbs提取19.0仅pbs未检测到
[0093]
结果显示,在所有提取样品中检测到莫能菌素,但相比于pbs,使用乙醇似乎更高效地从饲料中提取。这正如预期的,因为莫能菌素在有机溶剂中比在水性溶液中更易溶。竞争性elisa测定的结果证明了抗体对莫能菌素的特异性,并定义了可以在竞争性类型的测定中实现并潜在地可以转化为侧向流方法的莫能菌素检测的限度。
[0094]
实施例2:通过侧向流测定法检测饲料样品中的莫能菌素
[0095]
在该实施例中,开发了用于检测饲料样品中的莫能菌素的定量竞争性侧向测定(lfa)。lfa装置在图1中示意性地说明。简言之,将包含缀合至金纳米颗粒的抗莫能菌素抗体的缀合物抗体制剂加载到lfa装置的缀合物垫上。少量的对照抗体(抗鸡igy)也包含在加载到缀合物垫上的混合物中。当提取的饲料样品应用于装置的样品垫时,样品与抗莫能菌素缀合物混合,并且样品/缀合物混合物迁移并穿过lfa装置的测试线。测试线具有固定化在其上的bsa-莫能菌素,因此具有游离结合位点的任何抗莫能菌素缀合物(即,未与饲料样品中的莫能菌素结合的)由测试线捕获,形成目视可观察的线。随着样品中更多的莫能菌素竞争与抗莫能菌素缀合物的结合,更少的缀合物自由结合测试线上的bsa-莫能菌素。因此,如果饲料样品中不存在莫能菌素(或水平低于检测),则在其最高强度下目视观察到测试线。然而,如果饲料样品中存在莫能菌素(以高于检测限的水平),则其抑制缀合物与测试线上的bsa-莫能菌素的结合,因此测试线的强度减弱,与样品中莫能菌素的量成比例。还存在对照线,其加载有与对照抗体(抗鸡igy)结合的抗原(鸡igy),从而充当该装置的阳性对照。
[0096]
缀合物垫制备
[0097]
将市售的短切玻璃垫(ahlstrom-munksjo;grade 8951),切成10mm x300mm的条,用于缀合物垫。在室温将2ml的缀合物垫处理缓冲液(pbs,0.5%bsa,0.5%吐温-20,ph7.4)应用于每个缀合物垫,并允许在室温浸泡30分钟。将处理的缀合物垫在37℃烘箱中的干燥盘上干燥2小时。干燥后,将缀合物垫与干燥剂一起储存直至使用。
[0098]
测试和控制线的条纹化
[0099]
将市售的cn95硝化纤维素膜,25mm,(sartorius;1un95er100025nt)和市售的背衬卡(backing card),73.5mm(lohmaann;gl-57312)用于加载有测试和对照线的lfa装置的部分。从背衬卡除去中心内衬和膜,并将cn95膜层压到背衬卡上。内衬用于将cn95膜平滑到背衬卡上,以确保适当的粘附。
[0100]
对于检测线和对照线,分别使用莫能菌素-bsa缀合物(creative diagnostics;daga-050b)和山羊抗鸡igy(lampire;7455207)。在1 x pbs,0.5%蔗糖,ph 7.4中,将莫能菌素-bsa稀释至2mg/ml并且将抗鸡igy稀释至0.5mg/ml。将测试线(tl)放置于膜的中心,将控制线(cl)放置在相对于应用于样品垫的液体样品的流动方向的tl下游5mm处(即,将cl相对于tl放置,使得液体样品首先流过tl,然后流过cl)。
[0101]
根据下表3中所示的模式设置,使用biodot airjet
tm
纳升气溶胶分配器将测试和对照线“条纹化”到膜上:
[0102]
表3:用于测试线和对照线条纹化的biodot模式设置
[0103][0104][0105]
tl和cl在膜上条纹化后,将它们在37℃烘箱中干燥1小时。干燥后,将膜与干燥剂一起储存直至使用。
[0106]
金纳米壳缀合规程
[0107]
使用bioready金纳米壳(gns),羧基,120nm颗粒(nanocomposix;gsxr150-100m)将抗莫能菌素检测器抗体(creative diagnostics;hmabpy056)缀合至金纳米颗粒。
[0108]
为制作gns的储备制剂,将珠在旋转器上混合5-10分钟,水浴声处理5秒并涡旋达5秒两次。将珠等分至1ml x 1管的最终体积。
[0109]
为了激活,新鲜制备edc(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐;thermoscientific;目录号22980)和磺基-nhs(n-羟基磺基琥珀酰亚胺;thermoscientific;目录号24510)的溶液并在制备的10分钟内使用。用去离子水将edc和磺基-nhs溶液制成10mg/ml。
[0110]
将8ul edc添加到gns颗粒的等分试样中并短暂涡旋。立即将16ul磺基-nhs添加到(添加edc的)gns的等分试样中,短暂涡旋并返回到旋转器。当所有的管都被激活时,将每个管进行声处理并涡旋,管在室温旋转30分钟,水浴声处理5秒并涡旋达5秒两次。然后将珠在20℃以2000g离心7分钟,吸出上清液并将1ml的1x反应缓冲液(0.01pbs,0.5%peg,ph 7.4)添加到激活的gns颗粒的每个沉淀物,然后水浴声处理5秒并涡旋达5秒两次。
[0111]
对于抗体偶联,将40ug/ml的储备抗体添加到每管的激活珠,水浴声处理5秒并涡旋两次,每次5秒。将混合物在室温旋转30分钟,水浴声处理5秒并涡旋达5秒两次。为了淬灭偶联反应,向每个管添加5ul的50%乙醇胺(在去离子水中),水浴声处理5秒并涡旋达5秒两次。将管在室温旋转10分钟,并将珠在20℃以2000g离心7分钟。吸出上清液,并将珠重悬于1ml 1x反应缓冲液中,水浴声处理5秒并涡旋达5秒两次。再次将珠在20℃以2000g离心7分钟,吸出上清液,将珠重悬于1ml 1x反应缓冲液中,声处理5秒并涡旋两次达5秒每次。
[0112]
为了最终的重悬和吸光度的测量,再次将珠在20℃以2000g离心7分钟,吸出上清液,将珠重悬于0.5ml缀合物稀释物(0.5x pbs,1%bsa,1%吐温-20,0.05% proclin300,ph8.0)中,水浴声处理5秒并涡旋达5秒两次。根据gns制造商的说明,在495ul缀合物稀释剂中的5ul缀合物,在峰波长处测量吸光度(od)(通常为810-830nm)。将缀合的抗莫能菌素抗体储存于4℃直至使用。
[0113]
缀合物喷洒
[0114]
用抗莫能菌素缀合物制剂喷洒如上所述制备的缀合物垫。该制剂还用少量(5-10%)对照山羊抗鸡igy抗体(lampire;9401400)加标(spiked)。首先将缀合物制剂水浴声处理5秒,并涡旋达5秒三次。将蔗糖和海藻糖分别以10%和5%添加到制剂中,并将混合物涡旋直到糖溶解。将制剂再次水浴声处理5秒,并涡旋达5秒三次。
[0115]
根据下表4中所示的模式设置,使用biodot airjet
tm
纳升气溶胶分配器将抗莫能菌素缀合物制剂(包含对照抗体)喷洒到制备的缀合物垫上:
[0116]
表4:用于将缀合物制剂喷洒到缀合物垫上的biodot模式
[0117]
[0118][0119]
在喷洒缀合物垫后,将它们在37℃烘箱中干燥1小时。干燥后,将缀合物垫与干燥剂一起储存直至使用。
[0120]
lfa条制备和组装
[0121]
将吸收剂/芯垫(whatman;等级470;18mm)切成18mm的条。将顶部内衬从背衬卡(lohmann;gl-57312;73.5mm)去除,并且将whatman 470芯垫层压,与背衬卡的顶部边缘齐平。使用内衬将芯垫平滑到背垫上,以确保适当的粘附。
[0122]
为了将缀合物垫和样品垫固定到条上,将底部的2个内衬从背衬卡除去。将10mm ahlstrom 8951缀合物垫层压,与膜底部重叠2mm。使用内衬将缀合物垫平滑到背衬卡,以确保适当的粘附。将16mm ahlstrom 6614样品垫层压,与卡的底部齐平。使用运动(kinematic)切割器将组装的卡切割成4mm的条。将组装的lfa条与干燥剂一起储存直至使用。
[0123]
样本提取和lfa方案
[0124]
将0.5克饲料样品称入5ml管中,并添加2ml提取缓冲液(具有0.5%吐温-20和10%乙醇的pbs)。将混合物涡旋5秒并静置5分钟。在将样品提取物应用于lfa条之前,通常在1/20
–
1/50的范围内将样品提取物稀释。
[0125]
将lfa条置于平坦表面上,并将100ul饲料样品应用于条的样品垫。10-15分钟后,在leelu读取器(lumos diagnostics)中读取条。或者,可以将饲料样品置于管或孔中,并且可以将lfa条用作量油尺以使样品垫与进料样品接触。
[0126]
实施例3:莫能菌素侧向流测定的剂量响应性
[0127]
在该实施例中,用于检测莫能菌素的lfa条与含有各种已知量的莫能菌素的饲料样品一起使用,以检查测定的剂量响应性和饲料提取的时间依赖性。
[0128]
如实施例2所述制备lfa条,具有以下试剂浓度。对于测试线(tl),按照实施例2,以1.25mg/ml的浓度(0.7ul/cm)应用1x pbs,1%蔗糖中的莫能菌素-bsa(creative diagnostics)。对于对照线(cl),使用0.5mg/ml的鸡igy。对于抗莫能菌素抗体(creative diagnostics),按照实施例2,将gns稀释剂(0.5xpbs,1% bsa,1%tw-20,0.05% proclin300,ph8.0)中的抗体-gns缀合物以30ug/ml或40ug/ml的浓度喷洒到缀合物垫
(10ul/cm)上,本文分别称为load 30和load 40。应用于缀合物垫的缀合物制剂还包含10%抗鸡igy作为阳性对照。
[0129]
在第一组实验中,已知含有6g/短吨(6ppm)或9g/短吨(9ppm)的莫能菌素的饲料样品(如实施例2所述制备)用lfa条进行测试,该lfa条用30ug/ml(load 30)或40ug/ml(load 40)的抗莫能菌素缀合物制备。每种组合(即6或9克/短吨的load 30和6或9克/短吨的load 40)一式三份测试以进行所比较的总共12个lfa条。结果如图6a-d所示。结果显示,对于6g/短吨样品,使用load 30浓度的信号比load 40浓度更强,而对于9g/短吨样品,用两种浓度的信号大致相等。因此,load 30浓度用于随后的测定。
[0130]
在第二组实验中,用0、6、9或12克/短吨莫能菌素加标的饲料样品用load 30lfa条测试,并使用leelu读取器定量来自测试线的信号的强度,如实施例2中所述。结果如图7所示,其表明样品中莫能菌素的量渐增导致测试线信号的强度渐减,如对于竞争性侧向流测定所预期的。此外,lfa条以剂量响应的方式检测到莫能菌素,显示条足够灵敏以在饲料样品中6、9或12克/短吨的莫能菌素之间区分。
[0131]
在第三组实验中,用0、6、9或12克/短吨莫能菌素加标的饲料样品再次用load 30的lfa条测试,但将提取5分钟的样品与提取20分钟的样品进行比较。结果如图8a(5分钟)和图8b(20分钟)所示。结果表明,无论提取样品5分钟还是20分钟,测试线信号都是一致的。因此,结果表明,5分钟的提取对于使用侧向流测定准确检测饲料样品中的莫能菌素是足够的。
[0132]
在第四组实验中,用0、2、5和10ppm莫能菌素加标的饲料样品一式两份进行测试。结果如图9所示,其表明样品中莫能菌素的量渐增导致测试线信号的强度渐减,如对于竞争性侧向流测定所预期的。因此,结果表明条足够灵敏以在饲料样品中0、2、5和10ppm的莫能菌素之间区分。
[0133]
总之,这些实验证明成功使用lfa条定性和定量地检测饲料样品中的莫能菌素。此外,结果表明,30ug/ml的抗莫能菌素缀合物浓度和5分钟的饲料样品提取时间足以允许以高度灵敏度(下至约6ppm)检测莫能菌素。此外,结果表明,lfa条能够定量地区分含有0、2、5、6、9或12g/短吨(约0-12ppm)莫能菌素的样品。
[0134]
实施例4:分析和交叉反应性研究
[0135]
在该实施例中,进行分析和交叉反应性研究以确定能否通过莫能菌素侧向流测定检测除莫能菌素之外的各种离子载体、抗生素和饲料添加剂。通过将莫能菌素-阴性饲料样品与高浓度的测试物质组合来制备样品。然后根据实施例2和3中所述的测试方法提取并测定这些样品。结果如下表5所示:
[0136]
表5:分析&交叉反应性结果
[0137][0138]
结果表明,莫能菌素侧向流测定未检测到饲料样品中浓度高达上表5所列的甲基盐霉素(nar)、盐霉素(sal)、泰乐菌素(tyl)、莱克多巴胺(rac)或氨丙啉(amp),因此证实该测定缺乏交叉反应性。
[0139]
实施例5:得到结果的时间(time to result)研究
[0140]
在该实施例中,进行得到结果的时间研究以确定读取测试装置多于或少于5分钟对测试结果的影响。提取含有莫能菌素的样品,并根据实施例2和3中所述的测试方法进行测定,在3分钟、5分钟或7分钟读取测试装置。结果如下表6所示:
[0141]
表6:得到结果的时间的结果
[0142][0143]
结果表明,莫能菌素侧向流测定在所有三个测试的读取时间都是准确的,表明虽然5分钟读取时间是典型的,但该测试在较短和较长的读取时间都是准确的。
[0144]
实施例6:再现性和可重复性研究
[0145]
在该实施例中,进行研究以通过评估高阴性和低阳性样品的多个重复间的目视解释结果来确定莫能菌素侧向流测定的再现性。测试由两名不同的操作者在三天间进行,分为上午和下午运行。
[0146]
再现性定义为在测试期间在相同条件下由同一人观察到的解释结果的变化。再现性结果如下表7所示:
[0147]
表7:再现性结果
[0148][0149]
表7中的结果证明莫能菌素侧向流测定是可再现的。
[0150]
可重复性定义为整个研究在多个操作者、测试天数和测试时间之间的变化。可重复性结果如下表8所示,报告了对于操作者1&2在多个天数和时间点间的结果,以及第1、2和3天在多个操作者间的结果:
[0151]
表8:可重复性结果
[0152][0153]
表8中的结果证明莫能菌素侧向流测定是可重复的。
[0154]
实施例7:样品重量研究
[0155]
在该实施例中,进行研究以确定样品称重步骤的变化可以如何影响莫能菌素侧向流测定结果。各自提取具有三种不同的样品重量(4.0克、5.0克或6.0克的饲料)的高阴性和低阳性样品。除样品称重步骤以外的测定步骤根据实施例2和3中所述的方法进行。结果如下表9所示:
[0156]
表9:样品重量结果
[0157][0158]
结果证明莫能菌素侧向流测定在所有三种测试的样品重量下都是准确的,表明虽然5克的样品饲料作为样品重量是典型的,但该测试在较低和较高样品重量下也是准确的。
[0159]
实施例8:样品混合时间研究
[0160]
在该实施例中,进行研究以确定样品混合步骤的持续时间的变化可以如何影响莫能菌素侧向流测定结果。使用五种不同的样品混合时间(0秒、5秒、10秒、20秒和60秒)各自制备高阴性和低阳性样品。除样品混合时间以外的测定步骤根据实施例2和3中所述的方法进行。结果如下表10所示:
[0161]
表10:样品混合时间结果
[0162][0163]
表10中的结果证明莫能菌素侧向流测定在所有五种测试的样品混合时间都是准确的,表明虽然10秒的样品混合时间是典型的,但使用更短和更长的样品混合时间的该测试也是准确的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1