供治疗ILD、PF-ILD和IPF之用的病毒载体和核酸的制作方法
由于与ipf和其他纤维性ilds的发病机理有关的过多途径,目的在于同时调节各种疾病机制的多靶疗法很可能是最有效的。然而,使用小分子化合物(nces)或生物制品(nbes)如例如单克隆抗体的经典药理学策略难以执行相应的方法,这是因为这两种方式一般被设计用于特异性抑制或激活单一药物靶或一小组密切相关的分子。为了使得pf-ilds的多靶疗法成为可能,微小rnas(mirnas)基于它们在生理和病理生理条件下通过调节特定组的靶基因的mrna表达水平来控制和微调整个信号传导途径或细胞机制的能力代表了一种新颖且非常有吸引力的靶类别。mirnas是小的非编码rnas,其被转录为前体分子(pri-mirnas)。在细胞核内,pri-mirnas经历第一成熟步骤以产生所谓的pre-mirnas,其特征在于较小的发夹结构。核输出后,pre-mirnas经历由切酶酶介导的第二加工步骤,从而产生两条长度约为22个核苷酸的完全成熟的mirnas单链。为了发挥其基因调节功能,成熟的mirnas被并入rna诱导性沉默复合物(risc)中,以使得能够与位于靶mrnas的3'-utr内的mirna结合位点结合。结合时,mirnas诱导靶mrnas的去稳定和切割和/或通过抑制相应mrnas的蛋白质翻译来调节基因表达。迄今为止,已在人中发现了不止2000种mirnas,其可能调节最多到30%的转录物组(hammond sm,2015)。本发明公开了与纤维性肺部疾病发病机理有关的mirnas的鉴定以及通过在ild患者,优选pf-ild患者,特别是ipf患者中使用病毒载体,特别是腺伴随病毒(aav)的各mirnas的功能调节来治疗肺部疾病如pf-ild的方法。本发明集中于人的治疗,尽管任何种类的哺乳动物,尤其是伴侣动物哺乳动物,例如马、狗和猫也在本发明的范围内。
背景技术:
1、术语间质性肺病(ild)包括超过200种肺病症的大且异质的组,其大部分分类为罕见的。ilds的主要异常是远侧肺实质的破坏,从而导致受损的气体交换和限制性通气缺陷。人们普遍认为,肺泡上皮细胞的某种形式的损伤起始与修复机制偶联的炎症反应。损伤修复过程在病理学上反映为炎症、纤维化或两者的组合。不论作为基础的病理生理学如何,由此产生的间质间隙改变都导致诸如呼吸困难和咳嗽的临床症状,并导致肺功能测试时的限制性通气和气体交换缺陷(schwartz mi等人,2011)。ilds没有普遍接受的单一分类。它们通常可以基于其病因学(特发性或具有已知关联或原因的ilds)、临床过程(急性、亚急性或慢性ilds)以及基于主要病理学特征(炎症或纤维化ilds)进行分类。纤维化ilds可基于其纵向疾病行为再分为3组(wellsau,2004):
2、·内在地非进行性的,例如去除药物后药物诱导的肺部疾病或去除触发物(trigger)后的一些过敏性肺炎(hp)病例;
3、·进行性但通过免疫调谐稳定的,例如一些结缔组织病(ctd)-ilds病例(tashkindp等人,2006;fischera等人,2013;morissetj等人,2017;adegunsoyea等人,2017);
4、·尽管在个别ilds中治疗被认为适当但仍然进行性的,例如特发性肺纤维化(ipf)。
5、虽然ipf是进行性纤维性ild(pf-ild)的最著名的且原型的形式,但有一组具有除ipf以外的不同临床ild诊断的患者,其在其疾病过程期间发展进行性纤维性表型。这些患者显示出与患有ipf的患者的许多相似性,他们的疾病定义为成像时逐渐增加的肺纤维化程度,逐渐下降的肺功能,逐渐恶化的呼吸症状和生命质量,尽管在个别ilds中管理被认为是适当的,以及最终,早期死亡率(flaherty kr等人,2017;wells au等人,2018;cottin v等人,2019;kolb m等人,2019)。与ipf类似,fvc下降预测患有这些其他纤维性ilds的患者的死亡率(jegal y等人,2005;solomon jj等人,2016;gimenez a,等人,2017;gohns等人,2017;volkmanner等人2019)。存在高度未满足的医学需要,这是因为除患有ipf的患者之外,不存在针对患有进行性纤维性ilds的患者的经批准的缓解疾病的药物疗法。除了临床相似性之外,进行性纤维性ilds还共享代表对组织损伤的共同纤维化反应的病理生理机制(见图3)(thannickal vj等人,2014;bagnato g等人,2015;wollinl等人,2019;luckhardttr等人,2015)。这些机制是多因子的和复杂的。ild患者肺中的促纤维化(pro-fibrotic)和促增殖(pro-proliferative)环境导致平滑肌细胞和内皮细胞的增加和增殖。由此产生的远侧肺小动脉肌化增加和增加的毛细血管生长很可能有助于增加的血管阻力。
6、根据科学文献,可并发进行性纤维化的ilds包括,但不限于,特发性非特异性间质性肺炎(insip)(kim my等人,2012)、无法分类的特发性间质性肺炎(iip)(guler sa等人,2018)、过敏性肺炎(hp)(sadeleer lj等人,2019)、自身免疫性ilds例如类风湿性关节炎相关ild(ra-ild)(doyle tj&dellaripa pf 2017)和ssc-ild guler sa等人,2018)、结节病(walsh sl等人,2014)和职业相关肺病(khalil n等人,2007)。进行性纤维性ilds如ipf的病因仍是未知的;然而,包括吸烟、职业危险、病毒和细菌感染以及放疗和化疗剂(如例如博来霉素)的各种刺激物已被描述为ipf发展的潜在危险因素。由于过去数年期间ipf诊断标准的变化,文献中ipf的流行显著地变化。根据最近的数据,ipf流行的范围为每100,000人14.0-63.0个病例,而发病率为每100,000人每年6.8-17.4个新的病例(ley b等人,2013)。ipf通常在66岁平均发病年龄的老年人中被诊断出来(hopkins rb等人,2016)。最初诊断后,ipf进展迅速,3-5年内死亡率约为60%。与ipf形成对照,可变部分的患有ctd(包括例如类风湿性关节炎(ra)、干燥综合征和系统性硬化病(ssc))或结节病的患者显示进行性纤维性表型,其中约10-20%的ra患者、9-24%的干燥综合征、>70%的ssc(mathai sc和danoffsk,2016)和20-25%的结节病患者(spagnolo p等人,2018)发展肺纤维化。
7、在pf-ilds中观察到两个主要的组织病理学特征,即非特异性间质性肺炎(nsip)和寻常间质性肺炎(uip)。ipf的组织病理学标志是uip和由过度胞外基质沉积引起的进行性间质纤维化。uip的特征在于具有与受影响较小或正常的肺实质区域相间的胸膜下和隔旁纤维化区域的不均匀外观。活动性纤维化区域即所谓的纤维形成病灶的特征在于成纤维细胞累积和过度胶原沉积。纤维形成病灶经常位于血管内皮和肺泡上皮之间,从而导致肺构造的破坏和特征性“蜂窝”样结构的形成。ipf的临床表现是急剧受损的氧扩散、肺功能的进行性下降、咳嗽和生命质量的严重损害。
8、uip也是ra-ild和晚期结节病的主要组织病理学标志之一;然而,其他ctds,例如ssc或干燥综合征主要特征在于非特异性间质性肺炎(nsip)。
9、nsip的特征在于较小的空间异质性,即病理异常相当均匀地席卷整个肺。在细胞nsip亚型中,组织病理学的特征在于炎性细胞,而在更常见的纤维化亚型中,明显纤维化的额外区域是明显的。然而,病理表现可能多种多样,从而使正确诊断和与其他类型纤维化如uip/ipf的区分变得复杂。
10、由于ipf的未知的病因,关于细胞和分子水平的病理机制的知识仍然是有限的。然而,最近在使用实验疾病模型(体外和体内)用于进行功能研究以及使用来着ipf患者的组织样品用于进行基因组学/蛋白质组学分析的转化研究(translational research)中的进展使得对关键疾病机制的有价值的深入了解成为可能。根据我们当前的理解,ipf是通过重复的肺泡上皮细胞(aec)微损伤(micro-injuries)起始的,其最终导致不受控制和持续的伤口愈合反应。更详细地,aec损伤诱导邻近上皮细胞的异常活化,从而导致免疫细胞和干细胞或祖细胞募集到损伤部位。通过分泌各种细胞因子、趋化因子和生长因子,浸润细胞产生促炎环境,其最终导致成纤维细胞的扩充和活化。在生理条件下,这些所谓的肌成纤维细胞产生胞外基质(ecm)组分以稳定和修复受损组织。此外,肌成纤维细胞经由其固有的收缩功能在伤口愈合过程的后期有助于组织收缩和伤口闭合。与生理伤口愈合形成对照,炎症和ecm的产生在ipf中不是自限性的。因此,这导致ecm的持续沉积,其最终导致进行性肺变僵硬和肺构造的破坏。实际上,ecm生物标志物可用于确定pf-ild治疗的开始,参见wo2017/207643。在分子水平上,ipf的发病机理由许多促纤维化介质和信号传导途径和谐地安排(orchestrated)。除由于其强有力的促纤维化作用而在ipf中发挥主要作用的tgfβ之外,酪氨酸激酶信号传导和各种相应生长因子如例如血小板衍生生长因子(pdgf)和成纤维细胞生长因子(fgf)的提高也有助于ipf的发病机理。
11、近年来,已经对几种药物进行了ipf治疗的临床试验。然而,到现在为止,只有两种药物哌非尼酮(roche/genentech)和尼达尼布(nintedanib)(boehringeringelheim)通过减慢疾病进展显示出令人信服的治疗功效,如通过降低的肺功能衰退速度所证明的。尽管取得了这些鼓舞人心的结果,但ipf的医学需要仍然是高的,且迫切需要具有改善的功效和理想的缓解疾病潜力的额外疗法。尼达尼布还被批准用于治疗系统性硬化病相关的ild以及除ipf以外的具有进行性表型的慢性纤维性间质性肺病。一般来说,当前ilds的管理集中在用皮质类固醇或免疫调谐疗法抑制炎症。后者基于在使用硫唑嘌呤、环孢菌素、环磷酰胺、麦考酚酸吗啉乙酯、利妥希玛和他克莫司的小病例系列中的无对照报道和不受控制的治疗反应。一些ilds,例如一些ctd-ilds病例可以通过免疫调谐来稳定(tashkin dp等人,2006;fischer a等人2013;morisset j等人,2017;adegunsoye a等人,2017),其他是进行性的,尽管(药物和/或非药物)治疗被认为在个别ilds中是适当的(wellsau 2004),从而再次证明了对创新的治疗方法的仍然高的需要。
12、肺动脉高压(ph)是ilds中最常见的并发症之一,其可能是早期死亡率的独立驱动因素(driver)(galièn等人,2015)。ph被定义为具有升高的右心室收缩压(rvsp)、右心室压力超负荷以及右心房和心室扩张的疾病(smith等人(2013),am j med sci,346(3):221-225)。
13、慢性纤维化矽肺属于ilds家族。它是由长期、反复吸入结晶二氧化硅引起的,从而损害肺泡腔的上皮细胞并激活巨噬细胞以产生炎症反应。这两个因素都导致定居成纤维细胞的活化以及相关的胞外基质在这些肺区域中的大量沉积。
技术实现思路
1、不推荐使用ofev治疗患有中度(child pugh b)和重度(child pugh c)肝损伤的患者(参见epar)。已经服用氟伏沙明(用于治疗抑郁症和强迫症的药物)的患者或具有严重肝或肾问题的患者一定不能使用艾思瑞(esbriet)(参见epar)。因此,对于pf-ild患者,且特别对于具有严重肝和肾问题的ipf患者,仍然存在高的医学需要。本发明的目的是提供治疗备择方案。本发明的另一个目的是提供甚至可能适合不能从现有疗法中获益的患者群体的治疗备择方案。
2、虽然艾思瑞和ofev在临床试验中显示出令人信服的疗效,但也伴随着可能限制两种药物联合治疗的选择的副作用(参见两者epars)。因此,对于具有较少副作用或至少与用ofev或艾思瑞观察到的那些不同的副作用,以便与艾思瑞或ofev的联合治疗可能是提高整体治疗功效的可行选择的ild治疗,例如pf-ild,且特别是ipf治疗,仍然存在高的医学需要。本发明的另一个目的是提供与已确立的治疗选择相比具有不同风险/得益概况的治疗备择方案,例如与已确立的治疗选择相比具有较小的副作用或具有不同的副作用。虽然艾思瑞和ofev计划用于口服,即全身使用,但仍然需要一种可以通过局部施用或经由局部和全身途径两者施用的治疗选择。本发明的另一个目的是提供可以通过局部施用或经由局部和全身途径两者施用的治疗选择。本发明的另一个目的是提供有效表达相应微小rna的病毒载体。本发明的进一步备择的目的是,病毒载体比其对应物更有效地表达各自的微小rna,例如,如果各自的微小rna是5p,则5p微小rna比其3p对应物更有效地表达。
3、本发明的进一步备择的目的是提供
4、-具有活性成分的单次或有限次数的施用的ild、pf-ild或ipf的治疗选择和/或
5、-解决ild和/或ipf的表型的多个方面的ild、pf-ild或ipf的治疗选择和/或
6、-也解决ild和/或ipf的表型的多个方面的ild、pf-ild或ipf的治疗选择和/或
7、-在与ild、pf-ild和/或ipf具有显著的共病现象的疾病中可能具有有益效果的ild、pf-ild或ipf的治疗选择和/或
8、-在ild、pf-ild或ipf的动物模型和细胞模型中减少ild、pf-ild或ipf的表型的一个或多个方面的工具化合物的组合物。
9、本发明一方面涉及治疗剂,即病毒载体或mirna模拟物,用于治疗一般而言的ild,以及特别地pf-ild和ipf。
10、根据本发明的病毒载体通过调节mirna功能停止或减缓ild,优选pf-ild,且更优选ipf中观察到的组织转化的一个或多个方面,例如ecm沉积,且从而停止或减缓这些疾病中所见的用力肺活量的下降(参见wo2017/207643和参考文献)。根据本发明的病毒载体可以经由局部(鼻内、气管内、吸入)或全身(静脉内)途径施用于患者。尤其aav载体可以非常有效地靶向肺,具有低抗原潜力,且因此也特别适合全身施用。
11、从治疗的观点来看,mirna功能可以通过下述来调节:通过递送mirna模拟物,以增加内源性mirnas的作用,所述内源性mirnas在纤维化状况下被下调,或者通过递送分子以阻断mirnas或通过所谓的抗-mirs或mirna海绵(sponge)降低它们的可用性,从而抑制在病理条件下上调的内源性mirnas的功能性。
12、此外,本发明中描述的被上调的mirnas也可能作为天然抗纤维化反应的一部分发挥保护功能。然而,这种效果显然不足以独自解决病理。因此,在特定情况下,为在纤维化状况下已经升高的序列递送mirna模拟物可能进一步增强其抗纤维化作用,从而为治疗干预提供额外的模型。
13、基于mirnas和谐地安排多个靶基因的同时调节的事实,病毒载体介导的mirna功能的调节代表了一种有吸引力的策略,以通过影响不同的疾病途径来使得多靶向治疗成为可能。本发明中描述的肺纤维化相关mirnas通过调节不同组的靶基因区别于以前鉴定的mirnas,从而提供改善的治疗功效的潜力。
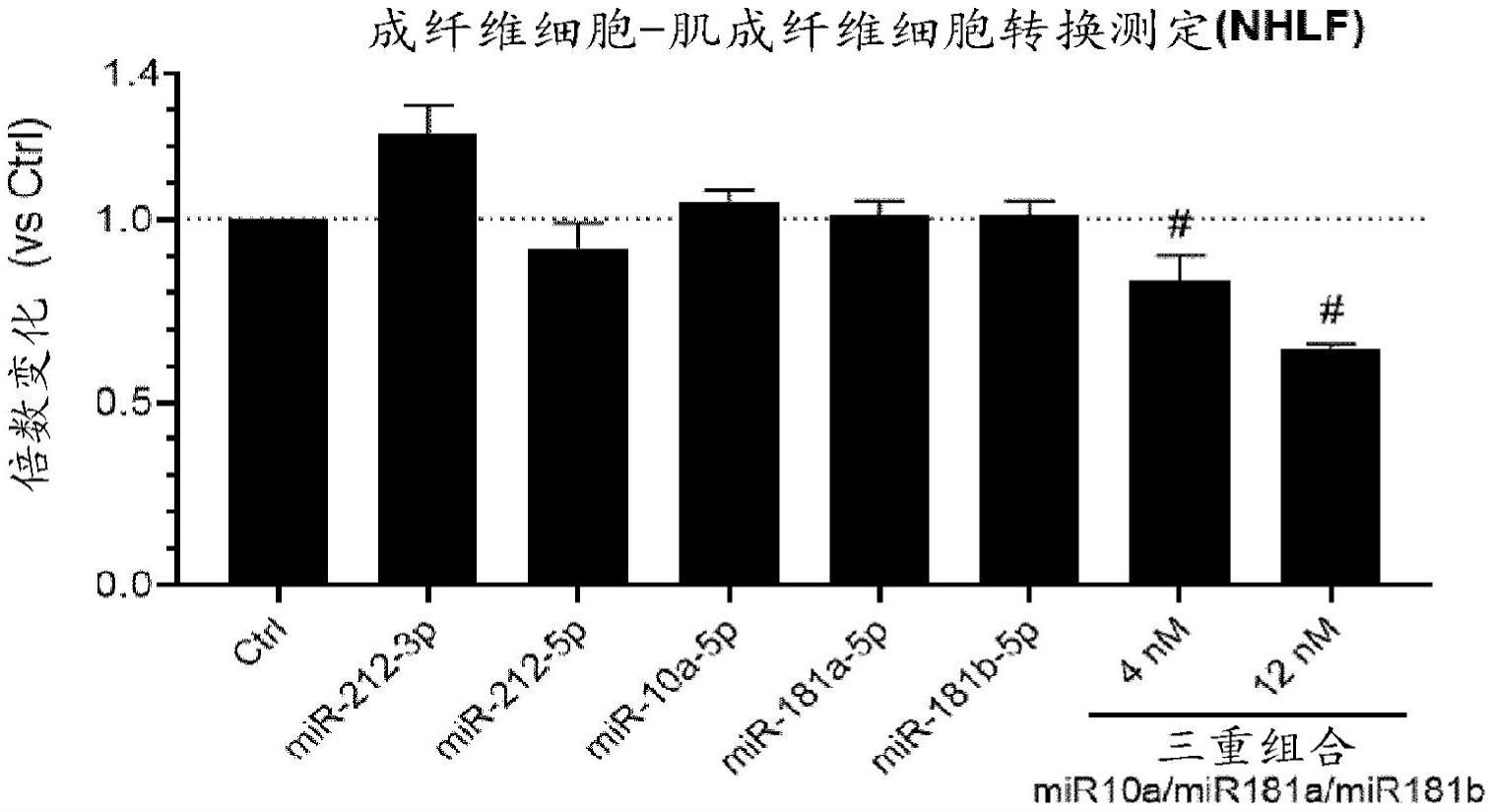
14、在本发明中,已通过对两种疾病相关动物模型的深入表征和计算分析鉴定了一组与肺纤维化有关的mirnas,特别地,博来霉素诱导的肺损伤,其特征在于斑片状、急性炎症驱动的纤维化表型,和aav-tgfβ1诱导的纤维化,其使人联想到更同质的nsip模式。已经产生了mirnas和mrnas的纵向转录谱(longitudinal transcriptional profiles)以及功能数据,以使得能够鉴定与疾病有关的mirnas。此外,已基于序列和表达反相关性(anti-correlation)建立了高可信度的mirna-mrna调节关系,从而允许基于其靶组在疾病模型的背景下对mirnas进行表征。为了进一步证实这些发现,产生了选择的mirna候选物(mir-29a-3p、mir-10a-5p、mir-181a-5p、mir-181b-5p、mir-212-5p)的合成rna寡核苷酸模拟物,并将其用于在原代人肺成纤维细胞、原代人支气管气道上皮细胞和a549细胞的细胞纤维化模型中进行瞬时转染实验。通过研究瞬时转染的mirnas对tgfβ-诱导的纤维化重塑(炎症、增殖、成纤维细胞-肌成纤维细胞转换(fmt)、上皮-间充质转换(emt))的主要方面的影响,可以证实选择的mirnas的预测的抗纤维化作用。最后,为了将这些发现转化为临床应用,描述了纤维性肺部病的新治疗方法以使得能够通过使用基于腺伴随病毒(aav)载体的病毒基因递送来调节pf-ild相关mirnas。
15、根据本发明的mirna模拟物通过调节mirna功能停止或减缓ildss如pf-ild和ipf中观察到的组织转化的一个或多个方面,例如ecm沉积,且从而停止或减缓这些疾病中所见的用力肺活量的下降(参见wo2017/207643和参考文献)。与根据本发明的病毒载体相比,它们具有不同的副作用概况,例如可能较低的抗原性,从而可能允许在不需要免疫抑制联合治疗的情况下的多种治疗。
16、通过对两种疾病相关动物模型即小鼠中博来霉素-和aav-tgfβ1-诱导的肺纤维化模型进行纵向深入分析,已鉴定出新的28种mirnas的组。为了选择最相关的mirnas,发明人开发了基于基因表达概况分析数据和关键功能性疾病参数之间的系统相关性分析的命中选择策略。考虑到pf-ilds的慢性特性,发明人描述了通过病毒载体尤其是基于腺伴随病毒(aav)的那些表达mirnas、抗-mirs或mirna海绵,作为新的治疗概念,以使得能够持久表达治疗用核酸用于纤维化相关mirnas的功能调节。
- 还没有人留言评论。精彩留言会获得点赞!