用于减少细胞中II类MHC的组合物和方法与流程
用于减少细胞中ii类mhc的组合物和方法
1.本技术根据35 u.s.c.119(e)要求2020年12月11日提交的美国临时申请第63/124,064号和2020年12月23日提交的美国临时申请第63/130,106号的权益;所述申请的公开内容各自通过引用整体并入本文。
2.本技术与电子格式的序列表一起提交。所述序列表以命名为“2021-12-10_01155-0034-00pct_seq_list_st25.txt”的文件提供,所述文件创建于2021年12月10日,大小为392,081字节。所述序列表的电子格式的信息通过引用整体并入本文。
3.引言和
技术实现要素:
4.下调ii类mhc的能力对于许多体内和离体应用至关重要,例如当使用同种异体细胞(源自供体)进行移植和/或例如在体外产生不会激活t细胞的细胞群体时。特别是,将同种异体细胞转移至受试者中是细胞疗法领域非常有兴趣的。同种异体细胞的使用由于接受受试者的免疫细胞排斥问题而受到限制,所述免疫细胞将移植细胞识别为外来的并发动攻击。为避免免疫排斥问题,基于细胞的疗法集中于自体方法,所述方法使用受试者自身的细胞作为疗法的细胞来源,这是一种耗时且昂贵的方法。
5.通常,同种异体细胞的免疫排斥由供体与接受体之间的主要组织相容性复合体(mhc)分子错配产生。在人类群体内,mhc分子以各种形式存在,包括例如编码不同形式的mhc蛋白的任何给定mhc基因的许多遗传变体,即等位基因。mhc分子的主要类别称为i类mhc和ii类mhc。i类mhc分子(例如人类中的hla-a、hla-b和hla-c)表达于所有有核细胞上并且呈递抗原以激活细胞毒性t细胞(cd8+ t细胞或ctl)。ii类mhc分子(例如人类中的hla-dp、hla-dq和hla-dr)仅在某些细胞类型(例如b细胞、树突状细胞和巨噬细胞)上表达并且呈递抗原以激活辅助t细胞(cd4+ t细胞或th细胞),进而向b细胞提供信号以产生抗体。
6.例如个体之间的mhc等位基因的微小差异会导致接受体中的t细胞被激活。在t细胞发育期间,个体的t细胞库对自身mhc分子具有耐受性,但识别另一个体的mhc分子的t细胞可在循环中持续存在并且称为同种异体反应性t细胞。同种异体反应性t细胞可例如通过在体内存在另一个体的表达mhc分子的细胞而被激活,引起例如移植物抗宿主疾病和移植排斥反应。
7.用于降低同种异体细胞对排斥反应的易感性的方法和组合物是令人感兴趣的,包括例如降低细胞的mhc蛋白表达以避免接受体t细胞反应。实际上,基因修饰同种异体细胞以移植至受试者中的能力受到在多重基因编辑以降低所有mhc蛋白表达的同时要避免其他有害接受体免疫反应的要求的妨碍。例如,尽管耗竭i类mhc蛋白的策略可能会减少ctl活化,但在表面上缺乏i类mhc的细胞易于由免疫系统的自然杀手(nk)细胞溶解,因为nk细胞活化是通过i类mhc特异性抑制受体调节。耗竭ii类mhc分子的基因编辑策略也已证实是困难的,尤其在某些细胞类型中,原因包括低编辑效率和低细胞存活率,阻碍了作为细胞疗法的实际应用。
8.因此,需要用于修饰同种异体细胞的改进方法和组合物以克服接受体免疫排斥问题和与产生更安全移植细胞所需的多重基因修饰相关的技术难题。
9.本公开提供了具有降低或消除的ii类mhc表面表达的工程化细胞。所述工程化细
10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234。在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470。
12.在一些实施方案中,提供了一种组合物,所述组合物包含:a)包含引导序列的ciita引导rna,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割;其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。
13.在一些实施方案中,提供了一种组合物,所述组合物包含:a)ciita引导rna(grna),所述grna包含i)选自seq id no:1-101的引导序列;或ii)选自seq idno:1-101的序列的至少17、18、19或20个连续核苷酸;或iii)与选自seq id no:1-101的序列至少95%、90%或85%同一的引导序列;或iv)包含表1中所列的基因组坐标的10个连续核苷酸
±
10个核苷酸的序列;或v)来自(iv)的序列的至少17、18、19或20个连续核苷酸;或vi)与选自(v)的序列至少95%、90%或85%同一的引导序列。
14.在一些实施方案中,提供了一种组合物,所述组合物包含:a)ciita引导rna,其为单引导rna(sgrna),所述sgrna包含i)选自seq id no:1-101的引导序列;或ii)选自seq id no:1-101的序列的至少17、18、19或20个连续核苷酸;或iii)与选自seq id no:1-101的序
列至少95%、90%或85%同一的引导序列;或iv)包含表1中所列的基因组坐标的10个连续核苷酸
±
10个核苷酸的序列;或v)来自(iv)的序列的至少17、18、19或20个连续核苷酸;或vi)与选自(v)的序列至少95%、90%或85%同一的引导序列。
15.在一些实施方案中,提供了一种制造工程化细胞的方法,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc蛋白的表面表达,所述方法包括使细胞与本文提供的任何实施方案的组合物接触。在一些实施方案中,组合物包含ciita引导rna,所述rna包含选自以下的核苷酸:seq id no:47、seq id no:55、seq id no:71、seq id no:80、seq id no:82、seq id no:83、seq id no:87、seq id no:91、seq id no:96、seq id no:97、seq id no:98、seq id no:100和seq id no:101。在一些实施方案中,组合物包含ciita引导rna,所述rna包含选自以下的核苷酸:seq id no:47、seq id no:55、seq id no:71、seq id no:80、seq id no:83、seq id no:87、seq id no:91、seq id no:97、seq id no:98和seq id no:100。
16.在一些实施方案中,提供了一种相对于未经修饰细胞降低工程化细胞中ii类mhc蛋白的表面表达的方法,所述方法包括使细胞与本文提供的任何实施方案的组合物接触。
附图说明
17.图1a-d显示t细胞筛选的结果,所述筛选通过流式细胞术针对cas9(图1c)和bc22(图1d)比较ciita引导rna的编辑(图1a(对于cas9裂解酶(cas9))和图1b(脱氨酶(bc22))与对ii类mhc的细胞表面表达呈阴性的t细胞的平均百分比(mhc ii阴性%)。
18.图2显示使用cas9和bc22的若干引导物的对ii类mhc的细胞表面表达呈阴性的t细胞的平均百分比(mhc ii阴性%)与显示为碱基对(“bp”)的切割位点至剪接位点边界核苷酸的距离的关系。正数值指示位于切割位点的3
′
的剪接位点边界核苷酸,而负数值指示位于切割位点的5
′
的剪接位点边界核苷酸。
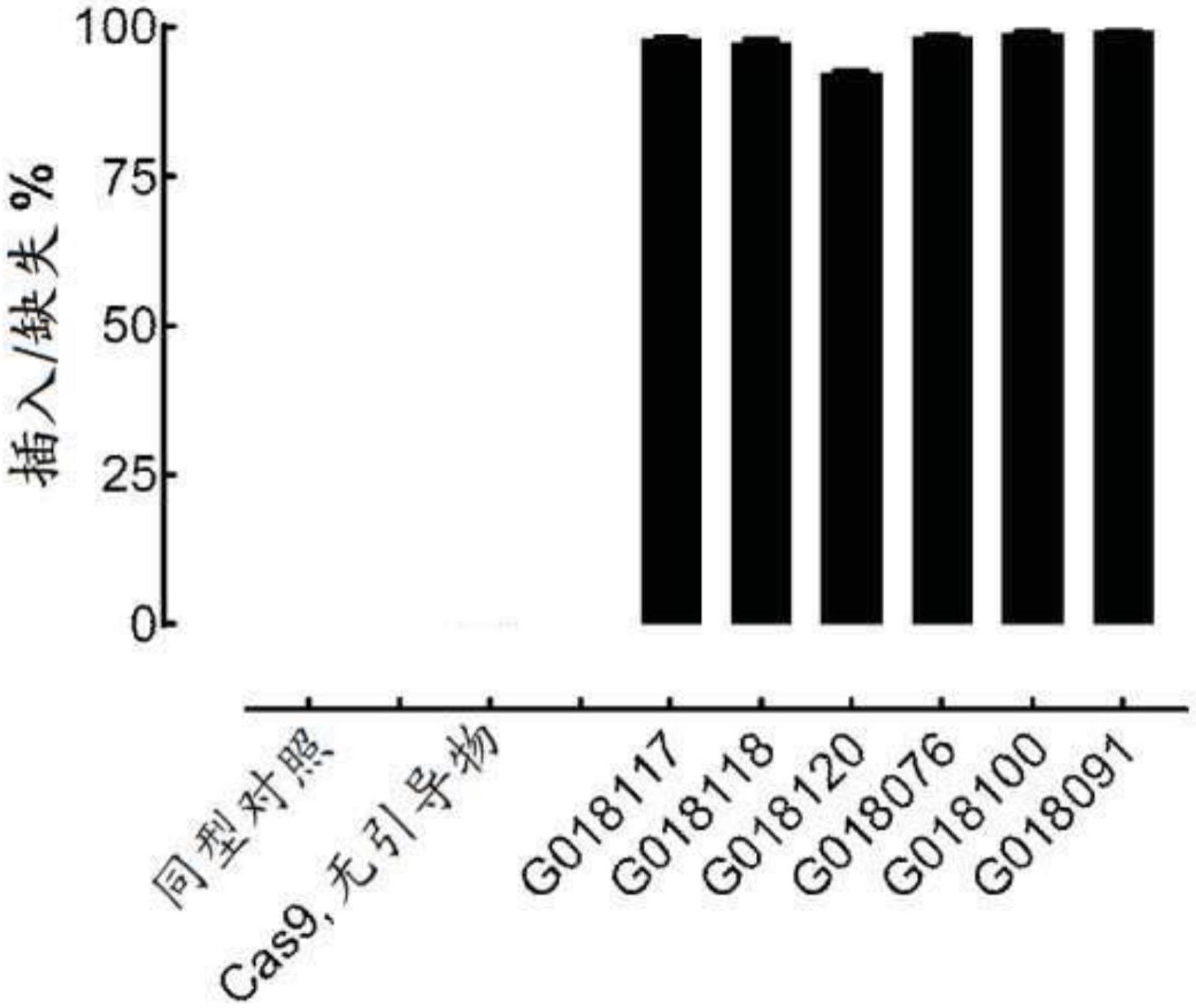
19.图3a-3d显示当改变bc22n(如本文所用,“bc22n”是指无ugi的bc22)mrna和cas9 mrna的水平时,呈总读段百分比形式的t细胞编辑概况。细胞经个别引导rna g015995(图3a)、g016017(图3b)、g016206(图3c)和g018117(图3d)编辑。
20.图4a-4d显示当同时使用四种引导rna进行编辑时,在改变bc22n mrna和cas9 mrna的水平时呈总读段百分比形式的t细胞编辑概况。对于由g015995(图4a)、g016017(图4b)、g016206(图4c)和g018117(图4d)靶向的四个基因座中的每一者显示多引导递送的总读段的百分比。
21.图5a-5h显示呈对抗体结合呈阴性的细胞百分比形式的表型分型结果,其中bc22n和cas9样品的总rna均增加(如表14中所示)。图5a显示当b2m引导物g015995用于编辑时,b2m阴性细胞的百分比。图5b显示当多引导物用于编辑时,b2m阴性细胞的百分比。图5c显示当trac引导物g016017用于编辑时,cd3阴性细胞的百分比。图5d显示当trbc引导物g016206用于编辑时,cd3阴性细胞的百分比。图5e显示当多个引导物用于编辑时,cd3阴性细胞的百分比。图5f显示当ciita引导物g018117用于编辑时,ii类mhc阴性细胞的百分比。图5g显示当多个引导物用于编辑时,ii类mhc阴性细胞的百分比。图5h显示当多个引导物用于编辑时,三重(b2m、cd3、mhc ii)阴性细胞的百分比。
22.图6a-6b显示在用不同mrna构建体和ciita靶向sgrna处理之后的t细胞(图6a)和
通过对用不同mrna构建体和ciita引导rna处理的t细胞进行流式细胞术分析而评估的ii类mhc阴性细胞(图6b)中的编辑概况。
23.图7a-7d显示散布图,所述散布图显示用第一引导物ugi mrna和cas9 mrna(图7a)或bc22n mrna(图7b),或用第二引导物ugi mrna和cas9 mrna(图7c)或bc22n mrna(图7d)处理的t细胞中的统计学显著(*=调整后p值<0.05)差异基因表达事件(黑点)。
24.图8a-8d显示在用第一引导物ugi mrna和cas9 mrna(图8a)或bc22n mrna(图8b),或用第二引导物ugi mrna和cas9 mrna(图8c)或bc22n mrna(图8d)处理的t细胞中,在差异性表达基因的列表中富集的蛋白质-蛋白质相互作用网络。
25.图9a-9c显示在通过体内成像系统(ivis)的nk细胞杀灭鼠类模型中,b2m基因敲除t细胞和b2m基因敲除/hla-e t细胞在注射后90天(图9a)、90天时程内(图9b)和30天时程内(图9c)的存活率;ivis信号定量为平均辐射强度。显示出个别小鼠(1-8)的数据点。
26.图10a-10b显示在磁性细胞分离处理之前(图10a)和在处理之后(图10b),根据ngs测序,t细胞中的ciita、b2m和trac的编辑百分比。
27.图11a-11b显示在处理之前(图11a)和在处理之后(图11b),通过流式细胞术,对ii类mhc、b2m和trac的细胞表面表达呈阴性的t细胞的平均百分比。
28.图12显示根据kromatid dgh测定,用电穿孔、同时lnp方法或依序lnp方法处理的经基因修饰细胞中的染色体结构变化。
具体实施方式
29.本公开提供了工程化细胞,以及用于基因修饰细胞以制备适用于例如过继性细胞转移(act)疗法的工程化细胞和工程化细胞群体的方法和组合物。本文所提供的本公开通过提供用于基因修饰ciita以降低细胞表面上ii类mhc蛋白的表达的方法和组合物来克服现有方法的某些障碍。在一些实施方案中,本公开提供了工程化细胞,其由于ciita基因中的基因修饰而具有降低或消除的ii类mhc的表面表达。在一些实施方案中,本公开提供了用于降低或消除ii类mhc蛋白的表达的组合物和方法和进一步降低细胞对免疫排斥的易感性的组合物和方法。例如,在一些实施方案中,所述方法和组合物包括通过基因修饰ciita来降低或消除ii类mhc蛋白的表面表达,和降低或消除i类mhc蛋白的表面表达和/或通过基因修饰将编码nk细胞抑制剂分子或靶向受体或其他多肽(表达于细胞表面上或分泌的)的外源核酸插入细胞中。通过本文所公开的方法产生的工程化细胞组合物具有所需特性,包括例如降低的mhc分子表达、降低的体外和体内免疫原性、增加的存活率和增加的与更多移植受试者的基因相容性。
30.术语“约”或“大约”意指如由本领域普通技术人员所测定的特定值的可接受的误差,其部分地取决于如何测量或测定所述值、或变化程度不会基本上影响所述主题的特性,或在本领域中所接受的公差内,例如在10%、5%、2%或1%内。因此,除非有相反指示,否则本说明书和所附权利要求书中所阐述的数值参数是可根据设法获得的所需特性而变化的近似值。至少,并且不试图将均等论的应用限于权利要求的范围,每个数值参数至少应根据所报告的有效数字的个数并通过应用普通舍入技术来解释。
31.i.定义
32.除非另外说明,否则如本文所用的以下术语和短语旨在具有以下含义:
33.如本文所用,术语“或其组合”是指在所述术语前面所列项的所有排列和组合。例如,“a、b、c或其组合”旨在包括以下中的至少一者:a、b、c、ab、ac、bc或abc,并且如果在特定情况下顺序是重要的,则还包括ba、ca、cb、acb、cba、bca、bac或cab。继续此实例,明确地包括含有一个或多个项或术语的重复的组合,例如bb、aaa、aab、bbc、cbba、caba等等。本领域技术人员应理解,除非另外从上下文显而易知,否则通常不存在对任何组合中的项目或项的数目的限制。
34.如本文所用,术语“试剂盒”是指相关组分如一种或多种多核苷酸或组合物和一种或多种相关材料如递送装置(例如注射器)、溶剂、溶液、缓冲剂、说明书或干燥剂的封装组。
35.如本文所用,“同种异体”细胞是指源自与接受受试者相同物种的供体受试者的细胞,其中供体受试者和接受受试者具有基因相异性,例如一个或多个基因座处的基因不同一。因此,例如,细胞相对于待施用所述细胞的受试者是同种异体的。如本文所用,从供体移出或分离、将不再引入至原始供体中的细胞被视为同种异体细胞。
36.如本文所用,“自体”细胞是指源自相同受试者的细胞,稍后将向所述受试者再引入材料。因此,例如,如果细胞从受试者移出并且其然后再引入至相同受试者中,则其视为自体的。
37.如本文所用,“β2m”或“b2m”是指“β-2微球蛋白”的核酸序列或蛋白质序列;人类基因具有登录号nc 000015(范围44711492..44718877),参考grch38.p13。b2m蛋白与有核细胞表面上杂二聚体形式的i类mhc分子相关,并且为i类mhc蛋白表达所需。
38.如本文所用,“ciita”或“ciita”或“c2ta”是指“ii类主要组织相容性复合体反式激活因子”的核酸序列或蛋白质序列;人类基因具有登录号nc_000016.10(范围10866208..10941562),参考grch38.p13。细胞核中的ciita蛋白充当ii类mhc基因转录的正调节因子并且为ii类mhc蛋白表达所需。
39.如本文所用,“mhc”或“mhc分子”或“mhc蛋白”或“mhc复合物”是指一个主要组织相容性复合体分子(或多个),并且包括例如i类mhc和ii类mhc分子。在人类中,mhc分子被称为“人类白细胞抗原”复合物或“hla分子”或“hla蛋白”。术语“mhc”和“hla”的使用不意在为限制性的;如本文所用,术语“mhc”可用于指人类mhc分子,即hla分子。因此,术语“mhc”和“hla”在本文中可互换使用。
40.如本文所用,hla-a蛋白的上下文中的术语“hla-a”是指i类mhc蛋白分子,其为由重链(由hla-a基因编码)和轻链(即β-2微球蛋白)组成的异二聚体。如本文所用,在核酸的上下文中的术语“hla-a”或“hla-a基因”是指编码hla-a蛋白分子的重链的基因。hla-a基因也被称为“hla i类组织相容性,a α链”;人类基因具有登录号nc_000006.12(29942532..29945870)。已知hla-a基因跨群体具有数千种不同型式(也称为“等位基因”)(并且个体可接受hla-a基因的两种不同等位基因)。hla-a等位基因的公共数据库(包括序列信息)可在ipd-imgt/hla:https://www.ebi.ac.uk/ipd/imgt/hla/访问。hla-a的所有等位基因均由术语“hla-a”和“hla-a基因”涵盖。
41.如本文在核酸的上下文中所用的术语“hla-b”是指编码hla-b蛋白分子的重链的基因。hla-b基因也被称为“hla i类组织相容性,bα链”;人类基因具有登录号nc_000006.12(31353875..31357179)。
42.如本文在核酸的上下文中所用的术语“hla-c”是指编码hla-c蛋白分子的重链的基因。hla-c基因也被称为“hla i类组织相容性,cα链”;人类基因具有登录号nc_000006.12(31268749..31272092)。
43.如本文所用,术语“基因组坐标内”包括给定基因组坐标范围的边界。例如,如果给出chr6:29942854-chr6:29942913,则涵盖坐标chr6:29942854-chr6:29942913。在整个本技术中,参考的基因组坐标是基于来自基因组参考联合会(genome reference consortium)的人类基因组的grch38(也称为hg38)组装中的基因组注释,其可在国家生物技术信息中心网站上获得。用于在一个组装与另一组装之间转化基因组坐标的工具和方法是本领域中已知的并且可用于将本文中提供的基因组坐标转化为人类基因组的另一组装中的对应坐标,包括转化为由同一机构或使用相同算法产生的早期组装(例如从grch38至grch37),和转化由不同机构或算法产生的组装(例如从grch38至ncbi33,通过国际人类基因组测序联合会(international human genome sequencing consortium)产生)。本领域中已知的可用方法和工具包括但不限于可在国家生物技术信息中心(national center for biotechnology information)网站获得的ncbi genome remapping service、可在ucsc genome brower网站获得的ucsc liftover和可在ensembl.org网站获得的assembly converter。
44.如本文所用,术语“同型接合”是指具有特定基因的两个相同等位基因。
45.如本文所用,“剪接位点”是指构成受体剪接位点或供体剪接位点(下文所定义)或本领域中已知为剪接位点的一部分的任何其他核苷酸的三个核苷酸。参见例如burset等人,nucleic acids research 28(21):4364-4375(2000)(描述哺乳基因组中的典型和非典型剪接位点)。构成“受体剪接位点”的三个核苷酸在内含子的3
′
和边界核苷酸(即,ag的外显子3
′
的第一核苷酸)处为两个保守残基(例如,人类中的ag)。受体剪接位点的“剪接位点边界核苷酸”在下图中指定为“y”,并且也可在本文中称为“受体剪接位点边界核苷酸”或“剪接受体位点边界核苷酸”。术语“受体剪接位点”、“剪接受体位点”、“受体剪接序列”或“剪接受体序列”可在本文中互换使用。
46.构成“供体剪接位点”的三个核苷酸是内含子的5
′
端处的两个保守残基(例如,人类中的gt(基因)或gu(在rna中,例如前mrna))和边界核苷酸(即,gt的外显子5
′
的第一个核苷酸)。供体剪接位点的“剪接位点边界核苷酸”在下图中指定为“x”,并且也可在本文中称为“供体剪接位点边界核苷酸”或“剪接供体位点边界核苷酸”。术语“供体剪接位点”、“剪接供体位点”、“供体剪接序列”或“剪接供体序列”可在本文中互换使用。
47.48.如本文所用,“剪接位点区域”包括剪接位点处的核苷酸,以及邻近剪接位点的核苷酸。
49.如本文所用,术语“受试者”旨在包括可引发免疫反应的活生物体,包括例如哺乳动物、灵长类动物、人类。
[0050]“多核苷酸”和“核酸”在本文中用以指包含含氮杂环碱基或碱基类似物沿主链连接在一起的核苷或核苷类似物的多聚化合物,其包括常规rna、dna、混合rna-dna和为其类似物的聚合物。核酸“主链(backbone)”可由多个键联构成,其包括糖-磷酸二酯键、肽-核酸键(“肽核酸”或pna;pct第wo 95/32305号)、硫代磷酸酯键、甲基膦酸酯键或其组合中的一者或多者。核酸的糖部分可为核糖、脱氧核糖,或具有取代(例如2
′
甲氧基或2
′
卤基取代)的类似化合物。含氮碱基可为常规碱基(a、g、c、t、u)、其类似物(例如经修饰的尿苷,例如5-甲氧基尿苷、假尿苷或n1-甲基假尿苷或其他经修饰的尿苷);肌苷;嘌呤或嘧啶的衍生物(例如n
4-甲基脱氧鸟苷、去氮嘌呤或氮杂嘌呤、去氮嘧啶或氮杂嘧啶、在5位或6位处具有取代基的嘧啶碱基(例如5-甲基胞嘧啶),在2位、6位或8位处具有取代基的嘌呤碱基,2-氨基-6-甲氨基嘌呤,o
6-甲基鸟嘌呤,4-硫基-嘧啶,4-氨基-嘧啶,4-二甲基肼-嘧啶和o
4-烷基-嘧啶;美国专利第5,378,825号和pct第wo 93/13121号)。对于一般论述,参见the biochemistry of the nucleic acids 5-36,adams等人编,第11版,1992)。核酸可包括一个或多个“无碱基”残基,其中主链不包括针对聚合物位置的含氮碱基(美国专利第5,585,481号)。核酸可仅包含常规rna或dna糖、碱基和键联,或可包括常规组分与取代(例如具有2
′
甲氧基键联的常规碱基,或含有常规碱基与一个或多个碱基类似物的聚合物)。核酸包括“锁核酸”(lna)、含有一种或多种lna核苷酸单体的类似物,所述单体具有模拟糖构象的锁定于rna中的双环呋喃糖单元,其会增强对互补rna和dna序列的杂交亲和力(vester和wengel,2004,biochemistry 43(42):13233-41)。rna和dna具有不同糖部分并且不同之处可为在rna中存在尿嘧啶或其类似物和在dna中存在胸腺嘧啶或其类似物。
[0051]“引导rna”、“grna”和简称“引导物”可在本文中互换地用于指例如将经rna引导的dna结合剂导引至目标dna的引导物,并且可为单一引导rna或crrna与trrna(也称为tracrrna)的组合。示例性grna包括经修饰或未经修饰形式的ii类cas核酸酶引导rna。crrna和trrna可以单一rna分子(单引导rna,sgrna)或以两个独立rna链(双引导rna,dgrna)形式缔合。“引导rna”或“grna”是指每个类型。trrna可为天然存在的序列,或与天然存在的序列相比具有修饰或变异的trrna序列。
[0052]
如本文所用,“引导序列”是指引导rna中与目标序列互补并用以通过经rna引导的dna结合剂将引导rna导引至目标序列以供结合或修饰(例如裂解)的序列。“引导序列”也可称为“靶向序列”或“间隔序列”。引导序列的长度可为20个碱基对,例如在酿脓链球菌(streptococcus pyogenes)(即spy cas9(spcas9))和相关cas9同源物/直系同源物的情况下。较短或较长序列也可用作例如长度为15、16、17、18、19、21、22、23、24或25个核苷酸的引导物。在一些实施方案中,目标序列处于例如基因中或染色体上,并且与引导序列互补。在一些实施方案中,引导序列与其对应目标序列之间的互补性或同一性的程度可为约75%、80%、85%、90%、95%、96%、97%、98%、99%或100%。在一些实施方案中,引导序列与目标区域可为100%互补或同一的。在其他实施方案中,引导序列和目标区域可含有至少一个错配。例如,引导序列和目标序列可含有1、2、3或4个错配,其中目标序列的总长度为至少
17、18、19、20个或更多个碱基对。在一些实施方案中,引导序列和目标区域可含有1-4个错配,其中引导序列包含至少17、18、19、20个或更多个核苷酸。在一些实施方案中,引导序列和目标区域可含有1、2、3或4个错配,其中引导序列包含20个核苷酸。
[0053]
经rna引导的dna结合剂的目标序列包括基因组dna的正链和负链(即给定序列和序列的反向互补序列),这是因为经rna引导的dna结合剂的核酸底物是双链核酸。因此,在引导序列据称“与靶序列互补”的情况下,应理解,引导序列可导引引导rna结合至目标序列的反向互补序列。因此,在一些实施方案中,在引导序列结合目标序列的反向互补序列的情况下,引导序列与目标序列(例如不包括pam的目标序列)的某些核苷酸具有同一性,不同之处在于在引导序列中u取代t。
[0054]
如本文所用,“经rna引导的dna结合剂”意指具有rna和dna结合活性的多肽或多肽复合物,或此类复合物的dna结合亚基,其中dna结合活性具有序列特异性并且依赖于rna序列。示例性经rna引导的dna结合剂包括cas裂解酶/切口酶和其灭活形式(“dcas dna结合剂”)。如本文所用,“cas核酸酶”也称作“cas蛋白”,其涵盖cas裂解酶、cas切口酶和dcas dna结合剂。cas裂解酶/切口酶和dcas dna结合剂包括iii型crispr系统的csm或cmr复合物、其cas10、csm1或cmr2亚基、i型crispr系统的级联复合物、其cas3亚基和2类cas核酸酶。如本文所用,“2类cas核酸酶”是具有经rna引导的dna结合活性的单链多肽。2类cas核酸酶包括2类cas裂解酶/切口酶(例如h840a、d10a或n863a变体),其进一步具有经rna引导的dna裂解酶或切口酶活性,和2类dcas dna结合剂,其中裂解酶/切口酶活性失活。2类cas核酸酶包括例如cas9、cpf1、c2c1、c2c2、c2c3、hf cas9(例如n497a、r661a、q695a、q926a变体)、hypacas9(例如n692a、m694a、q695a、h698a变体)、espcas9(1.0)(例如k810a、k1003a、r1060a变体)和espcas9(1.1)(例如k848a、k1003a、r1060a变体)蛋白和其修饰。cpf1蛋白(zetsche等人,cell,163:1-13(2015))与cas9同源并含有ruvc样核酸酶域。zetsche的cpf1序列通过引用整体并入。参见例如zetsche,表s1和表s3。参见例如makarova等人,nat rev microbiol,13(11):722-36(2015);shmakov等人,molecularcell,60:385-397(2015)。
[0055]
如本文所用,术语“编辑器”是指包含能够在dna序列内进行修饰的多肽的试剂。在一些实施方案中,编辑器为裂解酶,例如cas9裂解酶。在一些实施方案中,编辑器能够使dna分子内的碱基脱氨。在一些实施方案中,编辑器能够使dna中的胞嘧啶(c)脱氨。在一些实施方案中,编辑器是包含与胞苷脱氨酶融合的经rna引导的切口酶的融合蛋白。在一些实施方案中,编辑器是包含与apobec3a脱氨酶(a3a)融合的经rna引导的切口酶的融合蛋白。在一些实施方案中,编辑器包含与apobec3a脱氨酶(a3a)融合的cas9切口酶。在一些实施方案中,编辑器是包含与胞苷脱氨酶融合的经rna引导的切口酶和ugi的融合蛋白。在一些实施方案中,编辑器缺乏ugi。
[0056]
如本文所用,“胞苷脱氨酶”意指能够具有胞苷脱氨酶活性的多肽或多肽复合物,其催化胞苷或脱氧胞苷的水解脱氨作用,通常产生尿苷或脱氧尿苷。胞苷脱氨酶涵盖胞苷脱氨酶超家族中的酶,并且特别是apobec家族的酶(酶的apobec1、apobec2、apobec4和apobec3亚组)、活性诱导的胞苷脱氨酶(aid或aicda)和cmp脱氨酶(参见例如conticello等人,mol.biol.evol.22:367-77,2005;conticello,genome biol.9:229,2008;muramatsu等人,j.biol.chem.274:18470-6,1999);carrington等人,cells 9:1690(2020))。
[0057]
如本文所用,术语“apobec3”是指apobec3蛋白,例如由人类apobec3基因座的七个
基因(a3a-a3h)中的任一者表达的apobec3蛋白。apobec3可具有催化dna或rna编辑活性。已描述apobec3a的氨基酸序列(uniprot登录id:p31941)并且作为seq id no:40包括在本文中。在一些实施方案中,apobec3蛋白是人类apobec3蛋白和/或野生型蛋白。变体包括具有与野生型apobec3蛋白相差一个或若干个突变(即取代、缺失、插入),例如一个或若干个单点取代的序列的蛋白。例如,可使用缩短的apobec3序列,例如通过使若干n末端或c末端氨基酸,优选使序列c末端的一个至四个氨基酸缺失。如本文所用,术语“变体”是指与apobec3参考序列同源的等位基因变体、剪接变体和天然或人工突变体。变体为“功能性的”,因为其显示dna或rna编辑的催化活性。在一些实施方案中,apobec3(例如人类apobec3a)具有野生型氨基酸位置57(如在野生型序列中编号)。在一些实施方案中,apobec3(例如人类apobec3a)在氨基酸位置57(如在野生型序列中编号)具有天冬酰胺。
[0058]
如本文所用,“切口酶”是在双链dna中产生单链断裂(也称为“切口”)的酶,即切割dna双螺旋的一条链但不切割另一条链。如本文所用,“经rna引导的dna切口酶”意指具有dna切口酶活性的多肽或多肽复合物,其中dna切口酶活性是序列特异性的并且取决于rna的序列。示例性经rna引导的dna切口酶包括cas切口酶。cas切口酶包括iii型crispr系统的csm或cmr复合物、其cas10、csm1或cmr2亚基、i型crispr系统的级联复合物、其cas3亚基和2类cas核酸酶的切口酶形式。2类cas切口酶包括变体,其中两个催化域中的仅一者失活,其具有经rna引导的dna切口酶活性。2类cas切口酶包括例如cas9(例如spycas9的h840a、d10a或n863a变体)、cpf1、c2c1、c2c2、c2c3、hf cas9(例如n497a、r661a、q695a、q926a变体)、hypacas9(例如n692a、m694a、q695a、h698a变体)、espcas9(1.0)(例如k810a、k1003a、r1060a变体)和espcas9(1.1)(例如k848a、k1003a、r1060a变体)蛋白和其修饰。cpf1蛋白(zetsche等人,cell,163:1-13(2015))与cas9同源并且含有ruvc样蛋白域。zetsche的cpf1序列通过引用整体并入。参见例如zetsche,表s1和表s3。“cas9”涵盖酿脓链球菌(spy)cas9、本文所列的cas9的变体和其等效物。参见例如makarova等人,nat rev microbiol,13(11):722-36(2015);shmakov等人,molecular cell,60:385-397(2015)。
[0059]
如本文所用,术语“融合蛋白”是指包含来自至少两种不同蛋白的蛋白域的杂合多肽。一种蛋白可位于融合蛋白的氨基末端(n末端)部分或羧基末端(c末端)蛋白处,因此分别形成“氨基末端融合蛋白”或“羧基末端融合蛋白”。本文所提供的任一蛋白可通过本领域中已知的任何方法产生。例如,本文所提供的蛋白可经由重组蛋白表达和纯化来产生,其尤其适合于包含肽接头的融合蛋白。重组蛋白表达和纯化的方法是众所周知的,并且包括由green和sambrook,molecular cloning:a laboratory manual(第4版,cold spring harbor laboratory press,cold spring harbor,n.y.(2012))描述的那些方法,所述文献的全部内容通过引用并入本文。
[0060]
如本文所用的术语“接头”是指连接两个相邻分子或部分的化学基团或分子。通常,接头位于两个基团、分子或其他部分之间或由两个基团、分子或其他部分侧接,并且经由共价键彼此连接。在一些实施方案中,接头是一个氨基酸或多个氨基酸(例如肽或蛋白质),例如16个氨基酸残基的“xten”接头或其变体(参见例如实施例;和schellenberger等人,a recombinant polypeptide extends the in vivo half-life of peptides and proteins in a tunable manner.nat.biotechnol.27,1186-1190(2009))。在一些实施方案中,xten接头包含序列sgsetpgtsesatpes(seq id no:900)、sgsetpgtsesa(seq id no:
901)或sgsetpgtsesatpeggsggs(seq id no:902)。在一些实施方案中,接头是包含选自seq id no:903-971的一个或多个序列的肽接头。
[0061]
如本文所用,术语“尿嘧啶糖苷酶抑制剂”或“ugi”是指能够抑制尿嘧啶-dna糖苷酶(udg)碱基切除修复酶的蛋白质。
[0062]
如本文所用,基因的“开放阅读框”或“orf”是指由一系列密码子组成的序列,所述密码子指定所述基因编码的蛋白质的氨基酸序列。orf开始于起始密码子(例如dna中的atg或rna中的aug)并且以终止密码子结束,例如dna中的taa、tag或tga或rna中的uaa、uag或uga。
[0063]
如本文所用,“核糖核蛋白”(rnp)或“rnp复合物”是指引导rna以及经rna引导的dna结合剂,例如cas核酸酶,例如cas裂解酶、切口酶或dcas dna结合剂(例如cas9)。在一些实施方案中,引导rna将经rna引导的dna结合剂,例如cas9引导至目标序列,并且所述引导rna与目标序列杂交并且所述结合剂结合于目标序列;在结合剂为裂解酶或切口酶的情况下,结合之后进行裂解或切口。
[0064]
如本文所用,如果第一序列与第二序列的比对显示整个第二序列的x%或更多位置与第一序列匹配,则第一序列被视为“包含与第二序列具有至少x%同一的序列”。例如,序列aaga包含与序列aag具有100%同一性的序列,这是因为第二序列的全部三个位置均存在匹配,因此比对将得到100%同一性。rna与dna之间的差异(通常,尿苷交换为胸苷或反之亦然)和核苷类似物(例如经修饰的尿苷)的存在不会造成多核苷酸之间同一性或互补性的差异,只要相关核苷酸(例如胸苷、尿苷或经修饰的尿苷)具有相同互补序列(例如对于胸苷、尿苷或经修饰的尿苷全体而言,为腺苷;另一实例为胞嘧啶和5-甲基胞嘧啶,两者都具有鸟苷或经修饰的鸟苷作为互补序列)。因此,例如,序列5
′‑
axg(其中x为任何经修饰的尿苷,例如假尿苷、n1-甲基假尿苷或5-甲氧基尿苷)被视为与aug 100%同一,因为两者与同一序列(5
′‑
cau)完全互补。示例性比对算法是本领域中众所周知的史密斯-沃特曼(smith-waterman)和尼德曼-翁施(needleman-wunsch)算法。本领域技术人员应理解何种算法选择和参数设置适合于待比对的给定序列对;对于具有一般类似长度和针对氨基酸的>50%预期同一性或针对核苷酸的>75%预期同一性的序列而言,由ebi在www.ebi.ac.uk网站服务器提供的尼德曼-翁施算法接口的具有默认设置的尼德曼-翁施算法通常是适合的。
[0065]“mrna”在本文中用于指多核苷酸并且包含可翻译成多肽的开放阅读框(即可充当用于通过核糖体和氨基酰化trna进行的翻译的底物)。mrna可包含磷酸酯-糖主链,其包括核糖残基或其类似物,例如2
′‑
甲氧基核糖残基。在一些实施方案中,mrna磷酸酯-糖主链的糖基本上由核糖残基、2
′‑
甲氧基核糖残基或其组合组成。
[0066]
如本文所用,“插入/缺失”是指由多种核苷酸组成的插入/缺失突变,所述核苷酸例如在目标核酸中的双链断裂(dsb)位点处插入或缺失。
[0067]
如本文所用,细胞上蛋白质的表达“降低或消除”是指相对于未经修饰细胞而言,蛋白质的表达部分或完全损失。在一些实施方案中,通过流式细胞术测量细胞上蛋白质的表面表达,并且相对于未经修饰细胞,具有“降低或消除的”表面表达,如通过用针对蛋白质的相同抗体染色后荧光信号的减少所证明。通过流式细胞术相对于未经修饰细胞具有“降低或消除的”蛋白质表面表达的细胞可称作对于所述蛋白质的表达为“阴性的”,如通过类似于用同型对照抗体染色的细胞的荧光信号所证明。“降低或消除的”蛋白质表达可利用本
领域技术人员已知的适当对照,通过本领域中的其他已知技术来测量。
[0068]
如本文所用,“基因敲低(knockdown)”是指特定基因产物(例如蛋白质、mrna或两者)的表达降低,例如相较于未经编辑的靶序列的表达。蛋白质的基因敲低可通过检测来自样品,例如所关注的组织、体液或细胞群体的蛋白质的总细胞量来测量。其也可通过测量蛋白质的替代物、标志物或活性来测量。用于测量mrna的基因敲低的方法是已知的,并且包括对从所关注样品分离的mrna进行分析。在一些实施方案中,“基因敲低”可指一些特定基因产物的表达缺失,例如经转录的mrna的量下降或由细胞或细胞群体(包括体内群体,例如组织中所发现的那些)表达的蛋白质的量下降。
[0069]
如本文所用,“基因敲除(knockout)”是指细胞中的特定基因或特定蛋白质的表达缺失。基因敲除可导致表达降低至测定的检测水平以下。基因敲除可通过检测细胞、组织或细胞群体中蛋白质的总细胞量来测量。
[0070]
如本文所用,“目标序列”或“基因组目标序列”是指目标基因中与grna的引导序列具有互补性的核酸序列。目标序列与引导序列的相互作用导引经rna引导的dna结合剂结合,并且在目标序列中潜在地切口或裂解(取决于试剂活性)。
[0071]
如本文所用,“治疗”是指用于受试者的疾病或病症的治疗剂的任何施用或施加,并且包括抑制疾病、遏制其发展、减轻疾病的一种或多种症状、治愈疾病、或预防疾病的一种或多种症状,包括症状复发。
[0072]
现将详细参考本发明的某些实施方案,其实施例在附图中加以说明。尽管本发明结合所说明的实施方案加以描述,但应理解它们不旨在将本发明限于那些实施方案。相反,本发明旨在涵盖所有替代方案、修改和等效物,其可包括于如所附权利要求和所包括的实施方案所限定的本发明内。
[0073]
在详细描述本教导内容之前,应了解,本公开不限于特定组合物或方法步骤,因而可加以改变。应注意,除非上下文另外明确规定,否则如本说明书和所附权利要求中所用,单数形式“一(a/an)”和“所述(the)”包括多个参考物。因此,例如,提及“缀合物(a conjugate)”包括多个缀合物并且提及“细胞(a cell)”包括多个细胞等等。
[0074]
数值范围包括限定所述范围的数字。考虑到有效数字和与测量相关的误差,实测值和可测量值应理解为近似值。此外,“包含(comprise/comprises/comprising)”、“含有(contain/contains/containing)”和“包括(include/includes/including)”的使用不希望具有限制性。应理解,前述一般描述与详细描述都只是示例性和解释性的而并不限制教导内容。
[0075]
除非说明书中具体指出,否则本说明书中叙述“包含”各种组分的实施方案也设想为“由所叙述组分组成”或“基本上由所叙述组分组成”;本说明书中叙述“由各种组分组成”的实施方案也设想为“包含”所叙述组分或“基本上由所叙述组分组成”;并且本说明书中叙述“基本上由各种组分组成”的实施方案也设想为“由所叙述组分组成”或“包含”所叙述组分(这种互换性并不适用于这些术语在权利要求书中的使用)。除非上下文另外明确说明,否则术语“或”以包括性意义使用,即等于“和/或”。
[0076]
本文所用的章节标题仅出于组织目的而不应解释为以任何方式限制所需主题。在通过引用并入的任何材料与本说明书中所定义的任何术语或本说明书的任何其他表述内容相矛盾的情况下,以本说明书为准。尽管本发明的教导是与各种实施方案结合描述,但并
不旨在使本发明的教导限制于此类实施方案。相反,如本领域技术人员将了解,本教导内容涵盖各种替代方案、修改和等效物。
[0077]
ii.经基因修饰的细胞
[0078]
a.工程化细胞组合物
[0079]
本公开提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞组合物。在一些实施方案中,工程化细胞组合物包含ciita基因中的基因修饰。在一些实施方案中,工程化细胞是同种异体细胞。在一些实施方案中,具有降低的ii类mhc表达的工程化细胞适用于过继性细胞转移疗法。在一些实施方案中,工程化细胞在细胞基因组中包含额外基因修饰以产生同种异体移植目的所需的细胞。
[0080]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10877360-10923242内的剪接位点的至少一个核苷酸。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含剪接受体位点的至少一个核苷酸的修饰。在一些实施方案中,基因修饰包含剪接受体位点的至少一个核苷酸的修饰,其中一个核苷酸为腺嘌呤(a)。在一些实施方案中,基因修饰包含剪接受体位点的至少一个核苷酸的修饰,其中一个核苷酸为鸟嘌呤(g)。在一些实施方案中,基因修饰包含剪接供体位点的至少一个核苷酸的修饰。在一些实施方案中,基因修饰包含剪接供体位点的至少一个核苷酸的修饰,其中所述一个核苷酸为鸟嘌呤(g)。在一些实施方案中,基因修饰包含剪接供体位点的至少一个核苷酸的修饰,其中一个核苷酸为胸腺嘧啶(t)。在一些实施方案中,基因修饰包含剪接位点边界核苷酸的修饰。
[0081]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的至少5个连续核苷酸。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞在ciita基因中包含基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的至少6、7、8、9或10个连续核苷酸。
[0082]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的至少一个c至t取代或至少一个a至g取代。
[0083]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10903873-chr:10923242内的剪接位点的至少一个核苷酸。
[0084]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr:16:10906485-chr:10923242内的剪接位点的至少一个核苷酸。
[0085]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标
chr16:10908130-chr:10923242内的剪接位点的至少一个核苷酸。
[0086]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。
[0087]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470。
[0088]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。
[0089]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。
[0090]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所述基因修饰包含基因组坐标chr16:10908132-10908152内的剪接位点的至少一个核苷酸。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,所
10902799、chr16:10902788-10902808、chr16:10902789-10902809、chr16:10902790-10902810、chr16:10902795-10902815、chr16:10902799-10902819、chr16:10903708-10903728、chr16:10903713-10903733、chr16:10903718-10903738、chr16:10903721-10903741、chr16:10903723-10903743、chr16:10903724-10903744、chr16:10903873-10903893、chr16:10903878-10903898、chr16:10903905-10903925、chr16:10903906-10903926、chr16:10904736-10904756、chr16:10904790-10904810、chr16:10904811-10904831、chr16:10906481-10906501、chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0095]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0096]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0097]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr1 6:10908132-10908152、chr1 6:10908131-10908151、chr1 6:10916456-10916476、chr1 6:10918504-10918524、chr1 6:10909022-10909042、chr1 6:10918512-10918532、chr1 6:10918511-10918531、chr1 6:10895742-10895762、chr1 6:10916362-10916382、chr1 6:10916455-10916475、chr1 6:10909172-10909192、chr1 6:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0098]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。
[0099]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10908132-10908152内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10908131-10908151内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10916456-10916476内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,相对
于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10918504-10918524内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0100]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0101]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。在一些实施方案中,所述基因修饰包含基因组坐标内的至少5个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。在一些实施方案中,所述基因修饰包含基因组坐标内的至少一个c至t取代或至少一个a至g取代。
[0102]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。
[0103]
在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10918504-10918524内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10923218-10923238内的插入/缺失、c至t取代或a至g取代。在一些实施方案中,相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标
10902815、chr16:10902799-10902819、chr16:10903708-10903728、chr16:10903713-10903733、chr16:10903718-10903738、chr16:10903721-10903741、chr16:10903723-10903743、chr16:10903724-10903744、chr16:10903873-10903893、chr16:10903878-10903898、chr16:10903905-10903925、chr16:10903906-10903926、chr16:10904736-10904756、chr16:10904790-10904810、chr16:10904811-10904831、chr16:10906481-10906501、chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0105]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少10个连续核苷酸:chr16:10903873-10903893、chr16:10903878-10903898、chr16:10903905-10903925、chr16:10903906-10903926、chr16:10904736-10904756、chr16:10904790-10904810、chr16:10904811-10904831、chr16:10906481-10906501、chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、
chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10903873-10903893、chr16:10903878-10903898、chr16:10903905-10903925、chr16:10903906-10903926、chr16:10904736-10904756、chr16:10904790-10904810、chr16:10904811-10904831、chr16:10906481-10906501、chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0106]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少10个连续核苷酸:chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、
chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0107]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少10个连续核苷酸:chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、
chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0108]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0109]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234。在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0110]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0111]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10908132-10908152内的至少5个连续核苷酸:在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10908131-10908151内的至少5个连续核苷酸:在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10916456-10916476内的至少5个连续核苷酸:在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而
降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10918504-10918524内的至少5个连续核苷酸:在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0112]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶和经rna引导的切口酶。在一些实施方案中,脱氨酶为apobec3脱氨酶,例如apobec3a(a3a)。
[0113]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶和经rna引导的切口酶。在一些实施方案中,脱氨酶为apobec3脱氨酶,例如apobec3a(a3a)。
[0114]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶和经rna引导的切口酶。在一些实施方案中,脱氨酶为apobec3脱氨酶,例如
apobec3a(a3a)。
[0115]
在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标:10918504-10918524内的至少5个连续核苷酸:在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10923218-10923238内的至少5个连续核苷酸:在一些实施方案中,提供了一种工程化细胞,其通过结合至ciita基因组目标序列的基因编辑系统而降低或消除ii类mhc的表面表达,所述目标序列包含基因组坐标chr16:10923219-10923239内的至少5个连续核苷酸:在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。在一些实施方案中,ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶和经rna引导的切口酶。在一些实施方案中,脱氨酶为apobec3脱氨酶,例如apobec3a(a3a)。
[0116]
在一些实施方案中,对于基因组坐标的每个给定范围,范围可涵盖指定坐标的任一端上的+/-10个核苷酸。对于基因组坐标的每个给定范围,范围可涵盖指定坐标的任一端上的+/-5个核苷酸。例如,如果给出chr16:10923222-10923242,则在一些实施方案中,基因组目标序列或基因修饰可落在chr16:10923212-10923252内。
[0117]
在一些实施方案中,基因组坐标的给定范围可包含dna的两条链(即,正(+)链和负(-)链)上的目标序列。
[0118]
ciita基因中的基因修饰进一步描述于本文中。在一些实施方案中,ciita基因中的基因修饰包含目标序列中至少一个核苷酸的插入、缺失、取代或脱氨中的任何一者或多者。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰使剪接位点失活。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含剪接位点核苷酸处的插入。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含剪接位点核苷酸的缺失。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含剪接位点核苷酸的取代。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含剪接位点核苷酸的脱氨。
[0119]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含如本文所述的ciita基因中的基因修饰,并且其中所述细胞进一步具有降低或消除的hla-a的表面表达。在一些实施方案中,工程化细胞包含hla-a基因中的基因修饰。在一些实施方案中,工程化细胞包含hla-a基因中的基因修饰,并且其中所述细胞对hla-b为同型接合的并且对hla-c为同型接合的。在一些实施方案中,工程化细胞包含消除工程化细胞表面上hla-a蛋白的表达的基因修饰。
[0120]
本文所述的工程化人类细胞可包含hla-a基因的任何hla-a等位基因中的基因修饰。hla基因位于染色体6中称为hla超基因座的基因组区域中;本领域中已报道数百个hla-a等位基因(参见例如shiina等人,nature 54:15-39(2009)。hla-a等位基因的序列是本领域中可获得的(参见例如用于检索特定hla-a等位基因的序列的ipd-imgt/hla数据库https://www.ebi.ac.uk/ipd/imgt/hla/allele.html)。
[0121]
在以上实施方案中的任一者中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至ch6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;ch6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0122]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的
基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0123]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chhr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:
29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0124]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组
坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0125]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173、chr16:10916450-10916470、chr16:10923222-10923242、chr16:10916449-10916469和chr16:10923214-10923234,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的
基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0126]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906485-10906505、chr16:10916359-10916379、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10922153-10922173和chr16:10916450-10916470,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的
基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0127]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239,并且其中细胞进一步包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942854至chr6:29942913和chr6:29943518至chr6:29943619。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:
29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞包含hla-a基因中的基因修饰,并且其中hla-a基因中的基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞的hla-a表达通过结合至hla-a基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0128]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步具有降低或消除的i类mhc的表面表达。在一些实施方案中,工程化细胞包含β-2-微球蛋白(b2m)基因中的基因修饰。在一些实施方案中,工程化细胞包含降低工程化细胞表面上i类mhc蛋白的表达的基因修饰。
[0129]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步包含外源核酸。在一些实施方案中,外源核酸编码表达于工程化细胞的表面上的靶向受体。在一些实施方案中,靶向受体为嵌合抗原受体(car)。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为t细胞受体(tcr)。在一些实施方案中,靶向受体为wt1 tcr。在一些实施方案中,靶向受体为杂合car/tcr。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr的亚基)。在一些实施方案中,靶向受体为细胞因子受体。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为b细胞受体(bcr)。在一些实施方案中,外源核酸编码由工程化细胞分泌的多肽(即可溶性多肽)。在一些实施方案中,外源核酸编码治疗多肽。在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码酶。在一些实施方案中,外源核酸编码细胞因子。在一些实施方案中,外源核酸编码趋化因子。在一些实施方案中,外源核酸编码融合蛋白。
[0130]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,其中所述细胞进一步具有降低或消除的i类mhc的表面表达,并且其中所述细胞进一步包含外源核酸。在一些实施方案
中,工程化细胞包含β-2-微球蛋白(b2m)基因中的基因修饰。在一些实施方案中,工程化细胞包含降低工程化细胞表面上i类mhc蛋白的表达的基因修饰。在一些实施方案中,外源核酸编码表达于工程化细胞的表面上的靶向受体。在一些实施方案中,靶向受体为嵌合抗原受体(car)。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为t细胞受体(tcr)。在一些实施方案中,靶向受体为wt1 tcr。在一些实施方案中,靶向受体为杂合car/tcr。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr的亚基)。在一些实施方案中,靶向受体为细胞因子受体。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为b细胞受体(bcr)。在一些实施方案中,外源核酸编码由工程化细胞分泌的多肽(即可溶性多肽)。在一些实施方案中,外源核酸编码治疗多肽。在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码酶。在一些实施方案中,外源核酸编码细胞因子。在一些实施方案中,外源核酸编码趋化因子。在一些实施方案中,外源核酸编码融合蛋白。
[0131]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902662-chr16:10923285内的外显子的至少一个核苷酸,其中所述细胞进一步具有降低或消除的hla-a的表面表达,并且其中所述细胞进一步包含外源核酸。在一些实施方案中,工程化细胞包含hla-a基因中的基因修饰。在一些实施方案中,工程化细胞包含降低工程化细胞表面上hla-a蛋白的表达的基因修饰。在一些实施方案中,外源核酸编码表达于工程化细胞的表面上的靶向受体。在一些实施方案中,靶向受体为嵌合抗原受体(car)。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为t细胞受体(tcr)。在一些实施方案中,靶向受体为wt1 tcr。在一些实施方案中,靶向受体为杂合car/tcr。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr的亚基)。在一些实施方案中,靶向受体为细胞因子受体。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为b细胞受体(bcr)。在一些实施方案中,外源核酸编码由工程化细胞分泌的多肽(即可溶性多肽)。在一些实施方案中,外源核酸编码治疗多肽。在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码酶。在一些实施方案中,外源核酸编码细胞因子。在一些实施方案中,外源核酸编码趋化因子。在一些实施方案中,外源核酸编码融合蛋白。
[0132]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步具有相对于未经修饰细胞降低或消除的内源性tcr蛋白表达。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步包含外源核酸,并且进一步具有相对于未经修饰细胞降低或消除的内源性tcr蛋白表达。在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步具有降低或消除的i类mhc的表面表达,并且其中所述细胞进一步具
有相对于未经修饰细胞降低或消除的内源性tcr蛋白表达。
[0133]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902171-10923242内的剪接位点的至少一个核苷酸,并且其中所述细胞进一步包含外源核酸,并且其中所述细胞进一步具有降低或消除的i类mhc的表面表达,并且其中所述细胞进一步具有相对于未经修饰细胞降低或消除的内源性tcr蛋白表达。在一些实施方案中,工程化细胞具有相对于未经修饰细胞降低或消除的trac蛋白表达。在一些实施方案中,工程化细胞具有相对于未经修饰细胞降低或消除的trbc蛋白表达。在一些实施方案中,工程化细胞包含β-2-微球蛋白(b2m)基因中的基因修饰。在一些实施方案中,工程化细胞包含降低工程化细胞表面上i类mhc蛋白的表达的基因修饰。在一些实施方案中,外源核酸编码表达于工程化细胞的表面上的靶向受体。在一些实施方案中,靶向受体为嵌合抗原受体(car)。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为t细胞受体(tcr)。在一些实施方案中,靶向受体为wt1 tcr。在一些实施方案中,靶向受体为杂合car/tcr。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr的亚基)。在一些实施方案中,靶向受体为细胞因子受体。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为b细胞受体(bcr)。在一些实施方案中,外源核酸编码由工程化细胞分泌的多肽(即可溶性多肽)。在一些实施方案中,外源核酸编码治疗多肽。在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码酶。在一些实施方案中,外源核酸编码细胞因子。在一些实施方案中,外源核酸编码趋化因子。在一些实施方案中,外源核酸编码融合蛋白。
[0134]
在一些实施方案中,提供了相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达的工程化细胞,其包含ciita基因中的基因修饰,其中所述修饰包含基因组坐标chr16:10902662-chr16:10923285内的外显子的至少一个核苷酸,并且其中所述细胞进一步包含外源核酸,并且其中所述细胞进一步具有降低或消除的hla-a的表面表达,并且其中所述细胞进一步具有相对于未经修饰细胞降低或消除的内源性tcr蛋白表达。在一些实施方案中,工程化细胞具有相对于未经修饰细胞降低或消除的trac蛋白表达。在一些实施方案中,工程化细胞具有相对于未经修饰细胞降低或消除的trbc蛋白表达。在一些实施方案中,工程化细胞包含hla-a基因中的基因修饰。在一些实施方案中,工程化细胞包含降低工程化细胞表面上hla-a蛋白的表达的基因修饰。在一些实施方案中,外源核酸编码表达于工程化细胞的表面上的靶向受体。在一些实施方案中,靶向受体为嵌合抗原受体(car)。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为t细胞受体(tcr)。在一些实施方案中,靶向受体为wt1 tcr。在一些实施方案中,靶向受体为杂合car/tcr。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr的亚基)。在一些实施方案中,靶向受体为细胞因子受体。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为b细胞受体(bcr)。在一些实施方案中,外源核酸编码由工程化细胞分泌的多肽(即可溶性多肽)。在一些实施方案中,外源核酸编码治疗多肽。在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码酶。在一些实施方案中,外源核酸编码细胞因子。在一些实施方案中,外源核酸编码趋化因子。在一些实施方案中,外源核酸编码融合蛋白。
[0135]
工程化细胞可为本文所公开的示例性细胞类型中的任一者。在一些实施方案中,工程化细胞为免疫细胞。在一些实施方案中,工程化细胞为造血干细胞(hsc)。在一些实施方案中,工程化细胞为诱导多能干细胞(ipsc)。在一些实施方案中,工程化细胞为单核细胞、巨噬细胞、肥大细胞、树突状细胞或颗粒细胞。在一些实施方案中,工程化细胞为单核细胞。在一些实施方案中,工程化细胞为巨噬细胞。在一些实施方案中,工程化细胞为肥大细胞。在一些实施方案中,工程化细胞为树突状细胞。
[0136]
在一些实施方案中,工程化细胞为颗粒细胞。在一些实施方案中,工程化细胞为淋巴细胞。在一些实施方案中,工程化细胞为t细胞。在一些实施方案中,工程化细胞为cd4+ t细胞。在一些实施方案中,工程化细胞为cd8+ t细胞。在一些实施方案中,工程化细胞为记忆t细胞。在一些实施方案中,工程化细胞为b细胞。在一些实施方案中,工程化细胞为血浆b细胞。在一些实施方案中,工程化细胞为记忆b细胞。
[0137]
在一些实施方案中,工程化细胞对hla-b为同型接合的并且对hla-c为同型接合的。在一些实施方案中,hla-b等位基因选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02。
[0138]
在一些实施方案中,hla-c等位基因选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:01;hla-c*04:01;和hla-c*02:02。
[0139]
在一些实施方案中,hla-b等位基因选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02;并且hla-c等位基因选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:01;hla-c*04:01和hla-c*02:02。
[0140]
在一些实施方案中,工程化细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是选自以下hla-b和hla-c等位基因中的任一者:hla-b*07:02和hla-c*07:02;hla-b*08:01和hla-c*07:01;hla-b*44:02和hla-c*05:01;hla-b*35:01
和hla-c*04:01;hla-b*40:01和hla-c*03:04;hla-b*57:01和hla-c*06:02;hla-b*14:02和hla-c*08:02;hla-b*15:01和hla-c*03:03;hla-b*13:02和hla-c*06:02;hla-b*44:03和hla-c*16:01;hla-b*38:01和hla-c*12:03;hla-b*18:01和hla-c*07:01;hla-b*44:03和hla-c*04:01;hla-b*51:01和hla-c*15:02;hla-b*49:01和hla-c*07:01;hla-b*15:01和hla-c*03:04;hla-b*18:01和hla-c*12:03;hla-b*27:05和hla-c*02:02;hla-b*35:03和hla-c*04:01;hla-b*18:01和hla-c*05:01;hla-b*52:01和hla-c*12:02;hla-b*51:01和hla-c*14:02;hla-b*37:01和hla-c*06:02;hla-b*53:01和hla-c*04:01;hla-b*55:01和hla-c*03:03;hla-b*44:02和hla-c*07:04;hla-b*44:03和hla-c*07:01;hla-b*35:02和hla-c*04:01;hla-b*15:01和hla-c*04:01;以及hla-b*40:02和hla-c*02:02。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*07:02和hla-c*07:02。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*08:01和hla-c*07:01。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*44:02和hla-c*05:01。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*35:01和hla-c*04:01。
[0141]
在一些实施方案中,本公开提供了一种药物组合物,其包含本文所公开的任一种工程化细胞。在一些实施方案中,药物组合物包含本文所公开的任一种工程化细胞的群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少65%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少70%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少80%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少90%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少91%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少92%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少93%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少94%阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少95%内源性tcr蛋白阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少97%内源性tcr蛋白阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少98%内源性tcr蛋白阴性的工程化细胞群体。在一些实施方案中,药物组合物包含如通过流式细胞术所测量至少99%内源性tcr蛋白阴性的工程化细胞群体。
[0142]
在一些实施方案中,提供了用于向有需要的受试者施用本文所公开的工程化细胞或药物组合物的方法。在一些实施方案中,提供了用于向受试者施用作为act疗法的本文所公开的工程化细胞或药物组合物的方法。在一些实施方案中,提供了用于向受试者施用作为癌症治疗的本文所公开的工程化细胞或药物组合物的方法。在一些实施方案中,提供了用于向受试者施用作为自身免疫疾病治疗的本文所公开的工程化细胞或药物组合物的方法。在一些实施方案中,提供了用于向受试者施用作为感染性疾病治疗的本文所公开的工程化细胞或药物组合物的方法。
[0143]
b.用于降低或消除ii类mhc的表面表达的方法和组合物
[0144]
本公开提供了通过基因修饰ciita基因而相对于未经修饰细胞降低或消除细胞上ii类mhc蛋白质的表面表达的方法和组合物。所得经基因修饰的细胞在本文中也称为工程化细胞。在一些实施方案中,已经基因修饰的(或工程化)细胞可为使用本文所提供的方法或组合物进行进一步基因修饰的起始细胞。在一些实施方案中,细胞为同种异体细胞。在一些实施方案中,具有降低的ii类mhc表达的细胞适用于过继性细胞转移疗法。在一些实施方案中,ciita基因的编辑与额外基因修饰组合以产生同种异体移植目的所需的细胞。
[0145]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表面表达,其包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0146]
在一些实施方案中,方法包括制造工程化细胞,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc蛋白的表面表达,所述方法包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0147]
在一些实施方案中,方法包括基因修饰细胞以降低或消除ii类mhc蛋白的表面表达,其包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,
ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0148]
在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0149]
在一些实施方案中,方法包括在ciita中诱导dsb或单链断裂(ssb),其包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0150]
在一些实施方案中,方法包括降低细胞中ciita蛋白的表达,其包括将组合物递送至细胞,包括使细胞与含有包含引导序列的ciita引导rna的组合物接触,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,方法还包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,细胞(即,工程化细胞)表面上的ii类mhc蛋白表达由
此降低。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0151]
在一些实施方案中,降低细胞表面上ii类mhc蛋白的表达的方法包括使细胞与本文所公开的ciita引导rna中的任何一者或多者接触。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0152]
在一些实施方案中,提供了含有包含引导序列的ciita引导rna的组合物,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,组合物进一步包含经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。在一些实施方案中,组合物包含经rna引导的dna结合剂,所述结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂为酿脓链球菌cas9。在一些实施方案中,ciita引导rna为酿脓链球菌cas9引导rna。在一些实施方案中,经rna引导的dna结合剂包含脱氨酶区域。在一些实施方案中,经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0153]
在一些实施方案中,组合物进一步包含尿嘧啶糖苷酶抑制剂(ugi)。在一些实施方案中,组合物包含经rna引导的dna结合剂,所述经rna引导的dna结合剂通过ciita基因组目标序列产生胞嘧啶(c)向胸腺嘧啶(t)的转化。在一些实施方案中,组合物包含经rna引导的dna结合剂,所述经rna引导的dna结合剂通过ciita基因组目标序列产生腺苷(a)向鸟嘌呤(g)的转化。
[0154]
在一些实施方案中,提供了由本文所述的方法产生的工程化细胞。在一些实施方案中,由本文所述的方法和组合物产生的工程化细胞为同种异体细胞。在一些实施方案中,方法产生包含ii类mhc表达经降低的工程化细胞的组合物。在一些实施方案中,方法产生包含ciita蛋白表达经降低的工程化细胞的组合物。在一些实施方案中,方法产生包含细胞核中的ciita水平经降低的工程化细胞的组合物。在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞表达ciita蛋白的截短形式。在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞不产生可检测ciita蛋白。在一些实施方案中,相比于未经修饰细胞,工程化细胞具有降低的ii类mhc表达、降低的ciita蛋白和/或降低的细胞核中的ciita水平。在一些实施方案中,如在含有cd4+ t 细胞的体外细胞培养测定中所测量,相比于未经修饰细胞,由本文所公开的方法产生的工程化细胞由cd4+ t细胞引发的反应降低。
[0155]
在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含剪接受体位点的至少一个核苷酸的修饰。在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含剪接供体位点的至少一个核苷酸的修饰。
[0156]
在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因
修饰包含基因组坐标chr16:10902171-10923242内的至少5个连续核苷酸。在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸。在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含基因组坐标chr16:10902171-10923242内的至少一个c至t取代或至少一个a至g取代。
[0157]
在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含基因组坐标chr16:10903873-chr:10923242内的剪接位点的至少一个核苷酸。在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含基因组坐标chr:16:10906485-chr:10923242内的剪接位点的至少一个核苷酸。在一些实施方案中,提供了由本文所公开的方法或组合物产生的工程化细胞,其中细胞具有降低或消除的ii类mhc蛋白的表面表达,并且其中细胞包含基因修饰,所述基因修饰包含基因组坐标chr16:10908130-chr:10923242内的剪接位点的至少一个核苷酸。
[0158]
在一些实施方案中,本文所公开的组合物还包含药学上可接受的载体。在一些实施方案中,提供了由包含药学上可接受的载体的本文所公开的组合物产生的细胞。在一些实施方案中,提供了包含本文所公开的细胞的组合物。
[0159]
1.ciita引导rna
[0160]
本文所提供的方法和组合物公开了适用于降低细胞表面上ii类mhc蛋白质的表达的ciita引导rna。在一些实施方案中,此类引导rna将经rna引导的dna结合剂导引至ciita基因组目标序列,并且可在本文中称为“ciita引导rna”。在一些实施方案中,ciita引导rna将经rna引导的dna结合剂导引至人类ciita基因组目标序列。在一些实施方案中,ciita引导rna包含选自seq id no:1-101的引导序列。
[0161]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,其中ciita引导rna靶向包含基因组坐标chr16:10903873-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,其中ciita引导rna靶向包含基因组坐标chr:16:10906485-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,其中ciita引导rna靶向包含基因组坐标chr16:10908130-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。
[0162]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导
序列,所述引导序列靶向包含剪接受体位点的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,剪接受体位点的一个核苷酸为a。在一些实施方案中,剪接受体位点的一个核苷酸为g。在一些实施方案中,一个核苷酸为剪接受体位点的剪接位点边界核苷酸。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列靶向包含剪接供体位点的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,剪接供体位点的一个核苷酸为g。在一些实施方案中,剪接供体位点的一个核苷酸为u/t。在一些实施方案中,一个核苷酸为剪接供体位点的剪接位点边界核苷酸。
[0163]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr16:10903873-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr:16:10906485-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr16:10908130-chr:10923242内的至少一个核苷酸的ciita基因组目标序列。
[0164]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。
[0165]
在一些实施方案中,方法和组合物公开了一种ciita引导rna,其导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割。在其中经rna引导的dna切割剂为cas9的实施方案中,切割或“切割位点”出现在相对于原间隔序列相邻基序(pam)序列的第三碱基处。
[0166]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中切割位点位于受体剪接位点边界核苷酸的3
′
。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸5个核苷酸或更少
的ciita基因中进行切割,其中切割位点位于受体剪接位点边界核苷酸的5
′
。
[0167]
在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中切割位点位于供体剪接位点边界核苷酸的3
′
。在一些实施方案中,本文所公开的方法和组合物包含ciita引导rna,其包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸5个核苷酸或更少的ciita基因中进行切割,其中切割位点位于供体剪接位点边界核苷酸的5
′
。
[0168]
在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸4个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸3个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸2个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离受体剪接位点边界核苷酸1个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在受体剪接位点边界核苷酸处的ciita基因中进行切割。
[0169]
在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸4个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸3个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸2个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在距离供体剪接位点边界核苷酸1个核苷酸或更少的ciita基因中进行切割。在一些实施方案中,ciita引导物包含引导序列,其导引经rna引导的dna结合剂,以在供体剪接位点边界核苷酸处的ciita基因中进行切割。
[0170]
在一些实施方案中,提供了一种组合物,其包含本文所述的ciita引导rna和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0171]
在一些实施方案中,提供了一种含有包含引导序列的ciita单引导rna(sgrna)的组合物,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,提供了一种组合物,其包含本文所述的ciitasgrna和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0172]
在一些实施方案中,提供了一种含有包含引导序列的ciita双引导rna(dgrna)的组合物,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割,其中ciita引导物靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的基因组目标。在一些实施方案中,提供了一种组合物,
其包含本文所述的ciitadgrna和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0173]
示例性ciita引导序列如下表1中所示(seq id no:1-101与对应引导rna序列seq id no:200-300和301-401)。
[0174]
表1.示例性ciita引导序列。
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。
[0211]
在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。在一些实施方案中,基因修饰包含基因组坐标chr16:10908132-10908152内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10908131-10908151内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10916456-10916476内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10918504-10918524内的剪接位点的至少一个核苷酸。
[0212]
在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512、chr16:10906487-10906507。
[0213]
在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。
[0214]
在一些实施方案中,基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。在一些实施方案中,基因修饰包含基因组坐标chr16:10918504-10918524内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10923218-10923238内的剪接位点的至少一个核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10923219-10923239内的剪接位点的至少一个核苷酸。
[0215]
在一些实施方案中,基因修饰包含基因组坐标chr16:10902171-10923242内的至少5个连续核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸。在一些实施方案中,基因修饰包含基因组坐标chr16:10902171-10923242内的至少一个c至t取代或至少一个a至g取代。
[0216]
在一些实施方案中,对ciita的修饰包含目标序列中至少一个核苷酸的插入、缺失、取代或脱氨中的任何一者或多者。在一些实施方案中,对ciita的修饰包含目标序列中1、2、3、4或5个或更多个核苷酸的插入。在一些实施方案中,对ciita的修饰包含目标序列中1、2、3、4或5个或更多个核苷酸的缺失。在其他实施方案中,对ciita的修饰包含目标序列中
1、2、3、4、5、6、7、8、9、10、15、20或25个或更多个核苷酸的插入。在其他实施方案中,对ciita的修饰包含目标序列中1、2、3、4、5、6、7、8、9、10、15、20或25个或更多个核苷酸的缺失。在一些实施方案中,对ciita的修饰包含插入/缺失,其通常在本领域中定义为小于1000个碱基对(bp)的插入或缺失。在一些实施方案中,对ciita的修饰包含引起目标序列中的移码突变的插入/缺失。在一些实施方案中,对ciita的修饰包含目标序列中1、2、3、4、5、6、7、8、9、10、15、20或25个或更多个核苷酸的取代。在一些实施方案中,对ciita的修饰包含由并入模板核酸产生的核苷酸插入、缺失或取代中的一者或多者。在一些实施方案中,对ciita的修饰包含目标序列中供体核酸的插入。在一些实施方案中,对ciita的修饰并非暂时的。
[0217]
在一些实施方案中,剪接位点的至少一个核苷酸经修饰。在一些实施方案中,剪接受体位点的至少一个核苷酸经修饰。在一些实施方案中,剪接供体位点的至少一个核苷酸经修饰。在一些实施方案中,受体剪接位点边界核苷酸经修饰。在一些实施方案中,供体剪接位点边界核苷酸经修饰。在一些实施方案中,剪接受体位点的保守核苷酸中的一者经修饰。在一些实施方案中,剪接受体位点的保守核苷酸a经修饰。在一些实施方案中,剪接受体位点的保守核苷酸g经修饰。在一些实施方案中,剪接供体位点的保守核苷酸中的一者经修饰。在一些实施方案中,剪接供体位点的保守核苷酸g经修饰。在一些实施方案中,剪接供体位点的保守核苷酸t经修饰。
[0218]
在一些实施方案中,位于距离受体剪接位点边界核苷酸5个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离受体剪接位点边界核苷酸4个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离受体剪接位点边界核苷酸3个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离受体剪接位点边界核苷酸2个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离受体剪接位点边界核苷酸1个核苷酸或更少的核苷酸经修饰。
[0219]
在一些实施方案中,位于距离供体剪接位点边界5个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离供体剪接位点边界核苷酸4个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离供体剪接位点边界核苷酸3个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离供体剪接位点边界核苷酸2个核苷酸或更少的核苷酸经修饰。在一些实施方案中,位于距离供体剪接位点边界核苷酸1个核苷酸或更少的核苷酸经修饰。
[0220]
在一些实施方案中,本文所公开的方法和组合物使用经rna引导的dna结合剂(例如cas酶)修饰细胞中ciita的剪接位点。在一些实施方案中,经rna引导的dna结合剂为cas9。在一些实施方案中,经rna引导的dna结合剂切割距离剪接位点边界核苷酸5个核苷酸或更少的ciita,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,经rna引导的dna结合剂切割距离剪接位点边界核苷酸4个核苷酸或更少的ciita,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,经rna引导的dna结合剂切割距离剪接位点边界核苷酸3个核苷酸或更少的ciita,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,经rna引导的dna结合剂切割距离剪接位点边界核苷酸2个核苷酸或更少的ciita,其中ciita引导rna靶向包含基因组坐标
chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,经rna引导的dna结合剂切割距离剪接位点边界核苷酸1个核苷酸或更少的ciita,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,经rna引导的dna结合剂切割剪接位点边界核苷酸处的ciita,其中ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。在一些实施方案中,剪接位点边界核苷酸为受体剪接位点边界核苷酸。在一些实施方案中,剪接位点边界核苷酸为供体剪接位点边界核苷酸。
[0221]
在一些实施方案中,对ciita的基因修饰使剪接位点失活,即,剪接不在经修饰的剪接位点处发生。在一些实施方案中,对ciita的基因修饰使剪接受体位点失活。在一些实施方案中,对ciita的基因修饰使剪接供体位点失活。
[0222]
在一些实施方案中,对ciita的剪接位点的基因修饰去除剪接位点的所有三个核苷酸。在一些实施方案中,基因修饰去除剪接位点的2个核苷酸。在一些实施方案中,基因修饰去除剪接位点的1个核苷酸。在一些实施方案中,对ciita的剪接位点的基因修饰去除剪接受体位点的1或2个核苷酸。在一些实施方案中,对ciita的剪接位点的基因修饰去除剪接供体位点的1或2个核苷酸。在一些实施方案中,剪接位点的至少1个核苷酸经删除。在一些实施方案中,剪接位点的至少2个核苷酸经删除。在一些实施方案中,受体剪接位点边界核苷酸经删除。在一些实施方案中,供体剪接位点边界核苷酸经删除。
[0223]
在一些实施方案中,对ciita的基因修饰导致使用框外终止密码子。在一些实施方案中,对ciita的基因修饰导致剪接期间的外显子跳跃。在一些实施方案中,对ciita的基因修饰导致细胞的ciita蛋白表达降低。在一些实施方案中,对ciita的基因修饰导致细胞核中的ciita减少。在一些实施方案中,对ciita的剪接位点的修饰导致细胞表面上的ii类mhc蛋白表达降低。
[0224]
在一些实施方案中,对ciita的基因修饰产生ciita蛋白的截短形式。在一些实施方案中,经截短的ciita蛋白不结合至gtp。在一些实施方案中,经截短的ciita蛋白不定位至细胞核。在一些实施方案中,相比于野生型ciita蛋白与调节ii类mhc表达相关的活性,ciita蛋白(例如ciita蛋白的截短形式)的活性受损。在一些实施方案中,细胞表面上的ii类mhc表达由于ciita蛋白活性受损而降低。在一些实施方案中,细胞表面上的ii类mhc表达由于ciita蛋白活性受损而不存在。
[0225]
3.ciita引导rna的功效
[0226]
ciita引导rna的功效可通过本领域中可用的技术测定,所述技术评估目标细胞中引导rna的编辑效率、ciita蛋白和/或mrna的水平和/或ii类mhc的水平。在一些实施方案中,细胞表面上hla-a蛋白的降低或消除可通过与未经修饰细胞(或“相对于未经修饰细胞”)比较来测定。工程化细胞或细胞群体也可与未经修饰细胞群体进行比较。
[0227]
在一些实施方案中,ciita引导rna的功效是通过测量细胞中ciita蛋白的水平来测定。ciita蛋白的水平可通过例如细胞溶解物和使用抗ciita抗体的蛋白质印迹来检测。在一些实施方案中,ciita引导rna的功效是通过测量细胞核中ciita蛋白的水平来测定。在一些实施方案中,ciita引导rna的功效是通过测量细胞中ciita mrna的水平来测定。ciita mrna的水平可通过例如rt-pcr来检测。在一些实施方案中,相比于未经修饰细胞,目标细胞
中ciita蛋白和/或ciita mrna水平降低指示有效的剪接位点ciita引导rna。
[0228]“未经修饰细胞”(unmodified cell/unmodified cells)是指实验或测试中相同细胞类型的对照细胞(control cell/control cells),其中“未经修饰的”对照细胞尚未与ciita引导物接触(即,非工程化细胞)。因此,未经修饰细胞(unmodified cell/uhmodified cells)可为尚未与引导rna接触的细胞,或已与不靶向ciita的引导rna接触的细胞。
[0229]
在一些实施方案中,ciita引导rna的功效是通过测量目标细胞的ii类mhc蛋白表达的降低或消除来测定。ciita蛋白充当反式激活因子,激活ii类mhc启动子,并且对ii类mhc蛋白质的表达至关重要。在一些实施方案中,可在目标细胞的表面上检测ii类mhc蛋白表达。在一些实施方案中,ii类mhc蛋白表达是通过流式细胞术测量。在一些实施方案中,针对ii类mhc蛋白的抗体(例如抗hla-dr、-dq、-dp)可用于检测ii类mhc蛋白表达,例如通过流式细胞术。在一些实施方案中,相比于未经修饰细胞(或未经修饰细胞群体),细胞(或细胞群体)表面上ii类mhc蛋白的降低或消除指示有效ciita引导rna。在一些实施方案中,已与根据流式细胞术对ii类mhc蛋白呈阴性的特定ciita引导rna和经rna引导的dna结合剂接触的细胞(或细胞群体)指示有效ciita引导rna。
[0230]
在一些实施方案中,ii类mhc蛋白表达在使用本文所公开的方法和组合物的细胞群体中降低或消除。在一些实施方案中,相对于未经修饰细胞群体,细胞群体经富集(例如通过facs或macs)并且为至少65%、70%、80%、90%、91%、92%、93%或94%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体未经富集(例如通过facs或macs)并且为至少65%、70%、80%、90%、91%、92%、93%或94%ii类mhc阴性,如通过流式细胞术所测量。
[0231]
在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少65%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少70%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少80%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少90%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少91%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少92%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少93%ii类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少94%ii类mhc阴性,如通过流式细胞术所测量。
[0232]
在一些实施方案中,ciita引导rna的功效(即引导rna的效力)与(例如由cas9产生的)基因组目标序列中的切割位点相对于ciita中的剪接位点边界核苷酸之间的距离有关。在一些实施方案中,距离(以切割位点与剪接位点边界核苷酸之间的核苷酸数目计算)与ii类mhc表达的损失之间存在相关性。在一些实施方案中,剪接位点边界核苷酸与切割位点(例如,由cas9产生)之间的距离越短,目标细胞的ii类mhc表达的降低越大。在一些实施方案中,ciita中的剪接位点边界核苷酸与基因组目标序列中的切割位点之间的距离为5个核苷酸或更少、4个核苷酸或更少、3个核苷酸或更少、2个核苷酸或更少或1个核苷酸或更少。在一些实施方案中,切割位点位于剪接位点边界核苷酸的5
′
。在一些实施方案中,切割位点位于剪接位点边界核苷酸的3
′
。在一些实施方案中,ciita剪接位点边界为受体剪接位点边
界核苷酸。在一些实施方案中,ciita剪接位点边界为供体剪接位点边界核苷酸。
[0233]
在一些实施方案中,有效ciita引导rna可通过测量体外或体内免疫细胞(例如cd4+ t细胞)对经基因修饰的目标细胞的反应来测定。cd4+ t细胞反应可通过测量cd4+ t细胞的活化反应(例如cd4+ t细胞增殖)、活化标志物的表达和/或细胞因子产生(il-2、il-12、ifn-γ)的测定(例如流式细胞术、elisa)来评价。cd4+ t细胞的反应可在体外细胞培养测定中评价,其中经基因修饰的细胞与包含cd4+ t细胞的细胞共培养。例如,经基因修饰的细胞可例如与pbmc、包含cd4+ t细胞的经纯化cd3+ t细胞、经纯化cd4+ t细胞或cd4+ t细胞系共培养。由经基因修饰的细胞引发的cd4+ t细胞反应可与由未经修饰细胞引发的反应进行比较。cd4+ t细胞的反应降低指示有效ciita引导rna。
[0234]
ciita引导rna的功效也可通过细胞在编辑后的存活期来评估。在一些实施方案中,细胞在编辑后存活至少一周至六周。在一些实施方案中,细胞在编辑后存活至少一周至十二周。在一些实施方案中,细胞在编辑后存活至少两周。在一些实施方案中,细胞在编辑后存活至少三周。在一些实施方案中,细胞在编辑后存活至少四周。在一些实施方案中,细胞在编辑后存活至少五周。在一些实施方案中,细胞在编辑后存活至少六周。经基因修饰的细胞的活力可使用标准技术来测量,包括例如通过测量细胞死亡、通过流式细胞术live/dead染色或细胞增殖。
[0235]
c.用于减少或消除ii类mhc和额外修饰的方法和组合物
[0236]
1.i类mhc基因敲除
[0237]
在一些实施方案中,提供了通过如本文所公开对ciita进行基因修饰来降低或消除细胞表面上ii类mhc蛋白的表达的方法,其中所述方法进一步提供了相对于未经修饰细胞降低或消除细胞表面上i类mhc蛋白的表达。在一种方法中,i类mhc蛋白表达通过基因修饰b2m基因而降低或消除。在一些实施方案中,i类mhc蛋白表达通过使细胞与b2m引导rna接触而降低或消除。在另一方法中,i类mhc蛋白hla-a的表达是通过基因修饰hla-a而降低或消除,由此降低或消除人类细胞中hla-a的表面表达,其中人类细胞对hla-b为同型接合的并且对hla-c为同型接合的。因此,在一些实施方案中,hla-a蛋白表达是通过使人类细胞与hla-a引导rna接触而降低或消除,其中人类细胞对hla-b为同型接合的并且对hla-c为同型接合的。在一些实施方案中,所得细胞为同种异体细胞。
[0238]
在一些实施方案中,方法包括降低细胞表面上ii类mhc蛋白的表达,其包括对ciita进行基因修饰,包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与b2m引导rna接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。在一些实施方案中,方法还包括在b2m目标序列中诱导dsb或ssb。在一些实施方案中,由此通过细胞降低b2m表达。在一些实施方案中,由此通过细胞降低i类mhc蛋白表达。
[0239]
在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与b2m引导rna接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。在一些实施方案中,方法还包括在b2m目标序列中诱导dsb或ssb。在一些实施方案中,由此通过细胞降低b2m表达。在一些实施方案中,由此通过细胞降低i类mhc蛋白表达。
[0240]
在一些实施方案中,方法包括在ciita中诱导dsb或ssb,其包括使细胞与包含本文
所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与b2m引导rna接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。在一些实施方案中,方法还包括在b2m目标序列中诱导dsb或ssb。在一些实施方案中,由此通过细胞降低b2m表达。在一些实施方案中,由此通过细胞降低i类mhc蛋白表达。
[0241]
在一些实施方案中,方法包括降低细胞中ciita蛋白的表达,其包括将组合物递送至包含本文所公开的ciita引导rna的细胞,所述方法还包括使所述细胞与b2m引导rna接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。在一些实施方案中,方法还包括在b2m目标序列中诱导dsb或ssb。在一些实施方案中,由此通过细胞降低b2m表达。在一些实施方案中,由此通过细胞降低i类mhc蛋白表达。
[0242]
在一些实施方案中,b2m引导rna靶向人类b2m基因。
[0243]
在一些实施方案中,b2m引导rna包含seq id no:701。在一些实施方案中,b2m引导rna包含引导序列,所述引导序列为seq id no:701的至少17、18、19或20个连续核苷酸。在一些实施方案中,b2m引导rna包含与seq id no:701至少95%、90%或85%同一的引导序列。
[0244]
本文提供了b2m引导rna的其他实施方案,包括例如对引导rna的示例性修饰。
[0245]
在一些实施方案中,b2m引导rna的功效是通过测量相对于未经修饰细胞,细胞中b2m蛋白的水平来测定。在一些实施方案中,b2m引导rna的功效是通过测量由细胞表达的b2m蛋白的水平来测定。在一些实施方案中,针对b2m蛋白的抗体(例如抗b2m)可用于通过例如流式细胞术来检测b2m蛋白的水平。在一些实施方案中,通过测量细胞中b2m mrna的水平(例如通过rt-pcr)来测定b2m引导rna的功效。在一些实施方案中,相比于未经修饰细胞中b2m蛋白的水平,b2m蛋白或b2m mrna的水平的降低或消除指示有效b2m引导rna。在一些实施方案中,相比于未经修饰细胞(或未经修饰细胞群体),根据流式细胞术对b2m蛋白呈阴性的细胞(或细胞群体)指示有效b2m引导rna。在一些实施方案中,已与根据流式细胞术对i类mhc蛋白呈阴性的特定b2m引导rna和经rna引导的dna结合剂接触的细胞(或细胞群体)指示有效b2m引导rna。
[0246]
在一些实施方案中,b2m引导rna的功效是通过测量细胞表面上i类mhc蛋白的水平来测定。在一些实施方案中,i类mhc蛋白水平是通过流式细胞术(例如用针对hla-a、hla-b或hla-c的抗体)测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少65%mhc i阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少70%mhc i阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少80%i类mhc阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少90%mhc i阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少95%mhc i阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少100%i类mhc阴性,如通过流式细胞术所测量。
[0247]
在一些实施方案中,方法包括相对于未经修饰细胞降低或消除工程化细胞中ii类mhc蛋白的表面表达,其包括使所述细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括通过基因编辑系统降低或消除细胞的hla-a表达,所述基因编辑系统结合至hla-a基因组目标序列,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷
酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,方法包括相对于未经修饰细胞降低或消除工程化细胞中ii类mhc蛋白的表面表达,其包括使所述细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括通过基因编辑系统降低或消除细胞的hla-a表达,所述基因编辑系统结合至hla-a基因组目标序列,所述目标序列包含选自以下的基因组坐标内的至少10个连续核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。在一些实施方案中,hla-a基因组坐标选自chr6:29942864-29942884。在一些实施方案中,hla-a基因组坐标选自chr6:29942868-29942888。在一些实施方案中,hla-a基因组坐标选自chr6:29942876-29942896。在一些实施方案中,hla-a基因组坐标选自chr6:29942877-29942897。在一些实施方案中,hla-a基因组坐标选自chr6:29942883-29942903。在一些实施方案中,hla-a基因组坐标选自chr6:29943126-29943146。在一些实施方案中,hla-a基因组坐标选自chr6:29943528-29943548。在一些实施方案中,hla-a基因组坐标选自chr6:29943529-29943549。在一些实施方案中,hla-a基因组坐标选自chr6:29943530-29943550。在一些实施方案中,hla-a基因组坐标选自chr6:29943537-29943557。在一些实施方案中,hla-a基因组坐标选自chr6:29943549-29943569。在一些实施方案中,hla-a基因组坐标选自chr6:29943589-29943609。在一些实施方案中,hla-a基因组坐标选自chr6:29944026-29944046。在一些实施方案中,基因编辑系统包含经rna引导的dna结合剂。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0248]
在一些实施方案中,方法包括相对于未经修饰细胞降低或消除工程化细胞中ii类mhc蛋白的表面表达,其包括使所述细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与hla-a引导rna接触。在一些实施方案中,hla-a引导rna包含选自seq id no:2001-2095的引导序列(与对应引导rna序列seq id no:1811-1905和1906-2000)(参见下表2)。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。在一些实施方案中,经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0249]
在一些实施方案中,提供了制造工程化细胞的方法,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc蛋白的表面表达,所述方法包括:a.使所述细胞与ciita引导rna接触,其中引导rna包含选自seq id no:1-117的引导序列;以及b.使所述细胞与hla-a引导rna接触,其中hla-a引导rna包含选自seq id no:2001-2095中的任一者的引导序列(与对应引导rna序列seq id no:1811-1905和1906-2000)(参见下表2);以及c.任选地使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触;其中相对于未经修饰细胞,所述细胞在所述细胞中具有降低或消除的hla-a的表面表达。在一些
实施方案中,方法包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触。在一些实施方案中,经rna引导的dna结合剂包含酿脓链球菌cas9。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0250]
示例性hla-a引导rna提供于表2中(引导序列seq id no:2001-2095(与对应引导rna序列seq id no:1811-1905和1906-2000)。
[0251]
表2.示例性hla-a引导rna
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264]
[0265]
[0266]
[0267]
[0268]
[0269][0270]
在一些实施方案中,hla-a引导rna的功效是通过测量细胞表面上hla-a蛋白的水平来测定。在一些实施方案中,hla-a蛋白水平是通过流式细胞术(例如使用针对hla-a2和/或hla-a3的抗体)测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少65%hla-a阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少70%hla-a阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少80%hla-a阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少90%hla-a阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少95%hla-a阴性,如通过流式细胞术所测量。在一些实施方案中,相对于未经修饰细胞群体,细胞群体为至少100%hla-a阴性,如通过流式细胞术所测量。
[0271]
在一些实施方案中,b2m引导rna或hla-a引导物的功效可通过测量相比于未经修饰细胞,体外或体内免疫细胞(例如cd8+ t细胞)对经基因修饰的目标细胞的反应来测定。例如,cd8+ t细胞的反应降低表明有效b2m引导rna或hla-a。cd8+ t细胞反应可通过测量cd8+ t细胞活化反应(例如cd8+ t细胞增殖)、活化标志物的表达和/或细胞因子产生(il-2、ifn-γ、tnf-α)的测定(例如流式细胞术、elisa)来评价。cd8+ t细胞反应可在体外或体内评估。在一些实施方案中,cd8+t细胞反应可通过在体外共培养经基因修饰的细胞与cd8+ t细胞来评价。在一些实施方案中,cd8+ t细胞活性可在体内模型,例如啮齿动物模型中评价。在体内模型中,例如经基因修饰的细胞可与cd8+ t细胞一起施用;经基因修饰的细胞的存活指示避免cd8+ t细胞溶解的能力。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在cd8+ t细胞存在下体内存活超过1、2、3、4、5或6周或更多周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在cd8+ t细胞存在下体内存活至少一周至六周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在cd8+ t细胞存在下体内存活至少两周至四周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在cd8+ t细胞存在下体内存活至少四周至六周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在cd8+ t细胞存在下体内存活超过六周。
[0272]
在一些实施方案中,方法产生包含细胞的组合物,所述细胞相对于未经修饰细胞
具有降低或消除的ii类mhc表达和降低或消除的i类mhc表达。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达、和/或降低或消除的细胞核中的ciita水平、和或消除降低的i类mhc蛋白表达。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达、和/或降低或消除的细胞核中的ciita水平、和或消除降低的b2m蛋白表达。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达、和/或降低或消除的细胞核中的ciita水平、和降低或消除的b2m mrna水平。在一些实施方案中,细胞从cd8+ t细胞引发降低或消除的反应。
[0273]
在一些实施方案中,方法产生包含细胞的组合物,所述细胞相对于未经修饰细胞具有降低或消除的ii类mhc表达和降低或消除的hla-a表达,其中细胞对hla-b为同型接合的并且对hla-c为同型接合的。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达、和/或降低或消除的细胞核中的ciita水平、和或消除降低的hla-a蛋白表达。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达、和/或降低或消除的细胞核中的ciita水平、和/或消除或降低的hla-a蛋白表达。在一些实施方案中,细胞从cd8+ t细胞引发降低或消除的反应。
[0274]
在一些实施方案中,提供了一种工程化细胞,其中所述细胞在细胞表面上具有降低或消除的ii类mhc和i类mhc蛋白的表达,其中细胞包含ciita中的基因修饰,并且其中细胞包含b2m中的修饰。在一些实施方案中,同种异体细胞从cd4+ t细胞引发降低的反应并且从cd8+ t细胞引发降低的反应。
[0275]
在一些实施方案中,提供了一种工程化细胞,其中所述细胞在细胞表面上具有降低或消除的ii类mhc和hla-a蛋白的表达,其中细胞包含ciita中的基因修饰,并且其中细胞包含hla-a基因中的基因修饰,其中细胞对hla-b为同型接合的并且对hla-c为同型接合的。在一些实施方案中,提供了一种工程化细胞,其中所述细胞在细胞表面上具有降低或消除的ii类mhc和hla-a蛋白的表达,其中细胞包含ciita中的基因修饰,并且其中细胞包含hla-a基因中的基因修饰。在一些实施方案中,细胞对hla-b和hlac为同型接合的。在一些实施方案中,细胞从cd4+ t细胞引发降低的反应并且从cd8+ t细胞引发降低的反应。
[0276]
2.外源核酸
[0277]
在一些实施方案中,本公开提供了用于通过如本文所公开对ciita进行基因修饰来降低或消除细胞表面上ii类mhc蛋白的表达的方法和组合物,其中所述方法和组合物进一步提供了工程化细胞对外源核酸的表达。
[0278]
a)nk细胞抑制剂基因敲入
[0279]
在一些实施方案中,本公开提供了用于通过如本文所公开对ciita进行基因修饰来降低或消除细胞表面上ii类mhc蛋白的表达的方法,其中所述方法进一步提供了细胞对外源核酸的表达,其中外源核酸编码nk细胞抑制剂分子。在一些实施方案中,nk细胞抑制剂分子表达于细胞表面上,由此避免nk细胞活性(例如nk细胞对细胞的溶解)。在一些实施方案中,经基因修饰的细胞避免nk细胞溶解的能力使得细胞能够经受过继性细胞转移疗法。在一些实施方案中,细胞为同种异体细胞。
[0280]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与编码nk细胞抑制剂分子的核酸接触。在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行修饰,其包括使所述细胞与包含所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与编码nk细胞抑制剂分子的核酸和b2m引导rna接触,由此降低或消除细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0281]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括用以下各物对细胞进行基因修饰:一种或多种包含本文所公开的ciita引导rna的组合物、b2m引导rna、编码nk细胞抑制剂分子的核酸和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0282]
在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸接触。在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸和b2m引导rna接触,由此降低细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0283]
在一些实施方案中,方法包括在ciita中诱导dsb或ssb,其包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸接触。在一些实施方案中,方法包括在ciita中诱导dsb或ssb,其包括使细胞与包含本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸和b2m引导rna接触,由此降低细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0284]
在一些实施方案中,方法包括降低或消除细胞中ciita蛋白的表达,其包括递送包含本文所公开的ciita引导rna的组合物,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸接触。在一些实施方案中,方法包括降低细胞中ciita蛋白的表达,其包括递送包含本文所公开的ciita引导rna的组合物,所述方法还包括使细胞与编码nk细胞抑制剂分子的核酸和b2m引导rna接触,由此降低细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0285]
在一些实施方案中,nk细胞抑制剂分子与nk细胞上的抑制性受体结合。在一些实施方案中,nk细胞抑制剂分子与对i类mhc具有特异性的抑制性受体结合。在一些实施方案中,nk细胞抑制剂分子与对i类mhc不具有特异性的抑制性受体结合。nk细胞抑制性受体包括例如kir(人类)、cd94-nkg2a杂二聚体(人类/小鼠)、ly49(小鼠)、2b4、slamf6、nkfp-b、tigit、kir2dl4。
[0286]
在一些实施方案中,nk细胞抑制剂分子与nkg2a结合。
[0287]
在一些实施方案中,nk细胞抑制剂分子为i类mhc分子。在一些实施方案中,nk细胞抑制剂分子为经典i类mhc分子。在一些实施方案中,nk细胞抑制剂分子为非经典i类mhc分子。在一些实施方案中,nk细胞抑制剂分子为hla分子。nk细胞抑制剂分子包括例如hla-c、hla-e、hla-g、cd1、cd48、slamf6、clr-b和cd155。
[0288]
在一些实施方案中,nk细胞抑制剂分子为hla-e。
[0289]
在一些实施方案中,nk细胞抑制剂分子为融合蛋白。在一些实施方案中,nk细胞抑制剂分子为包含hla-e的融合蛋白。在一些实施方案中,nk细胞抑制剂分子包含b2m。在一些实施方案中,nk细胞抑制剂分子包含hla-e和b2m。在一些实施方案中,融合蛋白包括接头。在一些实施方案中,hla-e构建体提供于载体中。在一些实施方案中,包含hla-e构建体的载体为慢病毒载体。在一些实施方案中,hla-e构建体经由慢病毒转导递送至细胞。
[0290]
在一些实施方案中,nk细胞抑制剂分子插入至目标细胞的基因组中。在一些实施方案中,nk细胞抑制剂分子整合至目标细胞的基因组中。在一些实施方案中,nk细胞抑制剂分子通过同源重组(hr)整合至目标细胞的基因组中。在一些实施方案中,nk细胞抑制剂分子通过钝端插入整合至目标细胞的基因组中。在一些实施方案中,nk细胞抑制剂分子通过非同源末端接合整合至目标细胞的基因组中。在一些实施方案中,nk细胞抑制剂分子整合至细胞基因组中的安全港基因座中。在一些实施方案中,nk细胞抑制剂分子整合至trac基因座、b2m基因座、aavs1基因座和/或ciita基因座中的一者中。在一些实施方案中,nk细胞抑制剂分子在脂质核酸组装组合物中提供至细胞。在一些实施方案中,脂质核酸组装组合物为脂质纳米粒子(lnp)。
[0291]
在一些实施方案中,方法产生从nk细胞引发降低的反应的工程化细胞。nk细胞反应可在体外或体内评估。在一些实施方案中,nk细胞活性可通过体外共培养经基因修饰的细胞与nk细胞来评价。在一些实施方案中,nk细胞活性可在体内模型,例如啮齿动物模型中评价。在体内模型中,例如经基因修饰的细胞可与nk细胞一起施用;经基因修饰的细胞的存活指示避免nk细胞溶解的能力。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在nk细胞存在下体内存活超过1、2、3、4、5或6周或更多周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在nk细胞存在下体内存活至少一周至六周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在nk细胞存在下体内存活至少两周至四周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在nk细胞存在下体内存活至少四周至六周。在一些实施方案中,方法产生包含细胞的组合物,所述细胞在nk细胞存在下体内存活超过六周。
[0292]
在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞具有降低或消除的ii类mhc表达并且包含编码nk细胞抑制剂分子的核酸。在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞在细胞表面上具有降低或消除的ii类mhc表达和nk细胞抑制剂分子表达。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc表达并且从nk细胞引发降低的反应。在一些实施方案中,方法产生包含细胞的组合物,所述细胞具有降低或消除的ii类mhc蛋白表达,降低或消除的ciita蛋白表达和/或降低或消除的细胞核中的ciita水平,并且从nk细胞引发降低的反应,并且具有降低或消除的i类mhc蛋白表达。在一些实施方案中,细胞从cd4+ t细胞、cd8+ t细胞和/或nk细胞引发降低的反应。
[0293]
在一些实施方案中,提供同种异体细胞,其中细胞在细胞表面上具有降低或消除的ii类mhc和i类mhc蛋白表达,其中细胞包含如本文所公开的ciita中的修饰,其中细胞包含b2m中的修饰,并且其中细胞包含编码nk细胞抑制剂分子的核酸。在一些实施方案中,同种异体细胞从cd4+ t细胞、cd8+ t细胞和/或nk细胞引发降低的反应。
[0294]
b)靶向受体和其他细胞表面表达的多肽;分泌多肽
[0295]
在一些实施方案中,本公开提供了通过如本文所公开对ciita进行基因修饰来降低或消除细胞表面上ii类mhc蛋白的表达的方法,其中所述方法进一步提供一种或多种外源核酸(例如抗体、嵌合抗原受体(car)、t细胞受体(tcr)、细胞因子或细胞因子受体、趋化因子或趋化因子受体、酶、融合蛋白或其他类型的细胞表面结合或可溶性多肽)的表达。在一些实施方案中,外源核酸编码表达于细胞表面上的蛋白质。例如,在一些实施方案中,外源核酸编码表达于细胞表面上的靶向受体(本文中进一步描述)。在一些实施方案中,经基因修饰的细胞可充当用于表达由外源核酸编码的分泌多肽的“细胞工厂”,包括例如作为用于体内连续产生多肽的来源(如本文中进一步描述)。在一些实施方案中,细胞为同种异体细胞。
[0296]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸接触。在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸和b2m引导rna接触,由此降低或消除细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括基因修饰ciita基因的剪接位点,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸、细胞表面表达的(例如靶向受体)多肽或可溶性(例如分泌)多肽和b2m引导rna接触,由此降低或消除细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法包括使细胞与超过一种外源核酸接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0297]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸接触。在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸和hla-a引导rna接触,由此降低或消除细胞表面上hla-a蛋白的表达。在一些实施方案中,方法包括降低或消除细胞表面上hla-a蛋白的表达,包括基因修饰ciita基因的剪接位点,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与外源核酸、细胞表面表达的(例如靶向受体)多肽或可溶性(例如分泌)多肽和hla-a引导rna接触,由此降低或消除细胞表面上hla-a蛋白的表达。在一些实施方案中,方法包括使细胞与超过一种外源核酸接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0298]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括用以下各物对细胞进行基因修饰:一种或多种包含本文所公开的ciita引导rna的组合物、b2m引导rna、编码nk细胞抑制剂分子的核酸、编码多肽(例如靶向受体)的外源核酸和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0299]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白和i类mhc蛋白
的表达,包括用以下各物对细胞进行基因修饰:一种或多种包含本文所公开的ciita引导rna的组合物、b2m引导rna、编码nk细胞抑制剂分子的核酸、编码多肽(例如靶向受体)的外源核酸和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0300]
在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸接触。在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸和b2m引导物接触,由此降低细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸、编码nk细胞抑制剂的核酸和b2m引导rna接触,由此降低细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸和编码nk细胞抑制剂的核酸接触。在一些实施方案中,方法包括使细胞与超过一种外源核酸接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0301]
在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸接触。在一些实施方案中,方法包括使ciita中的剪接位点失活,其包括使细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使细胞与外源核酸和hla-a引导物接触,由此降低细胞表面上hla-a蛋白的表达。在一些实施方案中,方法包括使细胞与超过一种外源核酸接触。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0302]
在一些实施方案中,外源核酸编码表达于细胞表面上的多肽。在一些实施方案中,外源核酸编码可溶性多肽。如本文所用,“可溶性”多肽是指由细胞分泌的多肽。在一些实施方案中,可溶性多肽为治疗多肽。在一些实施方案中,可溶性多肽为抗体。在一些实施方案中,可溶性多肽为酶。在一些实施方案中,可溶性多肽为细胞因子。在一些实施方案中,可溶性多肽为趋化因子。在一些实施方案中,可溶性多肽为融合蛋白。
[0303]
在一些实施方案中,外源核酸编码抗体。在一些实施方案中,外源核酸编码抗体片段(例如fab、fab2)。在一些实施方案中,外源核酸编码全长抗体。在一些实施方案中,外源核酸编码单链抗体(例如scfv)。在一些实施方案中,抗体为igg、igm、igd、iga或ige。在一些实施方案中,抗体为igg抗体。在一些实施方案中,抗体为igg1抗体。在一些实施方案中,抗体为igg4抗体。在一些实施方案中,重链恒定区含有已知降低效应功能的突变。在一些实施方案中,重链恒定区含有已知增强效应功能的突变。在一些实施方案中,抗体为双特异性抗体。在一些实施方案中,抗体为单域抗体(例如,仅vh域的抗体)。
[0304]
在一些实施方案中,外源核酸编码中和抗体。中和抗体中和其目标抗原的活性。在一些实施方案中,抗体为针对病毒抗原的中和抗体。在一些实施方案中,抗体中和目标病毒抗原,阻断病毒感染细胞的能力。在一些实施方案中,基于细胞的中和测定可用于测量抗体的中和活性。特定细胞和读数将取决于中和抗体的目标抗原。抗体的半数最大有效浓度(ec
50
)可在基于细胞的中和测定中测量,其中较低ec
50
指示更有效中和抗体。
[0305]
在一些实施方案中,外源核酸编码结合至与疾病或病症(参见例如第iv部分中所述的疾病和病症)相关的抗原的抗体。
[0306]
在一些实施方案中,外源核酸编码在细胞表面上表达的多肽(即,细胞表面结合蛋白)。在一些实施方案中,外源核酸编码靶向受体。“靶向受体”为存在于细胞(例如t细胞)表面上的受体,以允许细胞结合至目标位点,例如生物体中的特定细胞或组织。在一些实施方案中,靶向受体为car。在一些实施方案中,靶向受体为通用car(unicar)。在一些实施方案中,靶向受体为tcr。在一些实施方案中,靶向受体为truc。在一些实施方案中,靶向受体为b细胞受体(bcr)(例如,表达于b细胞上)。在一些实施方案中,靶向受体为趋化因子受体。在一些实施方案中,靶向受体为细胞因子受体。
[0307]
在一些实施方案中,靶向受体包括嵌合抗原受体(car)、t细胞受体(tcr)和经由内部信号传导域中的至少一个跨膜域可操作地连接的细胞表面分子受体,所述内部信号传导域能够在细胞外受体部分结合时激活t细胞。在一些实施方案中,car是指细胞外抗原识别域,例如scfv、vhh、纳米抗体;可操作地连接于细胞内信号传导域,其在抗原结合时激活t细胞。car由四个区域构成:抗原识别域、胞外铰链区、跨膜域和细胞内t细胞信号传导域。此类受体是本领域中众所周知的(参见例如wo2020092057、wo2019191114、wo2019147805、wo2018208837)。也涵盖用于识别各种抗原的通用car(unicar)(参见例如ep 2 990 416 a1)和促进免疫细胞经由转接子分子与目标细胞结合的反向通用car(revcar)(参见例如wo2019238722)。car可靶向抗体可发展成的任何抗原并且通常针对呈现于待靶向的细胞或组织的表面上的分子。在一些实施方案中,靶向受体包含抗原识别域(例如,癌症抗原识别域和tcr(例如truc)的亚基。(参见baeuerle等人,nature communications 2087(2019))。
[0308]
在一些实施方案中,外源核酸编码tcr。在一些实施方案中,外源核酸编码经基因修饰的tcr。在一些实施方案中,外源核酸编码对由癌细胞表达的多肽具有特异性的经基因修饰的tcr。在一些实施方案中,外源核酸编码对威尔姆斯氏肿瘤基因(wt1)抗原具有特异性的靶向受体。在一些实施方案中,外源核酸编码wt1特异性tcr(参见例如wo2020/081613a1)。
[0309]
在一些实施方案中,外源核酸被插入至目标细胞的基因组中。在一些实施方案中,外源核酸被整合至目标细胞的基因组中。在一些实施方案中,外源核酸通过同源重组(hr)整合至目标细胞的基因组中。在一些实施方案中,外源核酸通过钝端插入整合至目标细胞的基因组中。在一些实施方案中,外源核酸通过非同源末端接合整合至目标细胞的基因组中。在一些实施方案中,外源核酸整合至细胞基因组中的安全港基因座中。在一些实施方案中,外源核酸整合至trac基因座、b2m基因座、aavs1基因座和/或ciita基因座中的一者中。在一些实施方案中,外源核酸在脂质核酸组装组合物中提供至细胞。在一些实施方案中,脂质核酸组装组合物为脂质纳米粒子(lnp)。
[0310]
在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞具有降低或消除的ii类mhc表达并且包含外源核酸。在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞具有降低或消除的ii类mhc表达并且分泌和/或表达由整合至细胞基因组中的外源核酸编码的多肽。在一些实施方案中,方法产生包含工程化细胞的组合物,所述工程化细胞具有降低或消除的ii类mhc蛋白表达、降低或消除的ciita蛋白表达和/或降低或消除的细胞核中的ciita水平,并且从nk细胞引发降低的反应,并且具有降低的i类mhc蛋白表达,并且分泌和/或表达由整合至细胞基因组中的外源核酸编码的多肽。在一些实施方案中,工程化细胞从cd4+ t细胞和/或cd8+ t细胞引发降低的反应。
[0311]
在一些实施方案中,提供了一种工程化细胞,其中所述细胞在细胞表面上具有降低或消除的ii类mhc和i类mhc蛋白的表达,其中细胞包含如本文所公开的ciita中的修饰,其中细胞包含b2m中的修饰,其中细胞包含编码nk细胞抑制剂分子的外源核酸,并且其中细胞进一步包含编码多肽(例如靶向受体)的外源核酸。在一些实施方案中,工程化细胞从cd4+ t细胞和/或cd8+ t细胞引发降低的反应。
[0312]
在实施方案中,提供了一种工程化细胞,其中所述细胞在细胞表面上具有降低或消除的ii类mhc和hla-a蛋白的表达,其中细胞包含如本文所公开的ciita中的修饰,其中细胞包含hla-a基因中的修饰,其中细胞进一步包含编码多肽(例如靶向受体)的外源核酸。在一些实施方案中,工程化细胞从cd4+ t细胞和/或cd8+ t细胞引发降低的反应。
[0313]
在一些实施方案中,本公开提供了通过如本文所公开对ciita进行基因修饰来降低或消除细胞表面上ii类mhc蛋白的表达的方法,其中所述方法进一步提供降低一个或多个额外目标基因(例如trac、trbc)的表达。在一些实施方案中,额外基因修饰提供将经基因修饰的细胞用于过继性细胞转移应用的进一步优势。在一些实施方案中,细胞为同种异体细胞。
[0314]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与引导rna接触,所述引导rna将经rna引导的dna结合剂导引至位于另一基因(例如除ciita或b2m或hla-a以外的基因)中的目标序列,由此降低或消除另一基因的表达。在一些实施方案中,方法包括降低细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,和b2m引导rna,由此降低或消除细胞表面上i类mhc蛋白的表达。在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除另一基因的表达,和编码多肽(例如靶向受体)的外源核酸。
[0315]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低另一基因的表达;b2m引导rna,由此降低细胞表面上i类mhc蛋白的表达;和编码nk细胞抑制剂的外源核酸。
[0316]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低另一基因的表达;和hla-a引导rna,由此降低细胞表面上hla-a蛋白的表达。
[0317]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接
触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除另一基因的表达;b2m引导rna,由此降低或消除细胞表面上i类mhc蛋白的表达;和编码多肽(例如靶向受体)的外源核酸。
[0318]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列;编码nk细胞抑制剂分子的外源核酸;和编码多肽(例如靶向受体)的外源核酸。
[0319]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低另一基因的表达;hla-a引导rna,由此降低细胞表面上hla-a蛋白的表达;和编码多肽(例如靶向受体)的外源核酸。
[0320]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括对ciita进行基因修饰,其包括使所述细胞与包含如本文所公开的ciita引导rna的组合物接触,所述方法还包括使所述细胞与以下各物接触:引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除另一基因的表达;b2m引导rna,所述rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除细胞表面上i类mhc蛋白的表达;编码nk细胞抑制剂分子的外源核酸;和编码多肽(例如靶向受体)的外源核酸。在一些实施方案中,方法还包括使细胞与经rna引导的dna结合剂接触。
[0321]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包括用以下各物对细胞进行基因修饰:一种或多种包含本文所公开的ciita引导rna的组合物;b2m引导rna;编码nk细胞抑制剂分子的核酸;编码多肽(例如靶向受体)的外源核酸;引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除另一基因的表达;和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0322]
在一些实施方案中,方法包括降低或消除细胞表面上ii类mhc蛋白的表达,包含用以下各物对细胞进行基因修饰:一种或多种包含本文所公开的ciita引导rna的组合物;hla-a引导rna;编码多肽(例如靶向受体)的外源核酸;引导rna,所述引导rna将经rna引导的dna结合剂导引至位于另一基因中的目标序列,由此降低或消除另一基因的表达;和经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0323]
在一些实施方案中,额外目标基因是trac。在一些实施方案中,额外目标基因是trbc。
[0324]
d.示例性细胞类型
[0325]
在一些实施方案中,本文所公开的方法和组合物对细胞进行基因修饰。在一些实施方案中,细胞为同种异体细胞。在一些实施方案中,细胞为人类细胞。在一些实施方案中,经基因修饰的细胞被称为工程化细胞。工程化细胞是指包含工程化基因修饰的细胞(或细胞后代),例如已与基因编辑系统接触并且经基因编辑系统基因修饰。术语“工程化细胞”和“经基因修饰的细胞”通篇可互换使用。工程化细胞可为本文所公开的示例性细胞类型中的任一者。
[0326]
在一些实施方案中,细胞为免疫细胞。如本文所用,“免疫细胞”是指免疫系统的细胞,包括例如淋巴细胞(例如t细胞、b细胞、自然杀手细胞(“nk细胞”和nkt细胞或inkt细胞))、单核细胞、巨噬细胞、肥大细胞、树突状细胞或颗粒细胞(例如嗜中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)。在一些实施方案中,细胞为原代免疫细胞。在一些实施方案中,免疫系统细胞可选自cd3
+
、cd4
+
和cd8
+ t细胞、调节t细胞(treg)、b细胞、nk细胞和树突状细胞(dc)。在一些实施方案中,免疫细胞为同种异体的。
[0327]
在一些实施方案中,所述细胞为淋巴细胞。在一些实施方案中,所述细胞为适应性免疫细胞。在一些实施方案中,所述细胞为t细胞。在一些实施方案中,细胞为b细胞。在一些实施方案中,所述细胞为nk细胞。在一些实施方案中,淋巴细胞为同种异体的。
[0328]
如本文所用,t细胞可定义为表达t细胞受体(“tcr”或“αβtcr”或“γδtcr”)的细胞,然而,在一些实施方案中,t细胞的tcr可经基因修饰以降低其表达(例如通过对trac或trbc基因的基因修饰),因此蛋白质cd3的表达可用作通过标准流式细胞术方法鉴定t细胞的标志物。cd3是与tcr相关的多亚基信号传导复合物。因此,t细胞可称为cd3+。在一些实施方案中,t细胞为表达cd3+标志物和cd4+或cd8+标志物的细胞。在一些实施方案中,t细胞为同种异体的。
[0329]
在一些实施方案中,t细胞表达糖蛋白cd8并且因此根据标准流式细胞术方法为cd8+,并且可称为“细胞毒性”t细胞。在一些实施方案中,t细胞表达糖蛋白cd4并且因此根据标准流式细胞术方法为cd4+,并且可称为“辅助”t细胞。cd4+ t细胞可分化成子集并且可称为th1细胞、th2细胞、th9细胞、th17细胞、th22细胞、t调节(“treg”)细胞或t滤泡性辅助细胞(“tfh”)。每个cd4+子集释放可具有促炎或消炎功能、存活或保护功能的特定细胞因子。t细胞可通过cd4+或cd8+选择方法从受试者分离。
[0330]
在一些实施方案中,所述t细胞为记忆t细胞。在体内,记忆t细胞遇到抗原。记忆t细胞可位于次级淋巴样器官(中枢记忆t细胞)或最近感染的组织(效应记忆t细胞)中。记忆t细胞可为cd8+ t细胞。记忆t细胞可为cd4+ t细胞。
[0331]
如本文所用,“中枢记忆t细胞”可定义为经历抗原的t细胞,并且例如可表达cd62l和cd45ro。中枢记忆t细胞可通过也表达ccr7的中枢记忆t细胞检测为cd62l+和cd45ro+,因此可通过标准流式细胞术方法检测为ccr7+。
[0332]
如本文所用,“早期干细胞记忆t细胞”(或“tscm”)可定义为表达cd27和cd45ra的t细胞,并且因此通过标准流式细胞术方法为cd27+和cd45ra+。tscm不表达cd45同工型cd45ro,因此如果此同工型通过标准流式细胞术方法进行染色,则tscm将进一步为cd45ro-。因此,cd45ro-cd27+细胞也是早期干细胞记忆t细胞。tscm细胞进一步表达cd62l和ccr7,因此可通过标准流式细胞术方法检测为cd62l+和ccr7+。已显示早期干细胞记忆t细胞与细胞疗法产品的持久性和治疗功效增加相关。
[0333]
在一些实施方案中,细胞为b细胞。如本文所用,“b细胞”可定义为表达cd19和/或cd20,和/或b细胞成熟抗原(“bcma”)的细胞,并且因此b细胞通过标准流式细胞术方法为cd19+,和/或cd20+,和/或bcma+。通过标准流式细胞术方法,b细胞对于cd3和cd56进一步为阴性的。b细胞可为浆细胞。b细胞可为记忆b细胞。b细胞可为初始b细胞。b细胞可为igm+,或具有类别转换的b细胞受体(例如igg+或iga+)。在一些实施方案中,b细胞为同种异体的。
[0334]
在一些实施方案中,细胞为单核细胞,例如来自骨髓或外周血。在一些实施方案
中,细胞为外周血单核细胞(“pbmc”)。在一些实施方案中,细胞为pbmc,例如淋巴细胞或单核细胞。在一些实施方案中,细胞为外周血淋巴细胞(“pbl”)。在一些实施方案中,单核细胞为同种异体的。
[0335]
包括act和/或组织再生疗法中所用的细胞,例如干细胞、祖细胞和原代细胞。例如,干细胞包括多能干细胞(psc);诱导多能干细胞(ipsc);胚胎干细胞(esc);间充质干细胞(msc,例如从骨髓(bm)、外周血(pb)、胎盘、脐带(uc)或脂肪分离);造血干细胞(hsc;例如从bm或uc分离);神经干细胞(nsc);组织特异性祖干细胞(tspsc);和角膜缘干细胞(lsc)。祖细胞和原代细胞包括单核细胞(mnc,例如从bm或pb分离);内皮祖细胞(epc,例如从bm、pb和uc分离);神经祖细胞(npc);和组织特异性原代细胞或从其衍生的细胞(tsc),包括软骨细胞、肌细胞和角质细胞。还包括用于器官或组织移植的细胞,例如胰岛细胞、心肌细胞、甲状腺细胞、胸腺细胞、神经元细胞、皮肤细胞和视网膜细胞。
[0336]
在一些实施方案中,细胞为人类细胞,例如从人类受试者分离的细胞。在一些实施方案中,细胞从人类供体pbmc或白细胞采集物分离。在一些实施方案中,细胞来自患有疾患、病症或疾病的受试者。在一些实施方案中,细胞来自具有爱泼斯坦-巴尔病毒(“ebv”)的人类供体。
[0337]
在一些实施方案中,离体进行所述方法。如本文所用,“离体”是指体外方法,其中细胞能够转移至受试者中,例如作为act疗法。在一些实施方案中,离体方法为涉及act疗法细胞或细胞群体的体外方法。
[0338]
在一些实施方案中,细胞来自细胞系。在一些实施方案中,细胞系衍生自人类受试者。在一些实施方案中,细胞系为类淋巴母细胞细胞系(“lcl”)。细胞可经冷冻保存和解冻。细胞可先前尚未经冷冻保存。
[0339]
在一些实施方案中,细胞来自细胞库。在一些实施方案中,细胞经基因修饰并且然后转移至细胞库中。在一些实施方案中,细胞从受试者移出,离体进行基因修饰,并转移至细胞库中。在一些实施方案中,将经基因修饰的细胞群体转移至细胞库中。在一些实施方案中,将经基因修饰的免疫细胞群体转移至细胞库中。在一些实施方案中,经基因修饰的免疫细胞群体包含第一和第二亚群,其中第一和第二亚群具有至少一个共同基因修饰并且至少一个不同基因修饰被转移至细胞库中。
[0340]
在一些实施方案中,当细胞对hla-b为同型接合时,hla-b等位基因选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02。
[0341]
在一些实施方案中,当细胞对hla-c为同型接合时,hla-c等位基因选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:01;hla-c*04:0 1;和hla-c*02:
02。
[0342]
在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b等位基因选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02;并且hla-c等位基因选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:0 1;hla-c*04:0 1;和hla-c*02:02。
[0343]
在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因选自以下hla-b和hla-c等位基因中的任一者:hla-b*07:02和hla-c*07:02;hla-b*08:01和hla-c*07:01;hla-b*44:02和hla-c*05:01;hla-b*35:01和hla-c*04:01;hla-b*40:01和hla-c*03:04;hla-b*57:01和hla-c*06:02;hla-b*14:02和hla-c*08:02;hla-b*15:01和hla-c*03:03;hla-b*13:02和hla-c*06:02;hla-b*44:03和hla-c*16:01;hla-b*38:01和hla-c*12:03;hla-b*18:01和hla-c*07:01;hla-b*44:03和hla-c*04:01;hla-b*51:01和hla-c*15:02;hla-b*49:01和hla-c*07:01;hla-b*15:01和hla-c*03:04;hla-b*18:01和hla-c*12:03;hla-b*27:05和hla-c*02:02;hla-b*35:03和hla-c*04:01;hla-b*18:01和hla-c*05:01;hla-b*52:01和hla-c*12:02;hla-b*51:01和hla-c*14:02;hla-b*37:01和hla-c*06:02;hla-b*53:01和hla-c*04:01;hla-b*55:01和hla-c*03:03;hla-b*44:02和hla-c*07:04;hla-b*44:03和hla-c*07:01;hla-b*35:02和hla-c*04:01;hla-b*15:01和hla-c*04:01;以及hla-b*40:02和hla-c*02:02。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*07:02和hla-c*07:02。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*08:01和hla-c*07:01。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*44:02和hla-c*05:01。在一些实施方案中,细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且hla-b和hla-c等位基因是hla-b*35:01和hla-c*04:01。
[0344]
iii.基因编辑系统的细节
[0345]
各种适合的基因编辑系统可用于制造本文所公开的工程化细胞,包括但不限于crispr/cas系统;锌指核酸酶(zfn)系统;和转录激活因子样效应物核酸酶(talen)系统。通常,基因编辑系统涉及使用工程化裂解系统以诱导目标dna序列中的双链断裂(dsb)或切口(例如单链断裂或ssb)。裂解或切刻可经由使用例如工程化的zfn、talen的特异性核酸酶,或使用具有工程化的引导rna的crispr/cas系统以引导目标dna序列的特异性裂解或切刻而发生。此外,基于阿尔古系统(argonaute system)(例如来自嗜热栖热菌(t.thermophilus),称为
‘
ttago’,参见swarts等人(2014)nature 507(7491):258-261)开
发靶向核酸酶,所述系统也可具有用于基因编辑和基因疗法中的潜力。
[0346]
在一些实施方案中,基因编辑系统为talen系统。转录激活因子样效应物核酸酶(talen)是可经工程化以切割dna的特定序列的限制酶。它们通过使tal效应子dna结合域与dna裂解域(切割dna链的核酸酶)融合而制得。转录激活因子样效应物(tale)可经工程化以结合至所需dna序列,以促进特定位置处的dna裂解(参见例如boch,2011,nature biotech)。限制酶可引入细胞中,用于原位基因编辑,一种称为用工程化核酸酶进行基因编辑的技术。其中使用的此类方法和组合物是本领域中已知的。参见例如wo2019147805、wo2014040370、wo2018073393,其内容特此整体并入。
[0347]
在一些实施方案中,基因编辑系统是锌指系统。锌指核酸酶(zfn)是通过将锌指dna结合域融合至dna裂解域产生的人工限制酶。锌指域可经工程化以靶向特定的所需dna序列,从而使得锌指核酸酶能够靶向复杂基因组内的独特序列。来自ii型限制性核酸内切酶foki的非特异性裂解域通常用作zfn中的裂解域。裂解通过内源性dna修复机制修复,允许zfn精确改变高等生物的基因组。其中使用的此类方法和组合物是本领域中已知的。参见例如wo2011091324,其内容特此整体并入。
[0348]
在一些实施方案中,基因编辑系统是crispr/cas系统,包括例如包含引导序列和经rna引导的dna结合剂的crispr引导rna,并且在本文中进一步描述。
[0349]
a.crispr引导rna
[0350]
本文提供了适用于修饰目标序列的引导序列,例如使用包含所公开的引导序列的引导rna与经rna引导的dna结合剂(例如crispr/cas系统)。
[0351]
本文所公开的引导序列中的每一者可进一步包含额外核苷酸以形成crrna,例如在其3
′
端处的引导序列后具有以下示例性核苷酸序列:呈5
′
至3
′
定向的guuuuagagcuaugcuguuuug(seq id no:170)。在sgrna的情况下,以上引导序列可进一步包含额外核苷酸(骨架序列)以形成sgrna,例如在引导序列的3
′
端之后具有以下示例性核苷酸序列:呈5
′
至3
′
定向的guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(seq id no:171)或guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seq id no:172,其为不具有四个末端u的seq id no:171)。在一些实施方案中,seq id no:171的四个末端u不存在。在一些实施方案中,仅存在seq id no:171的四个末端u中的1、2或3者。
[0352]
在一些实施方案中,sgrna包含seq id no:1-101的引导序列中的任一者和额外核苷酸以形成crrna,例如在其3
′
端处的引导序列后具有以下示例性骨架核苷酸序列:呈5
′
至3
′
定向的guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuuggcaccgagucggugc(seq id no:173)。seq id no:173参考野生型引导rna保守序列缺少8个核苷酸:guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seq id no:172)。
[0353]
其他示例性骨架核苷酸序列提供于表23中。在一些实施方案中,sgrna包含seq id no:1-101的引导序列中的任一者和额外的引导骨架序列,呈5
′
至3
′
定向,在表23中包括骨架序列的经修饰型式,如所示。
[0354]
引导rna可进一步包含trrna。在本文所述的每个组合物和方法实施方案中,crrna和trrna可缔合为单一rna(sgrna)或可处于单独rna(dgrna)上。在sgrna的情形下,crrna与
trrna组分可共价连接,例如经由磷酸二酯键或其他共价键。在一些实施方案中,crrna和/或trrna序列可称为引导rna的“支架”或“保守部分”。
[0355]
在本文所述的组合物、用途和方法实施方案中的每一者中,引导rna可包含呈“双引导rna”或“dgrna”形式的两个rna分子。dgrna包含有包含crrna的第一rna分子,所述crrna包含例如表1中所示的引导序列;和包含trrna的第二rna分子。第一和第二rna分子可不共价连接,但可经由crrna与trrna的部分之间的碱基配对形成rna双螺旋。
[0356]
在本文中所述的组合物、用途和方法实施方案中的每一者中,引导rna可包含呈“单引导rna”或“sgrna”形式的单个rna分子。sgrna可包含与trrna共价连接的crrna(或其一部分),其包含表1中所示的引导序列。sgrna可包含表1中所示的引导序列的17、18、19或20个连续核苷酸。在一些实施方案中,crrna和trrna经由接头共价连接。在一些实施方案中,sgrna经由crrna与trrna的部分之间的碱基配对形成茎-环结构。在一些实施方案中,crrna和trrna经由一个或多个不为磷酸二酯键的键共价连接。
[0357]
在一些实施方案中,trrna可包含来源于天然存在的crispr/cas系统的trrna序列的全部或一部分。在一些实施方案中,trrna包含经截短或经修饰的野生型trrna。trrna的长度取决于所用的crispr/cas系统。在一些实施方案中,trrna包含以下或由以下组成:5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50、60、70、80、90、100或超过100个核苷酸。在一些实施方案中,trrna可包含某些二级结构,例如一种或多种发夹结构或茎环结构或一种或多种隆突结构。
[0358]
在一些实施方案中,提供了一种组合物,其包含一个或多个包含表1中的任一引导序列的引导rna。在一些实施方案中,提供了一种包含一个或多个引导rna的组合物,所述一个或多个引导rna包含表1中的任一引导序列,其中seq id no:170、171、172或173的核苷酸在其3
′
端处跟随引导序列。在一些实施方案中,根据seq id no:300的修饰模式修饰包含表1中的任一引导序列的一个或多个引导rna,其中seq id no:170、171、172或173的核苷酸在其3
′
端处跟随引导序列。
[0359]
在一些实施方案中,提供了一种组合物,其包含一个或多个包含表1中的任一引导序列的引导rna。在一个方面,提供了包含一个或多个grna的组合物,其包含与seq id no:1-101的核酸中的任一者至少99%、98%、97%、96%、95%、94%、93%、92%、91%或90%同一的引导序列。
[0360]
在其他实施方案中,提供了一种组合物,其包含至少一个,例如至少两个包含选自表1中所示的任何两个或更多个引导序列的引导序列的grna。在一些实施方案中,组合物包含至少两个grna,其各自包含与表1中所示的任一引导序列至少99%、98%、97%、96%、95%、94%、93%、92%、91%或90%同一的引导序列。
[0361]
在一些实施方案中,本发明的引导rna组合物经设计以识别(例如杂交至)ciita中的目标序列。例如,ciita目标序列可通过包含引导rna的所提供cas裂解酶识别并裂解。在一些实施方案中,例如cas裂解酶的经rna引导的dna结合剂可通过引导rna导引至ciita中的目标序列,其中引导rna的引导序列与目标序列杂交,并且例如cas裂解酶的经rna引导的dna结合剂裂解目标序列。
[0362]
在一些实施方案中,一个或多个引导rna的选择是基于ciita内的目标序列而确定。在一些实施方案中,包含一个或多个引导序列的组合物包含根据来自人类参考基因组
hg38的坐标与表1中所示的对应基因组区域互补的引导序列。其他实施方案的引导序列可与ciita内任何表1中所列的基因组坐标邻近的序列互补。例如,其他实施方案的引导序列可与包含表1中所列的基因组坐标的10个连续核苷酸
±
10个核苷酸的序列互补。
[0363]
不受任何特定理论束缚,目标基因的某些区域中的修饰(例如由于核酸酶介导的dsb而发生的插入/缺失所产生的移码突变)可能比其他区域中的突变更难以耐受,因此dsb的位置是可引起蛋白质量或类型敲低的重要因素。在一些实施方案中,与目标基因内的目标序列互补或具有互补性的grna用于将经rna引导的dna结合剂导引至目标基因中的特定位置。
[0364]
在一些实施方案中,引导序列与存在于目标基因中的目标序列至少99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、85%或80%同一。在一些实施方案中,引导序列与存在于人类ciita基因中的目标序列至少99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、85%或80%同一。
[0365]
在一些实施方案中,目标序列可与引导rna的引导序列互补。在一些实施方案中,引导rna的引导序列与其对应目标序列之间的互补性或同一性程度可为至少80%、85%、90%、95%、96%、97%、98%、99%或100%。在一些实施方案中,grna的目标序列和引导序列可为100%互补或同一的。在其他实施方案中,grna的目标序列和引导序列可含有至少一个错配。例如,grna的目标序列和引导序列可含有1、2、3或4个错配,其中引导序列的总长度为20。在一些实施方案中,grna的目标序列和引导序列可含有1-4个错配,其中引导序列为20个核苷酸。
[0366]
在一些实施方案中,本文所公开的组合物或制剂包含mrna,其包含编码经rna引导的dna结合剂,例如如本文所述的cas核酸酶的开放阅读框(orf)。在一些实施方案中,提供、使用或施用包含编码例如cas核酸酶的经rna引导的dna结合剂的orf的mrna。
[0367]
b.grna的修饰
[0368]
在一些实施方案中,grna(例如,sgrna、短sgrna、dgrna或crrna)经修饰。在本文所述的grna的上下文中,术语“经修饰”或“修饰”包括上文所描述的修饰,包括例如(a)端修饰,例如5
′
端修饰或3
′
端修饰,包括5
′
或3
′
保护端修饰;(b)核碱基(或“碱基”)修饰,包括碱基置换或去除;(c)糖修饰,包括2
′
、3
′
和/或4
′
位置处的修饰;(d)核苷间键联修饰;和(e)主链修饰,其可包括磷酸二酯键和/或核糖的修饰或置换。核苷酸在指定位置的修饰包括紧接着核苷酸的糖的3
′
的磷酸二酯键的修饰或置换。因此,例如,包含5
′
端的第一糖与第二糖之间的硫代磷酸酯的核酸被视为包含位置1处的修饰。术语“经修饰的grna”通常指一种grna,其碱基、糖和磷酸二酯键或主链部分(包括核苷酸磷酸酯)中的一者或多者的化学结构具有修饰,全部如本文中所详述和示例。
[0369]
其他描述和示例性修饰模式提供于2019年12月12日公布的wo2019/237069的表1中,所述文献的全部内容通过引用并入本文。
[0370]
在一些实施方案中,grna包含在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或更多个ya位点处的修饰。在一些实施方案中,ya位点的嘧啶包含修饰(包括改变紧接嘧啶的糖的3
′
的核苷间键联的修饰)。在一些实施方案中,ya位点的腺嘌呤包含修饰(包括改变紧接腺嘌呤的糖3
′
的核苷间键联的修饰)。在一些实施方案中,ya位点的嘧啶和腺嘌呤包含修饰,例如糖、碱基或核苷间键联修饰。ya修饰可为本文所阐述的任何类型的修饰。在一些实
施方案中,ya修饰包含硫代磷酸酯、2
′‑
ome或2
′‑
氟中的一者或多者。在一些实施方案中,ya修饰包含嘧啶修饰,包含硫代磷酸酯、2
′‑
ome、2
′‑
h、肌苷或2
′‑
氟中的一者或多者。在一些实施方案中,ya修饰在含有一个或多个ya位点的rna双螺旋区内包含双环核糖类似物(例如lna、bna或ena)。在一些实施方案中,ya修饰在含有ya位点的rna双螺旋区内包含双环核糖类似物(例如lna、bna或ena),其中ya修饰位于ya位点远端。
[0371]
在一些实施方案中,grna的引导序列(或引导区)包含1、2、3、4、5或更多个可包含ya修饰的ya位点(“引导区ya位点”)。在一些实施方案中,位于相对于5
′
末端的5
′
端的5端、6端、7端、8端、9端或10端的一个或多个ya位点(其中“5端”等是指相对于引导区的3
′
端的位置5,即,引导区中的最多3
′
核苷酸)包含ya修饰。经修饰的引导区ya位点包含ya修饰。
[0372]
在一些实施方案中,经修饰的引导区ya位点位于引导区的3
′
末端核苷酸的20、19、18、17、16、15、14、13、12、11、10或9个核苷酸内。例如,如果经修饰的引导区ya位点位于引导区的3
′
末端核苷酸的10个核苷酸内并且引导区的长度为20个核苷酸,则经修饰的引导区ya位点中的经修饰核苷酸位于位置11-20中的任一位置。在一些实施方案中,经修饰的引导区ya位点位于相对于5
′
末端的5
′
端的核苷酸4、5、6、7、8、9、10或11处或其之后。
[0373]
在一些实施方案中,经修饰的引导区ya位点不同于5
′
端修饰。例如,sgrna可包含如本文所述的5
′
端修饰并且进一步包含经修饰的引导区ya位点。或者,sgrna可包含未经修饰的5
′
端和经修饰的引导区ya位点。或者,短sgrna可包含经修饰的5
′
端和未经修饰的引导区ya位点。
[0374]
在一些实施方案中,经修饰的引导区ya位点包含位于引导区ya位点5
′
的至少一个核苷酸不包含的修饰。例如,如果核苷酸1-3包含硫代磷酸酯,核苷酸4仅包含2
′‑
ome修饰,并且核苷酸5为ya位点的嘧啶并且包含硫代磷酸酯,则经修饰的引导区ya位点包含位于引导区ya位点5
′
的至少一个核苷酸(核苷酸4)不包含的修饰(硫代磷酸酯)。在另一实例中,如果核苷酸1-3包含硫代磷酸酯,并且核苷酸4为ya位点的嘧啶并且包含2
′‑
ome,则经修饰的引导区ya位点包含位于引导区ya位点5
′
的至少一个核苷酸(核苷酸1-3中的任一者)不包含的修饰(2
′‑
ome)。如果未经修饰的核苷酸位于经修饰的引导区ya位点5
′
,则也始终满足此条件。
[0375]
在一些实施方案中,经修饰的引导区ya位点包含如上文针对ya位点所述的修饰。grna的引导区可根据任何实施方案修饰,其包含本文所阐述的经修饰引导区。在可行的情况下,本公开在别处阐述的任何实施方案可以与任一前述实施方案组合。
[0376]
在一些实施方案中,grna的5
′
和/或3
′
末端区经修饰。
[0377]
在一些实施方案中,3
′
末端区中的末端(即,最后)1、2、3、4、5、6或7个核苷酸经修饰。在全篇中,此修饰可称为“3
′
端修饰”。在一些实施方案中,3
′
末端区中的末端(即,最后)1、2、3、4、5、6或7个核苷酸包含超过一个修饰。在一些实施方案中,3
′
端修饰包含或进一步包含以下中的任何一者或多者:选自2
′‑
o-甲基(2
′‑
o-me)修饰的核苷酸、2
′‑
o-(2-甲氧基乙基)(2
′‑
o-moe)修饰的核苷酸、2
′‑
氟(2
′‑
f)修饰的核苷酸、核苷酸之间的硫代磷酸酯(ps)键、反向无碱基修饰的核苷酸或其组合的经修饰的核苷酸。在一些实施方案中,3
′
端修饰包含或进一步包含grna的3
′
端的1、2、3、4、5、6或7个核苷酸的修饰。在一些实施方案中,3
′
端修饰包含或进一步包含一个ps键联,其中所述键联介于最后一个核苷酸与倒数第二个核苷酸之间。在一些实施方案中,3
′
端修饰包含或进一步包含最后三个核苷酸之间的两个
ps键联。在一些实施方案中,3
′
端修饰包含或进一步包含最后四个核苷酸之间的四个ps键联。在一些实施方案中,3
′
端修饰包含或进一步包含最后2、3、4、5、6或7个核苷酸中的任一者或多者之间的ps键联。在一些实施方案中,包含3
′
端修饰的grna包含或进一步包含3
′
尾,其中所述3
′
尾包含存在于3
′
尾中的任何一个或多个核苷酸的修饰。在一些实施方案中,3
′
尾完全被修饰。在一些实施方案中,3
′
尾包含1、2、3、4、5、6、7、8、9、10、1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9或1-10个核苷酸,任选地其中这些核苷酸中的任一者或多者经修饰。在一些实施方案中,提供包含3
′
保护端修饰的grna。在一些实施方案中,3
′
尾包含1至约20个核苷酸、1至约15个核苷酸、1至约10个核苷酸、1至约5个核苷酸、1至约4个核苷酸、1至约3个核苷酸,和1至约2个核苷酸。在一些实施方案中,grna不包含3
′
尾。
[0378]
在一些实施方案中,5
′
末端区经修饰,例如grna中前1、2、3、4、5、6或7个核苷酸经修饰。在全篇中,此修饰可称为“5
′
端修饰”。在一些实施方案中,5
′
末端区中的前1、2、3、4、5、6或7个核苷酸包含超过一个修饰。在一些实施方案中,5
′
端的末端(即,前)1、2、3、4、5、6或7个核苷酸中的至少一者经修饰。在一些实施方案中,grna的5
′
和3
′
末端区(例如端)两者均经修饰。在一些实施方案中,仅grna的5
′
末端区经修饰。在一些实施方案中,grna保守部分中仅3
′
末端区(加或减3
′
尾)经修饰。在一些实施方案中,grna包含在grna的5
′
末端区的前7个核苷酸的1、2、3、4、5、6或7者处的修饰。在一些实施方案中,grna包含在3
′
末端区的7个末端核苷酸中的1、2、3、4、5、6或7者处的修饰。在一些实施方案中,5
′
末端区的前4个核苷酸中的2、3或4者,和/或3
′
末端区的末端4个核苷酸中的2、3或4者经修饰。在一些实施方案中,5
′
末端区的前4个核苷酸中的2、3或4者经由硫代磷酸酯(ps)键连接。在一些实施方案中,对5
′
末端和/或3
′
末端的修饰包含2
′‑
o-甲基(2
′‑
o-me)或2
′‑
o-(2-甲氧基乙基)(2
′‑
o-moe)修饰。在一些实施方案中,修饰包含对核苷酸的2
′‑
氟(2
′‑
f)修饰。在一些实施方案中,修饰包含核苷酸之间的硫代磷酸酯(ps)键联。在一些实施方案中,修饰包含反向无碱基核苷酸。在一些实施方案中,修饰包含保护端修饰。在一些实施方案中,修饰包含超过一个修饰,其选自保护端修饰、2
′‑
o-me、2
′‑
o-moe、2
′‑
氟(2
′‑
f)、核苷酸之间的硫代磷酸酯(ps)键联,和反向无碱基核苷酸。在一些实施方案中,涵盖等效修饰。
[0379]
在一些实施方案中,提供包含5
′
端修饰和3
′
端修饰的grna。在一些实施方案中,grna包含不在5
′
或3
′
端处的经修饰的核苷酸。
[0380]
在一些实施方案中,提供了包含上茎修饰的sgrna,其中上茎修饰包含上茎区中的us 1至us12中的任一者或多者的修饰。在一些实施方案中,提供了包含上茎修饰的sgrna,其中上茎修饰包含对上茎区中的至少1、2、3、4、5、6、7、8、9、10、11或所有12个核苷酸的修饰。在一些实施方案中,提供了包含上茎修饰的sgrna,其中上茎修饰包含ya位点中的1、2、3、4或5个ya修饰。在一些实施方案中,上茎修饰包含2
′‑
ome修饰的核苷酸、2
′‑
o-moe修饰的核苷酸、2
′‑
f修饰的核苷酸和/或其组合。本文所述的其他修饰,例如5
′
端修饰和/或3
′
端修饰可与上茎修饰组合。
[0381]
在一些实施方案中,sgrna包含发夹区中的修饰。在一些实施方案中,发夹区修饰包含至少一个经修饰的核苷酸,其选自2
′‑
o-甲基(2
′‑
ome)修饰的核苷酸、2
′‑
氟(2
′‑
f)修饰的核苷酸和/或其组合。在一些实施方案中,发夹区修饰处于发夹1区中。在一些实施方案中,发夹区修饰处于发夹2区中。在一些实施方案中,发夹修饰包含ya位点中的1、2或3个ya修饰。在一些实施方案中,发夹修饰包含至少1、2、3、4、5或6个ya修饰。本文所述的其他修
饰,例如上茎修饰、5
′
端修饰和/或3
′
端修饰可与发夹区中的修饰组合。
[0382]
在一些实施方案中,grna包含经取代并且任选地缩短的发夹1区,其中以下核苷酸对中的至少一者在经取代并且任选地缩短的发夹1中被沃森-克里克配对(watson-crick pairing)核苷酸取代:h1-1和h1-12、h1-2和h1-11、h1-3和h1-10和/或h1-4和h1-9。“沃森-克里克配对核苷酸”包括能够形成沃森-克里克碱基对的任何对,包括a-t、a-u、t-a、u-a、c-g和g-c对,以及包括具有相同碱基配对偏好的前述核苷酸中的任一者的经修饰型式的对。在一些实施方案中,发夹1区缺乏h1-5至h1-8中的任一者或两者。在一些实施方案中,发夹1区缺乏以下核苷酸对中的一者、两者或三者:h1-1和h1-12、h1-2和h1-11、h1-3和h1-10和/或h1-4和h1-9。在一些实施方案中,发夹1区缺乏发夹1区的1至8个核苷酸。在任何前述实施方案中,缺乏核苷酸可使得被沃森-克里克配对核苷酸(h1-1和h1-12、h1-2和h1-11、h1-3和h1-10、和/或h1-4和h1-9)取代的一个或多个核苷酸对在grna中形成碱基对。
[0383]
在一些实施方案中,grna进一步包含缺乏至少1个核苷酸的上茎区,例如美国申请第62/946,905号的表7中指示的缩短的上茎区中的任一者,所述申请的内容通过引用整体并入本文或描述于本文中的其他地方,所述上茎区可与本文所述的缩短或经取代的发夹1区中的任一者组合。
[0384]
在一些实施方案中,本文所述的grna进一步包含联结区,其中所述联结区缺少至少一个核苷酸。
[0385]
在一些实施方案中,本文提供的sgrna是短单引导rna(短sgrna),例如,包含含有发夹区的sgrna的保守部分,其中所述发夹区缺少至少5-10个核苷酸或6-10个核苷酸。在一些实施方案中,所述5-10个核苷酸或6-10个核苷酸是连续的。
[0386]
在一些实施方案中,短sgrna缺少spycas9 sgrna的保守部分的至少核苷酸54-58(aaaaa)。在一些实施方案中,短sgrna是缺少对应于spycas9的保守部分的核苷酸54-58(aaaaa)的核苷酸的非spycas9 sgrna,如例如通过成对或结构对齐所确定。
[0387]
在一些实施方案中,本文描述的短sgrna包含含有发夹区的保守部分,其中所述发夹区缺少5、6、7、8、9、10、11或12个核苷酸。在一些实施方案中,缺少核苷酸是5-10个缺少核苷酸或6-10个缺少核苷酸。在一些实施方案中,缺少核苷酸是连续的。在一些实施方案中,缺少核苷酸跨越发夹1的至少一部分和发夹2的至少一部分。在一些实施方案中,5-10个缺少核苷酸包含seq id no:171的核苷酸54-58、54-61或53-60或由seq id no:171的核苷酸54-58、54-61或53-60组成。
[0388]
在一些实施方案中,本文描述的短sgrna进一步包含联结区,其中所述联结区缺少至少一个核苷酸(例如,联结区中的1、2、3、4、5、6、7、8、9或10个核苷酸)。在一些实施方案中,短sgrna缺少联结区中的每个核苷酸。
[0389]
在一些实施方案中,本文描述的spycas9短sgrna包含nnnnnnnnnnnnnnnnnnnnguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucacgaaagggcaccgagucggugcu(seq id no:976)的序列。
[0390]
在一些实施方案中,本文描述的短sgrna包含如seq id no:977中所示的修饰模式:mn*mn*mn*nnnnnnnnnnnnnnnnnguuuuagamgmcmumamgmamamamumamgmcaaguuaaaauaaggcuaguccguuaucacgaaagggcaccgagucggmumgmc*mu(seq id no:977),其中a、c、g、u和n分别是腺嘌呤、胞嘧啶、鸟嘌呤、尿嘧啶和任何核糖核苷酸,除非另有说明。m指示2
′
o-甲基修饰,并
且*指示核苷酸之间的硫代磷酸酯键联。
[0391]
在某些实施方案中,使用seq id no:172(“示例性spycas9 sgrna-1”)作为示例,示例性spycas9 sgrna-1进一步包括以下中的一者或多者:
[0392]
a.缩短的发夹1区,或被取代和任选地缩短的发夹1区,其中
[0393]
1.以下核苷酸对中的至少一者在发夹1中被沃森-克里克配对核苷酸取代:h1-1和h1-12、h1-2和h1-11、h1-3和h1-10、或h1-4和h1-9,并且发夹1区任选地缺少
[0394]
a.h1-5至h1-8中的任一者或两者,
[0395]
b.以下核苷酸对中的一者、两者或三者:h1-1和h1-12、h1-2和h1-11、h1-3和h1-10、以及h1-4和h1-9,或
[0396]
c.发夹1区的1-8个核苷酸;或
[0397]
2.缩短的发夹1区缺少6-8个核苷酸,优选地6个核苷酸;并且
[0398]
a.位置h1-1、h1-2或h1-3中的一者或多者相对于示例性spycas9 sgrna-1(seq id no:172)缺失或被取代,或
[0399]
b.位置h1-6至h1-10中的一者或多者相对于示例性spycas9 sgrna-1(seq id no:172)被取代;或
[0400]
3.缩短的发夹1区缺少5-10个核苷酸,优选地5-6个核苷酸,并且位置n18、h1-12或n中的一者或多者相对于示例性spycas9 sgrna-1(seq id no:172)被取代;或
[0401]
b.缩短的上茎区,其中所述缩短的上茎区缺少1-6个核苷酸,并且其中所述缩短的上茎区的6、7、8、9、10或11个核苷酸相对于示例性spycas9 sgrna-1(seq id no:172)包括少于或等于4个取代;或
[0402]
c.相对于示例性spycas9 sgrna-1(seq id no:172)在ls6、ls7、us3、us10、b3、n7、n15、n17、h2-2和h2-14中的任一者或多者处的取代,其中取代基核苷酸既不是嘧啶后接腺嘌呤,也不是腺嘌呤前接嘧啶;或
[0403]
d.具有上茎区的示例性spycas9 sgrna-1(seq id no:172),其中上茎修饰包含对上茎区中us1-us12中的任一者或多者的修饰,其中
[0404]
1.经修饰的核苷酸任选地选自2
′‑
o-甲基(2
′‑
ome)修饰的核苷酸、2
′‑
o-(2-甲氧基乙基)(2
′‑
o-moe)修饰的核苷酸、2
′‑
氟(2
′‑
f)修饰的核苷酸、核苷酸之间的硫代磷酸酯(ps)键联、反向无碱基修饰的核苷酸或其组合;或
[0405]
2.经修饰的核苷酸任选地包括2
′‑
ome修饰的核苷酸。
[0406]
在某些实施方案中,示例性spycas9 sgrna-1,或sgrna,例如包含示例性spycas9 sgrna-1的sgrna,进一步包括3
′
尾,例如,1、2、3、4或更多个核苷酸的3
′
尾。在某些实施方案中,尾包括一个或多个经修饰的核苷酸。在某些实施方案中,经修饰的核苷酸选自2
′‑
o-甲基(2
′‑
ome)修饰的核苷酸、2
′‑
o-(2-甲氧基乙基)(2
′‑
o-moe)修饰的核苷酸、2
′‑
氟(2
′‑
f)修饰的核苷酸、核苷酸之间的硫代磷酸酯(ps)键联和反向无碱基修饰的核苷酸或其组合。在某些实施方案中,经修饰的核苷酸包括2
′‑
ome修饰的核苷酸。在某些实施方案中,经修饰的核苷酸包括核苷酸之间的ps键联。在某些实施方案中,经修饰的核苷酸包括2
′‑
ome修饰的核苷酸和核苷酸之间的ps键联。
[0407]
在一些实施方案中,grna经化学修饰。包含一个或多个经修饰的核苷或核苷酸的grna被称为“经修饰的”grna或“经化学修饰的”grna,用于描述代替或外加典型a、g、c和u残
基使用的一种或多种非天然和/或天然存在的组分或构型的存在。经修饰的核苷和核苷酸可包括以下中的一者或多者:(i)磷酸二酯主链键联中的非键联磷酸氧中的一者或两者和/或键联磷酸氧中的一者或多者的改变,例如置换(示例性主链修饰);(ii)核糖成分,例如核糖上的2
′
羟基的改变,例如置换(示例性糖修饰);(iii)用“脱磷酸”接头批量置换磷酸酯部分(示例性主链修饰);(iv)天然存在的核碱基的修饰或置换,包括用非典型核碱基(示例性碱基修饰);(v)核糖-磷酸酯主链的置换或修饰(示例性主链修饰);(vi)寡核苷酸的3
′
端或5
′
端的修饰,例如末端磷酸酯基团的去除、修饰或置换或部分、帽或接头的缀合(此类3
′
或5
′
帽修饰可包含糖和/或主链修饰);和(vii)糖的修饰或置换(示例性糖修饰)。
[0408]
化学修饰(例如以上列出的那些)可经组合以得到经修饰的grna,其包含可具有两个、三个、四个或更多个修饰的核苷和核苷酸(统称为“残基”)。例如,经修饰的残基可具有经修饰的糖和经修饰的核碱基。在一些实施方案中,grna的每一碱基经修饰,例如所有碱基都具有例如硫代磷酸酯基团的经修饰的磷酸酯基团。在某些实施方案中,grna分子的所有或基本上所有磷酸酯基经硫代磷酸酯基置换。在一些实施方案中,经修饰的grna在rna的5
′
端处或附近包含至少一个经修饰的残基。在一些实施方案中,经修饰的grna在rna的3
′
端处或附近包含至少一个经修饰的残基。
[0409]
在一些实施方案中,grna包含一、二、三个或更多个经修饰的残基。在一些实施方案中,经修饰的grna中至少5%(例如至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%)的位置为经修饰的核苷或核苷酸。
[0410]
在主链修饰的一些实施方案中,经修饰的残基的磷酸酯基可通过用不同取代基置换一个或多个氧而经修饰。此外,经修饰的残基,例如存在于经修饰的核酸中的经修饰的残基可包括用如本文所描述的经修饰的磷酸酯基批量置换未经修饰的磷酸酯部分。在一些实施方案中,磷酸酯主链的主链修饰可包括产生不带电接头或具有不对称电荷分布的带电接头的变化。
[0411]
经修饰的磷酸酯基的实例包括硫代磷酸酯、硒代磷酸酯、硼烷磷酸酯、硼烷磷酸酯、氢膦酸酯、氨基磷酸酯、烷基或芳基膦酸酯和磷酸三酯。
[0412]
也可构建可模拟核酸的骨架,其中磷酸酯接头和核糖经核酸酶抗性核苷或核苷酸替代物置换。此类修饰可包含主链修饰和糖修饰。在一些实施方案中,核碱基可通过替代骨架栓系。实例可包括但不限于n-吗啉基、环丁基、吡咯烷和肽核酸(pna)核苷替代物。
[0413]
经修饰的核苷和经修饰的核苷酸可包括对糖基的一个或多个修饰,即糖修饰。例如,2
′
羟基(oh)可经修饰,例如经多个不同“氧基”或“脱氧”取代基置换。在一些实施方案中,对2
′
羟基的修饰可增强核酸的稳定性,因为羟基可不再脱质子化以形成2
′‑
烷氧离子。2
′
羟基修饰的实例可包括烷氧基或芳氧基(or,其中“r”可为例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、o(ch2ch2o)nch2ch2or,其中r可为例如h或任选地被取代的烷基,并且n可为0至20的整数。在一些实施方案中,2
′
羟基修饰可为2
′‑
o-me。在一些实施方案中,2
′
羟基修饰可为2
′‑
氟修饰,所述修饰用氟置换2
′
羟基。在一些实施方案中,2
′
羟基修饰可包括“锁”核酸,其中2
′
羟基可例如通过c
1-6
亚烷基或c
1-6
亚杂烷基桥连接至同一核糖的4
′
碳,其中示例性桥可包括亚甲基、亚丙基、醚或氨基桥。在一些实施方案中,2
′
羟基修饰可
包括“解锁”核酸(una),其中核糖环缺乏c2
′‑
c3
′
键。在一些实施方案中,2
′
羟基修饰可包括甲氧基乙基(moe)(och2ch2och3,例如peg衍生物)。
[0414]“脱氧”2
′
修饰可包括氢(即,脱氧核糖,例如在部分dsrna的突出部分处);卤基(例如溴基、氯基、氟基或碘基);氨基(其中氨基可为例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳氨基、二杂芳氨基或氨基酸);nh(ch2ch2nh)nch2ch
2-氨基(其中氨基可例如如本文所描述)、-nhc(o)r(其中r可为例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氰基;巯基;烷基-硫基-烷基;硫代烷氧基;和可任选地被例如如本文所描述的氨基取代的烷基、环烷基、芳基、烯基和炔基。
[0415]
糖修饰可包含还可含有一个或多个碳的糖基,其具有与核糖中的对应碳相反的立体化学构型。因此,经修饰的核酸可包括含有例如阿拉伯糖作为糖的核苷酸。经修饰的核酸还可包括无碱基糖。这些无碱基糖也可进一步在一个或多个组成性糖原子处经修饰。经修饰的核酸还可包括一种或多种呈l形式的糖,例如l-核苷。
[0416]
可并入至经修饰的核酸中的本文中所描述的经修饰的核苷和经修饰的核苷酸可包括经修饰的碱基,也称为核碱基。核碱基的实例包括但不限于腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和尿嘧啶(u)。这些核碱基可经修饰或完全置换以得到可并入至经修饰的核酸中的经修饰的残基。核苷酸的核碱基可独立地选自嘌呤、嘧啶、嘌呤类似物或嘧啶类似物。在一些实施方案中,核碱基可包括例如天然存在的碱基衍生物和合成碱基衍生物。
[0417]
在采用双引导rna的实施方案中,crrna和tracr rna中的每一者可含有修饰。此类修饰可处于crrna和/或tracr rna的一个或两个末端处。在包含sgrna的实施方案中,sgrna的一端或两端处的一个或多个残基可经化学修饰,或整个sgrna可经化学修饰。某些实施方案包含5
′
端修饰。某些实施方案包含3
′
端修饰。在某些实施方案中,grna分子的单链突出端中的一个或多个或所有核苷酸为脱氧核苷酸。
[0418]
在一些实施方案中,本文所公开的grna包含2018年6月14日公布的wo2018/107028 a1中所公开的修饰模式中的一者,所述文献的内容特此通过引用整体并入。
[0419]
术语“ma”、“mc”、“mu”或“mg”可用于指示经2
′‑
o-me修饰的核苷酸。术语“fa”、“fc”、“fu”或“fg”可用于指示经2
′‑
f取代的核苷酸。“*”可用于描述ps修饰。术语a*、c*、u*或g*可用于指示经ps键连接至后续(例如3
′
)核苷酸的核苷酸。术语“ma*”、“mc*”、“mu*”或“mg*”可用于指示已经2
′‑
o-me取代并且经ps键连接至下一个(例如3
′
)核苷酸的核苷酸。
[0420]
示例性spycas9 sgrna-1(seq id no:172)
[0421][0422]
c.核糖核蛋白复合物
[0423]
在一些实施方案中,本公开提供了包含一个或多个grna的组合物,所述一个或多个grna包含来自表1的一个或多个引导序列和经rna引导的dna结合剂,例如核酸酶,例如cas核酸酶,例如cas9。在一些实施方案中,经rna引导的dna结合剂具有裂解酶活性,其也可称作双链核酸内切酶活性。在一些实施方案中,经rna引导的dna结合剂包含cas核酸酶。cas9核酸酶的实例包括酿脓链球菌、金黄色葡萄球菌和其他原核生物(参见例如下一段中的列表)的ii型crispr系统的那些和其经修饰(例如工程化或突变)型式。参见例如us2016/0312198a1;us 2016/0312199a1。cas核酸酶的其他实例包括iii型crispr系统的csm或cmr复合物或其cas10、csm1或cmr2亚基;和i型crispr系统的级联复合物或其cas3亚基。在一些实施方案中,cas核酸酶可来自iia型、iib型或iic型系统。关于各种crispr系统和cas核酸酶的论述,参见例如makarova等人,nat.rev.microbiol.9:467-477(2011);makarova等人,nat.rev.microbiol,13:722-36(2015);shmakov等人,molecular cell,60:385-397(2015)。在一些实施方案中,经rna引导的dna结合剂包含cas切口酶。在一些实施方案中,经rna引导的切口酶经修饰或衍生自cas蛋白,例如2类cas核酸酶(其可例如为ii型、v型或vi型cas核酸酶)。2类cas核酸酶包括例如cas9、cpf1、c2c1、c2c2和c2c3蛋白质和其修饰。
[0424]
可衍生cas核酸酶或cas切口酶的非限制性示例性菌种包括酿脓链球菌(streptococcus pyogenes)、嗜热链球菌(streptococcus thermophilus)、链球菌属、金黄色葡萄球菌(staphylococcus aureus)、无害李氏菌(listeria innocua)、加氏乳杆菌(lactobacillus gasseri)、新凶手弗朗西斯氏菌(francisella novicida)、产琥珀酸沃廉菌(wolinella succinogenes)、华德萨特菌(sutterella wadsworthensis)、伽马变形菌(gammaproteobacterium)、脑膜炎奈瑟氏菌(neisseria meningitidis)、空肠弯曲杆菌(campylobacterjejuni)、多杀巴斯德菌(pasteurella multocida)、产琥珀酸纤维杆菌(fibrobacter succinogene)、深红红螺菌(rhodospirillum rubrum)、达松维尔拟诺卡氏菌(nocardiopsis dassonvillei)、始旋链霉菌(streptomyces pristinaespiralis)、产绿色链霉菌(streptomyces viridochromogenes)、产绿色链霉菌、粉红链孢囊菌(streptosporangium roseum)、粉红链孢囊菌、嗜酸热脂环杆菌(alicyclobacillus acidocaldarius)、假蕈状芽孢杆菌(bacillus pseudomycoides)、砷还原芽孢杆菌(bacillus selenitireducens)、西伯利亚微小杆菌(exiguobacterium sibiricum)、戴白氏乳杆菌(lactobacillus delbrueckii)、唾液乳杆菌(lactobacillus salivarius)、布氏乳杆菌(lactobacillus buchneri)、齿垢密螺旋体(treponema denticola)、海洋微颤菌(microscilla marina)、伯克霍尔德氏细菌(burkholderiales bacterium)、食萘极地单胞菌(polaromonas naphthalenivorans)、单胞菌属(polaromonas sp.)、瓦氏鳄球藻(crocosphaera watsonii)、鳄球藻属、铜绿微囊藻(microcystis aeruginosa)、聚球藻属(synechococcus sp.)、阿拉伯糖醋杆菌(acetohalobium arabaticum)、根制氨菌(ammonifex degensii)、热解纤维素菌(caldicelulosiruptor becscii)、脱硫假丝酵母(candidatus desulforudis)、肉毒梭菌(clostridiumbotulinum)、艰难梭菌(clostridium difficile)、大芬戈尔德菌(finegoldia magna)、嗜热盐碱厌氧菌(natranaerobius thermophilus)、嗜热丙酸厌氧肠状菌(pelotomaculum thermopropionicum)、嗜酸性喜温硫杆菌(acidithiobacillus caldus)、嗜酸氧化亚铁硫杆菌(acidithiobacillus ferrooxidans)、酒色异着色菌(allochromatium vinosum)、海杆菌属、嗜盐亚硝化球菌
(nitrosococcus halophilus)、瓦氏亚硝化球菌(nitrosococcus watsoni)、游海假交替单胞菌(pseudoalteromonas haloplanktis)、消旋纤线杆菌(ktedonobacter racemifer)、变异念珠藻(anabaena variabilis)、泡沫节球藻(nodularia spumigena)、念珠藻属(nostoc sp.)、极大节旋藻(arthrospira maxima)、钝顶节旋藻(arthrospira platensis)、节旋藻属、螺旋藻属(lynmgbya sp.)、原型微鞘藻(microcoleus chthonoplastes)、颤藻属(oscillatoria sp.)、运动石袍菌(petrotoga mobilis)、非洲高热杆菌(thermosipho africanus)、巴氏链球菌(streptococcus pasteurianus)、灰色奈瑟球菌(neisseria cinerea)、红嘴鸥弯曲杆菌(campylobacter lari)、食清洁剂细小棒菌(parvibaculum lavamentivorans)、白喉棒状杆菌(corynebacterium diphtheria)、氨基酸球菌属(acidaminococcussp.)、毛螺科菌(lachnospiraceae bacterium)nd2006和海洋无核氯菌(acaryochloris marina)。
[0425]
在一些实施方案中,cas核酸酶是来自酿脓链球菌的cas9核酸酶。在一些实施方案中,cas核酸酶是来自嗜热链球菌的cas9核酸酶。在一些实施方案中,cas核酸酶是来自脑膜炎奈瑟氏菌的cas9核酸酶。在一些实施方案中,cas核酸酶是来自金黄色葡萄球菌的cas9核酸酶。在一些实施方案中,cas核酸酶是来自新凶手弗朗西斯氏菌的cpf1核酸酶。在一些实施方案中,cas核酸酶是来自氨基酸球菌属的cpf1核酸酶。在一些实施方案中,cas核酸酶是来自毛螺科菌nd2006的cpf1核酸酶。在其他实施方案中,cas核酸酶是来自以下的cpf1核酸酶:土拉热弗朗西丝菌(francisella tularensis)、毛螺科菌、瘤胃溶纤维丁酸弧菌(butyrivibrio proteoclasticus)、佩氏细菌(peregrinibacteria bacterium)、帕库氏菌(parcubacteria bacterium)、史密斯氏菌(smithella)、氨基酸球菌属、白蚁甲烷支原体菌候选种(candidatus methanoplasma termitum)、挑剔真杆菌(eubacterium eligens)、牛眼莫拉菌(moraxella bovoculi)、稻田钩端螺旋体(leptospira inadai)、狗口腔卟啉单胞菌(porphyromonas crevioricanis)、解糖胨普雷沃菌(prevotella disiens)或猕猴卟啉单胞菌(porphyromonas macacae)。在某些实施方案中,cas核酸酶是来自氨基酸球菌属或毛螺科菌的cpf1核酸酶。
[0426]
在一些实施方案中,cas切口酶衍生自来自酿脓链球菌的cas9核酸酶。在一些实施方案中,cas切口酶衍生自来自嗜热链球菌的cas9核酸酶。在一些实施方案中,cas切口酶是来自脑膜炎奈瑟氏菌的cas9核酸酶的切口酶形式。参见例如wo/2020081568,其描述nme2cas9 d16a切口酶融合蛋白。在一些实施方案中,cas切口酶衍生自来自金黄色葡萄球菌的cas9核酸酶。在一些实施方案中,cas切口酶衍生自来自新凶手弗朗西斯氏菌的cpf1核酸酶。在一些实施方案中,cas切口酶衍生自来自氨基酸球菌属的cpf1核酸酶。在一些实施方案中,cas切口酶衍生自来自毛螺科菌nd2006的cpf1核酸酶。在其他实施方案中,cas切口酶衍生自来自以下的cpf1核酸酶:土拉热弗朗西丝菌、毛螺科菌、瘤胃溶纤维丁酸弧菌、佩氏细菌、帕库氏菌、史密斯氏菌、氨基酸球菌属、白蚁甲烷支原体菌候选种、挑剔真杆菌、牛眼莫拉菌、稻田钩端螺旋体、狗口腔卟啉单胞菌、解糖胨普雷沃菌或猕猴卟啉单胞菌。在某些实施方案中,cas切口酶衍生自来自氨基酸球菌属或毛螺菌科的cpf1核酸酶。如其他地方所论述,切口酶可通过使两个催化域中的一者失活而衍生自核酸酶,例如通过使核溶解所必需的活性位点残基(例如spy cas9中的d10、h840或n863)突变。本领域技术人员将熟悉容易地鉴定其他cas蛋白中的相应残基的技术,例如序列比对和结构比对,其将在下文详细论
述。
[0427]
在一些实施方案中,grna连同经rna引导的dna结合剂一起称为核糖核蛋白复合物(rnp)。在一些实施方案中,经rna引导的dna结合剂为cas核酸酶。在一些实施方案中,grna连同cas核酸酶一起称为cas rnp。在一些实施方案中,rnp包含第i型、第ii型或第iii型组分。在一些实施方案中,cas核酸酶是来自第ii型crispr/cas系统的cas9蛋白质。在一些实施方案中,grna连同cas9一起称为cas9 rnp。
[0428]
野生型cas9具有两个核酸酶域:ruvc和hnh。ruvc域裂解非目标dna链,并且hnh域裂解目标dna链。在一些实施方案中,cas9蛋白包含多于一个ruvc域和/或多于一个hnh域。在一些实施方案中,cas9蛋白为野生型cas9。在组合物、用途和方法实施方案中的每一者中,cas诱导目标dna中的双链断裂。
[0429]
在一些实施方案中,使用嵌合cas核酸酶,其中所述蛋白质的一个域或区被不同蛋白质的一部分置换。在一些实施方案中,cas核酸酶域可被来自例如fok1的不同核酸酶的域置换。在一些实施方案中,cas核酸酶可为经修饰的核酸酶。
[0430]
在其他实施方案中,cas核酸酶或cas切口酶可来自i型crispr/cas系统。在一些实施方案中,cas核酸酶可为第i型crispr/cas系统的级联复合物的组分。在一些实施方案中,cas核酸酶可为cas3蛋白。在一些实施方案中,cas核酸酶可来自第iii型crispr/cas系统。在一些实施方案中,cas核酸酶可具有rna裂解活性。
[0431]
在一些实施方案中,经rna引导的dna结合剂具有单链切口酶活性,即可切割一个dna链以产生单链断裂,所述单链断裂也称为“切口”。在一些实施方案中,经rna引导的dna结合剂包含cas切口酶。切口酶是在dsdna中产生切口,即切割dna双螺旋体的一条链但不切割另一条链的酶。在一些实施方案中,cas切口酶是其中例如通过催化域中的一种或多种变化(例如点突变)使核酸内切酶活性位点失活的cas核酸酶(例如上文所论述的cas核酸酶)的型式。关于cas切口酶和示例性催化域改变的论述,参见例如美国专利第8,889,356号。在一些实施方案中,cas切口酶,例如cas9切口酶具有失活的ruvc或hnh域。
[0432]
在一些实施方案中,经rna引导的dna结合剂经修饰而仅含有一个功能核酸酶域。例如,药剂蛋白质可经修饰以使得核酸酶域中的一者经突变或完全或部分缺失以降低其核酸裂解活性。在一些实施方案中,使用具有活性降低的ruvc域的切口酶。在一些实施方案中,使用具有非活性ruvc域的切口酶。在一些实施方案中,使用具有活性降低的hnh域的切口酶。在一些实施方案中,使用具有非活性hnh域的切口酶。
[0433]
在一些实施方案中,cas蛋白质核酸酶域中的保守氨基酸经取代以降低或改变核酸酶活性。在一些实施方案中,cas核酸酶可包含ruvc或ruvc样核酸酶域中的氨基酸取代。ruvc或ruvc样核酸酶域中的示例性氨基酸取代包括d10a(基于酿脓链球菌cas9蛋白)。参见例如zetsche等人,(2015)cell10月22:163(3):759-771。在一些实施方案中,cas核酸酶可包含hnh核酸酶域或类hnh核酸酶域中的氨基酸取代。hnh或hnh样核酸酶域中的示例性氨基酸取代包括e762a、h840a、n863a、h983a和d986a(基于酿脓链球菌cas9蛋白)。参见例如zetsche等人,(2015)。其他示例性氨基酸取代包括d917a、e1006a和d1255a(基于新凶手弗朗西斯氏菌u112 cpf1(fncpf1)序列(uniprotkb-a0q7q2(cpf1_fratn))。
[0434]
在一些实施方案中,编码切口酶的mrna将与一对分别与目标序列的有义链和反义链互补的引导rna组合提供。在此实施方案中,引导rna将切口酶导引至靶序列并且通过在
靶序列的相对链上产生切口而引入dsb(即双切口)。在一些实施方案中,使用双切口可改进特异性并减少脱靶效应。在一些实施方案中,连同目标dna的相对链的两个单独引导rna使用切口酶以在目标dna中产生双切口。在一些实施方案中,连同经选择以非常接近的两个单独引导rna使用切口酶以在目标dna中产生双切口。
[0435]
在一些实施方案中,经rna引导的dna结合剂缺乏裂解酶和切口酶活性。在一些实施方案中,经rna引导的dna结合剂包含dcas dna结合多肽。dcas多肽具有dna结合活性,而基本上缺乏催化(裂解酶/切口酶)活性。在一些实施方案中,dcas多肽为dcas9多肽。在一些实施方案中,缺乏裂解酶和切口酶活性的经rna引导的dna结合剂或dcas dna结合多肽是其中例如通过催化域的一种或多种改变(例如点突变),使核酸内切酶活性位点失活的cas核酸酶的形式(例如上文所论述的cas核酸酶)。参见例如us 2014/0186958 a1;us 2015/0166980 a1。
[0436]
在一些实施方案中,经rna引导的dna结合剂包含一个或多个异源功能域(例如为或包含融合多肽)。
[0437]
在一些实施方案中,经rna引导的dna结合剂包含apobec3脱氨酶。在一些实施方案中,apobec3脱氨酶为apobec3a(a3a)。在一些实施方案中,a3a为人类a3a。在一些实施方案中,a3a为野生型a3a。
[0438]
在一些实施方案中,经rna引导的dna结合剂包含脱氨酶和经rna引导的切口酶。在一些实施方案中,mrna进一步包含将测序编码a3a与测序编码经rna引导的切口酶的序列连接的接头。在一些实施方案中,接头是有机分子、基团、聚合物或化学部分。在一些实施方案中,接头是肽接头。在一些实施方案中,肽接头是具有至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少15个、至少20个、至少25个、至少30个、至少40个、至少50个或更多个氨基酸的任何氨基酸伸长段。在一些实施方案中,肽接头是16个残基的“xten”接头或其变体(参见例如实施例;和schellenberger等人,a recombinant polypeptide extends the in vivo half-life of peptides and proteins in a tunable manner.nat.biotechnol.27,1186-1190(2009))。在一些实施方案中,xten接头包含序列sgsetpgtsesatpes(seq id no:900)、sgsetpgtsesa(seq id no:901)或sgsetpgtsesatpeggsggs(seq id no:902)。在一些实施方案中,肽接头包含选自seq id no:903-913的一个或多个序列。
[0439]
在一些实施方案中,异源功能域可促进将经rna引导的dna结合剂输送至细胞核中。例如,异源功能域可为核定域信号(nls)。在一些实施方案中,经rna引导的dna结合剂可与1-10个nls融合。在一些实施方案中,经rna引导的dna结合剂可与1-5个nls融合。在一些实施方案中,经rna引导的dna结合剂可与一个nls融合。在使用一个nls的情况下,nls可在经rna引导的dna结合剂序列的n末端或c末端处融合。其也可插入经rna引导的dna结合剂序列内。在其他实施方案中,经rna引导的dna结合剂可与多于一个nls融合。在一些实施方案中,经rna引导的dna结合剂可与2、3、4或5个nls融合。在一些实施方案中,经rna引导的dna结合剂可与两个nls融合。在某些情形下,两个nls可相同(例如两个sv40 nls)或不同。在一些实施方案中,经rna引导的dna结合剂与在羧基末端处融合的两个nls序列(例如sv40)融合。在一些实施方案中,经rna引导的dna结合剂可与两个nls融合,一个nls连接在n末端处并且一个连接在c末端处。在一些实施方案中,经rna引导的dna结合剂可与3个nls融合。在
一些实施方案中,经rna引导的dna结合剂可不与nls融合。在一些实施方案中,nls可为单联(monopartite)序列,例如sv40 nls、pkkkrkv(seq id no:600)或pkkkrrv(seq id no:601)。在一些实施方案中,nls可为例如核质蛋白的nls、krpaatkkagqakkkk(seq id no:602)的双联序列。在一个特定实施方案中,单一pkkkrkv(seq id no:600)nls可在经rna引导的dna结合剂的c末端处融合。一个或多个接头任选地包括在融合位点处。
[0440]
在一些实施方案中,经rna引导的dna结合剂包含编辑器。示例性编辑器为bc22n,其包括通过xten接头与酿脓链球菌-d10a cas9切口酶融合的智人apobec3a,和编码bc22n的mrna。提供编码bc22n的mrna(seq id no:804)。
[0441]
在一些实施方案中,异源功能域可能够修改经rna引导的dna结合剂的细胞内半衰期。在一些实施方案中,经rna引导的dna结合剂的半衰期可得以提高。在一些实施方案中,经rna引导的dna结合剂的半衰期可得以降低。在一些实施方案中,异源功能域可能能够增加经rna引导的dna结合剂的稳定性。在一些实施方案中,异源功能域可能能够降低经rna引导的dna结合剂的稳定性。在一些实施方案中,异源功能域可充当蛋白质降解的信号肽。在一些实施方案中,蛋白质降解可由蛋白水解酶,例如蛋白酶体、溶酶体蛋白酶或钙蛋白酶蛋白酶介导。在一些实施方案中,异源功能域可包含pest序列。在一些实施方案中,经rna引导的dna结合剂可通过添加泛素或多泛素链来修饰。在一些实施方案中,泛素可为泛素样蛋白质(ubl)。泛素样蛋白质的非限制性实例包括小泛素样修饰因子(sumo)、泛素交叉反应蛋白(ucrp,也称作干扰素刺激基因-15(isg15))、泛素相关修饰因子-1(urm1)、神经元-祖细胞-细胞表达的发育下调蛋白-8(nedd8,在酿酒酵母中被称作rub1)、人类白细胞抗原f相关(fat10)、自噬-8(atg8)和自噬-12(atg12)、fau泛素样蛋白(fub1)、膜锚定ubl(mub)、泛素折叠修饰因子-1(ufm1)和泛素样蛋白-5(ubl5)。
[0442]
在一些实施方案中,异源功能域可为标记域。标记域的非限制性实例包括荧光蛋白、纯化标签、表位标签和报告基因序列。在一些实施方案中,标记域可为荧光蛋白。适合荧光蛋白的非限制实例包括绿色荧光蛋白(例如,gfp、gfp-2、taggfp、turbogfp、sfgfp、egfp、emerald、azami green、monomeric azami green、copgfp、acegfp、zsgreenl)、黄色荧光蛋白(例如,yfp、eyfp、citrine、venus、ypet、phiyfp、zsyellowl)、蓝色荧光蛋白(例如,ebfp、ebfp2、azurite、mkalamal、gfpuv、sapphire、t-sapphire)、青色荧光蛋白(例如,ecfp、cerulean、cypet、amcyan1、midoriishi-cyan)、红色荧光蛋白(例如,mkate、mkate2、mplum、dsred monomer、mcherry、mrfp1、dsred-express、dsred2、dsred-monomer、hcred-tandem、hcred1、asred2、eqfp611、mrasberry、mstrawberry、jred)和橙色荧光蛋白(morange、mko、kusabira-orange、monomeric kusabira-orange、mtangerine、tdtomato)或任何其他适合的荧光蛋白。在其他实施方案中,标记域可为纯化标签和/或表位标签。非限制性的示例性标签包括谷胱甘肽-s-转移酶(gst)、壳质结合蛋白(cbp)、麦芽糖结合蛋白(mbp)、硫氧还蛋白(trx)、聚(nanp)、串联亲和纯化(tap)标签、myc、acv5、au1、au5、e、ecs、e2、flag、ha、nus、softag 1、softag 3、strep、sbp、glu-glu、hsv、kt3、s、s1、t7、v5、vsv-g、6xhis、8xhis、生物素羧基载体蛋白质(bccp)、聚his和调钙蛋白。非限制性的示例性报告基因包括谷胱甘肽-s-转移酶(gst)、辣根过氧化酶(hrp)、氯霉素乙酰基转移酶(cat)、β-半乳糖苷酶、β-葡糖醛酸酶、荧光素酶或荧光蛋白。
[0443]
在其他实施方案中,异源功能域可将经rna引导的dna结合剂靶向至特定细胞器、
细胞型、组织或器官。在一些实施方案中,异源功能域可将经rna引导的dna结合剂靶向至线粒体。
[0444]
在其他实施方案中,异源功能域可为效应子域,例如编辑器域。当经rna引导的dna结合剂导引至其目标序列时,例如当cas核酸酶通过grna导引至目标序列时,效应子(例如编辑器)域可修饰或影响目标序列。在一些实施方案中,效应子(例如编辑器)域可选自核酸结合域、核酸酶域(例如非cas核酸酶域)、表观遗传修饰域、转录活化域或转录抑制子域。在一些实施方案中,异源功能域为核酸酶,例如foki核酸酶。参见例如美国专利第9,023,649号。在一些实施方案中,异源功能域为转录激活因子或抑制子。参见例如qi等人,“repurposing crispr as an rna-guided platform for sequence-specific control of gene expression”,cell 152:1173-83(2013);perez-pinera等人,“rna-guided gene activation by crispr-cas9-based transcription factors”,nat.methods10:973-6(2013);mali等人,“cas9 transcriptional activatorsfor target specificity screening and paired nickases for cooperative genome engineering”,nat.biotechnol
′
.31:833-8(2013);gilbert等人,“crispr-mediated modular rna-guided regulation of transcription in eukaryotes”,cell154:442-51(2013)。因此,经rna引导的dna结合剂基本上变成可使用引导rna导引以结合所需目标序列的转录因子。
[0445]
d.测定引导rna的功效
[0446]
在一些实施方案中,当与形成rnp的其他组分(例如,经rna引导的dna结合剂)一起递送或表达时,测定引导rna的功效。在一些实施方案中,引导rna与经rna引导的dna结合剂,例如cas蛋白,例如cas9一起表达。在一些实施方案中,将引导rna递送至已稳定表达rna引导的dna核酸酶(例如cas核酸酶或切口酶,例如cas9核酸酶或切口酶)的细胞系中或在所述细胞系中表达。在一些实施方案中,引导rna作为rnp的一部分递送至细胞。在一些实施方案中,将引导rna与编码经rna引导的dna核酸酶(例如cas核酸酶或切口酶,例如cas9核酸酶或切口酶)的mrna一起递送至细胞中。
[0447]
如本文所述,使用本文所公开的经rna引导的dna核酸酶和引导rna可引起dsb、ssb和/或位点特异性结合,其导致dna或前mrna中的核酸修饰,在通过细胞机制修复时,所述核酸修饰可产生呈插入/缺失(insertion/deletion、indel)突变形式的误差。归因于插入/缺失的多种突变改变阅读框、引入过早终止密码子或诱导外显子跳跃,并且因此产生非功能性蛋白质。
[0448]
在一些实施方案中,基于体外模型来测定特定引导rna的功效。在一些实施方案中,体外模型为t细胞系。在一些实施方案中,体外模型为hek293 t细胞。在一些实施方案中,体外模型为稳定地表达cas9的hek293细胞(hek293_cas9)。在一些实施方案中,体外模型为类淋巴母细胞细胞系。在一些实施方案中,体外模型为原代人类t细胞。在一些实施方案中,体外模型为原代人类b细胞。在一些实施方案中,体外模型为原代人类外周血淋巴细胞。在一些实施方案中,体外模型为原代人类外周血单核细胞。
[0449]
在一些实施方案中,体外模型中发生缺失或插入的脱靶位点数目例如通过分析来自经cas9 mrna和引导rna体外转染的细胞的基因组dna来测定。在一些实施方案中,此类测定包括分析来自经cas9 mrna、引导rna和供体寡核苷酸体外转染的细胞的基因组dna。用于此类测定的示例性程序提供于以下工作实施例中。
[0450]
在一些实施方案中,在用于引导rna选择过程的多个体外细胞模型上测定特定grna的功效。在一些实施方案中,与所选引导rna针对细胞系的数据进行比较。在一些实施方案中,使用多个细胞模型进行交叉筛选。
[0451]
在一些实施方案中,基于体内模型来测定特定引导rna的功效。在一些实施方案中,体内模型为啮齿动物模型。在一些实施方案中,啮齿动物模型为表达目标基因的小鼠。在一些实施方案中,啮齿动物模型为表达ciita基因的小鼠。在一些实施方案中,啮齿动物模型为表达人类ciita基因的小鼠。在一些实施方案中,啮齿动物模型为表达b2m基因的小鼠。在一些实施方案中,啮齿动物模型为表达人类b2m基因的小鼠。在一些实施方案中,体内模型为非人类灵长类动物,例如食蟹猴。
[0452]
在一些实施方案中,通过中靶裂解效率来评价引导rna的功效。在一些实施方案中,通过目标位置,例如ciita或b2m处的编辑百分比测量引导rna的功效。在一些实施方案中,深度测序可用于鉴定通过基因编辑引入的修饰(例如插入、缺失)的存在。插入/缺失百分比可根据下一代测序“ngs”计算。
[0453]
在一些实施方案中,通过目标细胞类型的基因组内的脱靶序列处的插入/缺失的数目和/或频率来测量引导rna的功效。在一些实施方案中,提供有效引导rna,其在细胞群体中和/或相对于目标位点处的插入/缺失产生频率在脱靶位点以极低频率(例如<5%)产生插入/缺失。因此,本公开提供引导rna,其并不展现目标细胞类型(例如t细胞或b细胞)中的脱靶插入/缺失形成,或其在细胞群体中和/或相对于目标位点处的插入/缺失产生频率产生<5%的脱靶插入/缺失形成频率。在一些实施方案中,本公开提供了并不展现目标细胞类型(例如t细胞或b细胞)中的任何脱靶插入/缺失形成的引导rna。在一些实施方案中,例如如通过一种或多种本文所述方法所评价,提供了在少于5个脱靶位点产生插入/缺失的引导rna。在一些实施方案中,例如如通过一种或多种本文所述方法所评价,提供了在少于或等于4、3、2或1个脱靶位点产生插入/缺失的引导rna。在一些实施方案中,脱靶位点不出现在目标细胞(例如t细胞或b细胞)基因组中的蛋白质编码区中。
[0454]
在一些实施方案中,线性扩增用于检测基因编辑事件,例如目标dna中插入/缺失(“插入缺失”)突变、易位和同源定向修复(hdr)事件的形成。例如,可使用具有独特序列标记的引物的线性扩增并且分离标记的扩增产物(下文称为“unit”,或“独特识别符标签化”方法)。
[0455]
在一些实施方案中,通过目标细胞类型内的染色体重排的数目来测量引导rna的功效。kromatid dgh测定可用于检测染色体重排,包括例如易位、相互易位、易位至脱靶染色体、缺失(即,由于编辑事件而在细胞复制周期中丢失片段的染色体重排)。在一些实施方案中,目标细胞类型具有小于10、小于8、小于5、小于4、小于3、小于2或小于1个染色体重排。在一些实施方案中,目标细胞类型不具有染色体重排。
[0456]
e.grna组合物的递送
[0457]
脂质纳米粒子(lnp)是用于递送核苷酸和蛋白质货物的众所周知的手段,并且可用于递送本文所公开的引导rna、组合物或药物制剂。在一些实施方案中,lnp递送核酸、蛋白质、或核酸连同蛋白质。
[0458]
在一些实施方案中,本发明包含向受试者递送本文所公开的grna中的任一者的方法,其中grna被配制为lnp。在一些实施方案中,lnp包含grna和cas9或编码cas9的mrna。
[0459]
在一些实施方案中,本发明包含一种包含所公开的任一种grna和lnp的组合物。在一些实施方案中,组合物进一步包含cas9或编码cas9的mrna。
[0460]
在一些实施方案中,lnp包含阳离子脂质。在一些实施方案中,lnp包含十八-9,12-二烯酸(9z,12z)-3-((4,4-以(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯(也称为(9z,12z)-十八-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯)或另一种可离子化脂质。参见例如wo/2017/173054和其中所描述的参考文献的脂质。在一些实施方案中,lnp包含摩尔比为约4.5、5.0、5.5、6.0或6.5的阳离子脂质胺与rna磷酸酯(n:p)。在一些实施方案中,在lnp脂质的情形下,术语阳离子型和可离子化可互换,例如其中可离子化脂质取决于ph而为阳离子型的。
[0461]
在一些实施方案中,本文所公开的grna被配制为lnp以用于制备供治疗疾病或病症用的药剂。
[0462]
电穿孔是递送货物的众所周知的方式,并且任何电穿孔方法可用于递送本文所公开的任一种grna。在一些实施方案中,电穿孔可用于递送本文所公开的任一种grna和cas9或编码cas9的mrna。
[0463]
在一些实施方案中,本发明包含向离体细胞递送本文所公开的grna中的任一者的方法,其中grna被配制为lnp或不配制为lnp。在一些实施方案中,lnp包含grna和cas9或编码cas9的mrna。
[0464]
在一些实施方案中,单独或在一个或多个载体上经编码的本文所述的引导rna组合物是在脂质纳米粒子中配制或经由脂质纳米粒子施用;参见例如wo/2017/173054和wo 2019/067992,其内容通过引用整体并入本文。
[0465]
在某些实施方案中,本发明包含dna或rna载体,其编码包含本文所述的引导序列中的任何一者或多者的引导rna中的任一者。在一些实施方案中,除引导rna序列之外,载体进一步包含不编码引导rna的核酸。不编码引导rna的核酸包括但不限于启动子、增强子、调节序列和编码经rna引导的dna核酸酶(其可为例如cas9的核酸酶)的核酸。在一些实施方案中,载体包含一个或多个编码crrna、trrna或crrna和trrna的核苷酸序列。在一些实施方案中,载体包含一个或多个编码sgrna的核苷酸序列和编码经rna引导的dna核酸酶(其可为cas核酸酶,例如cas9或cpf1)的mrna。在一些实施方案中,载体包含一个或多个编码crrna、trrna的核苷酸序列和编码经rna引导的dna核酸酶(其可为cas蛋白,例如cas9)的mrna。在一个实施方案中,cas9来自酿脓链球菌(即,spy cas9)。在一些实施方案中,编码crrna、trrna或crrna和trrna(其可为sgrna)的核苷酸序列包含以下或由以下组成:侧接来自天然存在的crispr/cas系统的重复序列的全部或一部分的引导序列。包含crrna、trrna或crrna和trrna或由crrna、trrna或crrna和trrna组成的核酸可进一步构成载体序列,其中所述载体序列包含以下或由以下组成:不会与crrna、trrna或crrna和trrna一起天然存在的核酸。
[0466]
iv.治疗方法和用途
[0467]
本文所述的任一工程化细胞和组合物可用于治疗如本文所述的多种疾病和病症的方法中。在一些实施方案中,经基因修饰的细胞(工程化细胞)和/或经基因修饰的细胞(工程化细胞)群体和组合物可用于治疗多种疾病和病症的方法中。在一些实施方案中,涵盖治疗本文所述的任一疾病或病症的方法,其包括施用本文所述的任何一种或多种组合
物。
[0468]
在一些实施方案中,本文所述的方法和组合物可用于治疗需要递送治疗剂的疾病或病症。在一些实施方案中,本发明提供了一种在受试者中提供免疫疗法的方法,所述方法包括向受试者施用有效量的如本文所述的工程化细胞(或工程化细胞群体),例如任何前述细胞方面和实施方案的细胞。
[0469]
在一些实施方案中,方法包括向受试者施用组合物,所述组合物包含在本文中描述为过继性细胞转移疗法的工程化细胞。在一些实施方案中,工程化细胞为同种异体细胞。
[0470]
在一些实施方案中,方法包括向受试者施用包含本文所述的工程化细胞的组合物,其中所述细胞产生、分泌和/或表达适用于治疗受试者的疾病或病症的多肽(例如靶向受体)。在一些实施方案中,细胞充当细胞工厂以产生可溶性多肽。在一些实施方案中,细胞充当细胞工厂以产生抗体。在一些实施方案中,细胞在体内连续分泌多肽。在一些实施方案中,细胞在体内移植之后持续分泌多肽,持续至少1、2、3、4、5或6周。在一些实施方案中,细胞在体内移植之后持续分泌多肽,持续超过6周。在一些实施方案中,可溶性多肽(例如抗体)由细胞以每天至少102、103、104、105、106、107或108个拷贝的浓度产生。在一些实施方案中,多肽为抗体并且由细胞以每天至少108个拷贝的浓度产生。
[0471]
在所述方法的一些实施方案中,方法包括在向受试者施用有效量的如本文所述的工程化细胞(engineered cell/engineered cells),例如前述细胞方面和实施方案中的任一者的细胞之前,施用淋巴细胞耗竭剂或免疫抑制剂。在另一方面,本发明提供了一种制备工程化细胞(例如工程化细胞群体)的方法。
[0472]
免疫疗法是通过激活或抑止免疫系统进行的疾病治疗。经设计以引发或扩增免疫反应的免疫疗法被归类为活化免疫疗法。已表明基于细胞的免疫疗法对于治疗一些癌症有效。免疫效应细胞,例如淋巴细胞、巨噬细胞、树突状细胞、自然杀手细胞、细胞毒性t淋巴细胞(ctl)、t辅助细胞、b细胞或其祖细胞,例如造血干细胞(hsc)或诱导多能干细胞(ipsc)可经程序化以响应于肿瘤细胞表面上表达的异常抗原而起作用。因此,癌症免疫疗法允许免疫系统的组分破坏肿瘤或其他癌细胞。也已证明基于细胞的免疫疗法有效地治疗自身免疫疾病或移植排斥反应。免疫效应细胞,例如调节t细胞(treg)或间充质干细胞可经程序化以响应于正常组织表面上所表达的自身抗原或移植抗原而起作用。
[0473]
在一些实施方案中,本发明提供了一种制备工程化细胞(例如工程化细胞群体)的方法。工程化细胞群体可用于免疫疗法。
[0474]
在一些实施方案中,本发明提供了一种治疗有需要的受试者的方法,其包括施用通过制备本文所述的细胞的方法,例如前述细胞制备方法的方面和实施方案中的任一者的方法制备的工程化细胞。
[0475]
在一些实施方案中,工程化细胞可用于治疗癌症、感染性疾病、炎症性疾病、自身免疫疾病、心血管疾病、神经疾病、眼科疾病、肾病、肝病、肌肉骨胳疾病、红细胞疾病或移植排斥反应。在一些实施方案中,工程化细胞可用于细胞移植,例如移植至心脏、肝脏、肺、肾脏、胰腺、皮肤或大脑。(参见例如deuse等人,nature biotechnology 37:252-258(2019)。)。
[0476]
在一些实施方案中,工程化细胞可用作包含同种异体干细胞疗法的细胞疗法。在一些实施方案中,细胞疗法包含诱导多能干细胞(ipsc)。ipsc可经诱导以分化为其他细胞
类型,包括例如β胰岛细胞、神经元和血细胞。在一些实施方案中,细胞疗法包含造血干细胞。在一些实施方案中,干细胞包含可发育为骨、软骨、肌肉和脂肪细胞的间充质干细胞。在一些实施方案中,干细胞包含眼干细胞。在一些实施方案中,同种异体干细胞移植包含同种异体骨髓移植。在一些实施方案中,干细胞包含多能干细胞(psc)。在一些实施方案中,干细胞包含诱导胚胎干细胞(esc)。
[0477]
本文所公开的工程化细胞适合于例如通过引入进一步编辑或修饰的基因或等位基因而进行进一步工程化。在一些实施方案中,多肽为野生型或变异型tcr。本发明的细胞也可适合于通过引入编码例如靶向受体(例如tcr、car、unicar)的外源核酸而进行进一步工程化。car也称为嵌合免疫受体、嵌合t细胞受体或人工t细胞受体。
[0478]
在一些实施方案中,细胞疗法是转基因t细胞疗法。在一些实施方案中,细胞疗法包含靶向转基因t细胞的威尔姆斯氏肿瘤1(wt1)。在一些实施方案中,细胞疗法包含市售t细胞疗法,例如car t细胞疗法的靶向受体或编码靶向受体的供体核酸。当前存在许多批准用于细胞疗法的靶向受体。本文所提供的细胞和方法可与这些已知构建体一起使用。包括用作细胞疗法的靶向受体构建体的商业批准细胞产品包括例如(替沙津鲁(tisagenlecleucel));(阿基仑赛(axicabtagene ciloleucel));tecartus
tm
(布莱奥妥(brexucabtagene autoleucel));肽贝鲁塞(tabelecleucel)viralym-m(alvr105);和viralym-c。
[0479]
在一些实施方案中,方法提供向受试者施用工程化细胞,其中所述施用为注射。在一些实施方案中,方法提供向受试者施用工程化细胞,其中所述施用为血管内注射或输注。在一些实施方案中,方法提供向受试者施用工程化细胞,其中所述施用为单次剂量。
[0480]
在一些实施方案中,方法提供减轻与用本文所公开的组合物治疗的受试者疾病相关的征象或症状。在一些实施方案中,受试者对用本文所公开的组合物治疗具有持续超过一周的反应。在一些实施方案中,受试者对用本文所公开的组合物治疗具有持续超过两周的反应。在一些实施方案中,受试者对用本文所公开的组合物治疗具有持续超过三周的反应。在一些实施方案中,受试者对用本文所公开的组合物治疗具有持续超过一个月的反应。
[0481]
在一些实施方案中,方法提供向受试者施用工程化细胞,并且其中所述受试者对所施用细胞具有反应,包含与通过细胞疗法治疗的疾病相关的征象或症状减轻。在一些实施方案中,受试者具有持续超过一周的反应。在一些实施方案中,受试者具有持续超过一个月的反应。在一些实施方案中,受试者具有持续至少1-6周的反应。
[0482]
实施例
[0483]
提供以下实施例以说明某些所公开实施方案并且不应视为以任何方式限制本公开的范围。
[0484]
实施例1.一般方法
[0485]
1.1.下一代测序(“ngs”)和中靶裂解效率分析。
[0486]
使用quickextract
tm dna提取溶液(lucigen,目录号qe09050)根据制造商的方案提取基因组dna。
[0487]
为了定量地测定基因组中的目标位置处的编辑效率,使用深度测序来鉴定通过基因编辑引入的插入和缺失的存在。围绕所关注基因(例如ciita)内的目标位点设计pcr引
物,并且扩增所关注基因组区域。按本领域中的标准进行引物序列设计。
[0488]
根据制造商的方案(illumina)进行额外pcr以添加用于测序的化学物质。扩增子在illumina miseq仪器上测序。在排除质量分数低的读段后,将读段与人类参考基因组(例如hg38)比对。将与所关注目标区域重叠的读段重新与局部基因组序列比对以改进所述比对。接着计算野生型读段的数目相对于含有c至t突变、c至a/g突变或插入/缺失的读段的数目。在以所预测的cas9裂解位点为中心的20bp区域中对插入和缺失进行评分。插入/缺失百分比定义为在20bp评分区域内插入或缺失一个或多个碱基的测序读段的总数目除以测序读段(包括野生型)的总数目。在包括20bp sgrna目标序列上游10bp和下游10bp的40bp区域中对c至t突变或c至a/g突变进行评分。c至t编辑百分比定义为在40bp区内具有一个或多个c至t突变的测序读段的总数目除以测序读段(包括野生型)的总数目。类似地计算c至a/g突变的百分比。
[0489]
1.2.t细胞培养基制备。
[0490]
下文使用的t细胞培养基组合物描述于此处和表3中。“x-vivo基础培养基”由x-vivo
tm 15培养基、1%penstrep、50μmβ-巯基乙醇、10mm nac组成。除上文所提及的组分以外,使用的其他可变培养基组分为:1.血清(胎牛血清(fbs));和2.细胞因子(il-2、il-7、il-15),也描述于表3中。t细胞培养基组分描述于下表3中。
[0491]
表3.t细胞培养基。
[0492]
[0493][0494]
1.3.制备脂质纳米粒子。
[0495]
将脂质组分以各种摩尔比溶解于100%乙醇中。将rna货物(例如cas9 mrna和grna)溶解于25mm柠檬酸盐、100mm nacl(ph 5.0)中,产生大致0.45mg/ml的rna货物浓度。
[0496]
脂质核酸组装体含有摩尔比分别为50∶38∶9∶3的可离子化脂质a(十八碳-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯,也称为(9z,12z)-十八碳-9,12
‑‑
二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯)、胆固醇、dspc和peg2k-dmg。脂质核酸组装体用约6的脂质胺与rna磷酸酯(n∶p)摩尔比和按重量计1∶1的grna与mrna的比配制。
[0497]
使用交叉流技术,利用含脂质的乙醇与两个体积的rna溶液和一个体积的水的冲击射流混合来制备脂质纳米粒子(lnp)。经由混合交叉使含脂质的乙醇与两个体积的rna溶液混合。经由线内t形件将第四水流与十字管的输出流混合(参见wo2016010840,图2)。将lnp在室温(rt)下保持1小时,并且进一步用水稀释(大约1:1v/v)。使用切向流过滤在平板滤筒(sartorius,100kd mwco)上浓缩lnp,并且然后使用pd-10脱盐柱(ge)将其缓冲液交换至50mm tris、45mm nacl、5%(w/v)蔗糖,ph 7.5(tss)中。或者,任选地使用100kda amicon旋转过滤器浓缩lnp,并且使用pd-10脱盐柱(ge)将其缓冲液交换至tss中。所得混合物接着
使用0.2μm无菌过滤器过滤。将最终lnp储存于4℃或-80℃下直至进一步使用。
[0498]
1.4.核酸酶mrna的体外转录(“ivt”)
[0499]
含有n1-甲基假-u的封端和聚腺苷酸化mrna是通过使用线性化质粒dna模板和t7 rna聚合酶的体外转录产生。通过在以下条件下与xbai一起在37℃下温育2小时来线性化含有t7启动子、转录序列和聚腺苷酸化区域的质粒dna:200ng/μl质粒、2u/μl xbai(neb)和1x反应缓冲液。通过在65℃下加热反应物20分钟来使xbai失活。由酶和缓冲盐纯化经线性化的质粒。用于产生经修饰mrna的ivt反应是通过在37℃下在以下条件下温育1.5-4小时来进行:50ng/μl线性化质粒;各2-5mm的gtp、atp、ctp和n1-甲基假-utp(trilink);10-25mm arca(trilink);5u/μl t7 rna聚合酶(neb);1u/μl鼠类核糖核酸酶抑制剂(neb);0.004u/μl无机大肠杆菌焦磷酸酶(neb);和1x反应缓冲液。将turbo dna酶(thermofisher)添加至0.01u/μl的最终浓度,并且将反应物再温育30分钟以去除dna模板。根据制造商的方案使用megaclear transcription clean-up试剂盒(thermofisher)或rneasy maxi试剂盒(qiagen)纯化mrna。经由沉淀方案(在一些情况下,其后接着是基于hplc的纯化)来纯化mrna。简言之,在dna酶消化之后,使用licl沉淀、乙酸铵沉淀和乙酸钠沉淀来纯化mrna。对于经hplc纯化的mrna,在licl沉淀和重构之后,通过rp-ip hplc纯化mrna (参见例如kariko等人,nucleic acids research,2011,第39卷,第21期e142)。合并选用于汇集的级分并且如上文所述通过乙酸钠/乙醇沉淀来脱盐。在另一个替代方法中,mrna用licl沉淀法纯化,然后通过切向流过滤进一步纯化。通过测量260nm处的吸光度(nanodrop)测定rna浓度,并且通过毛细电泳法用bioanlayzer(agilent)来分析转录物。
[0500]
根据seq id no:801-803(参见表19中的序列),从编码开放阅读框的质粒dna产生酿脓链球菌(“spy”)cas9 mrna。根据seq id no:804-805,从编码开放阅读框的质粒dna产生bc22n mrna。根据seq id no:806,从编码开放阅读框的质粒dna产生bc22 mrna。根据seq id no:807-808,从编码开放阅读框的质粒dna产生ugi mrna。当针对rna在下文提及seq id no:801-808时,应理解,t应替换为u(其为如上文所述的n1-甲基假尿苷)。实施例中使用的信使rna包括5
′
帽和3
′
聚腺苷酸化区域,例如至多100nt,并且在下表19中通过seq id no:801-808鉴定。
[0501]
实施例2.ciita引导rna的筛选。
[0502]
通过评估ii类mhc细胞表面表达的损失,筛选ciita引导rna在t细胞中的功效。在通过rnp电穿孔进行ciita编辑之后测定对ii类mhc蛋白呈阴性的t细胞的百分比(“mhc ii阴性%”)。
[0503]
2.1.t细胞的rnp电穿孔。
[0504]
使用cas9核糖核蛋白(rnp)电穿孔来评估cas9编辑活性。在解冻之后,泛cd3+ t细胞(stemcell,hla-a*02.01/a*03.01)以0.5
×
106个细胞/毫升的密度平铺于由以下各物构成的t细胞rpmi培养基中:rpmi 1640(invitrogen,目录号22400-089),含有5%(v/v)胎牛血清、1x gluatmax(gibco,目录号35050-061)、50μm 2-巯基乙醇、100μm非必需氨基酸(invitrogen,目录号11140-050)、1mm丙酮酸钠、10mm hepes缓冲液、1%的青霉素-链霉素和100u/ml重组人类白细胞介素-2(peprotech,目录号200-02)。t细胞用transact
tm
(1∶100稀释,miltenyi biotec)活化。细胞在rnp转染之前在t细胞rpmi培养基中扩增72小时。
[0505]
将ciita靶向sgrna从其储存板取出,并在95℃下变性2分钟,然后在室温下冷却10
分钟。制备20μm sgrna和10μm重组cas9-nls蛋白(seq id no:800)的rnp混合物并在25℃下温育10分钟。将5μl rnp混合物与100,000个细胞在20μl p3电穿孔缓冲液(lonza)中组合。将22μl rnp/细胞混合物转移至lonza shuttle 96孔电穿孔板的相应孔中。用制造商的脉冲码对细胞一式两份地电穿孔。电穿孔后立即将t细胞rpmi培养基添加至细胞中。随后如实施例1中所描述在编辑后2天培养并收集经电穿孔的t细胞用于ngs测序。
[0506]
2.2.流式细胞术。
[0507]
编辑后第10天,t细胞通过流式细胞术进行表型分型以测定ii类mhc蛋白表达。简言之,将t细胞在靶向hla-dr、dq、dp-pe的抗体(目录号361704)和同型对照-af647(目录号400234)的混合物中温育。随后洗涤细胞,在cytoflex流式细胞仪(beckman coulter)上处理并使用flowjo软件包进行分析。基于大小、形状、活力和ii类mhc表达对t细胞进行门控。如实施例1中所述,对dna样品进行pcr和后续ngs分析。
[0508]
2.3.ciita引导rna筛选的结果。
[0509]
表4a显示对ii类mhc细胞表面表达呈阴性的t细胞的平均百分比。对照1和对照2分别靶向b2m和trac以用于i类mhc的比较性表达。对于每个引导物,示出具有spcas9的切割位点的基因组坐标,以及受体剪接位点边界核苷酸或供体剪接位点边界核苷酸与切割位点之间的距离(核苷酸数)(在表4a中称为与切割位点的距离)。无圆括号的数值显示在剪接位点边界核苷酸与切割位点之间的5
′
方向上的核苷酸的数目,而圆括号中的数值显示在剪接位点边界核苷酸与切割位点之间的3
′
方向上的核苷酸的数目。表4b显示ngs分析的结果。
[0510]
表4a:ciita引导rna筛选。
[0511]
[0512]
[0513]
[0514]
[0515][0516]
表4b-ciita ngs分析。
[0517]
[0518]
[0519][0520]
实施例3.使用bc22筛选ciita引导rna
[0521]
使用bc22筛选ciita引导rna,bc22是一种碱基转化编辑核酸酶,其包括cas9d10a切口酶、人类apobec3a脱氨酶和尿嘧啶糖苷酶抑制剂的融合物。此构建体的特征编辑是胞嘧啶向胸腺嘧啶的转化,而非cas9裂解酶的典型插入/缺失。t细胞中的功效是通过ii类mhc细胞表面表达的损失来评估。在通过mrna和引导物电穿孔进行ciita编辑之后测定对ii类mhc蛋白呈阴性的t细胞的百分比。
[0522]
3.1.t细胞的mrna电穿孔。
[0523]
解冻后,将从商业获得的白细胞采集物(stemcell)分离的泛cd3+ t细胞以0.5
×
106个细胞/毫升的密度平铺于来自表3的培养基20中。用human t-activator cd3/cd28(thermofisher)活化t细胞。细胞在mrna转染之前在t细胞中扩增72小时。
[0524]
将ciita sgrna(表4a)从其储存板取出,并在95℃下变性2分钟,然后在室温下冷却10分钟。用含100,00个t细胞的p3缓冲液(lonza)和10ng/μl编码ugi的mrna(seq id no:807)、10ng/μl编码bc22的mrna(seq id no:806)和2μm sgrna来制备五十微升的电穿孔混
合物。将此混合物转移至lonza shuttle 96孔电穿孔板的对应孔中。使用lonza shuttle 96w,使用制造商的脉冲码在重复孔中对细胞进行电穿孔。电穿孔后立即将培养基20添加至细胞中。然后在编辑后10天培养和收集电穿孔的t细胞用于ngs测序和流式细胞术。如实施例2中所述进行流式细胞术。如实施例1中所述,对dna样品进行pcr和后续ngs分析。
[0525]
表5显示对ii类mhc的细胞表面表达呈阴性的t细胞的平均百分比以及平均编辑百分比。
[0526]
表5:使用bc22的ciita引导筛选。
[0527]
[0528]
[0529]
[0530][0531]
3.4.引导位置相对于ii类mhc蛋白敲低
[0532]
表6和图2显示使用cas9和bc22的ii类mhc的基因敲除%与切割位点至剪接位点边界核苷酸的距离的关系。
[0533]
对于每个引导物,示出具有spcas9的剪切位点的基因组坐标,以及受体剪接位点边界核苷酸或供体剪接位点边界核苷酸与剪切位点之间的距离(核苷酸数)。正数值显示在剪接位点边界核苷酸与剪切位点之间的5
′
方向上的核苷酸的数目,而负数值显示在剪接位点边界核苷酸与剪切位点之间的3
′
方向上的核苷酸的数目。
[0534]
表6:引导位置相对于蛋白质敲低效率
[0535][0536]
实施例4.使用反式ugi在t细胞中进行编辑。
[0537]
4.1t细胞中的编辑
[0538]
在ciita基因座处用反式ugi和bc22n或cas9编辑t细胞以评估编辑类型对ii类mhc抗原的影响。bc22n是一种碱基转化编辑器核酸酶,其包括cas9d10a切口酶、人类apobec3a脱氨酶的融合物。此构建体的特征编辑是胞嘧啶向胸腺嘧啶的转化,而非cas9裂解酶的典型插入/缺失。
[0539]
健康人类供体血球分离术是商业获得的(hemacare),并且细胞在lovo装置上经洗涤并重悬于pbs/edta缓冲液(miltenyi biotec目录号130-070-525)中。使
用cd4和cd8磁珠(miltenyi biotec目录号130-030-401/130-030-801),使用plus和ls一次性试剂盒,经由阳性选择分离t细胞。将t细胞等分至小瓶中并冷冻保存于cs10(stemcell technologies目录号07930)和plasmalyte a(baxter目录号2b2522x)的1:1制剂中以供将来使用。解冻后,t细胞以1.0
×
106个细胞/毫升的密度平铺于由以下各物构成的t细胞基础培养基中:x-vivo 15
tm
无血清造血细胞培养基(lonza bioscience),含有5%(v/v)胎牛血清、50μm 2-巯基乙醇、10mm n-乙酰基-l-(+)-半胱氨酸、10u/ml青霉素-链霉素,外加1x细胞因子(200u/ml重组人类白细胞介素-2、5μg/ml重组人类白细胞介素-7和5μg/ml重组人类白细胞介素-15)。用transact
tm
(1:100稀释,miltenyi biotec)活化t细胞。细胞在电穿孔之前在含有transact
tm
的t细胞基础培养基中扩增72小时。
[0540]
4.2.t细胞的电穿孔
[0541]
在无菌水中制备含有编码cas9、bc22n(seq id no:804)或ugi(seq id no:807)的mrna的溶液。将50μm ciita sgrna(g018076和g018117)(分别为seq id no:56和97)从其储存板取出,并且在95℃下变性2分钟,然后在冰上冷却。活化后七十二小时,收集t细胞,离心,并以12.5
×
106个t细胞/毫升的浓度重悬于p3电穿孔缓冲液(lonza)中。对于待电穿孔的每个孔,将1
×
105个t细胞与200ng编辑器mrna、200ng ugi mrna和20pmol sgrna在最终体积为20μl的p3电穿孔缓冲液中混合。此混合物一式三份转移至96孔nucleofector
tm
板中并使用制造商的脉冲码电穿孔。经电穿孔的t细胞立即在不含细胞因子的80μl t细胞基础培养基中静置10分钟,然后转移至含有额外100μl补充有2x细胞因子的t细胞基础培养基的新平底96孔板中。所得板在37℃下温育4天。96小时后,将t细胞以1:3稀释至含1x细胞因子的新鲜t细胞基础培养基中。随后将电穿孔的t细胞再培养3天并且收集用于流式细胞术分析、ngs测序和转录组学。如实施例1中所述进行ngs分析。
[0542]
4.3.流式细胞术和ngs测序。
[0543]
编辑后第7天,t细胞通过流式细胞术进行表型分型以测定ii类mhc蛋白表达。简言之,在靶向hla-dr、dq、dp-pe的抗体(目录号361704)和同型对照-pe(目录号400234)的混合液中温育t细胞。随后洗涤细胞,在cytoflex流式细胞仪(beckman coulter)上处理并使用flowjo软件包进行分析。基于大小、形状、活力和ii类mhc表达对t细胞进行门控。如实施例1中所述,对dna样品进行pcr和后续ngs分析。表7和图1a、图1b和图6a显示ciita基因编辑。对于cas9和bc22n条件,总编辑均接近完成,超过95%。表7和图1c、表1d和图6b显示在通过ugi mrna与cas9或bc22n mrna的组合进行电穿孔之后,ii类mhc阴性细胞的平均百分比。
[0544]
表7以总ngs读段的百分比呈现的t细胞中的ciita编辑;ii类mhc阴性的平均百分比的流式细胞术评估。
res.34,535-539;tf
ü
rei,d.等人,nat.methods13,966-967)测定蛋白质-蛋白质相互作用。使用分子复合物检测(mcode)算法鉴定密集连接的网络(bader,g.d.等人,bmc bioinformatics 4,1-27)并且保留依据p值的三个最佳评分项作为对应网络组件的功能描述。
[0551]
相比于用编码cas9的mrna(seq id no:809)处理的样品,用bc22n mrna(seq id no:806)电穿孔的t细胞显示ii类mhc基因和hla相关cd74基因的显著较强下调(表8和表9)。观测到对i类mhc基因的最小影响(表10和表11)。就总转录组范围内的差异基因表达事件而言,当与cas9 mrna相比时,用bc22nmrna处理产生较少差异表达基因(调整后p值<0.05)。在用sgrna g0 18076(seq id no:56)电穿孔的t细胞中,分别观测到cas9和bc22n mrna处理的总共553和65个差异基因表达事件(图7a和图7b)。在用sgrna g018117(seq id no:97)电穿孔的t细胞中观测到类似趋势,在分别用cas9和bc22n mrna处理时,其显示303和30个差异基因表达事件(图7c和图7d)。当相比于用cas9 mrna与sgrna g018076(seq id no:56)(图8a(cas9)和图8b(bc22n))和sgrna g018117(seq id no:97)(图8c(cas9)和图8d(bc22n))处理时,在用bc22nmrna处理的t细胞中,在差异表达基因列表中鉴定较少蛋白质-蛋白质相互作用网络。
[0552]
表8.t细胞中ii类mhc基因的差异基因表达。
[0553]
(ns=不显著,*=调整后p值<0.05,**=调整后p值<0.01,***=调整后p值<0.001)。关于转录物定量数据,参看表9。
[0554][0555]
表9.t细胞中ii类mhc基因表达的转录物定量。
[0556]
每个方格含有每一百万个mrna分子中来自给定基因的转录物的平均数目。关于统计学显著性,请参看表8。
[0557][0558][0559]
表10.用不同mrna组合和ciita sgrna处理后7天收集的t细胞中i类hla基因的差异基因表达。
[0560]
(ns=不显著,*=调整后p值<0.05,**=调整后p值<0.01,***=调整后p值<0.001)。关于转录物定量数据,参看表11。
[0561][0562]
表11.t细胞中i类hla基因表达的转录物定量。
[0563]
每个方格含有每一百万个mrna分子中来自给定基因的转录物的平均数目。关于统计学显著性,请参看表12。
[0564][0565][0566]
实施例6.bc22n:ugi比固定的t细胞中的lnp滴定。
[0567]
使用lnp递送至活化人类t细胞,用cas9或bc22n评估单靶点和多靶点编辑的效力。
[0568]
6.1.t细胞制备。
[0569]
健康人类供体血球分离术是商业获得的(hemacare),并且细胞在lovo装置上经洗涤并重悬于pbs/edta缓冲液(miltenyi biotec目录号130-070-525)中。使用cd4和cd8磁珠(miltenyi biotec目录号130-030-401/130-030-801),使用plus和ls一次性试剂盒,经由阳性选择分离t细胞。将t细胞等分至小瓶中并冷冻保存于cs 10(stemcell technologies目录号07930)和plasmalyte a(baxter目录号2b2522x)的1∶1制剂中以供将来使用。解冻后,t细胞以1.0
×
106个细胞/毫升的密度平铺于由以下各物构成的t细胞基础培养基中:x-vivo 15
tm
无血清造血细胞培养基(lonza bioscience),含有5%(v/v)胎牛血清、50μm 2-巯基乙醇、10mm n-乙酰基-l-(+)-半胱氨酸、10u/ml青霉素-链霉素,外加1x细胞因子(200u/ml重组人类白细胞介素-2、5ng/ml重组人类白细胞介素-7和5ng/ml重组人类白细胞介素-15)。t细胞用transact
tm
(1∶100稀释,miltenyi biotec)活化。细胞在lnp转染之前在t细胞基础培养基中扩增72小时。
[0570]
6.2.t细胞编辑。
[0571]
如实施例1中所述,每个rna物种,即ugi mrna、sgrna或编辑器mrna分别在lnp中配制。编辑器mrna编码bc22n(seq id no:805)或cas9。单独或组合使用靶向b2m(g015995)(seq id no:704)、trac(g016017)(seq id no:705)、trbc1/2(g016206)(seq id no:706)和ciita(g018117)(seq id no:97)的引导物。编码ugi的信使rna(seq id no:807)是在实验的cas9和bc22n组中递送以对脂质量进行归一化。先前实验已确立,ugi mrna在与cas9 mrna一起使用时不影响总编辑或编辑概况。如表12中所述,对于编辑器mrna、引导rna和ugi mrna,lnp分别混合至6∶3∶2的固定总mrna重量比。在表12中所述的4引导物实验中,将个别引导物稀释4倍以维持总体6:3编辑器mrna:引导物重量比并允许与基于总脂质递送的个别引导物效力进行比较。将lnp混合物在37℃下在用6%食蟹猴血清(bioreclamation ivt,目录号cyn220760)代替胎牛血清的t细胞基础培养基中温育5分钟。
[0572]
活化后七十二小时,将t细胞洗涤并悬浮于基础t细胞培养基中。将预温育lnp混合
物以1
×
10e5个t细胞/孔添加至每个孔中。在实验期间,在37℃下将t细胞与5%c02一起温育。在活化后6天和8天以及活化后第十天更换t细胞培养基,收集细胞以通过ngs和流式细胞术进行分析。如同实施例1进行ngs。
[0573]
表12和图3a-图3d描述当个别引导物用于编辑时t细胞的编辑概况。在所有测试的引导物中,总编辑和c至t编辑显示与bc22n mrna、ugi mrna和引导物的量增加的直接、剂量反应关系。插入/缺失和c转化为a或g与剂量逆相关,其中较低剂量导致较高百分比的这些突变。在经cas9编辑的样品中,总编辑和插入/缺失活性随总rna剂量而增加。
[0574]
表12.总读段百分比形式的编辑-单引导物递送。
[0575]
[0576][0577]
表13和图4a-图4d以总读段的百分比描述了当同时使用四个引导物进行编辑时,t细胞的编辑概况。在此组实验中,每个引导物以与单引导物编辑实验相比25%的浓度使用。总共,t细胞同时暴露于6种不同lnp(编辑器mrna、ugi mrna、4个引导物)。相比于用cas9编辑,用bc22n和反式ugi编辑使得每个基因座的最大总编辑百分比更高。
[0578]
表13.总读段百分比形式的编辑-多引导物递送。
[0579]
[0580][0581]
活化后第10天,t细胞通过流式细胞术进行表型分型以测定编辑是否导致细胞表面蛋白损失。简言之,将t细胞在以下抗体的混合物中温育:b2m-fitc(biolegend,目录号316304)、cd3-af700(biolegend,目录号317322)、hla dr dq dp-pe(biolegend,目录号361704)和dapi(biolegend,目录号422801)。将未编辑的细胞子集与同型对照-pe(目录号400234)一起温育。随后将细胞洗涤,在cytoflex仪器(beckman coulter)上处理并使用flowjo软件包进行分析。基于大小、形状、活力和抗原表达对t细胞进行门控。
[0582]
表14和图5a-图5h将表型分型结果报告为对抗体结合呈阴性的细胞的百分比。
bc22n和cas9样品两者的抗原阴性细胞的百分比随着总rna增加而以剂量反应性方式增加。对于所有测试的引导物,相比于经cas9编辑的细胞,经bc22n编辑的细胞显示出类似或更高的蛋白质敲除。在多编辑细胞中,相比于cas9与反式ugi,bc22n与反式ugi显示出显著更高百分比的抗原阴性细胞。例如,在550ng的最高总rna剂量下的bc22n编辑样品显示84.2%细胞缺乏所有三种抗原,而cas9编辑仅产生46.8%此类三重基因敲除细胞。对于仅用一个引导物处理的样品,dna编辑与抗原减少之间的相关性是稳定的。当比较c至t转化与抗原敲除时,bc22n的r平方测量值为0.93。当比较插入/缺失与抗原敲除时,cas9的r平方测量值为0.95。
[0583]
表14.流式细胞术数据-抗原阴性细胞百分比(n=2)。
[0584]
[0585]
block(biolegend)封闭5分钟,接着用抗人类mhc-i apc抗体(克隆编号w6/,biolegend)单独染色或与抗人类hla-e bv421抗体(克隆编号3d 12,biolegend)共染色30分钟。针对wt荧光素酶
+ t细胞、b2m-/-荧光素酶
+ t细胞和b2m-/-hla-e
+
荧光素酶
+ t细胞,使用bd facs aria分别对仅gfp
+
、gfp
+
/mhc-i-、gfp
+
/mhc-i-/hla-e
+
进行门控来分选细胞。将收集的细胞洗涤并重悬于中培养基编号19中,并且转移至6孔g-rex。细胞用1:100稀释的另一轮transact刺激48小时。刺激48小时后,经刺激的t细胞洗掉transact并重悬于中培养基编号19中,并且在每2天添加新鲜细胞因子的g-rex板中培养。
[0597]
7.5.制备注射用t细胞。
[0598]
在第二次刺激后10天,在用pbs洗涤并重悬于用于向nog-il15小鼠注射的hbss溶液中之后,注射t细胞。
[0599]
7.6.hla-e对体内b2m基因敲除t细胞的保护作用。
[0600]
nk细胞用hbss(gibco,目录号14025-092)洗涤并以10
×
106个细胞/毫升重悬,以便以150μl注射。小鼠最初分成两组:(1)未注射的nog/il-15小鼠,对照组(n=1);和(2)150万个原代nk细胞(n=2)。额外六组接受以下治疗:(3)仅野生型t细胞(n=4);(4)仅b2m-/-t细胞(n=4);(5)仅b2m-/-hla-e t细胞(n=4),(6)150万个原代nk细胞+野生型t细胞(n=5);(7)150万个原代nk细胞+b2m-/-t细胞(n=5);和(8)150万个原代nk细胞+b2m-/-hla-e t细胞(n=5)。用27号针经由尾静脉注射nk细胞溶液。
[0601]
小鼠在nk细胞注射后28天接种野生型、b2m-/-或b2m-/-+hla-e t细胞。以6
×
106个细胞/150μl体积的浓度制备细胞。
[0602]
进行ivis成像以通过ivis光谱鉴定荧光素酶阳性t细胞。在t细胞注射之后6小时、24小时、48小时、4天、6天、8天、11天、18天、25天、29天、33天、50天、55天、61天、74天和90天进行ivis成像。根据制造商的建议,通过以10μl/g体重,每只动物约150μl腹膜内注射d-荧光素使小鼠准备进行成像。将动物麻醉并接着置于ivis成像单元中。在曝光时间设定为自动、视野d、中等分格和f/stop设定为1的情况下进行可视化。
[0603]
图9a显示在t细胞注射后90天,hla-e保护b2m ko t细胞免受nk细胞溶解。图9b显示在t细胞注射后90天时程内,hla-e保护b2m ko t细胞免受nk细胞侵害。图9c显示hla-e在重复研究的30天时程内的保护作用。
[0604]
实施例8:类淋巴母细胞细胞系中的ciita编辑。
[0605]
包含ciita引导rna的脂质纳米粒子(lnp)用于编辑两种类淋巴母细胞细胞系(lcl)。lcl是通过用爱泼斯坦-巴尔病毒(epstein barr virus,ebv)感染来自人类供体的外周血淋巴细胞(pbl)而产生。已证明此过程在体外永生化人类静息b细胞,从而产生增殖活跃的b细胞群体,所述群体对b细胞标志物cd19呈阳性并且对t细胞标志物cd3以及nk细胞标志物cd56呈阴性(neitzel h.a routine method for the establishment of permanent growing lymphoblastoid cell lines.hum genet.1986;73(4):320-6)。
[0606]
类淋巴母细胞细胞系gm26200和gm20340获自coriell institute for medical research(camden,nj,usa)。lcl在具有l-谷氨酰胺和15%fbs的rpmi-1640中生长。在lnp接触时,细胞经4ng/ml il-4(r&d system目录号204-il-010)、1ng/ml il-40(r&d system目录号6245-cl-050)、25ng/ml baff(r&d system目录号2149-bf-010)活化。靶向b2m的lnp以50/10/38.5/1.5可离子化脂质b、胆固醇、dspc和peg2k-dmg的比率配制,如实施例1.3中所
biotec,目录号130-120-431)、ii类mhc(miltenyi biotec,130-104-823)和cd3-生物素(miltenyi biotec,目录号130-098-612)选择三重敲除细胞。收集阴性选择的细胞用于流式细胞术分析和ngs分析。实施例3.3和1.1中所述的方案用于这些分析。
[0615]
9.2.依序和同时lnp处理。
[0616]
对于lnp处理,如同实施例3.1分离和冷冻保存t细胞。解冻后,t细胞用制造商的方案所推荐的t细胞transact
tm
(miltenyi biotec,目录号130-111-160)活化,并且在37℃下培养24-72小时,如下文所规定。
[0617]
对于同时lnp处理,t细胞在活化后72小时用三种lnp处理,所述lnp递送编码cas9的mrna(seq id no:809)和分别靶向b2m、trac和ciita的sgrna g000529(seq id no:701)、g012086(seq id no:703)和g013674(seq id no:702)。将lnp在37℃下与食蟹猴血清一起预温育5分钟并且以每100,000个t细胞100ng总rna货物给药。在24小时lnp暴露后,将细胞洗涤并重悬于如表3中所述的培养基编号11中,并且在37℃下培养5天。
[0618]
对于依序lnp处理,t细胞在活化后24小时用单一lnp处理,所述lnp递送编码cas9的mrna(seq id no:809)和靶向b2m的g000529(seq id no:701),如上文针对同时lnp处理所描述。在洗涤和重悬之后,在活化后48小时添加单一lnp,所述lnp递送编码cas9的mrna(seq id no:809)和靶向ciita的g013674(seq id no:702)。最后,在洗涤和重悬后,在活化后72小时添加单一lnp,所述lnp递送编码cas9的mrna(seq id no:809)和靶向trac的g012086(seq id no:703)。在暴露于最终lnp 24小时之后,将细胞洗涤并重悬于如表3中所述的培养基编号11中,并且在37℃下培养5天。
[0619]
lnp处理的t细胞穿过macs三阴性选择过程并且对这些样品进行进一步流式细胞术分析(如实施例3.2中所述)和ngs分析(如实施例1.1中所述),如针对电穿孔细胞所描述。
[0620]
在macs处理之前和之后,通过ngs来测定经处理和未经处理的细胞的编辑百分比(如实施例1.1中所述),并且通过流式细胞术分析其蛋白质表达(如实施例3.3中所述)。以下流式细胞术试剂分别用作b2m、ciita和trac的基因编辑的表型读出:fitc抗人类β2-微球蛋白抗体(目录号316304)、apc抗人类cd3抗体(目录号300412)、pe抗人类hla-dr、dp、dq抗体(目录号361716)。ngs编辑结果显示于表15和图10a(在mac之前)、图10b(在mac之后)中。流式细胞术结果显示于表16和图11a(在mac之前)、图11b(在mac之后)中。
[0621]
表15.通过ngs的编辑分析。
[0622][0623]
表16.流式细胞术分析。
[0624][0625]
9.3.用于染色体结构重排的kromatid dgh
tm
分析。
[0626]
根据kromatid的方案制备工程化t细胞用于dgh程序。简言之,在添加kromatid提供的5μm brdu和1μm brdc的情况下,将t细胞培养17小时。以10μl/ml的浓度添加乙酰甲基秋水仙素(colcemid)后再维持4小时。通过离心收集细胞,在室温下在75mm kcl低渗溶液中温育30分钟,并且在3:1甲醇:乙酸溶液中固定。
[0627]
三组荧光原位杂交(fish)探针经设计以将用于工程化这些t细胞的引导物的基因组目标位点括在一起,所述t细胞位于独立染色体上。kromatid使用其专有的dgh fish对每个样品的200个中期扩散进行成像,并且对染色体结构重排的扩散进行评分。无染色体结构重排的细胞显示3对颜色匹配、相邻的fish信号。当在细胞中鉴定出目标位点的fish信号为零时,对“缺失”进行评分,表明染色体重排,其中片段在细胞复制周期中由于编辑事件的发生而丢失。对于各对相邻、颜色不匹配的fish信号进行“相互易位”评分,表明两个cas9靶向分裂之间(例如b2m与trac目标位点之间)的易位。“脱靶染色体易位”显示单一fish信号,表明cas9靶向裂解位点与未标记染色体位点之间的融合。
[0628]“复杂易位”指示fish信号不包括于相互易位和脱靶位点易位中。总易位计算为相互易位、基因组中的脱靶染色体/位点易位和复杂易位的总和。表17和图12显示通过此方法针对各条件鉴定的染色体重排。
[0629]
表17.通过kromatid dgh测定的易位分析。
[0630]
染色体重排事件:未处理依序lnp同时lnprnp ep总易位10713相互易位0023脱靶染色体易位1039复杂易位0021缺失08630
[0631]
实施例10:脱靶分析
[0632]
10.1.生物化学脱靶分析。
[0633]
生物化学方法(参见例如cameron等人,nature methods.6,600-606;2017)用于使用靶向ciita的特定引导物来确定由cas9裂解的潜在脱靶基因组位点。在此实验中,使用从淋巴母细胞细胞系na24385(coriell institute)纯化的基因组dna以及具有已知脱靶特征的三个对照引导物筛选了两种靶向人类ciita的sgrna。在生物化学测定中使用192nm和64nm的引导物浓度检测到的潜在脱靶位点数目显示于表18中。
[0634]
表18:生物化学脱靶分析。
[0635]
seq id no: 靶标位点数目
71g018091ciita60380g018100ciita291100g018120ciita203707g000644emx1440708g000645vegfa6384709g000646rag1b144
[0636]
seq id no: 靶标位点数目14g018034ciita1415g018035ciita358g018078ciita4961g018081ciita962g018082ciita2366g018086ciita35381g018101ciita1384g018104ciita3885g018105ciita9387g018107ciita3688g018108ciita5689g018109ciita73707g000644emx1276708g000645vegfa3259709g000646rag1b32
[0637]
10.2.用于验证潜在脱靶位点的靶向测序。
[0638]
通过检测测定,例如上文所用的生物化学方法预测的潜在脱靶位点可使用鉴定的潜在脱靶位点的靶向测序来评估,以确定是否检测到所述位点处的脱靶裂解。
[0639]
在一种方法中,将所关注的cas9和sgrna(例如用于评价的具有潜在脱靶位点的sgrna)引入至初级t细胞中。接着将t细胞溶解并且使用侧接潜在脱靶位点的引物产生用于ngs分析的扩增子。某一水平的插入/缺失的鉴定可验证潜在脱靶位点,而在潜在脱靶位点发现的插入/缺失的缺乏可表明所用脱靶预测测定的假阳性。
[0640]
实施例11:通过bc22n在t细胞中进行的ciita引导rna筛选
[0641]
使用c至t碱基编辑筛选不同sgrna在人类t细胞中敲除ciita基因的效力。在用mrna和不同sgrna电穿孔之后的ciita编辑后,测定了对ii类mhc和/或cd74蛋白表达呈阴性的t细胞的百分比。
[0642]
11.1t细胞制备
[0643]
健康人类供体血球分离术是商业上获得的(hemacare),并且将细胞洗涤并重悬于pbs/edta缓冲液(miltenyi biotec目录号130-070-525)中并且在multimacs
tm cell 24separator plus装置(miltenyi biotec)中进行处理。使用straight fromcd4/cd8microbead试剂盒,人类(miltenyi biotec目录号130-122-352)
经由阳性选择分离t细胞。将t细胞等分并且在cs10(stemcell technologies目录号07930)中冷冻保存以供将来使用。
[0644]
解冻后,将t细胞以1.0
×
10^6个细胞/毫升的密度平铺于由以下各物构成的t细胞生长培养基(tcgm)中:cts optmizer t细胞扩增sfm和t细胞扩增补充物(thermofisher目录号a1048501)、5%人类ab血清(geminibio,目录号100-512)、1x青霉素-链霉素、1x glutamax、10mm hepes、200u/ml重组人类白细胞介素-2(peprotech,目录号200-02)、5ng/ml重组人类白细胞介素-7(peprotech,目录号200-07)和5ng/ml重组人类白细胞介素-15(peprotech,目录号200-15)。t细胞在此培养基中静置24小时,此时其用以1∶100体积比添加的t cell transact
tm
,人类试剂(miltenyi,目录号130-111-160)活化。t细胞在电穿孔之前活化48小时。
[0645]
11.2通过rna电穿孔进行的t细胞编辑
[0646]
在p3缓冲液中制备含有编码bc22n(seq id no:804或805)和ugi(seq id no:807或808)的mrna的溶液。将一百μm ciita靶向sgrna从其储存板中取出并在95℃下变性2分钟,并且在室温下温育5分钟。活化后四十八小时,收集t细胞,离心,并以12.5
×
10^6个t细胞/毫升的浓度重悬于p3电穿孔缓冲液(lonza)中。对于电穿孔,将1
×
10^5个t细胞与20ng/μl bc22n mrna、20ng/μl ugi mrna和20pmol sgrna(如表1中所述)在最终体积为20μl的p3电穿孔缓冲液中混合。将此混合物一式两份地转移至96孔nucleofector
tm
板中并且使用制造商的脉冲码电穿孔。经电穿孔的t细胞立即在不含细胞因子的80μl cts optimizer t细胞生长培养基中静置15分钟,然后转移至含有额外80μl补充有2x细胞因子的cts optimizer t细胞生长培养基的新平底96孔板中。将所得板在37℃下温育10天。在电穿孔后第4天,细胞在2个u形底板中以1∶2分裂。收集一个板用于ngs测序,而另一个板补充有含1x细胞因子的cts optimizer新鲜培养基。此板在第7天用于流式细胞术。
[0647]
11.3流式细胞术和ngs测序
[0648]
编辑后第7天,通过流式细胞术测定t细胞以确定cd74和hla-dr、dp、dq的表面表达。简言之,将t细胞与在细胞染色缓冲液(biolegend,目录号420201)中稀释的抗体的混合物一起在4℃下温育30分钟。针对cd3(biolegend,目录号317336)、cd4(biolegend,目录号317434)、cd8(biolegend,目录号301046)和viakrome(beckman coulter,目录号c36628)的抗体以1:100稀释,并且针对hla ii-dr(biolegend,目录号327018)、hla ii-dp(bd biosciences,目录号750872)、hla ii-dq(biolegend,目录号561504)和cd74(biolegend,目录号326808)的抗体以1∶50稀释。随后将细胞洗涤,重悬于100μl细胞染色缓冲液中并且在cytoflex流式细胞仪(beckman coulter)上进行处理。使用flowjo软件包分析流式细胞术数据。基于大小、形状、活力、cd8、hla ii-dp、hla ii-dq、hla ii-dr和cd74表达对t细胞进行门控。
[0649]
表19:用bc22n对ciita进行基因组编辑后对表面蛋白呈阴性的细胞的百分比。(n=2)
[0650]
[0651]
[0652][0653]
在编辑后第4天,对dna样品进行pcr和后续ngs分析,如实施例1中所述。表20显示用bc22n编辑的t细胞中的ciita编辑结果。
[0654]
表20:在ciita基因座处用bc22n的平均编辑百分比。(n=2)
[0655]
[0656]
fromcd4/cd8microbead试剂盒,人类(miltenyi biotec目录号130-122-352)经由阳性选择分离t细胞。将t细胞等分并且在cs 10(stemcell technologies目录号07930)中冷冻保存以供将来使用。
[0662]
解冻后,将t细胞以1.0
×
10^6个细胞/毫升的密度平铺于由以下各物构成的t细胞生长培养基(tcgm)中:cts optmizer t细胞扩增sfm和t细胞扩增补充物(thermofisher目录号a1048501)、5%人类ab血清(geminibio,目录号100-512)、1x青霉素-链霉素、1x glutamax、10mm hepes、200u/ml重组人类白细胞介素-2(peprotech,目录号200-02)、5ng/ml重组人类白细胞介素7(peprotech,目录号200-07)和5ng/ml重组人类白细胞介素15(peprotech,目录号200-15)。t细胞在此培养基中静置24小时,此时其用以1∶100体积比添加的t cell transact
tm
人类试剂(miltenyi,目录号130-111-160)活化。t细胞在电穿孔之前活化48小时。
[0663]
12.2通过rna电穿孔进行的t细胞编辑
[0664]
在p3缓冲液中制备含有编码bc22n(seq id no:804或805)和ugi(seq id no:807或808)的mrna的溶液。将100μm ciita靶向sgrna从其储存板中取出并在95℃下变性2分钟,并且在室温下温育5分钟。活化后四十八小时,收集t细胞,离心,并且以12.5
×
10^6个t细胞/毫升的浓度重悬于p3电穿孔缓冲液(lonza)中。在96孔pcr板中从60pmol开始,一式两份地在p3电穿孔缓冲液中以1∶2比率连续稀释每个sgrna。稀释后,将1
×
10^5个t细胞、20ng/μl bc22n mrna和20ng/μl ugi mrna与sgrna板混合以制备最终体积为20μl的p3电穿孔缓冲液。将此混合物转移至4个对应96孔nucleofector
tm
板中并且使用制造商的脉冲码进行电穿孔。经电穿孔的t细胞立即在不含细胞因子的80μl cts optimizer t细胞生长培养基中静置15分钟,然后转移至含有额外80μl补充有2x细胞因子的cts optmizer t细胞生长培养基的新平底96孔板中。将所得板在37℃下温育7天。在电穿孔后第4天,细胞在两个u形底板中以1∶2分裂,并且收集一个板用于ngs测序,而另一个板补充有含1x细胞因子的cts optimizer新鲜培养基。此板在第7天用于流式细胞术。
[0665]
12.3流式细胞术和ngs测序
[0666]
编辑后第7天,通过流式细胞术测定t细胞以确定hla-dr、dp、dq的表面表达。简言之,将t细胞与在细胞染色缓冲液(biolegend,目录号420201)中稀释的抗体的混合物一起在4℃下温育30分钟。针对cd3(biolegend,目录号317336)、cd4(biolegend,目录号317434)、cd8(biolegend,目录号301046)和viakrome(beckman coulter,目录号c36628)的抗体以1∶100稀释,并且针对hla ii-dr、dp、dq(biolegend,目录号361714)的抗体以1∶50稀释。随后将细胞洗涤,重悬于100μl细胞染色缓冲液中并且在cytoflex流式细胞仪(beckman coulter)上进行处理。使用flowjo软件包分析流式细胞术数据。基于大小、形状、活力、cd8和hla-dr、dp、dq对t细胞进行门控。
[0667]
表21显示ciita编辑结果和在用bc22n进行碱基编辑之后t细胞中对hla-dr、dp、dq呈阴性的t细胞百分比。
[0668]
表21:编辑百分比和在用bc22n碱基编辑器进行ciita编辑之后的hla ii-dp、dq、dr阴性细胞百分比
[0669]
[0670]
[0671][0672]
实施例13.对ciita剪接引导物的脱靶分析
[0673]
筛选来自实施例10的t细胞以验证靶向ciita的脱靶基因组位点并且是根据integrated dna technologies,idt rhampseq rhpcr方案进行。在此实验中,筛选3种靶向ciita的sgrna以验证脱靶概况。靶向ciita引导物(g018082、g018081和g018034)的sgrna的经验证脱靶位点的数目显示于表22中。如果p值小于0.05%插入/缺失,则验证脱靶位点。在
针对靶向g018082的sgrna所鉴定的108个脱靶位点中,验证0个位点。在针对靶向g018081的sgrna所鉴定的111个脱靶位点中,验证3个位点。在针对靶向g018034的sgrna所鉴定的120个脱靶位点中,验证0个位点。
[0674]
表22.ciita剪接引导物的脱靶位点验证
[0675][0676]
额外实施方案
[0677]
本公开进一步包括以下实施方案。
[0678]
实施方案1为一种工程化细胞,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达,所述工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含基因组坐标chr1 6:10902171-10923242内的剪接位点的至少一个核苷酸。
[0679]
实施方案2为实施方案1所述的工程化细胞,其中所述基因修饰包含剪接受体位点的至少一个核苷酸的修饰。
[0680]
实施方案3为实施方案2所述的工程化细胞,其中所述一个核苷酸为a。
[0681]
实施方案4为实施方案2所述的工程化细胞,其中所述一个核苷酸为g。
[0682]
实施方案5为实施方案1所述的工程化细胞,其中所述基因修饰包含剪接供体位点的至少一个核苷酸的修饰。
[0683]
实施方案6为实施方案5所述的工程化细胞,其中所述一个核苷酸为g。
[0684]
实施方案7为实施方案5所述的工程化细胞,其中所述一个核苷酸为t。
[0685]
实施方案8为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含剪接位点边界核苷酸的修饰。
[0686]
实施方案9为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10902171-10923242内的至少5个连续核苷酸。
[0687]
实施方案10为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10902171-10923242内的至少6、7、8、9或10个连续核苷酸。
[0688]
实施方案11为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10902171-10923242内的至少一个c至t取代或至少一个a至g取代。
[0689]
实施方案12为实施方案1所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10903873-10923242内的剪接位点的至少一个核苷酸。
[0690]
实施方案13为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr:16:10906485-10923242内的剪接位点的至少一个核苷酸。
[0691]
实施方案14为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10908130-10923242内的剪接位点的至少一个核苷酸。
[0692]
实施方案15为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、
chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。
[0693]
实施方案16为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。
[0694]
实施方案17为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。
[0695]
实施方案18为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10908132-10908152内的剪接位点的至少一个核苷酸。
[0696]
实施方案19为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10908131-10908151内的剪接位点的至少一个核苷酸。
[0697]
实施方案20为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10916456-10916476内的剪接位点的至少一个核苷酸。
[0698]
实施方案21为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10918504-10918524内的剪接位点的至少一个核苷酸。
[0699]
实施方案22为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chrl6:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507。
[0700]
实施方案23为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。
[0701]
实施方案24为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含
选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。
[0702]
实施方案25为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10918504-10918524内的剪接位点的至少一个核苷酸。
[0703]
实施方案26为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10923218-10923238内的剪接位点的至少一个核苷酸。
[0704]
实施方案27为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标chr16:10923219-10923239内的剪接位点的至少一个核苷酸。
[0705]
实施方案28为一种工程化细胞,其相对于未经修饰细胞具有降低或消除的ii类mhc的表面表达,所述工程化细胞包含ciita基因中的基因修饰,其中所述基因修饰包含选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr16:10895410-10895430、chr16:10898649-10898669、chr16:10898658-10898678、chr16:10902171-10902191、chr16:10902173-10902193、chr16:10902174-10902194、chr16:10902179-10902199、chr16:10902183-10902203、chr16:10902184-10902204、chr16:10902644-10902664、chr16:10902779-10902799、chr16:10902788-10902808、chr16:10902789-10902809、chr16:10902790-10902810、chr16:10902795-10902815、chr16:10902799-10902819、chr16:10903708-10903728、chr16:10903713-10903733、chr16:10903718-10903738、chr16:10903721-10903741、chr16:10903723-10903743、chr16:10903724-10903744、chr16:10903873-10903893、chr16:10903878-10903898、chr16:10903905-10903925、chr16:10903906-10903926、chr16:10904736-10904756、chr16:10904790-10904810、chr16:10904811-10904831、chr16:10906481-10906501、chr16:10906485-10906505、chr16:10906486-10906506、chr16:10906487-10906507、chr16:10906492-10906512、chr16:10908127-10908147、chr16:10908130-10908150、chr16:10908131-10908151、chr16:10908132-10908152、chr16:10908137-10908157、chr16:10908138-10908158、chr16:10908139-10908159、chr16:10909006-10909026、chr16:10909007-10909027、chr16:10909018-10909038、chr16:10909021-10909041、chr16:10909022-10909042、chr16:10909172-10909192、chr16:10910165-10910185、chr16:10910176-10910196、chr16:10910186-10910206、chr16:10915547-10915567、chr16:10915551-10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。
[0706]
实施方案29为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:
10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。
[0707]
实施方案30为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。
[0708]
实施方案31为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。
[0709]
实施方案32为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507。
[0710]
实施方案33为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。
[0711]
实施方案34为实施方案28所述的工程化细胞,其中所述基因修饰包含选自以下的基因组坐标内的剪接位点的至少一个核苷酸:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。
[0712]
实施方案35为实施方案28-34中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标内的至少5个连续核苷酸。
[0713]
实施方案36为实施方案28-35中任一项所述的工程化细胞,其中所述基因修饰包含基因组坐标内的至少6、7、8、9或10个连续核苷酸。
[0714]
实施方案37为实施方案28-36中任一项所述的工程化细胞,其中所述基因修饰包
10915571、chr16:10915552-10915572、chr16:10915567-10915587、chr16:10916348-10916368、chr16:10916359-10916379、chr16:10916362-10916382、chr16:10916449-10916469、chr16:10916450-10916470、chr16:10916455-10916475、chr16:10916456-10916476、chr16:10918423-10918443、chr16:10918504-10918524、chr16:10918511-10918531、chr16:10918512-10918532、chr16:10918539-10918559、chr16:10922153-10922173、chr16:10922478-10922498、chr16:10922487-10922507、chr16:10922499-10922519、chr16:10923205-10923225、chr16:10923214-10923234、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923220-10923240、chr16:10923221-10923241和chr16:10923222-10923242。
[0719]
实施方案42为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026、chr16:10922478-10922498、chr16:10895747-10895767、chr16:10916348-10916368、chr16:10910186-10910206、chr16:10906481-10906501、chr16:10909007-10909027、chr16:10895410-10895430和chr16:10908130-10908150。
[0720]
实施方案43为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476、chr16:10918504-10918524、chr16:10909022-10909042、chr16:10918512-10918532、chr16:10918511-10918531、chr16:10895742-10895762、chr16:10916362-10916382、chr16:10916455-10916475、chr16:10909172-10909192、chr16:10906492-10906512、chr16:10909006-10909026和chr16:10922478-10922498。
[0721]
实施方案44为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10908132-10908152、chr16:10908131-10908151、chr16:10916456-10916476和chr16:10918504-10918524。
[0722]
实施方案45为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10908132-10908152内的至少5个连续核苷酸。
[0723]
实施方案46为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10908131-10908151内的至少5个连续核苷酸。
[0724]
实施方案47为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因
组坐标chr16:10916456-10916476内的至少5个连续核苷酸。
[0725]
实施方案48为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10918504-10918524内的至少5个连续核苷酸。
[0726]
实施方案49为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470、chr16:10922153-10922173、chr16:10923222-10923242、chr16:10910176-10910196、chr16:10895742-10895762、chr16:10916449-10916469、chr16:10923214-10923234、chr16:10906492-10906512和chr16:10906487-10906507。
[0727]
实施方案50为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238、chr16:10923219-10923239、chr16:10923221-10923241、chr16:10906486-10906506、chr16:10906485-10906505、chr16:10903873-10903893、chr16:10909172-10909192、chr16:10918423-10918443、chr16:10916362-10916382、chr16:10916450-10916470和chr16:10922153-10922173。
[0728]
实施方案51为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含选自以下的基因组坐标内的至少5个连续核苷酸:chr16:10918504-10918524、chr16:10923218-10923238和chr16:10923219-10923239。
[0729]
实施方案52为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10918504-10918524内的至少5个连续核苷酸。
[0730]
实施方案53为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10923218-10923238内的至少5个连续核苷酸。
[0731]
实施方案54为前述实施方案中任一项所述的工程化细胞,其中所述ii类mhc表达通过结合至ciita基因组目标序列的基因编辑系统而降低或消除,所述目标序列包含基因组坐标chr16:10923219-10923239内的至少5个连续核苷酸。
[0732]
实施方案55为实施方案38-54中任一项所述的工程化细胞,其中所述ciita基因组目标序列包含基因组坐标内的至少10个连续核苷酸。
[0733]
实施方案56为实施方案38-55中任一项所述的工程化细胞,其中所述ciita基因组目标序列包含基因组坐标内的至少15个连续核苷酸。
[0734]
实施方案57为实施方案38-56中任一项所述的工程化细胞,其中所述基因编辑系统包含经rna引导的dna结合剂。
[0735]
实施方案58为实施方案57所述的工程化细胞,其中所述经rna引导的dna结合剂包含cas9蛋白,例如酿脓链球菌cas9。
[0736]
实施方案59为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰使剪接位点失活。
[0737]
实施方案60为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含剪接位点核苷酸处的缺失。
[0738]
实施方案61为前述实施方案中任一项所述的工程化细胞,其中所述基因修饰包含剪接位点核苷酸处的取代。
[0739]
实施方案62为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞进一步具有降低或消除的i类mhc的表面表达。
[0740]
实施方案63为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞包含β-2-微球蛋白(b2m)基因中的基因修饰。
[0741]
实施方案64为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞包含hla-a基因中的基因修饰。
[0742]
实施方案65为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞进一步包含外源核酸。
[0743]
实施方案66为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞包含编码表达于所述工程化细胞的表面上的靶向受体的外源核酸。
[0744]
实施方案67为实施方案66所述的工程化细胞,其中所述靶向受体为car。
[0745]
实施方案68为实施方案66所述的工程化细胞,其中所述靶向受体为tcr。
[0746]
实施方案69为实施方案66所述的工程化细胞,其中所述靶向受体为wt1 tcr。
[0747]
实施方案70为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞进一步包含编码由所述工程化细胞分泌的多肽的外源核酸。
[0748]
实施方案71为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞为人类细胞。
[0749]
实施方案72为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞为免疫细胞。
[0750]
实施方案73为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞为单核细胞、巨噬细胞、肥大细胞、树突状细胞或颗粒细胞。
[0751]
实施方案74为前述实施方案中任一项所述的工程化细胞,其中所述工程化细胞为淋巴细胞。
[0752]
实施方案75为实施方案74所述的工程化细胞,其中所述工程化细胞为t细胞。
[0753]
实施方案76为实施方案75所述的工程化细胞,其中所述工程化细胞相对于未经修饰细胞进一步具有降低或消除的内源性t细胞受体(tcr)蛋白表达。
[0754]
实施方案77为实施方案76所述的工程化细胞,其中所述细胞相对于未经修饰细胞具有降低或消除的trac蛋白表达。
[0755]
实施方案78为实施方案76-77中任一项所述的工程化细胞,其中所述细胞相对于未经修饰细胞具有降低的trbc蛋白表达。
[0756]
实施方案79为一种药物组合物,所述药物组合物包含前述实施方案中任一项所述
的工程化细胞。
[0757]
实施方案80为一种细胞群体,所述细胞群体包含前述实施方案中任一项所述的工程化细胞。
[0758]
实施方案81为一种包含细胞群体的药物组合物,其中所述细胞群体包含前述实施方案中任一项所述的工程化细胞。
[0759]
实施方案82为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少65%ii类mhc阴性。
[0760]
实施方案83为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少70%ii类mhc阴性。
[0761]
实施方案84为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少80%ii类mhc阴性。
[0762]
实施方案85为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少90%ii类mhc阴性。
[0763]
实施方案86为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少92%ii类mhc阴性。
[0764]
实施方案87为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少93%ii类mhc阴性。
[0765]
实施方案88为实施方案80所述的细胞群体或实施方案81所述的药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少94%ii类mhc阴性。
[0766]
实施方案89为实施方案80-88中任一项所述的细胞群体或药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少95%内源性tcr蛋白阴性。
[0767]
实施方案90为实施方案80-89中任一项所述的细胞群体或药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少97%内源性tcr蛋白阴性。
[0768]
实施方案91为实施方案80-90中任一项所述的细胞群体或药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少98%内源性tcr蛋白阴性。
[0769]
实施方案92为实施方案80-91中任一项所述的细胞群体或药物组合物,其中如通过流式细胞术所测量,所述细胞群体为至少99%内源性tcr蛋白阴性。
[0770]
实施方案93为一种向有需要的受试者施用前述实施方案中任一项所述的工程化细胞、细胞群体或药物组合物的方法。
[0771]
实施方案94为一种将前述实施方案中任一项所述的工程化细胞、细胞群体或药物组合物作为过继性细胞转移(act)疗法向受试者施用的方法。
[0772]
实施方案95为一种组合物,所述组合物包含:a)包含引导序列的ciita引导rna,所述引导序列i)靶向包含剪接位点的至少一个核苷酸的ciita基因组目标序列,或ii)导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸5个核苷酸或更少的ciita基因组目标序列中进行切割;其中所述ciita引导rna靶向包含基因组坐标chr16:10902171-10923242内的至少10个连续核苷酸的ciita基因组目标序列。
[0773]
实施方案96为一种组合物,所述组合物包含:a)ciita引导rna(grna),所述grna包含i)选自seq id no:1-101的引导序列;或ii)选自seq id no:1-101的序列的至少17、18、19或20个连续核苷酸;或iii)与选自seq id no:1-101的序列至少95%、90%或85%同一的
引导序列;或iv)包含表1中所列的基因组坐标的10个连续核苷酸
±
10个核苷酸的序列;或v)来自(iv)的序列的至少17、18、19或20个连续核苷酸;或vi)与选自(v)的序列至少95%、90%或85%同一的引导序列。
[0774]
实施方案97为一种组合物,所述组合物包含:a)ciita引导rna,其为单引导rna(sgrna),所述sgrna包含i)选自seq id no:1-101的引导序列;或ii)选自seq id no:1-101的序列的至少17、18、19或20个连续核苷酸;或iii)与选自seq id no:1-101的序列至少95%、90%或85%同一的引导序列;或iv)包含表1中所列的基因组坐标的10个连续核苷酸
±
10个核苷酸的序列;或v)来自(iv)的序列的至少17、18、19或20个连续核苷酸;或vi)与选自(v)的序列至少95%、90%或85%同一的引导序列。
[0775]
实施方案98为实施方案95-97中任一项所述的组合物,其中所述ciita引导rna为酿脓链球菌cas9引导rna。
[0776]
实施方案99为实施方案95-98中任一项所述的组合物,所述组合物还包含经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸。
[0777]
实施方案100为实施方案99所述的组合物,其中所述编码经rna引导的dna结合剂的核酸为编码经rna引导的dna结合剂的mrna。
[0778]
实施方案101为实施方案99-100中任一项所述的组合物,其中所述经rna引导的dna结合剂包含酿脓链球菌cas9。
[0779]
实施方案102为实施方案99-101中任一项所述的组合物,其中所述经rna引导的dna结合剂包含脱氨酶区域。
[0780]
实施方案103为实施方案99-101中任一项所述的组合物,其中所述经rna引导的dna结合剂包含apobec3a脱氨酶(a3a)和经rna引导的切口酶。
[0781]
实施方案104为实施方案103所述的组合物,其中所述经rna引导的切口酶为酿脓链球菌cas9切口酶。
[0782]
实施方案105为实施方案102-104中任一项所述的组合物,所述组合物还包含尿嘧啶糖苷酶抑制剂(ugi)。
[0783]
实施方案106为实施方案102-105中任一项所述的组合物,其中所述经rna引导的dna结合剂通过所述ciita基因组目标序列产生胞嘧啶(c)向胸腺嘧啶(t)的转化。
[0784]
实施方案107为实施方案102-105中任一项所述的组合物,其中所述经rna引导的dna结合剂通过所述ciita基因组目标序列产生腺嘌呤(a)向鸟嘌呤(g)的转化。
[0785]
实施方案108为实施方案99-107中任一项所述的组合物,其中所述ciita引导rna靶向包含剪接受体位点的至少一个核苷酸的ciita基因组目标序列。
[0786]
实施方案109为实施方案108所述的组合物,其中所述一个核苷酸为a。
[0787]
实施方案110为实施方案108所述的组合物,其中所述一个核苷酸为g。
[0788]
实施方案111为实施方案108所述的组合物,其中所述一个核苷酸为剪接受体位点处的剪接位点边界核苷酸。
[0789]
实施方案112为实施方案99-107中任一项所述的组合物,其中所述ciita引导rna靶向包含剪接供体位点的至少一个核苷酸的ciita基因组目标序列。
[0790]
实施方案113为实施方案112所述的组合物,其中所述一个核苷酸为g。
[0791]
实施方案114为实施方案112所述的组合物,其中所述一个核苷酸为t。
[0792]
实施方案115为实施方案112所述的组合物,其中所述一个核苷酸为剪接供体位点处的剪接位点边界核苷酸。
[0793]
实施方案116为实施方案99-115中任一项所述的组合物,其中所述ciita引导rna包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸4个核苷酸或更少的ciita基因组目标序列中进行切割。
[0794]
实施方案117为实施方案99-115中任一项所述的组合物,其中所述ciita引导rna包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸3个核苷酸或更少的ciita基因组目标序列中进行切割。
[0795]
实施方案118为实施方案99-117中任一项所述的组合物,其中所述ciita引导rna包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸2个核苷酸或更少的ciita基因组目标序列中进行切割。
[0796]
实施方案119为实施方案99-118中任一项所述的组合物,其中所述ciita引导rna包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在距离剪接位点边界核苷酸1个核苷酸或更少的ciita基因组目标序列中进行切割。
[0797]
实施方案120为实施方案99-119中任一项所述的组合物,其中所述ciita引导rna包含引导序列,所述引导序列导引经rna引导的dna结合剂,以在剪接位点边界核苷酸处的ciita基因组目标序列中进行切割。
[0798]
实施方案121为一种制造工程化细胞的方法,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc蛋白的表面表达,所述方法包括使细胞与实施方案99-120中任一项所述的组合物接触。
[0799]
实施方案122为一种相对于未经修饰细胞降低工程化细胞中的ii类mhc蛋白的表面表达的方法,所述方法包括使细胞与实施方案99-120中任一项所述的组合物接触。
[0800]
实施方案123为实施方案121-122中任一项所述的方法,所述方法还包括相对于未经修饰细胞降低或消除细胞中i类mhc蛋白的表面表达。
[0801]
实施方案124为实施方案121-122中任一项所述的方法,所述方法还包括相对于未经修饰细胞降低或消除细胞中b2m蛋白的表面表达。
[0802]
实施方案125为实施方案121-122中任一项所述的方法,所述方法还包括相对于未经修饰细胞降低或消除细胞中hla-a蛋白的表面表达。
[0803]
实施方案126为实施方案122-125中任一项所述的方法,所述方法还包括相对于未经修饰细胞降低或消除细胞中tcr蛋白的表面表达。
[0804]
实施方案127为实施方案122-126中任一项所述的方法,所述方法还包括使所述细胞与外源核酸接触。
[0805]
实施方案128为实施方案127所述的方法,所述方法还包括使所述细胞与编码靶向受体的外源核酸接触。
[0806]
实施方案129为实施方案127所述的方法,所述方法还包括使所述细胞与编码由所述细胞分泌的多肽的外源核酸接触。
[0807]
实施方案130为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为同种异体细胞。
[0808]
实施方案131为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物
或方法,其中所述细胞为原代细胞。
[0809]
实施方案132为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为cd4+ t细胞。
[0810]
实施方案133为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为cd8+ t细胞。
[0811]
实施方案134为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为记忆t细胞。
[0812]
实施方案135为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为b细胞。
[0813]
实施方案136为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为浆b细胞。
[0814]
实施方案137为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为记忆b细胞。
[0815]
实施方案138为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为造血干细胞(hsc)。
[0816]
实施方案139为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为活化细胞。
[0817]
实施方案140为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞为非活化细胞。
[0818]
实施方案141为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子。
[0819]
实施方案142为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子,其中所述nk细胞抑制剂分子结合至nk细胞上的抑制性受体。
[0820]
实施方案143为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子,其中所述nk细胞抑制剂分子结合至nk细胞上的nkg2a。
[0821]
实施方案144为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子,其中所述nk细胞抑制剂分子为非经典i类mhc分子。
[0822]
实施方案145为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子,其中所述nk细胞抑制剂分子为hla-e。
[0823]
实施方案146为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑制剂分子,其中所述nk细胞抑制剂分子为融合蛋白。
[0824]
实施方案147为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含外源核酸或使所述细胞与外源核酸接触,其中所述外源核酸编码nk细胞抑
制剂分子,其中所述nk细胞抑制剂分子为包含hla-e和b2m的融合蛋白。
[0825]
实施方案148为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为抗体或抗体片段。
[0826]
实施方案149为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为全长igg抗体。
[0827]
实施方案150为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为单链抗体。
[0828]
实施方案151为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为中和抗体。
[0829]
实施方案152为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为治疗多肽。
[0830]
实施方案153为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为酶。
[0831]
实施方案154为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为细胞因子。
[0832]
实施方案155为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为趋化因子。
[0833]
实施方案156为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其包含编码由所述细胞分泌的多肽的外源核酸或使所述细胞与所述外源核酸接触,其中所分泌的多肽为融合蛋白。
[0834]
实施方案157为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其包含编码靶向受体的外源核酸或使所述细胞与编码靶向受体的外源核酸接触,其中所述靶向受体为t细胞受体(tcr)。
[0835]
实施方案158为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其包含编码靶向受体的外源核酸或使所述细胞与编码靶向受体的外源核酸接触,其中所述靶向受体为经基因修饰的tcr。
[0836]
实施方案159为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其包含编码靶向受体的外源核酸或使所述细胞与编码靶向受体的外源核酸接触,其中所述靶向受体为wt1 tcr。
[0837]
实施方案160为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其包含编码靶向受体的外源核酸或使所述细胞与编码靶向受体的外源核
酸接触,其中所述靶向受体为car。
[0838]
实施方案161为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述ciita引导rna在载体中提供至所述细胞。
[0839]
实施方案162为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述经ciita rna引导的dna结合剂在载体中,任选地在与所述ciita引导rna相同的载体中提供至所述细胞。
[0840]
实施方案163为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述外源核酸在载体中提供至所述细胞。
[0841]
实施方案164为实施方案163所述的工程化细胞、细胞群体、药物组合物或方法,其中所述载体为病毒载体。
[0842]
实施方案165为实施方案163所述的工程化细胞、细胞群体、药物组合物或方法,其中所述载体为非病毒载体。
[0843]
实施方案166为实施方案164所述的工程化细胞、细胞群体、药物组合物或方法,其中所述载体为慢病毒载体。
[0844]
实施方案167为实施方案164中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述载体为aav。
[0845]
实施方案168为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述引导rna在脂质核酸组装组合物中,任选地在与经rna引导的dna结合剂相同的脂质核酸组装组合物中提供至所述细胞。
[0846]
实施方案169为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述外源核酸在脂质核酸组装组合物中提供至所述细胞。
[0847]
实施方案170为实施方案168或169所述的工程化细胞、细胞群体、药物组合物或方法,其中所述脂质核酸组装组合物为脂质纳米粒子(lnp)。
[0848]
实施方案171为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述外源核酸整合至所述细胞的基因组中。
[0849]
实施方案172为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述外源核酸通过同源重组(hr)整合至所述细胞的基因组中。
[0850]
实施方案173为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述外源核酸被整合至所述细胞的基因组中的安全港基因座中。
[0851]
实施方案174为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:1。
[0852]
实施方案175为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:2。
[0853]
实施方案176为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:3。
[0854]
实施方案177为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:4。
[0855]
实施方案178为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:5。
[0856]
实施方案179为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:6。
[0857]
实施方案180为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:7。
[0858]
实施方案181为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:8。
[0859]
实施方案182为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:9。
[0860]
实施方案183为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:10。
[0861]
实施方案184为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:11。
[0862]
实施方案185为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:12。
[0863]
实施方案186为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:13。
[0864]
实施方案187为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:14。
[0865]
实施方案188为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:15。
[0866]
实施方案189为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:16。
[0867]
实施方案190为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:17。
[0868]
实施方案191为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:18。
[0869]
实施方案192为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:19。
[0870]
实施方案193为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:20。
[0871]
实施方案194为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:21。
[0872]
实施方案195为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:22。
[0873]
实施方案196为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:23。
[0874]
实施方案197为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:24。
[0875]
实施方案198为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药
物组合物或方法,其中所述ciita引导rna包含seq id no:25。
[0876]
实施方案199为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:26。
[0877]
实施方案200为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:27。
[0878]
实施方案201为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:28。
[0879]
实施方案202为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:29。
[0880]
实施方案203为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:30。
[0881]
实施方案204为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:31。
[0882]
实施方案205为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:32。
[0883]
实施方案206为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:33。
[0884]
实施方案207为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:34。
[0885]
实施方案208为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:35。
[0886]
实施方案209为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:36。
[0887]
实施方案210为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:37。
[0888]
实施方案211为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:38。
[0889]
实施方案212为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:39。
[0890]
实施方案213为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:40。
[0891]
实施方案214为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:41。
[0892]
实施方案215为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:42。
[0893]
实施方案216为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:43。
[0894]
实施方案217为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:44。
[0895]
实施方案218为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:45。
[0896]
实施方案219为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:46。
[0897]
实施方案220为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:47。
[0898]
实施方案221为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:48。
[0899]
实施方案222为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:49。
[0900]
实施方案223为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:50。
[0901]
实施方案224为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:51。
[0902]
实施方案225为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:52。
[0903]
实施方案226为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:53。
[0904]
实施方案227为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:54。
[0905]
实施方案228为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:55。
[0906]
实施方案229为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:56。
[0907]
实施方案230为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:57。
[0908]
实施方案231为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:58。
[0909]
实施方案232为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:59。
[0910]
实施方案233为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:60。
[0911]
实施方案234为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:61。
[0912]
实施方案235为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:62。
[0913]
实施方案236为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:63。
[0914]
实施方案237为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药
物组合物或方法,其中所述ciita引导rna包含seq id no:64。
[0915]
实施方案238为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:65。
[0916]
实施方案239为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:66。
[0917]
实施方案240为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:67。
[0918]
实施方案241为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:68。
[0919]
实施方案242为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:69。
[0920]
实施方案243为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:70。
[0921]
实施方案244为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:71。
[0922]
实施方案245为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:72。
[0923]
实施方案246为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:73。
[0924]
实施方案247为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:74。
[0925]
实施方案248为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:75。
[0926]
实施方案249为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:76。
[0927]
实施方案250为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:77。
[0928]
实施方案251为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:78。
[0929]
实施方案252为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:79。
[0930]
实施方案253为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:80。
[0931]
实施方案254为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:81。
[0932]
实施方案255为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:82。
[0933]
实施方案256为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:83。
[0934]
实施方案257为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:84。
[0935]
实施方案258为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:85。
[0936]
实施方案259为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:86。
[0937]
实施方案260为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:87。
[0938]
实施方案261为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:88。
[0939]
实施方案262为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:89。
[0940]
实施方案263为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:90。
[0941]
实施方案264为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:91。
[0942]
实施方案265为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:92。
[0943]
实施方案266为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:93。
[0944]
实施方案267为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:94。
[0945]
实施方案268为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:95。
[0946]
实施方案269为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:96。
[0947]
实施方案270为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:97。
[0948]
实施方案271为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:98。
[0949]
实施方案272为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:99。
[0950]
实施方案273为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:100。
[0951]
实施方案274为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含seq id no:101。
[0952]
实施方案275为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰。
[0953]
实施方案276为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药
物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其中所述至少一个修饰包括2
′‑
o-甲基(2
′‑
o-me)修饰的核苷酸。
[0954]
实施方案277为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含核苷酸之间的硫代磷酸酯(ps)键。
[0955]
实施方案278为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含2
′‑
氟(2
′‑
f)修饰的核苷酸。
[0956]
实施方案279为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的5
′
端的前五个核苷酸中的一者或多者处的修饰。
[0957]
实施方案280为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的3
′
端的最后五个核苷酸中的一者或多者处的修饰。
[0958]
实施方案281为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的前四个核苷酸之间的ps键。
[0959]
实施方案282为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的最后四个核苷酸之间的ps键。
[0960]
实施方案283为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的5
′
端的前三个核苷酸处的2
′‑
o-me修饰的核苷酸。
[0961]
实施方案284为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其中所述ciita引导rna包含至少一个修饰,其包含所述引导rna的3
′
端的最后三个核苷酸处的2
′‑
o-me修饰的核苷酸。
[0962]
实施方案285为前述实施方案中任一项所述的工程化细胞或细胞群体,其包含基因修饰,包括在所述ciita引导rna所靶向的基因组区域内的插入/缺失。
[0963]
实施方案286为前述实施方案中任一项所述的工程化细胞或细胞群体,其包含基因修饰,包括在所述ciita引导rna所靶向的基因组区域内的c至t取代或a至g取代。
[0964]
实施方案287为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其用于表达对由癌细胞表达的多肽具有特异性的tcr。
[0965]
实施方案288为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其用于作为过继性细胞转移(act)疗法向受试者施用。
[0966]
实施方案289为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其用于治疗患有癌症的受试者。
[0967]
实施方案290为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药物组合物或方法,其用于治疗患有感染性疾病的受试者。
[0968]
实施方案291为前述实施方案中任一项所述的工程化细胞、细胞群体、组合物、药
物组合物或方法,其用于治疗患有自身免疫疾病的受试者。
[0969]
实施方案292为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述基因修饰包含插入/缺失。
[0970]
实施方案293为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述基因修饰包含c至t取代。
[0971]
实施方案294为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述基因修饰包含a至g取代。
[0972]
实施方案295为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞对hla-b为同型接合的并且对hla-c为同型接合的。
[0973]
实施方案296为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞进一步包含hla-a基因中的基因修饰,其中所述细胞对hla-b为同型接合的并且对hla-c为同型接合的,并且其中所述hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:a)chr6:29942854至chr6:29942913和b) chr6:29943518至chr6:29943619。
[0974]
实施方案297为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中所述hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864至chr6:29942903。
[0975]
实施方案298为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中所述hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29943528至chr6:29943609。
[0976]
实施方案299为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中所述hla-a基因中的基因修饰包含选自以下的基因组坐标内的至少一个核苷酸:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。
[0977]
实施方案300为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞进一步包含hla-a基因中的基因修饰,并且其中所述hla-a基因中的基因修饰包含在选自以下的基因组坐标内的插入/缺失、c至t取代或a至g取代:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。
[0978]
实施方案301为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中所述细胞的hla-a表达是通过基因编辑系统降低或消除,所述基因编辑系统结
合至包含选自以下的基因组坐标内的至少5个连续核苷酸的hla-a基因组目标序列:chr6:29942864-29942884;chr6:29942868-29942888;chr6:29942876-29942896;chr6:29942877-29942897;chr6:29942883-29942903;chr6:29943126-29943146;chr6:29943528-29943548;chr6:29943529-29943549;chr6:29943530-29943550;chr6:29943537-29943557;chr6:29943549-29943569;chr6:29943589-29943609;和chr6:29944026-29944046。
[0979]
实施方案302为一种制造工程化细胞的方法,所述工程化细胞相对于未经修饰细胞具有降低或消除的ii类mhc蛋白和hla-a蛋白的表面表达,所述方法包括:a)使所述细胞与ciita引导rna接触,其中所述引导rna包含选自seq id no:1-101的引导序列;b)使所述细胞与hla-a引导rna接触,其中所述hla-a引导rna包含选自seq id no:2001-2095中的任一者的引导序列;和c)任选地使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触;由此相对于未经修饰细胞降低或消除所述细胞中ii类mhc蛋白和hla-a蛋白的表面表达。
[0980]
实施方案303为前一实施方案的方法,所述方法包括使所述细胞与经rna引导的dna结合剂或编码经rna引导的dna结合剂的核酸接触,任选地其中所述经rna引导的dna结合剂包含酿脓链球菌cas9。
[0981]
实施方案304为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02。
[0982]
实施方案305为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-c选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:01;hla-c*04:01;和hla-c*02:02。
[0983]
实施方案306为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b等位基因选自以下hla-b等位基因中的任一者:hla-b*07:02;hla-b*08:01;hla-b*44:02;hla-b*35:01;hla-b*40:01;hla-b*57:01;hla-b*14:02;hla-b*15:01;hla-b*13:02;hla-b*44:03;hla-b*38:01;hla-b*18:01;hla-b*44:03;hla-b*51:01;hla-b*49:01;hla-b*15:01;hla-b*18:01;hla-b*27:05;hla-b*35:03;hla-b*18:01;hla-b*52:01;hla-b*51:01;hla-b*37:01;hla-b*53:01;hla-b*55:01;hla-b*44:02;hla-b*44:03;hla-b*35:02;hla-b*15:01;和hla-b*40:02;并且hla-c等位基因选自以下hla-c等位基因中的任一者:hla-c*07:02;hla-c*07:01;hla-c*05:01;hla-c*04:01hla-c*03:04;hla-c*06:02;hla-c*08:02;hla-c*03:03;hla-c*06:02;hla-c*16:01;hla-c*12:03;hla-c*07:
01;hla-c*04:01;hla-c*15:02;hla-c*07:01;hla-c*03:04;hla-c*12:03;hla-c*02:02;hla-c*04:01;hla-c*05:01;hla-c*12:02;hla-c*14:02;hla-c*06:02;hla-c*04:01;hla-c*03:03;hla-c*07:04;hla-c*07:01;hla-c*04:01;hla-c*04:01;和hla-c*02:02。
[0984]
实施方案307为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b和hla-c等位基因选自以下hla-b和hla-c等位基因中的任一者:hla-b*07:02和hla-c*07:02;hla-b*08:01和hla-c*07:01;hla-b*44:02和hla-c*05:01;hla-b*35:01和hla-c*04:01;hla-b*40:01和hla-c*03:04;hla-b*57:01和hla-c*06:02;hla-b*14:02和hla-c*08:02;hla-b*15:01和hla-c*03:03;hla-b*13:02和hla-c*06:02;hla-b*44:03和hla-c*16:01;hla-b*38:01和hla-c*12:03;hla-b*18:01和hla-c*07:01;hla-b*44:03和hla-c*04:01;hla-b*51:01和hla-c*15:02;hla-b*49:01和hla-c*07:01;hla-b*15:01和hla-c*03:04;hla-b*18:01和hla-c*12:03;hla-b*27:05和hla-c*02:02;hla-b*35:03和hla-c*04:01;hla-b*18:01和hla-c*05:01;hla-b*52:01和hla-c*12:02;hla-b*51:01和hla-c*14:02;hla-b*37:01和hla-c*06:02;hla-b*53:01和hla-c*04:01;hla-b*55:01和hla-c*03:03;hla-b*44:02和hla-c*07:04;hla-b*44:03和hla-c*07:01;hla-b*35:02和hla-c*04:01;hla-b*15:01和hla-c*04:01;以及hla-b*40:02和hla-c*02:02。
[0985]
实施方案308为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b和hla-c等位基因是hla-b*07:02和hla-c*07:02。
[0986]
实施方案309为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b和hla-c等位基因是hla-b*08:01和hla-c*07:01。
[0987]
实施方案310为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b和hla-c等位基因是hla-b*44:02和hla-c*05:01。
[0988]
实施方案311为前述实施方案中任一项所述的工程化细胞、细胞群体、药物组合物或方法,其中hla-b和hla-c等位基因是hla-b*35:01和hla-c*04:01。
[0989]
表23.额外序列
[0990]
在下表和通篇中,术语“ma”、“mc”、“mu”或“mg”用于指示已经2
′‑
o-me修饰的核苷酸。在下表中,“*”用于描绘ps修饰。在本技术中,术语a*、c*、u*或g*可用于表示用ps键连接至下一个(例如3
′
)核苷酸的核苷酸。应理解,如果相对于rna提及dna序列(包含ts),则ts应经us(取决于上下文,其可经修饰或未经修饰)置换,并且反之亦然。在下表中,使用单氨基酸字母编码提供肽序列。
[0991]
[0992]
[0993]
[0994]
[0995]
[0996]
[0997]
[0998]
[0999]
[1000]
[1001]
[1002]
[1003]
[1004]
[1005]
[1006]
[1007]
[1008]
[1009]
[1010]
[1011]
[1012]
[1013]
[1014]
[1015]
[1016]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1