一种辣椒白绢病菌的遗传转化方法与流程
1.本发明涉及基因工程技术领域,具体涉及一种辣椒白绢病菌的遗传转化方法。
背景技术:
2.目前遗传转化的方式被广泛应用于丝状真菌的遗传转化中,丝状真菌的菌丝体、孢子、原生质体都可以为遗传转化的转化受体,使目的基因可以在转化受体内稳定的遗传和表达。已经建立的真菌遗传转化手段有很多,如电激介导的遗传转化、醋酸锂介导的遗传转化、限制性内切酶介导的遗传转化、cac1
2-peg介导的遗传转化、农杆菌介导的遗传转化、基因枪介导的遗传转化、转座子介导的遗传转化等。其中cac1
2-peg介导的遗传转化法以简单易行,成本较低,不需要特殊仪器设备和技术手段,尤其适用于不易产生有性和无性孢子的丝状真菌的转化和转化子的分离。目前已有很多研究采用了cac1
2-peg介导的遗传转化操作。杜娇(2018)采用peg介导的原生质体转化方法将核盘菌γ-谷氨酰磷酸还原酶编码基因ssgpr1进行沉默,发现沉默转化子在pda培养基上形成的菌核数量及平均干重与野生型菌株无显著性差异,且菌核均能萌发形成子囊盘,但菌丝生长稠密,生长速度显著下降。在含有h2o2的培养基中,ssgpr1基因沉默转化子菌丝生长受到更强的抑制,表明沉默转化子对氧化胁迫更加敏感。ssgpr1基因沉默转化子在活体油菜叶片和拟南芥植株上能引起发病,但病斑面积减小,表明沉默转化子致病力减弱,说明ssgpr1与核盘菌的生长和菌丝形态相关,且参与核盘菌对氧化胁迫的抵御及致病过程,为揭示核盘菌致病的机制奠定了基础。崔佳(2019)通过peg介导的原生质体转化手段对玉米弯孢叶斑病菌(curvularia lunata)的clpg1基因进行了基因敲除,结果发现,clpg1基因缺失会导致产孢量和孢子萌发率下降、多聚半乳糖醛酸酶活性降低,致病力减弱。
3.另外,还有大量的研究通过cac1
2-peg介导的原生质体转化方法成功建立了病原真菌的遗传转化体系,如稻瘟病菌(杨玮等,1994)、玉米丝轴黑粉菌(宁平等,2009)、棉花枯萎病菌(徐齐君等,2012)、辣椒疫霉菌(姜海滨等,2017)、辣椒炭疽病菌(曾泉等,2019),但这些研究的对象基本都是可产孢的真菌,无孢目真菌的遗传转化操作,至今仍然面临诸多难题。
4.辣椒白绢病的主要病原菌为齐整小核菌(sclerotium rolfsii),在分类学地位上属于半知菌亚口,丝孢纲,无孢目,小菌核属。由于s.rolfsii的营养体为双核菌丝,并且有锁状联合现象,遗传特性复杂,难以产生有性和无性孢子,使得对该菌的分子遗传学和致病机制的研究相对滞后。目前对于s.rolfsii致病机理的研究,仍然停留在细胞组织学(v.l.smith et al,1986)和对侵染循环的研究(liamngee kator et al.,2015)上。因此,采用原生质体技术,建立高效的遗传转化体系,有利于深入探明s.rolfsii高致病力特性和致病过程,为进一步探索辣椒白绢病的致病机理奠定基础。
技术实现要素:
5.本发明提供了解决无孢目丝状真菌遗传转化操作技术瓶颈的问题,公开了以下技
术方案:
6.一种辣椒白绢病菌的遗传转化方法,方法包括以下步骤:
7.(1)原生质体的制备
8.挑选白绢病菌的菌落置于yeg液体培养基中振荡培养;过滤菌丝,无菌水冲洗,用吸水纸将水稍吸干;将菌丝使用裂解酶进行酶解,得酶解液,再将加酶解液加入0.7m nacl溶液,轻轻摇晃,过滤膜过滤;收集滤液,离心弃上清,加stc缓冲液悬浮,得原生质体;
9.(2)转化
10.将含有待转化目的基因的pcr产物加入辣椒白绢病菌原生质体中,轻轻混匀,第一次室温静置;分2-3次加ptc缓冲液,轻轻混匀,第二次室温静置;把原生质体加到熔化后冷却至45-50℃的tb3固体培养基a中,轻轻混匀后倒入培养皿中,置于恒温箱中第一次黑暗培养;往培养皿中再倒入tb3固体培养基b,第二次黑暗培养,挑选上述转化子菌落移至含hygb的pda固体培养基中进行转化子筛选。
11.优选地,在步骤(1)中yeg液体培养基的制备方法为:酵母提取物5g,葡萄糖10g,加ddh2o溶解,定容至1l,121℃高压灭菌20min。
12.优选地,在步骤(1)中裂解酶的制备方法:细胞破壁酶0.3g,完全溶解于0.7mol/l nacl后定容至30ml,用0.22μm细菌过滤器过滤除菌。
13.优选地,在步骤(2)中ptc缓冲液的制备方法:称量peg 4000 120g,溶解于1
×
stc缓冲液中,定容至200ml,121℃高压灭菌20min。
14.优选地,在步骤(2)中pcr产物含有t-dna上下臂、目的基因和抗性基因。
15.优选地,在步骤(2)中pcr产物的制备方法:以sk1044质粒为模板,利用t-dna上下臂设计引物lb:5
’‑
ttaattcgggggatctggattttagtac-3’,rb:5
’′‑
taaacgctcttttctcttaaggtttaccg-3’,pcr扩增含有t-dna上下臂、egfp基因及潮霉素b抗性基因的dna片段。
16.优选地,在步骤(2)中第一次室温静置25min;第二次静置15min。
17.优选地,在步骤(2)中tb3固体培养基a的制备方法:酵母提取物3g,酸水解酪蛋白3g,蔗糖200g,加ddh2o定容至1l,121℃高压灭菌20min,固体培养基加琼脂7g/l,含100mg/l hyg b。
18.优选地,在步骤(2)中tb3固体培养基b的制备方法:酵母提取物3g,酸水解酪蛋白3g,蔗糖200g,加ddh2o定容至1l,121℃高压灭菌20min,固体培养基加琼脂7g/l,含100mg/l hyg b。
19.优选地,在步骤(2)中pda固体培养基中含200mg/l hyg b。
20.本发明的有益效果:
21.(1)gfp蛋白的导入,说明突破了无孢目真菌的遗传操作瓶颈,为从细胞学层面解析白绢病菌侵染的机制,提供了直观的视图,因为绿色荧光很容易检测,菌株侵入植物细胞之后通过切片能清晰的展现菌株在细胞内的扩展过程。
22.(2)下一步可以利用这个遗传操作技术,对白绢病菌里面的致病基因进行遗传敲除(也就是基因沉默),使得白绢病菌丧失致病性,从而为开发白绢病菌新的防控技术提供理论支持。
23.(3)下一步可以利用这个遗传操作技术,对白绢病菌中的致病基因进行功能分析,
rolfsii sacc.)的有性态,有性世代不常发生。
40.1.2、pda培养基:购自北京索莱宝公司制备的马铃薯葡萄糖培养基,46g于1lddh2o,溶解,121℃高压灭菌20min。
41.tb3培养基:酵母提取物3g,酸水解酪蛋白3g,蔗糖200g,加ddh2o定容至1l,121℃高压灭菌20min,固体培养基加琼脂7g/l。
42.1.3、试剂
43.裂解酶(lysing enzymes)、聚乙二醇(peg)和潮霉素(hygromycin b)b购自美国sigma aldrich公司。
[0044]1×
stc缓冲液:蔗糖100g,tris-hcl(50mmol/l)3.0285g(ph=8.0),cacl2(50mmol/l)2.745g;加ddh2o至500ml,121℃高压灭菌20min。
[0045]
ptc缓冲液:称量peg 4000 120g,溶解于1
×
stc缓冲液中,定容至200ml,121℃高压灭菌20min。
[0046]
yeg:酵母提取物5g,葡萄糖10g,加ddh2o溶解,定容至1l,121℃高压灭菌20min。
[0047]
酶解液配制:细胞破壁酶0.3g,完全溶解于0.7mol/l nacl后定容至30ml,用0.22μm细菌过滤器过滤除菌。
[0048]
2、对数生长期确定
[0049]
将直径5mm的菌丝块移于马铃薯葡萄糖琼脂(pda)平板中央培养,置于28℃恒温培养箱培养,观察生长情况,1、2、3、4d后测量菌丝直径,设置3次重复。
[0050]
结果分析:如图2所示,白绢病菌在pda培养基生长良好,菌体直径呈指数增加,第3-4天菌丝生长最为迅速,而生长5天后因达到培养皿最大直径,生长将受到抑制。
[0051]
3、对潮霉素的敏感性测定
[0052]
将辣椒白绢病菌菌株csr1接种在pda培养基培养4d后,用打孔器沿菌落边缘打取菌丝块,转接到潮霉素b浓度分别为0、100、150、200、250mg/l的pda平板上,28℃恒温培养箱中培养3d,观察生长情况,每个浓度设置3次重复。
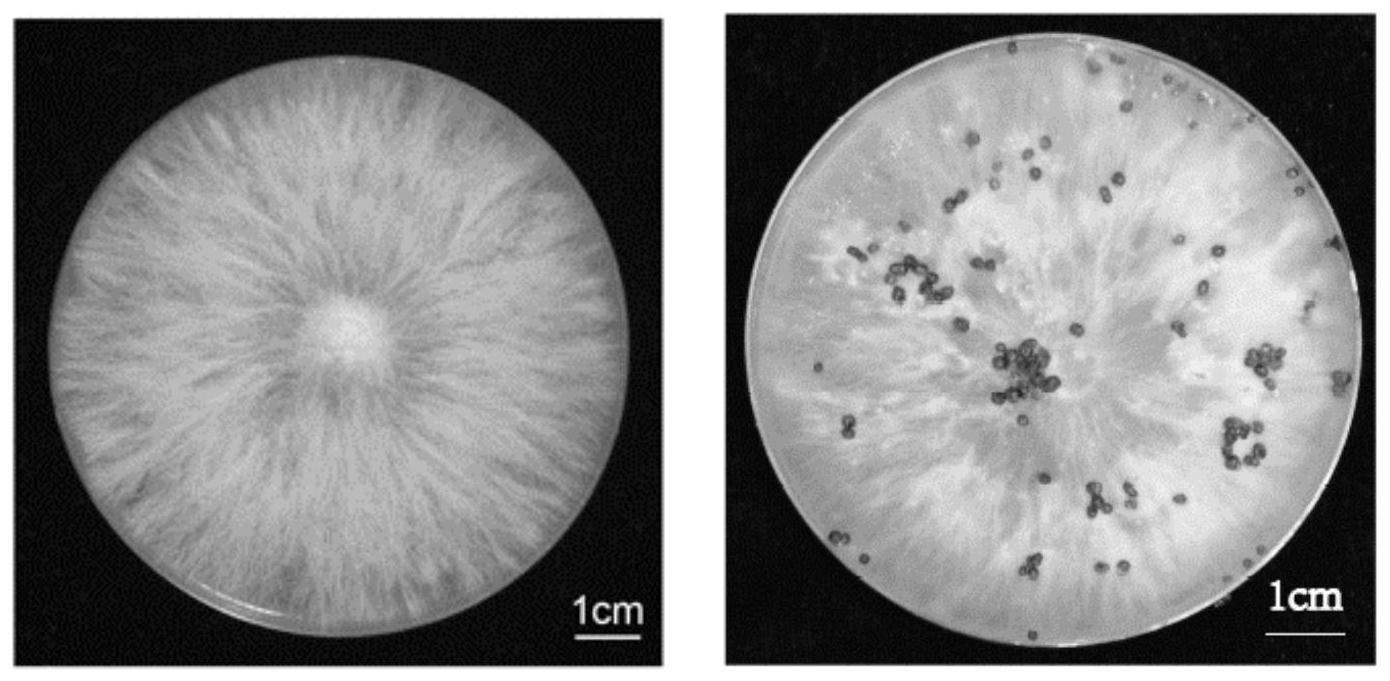
[0053]
结果分析:设置不同浓度(0、100、150、200、250mg/l)的潮霉素b,将培养4d的辣椒白绢病菌菌株csr1接种于含潮霉素b的pda平板上,置于28℃培养3d。实验结果显示,100~250mg/l的潮霉素b(hyg b)对辣椒白绢病菌的生长有不同程度的抑制效果,200mg/l几乎不生长,250mg/l生长完全受到抑制(图3)。因此,选择200mg/l潮霉素b作为筛选转化子的浓度。
[0054]
4.1原生质体的制备
[0055]
接种菌丝块于pda平板上生长3d,菌落直径3cm;切取直径3cm的菌落,尽量切碎,置于200ml yeg的液体培养基中,28℃、200rpm振荡培养2d;用1-2层miracloth过滤菌丝,无菌水冲洗两遍,用吸水纸将水稍吸干;将菌丝置于盛有30ml裂解酶(lysing enzymes from trichodema)解液的50ml离心管中酶解。离心管躺平,30℃、60rpm振荡2h酶解;取出酶解液,加10ml 0.7mnacl溶液,轻轻摇晃,倒于2-3层miracloth过滤膜过滤;收集滤液于50ml离心管中,3000r/min、4℃离心10min;小心弃上清,加1ml1
×
stc悬浮,计数,使原生质体终浓度为108个/ml,分装为150μl/管。图4为辣椒白绢病菌原生质体显微观察图。
[0056]
4.2、转化
[0057]
以sk1044质粒为模板,利用t-dna上下臂设计引物(lb:5
’‑
ttaattcgggggatctggattttagtac-3’如seq id no:3所示;rb:5
’‑
taaacgctcttttctcttaaggtttaccg-3’如seq id no:4所示),pcr扩增含有t-dna上下臂、egfp基因及潮霉素b抗性基因的dna片段(3000bp)如图5,将2μg已纯化的pcr产物加入150μl辣椒白绢病菌原生质体中,轻轻混匀,室温静置25min;分2-3次加1ml ptc,轻轻混匀,室温静置15min;把原生质体加到10ml左右熔化后冷却至45-50℃的tb3(含100mg/l hyg b)固体培养基中,轻轻混匀后倒入培养皿中。置于28℃恒温箱、黑暗培养24-48h(如图6)。往培养皿中再倒入10ml含200mg/l hygb的tb3固体培养基。28℃下黑暗培养2-3d,待上述转化子菌落直径5mm时,从菌体上挑取小块菌丝块移至含200mg/l hygb的pda固体培养基中进行转化子筛选。
[0058]
4.3、稳定转化子的获得
[0059]
随机挑取5个转化子菌体,以野生型白绢病菌为对照,在pda培养基(含200mg/l hyg b)上培养7代后收集菌丝体。挑取转化子的菌丝制成临时玻片,在confocal880激光共聚焦显微镜下用200倍采用进行荧光观察,同时以野生原始菌株为对照,结果野生菌株没有观察到任何荧光,转化成功的转化子产生强烈的绿色荧光信号。(结果如图7所示,激光共聚焦电子显微镜下拍摄的培养7代后的转化菌株与野生菌株;a/b/c:gfp成功转化的菌株;d/e/f:野生菌株;a和d:叠加场的菌丝;b和e:荧光下的菌丝;c和f:白光下的菌丝)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1