一种检测肿瘤细胞或肿瘤细胞碎片的方法与流程
1.本公开属于生物检测领域,具体涉及一种检测肿瘤细胞或肿瘤细胞碎片的方法,特别是通过增强检测信噪比来检测肿瘤细胞或肿瘤细胞碎片的方法。
背景技术:
2.循环肿瘤细胞(circulating tumor cells,ctcs)是指由实体肿瘤上脱落下来进入血液或者淋巴系统的肿瘤细胞。外周血中的循环肿瘤细胞非常罕见,每毫升血约含有1~10个ctcs,ctc远低于血液中其他类型的细胞,数量的稀少使得血液ctc检测极具挑战性,加上ctc产生的复杂性、异质性,更增加了其检测的难度。由于其稀有性,大多数技术都需要在检测ctc之前进行富集步骤。这要求所用检测方法能高效准确地从大量非目标细胞中检测出极少的目标细胞。ctc检测技术包括ctc的富集(分离)和ctc的分析鉴定(检测)。
3.ctc的富集方法可以分为生物化学特性富集法(亲和性富集法)和物理特性富集法。亲和性富集法主要是根据通过细胞表面特异性表达的蛋白质生物标志物分离靶细胞,包括正向捕获ctc的阳性富集法和负向去除白细胞的阴性富集法。但是亲和性富集法需要用到大量抗体,成本较高。物理特性富集法主要是根据ctc的大小、密度、力学和介电性能等物理特性将ctc筛选出来。具体来说,ctc的可变形性不及血细胞。这些物理特性富集技术操作简单成本低廉,不依赖细胞表面抗原的表达,捕获的细胞数量多,但是由于ctc物理特性的异质性,难以富集到高纯度的ctc。
4.ctc的检测方法主要是免疫荧光,即以荧光物质标记抗体而进行肿瘤细胞的抗原定位,再通过用不同的荧光标记物标记不同的细胞进行计数,但是肿瘤患者血液样本中的ctc是稀有细胞,而白细胞的数量极多,导致背景高,加上肿瘤细胞的异质性,ctc的检测信号弱、效率不高、信噪比低。
5.碱性磷酸酶(alp或akp)是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶,可直接参与磷代谢,在钙、磷的消化、吸收、分泌及骨化的过程发挥了重要作用。碱性磷酸酶不是单一的酶,而是一组同工酶。目前己知人类同工酶包括:组织非特异性碱性磷酸酶(tnap),肠型碱性磷酸酶(iap),胎盘型碱性磷酸酶(plap)和类胎盘型碱性磷酸酶(gcap)。正常人血清中的碱性磷酸酶主要来自肝和骨骼,碱性磷酸酶测定主要用于诊断肝胆和骨骼系统疾病,是反映肝外胆道梗阻、肝内占位性病变和佝偻病的重要指标。
6.碱性磷酸酶异源二聚体在结直肠癌、乳腺癌、肝细胞癌、宫颈癌等肿瘤组织中高表达。游离的碱性磷酸酶异源二聚体、含有碱性磷酸酶异源二聚体的外泌体或循环肿瘤细胞可以从原发性肿瘤或转移病灶释放到血流中。因此,检测游离的碱性磷酸酶异源二聚体、外泌体或循环肿瘤细胞将有助于肿瘤的早期诊断和筛查、监测术后患者肿瘤的复发与转移、评估抗肿瘤药物的敏感性与患者预后以及选择个体化治疗的策略。
7.例如,pct国际申请wo2019149115a1公开了一种捕获和/或检测待测样本是否含有表达碱性磷酸酶的肿瘤细胞(特别是ctc)的方法,其使用核酸适配体bg2通过检测异源二聚体碱性磷酸酶来确定待测样本中是否含有表达碱性磷酸酶的肿瘤细胞。以适配体bg2作为
分子探针,可以检测到plap-iap异二聚体在许多癌细胞系表面过度表达,如结肠癌、乳腺癌、宫颈癌和肝癌细胞(luyao shen, et al. anal. chem. 2020, 92, 5370
−
5378; tao bing, et al. adv. sci. 2019, 6, 1900143)。然而,由于该方法未排除白细胞的信号干扰,导致ctc的检测信号弱,从而影响检测结果。
8.因此,急需开发一种新的ctc检测方法,以解决检测过程中ctc的检测信号弱、效率不高、信噪比低等问题。
技术实现要素:
9.为了解决现有技术中存在的问题,本公开的目的在于提供一种新的肿瘤细胞或肿瘤细胞碎片检测方法,采用所述方法,可以使白细胞背景值成倍降低,肿瘤细胞的信号值不变或轻微降低,信噪比显著提升。组织非特异性碱性磷酸酶(tnap)抑制剂能够抑制白细胞表达的碱性磷酸酶,降低由白细胞导致的检测背景噪音,提高肿瘤细胞检测灵敏度。
10.为了实现上述目的,本公开采用以下具体方案:在一方面,本公开提供了组织非特异性碱性磷酸酶(tnap)抑制剂在制备用于待测样本中肿瘤细胞或肿瘤细胞碎片的检测试剂或检测试剂盒中、或在制备诊断肿瘤的诊断试剂或诊断试剂盒中、或在制备提高待测样本中的肿瘤细胞或肿瘤细胞碎片检测信噪比的试剂或试剂盒中的用途。
11.在另一方面,本公开提供了一种检测循环肿瘤细胞的方法,其包括:(1)从受试者获得待测样本;(2) 将组织非特异性碱性磷酸酶(tnap)抑制剂、肿瘤细胞碱性磷酸酶活性检测试剂以及步骤(1)获得的待测样本混合,获得混合物;(3) 检测步骤(2)获得的混合物中是否含有肿瘤细胞的碱性磷酸酶活性,从而测定或鉴定待测样本中是否含有表达碱性磷酸酶的肿瘤细胞或肿瘤细胞碎片。
12.在另一方面,本公开提供了一种增强肿瘤细胞或肿瘤细胞碎片检测信噪比的方法,所述方法包括向待测样本中添加组织非特异性碱性磷酸酶(tnap)抑制剂。
13.在另一方面,本公开提供了一种检测待测样本中肿瘤细胞或肿瘤细胞碎片的检测试剂或检测试剂盒,其包含组织非特异性碱性磷酸酶(tnap)抑制剂和检测肿瘤细胞或肿瘤细胞碎片碱性磷酸酶活性的试剂。
附图说明
14.图1示出了各种肿瘤细胞系细胞的碱性磷酸酶活性。
15.图2示出了tnap抑制剂1(4-氰基-n-(4-甲苯-1-磺酰基)-l-苯丙氨酸(c
17h16
n2o4s))对lovo肿瘤细胞和白细胞碱性磷酸酶的抑制作用。
16.图3示出了tnap抑制剂2(5-((5-氯-2-甲氧基苯基)磺酰胺)烟酰胺(c
13h12
cln3o4s))对lovo肿瘤细胞和白细胞碱性磷酸酶的抑制作用。
17.图4示出了tnap抑制剂3(h-hoarg-oh)对lovo肿瘤细胞和白细胞碱性磷酸酶的抑制作用。
18.图5示出了tnap抑制剂在肿瘤细胞富集过程中对提高信噪比的应用。
19.图6示出了tnap抑制剂在采用单抗体捕获病人样本肿瘤细胞过程中对提高信噪比
的应用。
20.图7示出了tnap抑制剂在采用多抗体捕获肿瘤细胞过程中对提高信噪比的应用。
21.图8示出了tnap抑制剂在采用核酸适配体捕获肿瘤细胞过程中对提高信噪比的应用。
具体实施方式
22.在本公开中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本公开,下面提供相关术语的定义和解释。
23.本文中,术语ic50 (half maximal inhibitory concentration)是指被测量的拮抗剂的半抑制浓度。它能指示某一药物或者物质(抑制剂)在抑制某些生物程序(或者是包含在此程序中的某些物质,比如酶,细胞受体或是微生物)的半量。
24.本文中,术语“富集”即将肿瘤细胞或者循环肿瘤细胞(ctc)从待测样本当中分离出来。
25.本文中,术语“信噪比”即肿瘤细胞或循环肿瘤细胞和非特异性结合的白细胞的碱性磷酸酶活性与非特异性结合的白细胞的碱性磷酸酶活性的比值。
26.本文中,术语“tnap抑制剂”即组织非特异性碱性磷酸酶(tnap)的抑制剂。
27.本文中,术语“链霉亲和素”可指可与生物素结合的蛋白质或肽,并且可包括:天然蛋清抗生物素蛋白(egg-white avidin)、重组抗生物素蛋白、抗生物素蛋白的去糖基化形式、细菌链霉亲和素、重组链霉亲和素、截短型链霉亲和素和/或其任何衍生物。
28.在一方面,本公开提供了一种组织非特异性碱性磷酸酶(tnap)抑制剂在制备用于检测待测样本中肿瘤细胞或肿瘤细胞碎片的检测试剂或检测试剂盒中或在制备用于提高待测样本中的肿瘤细胞或肿瘤细胞碎片检测信噪比的试剂或试剂盒中的用途。
29.在本公开的一些实施方案中,所述待测样本为血液、唾液、尿液、胸腔积液或腹腔积液。
30.在本公开的一些优选实施方案中,所述待测样本为血液样本。
31.在本公开的一些实施方案中,所述肿瘤细胞选自肠癌细胞、乳腺癌细胞、肺癌细胞、胃癌细胞、肝癌细胞、人胎盘绒毛癌细胞、宫颈癌细胞中的一种或多种。
32.在本公开的一些实施方案中,所述肿瘤细胞为人肿瘤细胞。
33.在本公开的一些实施方案中,所述肿瘤细胞为表达碱性磷酸酶的肿瘤细胞;优选为高表达碱性磷酸酶的肿瘤细胞。
34.在本公开的一些实施方案中,所述碱性磷酸酶为肠型碱性磷酸酶(iap)、胎盘型碱性磷酸酶(plap)、类胎盘型碱性磷酸酶(gcap)或其任意的异源二聚体。
35.在另一方面,本公开提供了一种组织非特异性碱性磷酸酶(tnap)抑制剂在制备用于诊断肿瘤的诊断试剂或诊断试剂盒中的用途。
36.在本公开的一些实施方案中,诊断肿瘤包括使用体外检测肿瘤细胞或肿瘤细胞碎片的方法来检测肿瘤细胞或肿瘤细胞碎片的步骤。
37.在本公开的一些实施方案中,所述肿瘤选自肠癌、乳腺癌、肺癌、胃癌、肝癌、人胎
盘绒毛癌、宫颈癌中的一种或多种。
38.在本公开的一些实施方案中,所述肿瘤为人肿瘤。
39.在本公开的一些实施方案中,所述肿瘤为表达碱性磷酸酶的肿瘤;优选为高表达碱性磷酸酶的肿瘤。
40.在本公开的一些实施方案中,所述碱性磷酸酶为肠型碱性磷酸酶(iap)、胎盘型碱性磷酸酶(plap)、类胎盘型碱性磷酸酶(gcap)或其任意的异源二聚体。
41.在另一方面,本公开提供了一种体外检测肿瘤细胞或肿瘤细胞碎片的方法,其包括:(1) 从受试者获得待测样本;(2) 将组织非特异性碱性磷酸酶(tnap)抑制剂、肿瘤细胞碱性磷酸酶活性检测试剂以及步骤(1)获得的待测样本混合,获得混合物;(3) 检测步骤(2)获得的混合物中是否含有肿瘤细胞的碱性磷酸酶活性,从而测定或鉴定待测样本中是否含有表达碱性磷酸酶的肿瘤细胞或肿瘤细胞碎片。
42.在本公开的一些实施方案中,在步骤(1)之后且在步骤(2)之前还包括对待测样本进行富集,获得具有富集肿瘤细胞或肿瘤细胞碎片的待测样本的步骤。
43.在本公开的一些实施方案中,所述富集的方法选自阴性富集法、阳性富集抗体捕获法、核酸适配体捕获法中的一种或多种。
44.在本公开的一些实施方案中,检测碱性磷酸酶活性的方法选自酶联免疫底物显色法、化学发光和单分子免疫检测法中的一种或多种,通过检测混合物的吸光度或相对发光单位判断待测样本是否含有碱性磷酸酶活性,从而测定或鉴定待测样本中是否含有表达碱性磷酸酶的肿瘤细胞或肿瘤细胞碎片。
45.在另一方面,本公开提供了一种增强肿瘤细胞或肿瘤细胞碎片检测信噪比的方法,所述方法包括向待测样本中添加组织非特异性碱性磷酸酶(tnap)抑制剂。
46.在另一方面,本公开提供了一种待测样本中肿瘤细胞或肿瘤细胞碎片的检测试剂或检测试剂盒,其包含组织非特异性碱性磷酸酶(tnap)抑制剂和检测肿瘤细胞或肿瘤细胞碎片碱性磷酸酶活性的试剂。在本公开的一些实施方案中,所述检测肿瘤细胞或肿瘤细胞碎片碱性磷酸酶活性的试剂至少包含与碱性磷酸酶反应的底物。
47.在本公开的一些实施方案中,所述底物为显色底物。
48.在本公开的一些实施方案中,所述底物为荧光底物分子、化学发光底物分子或显色底物分子,包括amppd(3-(2'-螺旋金刚烷)-4-甲氧基-4-(3'-磷酰氧基)苯-1,2-二氧杂环丁烷)、cdp-star(3-(2-螺旋金刚烷)-4-甲氧基-4-(3-磷氧酰)-苯基-1,2-二氧环乙烷)、aps-5((4-氯苯巯基)(10-甲基-9,10-二氢化吖啶亚甲基)磷酸二钠盐)、lumi-phos 530(包含3-(2'-螺旋金刚烷)-4-甲氧基-4-(3'-磷酰氧基)苯-1,2-二氧杂环丁烷amppd和二钠盐),pnpp(对硝基苯基磷酸酯)、bcip(5-溴-4-氯-3-吲哚-磷酸盐)和nbt(氯化硝基四氮唑兰)中的一种或多种。
49.在本公开的一些实施方案中,所述检测试剂或检测试剂盒还包含肿瘤细胞或肿瘤细胞碎片的捕获试剂。
50.在本公开的一些实施方案中,所述肿瘤细胞或肿瘤细胞碎片的捕获试剂选自以下试剂中的一种或多种:
(1)肿瘤细胞或肿瘤细胞碎片负向捕获试剂,其包含至少一种针对白细胞抗原的抗体;(2)肿瘤细胞抗体捕获试剂,其包含至少一种针对肿瘤细胞相关抗原的抗体;(3)核酸适配体捕获试剂,其至少包含seq id no. 11所示的核酸适配体及其衍生物。
51.在本公开的一些实施方案中,所述肿瘤细胞或肿瘤细胞碎片的捕获试剂还包含红细胞裂解液、清洗缓冲液、结合缓冲液、载体中的一种或多种。
52.在本公开的一些实施方案中,(1)所述负向捕获试剂所包含白细胞表面抗原的抗体是修饰物修饰的抗体;更优选地,所述修饰物是生物素。
53.在本公开的一些实施方案中,所述白细胞表面抗原为选自cd45、cd11b、cd14、cd68、cd16、cd56、cd57、cd59、cd94、cd3、cd4、cd8、cd80、cd86、cd40、cd21、cd19、cd20、cd18、cd32、cd44、cd55和cd66b中的一种或多种。
54.在本公开的一些实施方案中,所述肿瘤细胞或肿瘤细胞碎片负向捕获试剂还包含红细胞裂解液、清洗缓冲液、结合缓冲液和载体中的一种或多种。优选地,所述载体是用于连接抗体或连接核酸适配体的载体。
55.在本公开的一些实施方案中,(2)所述抗体捕获试剂所包含肿瘤细胞相关抗原是修饰物修饰的抗体;优选地,所述修饰物是生物素。
56.在本公开的一些实施方案中,所述肿瘤细胞相关抗原为选自egfr、epcam、her2、plap、cea、ca19-9、gpa33、间皮素(mesothelin)、muc1、cd133、cd44、vim、fr、nectin-4、gpc3、pd-l1、met、ca15-3、gd2、ror1、fap 、cldn18.2和trop2中的一种或多种。
57.在本公开的一些实施方案中,所述肿瘤细胞或肿瘤细胞碎片捕获试剂还包含红细胞裂解液、清洗缓冲液、结合缓冲液和用于连接抗体的载体中的一种或多种。
58.在本公开的一些实施方案中,(3)所述核酸适配体捕获试剂包含seq id no. 11所示的核酸适配体bg2。
59.在本公开的一些实施方案中,所述bg2是修饰物修饰的核酸适配体bg2;优选地,所述修饰物是生物素。
60.在本公开的一些实施方案中,所述核酸适配体捕获试剂还包含红细胞裂解液、清洗缓冲液、结合缓冲液和用于连接核酸适配体bg2的载体中的一种或多种。
61.在本公开的一些实施方案中,所述缓冲液选自pbs、bsa以及pbs和bsa的混合液。
62.在本公开的一些实施方案中,所述载体为选自磁珠、琼脂糖珠、胶乳颗粒和孔板中的一种或多种。在本公开的一些实施方案中,所述载体是修饰物修饰的载体;优选地,所述修饰物是链霉亲和素。
63.在本公开的一些实施方案中,所述磁珠选自链霉亲和素磁珠、羧基磁珠、氨基磁珠、羟基磁珠和环氧基磁珠。
64.在本公开的一些实施方案中,所述琼脂糖珠是protein a/g琼脂糖珠。
65.在本公开的一些实施方案中,所述组织非特异性碱性磷酸酶(tnap)抑制剂选自磺酰胺类衍生物、氨基酸类衍生物、吡唑酰胺衍生物、吡啶并噁嗪酮衍生物和联芳基衍生物中的一种或多种。
66.在本公开的一些实施方案中,所述磺酰胺类衍生物选自4-氰基-n-(4-甲苯-1-磺
酰基)-l-苯丙氨酸(c
17h16
n2o4s)、5-((5-氯-2-甲氧基苯基)磺酰胺)烟酰胺(c
13h12
cln3o4s)、5-氯-n-[(8s,9ar)-8-羟基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-甲氧基苯磺酰胺、5-氯-n-[(8s,9ar)-8-羟基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-(三氟甲氧基)苯磺酰胺、5-氯-n-[(8r,9ar)-8-羟基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-甲氧基苯磺酰胺、5-氯-n-[(9s,9as)-9-羟基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-甲氧基苯磺酰胺、5-氯-n-[(9s,9as)-9-羟基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-(三氟甲氧基)苯磺酰胺、5-氯-n-[(8s,9ar)-8-氟-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]-2-甲氧基苯磺酰胺、5-氯-2-甲氧基-n-[(8s,9ar)-8-甲氧基-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-3-基]苯磺酰胺、(8s,9ar)-3-{[(5-氯-2-甲氧基苯基)磺酰基]氨基}-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-8-基甲基氨基甲酸酯和[(8r,9ar)-3-{[(5-氯-2-甲氧基苯基)磺酰基]氨基}-5-氧代-8,9,9a,10-四氢-5h,7h-吡啶并[3,2-f]吡咯并[2,1-c][1,4]氧氮杂-8-基]氨基甲酸甲酯。
[0067]
在本公开的一些实施方案中,所述氨基酸类衍生物选自l-高精氨酸(l-homoarginine)和l-高精氨酸-d4二盐酸盐(l-homoarginine-d4 dihydrochloride)。
[0068]
在本公开的一些实施方案中,所述吡唑酰胺衍生物选自3-(2,4-二氯苯基)-n-(2-羟乙基)-1h-吡唑-5-甲酰胺、3-(2,4-二氯苯基)-n-异丙基-1h-吡唑-5-甲酰胺、3-(2,4-二氯苯基)-1h-吡唑-5-基)(4-(2-羟乙基)哌嗪-1-基)甲酮、3-(2,4-二氯-5-氟苯基)-n-(2-羟乙基)-1h-吡唑-5-甲酰胺、3-(2,4-二氯苯基)-n-(3-羟丙基)-1h-吡唑-5-甲酰胺、3-(2,4-二氯-5-氟苯基)-n-(3-羟丙基)-1h-吡唑-5-甲酰胺、3-(2,4,5-三氯苯基)-n-(2-羟乙基)-1h-吡唑-5-甲酰胺和3-(2,4-二氟苯基)-n-(2-羟乙基)-1h-吡唑-5-甲酰胺。
[0069]
在本公开的一些实施方案中,所述吡啶并噁嗪酮衍生物选自5-氯-2-甲氧基-n-(5-氧代-4-苯基-2,3,4,5-四氢吡啶并[3 ,2-f][1,4]氧氮杂-7-基)苯磺酰胺5-氯-2-甲氧基-n-(5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基)苯磺酰胺、5-氯-2-甲氧基-n-[(3s)-3-甲基-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]苯磺酰胺、5-氯-n-[(3s)-3-乙基-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]-2-甲氧基苯磺酰胺、5-氯-n-[(3s)-3-(羟基甲基)-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]-2-甲氧基苯磺酰胺、5-溴-n-[(3s)-3-(羟基甲基)-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]-2-甲氧基苯磺酰胺、5-氯-n-[(3s)-3-(羟基甲基)-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]-2-(三氟甲氧基)苯磺酰胺、5-氯-n-[(3s)-3-(2-羟乙基)-5-氧代-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]-2-甲氧基苯磺酰胺、5-氯-2-甲氧基-n-(5'-氧代-4',5'-二氢螺[环丙烷-1,3'-吡啶并[3,2-f][1,4]氧氮杂]-7'-基)苯磺酰胺、5-氯-n-(5'-氧代-4',5'-二氢螺[环丙烷-1,3'-吡啶并[3,2-f][1,4]氧氮杂]-7'-基)-2-(三氟甲氧基)苯磺酰胺、2-乙氧基-5-氟-n-(5'-氧代-4',5'-二氢螺[环丙烷-1,3'-吡啶并[3,2-f][1,4]氧氮杂]-7'-基)苯磺酰胺和5-氯-2-甲氧基-n-[5-氧代-3-(吡啶-3-基)-2,3,4,5-四氢吡啶并[3,2-f][1,4]氧氮杂-7-基]苯磺酰胺。
[0070]
在本公开的一些实施方案中,所述联芳基衍生物选自2-({5'-氯-2'-[(5-乙基吡
啶-3-磺酰基)氨基]-3'-氟[1,1'-联苯]-4-基}氧基)-2-甲基丙酸、{5'-氯-3'-氟-2'-[(5-甲基吡啶-3-磺酰基)氨基][1,1'-联苯]-4-基}乙酸、{5'-氯-2'-[(4,5-二甲基吡啶-3-磺酰基)氨基]-3'-氟[1,1'-联苯]-4-基}乙酸、({3',5'-二氯-2'-[(5-甲基吡啶-3-磺酰基)氨基][1,1'-联苯]-4-基}氧基)乙酸、3-{5'-氯-2'-[(5-乙基吡啶-3-磺酰基)氨基]-3'-氟[1,1'-联苯]-4-基}丙酸和2-{5'-氯-3'-氟-2'-[(5-甲基吡啶-3-磺酰基)氨基][1,1'-联苯]-4-基}丙酸。
[0071]
在本公开的一些实施方案中,所述组织非特异性碱性磷酸酶(tnap)抑制剂选自4-氰基-n-(4-甲苯-1-磺酰基)-l-苯丙氨酸(c
17h16
n2o4s)、5-((5-氯-2-甲氧基苯基)磺酰胺)烟酰胺(c
13h12
cln3o4s)和l-高精氨酸(l-homoarginine)。
[0072]
在本公开的一些实施方案中,所述组织非特异性碱性磷酸酶(tnap)抑制剂为4-氰基-n-(4-甲苯-1-磺酰基)-l-苯丙氨酸(c
17h16
n2o4s)。
[0073]
在本公开的一个具体实施方案中,采用负向去除白细胞的阴性富集法来富集肿瘤细胞,其包括以下步骤:(a) 样本准备:取适量全血(待测样本),裂解(待测样本为胸水或腹水时不需要裂解)(例如按1:10比例(全血体积:1
×
红细胞裂解液体积)裂解10min),离心(例如500g离心5min),去上清,重悬细胞(例如用0.5%的bsa重悬细胞),获得细胞悬液;(b) 抗体孵育:将步骤(a)获得的细胞悬液和修饰物1(例如生物素)修饰的针对白细胞抗原的抗体(例如生物素修饰的cd45抗体和生物素修饰的cd66b抗体)混合,孵育,获得修饰物1-抗体-细胞复合物样本;优选地,在4℃孵育;优选地,孵育1h;优选地,将修饰物1-抗体-细胞复合物样本离心(优选500g离心5min),去上清,获得离心后的修饰物1-抗体-细胞复合物样本,用洗涤液(例如bsa-pbs)洗涤离心后的修饰物1-抗体-细胞复合物样本(例如洗涤1次),离心(优选500g离心5min),去上清,获得再次离心后的修饰物1-抗体-细胞复合物样本;优选地,加入的生物素修饰的cd45抗体终浓度为5μg/ml;优选地,加入生物素修饰的cd66b抗体终浓度10μg/ml;(c) 磁珠孵育:将步骤(b)获得的修饰物1-抗体-细胞复合物样本和修饰物2(例如链霉亲和素)修饰的磁珠混合,孵育,获得修饰物1-抗体-修饰物2-磁珠-细胞复合物样本;优选地,在4℃孵育,优选旋转孵育;优选地,孵育1h;(d) 磁力架分离:将步骤(c)获得的修饰物1-抗体-修饰物2-磁珠-细胞复合物样本置于磁力架上,磁分离,获得上清和纯化的肿瘤细胞样本,将纯化的肿瘤细胞样本离心,收集细胞沉淀。
[0074]
在本公开的一个具体实施方案中,采用正向抗体捕获肿瘤细胞的阳性富集法来富集肿瘤细胞,其包括以下步骤:(a) 磁珠偶联:取修饰物1(例如生物素)修饰的抗体(例如egfr抗体)和修饰物2(例如链霉亲和素)修饰的磁珠,加入到缓冲液(例如0.5% bsa-pbs缓冲液)中,孵育(例如室温旋转孵育4h),磁分离(例如分离3min),得到偶联抗体(例如egfr)的磁珠(即修饰物1-抗体-修饰物2-磁珠复合物);优选地,用0.5% bsa-pbs缓冲液洗涤此分离后的偶联抗体(例如egfr)的磁珠;(b) 样本准备:从受试者获得待测样本;
(c) 磁珠孵育:将步骤(a)获得的偶联抗体的磁珠和步骤(b)获得的待测样本混合,孵育,获得修饰物1-抗体-修饰物2-磁珠-细胞复合物样本;优选地,在4℃孵育,优选旋转孵育;优选地,孵育1h;(d) 磁力架分离:将步骤(c)获得的修饰物1-抗体-修饰物2-磁珠-细胞复合物样本置于磁力架上,磁分离,去除上清,获得肿瘤细胞样本。
[0075]
在本公开的一个具体的实施方案中,所述正向抗体捕获是单抗体捕获或多抗体捕获。
[0076]
在本公开的一个具体实施方案中,采用核酸适配体捕获肿瘤细胞的方法来富集肿瘤细胞,其包括以下步骤:(a) 磁珠偶联;将磁珠和碱性磷酸酶核酸适配体连接,获得偶联碱性磷酸酶核酸适配体(例如bg2)的磁珠;优选地,所述碱性磷酸酶核酸适配体的核苷酸序列如seq id no. 11所示;(b) 样本准备:取全血,获得待测样本;(c) 磁珠孵育:将步骤(a)获得的偶联碱性磷酸酶核酸适配体的磁珠和步骤(b)获得的待测样本混合,孵育,获得碱性磷酸酶核酸适配体-磁珠-细胞复合物样本;(d) 磁力架分离:将步骤(c)获得的碱性磷酸酶核酸适配体-磁珠-细胞复合物样本置于磁力架上,磁分离,去除上清,获得肿瘤细胞样本。
[0077]
可以理解地,上述利用肿瘤细胞或肿瘤细胞碎片负向捕获试剂采用负向去除白细胞的阴性富集法来富集肿瘤细胞、利用肿瘤细胞抗体捕获试剂采用正向捕获肿瘤细胞的阳性富集法来富集肿瘤细胞以及采用核酸适配体捕获试剂的方法中,所述肿瘤细胞包含肿瘤细胞和/或肿瘤细胞碎片,其由于具有特定表面生物标志物而均能被相应的捕获试剂捕获。
[0078]
在本公开的一个具体实施方案中,采用如下方式检测碱性磷酸酶活性:(1)将碱性磷酸酶的荧光发光底物、化学发光底物或显色底物与tnap抑制剂(例如tnap抑制剂1)混合,获得包含tnap抑制剂的碱性磷酸酶的发光底物液或显色底物液;(2)将步骤(1)获得的包含tnap抑制剂的碱性磷酸酶的发光底物液或显色底物液和肿瘤细胞样本混合,获得混合物;(3)检测步骤(2)获得的混合物,通过检测混合物的吸光度或相对发光单位来判断待测样本是否含有碱性碱性磷酸酶活性,从而测定或鉴定待测样本中是否含有表达碱性磷酸酶的肿瘤细胞或肿瘤细胞碎片。
[0079]
在本公开的一个具体实施方案中,所述肿瘤细胞是循环肿瘤细胞。
[0080]
采用本公开的方法,可以使白细胞背景值成倍降低,肿瘤细胞的信号值不变或轻微降低,信噪比显著提升。
[0081]
为了达到清楚和简洁描述的目的,本文中作为相同的或分开的一些实施方案的一部分来描述特征,然而,将要理解的是,本公开的范围可包括具有所描述的所有或一些特征的组合的一些实施方案。
[0082]
下面,参考具体实施例更详细地描述本公开,然而,实施例仅用于说明目的,对于本公开不具有限制作用。
实施例
[0083]
在以下实施例中各缩写表示的含义如下:tnap:组织非特异性碱性磷酸酶wbc:白细胞alpl:组织非特异性碱性磷酸酶基因,表达tnap(组织非特异性碱性磷酸酶)alpp:胎盘型碱性磷酸酶基因,表达plap(胎盘型碱性磷酸酶)alpi:肠型碱性磷酸酶基因,表达iap(肠型碱性磷酸酶)alpg:类胎盘型碱性磷酸酶基因,表达gcap(类胎盘型碱性磷酸酶)bg2:caaggaataggggtcggtgtgggtggttatgattggcttccttg(seq id no. 11)bg2 biotin:修饰了生物素的bg2bg2 peg biotin:修饰了peg(聚乙二醇)的bg2 biotinrlu:相对发光强度实施例1:肿瘤细胞与白细胞(wbc)的alpl、alpp、alpi以及alpg基因的表达水平对比1.1 实验步骤(1)提取白细胞(wbc)和肿瘤细胞系lovo、mcf-7、sw480、hcc827、h820、mkn 7、7721、caco2、和bewo(表1)的总rna,并对rna样本进行去gdna和逆转录处理,获得cdna。
[0084]
表1细胞系名称与其对应的肿瘤类型(2)将步骤(1)获得的cdna按照下述体系(表2和3)进行qpcr定量扩增,分别检测wbc和肿瘤细胞lovo、mcf-7、sw480、hcc827、h820、mkn 7、7721、caco2、和bewo的平均ct值,并将得到的平均ct值通过2
–
δδct (livak)方法计算得到wbc和肿瘤细胞系mcf-7、sw480、hcc827、h820、mkn 7、7721、caco2、bewo相对于lovo细胞alpl、alpp基因、alpi基因及alpg基因的相对表达量。使用引物见表2。
[0085]
表2引物信息
加样体系见表3。
[0086]
表3加样体系1.2 实验结果平均ct值结果见表4。
[0087]
表4平均ct值注:“无表达”表示样本未扩增根据表4的数据及2
–
δδct (livak)方法计算得到wbc以及肿瘤细胞系lovo、mcf-7、sw480、hcc827、h820、mkn 7、7721、caco2和bewo相对于lovo细胞alpl基因、alpp基因、alpi基因及alpg基因的相对表达量,结果见表5。
[0088]
表5基因的相对表达量
1.3 结论由表5可见,白细胞(wbc)中alpl基因的相对表达量显著高于肿瘤细胞系lovo、mcf-7、sw480、hcc827、h820、mkn 7、7721、caco2、bewo的相对表达量;且白细胞不表达alpp基因、alpi基因和alpg基因,或表达量极低。肿瘤细胞系lovo、mcf-7、sw480、hcc827、h820、mkn7、7721、caco2、bewo均表达alpp基因、alpi基因及alpg中的一种或几种;且上述肿瘤细胞系不表达alpl基因,或表达量极低。
[0089]
实施例2:肿瘤细胞系碱性磷酸酶的活性测试2.1 实验步骤(1)细胞准备:分别用0.25%的胰酶对肿瘤细胞系lovo、bewo、mkn-7、caco-2、mcf-7、7721消化2min,后用1640完全培养基终止消化,之后用1
×
pbs清洗细胞,离心去上清,用1ml 1
×
pbs重悬细胞并用血球计数板计数,将所得的细胞悬液分别按照每管1000个肿瘤细胞系细胞的量加入至1.5ml ep管,获得每管含有1000个lovo细胞(lovo-1000)的1.5ml ep管、每管含有1000个bewo细胞(bewo-1000)的1.5ml ep管、每管含有1000个mkn-7细胞(mkn-7-1000)的1.5ml ep管、每管含有1000个caco-2细胞(caco-2-1000)的1.5ml ep管、每管含有1000个mcf-7细胞(mcf-7-1000)的1.5ml ep管、每管含有1000个7721细胞(7721-1000)的1.5ml ep管。
[0090]
(2)化学发光检测:实验组:分别向步骤(1)中每个含有1000个肿瘤细胞系细胞的1.5ml ep管加入碱性磷酸酶化学发光底物液(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)400μl混匀反应5min,12000rpm离心2min,取200μl上清至酶标仪检测化学发光读值。
[0091]
空白对照实验:向1.5ml ep管加入碱性磷酸酶化学发光底物液(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)400μl,混匀反应5min,12000rpm离心2min,取200μl上清至酶标仪检测化学发光读值。
[0092]
2.2 实验结果及结论实验结果如图1所示,与空白对照实验相比,lovo(肠癌)、bewo(人胎盘绒毛癌细胞)、mkn-7(胃癌)、caco2(肠癌)、mcf7(乳腺癌)和7721(肝癌)细胞系的rlu值明显高于空白
oh)对白细胞上的组织非特异性碱性磷酸酶的抑制效果显著,而对肿瘤细胞lovo的影响较小。因此,可以通过抑制白细胞表面的组织非特异性碱性磷酸酶来降低白细胞来源的碱性磷酸酶背景。
[0104]
实施例4:tnap抑制剂在肿瘤细胞富集过程中对提高信噪比的应用本实施例采用阴性富集法富集肿瘤细胞,将白细胞和lovo细胞进行混合,模拟肿瘤病人的血液样本(待测样本)。本实施例的实验组分为6组:wbc样本组:100w个白细胞经过负向富集后,在富集出来的样本中加入碱性磷酸酶化学发光底物,未加入抑制剂,并进行发光检测;wbc-5 ic50样本组:100w个白细胞经过负向富集后,在富集出来的样本中加入含有950nm的tnap抑制剂1的碱性磷酸酶化学发光底物,并进行发光检测;wbc-10 ic50样本组:100w个白细胞经过负向富集后,在富集出来的样本中加入含有1900nm的tnap抑制剂1的碱性磷酸酶化学发光底物,并进行发光检测;wbc&lovo样本组:100w个白细胞与1000个lovo细胞的混合细胞经过负向富集后,在富集出来的样本中加入碱性磷酸酶化学发光底物,未加入抑制剂,并进行发光检测;wbc&lovo-5ic50样本组:将100w个白细胞与1000个lovo细胞的混合细胞经过负向富集后,在富集出来的样本中加入含有950nm的tnap抑制剂1的碱性磷酸酶化学发光底物,并进行发光检测;wbc&lovo-10 ic50样本组:将100w个白细胞与1000个lovo细胞的混合细胞经过负向富集后,在富集出来的样本中加入含有1900nm的tnap抑制剂1的碱性磷酸酶化学发光底物,并进行发光检测。
[0105]
4.1 实验步骤(1)wbc细胞准备:取5ml全血,用1
×
红细胞裂解液50ml裂解10min,500g离心5min去上清,之后用pbs清洗两遍,第一遍洗涤后500g离心5min,去上清,然后进行第二遍洗涤,再次300g离心3min,去上清,用1ml 0.5%的bsa重悬细胞,获得wbc细胞悬液,血球计数板计数。将细胞悬液按照每管100w个wbc细胞加入至1.5ml ep管。
[0106]
(2)lovo细胞准备:用0.25%的胰酶消化lovo细胞,用0.5% bsa-pbs终止消化,600rpm离心3min,2ml 0.5% bsa-pbs重悬细胞,获得lovo细胞悬液,血球计数板计数。将细胞悬液按照每管1000个lovo细胞加入至1.5ml ep管。
[0107]
(3)细胞混合:将100w个白细胞(wbc)与1000个lovo细胞在1.5ml ep管中混合并补充1
×
pbs至1ml。
[0108]
(4)抗体孵育:加入生物素标记的cd45抗体(终浓度5μg/ml)和生物素标记的cd66b抗体(终浓度10μg/ml),4℃孵育1h。
[0109]
(5)洗涤:500g离心5min,去上清,加入1ml 0.5% bsa-pbs洗涤1次,500g离心5min,去上清,保留30μl上清,补充0.5% bsa-pbs至1000μl。
[0110]
(6)磁珠孵育:加入25μl链霉亲和素磁珠,4℃旋转孵育1h。
[0111]
(7)磁力架分离:孵育后的样本放磁力架上10 min,将上清转移到新的ep管中,加入1ml 0.5% bsa-pbs洗涤1次,合并2次上清,500g离心5min,收集细胞沉淀,10μl 0.5% bsa-pbs重悬。cd45与cd66b是白细胞(wbc)表面抗原,白细胞(wbc)与生物素标记的cd45抗体与生物素标记的cd66b抗体结合后,带有生物素的抗体会与链霉亲和素磁珠结合,从而将白细胞(wbc)富集在磁珠上,通过磁力架分离去除磁珠即去除了白细胞(wbc),剩下的上清离心后获得的沉淀即是从白细胞(wbc)与lovo混合细胞中富集出来的样本。
[0112]
(8)检测:在碱性磷酸酶的化学发光底物(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)中加入tnap抑制剂1(c
17h16
n2o4s),使其终浓度为5 ic50(ic50=190nm)和10 ic50(ic50=190nm),获得5 ic50碱性磷酸酶化学发光底物液和10 ic50碱性磷酸酶化学发光底物液。
[0113]
每个样本加入碱性磷酸酶化学发光底物液400μl混匀反应5min,12000rpm离心2min,取200μl上清酶标仪检测化学发光读值。
[0114]
4.2 实验结果不同浓度tnap抑制剂对检测样本信噪比的影响见图5。由图5可见,tnap抑制剂1能够抑制tnap酶。
[0115]
表12表12中的信噪比是wbc&lovo化学发光读值与wbc化学发光读值的比值。由表12可见,使用tnap抑制剂1(c
17h16
n2o4s)后信噪比从6.2提升到171.5,信噪比提升显著。
[0116]
4.3 结论tnap抑制剂1(c
17h16
n2o4s)可以在模拟肿瘤病人的血液样本中提高信噪比。加入tnap抑制剂后,能够降低由白细胞导致的检测背景噪音,提高肿瘤细胞检测灵敏度。
[0117]
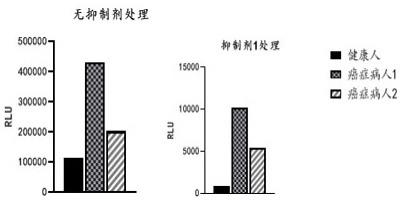
实施例5:tnap抑制剂在肿瘤细胞富集过程中对提高信噪比的应用本实施例采用单抗体捕获法富集肿瘤细胞。本实施例分为3个实验组,即:健康人样本组、癌症病人1样本组和癌症病人2样本组。
[0118]
5.1 实验步骤(1)磁珠偶联:取25μl链霉亲和素修饰的磁珠和4.5μl生物素标记的egfr抗体(egfr-biotin,购自thermo,货号ma5-12872)加入到1ml 0.5% bsa-pbs缓冲液中,室温旋转孵育4h,磁分离3min,0.5% bsa-pbs缓冲液洗涤2次,磁分离,得到偶联egfr抗体的磁珠。
[0119]
(2)样本准备:健康人和癌症病人样本(癌症病人1和癌症病人2)各取0.5ml全血,补充1
×
pbs至1ml,分别获得健康人样本和癌症病人样本。
[0120]
(3)磁珠孵育:向以上样本中加入步骤(1)制备得到的偶联egfr抗体的磁珠25μl,4℃旋转孵育1h。
[0121]
(4)磁力架分离:孵育完成后,将样本放在磁力架上20分钟,去上清,之后加入1ml 0.5% bsa-pbs洗涤,取下样本管用手轻轻旋转洗涤60次,再放在磁力架20分钟,去上清,共洗涤3次。最后一次洗涤完之后将样本管放在小型离心机上甩10秒后再放磁力架上5min,将上清吸干。
[0122]
(5)检测:在碱性磷酸酶的化学发光底物(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)中加入tnap抑制剂1(c
17h16
n2o4s),使其终浓度为5 ic50(ic50=190nm)。每个样本加入400μl以上配置好的碱性磷酸酶化学发光底物,混匀反应5min,12000rpm离心2min,取200μl上清至酶标仪检测化学发光读值。
[0123]
5.2 实验结果tnap抑制剂对检测样本信噪比的影响见图6。由图6可见,癌症病人1和癌症病人2样本的化学发光值显著高于健康人样本。
[0124]
表13由表13可见,没有使用抑制剂前癌症病人1、癌症病人2样本与健康人样本的化学发光比值为4和2,使用tnap抑制剂后癌症病人1、癌症病人2与健康人样本的化学发光比值为12和6,可见,使用tnap抑制剂后,癌症病人1、癌症病人2样本与健康人样本的化学发光比值增大。
[0125]
5.3 结论tnap抑制剂1(c
17h16
n2o4s)可以在实际的癌症病人样本中提高信噪比。加入tnap抑制剂后,能够降低由白细胞导致的检测背景噪音,提高肿瘤细胞检测灵敏度。
[0126]
实施例6:tnap抑制剂在肿瘤细胞富集过程中对提高信噪比的应用本实施例采用多抗体捕获法富集肿瘤细胞。本实施例分为2组,即:对照组(健康人全血)、癌细胞实验组(健康人全血+1000 lovo)。
[0127]
6.1 实验步骤(1)磁珠偶联:取25μl链霉亲和素修饰的磁珠和2μl生物素标记的egfr抗体(egfr-biotin,购自thermo,货号:ma5-12872)和epcam抗体(epcam-biotin,购自abcam,货号:ab79079)混合物,加入到1ml 0.5% bsa-pbs缓冲液中,室温旋转孵育4h,磁分离3min,0.5% bsa-pbs缓冲液洗涤2次,磁分离,得到偶联egfr和epcam抗体的磁珠。
[0128]
(2)样本准备:对照组和实验组各取0.5ml健康人全血,其中,往实验组中添加1000个lovo细胞,补充pbs至1ml,分别获得对照组样本和实验组样本。
[0129]
(3)磁珠孵育:
向以上样本中加入步骤(1)制备得到的偶联egfr和epcam抗体的磁珠25μl,4℃旋转孵育1h。
[0130]
(4)磁力架分离:孵育完成后,将样本放在磁力架上20分钟,去上清,之后加入1ml 0.5%bsa-pbs洗涤,再放在磁力架20分钟,去上清,共洗涤3次。最后一次洗涤完之后将样本管放在小型离心机上甩10秒后再放磁力架上5min,将上清吸干。
[0131]
(5)检测:在碱性磷酸酶的化学发光底物(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)中加入tnap抑制剂1(c
17h16
n2o4s),使其终浓度为5 ic50(ic50=190nm)。每个样本加入400μl以上配置好的碱性磷酸酶化学发光底物液,混匀反应5min,12000rpm离心2min,取200μl上清至酶标仪检测化学发光读值。
[0132]
6.2 实验结果tnap抑制剂对检测样本信噪比的影响见图7。由图7可见,实验组的化学发光值显著高于对照组。
[0133]
表14由表14可见,没有使用抑制剂前实验组与对照组的化学发光比值为12,使用tnap抑制剂后实验组与对照组的化学发光比值为214,可见,使用tnap抑制剂后,实验组与对照组的化学发光比值增大。
[0134]
6.3 结论tnap抑制剂1(c
17h16
n2o4s)可以在细胞加标实验中提高检测信噪比。加入tnap抑制剂后,能够降低由白细胞导致的检测背景噪音,提高肿瘤细胞检测灵敏度。
[0135]
实施例7:tnap抑制剂在肿瘤细胞富集过程中对提高信噪比的应用本实施例采用核酸适配体捕获法富集肿瘤细胞,将白细胞和lovo细胞进行混合,模拟肿瘤病人的血液样本(待测样本)。本实施例分为2组,即:对照组(wbc)、实验组(wbc+1000 lovo)。
[0136]
7.1实验步骤(1)磁珠偶联取25μl链霉亲和素修饰的磁珠和0.4μl bg2 peg biotin或bg2 biotin,加入到1ml pbs+bsa(1 mg/ml)缓冲液中,室温孵育30min,磁分离3min,1ml pbs+bsa(1 mg/ml)缓冲液洗涤2次,磁分离3min,得到偶联bg2 peg biotin或bg2 biotin的磁珠。
[0137]
(2)wbc细胞准备:取5ml全血,用1
×
红细胞裂解液50ml裂解10min,500g离心5min去上清,之后用pbs清洗两遍,第一遍洗涤后500g离心5min,去上清,然后进行第二遍洗涤,再次300g离心3min,去上清,用1ml 0.5%的bsa重悬细胞,获得wbc细胞悬液,血球计数板计数。将细胞悬液按照每管100万(100w)个白细胞(wbc)细胞加入至1.5ml ep管。
[0138]
(3)lovo细胞准备:
用0.25%的胰酶消化lovo细胞,用0.5% bsa-pbs终止消化,600rpm离心3min,2ml 0.5% bsa-pbs重悬细胞,获得lovo细胞悬液,血球计数板计数。将细胞悬液按照每管1000个lovo细胞加入至1.5ml ep管。
[0139]
(4)细胞混合:将100w个白细胞(wbc)与1000个lovo细胞在1.5ml ep管中混合并补充pbs+bsa(1 mg/ml)+鲑鱼精dna(0.1 mg/ml)至1ml。
[0140]
(5)磁珠孵育:向以上样本中分别加入步骤(1)制备得到的偶联bg2 peg biotin或bg2 biotin的磁珠25μl,4℃旋转孵育1h。
[0141]
(6)磁力架分离:孵育完成后,将样本放在磁力架上20分钟,去上清,之后加入1ml pbs+bsa(1 mg/ml)洗涤,取下样本管洗涤,再放在磁力架20分钟,去上清,共洗涤2次。最后一次洗涤完之后将样本管放在小型离心机上甩10秒后再放磁力架上5min,将上清吸干。
[0142]
(7)化学发光检测:在碱性磷酸酶的化学发光底物(碱性磷酸酶底物液a04,购自深圳美凯特科技有限公司,货号为224179)中加入tnap抑制剂1(c
17h16
n2o4s),使其终浓度为5 ic50(ic50=190nm),获得5 ic50碱性磷酸酶化学发光底物液。每个样本加入碱性磷酸酶化学发光底物液400μl混匀反应5min,12000rpm离心2min,取200μl上清至酶标仪检测化学发光读值。
[0143]
7.2实验结果tnap抑制剂对检测样本信噪比的影响见图8。由图8可见,实验组的化学发光值显著高于对照组。
[0144]
表15表15的信噪比是wbc&lovo化学发光读值与wbc化学发光读值的比值。由表15可见,没有使用抑制剂前bg2 peg biotin、bg2 biotin捕获lovo细胞的信噪比分别是45、32,使用tnap抑制剂后bg2 peg biotin, bg2 biotin的信噪比分别是188、96,可见,使用tnap抑制剂后信噪比提升明显。
[0145]
7.3 结论tnap抑制剂1(c
17h16
n2o4s)可以在肿瘤细胞添加实验中提高检测信噪比。加入tnap抑制剂后,能够降低由白细胞导致的检测背景噪音,提高肿瘤细胞检测灵敏度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1