环肽化合物及钯催化C-H烷基化构建该环肽化合物的方法
环肽化合物及钯催化c-h烷基化构建该环肽化合物的方法
技术领域
1.本发明涉及环肽化合物的制备技术领域,具体涉及一种环肽化合物及钯催化c(sp3)-h烷基化构建该环肽化合物的方法。
背景技术:
2.公开该背景技术部分的信息旨在增加对本发明总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.环肽是一类重要的具有生物活性的化合物,自1944年gause和brazhnikova发现gramicidin s以来,环肽化合物在医疗科学中的应用呈现迅猛增长的趋势。这类化合物的其中一个重要作用在于它能够调节蛋白质-蛋白质之间的相互作用,这对于小分子化合物而言具有相当大的挑战性。此外,相较于线性前体而言,环肽化合物具有表现出较高的细胞穿透性和对蛋白酶的较强的抵抗能力。环肽在医疗领域的巨大优势促使人们开发更加高效的合成策略。
4.近年来,过渡金属催化的c-h活化已经成为多肽和拟肽功能化的一项有效手段。例如,现有技术利用吡啶酰胺的导向作用实现n端氨基酸的δ-c(sp3)-h烷基化(参见文献1)。另一现有技术通过在多肽骨架中引入三氮唑单元,实现了丙氨酸残基的β-c(sp3)-h的芳基化(参见文献2)。另一现有技术通过aq/pa导向的c(sp3)-h芳基化策略,高效合成了一系列具有苯环支撑结构环肽分子(参见文献3)。x射线单晶衍射表明,通过该方法的构建的环肽中的苯环平面结构发生了弯曲,一般方法难以实现该特殊结构的合成。
5.然而,本发明人发现,上述方法采用的导向基团参与的多肽的官能化的方法在后期还要涉及到导向基团的去除问题,在原子经济性方面存在一定的不足。
6.现有技术文献:
7.文献1:zhan,b.-b.;li,y.;xu,j.w.;nie,x.-l.;fan,j.;jin,l.;shi,b.-f.angew.chem.int.ed.2018,57,5858.
8.文献2:liu,t.;qiao,j.x.;poss,m.a.;yu,j.q.angew.chem.int.ed.2017,56,10924-10927.
9.文献3:zhang,x.;lu,g.;sun,m.;mahankali,m.;ma,y.;zhang,m.;hua,w.;hu,y.;wang,q.;chen,j.;he,g.;qi,x.;shen,w.;liu,p.;chen,g.nat.chem.2018,10,540-548.
技术实现要素:
10.针对上述的问题,本发明提供一种环肽化合物及钯催化c(sp3)-h烷基化构建该环肽化合物的方法。本发明利用多肽骨架导向作用,实现多肽中甘氨酸选择性的c(sp3)-h烷基化。此外,本发明的合成方法中以二氯烷烃同时作为反应原料和溶剂,操作简单且反应高效。为实现上述目的,本发明公开如下技术方案。
11.在本发明的第一方面,公开一种环肽化合物,其结构式如式(1)所示:
[0012][0013]
上述式(1)中,所述r1选自h、f、cl、br、tbu、cn、ph、me、no2基团中的任意一种。
[0014]
上述式(1)中,所述r2选自me、ipr、tbu基团中的任意一种。
[0015]
上述式(1)中,所述r3选自me、bn基团中的任意一种。
[0016]
在本发明的第二方面,公开一种钯催化c(sp3)-h烷基化构建上述式(1)所示的环肽化合物的方法,包括如下步骤:将钯盐、氧化剂、多肽溶解于溶剂中形成混合液,所述多肽的结构式如式(2)所示。然后使所述混合液在加热条件下进行反应,反应完成之后分离出反应产物,即得所述环肽化合物。
[0017][0018]
上述式(2)中,所述r1选自h、f、cl、br、tbu、cn、ph、me、no2基团中的任意一种。
[0019]
上述式(2)中,所述r2选自me、ipr、tbu基团中的任意一种。
[0020]
上述式(2)中,所述r3选自me、bn基团中的任意一种。
[0021]
进一步地,所述钯盐包括醋酸钯(pd(oac)2)、三氟乙酸钯(pd(tfa)2)氯化钯(pdcl2)、四三苯基膦钯(pd(pph3)4)等中的任意一种。在本发明中,所述钯盐的作用包括:pd能够与多肽体系中的n、o进行配位,然后对多肽中甘氨酸的c(sp3)-h进行活化。随后,卤代烃对钯进行氧化加成,将二价钯氧化为四价态,最后,经历还原消除实现最终产物的合成。
[0022]
进一步地,在本发明中,为实现反应过程中钯盐的催化循环和氧化过程中卤代烃与甘氨酸的选择性c(sp3)-c(sp3)偶联,需要添加氧化剂对钯盐进行有效氧化,所述氧化剂包括银盐,优选为醋酸银(agoac),碳酸银(ag2co3),氯化银(agcl),磷酸银(ag3po4)等中的任意一种。
[0023]
进一步地,所述溶剂中包含二氯代烃,如含有二氯代烃的乙腈、丙酮、甲苯、正己烷等。优选为以纯二氯代烃为溶剂,在本发明中,所述二氯代烃即可作为反应原料,又可以作为反应溶剂。若采用混合溶剂,将反应当量的1,2-二氯乙烷分别溶解于乙腈,丙酮,甲苯,正己烷中,目标产物产率较低。原因可能是由于乙腈、丙酮、甲苯极性大,对氯代烃极化作用明显,影响多肽中甘氨酸与氯代烃c(sp3)-c(sp3)的有效偶联,非极性溶剂正己烷受制于对多肽底物溶解性问题,导致产率较低。
[0024]
进一步地,所述混合液中,钯盐、氧化剂、多肽的摩尔比为钯盐:氧化剂:多肽=1:10:10~1:100:200。
[0025]
进一步地,所述加热在空气中进行,加热反应温度范围为60~150℃,加热反应时间为12~24小时。优选地,所述加热反应温度为120℃,加热反应时间为15小时。
[0026]
进一步地,所述分离出反应产物的方法可采用:反应完成之后通过柱层析进行产
物分离,并以石油醚-乙酸乙酯为淋洗剂作梯度洗脱得到最终产物,即得所述环肽化合物。
[0027]
相较于现有技术,本发明具有以下有益而独特的效果:
[0028]
(1)本发明通过金属钯作为催化剂,在无需引入导向基团及其配体的前提下,利用式(2)所示的多肽骨架酰胺键的导向作用,高效实现了多肽甘氨酸csp
3-h的烷基化修饰及其环肽化合物的构建。同时,通过式(2)引入不同基团和二氯烷基的参与,成功实现不同环大小的环肽化合物。
[0029]
(2)本发明利用二氯代烃作为反应底物和反应溶剂,不仅操作简单,反应高效,而且由于无外在导向基团的参与,因此具有较高的原子经济型。这是因为:一方面对多肽具有良好的溶解能力;另一方面,能够保证反应在c(sp3)-h活化/c(sp3)-c(sp3)偶联之后进行后续c-n偶联,保证环肽产物的顺利生。
附图说明
[0030]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:
[0031]
图1为本发明第一实施例合成的环肽化合物的核磁共振图谱。
[0032]
图2为本发明第二实施例合成的环肽化合物的核磁共振图谱。
[0033]
图3为本发明第三实施例合成的环肽化合物的核磁共振图谱。
[0034]
图4为本发明第四实施例合成的环肽化合物的核磁共振图谱。
具体实施例
[0035]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
[0036]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。本发明中所述的较佳实施方法与材料仅作示范之用。现根据说明书附图和具体实施方式对本发明进一步说明。
[0037]
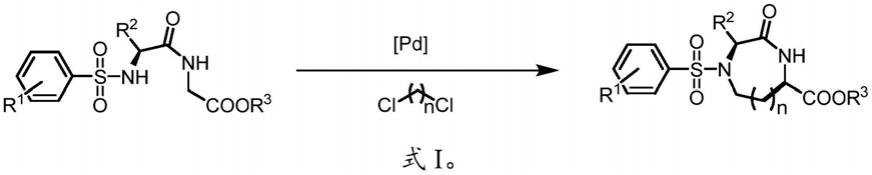
下列实施例中,所述肽化合物的反应方程式如式i所示:
[0038][0039]
第一实施例
[0040]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0041]
(1)将多肽4-no
2-phe-tleu-gly-obn(0.5mmol),1,2-二氯乙烷(5.0ml),醋酸钯(0.05mmol),碳酸银(1.0mmol)加入15ml的耐压管中,120℃油浴加热反应15h。
[0042]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到式a所示的环肽化合物,产率为70%。
[0043]
对本实施例构建的环肽化合物进行核磁共振检测,检测结果为:
[0044]1h nmr(500mhz,cdcl3)δ8.39(d,j=7.6hz,2h),8.14(d,j=8.6hz,2h),7.42-7.31(m,5h),7.26(s,1h),5.24-5.03(m,1h),4.75(d,j=17.0hz,1h),4.43-4.29(m,1h),4.23(d,j=17.0hz,1h),3.88(s,1h),3.54(s,1h),3.53-3.37(m,1h),1.08(s,9h).
[0045]
图1是本实施例制备的环肽化合物(1hnmr,500m,溶剂cdcl3)核磁共振谱图。
[0046][0047]
可以看出,本实施例通过醋酸钯作为催化剂,在无需引入导向基团及其配体的前提下,利用4-no
2-phe-tleu-gly-obn的骨架酰胺键的导向作用,高效实现了多肽甘氨酸c(sp3)-h的烷基化修饰及其环肽化合物的构建。
[0048]
第二实施例
[0049]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0050]
(1)将多肽2-ch
3-phe-tleu-gly-obn(0.5mmol),1,2-二氯乙烷(5.0ml),醋酸钯(0.05mmol),碳酸银(1.0mmol)加入15ml的耐压管中,120℃油浴加热反应15h。
[0051]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到式a所示的环肽化合物,产率为75%。
[0052]
对本实施例构建的环肽化合物进行核磁共振检测,检测结果为:
[0053]1h nmr(500mhz,cdcl3)δ8.45(d,j=7.6hz,1h),7.55-7.01(m,8h),5.14(q,j=12.2hz,2h),5.00(d,j=17.5hz,1h),4.42-4.16(m,1h),4.06(d,j=17.5hz,1h),3.81(dd,j=9.9,5.1hz,1h),3.54-3.17(m,4h),2.76(s,3h),1.08(s,9h).
[0054]
图2是本实施例制备的环肽化合物(1hnmr,500m,溶剂cdcl3)核磁共振谱图。
[0055][0056]
可以看出,本实施例通过金属钯作为催化剂,在无需引入导向基团及其配体的前提下,利用2-ch
3-phe-tleu-gly-obn的骨架酰胺键的导向作用,高效实现了多肽甘氨酸c(sp3)-h的烷基化修饰及其环肽化合物的构建。
[0057]
第三实施例
[0058]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0059]
(1)将多肽2-cl-phe-tleu-gly-obn(0.5mmol),1,2-二氯乙烷(5.0ml),醋酸钯(0.5mmol),碳酸银(1.0mmol)加入15ml的耐压管中,120℃油浴加热反应15h。
[0060]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到式a所示的环肽化合物,产率为65%。
[0061]
对本实施例构建的环肽化合物进行核磁共振检测,检测结果为:
[0062]1h nmr(500mhz,cdcl3)δ8.62(s,1h),7.49-7.28(m,9h),7.26(s,1h),5.13(d,j=11.9hz,2h),5.01(d,j=17.5hz,1h),4.43-4.27(m,1h),4.22(dt,j=10.3,5.1hz,1h),4.17-4.07(m,1h),3.65(s,1h),3.63-3.49(m,2h),1.07(s,9h).
[0063]
图3是本实施例制备的环肽化合物(1hnmr,500m,溶剂cdcl3)核磁共振谱图。
[0064][0065]
可以看出,本实施例通过金属钯作为催化剂,在无需引入导向基团及其配体的前提下,利用2-cl-phe-tleu-gly-obn的骨架酰胺键的导向作用,高效实现了多肽甘氨酸csp
3-h的烷基化修饰及其环肽化合物的构建。
[0066]
第四实施例
[0067]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0068]
(1)将多肽4-no
2-phe-tleu-gly-ome(0.5mmol),1,3-二氯丙烷(5.0ml),醋酸钯(0.05mmol),碳酸银(1.0mmol)加入15ml的耐压管中,120℃油浴加热反应15h。
[0069]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到式a所示的环肽化合物,产率为70%。
[0070]
对本实施例构建的环肽化合物进行核磁共振检测,检测结果为:
[0071]1h nmr(500mhz,cdcl3)δ8.42(d,j=6.3hz,2h),8.17(d,j=8.4hz,2h),7.34(s,5h),7.27(s,1h),5.09(s,1h),4.70(d,j=17.0hz,1h),4.27(dt,j=12.3,6.2hz,1h),4.02(d,j=17.1hz,1h),3.77(s,1h),3.60(s,1h),3.50
–
3.23(m,1h),2.05
–
1.65(m,1h),1.08(s,9h)
[0072]
图4是本实施例制备的环肽化合物(1hnmr,500m,溶剂cdcl3)核磁共振谱图。
[0073][0074]
可以看出,本实施例通过醋酸钯作为催化剂,在无需引入导向基团及其配体的前提下,利用4-no
2-phe-tleu-gly-ome的骨架酰胺键的导向作用,高效实现了多肽甘氨酸c
(sp3)-h的烷基化修饰及其环肽化合物的构建。
[0075]
第五实施例
[0076]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0077]
(1)将多肽4-no
2-phe-tleu-gly-obn(0.5mmol),1,2-二氯乙烷(5.0ml),三氟乙酸钯(0.05mmol),醋酸银(0.5mmol)加入15ml的耐压管中,150℃油浴加热反应12h。
[0078]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到环肽化合物,产率为72%。
[0079]
第六实施例
[0080]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0081]
(1)将多肽4-no
2-phe-tleu-gly-obn(10mmol),1,2-二氯乙烷(5.0ml),氯化钯(0.05mmol),氯化银(5.0mmol)加入15ml的耐压管中,60℃油浴加热反应24h。
[0082]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到环肽化合物,产率为68%。
[0083]
第七实施例
[0084]
一种钯催化c(sp3)-h烷基化构建环肽化合物的方法,包括如下步骤:
[0085]
(1)将多肽2-ch
3-phe-tleu-gly-obn(5mmol),1,2-二氯乙烷(5.0ml),四三苯基膦钯(0.05mmol),磷酸银(2.5mmol)加入15ml的耐压管中,90℃油浴加热反应20h。
[0086]
(2)反应完成后,将反应混合物用旋转蒸发仪在转速为120rps,水浴温度45℃,水泵真空度为0.1mpa的条件下进行减压浓缩。随后用硅胶柱层析分离产物,石油醚(b.p.60-90℃)-乙酸乙酯为淋洗剂进行梯度洗脱,得到式a所示的环肽化合物,产率为77%。
[0087]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1