Reg4抗菌肽治疗致病性大肠埃希菌感染的应用的制作方法
reg4抗菌肽治疗致病性大肠埃希菌感染的应用
技术领域
1.本发明涉及新药物用途领域,具体地,涉及reg4抗菌肽治疗致病性大肠埃希菌感染的应用。
背景技术:
2.大肠埃希菌是人和动物肠道正常菌群的主要成员,但其中有些带有致病基因的血清型会引起人类肠道感染、泌尿道感染,并可引发致死性并发症。
3.在胃肠道感染疾病中,肠致病性大肠埃希菌(enteropathogenic e.coli,epec)为大肠埃希菌性胃肠炎的常见病原体之一,其在儿童中的发病率较高,尤其是3岁以下的幼儿,且疾病的危害性大,在发展中国家的发病率和病死率较高。
4.由此,研究表明,肠致病性大肠埃希菌(epec)是儿童中重度腹泻的主要病原菌之一,严重威胁婴幼儿肠道发育和健康成长。抗生素治疗是治疗epec感染的重要手段,但随着抗生素的滥用,越来越多的epec临床分离株表现出对青霉素和头胞菌素等多种抗生素耐药。
5.婴幼儿肠道免疫功能发育不成熟、胃酸及各种消化酶活力较低,且自身免疫力低下。epec感染易引起患儿出现中重度急性水样腹泻、发热和呕吐等症状,严重影响患儿身心健康。越来越多的epec临床分离株表现出对青霉素和头胞菌素等多种抗生素耐药。因此,目前迫切需要开发不易产生耐药性、活性高、安全可靠的新型抗epec感染的药物。
6.虽然,抗菌肽是抗生素的理想代替品之一。但目前尚未有研究发现reg4蛋白在治疗epec感染中的作用。
技术实现要素:
7.本发明旨在克服上述缺陷,提供了一种抗生素的理想代替品,即、reg4抗菌肽。
8.本发明提供了一种活性成分的用途,其特征在于:
9.上述活性成分为:reg4蛋白;
10.关于reg4蛋白的序列如seq id no.1所示;
11.seq id no.1
12.》sp|q9d8g5|reg4_mouse regenerating islet-derived protein 4 os=mus musculus ox=10090 gn=reg4 pe=2sv=1
13.metalaserlysglyvalargleuleuleuleuleusertrpvalalaglyprogluval
14.leuseraspileleuargprosercysalaproglytrpphetyrtyrargserhiscys
15.tyrglytyrphearglysleuargasntrpserhisalagluleuglucysglnsertyr
16.glyasnglyserhisleualaservalleuasnglnlysglualaservalileserlys
17.tyrilethrglytyrglnargasnleuprovaltrpileglyleuhisaspproglnlys
18.lysglnleutrpglntrpthraspglyserthrasnleutyrargargtrpasnproargthrlyssergluala
19.arghiscysalaglumetasnprolysasplyspheleuthrtrp
20.asnlysasnglycysalaasnargglnhispheleucyslystyrlysthr
21.上述用途包括:用于制备治疗epec感染症状的药物。
22.本发明提供了一种活性成分的用途,其特征在于:
23.所述用途还包括:用于制备治疗和缓解由epec感染引起的肠道炎症反应的药物;
24.本发明提供了一种活性成分的用途,其特征在于:
25.所述用途还包括:用于制备治疗和缓解由epec感染引起的病理性损伤的药物。
26.本发明提供了一种活性成分的用途,其特征在于:
27.所述用途还包括:用于制备治疗和缓解由epec感染导致的体重丢失病症的药物。
28.本发明提供了一种活性成分的用途,其特征在于:
29.所述用途还包括:本发明提供了一种活性成分的用途,其特征在于:
30.所述用途包括:用于制备抑制epec生长的药物。
31.本发明提供了一种活性成分的用途,其特征在于:
32.所述用途还包括:用于制备减少epec在肠道内的定植的药物。
33.本发明提供了一种活性成分的用途,其特征在于:
34.所述用途还包括:用于制备能够降低epec迁移能力的药物。
35.本发明提供了一种活性成分的用途,其特征在于:
36.所述用途还包括:用于制备减少epec对肠道外脏器的侵袭的药物。
37.此外,本发明还提供了一种epec急性感染实验模型,其特征在于,由如下步骤建模:
38.s1.在细菌感染前2天,向目标模型体添加链霉素;
39.s2.在细菌感染前1天,停止添加链霉素;
40.s3.采用epec菌液进行细菌感染。
41.本发明的作用和效果:
42.在本发明的研究中表明,再生基因(regenerating family,reg)蛋白4(reg4)是机体表达的分泌性蛋白,经本发明的研究表明reg4蛋白具有抗菌肽活性。
43.在本发明的研究中将不同浓度reg4蛋白与epec共孵育,发现reg4蛋白能显著抑制epec生长。定量pcr检测epec感染小鼠肠道粘膜中reg4表达水平,发现epec感染导致reg4表达水平升高。
44.此外,本发明基于成功建立的epec急性感染实验,使用reg4蛋白治疗epec感染小鼠,发现reg4蛋白能减少epec在肠道内的定植及对肠道外脏器的侵袭,改善由epec感染引起的肠道炎症和病理性损伤。同时,elisa实验检测发现reg4蛋白能与epec鞭毛蛋白结合,从而减少epec迁移能力。
45.此外,epec致病主要依靠肠上皮细胞脱落基因座(the locus of enterocyte effacement,lee)编码效应分子,该效应分子依靠lee编码的iii型分泌系统(t3ss)分泌并转位进入宿主细胞,从而引起细胞病变和损伤。典型的改变是细菌紧密粘附在宿主细胞表面,引起肠刷状缘位点破坏和原生质膜扭曲变形,细胞骨架重新排列。细菌粘附处形成基垫,并伴有上皮细胞大量微绒毛脱落,即粘附和脱落损伤(attaching and effacing lesion,a/e lesion)。a/e损伤导致了肠黏膜吸收能力下降,从而破坏机体电解质平衡,导
致严重腹泻。鞭毛作为肠致病性大肠埃希菌的运动器官,在细菌运动和致病性上具有重要作用。细菌鞭毛可促进肠致病性大肠埃希菌粘附和侵袭肠上皮细胞。故而,通过本发明的研究表明,reg4能够与epec鞭毛蛋白结合,也就是说在本发明中明确了reg4蛋白通过结合肠致病性大肠埃希菌鞭毛,从而减少epec定植肠道和侵袭肠道外脏器的具体机制。
46.由此,本发明公开的reg4蛋白抗菌活性较强,具有分子质量小、抗蛋白酶降解、抗菌谱广、抗菌机制异于传统抗生素,对抗生素产生的超级耐药菌株具有较好的抗菌活性等特性,而reg4蛋白属于人体抗菌肽中的一种,不会引起机体排异反应,且无药物残留等风险。
47.因此,本发明公开的reg4蛋白有望减少传统抗生素耐药性,作为一种新型抗菌肽,用于有效治疗epec感染,成为今后治疗肠致病性大肠埃希菌感染的最佳药物,为临床治疗epec感染提供新的治疗策略。
附图说明
48.图1.reg4蛋白抑制epec生长
49.其中,图1a为epec细菌生长动力学曲线(****,epec+pbs vs.epec+10μg/ml,p《0.0001)。
50.图1b为reg4蛋白和epec细菌共同孵育第4h od
600
测量结果。
51.图1c为reg4蛋白和epec细菌共同孵育第24h细菌平板涂布结果。
52.图1d为reg4蛋白和epec细菌共同孵育第24h细菌数目测量结果。
53.图2.epec感染小鼠流程图和小鼠体重变化
54.其中,图2a为epec感染小鼠流程图。
55.图2b为epec感染小鼠体重变化。
56.图3.epec感染小鼠肠道病理变化和评分
57.其中,图3a为回肠和结肠he染色光镜(各组放大倍数:
×
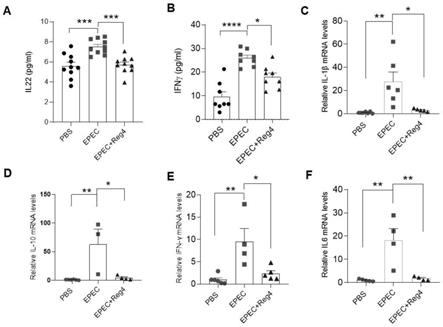
100)。
58.图3b为各组小鼠回肠和结肠炎症病理学评分
59.图4.小鼠盲肠及粪便中epec细菌含量检测结果
60.其中,图4a为重组鼠reg4蛋白对盲肠和粪便中epec细菌含量的影响。
61.图4b为各组小鼠盲肠组织和粪便中epec细菌含量的比较。
62.图5.小鼠肝脏、脾脏和肠系膜淋巴结中epec细菌含量检测结果
63.其中,图5a为重组鼠reg4蛋白对肝脏、脾脏和肠系膜淋巴结中epec细菌含量的影响。
64.图5b为各组小鼠肝脏中epec细菌含量的比较。
65.图5c为各组小鼠脾脏中epec细菌含量的比较。
66.图5d为各组小鼠肠系膜淋巴结中epec细菌含量的比较。
67.图6.小鼠相关炎症因子表达水平检测
68.其中,图6a为elisa检测小鼠血清中il-22含量。
69.图6b为elisa检测小鼠血清中ifn-γ含量。
70.图6c为小鼠结肠粘膜组织中il-1β的表达水平。
71.图6d为小鼠结肠粘膜组织中il-10的表达水平。
72.图6e为小鼠结肠粘膜组织中ifn-γ的表达水平。
73.图6f为小鼠结肠粘膜组织中il-6的表达水平。
74.图7.reg4与epec鞭毛结合作用
75.其中,图7a为epec在半固体琼脂糖培养板内迁移结果。
76.图7b为epec在半固体琼脂糖培养板内迁移形成的晕圈直径检测结果。
77.图7c为epec鞭毛蛋白提取结果。
78.图7d为elisa检测epec鞭毛与reg4蛋白结合作用。
具体实施方式
79.实施例1.reg4蛋白在体外抑制epec生长实验
80.1.1主要材料
81.(1)胰蛋白胨:st800,上海碧云天生物技术有限公司
82.(2)酵母膏:st968,上海碧云天生物技术有限公司
83.(3)氯化钠:1249kg001,上海兢蔚生物科技有限公司
84.(4)高纯度低电渗琼脂糖:g5056-100g,武汉塞维尔生物科技有限公司
85.(5)肠致病性大肠埃希氏菌(escherichia coli,epec):bio-56094,购自北京百欧博伟生物技术有限公司。
86.1.2方法
87.1.2.1 luria-bertani(lb)培养基和培养板的配制:
88.lb培养基:在1000ml去离子水中加入:胰化蛋白胨10g,酵母提取物5g,nacl 10g,加入1000ml双蒸水(摇动容器直至溶质溶解,高压下蒸汽灭菌20min。
89.lb固体培养基及倒板:(1).配制:100ml lb培养基加入1.5g琼脂粉;
90.(2).抗生素的加入:高压灭菌后,将融化的lb固体培养基置与55℃的水浴中,待培养基温度降到55℃时加入卡那霉素(终浓度为50μg/ml),以免温度过高导致抗生素失效,并充分摇匀。
91.(3).倒板:10ml lb倒1个板子。培养基倒入培养皿后,打开盖子,在紫外下照10-15分钟。
92.(4).保存:用封口胶封边,并倒置放于4℃保存,一个月内使用。
93.1.2.2肠致病性大肠埃希氏菌培养
94.用无菌吸管吸取0.5ml左右lb液体培养基于冻干管中将冻干菌粉全部溶解。将溶解后的细菌悬液转移至盛有5ml液体培养基的试管中混匀,并取100μl转接到固体培养基上。将液体试管和斜面试管静置培养。取100μl epec菌液加至1000ml含50μg/ml卡那霉素的写上全称然后再缩写培养基中,37℃,过夜培养,培养至对数生长期后,4000rpm,20min,离心收集菌体,用pbs缓冲液重悬,使用平板计数法测定菌液菌落总数,-80℃保存菌体备用。
95.1.2.3 reg4蛋白浓度调整
96.用灭菌pbs缓冲液将药物浓度调整为1mg/ml。所有蛋白溶液在使用前均使用0.22μm滤膜过滤除菌,保存于无菌1.5ml ep管。
97.1.2.4 reg4蛋白与epec共孵育
98.将10μl复苏的epec细菌悬液接种到总共200μl含有不同浓度(0,2或10μg/ml)reg4
蛋白。每2小时通过od
600
测量监测细菌的生长。
99.用灭菌pbs缓冲液将epec稀释至终浓度为2
×
105cfu/ml。取15ml离心管4支,排成一排,第1管加入1980ul lb培养基和20μl稀释好的epec菌液(作为对照组),第2管加入1978μl lb培养基、20μl菌液和2μl重组鼠reg4蛋白(作为1μg/ml组),第3管加入1960μl lb培养基、20μl菌液和20μl重组鼠reg4蛋白(作为10μg/ml组),混匀。盖好盖子,置37℃恒温箱中孵育24小时。
100.1.2.5细菌菌落总数测定
101.将孵育好的菌液用灭菌水连续稀释至终浓度为1
×
107cfu/ml。取100μl孵育好的菌液均匀涂抹于卡那霉素琼脂培养板上。平板平放于超净台上30分钟,使菌液渗入培养基表层内。将平板倒置于37℃恒温箱中培养24h,24h后计算平板菌落数目,乘于稀释倍数即得出各组菌落数目。
102.1.3结果
103.1.3.1细菌菌落总数测定
104.根据gb 4789.2-2016标准进行细菌平板计数。epec菌落总数为7.6
×
109cfu/ml。
105.1.3.2重组reg4蛋白抑制epec细菌生长
106.将epec分别与不同浓度的重组reg4蛋白共同孵育,进行od
600
测定(图1a-b)。细菌生长动力学曲线结果显示,当reg4蛋白浓度达到10μg/ml时能有效抑制epec的生长。
107.将epec分别与pbs、1μg/ml、5μg/ml和10μg/ml重组鼠reg4蛋白共同孵育24h,进行细菌菌落总数测定(图1c-d)。结果显示,pbs组细菌总数为8.46
×
109cfu/ml,给予1μg/ml重组reg4蛋白后细菌总数减少至3.51
×
109cfu/ml(p=0.023),给予5μg/ml重组reg4蛋白后细菌总数减少至1.87
×
109cfu/ml(p=0.002),给予10μg/ml重组reg4蛋白细菌总数则减少约7倍,总数为1.24
×
109cfu/ml(p=0.0005)。结果表明,重组reg4蛋白能有效抑制epec生长。
108.实施例2.reg4蛋白抵抗epec感染小鼠
109.2.1主要材料
110.(1)c57bl/6小鼠:上海吉辉实验动物饲养有限公司
111.(2)灌胃针8号:gwz-8-45,上海晶旷生物科技有限公司
112.2.2方法
113.2.2.1 reg4蛋白浓度调整
114.用灭菌pbs缓冲液将药物浓度调整为1mg/ml。所有蛋白在使用前均使用0.22μm滤膜过滤除菌,保存于无菌1.5ml ep管。
115.2.2.2 epec菌液稀释
116.用灭菌pbs缓冲液将epec稀释至终浓度为2
×
109cfu/ml。
117.2.2.3小鼠急性感染实验
118.取35日龄野生型(wide type,wt)雄性c57bl/6小鼠作为感染对象,随机分成6组,分组如下:包括con组(n=10),epec+pbs组和epec+reg4组(n=10)。
119.实验操作如图2a所示,在细菌感染前2天在小鼠饮用水中添加5g/l链霉素以引起肠道菌群絮乱,感染前1天改用正常饮用水。给予每只小鼠灌胃100μl epec菌液(细菌总量为2
×
109cfu)。从感染后第1天起,epec+reg4组小每日经腹腔注射给予100μl 10μg/ml鼠
reg4蛋白,con组和epec+pbs组给予腹腔注射等量灭菌pbs。
120.每日定时记录小鼠体重,在感染第4天进行取材。小鼠麻醉之后眼球取血,脱颈处死,开腹取材。取部分回肠和结肠置于4%多聚甲醛中固定。收集肝脏、脾脏、肠系膜淋巴结、部分盲肠和小鼠粪便用于细菌总数测定。刮取回肠末端和结肠肠粘膜。
121.2.2.4脏器细菌负荷量测定
122.用无菌剪刀、镊子取小鼠肝脏、脾脏、肠系膜淋巴结、盲肠和粪便,根据重量加入无菌pbs溶液,无菌环境中进行匀浆处理。后对匀浆液进行连续梯度稀释,分别吸取100μl匀浆液涂布在含有卡那霉素的lb培养板上,过夜培养,观察菌落状态并计数。
123.2.2.6肠道组织病理学评分
124.取小鼠回肠和结肠置于4%多聚甲醛中固定,常规脱水、包埋、切片、he染色,显微镜下观察肠上皮组织完整性、粘膜下水肿程度和炎症细胞浸润等病理变化。
125.2.2.7检测肠道炎症反应
126.根据试剂商提供的实验方案,检测小鼠血清中il-22和ifn-γ含量。使用rna提取试剂盒提取小鼠结肠粘膜组织,定量per检测小鼠结肠粘膜相关炎症基因的表达水平,包括il-1β、il-10、ifn-γ和il-6。
127.2.3结果
128.2.3.1 reg4蛋白能改善epec感染小鼠体重丢失
129.各组小鼠体重丢失情况如图2b所示,未给予epec感染的con组小鼠体重缓慢上升,感染后第3天体重增长初始体重的107.8%,而epec感染的各组小鼠均出现不同程度的体重丢失。在感染后第1天,epec+pbs组和epec+reg4组小鼠体重分别为初始体重的96.1%和96.4%,显著低于con组(p均《0.0001)。在感染后第3天,epec+reg4组小鼠体重增长初始体重的102.8%,而epec+reg4组小鼠体重为初始体重的98.6%,两组小鼠体重增长速率具有统计学差异(p=0.0069)。结果表明,reg4蛋白治疗能改善epec感染小鼠体重丢失情况。
130.2.3.2 reg4蛋白能缓解epec引起的肠道损伤
131.病理检测结果如图3a-b显示,相比于con组小鼠回肠和结肠组织,epec+pbs组小鼠回肠和结肠均可见肠绒毛均发生严重的破损、脱落,粘膜脱落至肠腔内,肠腔内可见纤维素渗出,大部分腺体被破坏,粘膜下层水肿严重,粘膜肌层和粘膜下层可见有大量中性粒细胞浸润。而epec+reg4组小鼠回肠和结肠损伤均有所改善,肠粘膜脱落减轻,固有层炎症细胞浸润减少。肠道病理评分也显示,epec+pbs组小鼠回肠和结肠发生严重的炎症,而给予reg4蛋白后肠道炎症明显减轻。结果表明reg4蛋白可以有效缓解epec造成的肠道病理损伤。
132.2.3.3 reg4蛋白能减少epec在肠道内定植
133.对各组小鼠粪便和盲肠中的epec细菌数量进行检测,结果如图4a-c。未感染对照组小鼠盲肠和粪便中均未检测到epec,而epec+pbs组小鼠盲肠和粪便均检测到大量epec。在给予reg4蛋白治疗后,epec+reg4组小鼠盲肠和粪便中的epec数目明显减少(p《0.01)。
134.2.3.4 reg4蛋白能减轻epec对小鼠脏器组织的侵袭情况
135.对各组小鼠肠系膜淋巴结、脾脏和肝脏中的epec细菌数量进行检测,结果如图5a-d。未感染对照组小鼠肠道外脏器中未检测到epec,epec感染小鼠各脏器均可见epec定植分布。与epec+pbs组小鼠相比,epec+reg4组小鼠肝脏、脾脏和肠系膜淋巴结中的epec数量明显减少。结果表明reg4蛋白能有效抑制epec侵袭其他肠道外器官组织。
136.2.3.5 reg4蛋白能改善epec诱导的肠道炎症反应
137.使用elisa试剂盒检测各组小鼠血清中il-22和ifn-γ含量。结果如图6a-b显示,epec感染小鼠血清il-22和ifn-γ含量较未感染组小鼠明显增加,给予reg4蛋白干预可明显减少血清中il-22和ifn-γ含量。使用定量per检测小鼠结肠粘膜相关炎症基因的表达水平,结果如图6c-f。epec感染小鼠结肠粘膜组织中il-1β、il-10、ifn-γ和il-6的表达水平均较未感染组小鼠明显升高,给予reg4蛋白干预可明显减低小鼠结肠粘膜组织中il-1β、il-10、ifn-γ和il-6的表达水平。以上结果表明reg4蛋白能改善epec诱导的肠道炎症反应。
138.实施例3.reg4抑制epec迁移作用机制
139.3.1主要材料
140.(1)96孔eia/ria板:9018,上海宇进生物科技有限公司
141.(2)reg4抗体:bs-10036r,上海科雅生物科技有限公司
142.(3)tmb显色液:p0209-100ml,上海碧云天生物技术有限公司
143.3.2方法
144.3.2.1 reg4蛋白对epec迁移的影响
145.将处于对数生长期的epec与reg4蛋白共孵育1h。取10ul培养物接种在含有0.3%琼脂的半固体琼脂平板上,37℃孵育10h后细菌运动形成晕圈,检测晕圈直径大小。
146.3.2.2提取伤epec鞭毛
147.epec培养至对数生长期,用pbs重悬细菌沉淀,300次/min振荡分离鞭毛和菌体。离心(4000g,20min),获取上清和沉淀。将上清进一步超速离心(80000g,60min),获取上清和沉淀,沉淀即为epec鞭毛。sds-page鉴定epec鞭毛蛋白纯度。
148.3.2.3 elisa实验检测epec鞭毛与reg4蛋白结合
149.将elisa板用100ug/ml鞭毛或bsa包被过夜(4℃,16h)。使用pbs洗板3次,用含1%bsa的pbs配制不同浓度的reg4蛋白和突变型reg4蛋白(0、2、4、6、8和10ug/ml),将含蛋白溶液与elisa板共孵育2h(37℃)。pbs洗板3次,加入reg4抗体(1:1000),孵育2h。pbs洗板3次,加入二抗(1:5000),在37℃孵育2h。pbs洗板3次,加入tmb显色,测量od
450
值。
150.3.3结果
151.3.3.1 reg4蛋白能减少epec迁移
152.对比epec在半固体琼脂平板的迁移情况,结果如图7a-b。pbs组epec在半固体琼脂平板迁移,形成直径为(12.8
±
0.4)cm的晕圈,而给予reg4蛋白之后,reg4+epec组细菌晕圈直径减小为(8.8
±
0.6)cm,提示reg4蛋白能抑制epec迁移。
153.3.3.2提取epec鞭毛
154.提取鞭毛蛋白并行sds-page电泳,考马斯亮蓝染色分析。结果如图7c,考马斯亮蓝结果显示在沉淀中检测到相对分子质量约为60kda的条带,其大小均与预期蛋白大小相符。鞭毛蛋白浓度为1.1mg/ml。
155.3.3.3 epec鞭毛与reg4蛋白结合
156.使用elisa实验检测epec鞭毛与reg4结合情况,结果如图7d.epec+bsa值od
450
值未见明显变化,而epec+reg4组od
450
值随着reg4蛋白剂量的增加而增加,提示reg4蛋白与epec鞭毛蛋白相互结合。
157.158.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1