FTO在诊治骨肉瘤中的应用
fto在诊治骨肉瘤中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及fto在诊治骨肉瘤中的应用。
背景技术:
2.骨肉瘤是儿童和青壮年最常见的原发性骨恶性肿瘤,虽然只占儿童和青少年癌症的约5%,但它对儿童癌症死亡率有很大影响。骨肉瘤可在任何骨骼中诊断,但最常见的表现部位是长骨的干骺端,主要是股骨远端,其次是胫骨近端和肱骨近端,只有不到10%的儿童病例会在中轴骨骼中诊断。其中,大约20%的患者在就诊时就发现转移性病变,最常见的是肺部,其次是骨、淋巴结或其他软组织病变。转移灶的存在是一个显著的不良预后指标。
3.上世纪70年代和80年代,随着新辅助化疗的出现以及外科保肢技术的进步,骨肉瘤患者的预后得到了极大的改善,没有转移性病变的骨肉瘤患者的总体生存率提高到60%~70%,这支持了从诊断时就控制微转移病变对长期生存是必须的这一观点,新辅助化疗成为骨肉瘤患者护理的标准。然而,对于出现了转移性病变的患者,尽管进行积极地切除和强化全身化疗,5年的无事件生存率(event-free survival,efs)却只有20%。复发的患者同样表现不佳,10年总体生存率只有20%或更低。此外,大约40~50%患者对当前化疗方案不敏感。近二三十年来,基于众多针对骨肉瘤发病机制的研究,多项新药物的临床试验以及通过进行标准化疗强化剂量策略的研究未能成功改善骨肉瘤患者的预后。
4.目前,骨肉瘤的发病机制仍不清楚,它的发生、发展是一个多因素、多步骤、多基因参与的复杂过程。既往研究者们对骨肉瘤的发生、发展机制做了大量的研究,发现了骨肉瘤不同发生发展进程相关的基因组紊乱及异常信号通路,包括大多数骨肉瘤病例中都存在tp53及rb基因的失活等。然而这些研究尚未能更好地提高目前治疗策略的疗效来改善患者预后,临床治疗效果停滞不前。因此,在新的分子层面继续深入探索骨肉瘤发生、发展的机制显得尤为重要。
5.能量与肥胖相关蛋白(fto)是第一个被发现的m6a mrna去甲基化酶,以二价铁依赖的方式催化m6a去甲基化。它既往被认为与儿童和成人的肥胖高度相关,在小鼠体内敲除fto基因显示出对肥胖的保护作用。但是,尚无fto在诊治骨肉瘤中应用的报道。
技术实现要素:
6.本发明的第一方面的目的,在于提供检测fto和/或dact1的试剂在制备骨肉瘤诊断或预后评估的产品中的应用。
7.本发明的第二方面的目的,在于提供fto抑制剂的应用。
8.本发明的第三方面的目的,在于提供一种rna。
9.本发明的第四方面的目的,在于提供编码本发明第三方面的rna的核酸分子。
10.本发明的第五方面的目的,在于提供包含本发明第四方面的核酸分子的表达盒、载体或转基因细胞系。
11.本发明的第六方面的目的,在于提供一种诊断产品。
12.本发明的第七方面的目的,在于提供一种产品。
13.本发明的第八方面的目的,在于提供fto和/或dact1作为靶点在开发防治骨肉瘤的药物中的应用。
14.为了实现上述目的,本发明所采取的技术方案是:
15.本发明的第一个方面,提供(1)~(3)中任一种在制备骨肉瘤诊断或预后评估的产品中的应用;
16.(1)检测fto的物质;
17.(2)检测dact1的物质;
18.(3)检测fto的物质和检测dact1的物质。
19.优选地,所述检测fto的物质为定量检测fto的物质。
20.优选地,所述检测dact1的物质为定量检测dact1的物质。
21.优选地,所述检测fto的物质为在基因水平和/或蛋白质水平上检测fto的物质。
22.优选地,所述检测dact1的物质为在基因水平和/或蛋白质水平上检测dact1的物质。
23.优选地,所述物质是用于选自下组的一种或多种检测技术或方法中的物质:免疫组织化学法(如免疫荧光分析、反向酶联免疫吸附、免疫胶体金法)、western印迹法、northern印迹法、pcr、生物芯片法。
24.优选地,所述免疫组织化学法选自:免疫荧光分析、反向酶联免疫吸附和免疫胶体金法。
25.优选地,所述检测fto的物质选自:对fto具有特异性的物质,例如其抗体(优选单克隆抗体);fto特异性的探针、基因芯片、pcr引物等。
26.优选地,所述检测dact1的物质选自:对dact1具有特异性的物质,例如其抗体(优选单克隆抗体);dact1特异性的探针、基因芯片、pcr引物等。
27.优选地,所述检测fto的物质选自:fto抗体;和/或
28.fto特异性的pcr引物,所述引物的序列如seq id no.57、seq id no.58所示。
29.优选地,所述检测dact1的物质选自:dact1抗体;和/或
30.dact1特异性的pcr引物,所述引物的序列如seq id no.59、seq id no.60所示。
31.优选地,所述产品为试剂盒。
32.优选地,所述fto的登录号为q9c0b1。
33.优选地,所述dact1的登录号为q9nyf0。
34.本发明的第二个方面,提供fto抑制剂的应用。
35.fto抑制剂在(4)~(8)中任一种中的应用;
36.(4)制备防治骨肉瘤的药物;
37.(5)制备抑制骨肉瘤细胞增殖的试剂;
38.(6)制备抑制骨肉瘤细胞迁移的试剂;
39.(7)制备抑制骨肉瘤细胞侵袭的试剂;
40.(8)制备促进骨肉瘤细胞凋亡的试剂。
41.优选地,所述骨肉瘤细胞包括u2os、u2os/mtx300、mnng/hos、143b和sjsa-1中的至少一种。
42.优选地,所述fto抑制剂为抑制fto活性的物质、降解fto的物质和降低fto表达水平的物质中的至少一种;进一步为降低fto表达水平的物质和降低fto表达水平的物质中的至少一种。
43.优选地,所述抑制fto活性的物质为恩他卡朋或其药学上可接受的盐。
44.优选地,所述降低fto表达水平的物质为(9)~(11)中至少一种:
45.(9)靶向fto的sirna、dsrna、mirna、核酶或shrna;
46.(10)编码(9)的核酸分子;
47.(11)包含(10)的表达盒、载体或转基因细胞系。
48.优选地,所述fto抑制剂为(12)~(18)中至少一种:
49.(12)恩他卡朋或其药学上可接受的盐;
50.(13)靶向fto的sirna;
51.(14)编码(13)的核酸分子;
52.(15)包含(14)的表达盒、载体或转基因细胞系;
53.(16)靶向fto的shrna;
54.(17)编码(16)的核酸分子;
55.(18)包含(17)的表达盒、载体或转基因细胞系。
56.优选地,所述sirna为反向互补的双链rna,其中的一条链的序列如seq id no.21或seq id no.22所示。
57.优选地,所述shrna为a1)或a2):
58.a1)所述shrna的正义链的序列如seq id no.67所示,所述shrna的反义链的序列如seq id no.68所示;
59.a2)所述shrna的正义链的序列如seq id no.69所示,所述shrna的反义链的序列如seq id no.70所示。
60.优选地,所述fto的登录号为q9c0b1。
61.本发明的第三个方面,提供一种rna,为sirna和/或shrna;
62.所述sirna为反向互补的双链rna,其中的一条链的序列如seq id no.21或seq id no.22所示;
63.所述shrna为a1)或a2):
64.a1)所述shrna的正义链的序列如seq id no.67所示,所述shrna的反义链的序列如seq id no.68所示;
65.a2)所述shrna的正义链的序列如seq id no.69所示,所述shrna的反义链的序列如seq id no.70所示。
66.本发明的第四个方面,提供编码本发明第三方面的rna的核酸分子。
67.本发明的第五个方面,提供包含本发明第四方面的核酸分子的表达盒、载体或转基因细胞系。
68.优选地,所述转基因细胞系不包含繁殖材料。
69.本发明的第六个方面,在于提供一种诊断产品,包括(1)~(3)中任一种:
70.(1)检测fto的物质;
71.(2)检测dact1的物质;
72.(3)检测fto的物质和检测dact1的物质。
73.优选地,所述检测fto的物质选自:fto抗体;和/或
74.fto特异性的pcr引物,所述引物的序列如seq id no.57、seq id no.58所示。
75.优选地,所述检测fto的物质选自:fto特异性的pcr引物,所述引物的序列如seq id no.57、seq id no.58所示;或
76.fto特异性的pcr引物和fto抗体,所述引物的序列如seq id no.57、seq id no.58所示。
77.优选地,所述检测dact1的物质选自:dact1抗体;和/或
78.dact1特异性的pcr引物,所述引物的序列如seq id no.59、seq id no.60所示。
79.优选地,所述检测dact1的物质选自:dact1特异性的pcr引物,所述引物的序列如seq id no.59、seq id no.60所示;或
80.dact1特异性的pcr引物和dact1抗体,所述引物的序列如seq id no.59、seq id no.60所示。
81.优选地,所述诊断产品用于骨肉瘤的诊断或预后评估。
82.优选地,所述诊断产品为试剂盒。
83.优选地,所述fto的登录号为q9c0b1。
84.优选地,所述dact1的登录号为q9nyf0。
85.本发明的第七个方面,在于提供一种产品,包括:(19)~(22)中的至少一种:
86.(19)本发明第三个方面的rna;
87.(20)本发明第四个方面的核酸分子;
88.(21)本发明第五个方面的表达盒、载体或转基因细胞系;
89.(22)恩他卡朋或其药学上可接受的盐。
90.优选地,所述产品包括:(19)~(21)中的至少一种;或
91.(22)以及(19)~(21)中的至少一种。
92.优选地,所述产品具有(23)~(27)中至少一种功能:
93.(23)防治骨肉瘤;
94.(24)抑制骨肉瘤细胞增殖;
95.(25)抑制骨肉瘤细胞迁移;
96.(26)抑制骨肉瘤细胞侵袭;
97.(27)促进骨肉瘤细胞凋亡。
98.优选地,所述骨肉瘤细胞包括u2os、u2os/mtx300、mnng/hos、143b和sjsa-1中的至少一种。
99.本发明的第八个方面,在于提供fto和/或dact1作为靶点在开发防治骨肉瘤的药物中的应用。
100.优选地,所述fto的登录号为q9c0b1。
101.优选地,所述dact1的登录号为q9nyf0。
102.本发明的有益效果是:
103.本发明首次公开了fto和/或dact1在骨肉瘤诊断或预后评估中的应用,通过fto和/或dact1与总生存率、无肺转移生存曲线图以及fto和/或dact1的5年生存率roc曲线图
可知:dact1和/或fto可作为骨肉瘤诊断或预后评估的标志物。
104.本发明首次公开了fto抑制剂在防治骨肉瘤中的应用,通过fto抑制剂靶向下调fto(抑制fto表达)、降解fto、抑制fto活性,可以抑制影响骨肉瘤细胞的增殖、转移和侵袭能力,并且促进其凋亡,最终改善或治疗骨肉瘤。
105.本发明还提供了靶向fto的rna、编码rna的核酸分子、包含该核酸分子的表达盒、载体或转基因细胞系,其通过靶向下调fto(抑制fto表达)、降解fto、抑制fto活性,可以抑制影响骨肉瘤细胞的增殖、转移和侵袭能力,并且促进其凋亡,最终改善或治疗骨肉瘤。
附图说明
106.图1是不同m6a相关调节因子对骨肉瘤细胞增殖影响的结果图:其中,a为不同m6a相关调节因子对骨肉瘤细胞增殖影响的直观图;b为不同m6a相关调节因子对骨肉瘤细胞增殖影响的散点图。
107.图2是骨肉瘤组织/细胞中fto表达量的结果图:其中,a为骨肉瘤组织中ftomrna水平的结果图;b为骨肉瘤组织中fto蛋白水平的结果图;c为骨肉瘤细胞中fto蛋白水平的结果图。
108.图3是fto与总生存率、无肺转移生存的曲线图:其中,a是fto与总生存率(n_fto high=38,n_fto low=32)的曲线图;b是fto与无肺转移生存(n_fto high=32,n_fto low=30)的曲线图。
109.图4是fto作为靶标治疗骨肉瘤的体外实验结果图:其中,a是敲低fto对m6a甲基化水平的影响图;b是敲低fto对fto蛋白表达水平的影响图;c是敲低fto对骨肉瘤细胞增殖的影响图;d是敲低fto对骨肉瘤细胞克隆形成的影响图;e是敲低fto对骨肉瘤细胞凋亡的影响图;f是敲低fto对骨肉瘤细胞的迁移和侵袭能力的影响图;g是过表达fto和fto-dm对m6a甲基化水平的影响图;h是过表达fto和fto-dm对fto蛋白表达水平的影响图;i是过表达fto和fto-dm对骨肉瘤细胞增殖的影响图;j是过表达fto和fto-dm对骨肉瘤细胞克隆形成的影响图;k是fto和fto-dm对骨肉瘤细胞的迁移和侵袭能力的影响图。
110.图5是fto作为靶标治疗骨肉瘤的体内实验结果图:其中,a是敲低fto对肿瘤体积的影响图;b是敲低fto对肿瘤重量的影响图;c是敲低fto对肺结节数量的影响的统计结果图;d是过表达fto和fto-dm对肿瘤体积的影响图;e是过表达fto和fto-dm对肿瘤重量的影响图;f是过表达fto和fto-dm对肺结节数量的影响的统计结果图;g是敲低fto对肺结节数量的影响的直观图;h是过表达fto和fto-dm对肺结节数量的影响的直观图。
111.图6是merip-seq联合rna-seq寻找fto潜在下游靶标的结果图:其中,a是敲低fto对不同区域的m6a比例的影响的饼状图;b是敲低fto对不同区域的m6a比例的影响的曲线图;c是对照细胞和fto敲低细胞共同富集的最丰富的motif的结果图;d是merip-seq中发现的差异基因的结果图;e是merip-seq中发现的差异基因的go分析图;f是rna-seq发现敲低fto的143b细胞中差异基因的go分析图;g是rna-seq发现过表达fto的mnng/hos细胞中差异基因的go分析图;h是merip-seq联合rna-seq发现的15个fto下游的候选基因的结果图;i是fto对dact1mrna水平的影响图;j是fto对dact1蛋白水平的影响图;k是fto对dact1的甲基化水平的影响图。
112.图7是fto对dact1 mrna稳定性的影响图:其中,a是敲低fto对dact1的cds区中m6a
的影响图;b是双荧光素酶报告基因载体及其突变体的示意图;c是fto对dact1的影响图;d是fto对dact1 mrna稳定性的影响的结果图。
113.图8是fto以igf2bp1依赖的方式调控dact1表达量的结果图:其中,a是rna干扰不同阅读蛋白后对dact1 mrna水平的影响图;b是敲低igf2bp1后对fto对dact1的调控的影响图;c是rip-qpcr结果图。
114.图9是fto通过dact1/wnt-βcatenin信号通路促进骨肉瘤的发生和发展的体外实验结果图:其中,a是western blot验证dact1过表达效率的结果图;b是过表达dact1对骨肉瘤细胞增殖的影响图;c是过表达dact1对骨肉瘤细胞的迁移和侵袭能力的影响图;d是过表达dact1对wnt信号通路分子的蛋白水平的影响图;e是敲低fto和dact1对骨肉瘤细胞143b增殖的影响图;f是敲低fto和dact1对骨肉瘤细胞mnng/hos增殖的影响图;g是敲低fto和dact1对骨肉瘤细胞143b的迁移和侵袭能力的影响图;h是敲低fto和dact1对骨肉瘤细胞mnng/hos的迁移和侵袭能力的影响图;i是过表达fto和dact1对wnt信号通路分子的蛋白水平的影响图。
115.图10是fto通过dact1/wnt-βcatenin信号通路促进骨肉瘤的发生和发展的体内实验结果图:其中,a是敲低fto和dact1对肿瘤体积的影响图;b是敲低fto和dact1对肿瘤大小的影响的直观图;c是敲低fto和dact1对肿瘤重量的影响图;d是敲低fto和dact1对肺转移结节的数量影响的直观图;e是敲低fto和dact1对肺转移结节的数量影响的统计结果图。
116.图11是骨肉瘤组织中fto与dact1表达量关系的结果图:其中,a是rt-qpcr检测骨肉瘤组织中fto与dact1的mrna的相关关系图;b是免疫组化染色检测骨肉瘤组织中fto与dact1的蛋白量的相关关系图。
117.图12是dact1与总生存率、无肺转移生存的曲线图:其中,a是dact1与总生存率(n dact1 high=29,n dact1 low=41)的曲线图;b是dact1与无肺转移生存(n dact1 high=28,n dact1 low=34)的曲线图。
118.图13是dact1及fto与总生存率、无肺转移生存的曲线图:其中,a是dact1及fto与总生存率(n_fto high-dact1 low=29,n fto low-dact high=20)的曲线图;b是dact1及fto与无肺转移生存(n_fto high-dact1 low=24,n fto low-dact1 high=20)的曲线图。
119.图14是fto、dact1及其组合的5年生存率roc曲线图。
120.图15是恩他卡朋对骨肉瘤影响的体外实验结果图:其中,a是恩他卡朋对骨肉瘤细胞存活率的影响图;b是恩他卡朋对骨肉瘤细胞中fto、dact1、ctnnb1及c-jun蛋白含量的影响图;c是恩他卡朋对骨肉瘤细胞中m6a水平的影响图;d是恩他卡朋对骨肉瘤细胞增殖速度的影响图;e是恩他卡朋对骨肉瘤细胞迁移和侵袭能力的影响图;f是恩他卡朋对骨肉瘤细胞克隆形成能力的影响图。
121.图16是恩他卡朋对骨肉瘤影响的体内实验结果图:其中,a是恩他卡朋对肿瘤体积的影响图;b是恩他卡朋对肿瘤大小影响的直观图;c是恩他卡朋对肿瘤重量的影响图;d是恩他卡朋对肺转移结节数量影响的直观图;e是恩他卡朋对肺转移结节数量影响的统计结果图;f是恩他卡朋对体重的影响图。
具体实施方式
122.以下通过具体的实施例对本发明的内容作进一步详细的说明。
123.本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
124.本实施例中采用的方法具体如下:
125.1.细胞培养:
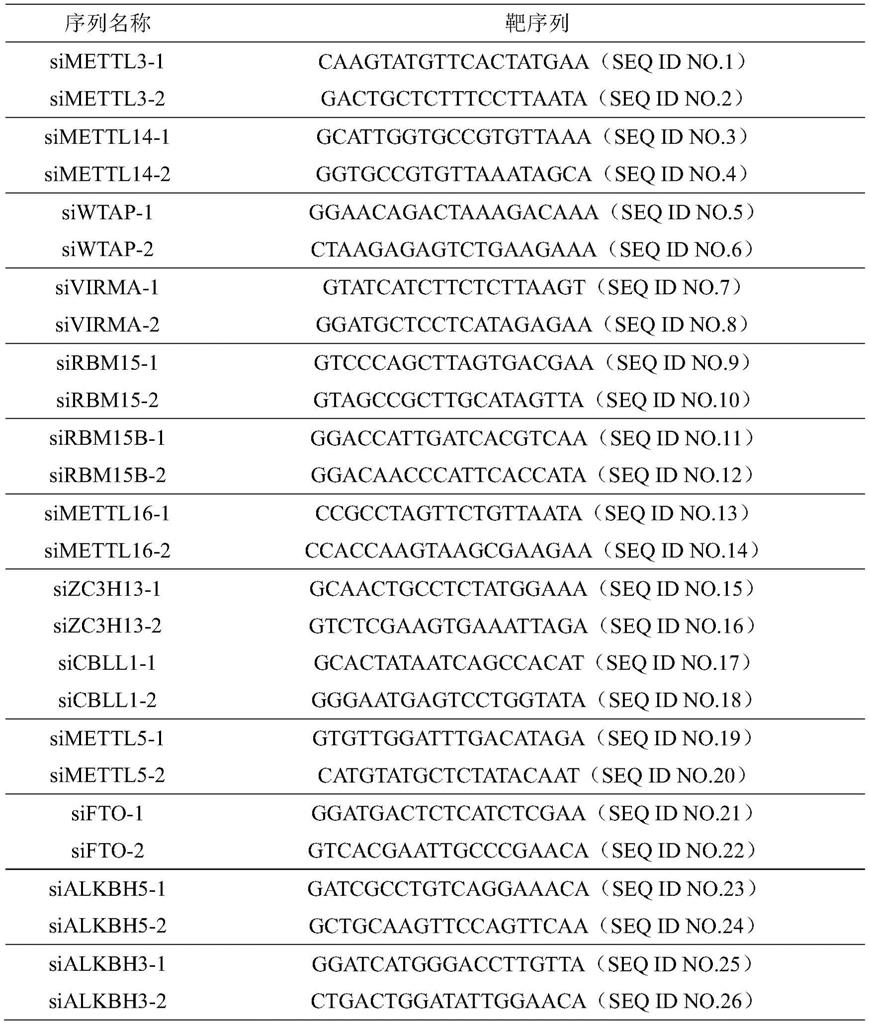
126.本实施例中所用细胞系:hfob1.19、u2os、u2os/mtx300、mnng/hos、143b、sjsa-1、hek293t,均来源于中山大学附属第一医院,为常用市售细胞系。所有细胞系均进行短串联重复序(str)鉴定,经检测无支原体污染。上述细胞用含有10%胎牛血清(thermo fisher scientific,usa)和1%青霉素/链霉素(碧云天,中国)的dmem培养基(thermo fisher scientific,usa)培养,置于37℃、5%co2培养箱中,在细胞增殖至80%~90%密度时进行细胞传代。首先吸去10cm2培养皿中旧培养基,在培养皿中加入3ml无菌pbs洗一遍细胞,吸除pbs后加入1ml胰酶(thermo fisher scientific,usa),晃动培养皿使胰酶铺匀,然后置于培养箱中消化1分钟,显微镜下观察细胞回缩变圆后,轻轻拍打培养皿,加入2ml含血清培养基终止消化。随后用移液枪吹散细胞,形成细胞悬液,收集悬液后1000r/min离心3.5min,去除上清,加入含血清培养基,吹匀后接种至新皿。
127.2.敲低及过表达载体的构建
128.1)从sigma网站获取fto、dact1、igf2bp1的shrna序列,靶向fto的shrna的正义链序列如seq id no.67所示,反义链序列如seq id no.68所示,或正义链序列如seq id no.69所示,反义链序列如seq id no.70所示;靶向dact1的shrna的正义链序列如seq id no.71所示,反义链序列如seq id no.72所示,或正义链序列如seq id no.73所示,反义链序列如seq id no.74所示;靶向igf2bp1的shrna的正义链序列如seq id no.75所示,反义链序列如seq id no.76所示,或正义链序列如seq id no.77所示,反义链序列如seq id no.78所示;通过退火连接到plko.1-puro载体上(插入位点为ecori以及bshti),构建plko.1-fto-puro、plko.1-dact1-puro和plko.1-igf2bp1-puro敲低质粒。
129.2)从ncbi网站上获取fto、dact1的cds区域序列,fto的cds区域序列如seq id no.79所示,dact1的cds区域序列如seq id no.80所示,根据序列设计带同源臂引物,通过分子克隆将cds区域序列克隆连接到psin-ef2-puro慢病毒载体上(购于addgene,插入位点为bstb1、nhe1),构建成psin-fto-puro和psin-dact1-puro过表达质粒。
130.3.病毒包装及收集、病毒感染、构建稳定株
131.1)配置慢病毒包装质粒混合液,准备两管混合液,管1:3μg目的质粒+2μg pspax2+1μg pmd2.g+100μl opti-mem;管2:10μl lipofectamine 2000+100μl opti-mem。两管分别静置5min,后将两管混匀静置20min。将混合液加入70%~80%细胞密度hek293t细胞的六孔板培养液中,避免细胞吹起,轻轻摇匀。置于培养箱中6~8小时后换液,继续培养48小时后,用0.45μm millipore针头滤器过滤收集上清至新离心管中,直接使用或者分装保存于-80℃。
132.2)将需要感染的骨肉瘤细胞消化,在6孔板中每孔加入2x105个细胞。每孔再加入1ml病毒液、1ml dmem培养基以及2μl1000
×
聚凝胺,摇匀。置于培养箱中,培养24小时后换含有嘌呤霉素的dmem培养基,传代筛选3~5日,等到细胞状态稳定,不再有较多细胞死亡,贴壁生长的细胞即为成功构建的稳定株。
133.4.rna干扰
134.1)配置混合液:将50nm sirna(序列相关信息如表1所示)与5μl lipofectamine rnai max transfection reagent(invitrogen)混匀后,加入100μl opti-mem,静置20min;
135.2)将混合液加入铺了细胞的孔板中,轻轻摇匀,置于培养箱中,6~8小时后换液,继续培养。
136.表1 sirna序列相关信息
137.[0138][0139]
5.细胞rna提取
[0140]
1)吸干净细胞培养皿中的培养基,加入1ml trizol裂解液;
[0141]
2)将上述裂解液吸入1.5ml ep管中,避光,按5:1比例加入氯仿,混匀后静置2min,室温;
[0142]
3)4℃下12000x g离心15min,小心吸取上层液体400μl,并加入500μl异丙醇,混匀后静置10min,室温;
[0143]
4)4℃下12000x g离心10min,弃上清,加入500μl70%乙醇洗涤;
[0144]
5)4℃下12000x g离心5min,弃上清,得到白色沉淀,自然风干;
[0145]
6)加入适量depc水(一般30μl),轻轻把沉淀吹匀,得到rna溶液,测浓度,直接使用或-80℃保存。
[0146]
6.逆转录聚合酶链式反应(rt-pcr)
[0147]
使用诺唯赞公司的hiscript 1st strand cdna synthesis kit试剂盒(r111)
[0148]
1)rna模板的变性
[0149]
使用rnase-free离心管配置以下混合液:5
×
buffer mixture 4μl,oligo(dt)23vn(50μmol/l)1μl,模板rna 1μl,rnase free h2o至12μl;混匀后65℃,5min,置于冰上,静置2min。
[0150]
2)去除基因组dna
[0151]
步骤1)的混合液12μl,4
×
gdna wiper mix 4μl,混合。
[0152]
3)配置合成反应混合液
[0153]
步骤2)的混合液16μl,10x rt mix 2μl,hiscriptⅱenzyme mix 2μl。
[0154]
混匀后,放进pcr仪器:25℃5min,50℃45min,85℃2min,4℃∞。
[0155]
7.实时荧光定量聚合酶链式反应(rt-qpcr)
[0156]
使用诺唯赞公司的实时荧光定量pcr试剂盒(q321),反应体系共10μl,如下所示:cdna 4μl,2
×
sybr mixture 5μl,forward primer(20μm)0.5μl,reverse primer(20μm)0.5μl;引物序列信息如表2所示;混匀后置于roche light cycler 480仪器中进行扩增检测,条件如下:98℃预热5min;98℃(变性)10s,60℃(退火)10s,72℃(延伸)20s,变形、退火和延伸这一过程共40个循环;溶解曲线:60℃~95℃,5s。
[0157]
表2 rt-qpcr相关引物序列信息
[0158][0159]
8.细胞总蛋白的提取
[0160]
1)按照ripa裂解液:蛋白酶抑制剂:磷酸酶抑制剂=100:1:1的比例配置裂解混合液,全程在冰上操作;
[0161]
2)从培养箱中取出细胞,吸除细胞培养液,用预冷的pbs洗3次,吸尽pbs;
[0162]
3)往细胞中加入裂解液,尽量铺匀,冰上静置30min,充分裂解;
[0163]
4)用细胞刮刀把细胞以及裂解液刮下,收集于1.5ml ep管中,冰上操作;
[0164]
5)高速冷冻离心机4℃,12000
×
g 20min;
[0165]
6)离心后,吸取裂解液上清,用bradford法测定蛋白浓度,并将样品浓度调成一致;
[0166]
7)往ep管中加入适量5
×
loading buffer,混匀后100℃变性10min;
[0167]
8)直接用于western blot检测或者-20℃保存。
[0168]
9.蛋白免疫印迹法(western blotting)
[0169]
1)将配好的蛋白凝胶置于垂直电泳槽,往相应泳道中加入10μl蛋白样品和蛋白分子量指示蛋白(marker);
[0170]
2)恒压80v跑胶至蛋白跑出浓缩胶,调整电压至120v,直到蛋白即将跑出分离胶时结束电泳;
[0171]
3)按照电转“三明治”顺序及黑色板(负极)-海绵-滤纸-凝胶-活化的pvdf膜-滤纸-海绵-白色板(正极),在4℃冷库恒流350ma转膜1小时;
[0172]
4)把pvdf膜浸泡于含有5%脱脂奶粉的pbst中,置于低速摇床上封闭1小时,室温;
[0173]
5)按一定比例稀释一抗(按照抗体说明书推荐比例稀释一抗),将pvdf膜置于一抗中孵育,4℃过夜,抗体相关信息如表3所示;
[0174]
6)pbst洗膜3次,置于摇床上,每次10min;
[0175]
7)将洗去多余一抗的pvdf膜置于偶联hrp二抗中,置于低速摇床上室温孵育1小时,注意使用相应种属的二抗;
[0176]
8)配置显影液,曝光显影。
[0177]
表3 所用抗体相关信息
[0178][0179]
10.细胞增殖实验
[0180]
1)消化细胞,离心重悬,计数;
[0181]
2)96孔板中铺板,每组6个复孔,加入含1500个悬浮细胞的培养液200μl;
[0182]
3)24小时后每孔加进20μl 5mg/ml的mtt溶液,置入37℃培养箱4小时,避光操作;
[0183]
4)吸除培养基,每孔加进100μl dmso,摇床摇匀10min,避光操作;
[0184]
5)酶标仪选择波长a492 nm读取每孔吸光值;
[0185]
6)在连续4天相同时间点重复上述操作,根据吸光值绘制增殖曲线。
[0186]
11.细胞凋亡实验
[0187]
使用凯基生物公司的annexin v-fitc/pi凋亡双染试剂盒(kga108),具体步骤如下:
[0188]
1)培养箱中取出细胞培养板,收集培养液,用pbs洗2次细胞,加入无edta胰酶消化;
[0189]
2)用收集的培养液终止消化,1000rpm/min离心3min,用pbs洗2次细胞,去除上清;
[0190]
3)加入500μl binding buffer后混匀;
[0191]
4)避光加入5μl annexin v-fitc后混匀;
[0192]
5)避光加入5μl propidium iodide后混匀;
[0193]
6)避光,室温反应5~15min,在1小时内尽快使用流式细胞仪检测。
[0194]
12.克隆形成实验
[0195]
1)消化细胞,离心重悬后计数;
[0196]
2)6孔板铺板,每组3个复孔,每孔加入含500个细胞的dmem培养液2ml,摇匀,置于培养箱培养;
[0197]
3)每3天更换1次培养液;
[0198]
4)根据细胞生长速度,若干天后吸除培养基,pbs清洗1次,加入1ml 4%多聚甲醛固定30min;
[0199]
5)吸去多聚甲醛,加入1%的甲紫溶液染色30min,pbs清洗1次,晾干;
[0200]
6)拍照并计算含50个细胞以上的克隆数量。
[0201]
13.细胞迁移和侵袭实验
[0202]
细胞迁移实验:
[0203]
1)细胞消化,离心重悬;
[0204]
2)用无菌pbs清洗细胞2次,动作轻柔,用无血清dmem培养基重悬并计数;
[0205]
3)往transwell下室加入600μl含10%血清的培养基,上室加入120μl含5x104个细胞的无血清培养基悬液,放进37℃培养箱;
[0206]
4)根据不同细胞的特性培养不同时长后取出,用棉签擦去上室细胞,力度要适中,过轻擦不净细胞,过重会损坏小室的膜;
[0207]
5)4%多聚甲醛固定小室30min;
[0208]
6)1%甲紫溶液染色小室30min,晾干;
[0209]
7)镜下拍照并计数。
[0210]
细胞侵袭实验需要将matrigel基质胶铺在上层小室,准备操作如下:
[0211]
1)将基质胶与无血清培养基1:8混合均匀,冰上操作;
[0212]
2)往transwell上室加入50μl稀释后的基质胶,均匀铺开,避免气泡,置于4℃;
[0213]
3)实验前将铺了基质胶的小室置于37℃培养箱中静置2小时,使其凝固;
[0214]
4)加入200μl无血清培养基,37℃水化30min;
[0215]
5)吸去培养基,后续实验步骤与迁移实验一致。
[0216]
14.动物实验(骨肉瘤胫骨原位模型)
[0217]
1)选择5周龄的balb/c-nu雄性裸鼠,随机分组,每组6只;
[0218]
2)分别将8x105个骨肉瘤细胞注射进裸鼠的胫骨近端;
[0219]
3)每3天量取肿瘤大小和称量小鼠体重,并作好记录;
[0220]
4)若需进行灌胃处理,先提前制备符合工作浓度的药物溶液,每天1次灌胃操作,每次250μl,于每天同一时段进行;
[0221]
5)4周后将小鼠安乐死,并切取小鼠肿瘤及肺组织,于福尔马林溶液中固定;
[0222]
6)将小鼠肿瘤组织和肺组织作包埋、he染色。
[0223]
15.临床组织样品蛋白提取
[0224]
从中山大学附属第一医院收集骨肉瘤临床组织标本,组织蛋白提取过程:
[0225]
1)从-80℃冰箱取出标本,冰上解冻;
[0226]
2)往强ripa裂解液中按照1:100加入蛋白酶和磷酸酶抑制剂;
[0227]
3)切取米粒大小组织置于1.5ml ep管中,加入150μlripa裂解液,用眼科剪反复剪碎组织,冰上裂解30min;
[0228]
4)4℃12000x g离心30min;
[0229]
5)收集上清,测定蛋白浓度并配平,加入5x loading buffer溶液,100℃蛋白变性10min;
[0230]
6)直接用于western blot或者-80℃保存。
[0231]
16.免疫组织化学(immunohistochemistry,ihc)
[0232]
1)将切片置于60℃烤箱,烤片1~2小时。
[0233]
2)石蜡切片脱蜡至水:将切片依次放入二甲苯ⅰ15min-二甲苯ⅱ15min-二甲苯iii 15min-无水乙醇ⅰ5min-无水乙醇ⅱ5min-85%酒精5min-75%酒精5min-蒸馏水清洗。
[0234]
3)抗原修复:组织切片置于盛满edta抗原修复液的修复盒中,于微波炉内进行抗原修复,中火8min至沸,停火8min保温再转中低火7min,此过程切勿干片。自然冷却后将玻片置于pbs(ph7.4)中在摇床上洗涤3次,每次5min。
[0235]
4)阻断内源性过氧化物酶:切片放进3%双氧水溶液,室温避光孵育25min,将玻片置于pbs(ph7.4)中在摇床上洗涤3次,每次5min。
[0236]
5)血清封闭:使用粗头免疫组化笔将切片组织圈出,在组化圈内滴加3%bsa铺匀组织,室温封闭30min。
[0237]
6)加一抗:轻轻甩掉封闭液,在切片上滴加一抗,切片平放于湿盒内4℃孵育过夜。
[0238]
7)加二抗:玻片置于pbs(ph7.4)中在摇床上洗涤3次,每次5min。切片稍甩干后在圈内滴加与一抗相应种属的二抗(hrp标记)覆盖组织,室温孵育60min。
[0239]
8)dab显色:玻片置于pbs(ph7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加新鲜配制的dab显色液,控制显色时间,阳性为棕黄色,蒸馏水终止显色。
[0240]
9)复染细胞核:苏木素复染1~3min,蒸馏水终止显色。
[0241]
10)脱水:将切片依次放入75%酒精5min-85%酒精5min
‑‑
无水乙醇ⅰ5min-无水乙醇ⅱ5min-二甲苯ⅰ5min中脱水透明,将切片从二甲苯拿出来晾干。
[0242]
11)使用中性树胶封片,显微镜镜检,图像采集分析。
[0243]
17.rna m6a dot blot实验
[0244]
1)取2μl 250ng/μl的mrna点在铺平的尼龙膜上(ge healthcare),两点之间相隔1cm,注意使用rna-free枪头,滴加时动作轻柔;
[0245]
2)将尼龙膜在254nm紫外光下进行2次交联,pbst清洗1遍,置于中速摇床上3min,以洗去未交联的rna;
[0246]
3)5%的脱脂牛奶室温封闭1小时,置于低速摇床;
[0247]
4)将尼龙膜置于m6a抗体(abe572,1:1000,merck millipore)中,4℃孵育过夜;
[0248]
5)去除一抗,pbst洗涤3次,每次10min;
[0249]
6)将pvdf膜置于相同种属的二抗中,室温摇床孵育1小时;
[0250]
7)pbst洗涤3次,每次10min,曝光显影;
[0251]
8)将同样量的mrna点在尼龙膜上,随后置于0.02%亚甲基蓝中染色2小时,拍照。
[0252]
18.m6a-rna免疫沉淀试验及rna m6a测序
[0253]
1)使用琼脂糖凝胶电泳和nanodrop
tm
分光光度计检测rna的完整性和质量;
[0254]
2)使用arraystar seq-star
tm
poly(a)mrna isolation kit提取完整mrna;
[0255]
3)使用化学的方法将分离得到的mrna打断成100nt左右的片段,用琼脂糖凝胶电泳检测打断效果;
[0256]
4)将m6a抗体和每个样品的一部分mrna进行免疫沉淀反应(剩下的部分mrna作为input对照)。主要包括免疫沉淀反应、清洗和洗脱。将洗脱后得到的m6a mrna和input mrna分别进行富集,构建rna测序文库;
[0257]
5)使用kapa stranded mrna-seq kit(illumina)构建m6a和input mrna构建rna测序文库,最后利用agilent 2100bioanalyzer对得到的文库质量进行检测;
[0258]
6)将文库浓度稀释到8pm,并用hiseq 3000/4000pe cluster kit(#pe-410-1001,illumina)在illumina cbot生成cluster。最后用illumina hiseq 4000进行测序(hiseq 3000/4000sbs kit);
[0259]
7)对测序得到的数据进行生物信息统计分析。
[0260]
19.rna测序
[0261]
提取的总rna样品经琼脂糖电泳和nanodrop质检和定量后,用oligo(dt)磁珠富集mrna;随后进行rna测序文库的构建,包括rna片段化后用随机引物反转生成第一链cdna,加入dutp合成第二链cdna,双链cdna末端修复加a后连接illumina匹配接头,pcr扩增得到最终文库;构建好的文库用agilent 2100进行质检,由qpcr方法进行文库定量,使用illumina hiseq 4000测序仪进行测序。
[0262]
20.merip-qpcr analysis
[0263]
1)提取总rna,用oligodt磁珠富集带polya尾的mrna;
[0264]
2)将a/g免疫磁珠以及m6a抗体预混,制备免疫磁珠抗体预混液;
[0265]
3)将预混好的免疫磁珠m6a抗体加入mrna中,用磁力架对m6a免疫磁珠进行富集;
[0266]
4)用蛋白酶对rna-抗体复合物进行消化,m6a抗体被消化后只剩rna;
[0267]
5)进行常规qpcr步骤。
[0268]
21.rna免疫沉淀实验(rip)
[0269]
使用magna rip试剂盒(millipore,germany),具体步骤如下:
[0270]
1)按照说明书推荐比例制备完全rip裂解缓冲液,裂解细胞;
[0271]
2)将磁珠与5μg的fto、igf2bp1和igg抗体混合孵育;
[0272]
3)把磁珠加入细胞裂解液中(每份样品中大概含2x107个细胞);
[0273]
4)蛋白酶k处理后,从免疫沉淀复合物中洗脱出目的rna,并进一步纯化用于qpcr;
[0274]
5)计算公式为%input=1/10
×2ct[ip]
–
ct[input]
。
[0275]
22.mrna稳定性实验
[0276]
往细胞培养液中加入5μg/ml放线菌素d(mce,usa),于0、3、6小时不同时间点收集
细胞,提取细胞rna并进行逆转录检测。
[0277]
23.荧光素酶报告基因实验
[0278]
双荧光素酶载体pmiglo从中山大学肿瘤防治中心获得,为常用市售载体。通过聚合酶链式反应获得dact1 cds区域目的序列,并插入到pmiglo载体上(nhei和xbai位点之间)。通过merip-seq测序分析,定位dact1 cds区域上的m6a位点,通过定位突变pcr把a变成t,构建dact1突变型报告基因质粒,并转染稳定株细胞。
[0279]
luciferase活性测定:
[0280]
1)配制lar ii,即firefly luciferase的底物:将lar ii溶解在lar ii buffer中,并分装-80℃避光保存;
[0281]
2)配制stop&glo,即renilla luciferase的底物,该溶液能够终止lar ii的反应;
[0282]
3)加入1x plb,室温下裂解细胞15min;
[0283]
4)测定混合液荧光值:向40ul lar ii中加入20ul细胞裂解液,轻轻吹打混匀后(尽量避免产生气泡),检测读数,即firefly luciferase的值;加入40ul stop&glo后,再次检测读数,即renilla luciferase的值;
[0284]
5)对采集到的数据进行处理。
[0285]
24.统计分析
[0286]
使用graphpad prism 8.0和spss 25.0进行统计分析及绘图。每组实验独立重复三次。数据用均数
±
标准差描述。定量数据采用双尾学生t检验比较,定性数据采用卡方检验进行分析。用卡普兰-迈耶法和对数秩检验分析总体生存率和无疾病进展生存率。在lmfs分析中,诊断时伴有肺转移的患者被删失。单变量和多变量cox回归模型用于研究独立的预后因素。此外,用线性回归对基因表达进行相关分析。每个实验结果的p值标注于图表中。
[0287]
实施例1 fto作为骨肉瘤的诊断和/或预后标志物
[0288]
为了明确m6a相关调节因子在骨肉瘤中的功能作用,先构建稳定表达gfp的143b骨肉瘤细胞,通过rna干扰技术在gfp+143b细胞中对目前已知的28个m6a相关调节因子(如表1所示)进行rna干扰,通过高内涵成像系统检测gfp的荧光值,发现干扰一系列m6a相关调节因子对骨肉瘤细胞的增殖能力能产生一定影响,说明m6a甲基化修饰在骨肉瘤细胞中发挥重要的表观调控作用。其中,干扰fto后对骨肉瘤细胞的增殖能力影响最显著(图1)。
[0289]
通过rt-qpcr和western blot检测发现,与癌旁组织相比,fto在骨肉瘤组织中的mrna水平及蛋白表达量明显上调(图2中a、b)。此外,与正常成骨细胞hfob1.19相比,骨肉瘤细胞如u2os/mtx300、143b及sjsa-1等中fto的蛋白表达量显著上调(图2中c)。综合上述研究结果,说明fto在骨肉瘤的发生发展中起到重要的作用,可以作为骨肉瘤诊断的标志物。
[0290]
通过对70例石蜡包埋的骨肉瘤(os)组织进行fto免疫组化染色,分析fto与总生存率、无肺转移生存的关系,结果如图3所示:fto的高表达与骨肉瘤的不良预后密切相关,fto能够成为预测骨肉瘤预后的独立预测因素。
[0291]
实施例2 fto作为靶标在治疗骨肉瘤中的应用
[0292]
为了进一步明确fto在骨肉瘤中的功能作用,设计针对fto基因的small hairpin rna(shrna),在骨肉瘤高转移细胞株143b和sjsa-1两个细胞系中构建稳定敲低fto的细胞株,dot blot实验检测显示mrna m6a甲基化水平显著提高,western blot检测细胞株内fto的蛋白水平明显下调(图4中a、b)。进一步在细胞功能实验中,观察到敲低fto的143b和
sjsa-1细胞增殖速度显著放缓,细胞克隆形成能力减弱,伴随细胞的凋亡增加(图4中c、d、e)。在细胞侵袭和迁移实验中观察到敲低fto后细胞的迁移和侵袭能力降低(图4中f)。随后,在与143b细胞同源的低转移骨肉瘤细胞系mnng/hos中过表达fto以及去甲基化酶失活双重突变型(fto-dm),dot blot实验检测过表达fto后细胞mrna m6a甲基化水平明显降低,western blot验证其过表达效率(图4中g、h)。观察到fto过表达细胞增殖速度加快,克隆形成能力增强,伴随细胞迁移和侵袭能力的提高;而过表达fto-dm则与对照组无显著差异(图4中i、j、k)。上述结果表明fto介导的m6a去甲基化修饰在骨肉瘤中扮演重要的促癌生物学角色。
[0293]
进一步通过裸鼠胫骨原位模型来探索动物体内fto对骨肉瘤的作用。将骨肉瘤细胞143b和mnng/hos注射进裸鼠胫骨原位后,每三天测量一次肿瘤体积,待肿瘤到一定大小后处死小鼠,取出瘤子并称重。敲低fto后原位肿瘤的生长速度明显减缓(图5中a),肿瘤重量减轻(图5中b),同时肺转移结节数也显著减少(图5中c、g);过表达fto后肿瘤的生长速度加快(图5中d),肿瘤重量增加(图5中e),同时肺转移结节数也增加(图5中f、h),而过表达fto-dm无明显差异。上述结果说明m6a去甲基化酶fto对骨肉瘤的体内生长及转移起到重要的调控作用,可以通过敲低fto抑制骨肉瘤的增殖、迁移与侵袭能力从而达到治疗骨肉瘤的效果。
[0294]
恩他卡朋最初被fda批准作为辅助用药,与左旋多巴和卡比多巴联用于治疗帕金森病。最近基于结构的虚拟筛选研究发现,恩他卡朋能直接结合fto并在体外抑制fto的活性。为了进一步探索恩他卡朋是否有治疗骨肉瘤的应用前景,先通过体外实验探索恩他卡朋对骨肉瘤的功能作用。先检测了恩他卡朋在骨肉瘤细胞中的ic50,结果表明,恩他卡朋在143b和sjsa-1细胞中的ic50分别为48.26μm及42.35μm(图15中a)。通过western blot检测发现恩他卡朋能呈剂量依赖性降低fto蛋白水平,上调dact1,及下调ctnnb1及c-jun,并且上调细胞中m6a水平(图15中b、c)。进一步发现恩他卡朋能呈剂量依赖性减缓骨肉瘤细胞143b和sjsa-1的生长速度、减弱其克隆形成能力以及迁移和侵袭能力(图15中d、e、f)。
[0295]
随后,构建裸鼠胫骨原位骨肉瘤模型,待肿瘤长到肉眼可见后,每天一次恩他卡朋药物灌胃处理,每三天量取肿瘤体积并称量小鼠体重。待瘤长到一定大小后处死小鼠,量取肿瘤重量。结果表明,恩他卡朋呈剂量依赖性减缓肿瘤生长速度(图16中a),肿瘤体积、重量明显减小(图16中b、c),肺转移结节也显著减少(图16中d、e),而各组间小鼠体重无明显差异(图16中f)。
[0296]
综上所述,fto抑制剂(抑制fto活性的物质、降解fto的物质和降低fto表达水平的物质例如:靶向fto的sirna、shrna)可以抑制骨肉瘤的增殖、迁移与侵袭能力从而达到治疗骨肉瘤的效果。
[0297]
实施例3 merip-seq联合rna-seq寻找fto的潜在下游靶标
[0298]
为了进一步探索在骨肉瘤中fto的潜在下游靶标,先通过m6a rna甲基化免疫沉淀测序(m6a methylated rna ip sequencing,merip-seq)对143b的fto敲低及对照细胞进行检测及生物信息学分析,发现敲低了fto后mrna上非翻译区域的m6a比例上调,蛋白质编码区上的m6a比例下调(图6中a),m6a总体水平上升,主要位于cds区、5’utr区以及终止密码子附近(图6中b)。对照细胞和fto敲低细胞共同富集的motif中最丰富的为swgga(s=c或g,w=a或u),p值分别为1.7e-7和6.0e-10(图6中c)。其中,变化倍数超过1.5倍的上调的m6a峰
有7434个,下调的m6a峰有5868个(图6中d)。由于fto为m6a去甲基化酶,重点关注敲低fto后上调的m6a峰。这些上调的m6a峰一共定位在3033个基因上,通过kegg分析发现,受fto表观调控的基因主要集中在wnt信号通路、hippo信号通路、细胞内吞、胰岛素信号通路、细胞间粘附和细胞凋亡相关通路等(图6中e)。随后,通过rna-seq检测敲低fto的143b细胞和过表达fto的mnng/hos细胞的基因表达谱变化。在143b细胞中共发现429个差异基因(deg),其中上调的基因有255个,下调的基因有174个,go分析发现这些差异基因与wnt信号通路、血管生成、细胞外基质重塑等密切相关(图6中f)。在mnng/hos细胞中共发现430个差异基因,其中上调的基因有212个,下调的基因有218个。go分析发现这些差异基因与dna重排、转录调控等密切相关(图6中g)。
[0299]
把merip-seq和rna-seq数据进行交集,共发现了15个fto潜在的下游靶基因,包括dact1、ndst1、tbrg1、cyb561d1及zfand3等(图6中h)。进一步通过rt-qpcr在敲低fto的143b细胞和过表达fto及fto-dm的mnng/hos细胞中对这些基因进行初步验证,发现敲低了fto后,dact1的mrna水平显著上调,过表达后则产生相反效应,而过表达fto-dm则无明显差异(图6中i)。随后western blot检测其蛋白含量也得到了一致的结果(图6中j)。接着,通过merip-qpcr实验对潜在的m6a位点进行验证,发现在143b细胞中敲低fto后能上调dact1的甲基化水平,而在mnng/hos细胞中过表达fto后能下调dact1的甲基化水平,过表达fto-dm则无明显差异(图6中k)。上述结果表明,dact1可能是fto在骨肉瘤细胞中的潜在下游靶标。
[0300]
实施例4 fto介导的m6a去甲基化修饰通过igf2bp1依赖的方式影响dact1的mrna稳定性
[0301]
通过对merip-qpcr数据的分析,发现在143b细胞中敲低fto后dact1 mrna的cds区中有一段196bp的区域出现明显的m6a峰上调(图7中a)。通过双荧光素酶报告基因实验,把目标196bp的区域插入到pmirglo质粒中,并通过把相应m6a motif中的a变成t构建突变体(图7中b)。在143b细胞中敲低fto后,转入wt质粒的荧光信号比值相应上调,转入m6a motif突变体后荧光强度无明显差异;在mnnghos中可见类似的结果,上述表明m6a去甲基化酶fto与dact1之间存在负性的表观调控作用(图7中c)。随后进行mrna稳定性试验,发现敲低fto后,dact1的mrna稳定性上调,而过表达fto而不是fto-dm后,dact1的mrna稳定性下调(图7中d),说明fto与dact1之间的负性表观调控作用通过影响dact1的mrna稳定性实现的。
[0302]
m6a阅读蛋白(readers)识别m6a修饰的转录产物并产生一系列不同的生物效应。为了寻找能介导fto表观调控dact1的m6a阅读蛋白,通过对28个阅读蛋白进行rna干扰,发现干扰igf2bp1后dact1的mrna相对水平明显下调(图8中a)。igf2bp家族是近年来发现的新的m6a阅读器蛋白,可选择性识别m6a修饰位点,促进靶基因的mrna稳定性。随后,在143b细胞和sjsa-1细胞中敲低fto,并进一步敲低igf2bp1,发现敲低fto后dact1的表达量上调,然而敲低igf2bp1后逆转该上调趋势(图8中b)。进一步通过rip-qpcr证明igf2bp1能够结合到dact1的mrna上(图8中c)。
[0303]
实施例5 fto通过dact1/wnt-βcatenin信号通路促进骨肉瘤的发生和发展
[0304]
wnt/β-catenin信号通路的功能紊乱是多种肿瘤发生和进展的重要原因。既往研究报道,dact1可通过两个途径抑制经典wnt/β-catenin信号通路的功能,一是通过结合dvl蛋白并促使其降解,从而增加降解复合物对β-catenin的降解;二是直接抑制细胞核中β-catenin/lef转录复合物的功能。目前,dact1在骨肉瘤中的功能作用尚未清楚,为了进一步
明确dact1在骨肉瘤中的生物学功能,在高转移株143b和sjsa-1细胞中过表达dact1,细胞的增殖、迁移和侵袭能力明显减弱(图9中a、b、c),伴随下游wnt信号通路中的ctnnb1、cyclin d1及c-jun表达量下调(图9中d),预示着dact1在骨肉瘤中扮演着抑癌基因的角色。随后,在143b及mnnghos细胞中进行功能回复实验,发现敲低fto后细胞的增殖、迁移和侵袭能力显著受抑制,进一步敲低dact1后该抑制效应消失(图9中e、g)。同样地,在mnng/hos细胞中过表达fto后细胞增殖、迁移和侵袭能力增强,进一步过表达dact1后该增强效应消失(图9中f、h)。western blot检测发现过表达fto后能促进ctnnb1和c-jun的表达,而进一步过表达dact1后能减弱该促进作用(图9中i)。上述结果表明,fto的敲低或过表达对骨肉瘤细胞的生物学功能跟fto对dact1的负调控密切相关。
[0305]
接着,构建胫骨原位骨肉瘤小鼠模型,将分别敲低了fto和dact1以及同时敲低fto及dact1的143b细胞注射进入小鼠胫骨髓腔,随后每三天测量肿瘤体积,待肿瘤长到一定大小后处死老鼠,并称量肿瘤重量及取出肺组织进行组织包埋和he染色。动物体内实验结果表明,敲低了fto后肿瘤的生长速度减缓及肿瘤体积明显减少,出现的肺结节数量较少,进一步敲低dact1后减弱该抑制效应(图10中a、b、c、d、e)。
[0306]
综合上述实验结果,m6a去甲基化酶fto通过dact1/wnt-βcatenin信号通路促进骨肉瘤的发生和发展。
[0307]
实施例6 骨肉瘤组织中fto与dact1表达量呈负相关关系
[0308]
在40例骨肉瘤患者新鲜肿瘤组织中通过rt-qpcr检测发现,dact1的mrna表达量与fto的呈负相关关系(图11中a)。通过免疫组织化学染色,在70例骨肉瘤患者的石蜡组织切片中,fto高表达的有38例,dact1高表达的有29例,两者的表达量呈负相关关系(图11中b)。分析dact1与总生存率、无肺转移生存的关系,结果如图12所示:dact1的低表达与骨肉瘤的不良预后密切相关,dact1能够成为预测骨肉瘤预后的独立预测因素。分析dact1及fto与总生存率、无肺转移生存的关系,结果如图13所示:dact1的低表达及fto的高表达与骨肉瘤的不良预后密切相关,dact1及fto能够成为预测骨肉瘤预后的预测因素。fto、dact1及其组合的5年生存率roc曲线图如图14所示:auc
fto
=0.753,auc
dact1
=0.709,auc
combination
=0.792,进一步说明dact1和/或fto可作为骨肉瘤预后的诊断标志物。
[0309]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1