以氨磷汀为底物利用ATRP信号放大策略检测碱性磷酸酶的电化学试剂盒及使用方法
以氨磷汀为底物利用atrp信号放大策略检测碱性磷酸酶的电化学试剂盒及使用方法
技术领域
1.本发明涉及一种以氨磷汀为底物利用atrp信号放大策略检测碱性磷酸酶的电化学试剂盒及其使用方法,属于生物分析技术领域。
背景技术:
2.碱性磷酸酶(alp)是一种广泛存在于生物体中的重要水解酶,它致力于在碱性条件下催化核酸、蛋白质等分子中磷酸单酯结构的水解,生成相应的醇、酚及糖类化合物。人体中的alp主要分布在肝、骨、肾、胎盘及肠道组织中,几乎参与所有生命过程,其中在组织矿化和成骨中具有至关重要的作用。研究表明alp活性异常与多种疾病密切相关,例如成骨细胞骨肿瘤、骨软化、慢性肾炎、糖尿病等。因此alp活性检测对相关疾病诊断及监测具有重要意义。
3.目前,研究者们已开发了多种方法用于alp活性检测,包括比色法、荧光法、电化学法、化学发光法等。其中电化学法因其灵敏度高、响应速度快、成本低廉,携带方便、易于微型化和自动化等优点,已广泛应用于食品药物分析、环境监测、生命科学等领域。
4.相比于传统的电化学传感器目标检测物与信号分子1:1耦合,引入聚合信号放大策略在一个活性位点上接枝大量的信号分子可有效提高传感器的灵敏度。原子转移自由基聚合(atrp)因其单体适用范围广、反应条件温和等优点而被广泛应用于生物传感领域。本发明旨在研发以氨磷汀为alp底物,基于atrp信号放大策略的电化学试剂盒,使其具有灵敏度高、选择性好、操作简单,成本低廉等特点,可用于较低活性的碱性磷酸酶检测。
技术实现要素:
5.针对现有技术的不足,本发明的目的是提供一种以氨磷汀为底物利用atrp信号放大策略检测碱性磷酸酶的电化学试剂盒及其使用方法,该试剂盒具有选择性高、灵敏度高等特点。
6.为了实现上述目的,本发明的技术方案是:
7.一种以氨磷汀为底物利用atrp信号放大策略检测碱性磷酸酶的电化学试剂盒,包括:金电极、bpaa、edc、nhs、氨磷汀、cubr2/me6tren、fmma、aa、liclo4、dmso、超纯水、tris-hcl缓冲溶液。
8.使用时,bpaa配制为1mm,edc配制为1mm,nhs配制为1mm,氨磷汀配制为2mm;cubr2/me6tren溶液中cubr2的浓度为10mm,me6tren的浓度为12mm,fmma溶液浓度为10mm,aa溶液浓度为20mm,liclo4溶液浓度为1m。
9.一种上述试剂盒的使用方法,包括以下步骤:
10.(1)edc、nhs活化bpaa羧基
11.将bpaa、edc及nhs加入dmso中,反应;
12.(2)氨磷汀的水解
13.将氨磷汀溶液与待检测样品溶液混合,反应;
14.(3)金电极的修饰和atrp反应
15.①
金电极的修饰:将步骤(2)的反应液滴加在金电极表面,反应,洗涤,吹干;
16.②
bpaa修饰:将修饰电极浸泡在步骤(1)的反应液中,反应,洗涤,吹干;
17.③
atrp反应:依次向h2o中加入cubr2/me6tren溶液、fmma溶液、aa溶液,混合均匀后,将电极浸泡在混合溶液中,反应;
18.(4)swv检测
19.将步骤(3)所得电极浸入liclo4溶液中,进行方波伏安法电化学测量。
20.氨磷汀溶液的配制方法为:将氨磷汀加入tris-hcl缓冲溶液中,使其浓度为2mm,tris-hcl缓冲溶液的ph为9.0,氨磷汀溶液和待检测样品溶液的体积比为1:1。
21.金电极先进行预处理,预处理方法为:
22.①
将金电极分别用无水乙醇和超纯水超声洗涤30s;
23.②
分别用0.3μm、0.05μm的氧化铝抛光粉打磨3~5min;
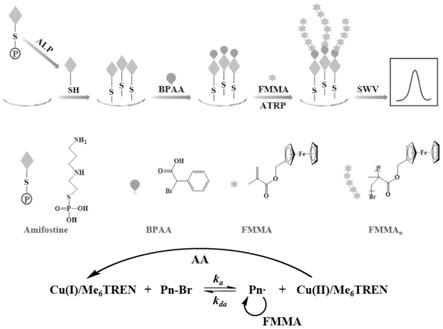
24.③
分别用无水乙醇和超纯水超声洗涤30s;
25.④
用水虎鱼酸浸泡15min;
26.⑤
分别用无水乙醇和超纯水超声洗涤30s;
27.⑥
电极浸泡在0.5m硫酸溶液中,设置电位为-0.3~1.5v,扫描速率为0.2v/s,设置扫描段数为40,直至得到可重复的循环伏安图;
28.⑦
用超纯水超声洗涤,再用氮气吹干备用。
29.dmso中bpaa浓度为1mm,edc浓度为1mm,nhs浓度为1mm,cubr2/me6tren中cubr2的浓度为10mm,me6tren的浓度为12mm,fmma溶液浓度为10mm,aa溶液浓度为20mm,h2o、cubr2/me6tren溶液、fmma溶液、aa溶液的体积比为7:1:1:1,liclo4溶液浓度为1m。
30.方波伏安法电化学测量的扫描范围为0~0.6v电位。
31.步骤(1)中反应温度为37℃,时间为4~8h;步骤(2)和(3)中反应温度为37℃,时间为1~2h。
32.一种上述试剂盒在检测碱性磷酸酶中的应用。
33.本发明检测原理示意图如图1所示。
34.本发明的有益效果:
35.1、本发明使用atrp作为信号放大策略,避免了目前常用信号放大策略中纳米材料和生物酶(易受外界环境如ph和温度影响)的使用,在信号能够成倍放大,灵敏度极大提高的同时,稳定性和重现性也相对较高。
36.2、相比于传统的alp检测方法,电化学方法能够对生物反应发生进行实时监测并将其转换为电信号,这种类型的信号可以很容易地在微型设备中集成和观察。
37.3、本发明利用氨磷汀的磷酸酯结构可在alp催化作用水解为游离的巯基,可通过硫-金键自组装在金电极表面,氨磷汀水解产物的固定为后续原子转移自由基聚合反应的引发剂提供连接位点;经edc、nhs预活化的引发剂α-溴苯乙酸(bpaa)可通过酰胺键与氨磷汀的水解产物连接,从而引发单体甲基丙烯酸二茂铁(fmma)进行atrp反应,使大量的二茂铁电活性分子接枝在电极表面,有效增大电信号输出;最后,利用方波伏安法(swv)记录氧化电流响应,实现alp活性定量检测。在最佳条件下,alp活性在5~100mu/ml范围内与电流
信号呈现良好的线性关系,的到线性回归方程为y=0.05192x+0.33066,r2=0.998(x为alp活性,单位:mu/ml;y为氧化电流强度,单位:μa),计算得到检测限为1.71mu/ml。并且研究结果表明本发明试剂盒具有良好的择性及抗干扰性,且可用于alp活性抑制剂的筛选。由于本发明试剂盒具有灵敏度高、操作简单和成本低廉等优点,有望用于医学领域alp活性检测及抑制剂筛选。
附图说明
38.图1为本发明检测原理示意图。
39.图2为本发明试剂盒的可行性研究。
40.图3为修饰电极的电化学表征。
41.图4为修饰电极的原子力显微镜照片。
42.图5为不同修饰状态电极表面的接触角照片。
43.图6为检测条件的优化。
44.图7为alp活性与电流强度的线性关系。
45.图8为本发明试剂盒的选择性研究。
46.图9为本发明试剂盒的抗干扰性研究。
47.图10为钒酸钠对alp活性抑制率研究。
具体实施方式
48.以下结合实施例对本发明的具体实施方式作进一步详细说明。
49.实施例1:试剂盒
50.一种以氨磷汀为底物利用atrp信号放大策略检测碱性磷酸酶的电化学试剂盒,包括:金电极、α-溴苯乙酸(bpaa)、1-乙基-3-(二甲基氨基丙基)碳二亚胺(edc)、n-羟基琥珀酰亚胺(nhs)、氨磷汀、alp、cubr2/me6tren、甲基丙烯酸二茂铁基甲酯(fmma)、抗坏血酸(aa)、liclo4、二甲基亚砜(dmso)、超纯水、tris-hcl缓冲溶液(ph 9.0)。
51.使用时,bpaa配制为1mm,edc配制为1mm,nhs配制为1mm,氨磷汀配制为2mm。cubr2/me6tren溶液中cubr2的浓度为10mm,me6tren的浓度为12mm,fmma溶液浓度为10mm,aa溶液浓度为20mm,liclo4溶液浓度为1m。
52.实施例2:检测方法
53.一种检测碱性磷酸酶的方法,包括以下步骤:
54.(1)edc、nhs活化α-溴苯乙酸(bpaa)羧基
55.将bpaa、edc及nhs加入dmso中,使三者浓度均为1mm,在37℃摇床中反应5h;
56.(2)氨磷汀的水解
57.将氨磷汀加入tris-hcl缓冲溶液(ph 9.0)中,使其浓度为2mm,并与等体积待检测样品溶液(含alp)混合,在37℃摇床中反应1h;
58.(3)金电极的修饰和atrp反应
59.①
金电极的修饰:将10μl步骤(2)的反应液滴加在预处理的金电极表面,在37℃下反应80min后,用超纯水清洗电极,氮气吹干;
60.②
bpaa修饰:将修饰电极浸泡在10ml步骤(1)的反应液中,37℃反应1h,然后依次
用dmso和超纯水冲洗,氮气吹干;
61.③
atrp反应:在37℃下,依次向1.4ml h2o中加入200μl cubr2/me6tren溶液(cubr2的浓度为10mm,me6tren的浓度为12mm)、200μl fmma溶液(10mm)、200μl aa溶液(20mm),混合均匀后,将电极浸泡在混合溶液中,37℃反应1h;
62.(4)swv检测
63.将步骤(3)所得电极浸入liclo4溶液(1.0m)中,进行方波伏安法(swv)电化学测量。
64.其中,金电极的预处理方法为:
65.①
将金电极分别用无水乙醇和超纯水超声洗涤30s;
66.②
分别用0.3μm、0.05μm的氧化铝抛光粉打磨3~5min;
67.③
分别用无水乙醇和超纯水超声洗涤30s;
68.④
用水虎鱼酸浸泡15min;
69.⑤
分别用无水乙醇和超纯水超声洗涤30s;
70.⑥
电极浸泡在0.5m硫酸溶液中,设置电位为-0.3~1.5v,扫描速率为0.2v/s,设置扫描段数为40,直至得到可重复的循环伏安图;
71.⑦
用超纯水超声洗涤,再用氮气吹干备用。
72.实施例3:可行性验证
73.为了验证所提出的alp活性检测方法的可行性,进行了一系列空白对照实验,比较缺少不同材料修饰电极的电流强度,各种修饰电极的swv曲线见图2。在没有alp(曲线b)、氨磷汀(曲线c)、bpaa(曲线d)、cubr2/me6tren(曲线e)、aa(曲线f)、fmma(曲线g)的情况下,几乎没有电化学信号响应,当所有修饰材料均逐步修饰在金电极表面时(曲线a),在电位约为0.38v的处可观察到明显的氧化电流信号。因此,以上实验结果表明本发明试剂盒用于alp活性检测是可行的。
74.实施例4:修饰电极的电化学表征
75.为了证明电化学检测的构建过程是成功且顺利的,通过电化学阻抗谱(eis)对逐步修饰电极进行表征。在nyquist图中,高频区半圆的直径等于电荷转移电阻(r
ct
)。如图3a所示,裸金电极显示出最小的r
ct
(~0.27kω,a),在电极表面修饰氨磷汀的水解产物导致r
ct
增加(~0.39kω,b)。随后,由于引发剂bpaa的修饰导致r
ct
进一步增加(~0.53kω,c)。进行atrp反应后,由于聚合物层的形成,r
ct
显著增加(~2.36kω,d)。该结果证明全修饰电极构建成功。
76.同时,为了证明atrp反应的成功发生,在liclo4溶液中采用循环伏安法(cv)对修饰电极进行表征,研究不同扫描速率对氧化还原电流强度的影响。从图3b可以看出,随着扫描速率从0.01增加到1.0v/s,氧化还原电流峰值与扫描速率呈现良好的线性关系。这证明单体fmma中的二茂铁分子的氧化还原过程不是通过静电吸附,而是通过共价键连接在金电极表面。
77.实施例5:电极表面形貌表征
78.为了进一步证明聚合物的形成,通过原子力显微镜(afm)观察修饰电极的表面形貌。通过比较聚合反应前后电极表面高度的变化,证明聚合物链的形成。从图4可以看出,引发剂bpaa修饰后,金电极的高度为8.1nm(左图),atrp反应后表面高度增加到28.3nm(右
图)。综上所述,金电极表面高度的增加证明了atrp反应的发生。
79.此外,根据修饰电极表面基团亲水性的差异,采用水接触角(wca)来表征逐步修饰电极。如图5所示,由于金的强疏水性,裸金电极的wca为91.2
°
(图5a)。在氨磷汀水解产物改性后,氨基的引入导致wca降低至85.4
°
(图5b)。随后,由于碳链的疏水性(88.6
°
)(图5c),引发剂bpaa的修饰导致wca增加。最终,由于聚合物链的高疏水性,wca显着增加到92.3
°
(图5d)。wca的变化进一步证明电极成功地进行了修饰。
80.实施例6:检测条件优化
81.为了达到该电极的最佳分析性能,本发明研究了tris-hcl缓冲液ph值、氨磷汀水解产物与电极反应时间、atrp反应时间的最优值。
82.(1)tris-hcl缓冲液ph值的优化
83.当ph值合适时,alp催化底物氨磷汀水解的反应效率较高,氨磷汀能够更多水解从而为引发剂提供更多的附着位点,进而导致更多的聚合物链连接。考虑到碱性条件更适合alp去磷酸化,本发明的ph范围选择在7.5~9.7。从图6可以看出,电流强度随着ph值的增加而逐渐增加,在9.0时达到最大值,然后下降。因此,对于后续的反应采用ph为9.0的tris-hcl缓冲液。
84.(2)氨磷汀水解产物与电极反应时间的优化
85.在本研究中,采用swv记录氨磷汀水解产物修饰时间从20~120min的信号响应。如图6所示,swv响应在前80min内随着反应时间逐渐增加,之后电流强度保持稳定。因此,选择80min作为本发明方法中氨磷汀水解产物修饰时间的最佳时间,并应用于后续研究。
86.(3)atrp反应时间的优化
87.在atrp反应中,反应时间可以控制连接聚合物链的长度。因此,本发明研究了15~90min内的atrp时间对峰值电流信号的影响。如图6所示,峰值电流信号在15~45min内随着atrp时间的增加而迅速增加,但在60min时达到平衡。因此,在之后研究中,atrp的反应时间设定为60min。
88.实施例7:分析性能
89.在最佳条件下,用一系列不同活性的alp溶液研究该试剂盒的检测性能。如7a所示,alp活性为5~100mu/ml时,电流强度随着alp活性的增加而逐渐增大。此外,如图7b所示,电化学信号强度在5~100mu/ml之间与alp活性呈线性相关。线性回归方程为y=0.05192x+0.33066,r2=0.998(x为alp活性,单位:mu/ml;y为氧化电流强度,单位:μa),计算得到检测限为1.71mu/ml(s/n=3)。与现有碱性磷酸酶检测方法相比,本发明提出的基于atrp信号放大策略以氨磷汀为酶底物电化学检测碱性磷酸酶的方法具有相对较低的检测限。
90.实施例8:选择性实验
91.为了验证该信号放大方法的选择性,本发明比较了相同条件下alp(50mu/ml)与胃蛋白酶(pepsin)、牛血清白蛋白(bsa)和葡萄糖氧化酶(gox)的信号响应来研究本发明方法的选择性。pepsin、gox和bsa的浓度分别为50mu/ml、50mu/ml和50μm。如图8所示,仅在alp中可以看到显著的电流响应,其它非靶蛋白对电化学信号的影响可以忽略不计。注意到一些含硫醇的小分子也可能导致信号响应,因此在进行实际样品检测之前,需要用丙烯酰胺对样品进行预处理以排除干扰。结果表明,本发明方法对alp的检测具有很高的选择性。
92.实施例9:抗干扰能力
93.为了评估本发明方法的抗干扰能力,将不同活性的alp(20、50、80mu/ml)在tris-hcl缓冲液中与在10%人血清中的电化学信号进行比较。如图9所示,来自10%人血清的电流信号分别为tris-hcl缓冲液的102.4%(20mu/ml)、97.0%(50mu/ml)和93.0%(80mu/ml)。因此,该方法对血清基质具有优异的抗干扰能力。
94.实施例10:重现性及稳定性研究
95.通过批内和批间实验对本发明方法的重现性进行了研究。批内和批间(n=5)的氧化电流强度的变异系数分别为3.13%和4.82%。结果表明,本发明建立的alp活性检测方法具有良好的重现性。
96.为了评估所构建的全修饰电极的稳定性,本发明进行了储存实验。具体来说,在相同条件下制备了两组修饰电极(n=5),一组在制备后立即进行swv测量,另一组在4℃的水分饱和环境中存储两周后进行测量,比较两组电流强度的平均值。结果显示,存储两周后的修饰电极与新制备的电极相比可以保留高达93.7%的电流信号。因此,构建的全修饰电极具有良好的储存稳定性。
97.实施例11:抑制率实验
98.alp的过度表达已被证明与多种可以通过抑制剂有效调节的疾病密切相关。本发明所提出的方法在抑制剂筛选中的潜在应用以钒酸钠(na3vo4)为模型进行评估。结果表明,随着na3vo4浓度的增加,检测所得的峰值氧化电流逐渐减小。如图10所示,随着na3vo4浓度的增加,抑制效率也逐渐增加,这说明na3vo4对alp活性的浓度依赖性抑制。半数最大抑制浓度(ic
50
,当alp活性被抑制50%时的na3vo4浓度)约2.64mm。综上所述,本发明方法适用于alp活性抑制剂的筛选。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1