一种制备α-硫二氟酯基酮/酯的方法及产品
一种制备
α-硫二氟酯基酮/酯的方法及产品
技术领域
1.本发明属于有机化学合成领域,特别涉及一种制备α-硫二氟酯基酮/酯的新方法及产品。
背景技术:
2.由于氟原子具有电负性高、原子半径小的独特性质,将氟掺入有机分子中可以改变其物理、化学和生物学性质。在众多含氟基团中,二氟甲硫基(-scf2h)一种常见的含氟官能团,具有较强的脂溶性和较强的吸电子能力。二氟甲硫基与羟基、氨基在酸碱性和电性上相似,可以作为他们的生物电子等排体,增强药物分子与靶点蛋白之间的作用力,提高药物分子的识别能力。因此,含二氟甲硫基的化合物在农药和医药等领域的应用十分广泛,例如:pyriprole(vet.rec.2010,167,442-445)是一种杀虫剂,可用于动植物虫害防治;氟氧头孢钠(infection,1991,19,253-257)是一种广谱抗生素,适用于多种外科手术感染、心内膜炎、败血症等。
3.最近,硫二氟烷基
“‑
scf2fg”基团(fg=co2r,po(oet)2,so2ph)作为二氟甲硫基(-scf2h)的一个非常有吸引力的替代品出现。因为额外的fg为药物分子结构的灵活变化提供了潜在机会,此外,相比于-po(oet)2和-so2ph取代基,-scf2co2r中的酯基更容易衍生为其他官能团。
4.目前,报道的α-硫二氟酯基酮/酯化合物的合成方法主要有以下几种:(一)、β-二羰基化合物的α-硫二氟酯基化反应(org.lett.2017,19,1032-1035)。该反应虽然具有比较高的转化率,但是令人遗憾的是该反应的烷基亲核试剂只能是β-二羰基化合物,底物范围太窄;(二)、芳基/杂芳基酮的α-硫二氟酯基化反应(eur.j.org.chem.2017,14,1911-1914),该反应需要在90℃下才能顺利进行的缺点又限制了此类反应的应用,且反应产率很低,普遍达不到50%。(三)、α-溴代芳基酮出发的羰基化合物α-硫二氟酯基化反应(tetrahedron 2017,73,6057-6066),该反应从α-溴代芳基酮出发,能够以较为温和的条件得到目标产物,但是反应产率较低,普遍在中等或中等偏下,且底物范围较窄,仅限于α-溴代芳基酮类试剂。
技术实现要素:
5.为了克服现有技术中存在的缺陷,本发明提供了一种制备α-硫二氟酯基酮/酯的新方法。该反应方法创新性高,条件温和,选择性好,收率高,官能团兼容性强。
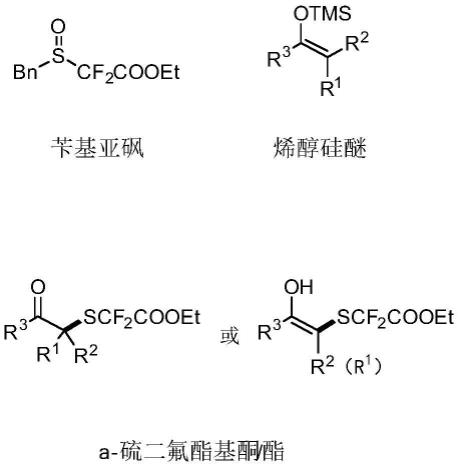
6.一种制备α-硫二氟酯基酮/酯的方法,包括:苄基亚砜与烯醇硅醚在活化剂作用下组装形成硫鎓盐,硫鎓盐在碱的作用下脱苄基得到α-硫二氟酯基酮/酯。
7.所述苄基亚砜、亲核试剂以及α-硫二氟酯基酮/酯的结构分别如下:
[0008][0009]
其中:r1为h、c1~c5酯基、c1~c5烷基、3~8元环烷基;
[0010]
r2为h、3~8元环烷基;
[0011]
r3为苯基、c1~c3烷基取代苯基、卤素取代苯基、萘、c1~c8烷基、c1~c8烷氧基。
[0012]
反应过程如下:
[0013][0014]
作为优选,包括如下步骤:
[0015]
(1)在有机溶剂中加入苄基亚砜、烯醇硅醚,低温下加入活化剂,t1温度下至反应完成;
[0016]
(2)向将步骤(1)的反应液中加入碱,缓慢升温至t2,待反应完成,后处理得到所述的α-硫二氟酯基酮/酯。
[0017]
作为优选,所述活化剂为三氟甲磺酸酐。
[0018]
作为优选,所述活化剂加入的温度为0~-70℃。
[0019]
作为优选,所述制备硫鎓盐的反应温度或者t1为0~-70℃,进一步优选为0~-60℃;进一步优选为-30~-70℃,进一步优选为-30~-60℃,更进一步优选为-30~-40℃。
[0020]
作为优选,所述碱为二乙胺、三乙胺、吡啶,苯胺。进一步优选为二乙胺。
[0021]
作为优选,反应溶剂为乙腈。最好选择干燥后的乙腈。
[0022]
作为优选,所述硫鎓盐在碱的作用下脱苄基的反应温度或者t2为-40~35℃;进一步优选为-30~35℃,更进一步优选为-30~25℃,更进一步优选为0~25℃;某些优选的实施例中,选择25℃。
[0023]
作为优选,所述烯醇硅醚与苄基亚砜的摩尔比为1:(1~4),进一步优选为1:(1~2);所述烯醇硅醚与活化剂的摩尔比为1:(1~2);进一步优选为1:1.5;所述烯醇硅醚与碱的摩尔比为1:(1~3);进一步优选为1:(2~3)。
[0024]
作为优选,制备硫鎓盐的反应时间为5min~6小时,优选为0.5~2小时。所述在碱的作用下脱苄基的反应时间为5min~20小时,优选为10~14小时。
[0025]
作为优选,r1为h、乙氧羰基、正丁基、环己基;r2为h、环己基;r1、r2可以进一步形成环己基;r3为h、甲基取代苯基、氯取代苯基、β-萘、c1~c5烷基、c1~c2烷氧基;
[0026]
本发明中,所述c1~c5烷基包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、正戊基、叔丁基甲基等;氯取代苯基包括对位、邻位或者间位取代的氯取代苯基;同样的定义,甲基取代苯基包括对位、邻位或者间位的取代。c1~c2烷氧基包括甲氧基、乙氧基。c1~c3烷基包括甲基、乙基、丙基、异丙基。
[0027]
本发明还提供了一种α-硫二氟酯基酮/酯化合物,具有如下通式所示的化合物:
[0028][0029]
其中:r1为h、c1~c5酯基、c1~c5烷基、3~8元环烷基;
[0030]
r2为h、3~8元环烷基;
[0031]
r3为苯基、c1~c3烷基取代苯基、卤素取代苯基、萘、c1~c8烷基、c1~c8烷氧基;
[0032]
作为优选,r1为h、乙氧羰基、正丁基、环己基;r2为h、环己基;r1、r2可以进一步形成环己基;r3为h、甲基取代苯基、氯取代苯基、β-萘、c1~c5烷基、c1~c2烷氧基;
[0033]
与现有方法相比,本方法通过烯醇硅醚与苄基亚砜在温和条件下合成α-硫二氟酯基酮/酯,其优势在于:
[0034]
1)本方法反应选择性好,收率高,产物易分离、操作简单;
[0035]
2)本方法所用原料廉价易得,反应条件温和,避免了传统方法中反应条件要求严格,反应底物受到限制的缺点;
[0036]
3)本反应设计新颖,为羰基/酯基化合物α-位硫二氟酯基化开辟了新的合成途径。
具体实施方式
[0037]
以下介绍本发明提供的制备α-硫二氟酯基酮/酯的具体实施实例,共提供了8个具体实施例。应当指出的是,本发明的实施不局限于以下实施例。
[0038]
实施例1:
[0039][0040]
在干燥的25mlschlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(39mg,0.2mmol),超干的乙腈(2.0ml)和上式所示的苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率70%。(rf=0.61,展开剂:pe/etoac=10/1)。
[0041]1h nmr(600mhz,cdcl3):δ7.98
–
7.92(m,2h),7.65
–
7.57(m,1h),7.53
–
7.46(m,2h),4.47(s,2h),4.35(q,j=7.2hz,2h),1.35(t,j=7.2hz,3h).
[0042]
13
c nmr(151mhz,cdcl3):δ192.68,161.61(t,j=32.7hz),135.11,134.16,129.00,128.51,120.08(t,j=286.7hz),64.01,37.19,13.94.
[0043]
19
f nmr(565mhz,cdcl3):δ-83.10(s).
[0044]
ir(neat):2985,1758,1683,1597,1580,1499,1291,1097,981,750,787,643.
[0045]
hrms(esi-tof):calculated for[c
12h12
f2o3sna(m+na
+
)]:297.0367,found:297.0360.
[0046]
实施例2:
[0047][0048]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(41mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率69%。(rf=0.59,展开剂:pe/etoac=5/1)。
[0049]1h nmr(400mhz,cdcl3):δ7.86(d,j=8.2hz,2h),7.29(d,j=8.0hz,2h),4.46(s,2h),4.35(q,j=7.1hz,2h),2.42(s,3h),1.35(t,j=7.2hz,3h).
[0050]
13
c nmr(101mhz,cdcl3):δ192.27,161.65(t,j=32.8hz),145.26,132.61,129.69,128.64,120.13(t,j=286.6hz),63.99,37.20,21.86,13.95.
[0051]
19
f nmr(377mhz,cdcl3):δ-83.11(s)
[0052]
ir(neat):2990,2935,1764,1680,1604,1471,1292,1218,1122,1035,993,857,809,751.
[0053]
hrms(esi-tof):calculated for[c
13h15
f2o3s(m+h
+
)]:289.0704,found:289.0705.
[0054]
实施例3:
[0055][0056]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(45mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率63%。(rf=0.29,展开剂:pe/etoac=5/1)。
[0057]1h nmr(400mhz,cdcl3):δ7.89(d,j=8.6hz,2h),7.45(d,j=8.6hz,2h),4.42(s,2h),4.34(q,j=7.1hz,2h),1.34(t,j=7.2hz,3h).
[0058]
13
c nmr(101mhz,cdcl3):δ191.58,161.49(t,j=32.6hz),140.66,133.37,129.91,129.31,119.98(t,j=287.0hz),64.05,36.94,13.90.
[0059]
19
f nmr(377mhz,cdcl3):δ-83.00(s).
[0060]
ir(neat):1758,1513,1445,1393,1288,1097,1010,927,911,834,715,695,636.
[0061]
hrms(esi-tof):calculated for[c
12h11
f2o3sclna(m+na
+
)]:330.9978,found:330.9967.
[0062]
实施例4:
[0063][0064]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(49mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率67%。(rf=0.45,展开剂:pe/etoac=5/1)。
[0065]1h nmr(400mhz,cdcl3):δ8.48(s,1h),8.04-7.97(m,2h),7.96-7.86(m,2h),7.68-7.55(m,2h),4.63(s,2h),4.38(q,j=7.1hz,2h),1.37(t,j=7.1hz,3h).
[0066]
13
c nmr(101mhz,cdcl3):δ192.65,161.70(t,j=32.8hz),136.05,132.48,132.44,130.61,129.82,129.23,129.02,128.01,127.30,123.79,120.16(t,j=286.7hz),64.08,37.36,14.00.
[0067]
19
f nmr(377mhz,cdcl3):δ-83.01(s).
[0068]
ir(neat):3061,2929,2927,1759,1676,1301,1185,1094,998,943,858,753.
[0069]
hrms(esi-tof):calculated for[c
16h14
f2o3sna(m+na
+
)]:347.0524,found:347.0544.
[0070]
实施例5:
[0071][0072]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(37mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶
柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率82%。(rf=0.51,展开剂:pe/etoac=10/1)。
[0073]1h nmr(400mhz,cdcl3):δ4.33(q,j=7.1hz,2h),3.77(s,2h),2.54(t,j=7.4hz,2h),1.64
–
1.53(m,2h),1.42
–
1.20(m,7h),0.87(t,j=6.9hz,3h).
[0074]
13
c nmr(101mhz,cdcl3):δ203.66,161.52(t,j=32.7hz),119.90(t,j=286.9hz),64.00,41.48,38.98,31.25,23.47,22.46,13.96,13.92.
[0075]
19
f nmr(377mhz,cdcl3):δ-83.23(s).
[0076]
ir(neat):2924,2854,1760,1707,1457,116.
[0077]
hrms(esi-tof):calculated for[c
11h18
f2o3sna(m+na
+
)]:291.0837,found:291.0839.
[0078]
实施例6:
[0079][0080]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(40mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率87%。(rf=0.42,展开剂:pe/etoac=5/1)。
[0081]1h nmr(600mhz,cdcl3):δ14.14(s,1h),4.35
–
4.23(m,4h),2.38(s,3h),1.37
–
1.30(m,6h).
[0082]
13
c nmr(151mhz,cdcl3):δ188.01,172.76,161.93(t,j=32.5hz),119.74(t,j=288.0hz),86.66,63.59,62.11,21.54(s),14.16,14.00.
[0083]
19
f nmr(377mhz,cdcl3):δ-85.28(s).
[0084]
ir(neat):2985,1756,1730,1280,1118,979,723.
[0085]
hrms(esi-tof):calculated for[c
10h14
f2o5sna(m+na
+
)]:307.0422,found307.0431.
[0086]
实施例7:
[0087][0088]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(43mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,
搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率81%。(rf=0.53,展开剂:pe/etoac=10/1)。
[0089]1h nmr(400mhz,cdcl3):δ4.35(q,j=7.1hz,2h),4.28
–
4.12(m,2h),3.84(t,j=7.5hz,1h),1.97
–
1.85(m,1h),1.84
–
1.72(m,1h),1.45
–
1.23(m,10h),0.89(t,j=6.9hz,3h).
[0090]
13
c nmr(101mhz,cdcl3):δ171.72,161.51(t,j=32.6hz),120.25(t,j=287.1hz),64.01,61.88,45.26,32.32,29.06,22.20,14.12,13.97,13.88.
[0091]
19
f nmr(377mhz,cdcl3):δ-81.36(q,j=221.0hz).
[0092]
ir(neat):2961,2934,2874,1762,1736,1466,1290,1096,1014,984,724.
[0093]
hrms(esi-tof):calculated for[c
12h20
f2o4sna(m+na
+
)]:321.0943,found:321.0744.
[0094]
实施例8:
[0095][0096]
在干燥的25ml schlenk烧瓶中,氮气保护下依次加入上式所示的烯醇硅醚(43mg,0.2mmol),超干的乙腈(2.0ml)和苄基亚砜(79mg,0.3mmol)。搅拌均匀后,将反应器置于-40℃低温中平衡5min,然后低温下加入三氟甲磺酸酐(50μl,0.3mmol)。之后在此温度下搅拌反应1h。然后在此温度下将二乙胺(62μl,0.6mmol)添加到反应混合物中。缓慢升温至室温,搅拌12h后,混合物通过一个短的硅胶柱,收集滤液在真空下浓缩。将得到的残留物用硅胶柱层析法进一步纯化得到黄色油状产物,纯度大于99%,产率85%。(rf=0.54,展开剂:pe/etoac=5/1)。
[0097]1h nmr(400mhz,cdcl3):δ4.31(q,j=7.1hz,2h),3.75(s,3h),2.33
–
2.19(m,2h),1.91
–
1.80(m,2h),1.76
–
1.65(m,2h),1.50
–
1.38(m,4h),1.33(t,j=7.1hz,3h).
[0098]
13
c nmr(101mhz,cdcl3):δ172.81,161.35(t,j=31.8hz),121.28(t,j=288.2hz),63.86,55.75,52.79,34.86,25.00,22.83,13.83
[0099]
19
f nmr(377mhz,cdcl3):δ-78.46(s)
[0100]
ir(neat):2932,2873,1760,1717,1467,1398,1099,987,909,728.
[0101]
hrms(esi-tof):calculated for[c
12h19
f2o4sna(m+h
+
)]:297.0967,found:297.0962.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1