靶向高尔基体的谷胱甘肽比率荧光探针、制备方法与应用
1.本发明属于荧光探针领域,具体涉及一种靶向高尔基体的谷胱甘肽比率荧光探针及其在测量、检测或筛选谷胱甘肽及在活细胞荧光成像和对癌细胞选择性毒性中的应用。
背景技术:
2.硫醇在生命系统的生理和病理过程中起着至关重要的作用,其中包括信号转导、维持细胞氧化还原平衡和炎症等。谷胱甘肽属于硫醇中的一种,是一种γ-酰胺键,是由谷氨酸、半胱氨酸和甘氨酸组成的含硫醇的三肽,几乎存在于人体的每个细胞中。作为细胞内含量最丰富的生物硫醇,它可参与对细胞的保护和解毒,其浓度与多种细胞功能相关,如生长、代谢以及对癌症的放疗和化疗的耐药性等。同时,谷胱甘肽水平的失衡也和各种疾病有关,如阿尔茨海默病,获得性免疫缺陷综合征(aids)、帕金森氏病、心脏病、神经退行性疾病、多种癌症等。高尔基体作为一种重要的细胞器,参与蛋白质的包装和运输,在生命体中发挥重要作用,由于缺乏检测高尔基体中的谷胱甘肽的可靠技术,谷胱甘肽在高尔基体中的作用机制还没有被完全的阐明。因此,寻求一种特定的灵敏检测生命体内高尔基体中的谷胱甘肽的技术是至关重要的。
3.近年来,已报到道的检测谷胱甘肽的方法有分光光度比色法、高效液相色谱法、化学发光分析法、荧光探针分析法等,其中荧光探针因其超灵敏、高选择、合成简单等独特的优势而成为研究者关注的焦点。目前已报道的荧光探针分析方法仍存在一定的缺陷,例如灵敏度低、选择性差、合成复杂等。生命体内的其他化合物的存在可能会对谷胱甘肽的检测构成潜在干扰,并且生理环境中的谷胱甘肽的含量较低,因此,发展高选择性高灵敏度的荧光探针成为急需研究的课题。另外,比率型荧光探针因可以消除环境因素的干扰而受到广泛关注。
4.此外,因每年快速增长的发病率和死亡率,癌症已成为一种严重危害人类健康的疾病。然而现有的癌症治疗手段还非常有限,且其治疗效果也有待提高。因此,开发新的对癌细胞具有选择性毒性的荧光探针对癌症的高效治疗具有十分重大的意义。
5.总之,发展高选择性、高灵敏度、高尔基体靶向、对癌细胞具有选择性毒性的谷胱甘肽比率荧光探针具有重要意义。
技术实现要素:
6.有鉴于此,本发明的目的是在于提供一类靶向高尔基体的谷胱甘肽比率荧光探针,以及它们的制备方法和应用,具有合成简单、选择性好、灵敏度高、对癌细胞具有选择性毒性、能够靶向高尔基体和特异性识别谷胱甘肽等特点,并且能够在生理水平条件下对谷胱甘肽进行有效测量、检测或筛选。
7.具体而言,本发明提供了一种化合物,具有式(ⅰ)所示的结构:
[0008][0009]
式(i)中,r1,r2,r3,r4,r5、r6、r7和r8为独立地选自由氢原子、直链或支链烷基、直链或支链烷氧基、磺酸基、酯基和羟基组成的组;且其中的r1,r2,r3,r4,r5、r6、r7和r8可以相同或不同。
[0010]
在本发明的一些具体实施方案中,本发明的化合物是r1,r2,r3,r4,r5、r6、r7和r8均为氢原子的式(ⅱ)化合物,其结构式如下:
[0011][0012]
本发明还提供了式(ⅰ)化合物的制备方法,包括如下步骤:
[0013]
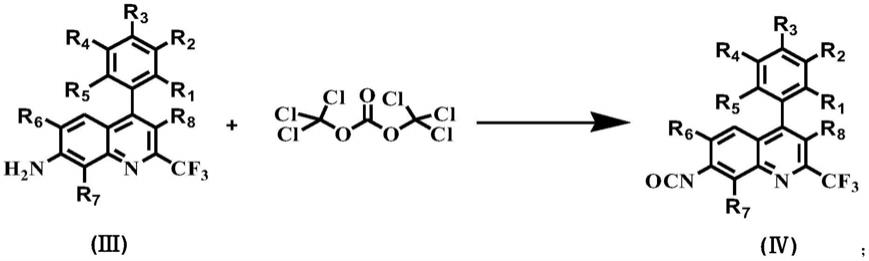
步骤1:使式(ⅲ)化合物和三光气反应制备式(ⅳ)化合物,反应式如下:
[0014][0015]
步骤2:使式(ⅳ)化合物和式(
ⅴ
)化合物反应制备式(ⅰ)化合物,反应式如下:
[0016][0017]
在本发明的一些具体实施方案中,式(
ⅴ
)化合物包括如下制备步骤:使环己烯酮
和甲醛反应制备式(
ⅴ
)化合物,反应式如下:
[0018][0019]
具体而言:将环己烯酮和甲醛及催化剂4-二甲氨基吡啶加入到四氢呋喃中,然后在常温下反应,制备得式(
ⅴ
)化合物。步骤二是将式(ⅵ)化合物与三光气溶于甲苯中,加热回流反应,然后减压旋蒸除去溶剂得固体式(ⅳ)化合物。步骤三反应为将式(
ⅴ
)化合物与式(ⅳ)化合物加入到二氯甲烷中,然后常温反应,抽滤,减压旋蒸去除溶剂得到固体,然后,进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系,可得到纯净的式(ⅰ)化合物。
[0020]
在本发明的一些具体实施方案中,式(
ⅴ
)化合物和式(ⅳ)化合物的摩尔比为1:1-1:2。
[0021]
在本发明的一些具体实施方案中,步骤三的反应时间为6-12小时。
[0022]
本发明还提供了用于测量、检测或筛选谷胱甘肽的荧光探针组合物,其包含本发明的所述式(i)化合物。
[0023]
在本发明的一些具体实施方案中,所述式(i)化合物具有以下结构:
[0024][0025]
在本发明的一些具体实施方案中,所述荧光探针组合物进一步包含溶剂、酸、碱、缓冲溶液或其组合。
[0026]
本发明还提供了用于检测样品中谷胱甘肽的存在或测量样品中的谷胱甘肽含量的方法,其包括:
[0027]
a)使所述式(i)或式(ⅱ)化合物与样品接触以形成荧光化合物;
[0028]
b)测定所述荧光化合物的荧光性质。
[0029]
在本发明的一些具体实施方案中,所述样品是化学样品或生物样品。
[0030]
在本发明的一些具体实施方案中,所述样品是包括水、血液、微生物或者动物细胞或组织在内的生物样品。
[0031]
本发明还提供了检测样品中谷胱甘肽的存在或测定样品中的谷胱甘肽含量的试剂盒,其包含所述式(i)或式(ⅱ)化合物。
[0032]
本发明还提供了所述式(i)或式(ⅱ)化合物在细胞荧光成像中的应用。
[0033]
本发明还提供了所述式(i)或式(ⅱ)化合物在制备对癌细胞具有选择性毒性的试剂中的应用。
[0034]
本发明相对于现有技术具有如下的显著优点及效果:
[0035]
(1)快速响应
[0036]
本发明的荧光探针能够对谷胱甘肽瞬时谷胱甘肽快速响应,有利于谷胱甘肽的快速检测。
[0037]
(2)特异性好,抗干扰能力强
[0038]
本发明荧光探针可选择性的与谷胱甘肽发生特异性反应,生成荧光变化的产物,相较于常见的其他金属离子及生命体内的其他物质,本发明荧光探针显示出了较高的选择性,并且抗干扰能力强。
[0039]
(3)可比率检测
[0040]
本发明荧光探针属于比率型荧光探针,与单波长荧光探针相比,具有消除多种干扰因素的优点,例如探针定位,环境变化,激发和发射效率等。
[0041]
(4)生理水平条件下应用,可细胞荧光成像
[0042]
本发明荧光探针能够在生理水平条件下应用,有利于将其长时间应用于细胞样品中谷胱甘肽的检测或成像。
[0043]
(5)灵敏度高
[0044]
本发明荧光探针与谷胱甘肽反应非常灵敏,从而有利于对谷胱甘肽的检测。
[0045]
(6)选择性毒性
[0046]
相比于正常细胞,本发明荧光探针对特定种类的癌细胞表现出较强细胞毒性,尤其是对hela细胞,细胞毒性最大。
[0047]
(7)合成简单
[0048]
本发明的谷胱甘肽荧光探针合成简单,有利于商业化的推广应用。
附图说明
[0049]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0050]
图1是探针(5μm)加入谷胱甘肽(300μm)前后的响应时间谱图;
[0051]
图2是探针(5μm)加入不同浓度谷胱甘肽(0-325μm)前后的荧光光谱变化;
[0052]
图3是探针(5μm)定量分析不同浓度谷胱甘肽(0-75μm)的工作曲线,其中纵坐标为510nm与425nm处的荧光强度的比值。
[0053]
图4不同离子分析物(除特殊表明外,都为500μm)对探针(5μm)的荧光强度的影响;
[0054]
图5不同离子分析物(除特殊表明外,都为500μm)存在下探针(5μm)对谷胱甘肽(300μm)识别后的荧光强度;柱状图代表的探针在不同测试条件下510nm与425nm处的荧光强度的比值;
[0055]
图6是探针(10μm)对高尔基体的共定位能力测试的细胞成像图;
[0056]
图7是经不同浓度探针处理和未经探针处理的hela细胞成像图。
[0057]
图8是采用mtt法测试探针对正常细胞和癌细胞的毒性数据图
具体实施方式
[0058]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行、清楚完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,不应该用来限制本发明的保护范围。基于本发明中的实施例,本领域的普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
[0059]
实施例1式(ⅱ)化合物的合成
[0060]
步骤1反应式如下:
[0061][0062]
步骤2反应式如下:
[0063][0064]
步骤3反应式如下:
[0065][0066]
实施方案1:
[0067]
具体操作步骤如下:
[0068]
步骤1反应为将环己烯酮和甲醛及催化剂4-二甲氨基吡啶加入到四氢呋喃中,然后在常温下搅拌反应36小时。步骤二是将式(ⅵ)化合物与三光气溶于甲苯中,120℃加热回流反应4小时,然后减压旋蒸除去溶剂得固体。步骤三反应为将252mg(2mmol)步骤1反应产物与576mg(2mmol)步骤2反应产物加入到二氯甲烷中,然后常温反应12小时,抽滤,减压旋蒸去除溶剂得到固体,然后,进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系(二氯甲烷:甲醇=60:1,v/v)为洗脱剂,可得到纯净的式(ⅱ)化合物350mg,产率为40%。
[0069]
实施方案2:
[0070]
具体操作步骤如下:
[0071]
步骤1反应为将环己烯酮和甲醛及催化剂4-二甲氨基吡啶加入到四氢呋喃中,然后在常温下搅拌反应36小时。步骤二是将式(ⅵ)化合物与三光气溶于甲苯中,120℃加热回流反应4小时,然后减压旋蒸除去溶剂得固体。步骤三反应为将252mg(2mmol)步骤1反应产物与1152mg(4mmol)步骤2反应产物加入到二氯甲烷中,然后常温反应12小时,抽滤,减压旋蒸去除溶剂得到固体,然后,进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系(二
氯甲烷:甲醇=60:1,v/v)为洗脱剂,可得到纯净的式(ⅱ)化合物380mg,产率为43%。
[0072]
实施方案3:
[0073]
具体操作步骤如下:
[0074]
步骤1反应为将环己烯酮和甲醛及催化剂4-二甲氨基吡啶加入到四氢呋喃中,然后在常温下搅拌反应36小时。步骤二是将式(ⅵ)化合物与三光气溶于甲苯中,120℃加热回流反应4小时,然后减压旋蒸除去溶剂得固体。步骤三反应为将252mg(2mmol)步骤1反应产物与1728mg(6mmol)步骤2反应产物加入到二氯甲烷中,然后常温反应12小时,抽滤,减压旋蒸去除溶剂得到固体,然后,进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系(二氯甲烷:甲醇=60:1,v/v)为洗脱剂,可得到纯净的式(ⅱ)化合物420mg,产率为48%。
[0075]
实施方案4:
[0076]
具体操作步骤如下:
[0077]
步骤1反应为将环己烯酮和甲醛及催化剂4-二甲氨基吡啶加入到四氢呋喃中,然后在常温下搅拌反应36小时。步骤二是将式(ⅵ)化合物与三光气溶于甲苯中,120℃加热回流反应4小时,然后减压旋蒸除去溶剂得固体。步骤三反应为将252mg(2mmol)步骤1反应产物与1728mg(6mmol)步骤2反应产物加入到二氯甲烷中,然后常温反应12小时,抽滤,减压旋蒸去除溶剂得到固体,然后,进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系(二氯甲烷:甲醇=60:1,v/v)为洗脱剂,可得到纯净的式(ⅱ)化合物37mg,产率为42%。
[0078]
产品结构表征:1hnmr(400mhz,cdcl3)δ(ppm):2.025-2.089(m,2h),2.449-2.529(m,4h),4.909(s,2h),7.097(s,1h),7.184(t,j=4hz,1h),7.482-7.569(m,3h),7.750-7.778(m,1h),8.051-8.075(m,2h),8.165-8.186(m,2h),8.228(d,j=2hz,1h);
13
cnmr(100mhz,cdcl3)δ(ppm):21.62,24.87,37.11,61.50,113.46,115.67,117.08,119.56,121.16,123.69,123.89,126.43,127.94,129.02,133.48,133.56,133.87,137.33,138.80,148.91,149.15,152.01,156.18,197.35.hrms(esi):calcdforc
24h19
f3n2o3[m+h]
+
441.1421;found,441.1421.
[0079]
实施例2:测试荧光探针的时间动力学
[0080]
配制一个荧光探针浓度为5μm的10ml的测试体系,然后将300μm的谷胱甘肽加入到测试体系中,摇晃均匀后立即用荧光光谱仪测试其荧光强度变化。上述测定是在乙醇:水=4:6(10mmpbs,ph7.4)体系中进行的,所使用的探针是实施例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0081]
由图1可以清楚地看到,当谷胱甘肽加入后,经检测18min左右425nm处的荧光强度达到最小值并保持不变,510nm处的荧光强度达到最大值并保持不变,这说明该探针与谷胱甘肽反应迅速,能够为谷胱甘肽的测定提供快速的分析方法。
[0082]
实施例3:测试荧光探针对于谷胱甘肽的浓度梯度(0-325μm)
[0083]
配置多个探针浓度为5μm的平行样品于10ml比色管中,然后将不同浓度(0-325μm)的谷胱甘肽加入到测试体系中,摇晃均匀后静置20分钟,然后用荧光光谱仪测试其荧光强度变化。上述测定是在乙醇:水=4:6(10mm pbs,ph7.4)体系中进行的,所使用的探针是实施例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0084]
用荧光光谱仪测试其荧光强度变化,从图2可以清晰的看出,在低浓度范围内,随着谷胱甘肽浓度的增加,425nm处的荧光强度降低,510nm处的荧光强度逐渐增强。并且,由
图3可以看出荧光探针(5μm)加入谷胱甘肽(0-75μm)之后,荧光强度比值(i
510
/i
425
)与加入谷胱甘肽的浓度之间呈现了良好的线性关系,这证明借助于该荧光探针能够对谷胱甘肽进行定量分析。
[0085]
实施例4:测试荧光探针的选择性
[0086]
配置多个探针浓度为5μm的平行样品于10ml比色管中,然后将不同的分析物(编号1-29分析物分析物分别是空白、组氨酸、丙氨酸、谷氨酸、丝氨酸、甘氨酸、精氨酸、缬氨酸、蛋氨酸、苏氨酸、亮氨酸、脯氨酸、钠离子、钾离子、钙离子、镁离子、铝离子、硫酸根、硝酸根、亚硝酸根、硫化氢、过氧化氢(100μm)、羟基自由基(100μm)、过氧化叔丁醇(100μm)、过氧化叔丁醇自由基(100μm)、超氧化钾(100μm)、次氯酸钠(100μm)、一氧化氮(100μm)、谷胱甘肽(300μm);除特殊标明外,其他分析物浓度均为100μm)加入到测试体系中,摇晃均匀后静置20分钟,然后用荧光光谱仪测试其荧光强度变化。上述测定是在乙醇:水=6:4(10mmpbs,ph7.4)体系中进行的,所使用的探针是实施例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0087]
从图4可以清晰的看出,只有谷胱甘肽加入的时候才能引起探针荧光强度比值(i
510
/i
425
)的强烈变化,而其他分析物的影响几乎可以忽略不计。实验证明,该探针对谷胱甘肽具有较高的选择性,有利于对谷胱甘肽的检测分析。
[0088]
实施例5:测试荧光探针的抗干扰能力
[0089]
配置多个探针浓度为5μm的平行样品于10ml比色管中,然后将不同的分析物(分析物分别是空白、组氨酸、丙氨酸、谷氨酸、丝氨酸、甘氨酸、精氨酸、缬氨酸、蛋氨酸、苏氨酸、亮氨酸、脯氨酸、钠离子、钾离子、钙离子、镁离子、铝离子、硫酸根、硝酸根、亚硝酸根、硫化氢;除特殊标明外,其他分析物浓度均为500μm)加入到测试体系中,然后分别加入谷胱甘肽(300μm),摇晃均匀后静置20分钟,用荧光光谱仪测试其荧光强度变化。上述测定是在乙醇:水=6:4(10mmpbs,ph7.4)体系中进行的,所使用的探针是实施例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0090]
从图5可以清晰的看出,其他分析物加入对荧光探针检测谷胱甘肽几乎没有干扰,实验证明,该探针对谷胱甘肽具有较高的抗干扰能力,有利于对谷胱甘肽的检测分析。
[0091]
实施例6:探针的检出限测试和计算
[0092]
采用荧光滴定法计算检出限。检测限计算公式如下:
[0093]
检出限=3σ/k
[0094][0095]
σ是空白探针的荧光强度的标准差,k是图3线性关系图的斜率。
[0096]
由此计算式(ⅱ)探针的检出限为0.49μm。
[0097]
实施例7:测试荧光探针对高尔基体的共定位能力测试
[0098]
先用谷胱甘肽孵育raw264.7巨噬细胞、hela细胞、hepg2细胞30分钟,再分别用探针和商业用的高尔基体探针(bodipytr神经酰胺)对上述细胞孵育40分钟。通过共聚焦显微镜观察探针的共定位能力,从图6可以看出该探针有较强的组织穿透性能,能够检测细胞内的谷胱甘肽,通过与高尔基体染料标记细胞对比,在叠加场可以看出两者染色位置基本完
全重合,表现出探针靶向和定位高尔基体的优秀能力。
[0099]
所使用的探针是实施例1中所制备的探针。
[0100]
实施例8:荧光探针在细胞中比率荧光成像测试
[0101]
将hela细胞分成四组,a组作为对照组,不作任何孵育处理,b组用探针(10μm)孵育20min;c组先用探针(10μm)孵育20min,再加谷胱甘肽(5mm)孵育30min;d组先用探针(10μm)孵育20min,再加谷胱甘肽(10mm)孵育30min。最后对四组细胞分别进行共聚焦显微成像,测试结果如图7所示。
[0102]
通过计算绿色通道与蓝色通道的比值,可以看出探针对细胞内的谷胱甘肽有良好的的比率荧光成像效果。
[0103]
所使用的探针是实施例1中所制备的探针。
[0104]
实施例9:荧光探针的选择性毒性测试
[0105]
将浓度为0、100、150和200μm的探针孵育raw264.7、hela、hepg2细胞18小时。最后通过计算统计平均值和标准偏差来估计细胞的存活率,从而考察探针对不同种类细胞的毒性。从图8中可以看出,相比于正常细胞,该探针对特定种类的癌细胞表现出较强细胞毒性,尤其是对hela细胞,细胞毒性最大。
[0106]
所使用的探针是实施例1中所制备的探针。
[0107]
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精神的前提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1