一种合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法
1.本发明属于手性锌配合物催化剂技术领域,涉及一种手性锌配合物、3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法,尤其涉及一种利用手性锌配合物高对映选择性地催化合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法。
背景技术:
2.手性3-羟基氧化吲哚是重要的天然产物和药物分子的前体,类似的结构可以通过3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的转化来合成,而且有机硼试剂具有易于获得、稳定性好、低毒性和操作简便等诸多优点。
3.因此,这些试剂被广泛用于不对称合成化学。过去,许多化学家利用手性布朗斯特酸和有机小分子催化剂通过靛红和烯丙基硼酸频哪醇酯反应合成3-羟基-3-烯丙基氧化吲哚。然而,很少有人通过路易斯酸催化此类不对称反应。而且利用手性布朗斯特酸和有机小分子催化剂通过靛红与联烯基硼酸频哪醇酯反应实现靛红的联烯化是非常困难的。现有技术中只有hoveyda课题组使用有机小分子催化剂成功发展了靛红与有机硼试剂的不对称烯丙基化和联烯化,但底物的拓展范围非常有限。
4.因此,为了扩大此类反应的底物范围,更好的拓展反应类型和反应方式,设计可用于靛红的烯丙基化和联烯化的新催化剂体系是非常必要的,同时该项工作具有极强的挑战性,也是本领域诸多具有前瞻性的研究人员广为关注的焦点之一。
技术实现要素:
5.有鉴于此,本发明要解决的技术问题在于提供一种手性锌配合物、3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法,特别是利用手性锌配合物高对映选择性地催化合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法,本发明提供的手性锌配合物催化剂能高效地催化有机硼试剂与靛红类化合物的不对称烯丙基化和联烯化反应。
6.本发明提供了一种手性锌配合物,具有如式(ci)或式(cii)所示的结构;
[0007][0008]
所述ar1、ar2各自独立地选自取代或未经取代的芳基。
[0009]
优选的,所述芳基包括苯基;
[0010]
所述取代的芳基中的取代基包括烷基、烷氧基和卤代烷基中的一种或多种;
[0011]
所述取代基的个数包括一个或多个。
[0012]
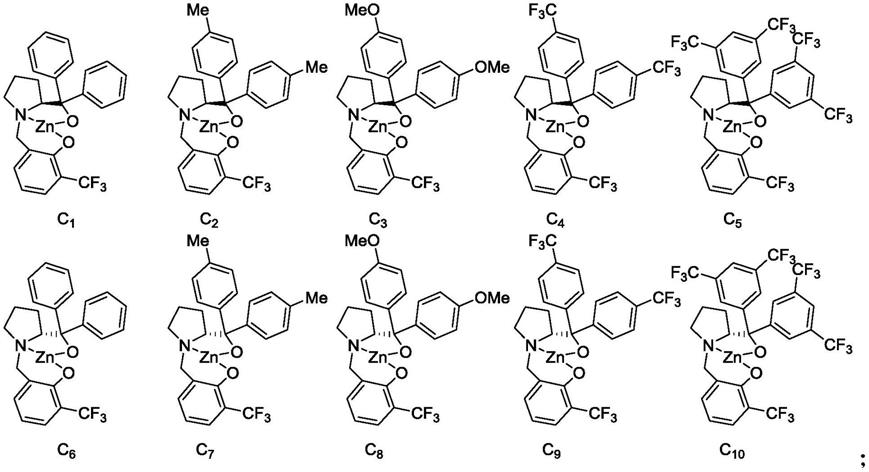
优选的,所述手性锌配合物具有如式(c1)~式(c
10
)所示的结构;
[0013][0014]
所述手性锌配合物的制备方法,包括以下步骤:
[0015]
a)将锌盐、碱性化合物和配体在溶剂中反应后,得到手性锌配合物。
[0016]
优选的,所述锌盐包括溴化锌、氟化锌、氯化锌、三氟甲烷磺酸锌、硝酸锌、硫酸锌和醋酸锌中的一种或多种;
[0017]
所述碱性化合物包括碳酸铯,碳酸锂,碳酸钠,碳酸钾,叔丁醇钾、三乙烯二胺、三乙胺、哌啶、1,8-二氮杂二环[5.4.0]十一碳-7-烯、n,n-二异丙基乙胺和n-乙基吗啉中的一种或多种;
[0018]
所述配体具有如式(li)或式(lii)所示的结构;
[0019][0020]
所述ar1、ar2各自独立地选自取代或未经取代的芳基。
[0021]
优选的,所述锌盐与碱性化合物的摩尔比为1:(0.5~3);
[0022]
所述锌盐与配体的摩尔比为1:(0.5~3);
[0023]
所述溶剂包括甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇和水中的一种或多种;
[0024]
所述反应的温度为-20~30℃;
[0025]
所述反应的时间为2~4h。
[0026]
本发明提供了上述技术方案任意一项所述的手性锌配合物在催化剂方面的应用。
[0027]
优选的,所述催化剂具体为合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的催化剂;
[0028]
所述合成的原料包括靛红类化合物和有机硼试剂;
[0029]
所述催化剂与所述靛红类化合物的摩尔比为(5~30):100;
[0030]
所述3-羟基-3-烯丙基氧化吲哚具有如式(iv)所示的结构;
[0031]
所述3-羟基-3-联烯基氧化吲哚具有如式(v)所示的结构;
[0032][0033]
所述r1各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0034]
所述r2各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0035]
所述r3各自独立地选自取代或未经取代的烷基、取代或未经取代的芳基。
[0036]
本发明还提供了一种3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法,包括以下步骤:
[0037]
1)将手性锌配合物催化剂、靛红类化合物、有机硼试剂、添加剂和溶剂进行混合反应后,得到3-羟基-3-烯丙基氧化吲哚或3-羟基-3-联烯基氧化吲哚;
[0038]
所述手性锌配合物催化剂包括权利要求1~5任意一项所述的手性锌配合物;
[0039]
所述靛红类化合物具有如式(i)所示的结构;
[0040][0041]
所述3-羟基-3-烯丙基氧化吲哚具有如式(iv)所示的结构;
[0042]
所述3-羟基-3-联烯基氧化吲哚具有如式(v)所示的结构;
[0043][0044]
所述r1各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0045]
所述r2各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0046]
所述r3各自独立地选自取代或未经取代的烷基、取代或未经取代的芳基。
[0047]
优选的,所述手性锌配合物催化剂的摩尔量为所述靛红类化合物的摩尔量的5%~30%;
[0048]
所述有机硼试剂包括烯丙基硼酸频哪醇酯和联烯基硼酸频哪醇酯;
[0049]
所述靛红类化合物与所述有机硼试剂的摩尔比为1:(1~5);
[0050]
所述添加剂包括甲醇、水、三氟乙醇、六氟异丙醇、苯酚、对氟苯酚、邻氟苯酚、对氯苯酚、邻氯苯酚、无水硫酸钠、分子筛和无水硫酸镁中的一种或多种;
[0051]
所述添加剂与所述靛红类化合物的摩尔比为(0.5~3):1。
[0052]
优选的,所述溶剂包括甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇和水中的一种或多种;
[0053]
所述混合反应的温度为-20~30℃;
[0054]
所述混合反应的时间为6~48h;
[0055]
所述步骤1)具体为:
[0056]
将锌盐、碱性化合物和配体在溶剂中反应后,得到包含手性锌配合物的反应混合物;
[0057]
向上述步骤得到的反应混合物中,加入靛红类化合物和有机硼试剂,进行混合反应后,得到3-羟基-3-烯丙基氧化吲哚或3-羟基-3-联烯基氧化吲哚。
[0058]
本发明提供了一种手性锌配合物,具有如式(ci)或式(cii)所示的结构。与现有技术相比,本发明针对现有的制备路线中难以通过路易斯酸催化此类不对称反应,特别是难以利用手性布朗斯特酸和有机小分子催化剂通过靛红与联烯基硼酸频哪醇酯反应实现靛红的联烯化过程,而且还存在底物拓展范围非常有限的局限性。本发明研究认为,当金属盐与联烯基硼酸频哪醇酯混合时,容易发生金属与硼之间的交换,形成金属-联烯基络合物或金属-炔丙基络合物,且这两种金属络合物的形成选择性可以通过配体来控制。金属-炔丙基络合物可以进一步与靛红反应合成3-羟基-3-联烯基氧化吲哚。
[0059]
本发明设计了一种具有特定结构的组成的手性锌配合物,该配合物具有如式(ci)或式(cii)所示的结构。本发明创造性的将该手性锌配合物作为催化剂,能高效地催化有机硼试剂与靛红类化合物的不对称烯丙基化和联烯化反应,能够以高对映选择性得到3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。
[0060]
实验结果表明,本发明首次采用上述(ci)或式(cii)所示的手性锌配合物作为催化剂,通过有机硼试剂对靛红类化合物的高对映选择性不对称烯丙基化和联烯化,制备3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。本发明首次将该路易斯酸催化剂体系应用于靛红的烯丙基化和联烯化,并获得了优异的对映选择性。
附图说明
[0061]
图1为本发明实施例1制备的目标产物(s)-3a的核磁共振氢谱图;
[0062]
图2为本发明实施例1制备的目标产物(s)-3a的核磁共振碳谱图;
[0063]
图3为本发明实施例2制备的目标产物(s)-3b的核磁共振氢谱图;
[0064]
图4为本发明实施例2制备的目标产物(s)-3b的核磁共振碳谱图;
[0065]
图5为本发明实施例3制备的目标产物(s)-3c的核磁共振氢谱图;
[0066]
图6为本发明实施例3制备的目标产物(s)-3c的核磁共振碳谱图;
[0067]
图7为本发明实施例4制备的目标产物(s)-3d的核磁共振氢谱图;
[0068]
图8为本发明实施例4制备的目标产物(s)-3d的核磁共振碳谱图;
[0069]
图9为本发明实施例5制备的目标产物(s)-3e的核磁共振氢谱图;
[0070]
图10为本发明实施例5制备的目标产物(s)-3e的核磁共振碳谱图;
[0071]
图11为本发明实施例6制备的目标产物(s)-3f的核磁共振氢谱图;
[0072]
图12为本发明实施例6制备的目标产物(s)-3f的核磁共振碳谱图;
[0073]
图13为本发明实施例7制备的目标产物(s)-3g的核磁共振氢谱图;
[0074]
图14为本发明实施例7制备的目标产物(s)-3g的核磁共振碳谱图;
[0075]
图15为本发明实施例8制备的目标产物(s)-3h的核磁共振氢谱图;
[0076]
图16为本发明实施例8制备的目标产物(s)-3h的核磁共振碳谱图;
[0077]
图17为本发明实施例9制备的目标产物(s)-3i的核磁共振氢谱图;
[0078]
图18为本发明实施例9制备的目标产物(s)-3i的核磁共振碳谱图;
[0079]
图19为本发明实施例10制备的目标产物(s)-3j的核磁共振氢谱图;
[0080]
图20为本发明实施例10制备的目标产物(s)-3j的核磁共振碳谱图。
具体实施方式
[0081]
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为了进一步说明本发明的特征和优点,而不是对发明权利要求的限制。
[0082]
本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。
[0083]
本发明所用原料,对其纯度没有特别限制,本发明优选为分析纯或3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚制备领域的常规纯度即可。
[0084]
本发明所有原料,其牌号和简称均属于本领域常规牌号和简称,每个牌号和简称在其相关用途的领域内均是清楚明确的,本领域技术人员根据牌号、简称以及相应的用途,能够从市售中购买得到或常规方法制备得到。
[0085]
本发明所有工艺,其简称均属于本领域的常规简称,每个简称在其相关用途的领域内均是清楚明确的,本领域技术人员根据简称,能够理解其常规的工艺步骤。
[0086]
本发明提供了一种手性锌配合物,具有如式(ci)或式(cii)所示的结构;
[0087][0088]
所述ar1、ar2各自独立地选自取代或未经取代的芳基。
[0089]
在本发明中,所述芳基优选包括苯基。
[0090]
在本发明中,所述取代的芳基中的取代基优选包括烷基、烷氧基和卤代烷基中的一种或多种,更优选为烷基、烷氧基或卤代烷基。
[0091]
在本发明中,所述取代基的个数优选包括一个或多个。
[0092]
在本发明中,所述手性锌配合物优选具有如式(c1)~式(c
10
)所示的结构;
[0093][0094]
在本发明中,所述手性锌配合物的制备方法,优选包括以下步骤:
[0095]
a)将锌盐、碱性化合物和配体在溶剂中反应后,得到手性锌配合物。
[0096]
在本发明中,所述锌盐优选包括溴化锌、氟化锌、氯化锌、三氟甲烷磺酸锌、硝酸锌、硫酸锌和醋酸锌中的一种或多种,更优选为溴化锌、氟化锌、氯化锌、三氟甲烷磺酸锌、硝酸锌、硫酸锌或醋酸锌。
[0097]
在本发明中,所述碱性化合物优选包括碳酸铯,碳酸锂,碳酸钠,碳酸钾,叔丁醇钾、三乙烯二胺、三乙胺、哌啶、1,8-二氮杂二环[5.4.0]十一碳-7-烯、n,n-二异丙基乙胺和n-乙基吗啉中的一种或多种,更优选为碳酸铯,碳酸锂,碳酸钠,碳酸钾,叔丁醇钾、三乙烯二胺、三乙胺、哌啶、1,8-二氮杂二环[5.4.0]十一碳-7-烯、n,n-二异丙基乙胺或n-乙基吗啉。
[0098]
在本发明中,所述配体优选具有如式(li)或式(lii)所示的结构;
[0099][0100]
所述ar1、ar2各自独立地优选选自取代或未经取代的芳基。
[0101]
在本发明中,所述式(li)或式(lii)所示的结构中,所述ar1、ar2的选择范围以及优选原则,原则上与前述式(ci)或式(cii)所示的结构中,ar1、ar2的选择范围以及优选原则,可以一一进行对应,在此不再一一赘述。
[0102]
在本发明中,所述锌盐与碱性化合物的摩尔比优选为1:(0.5~3),更优选为1:(0.75~2.0),更优选为1:(0.9~1.2)。
[0103]
在本发明中,所述锌盐与配体的摩尔比优选为1:(0.5~3),更优选为1:(0.75~2.0),更优选为1:(0.9~1.2)。
[0104]
在本发明中,所述溶剂优选包括甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇和水中的一种或多种,更优选为甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇或水。
[0105]
在本发明中,所述反应的温度优选为-20~30℃,更优选为0~30℃,更优选为20~30℃。
[0106]
在本发明中,所述反应的时间优选为2~4h,更优选为2~3h,更优选为2~2.5h。
[0107]
本发明提供了上述技术方案任意一项所述的手性锌配合物在催化剂方面的应用。
[0108]
在本发明中,所述催化剂具体优选为合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的催化剂。
[0109]
在本发明中,所述合成的原料优选包括靛红类化合物和有机硼试剂。
[0110]
在本发明中,所述催化剂与所述靛红类化合物的摩尔比优选为(5~30):100,更优选为(7.5~25):100,更优选为(10~20):100。
[0111]
在本发明中,所述3-羟基-3-烯丙基氧化吲哚优选具有如式(iv)所示的结构。
[0112]
在本发明中,所述3-羟基-3-联烯基氧化吲哚优选具有如式(v)所示的结构。
[0113][0114][0115]
在本发明中,所述r1各自独立地优选选自氢、烷基、烷氧基和卤素中的一种或多种,更优选为氢、烷基、烷氧基或卤素。
[0116]
在本发明中,所述r2各自独立地优选选自氢、烷基、烷氧基和卤素中的一种或多种,更优选为氢、烷基、烷氧基或卤素。
[0117]
在本发明中,所述r3各自独立地优选选自取代或未经取代的烷基、取代或未经取代的芳基。
[0118]
本发明提供了一种3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法,包括以下步骤:
[0119]
1)将手性锌配合物催化剂、靛红类化合物、有机硼试剂、添加剂和溶剂进行混合反应后,得到3-羟基-3-烯丙基氧化吲哚或3-羟基-3-联烯基氧化吲哚;
[0120]
所述手性锌配合物催化剂包括上述技术方案任意一项所述的手性锌配合物;
[0121]
所述靛红类化合物具有如式(i)所示的结构;
[0122]
[0123]
所述3-羟基-3-烯丙基氧化吲哚具有如式(iv)所示的结构;
[0124]
所述3-羟基-3-联烯基氧化吲哚具有如式(v)所示的结构;
[0125][0126]
所述r1各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0127]
所述r2各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种;
[0128]
所述r3各自独立地选自取代或未经取代的烷基、取代或未经取代的芳基。
[0129]
在本发明中,所述r1各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种,更优选为氢、烷基、烷氧基或卤素。
[0130]
在本发明中,所述r2各自独立地选自氢、烷基、烷氧基和卤素中的一种或多种,更优选为氢、烷基、烷氧基或卤素。
[0131]
在本发明中,所述r3各自独立地选自取代或未经取代的烷基、取代或未经取代的芳基。
[0132]
在本发明中,所述手性锌配合物催化剂的摩尔量优选为所述靛红类化合物的摩尔量的5%~30%,更优选为7.5%~25%,更优选为10%~20%。
[0133]
在本发明中,所述步骤1)具体优选为:
[0134]
将锌盐、碱性化合物和配体在溶剂中反应后,得到包含手性锌配合物的反应混合物;
[0135]
向上述步骤得到的反应混合物中,加入靛红类化合物和有机硼试剂,进行混合反应后,得到3-羟基-3-烯丙基氧化吲哚或3-羟基-3-联烯基氧化吲哚。
[0136]
在本发明中,所述有机硼试剂优选包括烯丙基硼酸频哪醇酯或联烯基硼酸频哪醇酯。具体的,所述烯丙基硼酸频哪醇酯优选具有式(ii)所示的结构。
[0137]
所述联烯基硼酸频哪醇酯优选具有式(iii)所示的结构。
[0138][0139]
在本发明中,所述靛红类化合物与所述有机硼试剂的摩尔比优选为1:(1~5),更优选为1:(1.5~4.5),更优选为1:(2~4),更优选为1:(2.5~3.5)。
[0140]
在本发明中,所述添加剂优选包括甲醇、水、三氟乙醇、六氟异丙醇、苯酚、对氟苯酚、邻氟苯酚、对氯苯酚、邻氯苯酚、无水硫酸钠、分子筛和无水硫酸镁中的一种或多种,更优选为甲醇、水、三氟乙醇、六氟异丙醇、苯酚、对氟苯酚、邻氟苯酚、对氯苯酚、邻氯苯酚、无水硫酸钠、分子筛或无水硫酸镁。
[0141]
在本发明中,所述添加剂与所述靛红类化合物的摩尔比优选为(0.5~3):1。
[0142]
在本发明中,所述溶剂优选包括甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇和水中的一种或多种,更优选为甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇或水。
[0143]
在本发明中,所述混合反应的温度优选为-20~30℃,更优选为-10~20℃,更优选为5~15℃。
[0144]
在本发明中,所述混合反应的时间优选为6~48h,更优选为10~36h,更优选为12~24h。
[0145]
本发明为完整和细化整体技术方案,更好的保证手性锌配合物的催化性能,进一步提高制备3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的的效果,上述3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法具体可以为以下步骤:
[0146]
本发明提出了一种高对映选择性地催化合成式(iv)的3-羟基-3-烯丙基氧化吲哚和式(v)的3-羟基-3-联烯基氧化吲哚的方法,可以包括以下步骤:
[0147]
1)将式(ci)或(cii)的手性锌配合物催化剂、式(i)的靛红类化合物、式(ii)的烯丙基硼酸频哪醇酯或式(iii)的联烯基硼酸频哪醇酯、添加剂分别加入到反应器中,在溶剂的存在下搅拌反应。
[0148]
2)将反应完成后的溶液分离提纯获得式(iv)的3-羟基-3-烯丙基氧化吲哚和式(v)的3-羟基-3-联烯基氧化吲哚。
[0149][0150]
其中,r1选自氢、烷基、烷氧基或卤素;
[0151]
r2选自氢、烷基、烷氧基或卤素;
[0152]
r3选自烷基、取代烷基、芳基或取代芳基。
[0153]
具体的,烷基包括但不限于c
1~6
烷基,如甲基、乙基、正丙基、异丙基、叔丁基、正戊基、正己基等。烯基包括但不限于c
1~6
烯基。
[0154]
具体的,烷氧基包括但不限于c
1~6
烷氧基、如甲氧基、乙氧基、异丙氧基等。
[0155]
具体的,取代烷基包括但不限于被卤素、苯基等取代的烷基。
[0156]
具体的,卤素包括氟、氯、溴和碘等。
[0157]
具体的,芳基可以选自苯基等。
[0158]
具体的,取代芳基包括但不限于被烷基、取代烷基、烯基、取代烯基、烷氧基、卤素、硝基等取代的芳基。
[0159]
具体的,在一些实施方案中,手性锌配合物催化剂选自以下中的一种或多种:
[0160][0161]
本发明涉及制备上述手性锌配合物催化剂,其制备方法包括:将二价锌盐(有时候也简称为锌盐)、碱与式(li)或(lii)的配体在溶剂中混合反应而得到式(ci)或(cii)的手性锌配合物催化剂。
[0162]
具体的,配体选自:
[0163][0164]
具体的,二价锌盐选自溴化锌、氟化锌、氯化锌、三氟甲烷磺酸锌、硝酸锌、硫酸锌、醋酸锌等。
[0165]
具体的,碱选自碳酸铯,碳酸锂,碳酸钠,碳酸钾,叔丁醇钾、三乙烯二胺、三乙胺、哌啶、1,8-二氮杂二环[5.4.0]十一碳-7-烯、n,n-二异丙基乙胺、n-乙基吗啉等。
[0166]
具体的,所述催化剂的摩尔量为所述靛红类化合物的摩尔量的5%~30%。
[0167]
具体的,所述靛红类化合物与所述有机硼试剂中硼酸酯的摩尔比为1:(1~5)。更具体的,所述靛红类化合物的起始浓度优选为0.1~0.3mol/l。
[0168]
在制备的手性锌配合物催化剂的存在下,将式(i)的靛红类化合物与式(ii)的烯丙基硼酸频哪醇酯或式(iii)的联烯基硼酸频哪醇酯、添加剂在溶剂中混合反应,得到式(iv)的3-羟基-3-烯丙基氧化吲哚和式(v)的3-羟基-3-联烯基氧化吲哚。
[0169]
具体地,本发明的制备3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法优选包括如下步骤:
[0170]
(a)将二价锌盐、碱与式(li)或(lii)的配体在溶剂中混合而得到包含式(ci)或(cii)的手性锌配合物催化剂的反应混合物;
[0171][0172]
(b)将式(i)的靛红类化合物、有机硼试剂和添加剂分别加入到步骤(a)获得的反应混合物中。
[0173]
更具体的:
[0174]
第一步:将二价锌盐(优选为三氟甲磺酸锌)、碱(优选为碳酸铯)与配体(优选为l2)在溶剂中混合搅拌2~4h(例如在-20℃~30℃的温度)而得到反应混合物,该反应混合物即为本发明所述的手性锌配合物,并且其可以直接用于下一反应步骤;
[0175]
第二步:将式(i)的靛红类化合物和式(ii)和式(iii)的有机硼试剂分别加入到上述步骤获得的反应混合物中。
[0176]
具体的,所述溶剂为本领域技术人员熟知的溶剂即可,并无特殊的限制,本发明中优选为甲苯、二甲苯、氯仿、二氯甲烷、四氢呋喃、丙酮、乙酸乙酯、1,4-二氧六环、甲基叔丁基醚、甲醇、乙醇、异丙醇和水中的一种或多种,更优选为丙酮或异丙醇。
[0177]
具体的,式(ii)所示的靛红类化合物在反应体系中的起始浓度优选为0.1~0.5mol/l,更优选为0.1~0.3mol/l;反应温度优选为-20℃~30℃,更优选为5℃~15℃。
[0178]
在步骤第二步的混合反应后,经分离提纯得到3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。
[0179]
具体的,所述分离提纯的方式包括柱色谱法、蒸馏和重结晶。所述分离提纯的方法为本领域技术人员熟知的方法即可,并无特殊的限制,本发明中优选为柱色谱法、液相色谱、蒸馏或重结晶等液液分离或固液分离方式,更优选为柱色谱法。所述柱层色谱的洗脱剂优选为乙酸乙酯与石油醚混合溶剂。所述乙酸乙酯与石油醚的体积比优选为1:10至1:1。在本发明中,优选将混合反应后的反应液用乙酸乙酯萃取后,再用饱和食盐水反萃取,旋干后,再进行柱色谱分离。
[0180]
本发明首次采用上述式(ci)或(cii)所示的手性锌配合物作为催化剂,通过有机硼试剂对靛红类化合物的高对映选择性不对称烯丙基化和联烯化制备3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。
[0181]
本发明上述步骤提供了一种利用手性锌配合物高对映选择性地催化合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法。本发明设计的具有特定结构的组成的手性锌配合物,该配合物具有如式(ci)或式(cii)所示的结构。本发明将该手性锌配合物作为催化剂,能高效地催化有机硼试剂与靛红类化合物的不对称烯丙基化和联烯化反应,能够以高对映选择性得到3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。
[0182]
实验结果表明,本发明首次采用上述(ci)或式(cii)所示的手性锌配合物作为催化剂,通过有机硼试剂对靛红类化合物的高对映选择性不对称烯丙基化和联烯化,制备3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚。本发明首次将该路易斯酸催化剂体系应用于靛红的烯丙基化和联烯化,并获得了优异的对映选择性。
[0183]
为了进一步说明本发明,下面结合实施例对本发明提供的一种手性锌配合物、3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的制备方法进行详细描述,但是应当理解,这些实施例是在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制,本发明的保护范围也不限于下述的实施例。
[0184]
条件优化:
[0185]
1.1制备手性锌复合物催化剂,所述手性锌复合物是由三氟甲磺酸锌、碳酸铯和配体l以1:1:1的摩尔比在溶剂中室温搅拌反应2h制备而成。
[0186]
1.2将上述式(i)所示的靛红类化合物和式(ii)或式(iii)所示的有机硼试剂分别加入到上述制备的催化剂中,催化剂与反应物靛红类化合物的摩尔比为1:10;溶剂的用量要保证靛红类化合物的初始浓度为0.1mol/l为准。
[0187]
1.3将反应后的溶液,用乙酸乙酯萃取,饱和食盐水反萃取,无水硫酸钠干燥,旋干,残留物用硅胶过柱,用石油醚/乙酸乙酯体系作为洗脱剂从体积比10/1-1/1过柱;在本发明中选用的洗脱剂为石油醚/乙酸乙酯混合溶剂,这并不是说其它洗脱剂体系就不是本发明的要求,只要符合洗脱目的的试剂均可以使用。
[0188]
反应方程式为:
[0189][0190]
实施例1
[0191]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),丙酮(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1a(16.1mg,0.1mmol),烯丙基硼酸频哪醇酯2a(42.0mg,0.25mmol)和10微升甲醇,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3a(98%收率,19.9mg,93%ee)。
[0192]
利用核磁共振对实施例1中得到的目标产物(s)-3a进行分析,得到其核磁共振氢谱图,如图1所示。
[0193]
参见图1,图1为本发明实施例1制备的目标产物(s)-3a的核磁共振氢谱图。
[0194]1h nmr(400mhz,cdcl3)δ7.39(dd,j=7.4,0.8hz,1h),7.32(ddd,j=7.8,6.3,1.2hz,1h),7.09(td,j=7.6,0.9hz,1h),6.82(d,j=7.8hz,1h),5.72
–
5.54(m,1h),5.16
–
5.02(m,2h),3.63(s,1h),3.16(s,3h),2.83
–
2.72(m,1h),2.62(dd,j=13.4,8.3hz,1h).
[0195]
利用核磁共振对实施例1中得到的目标产物(s)-3a进行分析,得到其核磁共振碳谱图,如图2所示。
[0196]
参见图2,图2为本发明实施例1制备的目标产物(s)-3a的核磁共振碳谱图。
[0197]
13
c nmr(100mhz,cdcl3)δ177.9,143.2,130.6,129.8,129.7,124.1,123.1,120.3,108.4,76.0,42.9,26.2.
[0198]
实施例2
[0199]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),丙酮(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1b(22.3mg,0.1mmol),烯丙基硼酸频哪醇酯2a(42.0mg,0.25mmol)和10微升甲醇,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3b(97%收率,25.7mg,89%ee)。
[0200]
利用核磁共振对实施例2中得到的目标产物(s)-3b进行分析,得到其核磁共振氢谱图,如图3所示。
[0201]
参见图3,图3为本发明实施例2制备的目标产物(s)-3b的核磁共振氢谱图。
[0202]1hnmr(400mhz,cdcl3)δ7.58
–
7.34(m,6h),7.25(t,j=7.7hz,1h),7.13(t,j=7.5hz,1h),6.80(d,j=7.9hz,1h),5.79
–
5.56(m,1h),5.24
–
5.07(m,2h),3.26(s,1h),2.92
–
2.66(m,2h)。
[0203]
利用核磁共振对实施例2中得到的目标产物(s)-3b进行分析,得到其核磁共振碳谱图,如图4所示。
[0204]
参见图4,图4为本发明实施例2制备的目标产物(s)-3b的核磁共振碳谱图。
[0205]
13
cnmr(100mhz,cdcl3)δ177.2,143.3,134.0,134.0,129.7,129.6,129.3,128.3,126.5,124.4,123.6,120.7,109.7,76.1,43.5.
[0206]
实施例3
[0207]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),丙酮(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1c(23.7mg,0.1mmol),烯丙基硼酸频哪醇酯2a(42.0mg,0.25mmol)和10微升甲醇,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3c(99%收率,27.6mg,95%ee)。
[0208]
利用核磁共振对实施例3中得到的目标产物(s)-3c进行分析,得到其核磁共振氢谱图,如图5所示。
[0209]
参见图5,图5为本发明实施例3制备的目标产物(s)-3c的核磁共振氢谱图。
[0210]1hnmr(400mhz,cdcl3)δ7.40(d,j=7.2hz,1h),7.33
–
7.22(m,5h),7.19(t,j=7.7hz,1h),7.06(t,j=7.5hz,1h),6.69(d,j=7.8hz,1h),5.71
–
5.54(m,1h),5.20
–
4.95(m,3h),4.71(d,j=15.7hz,1h),3.39(s,1h),2.82(dd,j=13.3,6.2hz,1h),2.71(dd,j=13.3,8.5hz,1h).
[0211]
利用核磁共振对实施例3中得到的目标产物(s)-3c进行分析,得到其核磁共振碳谱图,如图6所示。
[0212]
参见图6,图6为本发明实施例3制备的目标产物(s)-3c的核磁共振碳谱图。
[0213]
13
cnmr(100mhz,cdcl3)δ177.9,142.5,135.4,130.6,129.7,129.6,128.8,127.7,127.3,124.2,123.1,120.6,109.5,76.0,43.8,43.1.
[0214]
实施例4
[0215]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,
4.6mg,0.01mmol),丙酮(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1d(17.5mg,0.1mmol),烯丙基硼酸频哪醇酯2a(42.0mg,0.25mmol)和10微升甲醇,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3d(98%收率,21.3mg,90%ee)。
[0216]
利用核磁共振对实施例4中得到的目标产物(s)-3d进行分析,得到其核磁共振氢谱图,如图7所示。
[0217]
参见图7,图7为本发明实施例4制备的目标产物(s)-3d的核磁共振氢谱图。
[0218]1h nmr(500mhz,cdcl3)δ7.21(s,1h),7.12(d,j=7.8hz,1h),6.71(d,j=7.9hz,1h),5.73
–
5.58(m,1h),5.18
–
5.04(m,2h),3.15(s,3h),2.73(dd,j=13.4,6.3hz,1h),2.61(dd,j=13.4,8.4hz,1h),2.35(s,3h).
[0219]
利用核磁共振对实施例4中得到的目标产物(s)-3d进行分析,得到其核磁共振碳谱图,如图8所示。
[0220]
参见图8,图8为本发明实施例4制备的目标产物(s)-3d的核磁共振碳谱图。
[0221]
13
c nmr(125mhz,cdcl3)δ176.6,139.9,131.7,129.6,128.8,128.6,123.8,119.3,107.1,74.9,41.9,25.2,20.1.
[0222]
实施例5
[0223]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),丙酮(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1e(19.5mg,0.1mmol),烯丙基硼酸频哪醇酯2a(42.0mg,0.25mmol)和10微升甲醇,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3e(98%收率,23.2mg,95%ee)。
[0224]
利用核磁共振对实施例5中得到的目标产物(s)-3e进行分析,得到其核磁共振氢谱图,如图9所示。
[0225]
参见图9,图9为本发明实施例5制备的目标产物(s)-3e的核磁共振氢谱图。
[0226]1h nmr(500mhz,cdcl3)δ7.30(d,j=7.9hz,1h),7.07(dd,j=7.9,1.4hz,1h),6.82(d,j=1.4hz,1h),5.67
–
5.52(m,1h),5.15
–
5.01(m,2h),3.49(s,1h),3.15(s,3h),2.73(dd,j=13.4,6.4hz,1h),2.59(dd,j=13.3,8.4hz,1h).
[0227]
利用核磁共振对实施例5中得到的目标产物(s)-3e进行分析,得到其核磁共振碳谱图,如图10所示。
[0228]
参见图10,图10为本发明实施例5制备的目标产物(s)-3e的核磁共振碳谱图。
[0229]
13
c nmr(125mhz,cdcl3)δ177.9,144.5,135.5,130.1,128.1,125.1,122.9,120.7,109.2,75.6,42.8,26.3.
[0230]
实施例6
[0231]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),异丙醇(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1a(16.1mg,0.1mmol),联烯基硼酸频哪醇酯2b(41.5mg,0.25mmol)和10mg无水硫酸钠,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫
酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3f (99%收率,19.9mg,97%ee)。
[0232]
利用核磁共振对实施例6中得到的目标产物(s)-3f进行分析,得到其核磁共振氢谱图,如图11所示。
[0233]
参见图11,图11为本发明实施例6制备的目标产物(s)-3f的核磁共振氢谱图。
[0234]1h nmr(500mhz,acetone)δ7.38
–
7.31(m,2h),7.06(t,j=7.5hz,1h),6.96(d,j=7.8hz,1h),5.55(t,j=6.6hz,1h),5.28(s,1h),4.85(dd,j=11.5,6.7hz,1h),4.76(dd,j=11.5,6.6hz,1h),3.14(s,3h).
[0235]
利用核磁共振对实施例6中得到的目标产物(s)-3f进行分析,得到其核磁共振碳谱图,如图12所示。
[0236]
参见图12,图12为本发明实施例6制备的目标产物(s)-3f的核磁共振碳谱图。
[0237]
13
c nmr(125mhz,acetone)δ205.3,175.6,143.4,130.3,129.4,124.7,122.2,108.3,92.9,77.9,74.2,25.3.
[0238]
实施例7
[0239]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),异丙醇(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1b(22.3mg,0.1mmol),联烯基硼酸频哪醇酯2b(41.5mg,0.25mmol)和10mg硫酸钠,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3g(97%收率,25.5mg,97%ee)。
[0240]
利用核磁共振对实施例7中得到的目标产物(s)-3g进行分析,得到其核磁共振氢谱图,如图13所示。
[0241]
参见图13,图13为本发明实施例7制备的目标产物(s)-3g的核磁共振氢谱图。
[0242]1h nmr(500mhz,cdcl3)δ7.55
–
7.45(m,3h),7.44
–
7.38(m,3h),7.25(t,j=7.7hz,1h),7.13(t,j=7.5hz,1h),6.82(d,j=7.9hz,1h),5.62(t,j=6.5hz,1h),5.08
–
4.93(m,2h),3.77(s,1h).
[0243]
利用核磁共振对实施例7中得到的目标产物(s)-3g进行分析,得到其核磁共振碳谱图,如图14所示。
[0244]
参见图14,图14为本发明实施例7制备的目标产物(s)-3g的核磁共振碳谱图。
[0245]
13
c nmr(125mhz,cdcl3)δ206.8,174.9,142.0,132.9,128.7,128.6,128.1,127.2,125.4,124.0,122.6,108.8,91.9,79.1,73.6.
[0246]
实施例8
[0247]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),异丙醇(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1c(23.7mg,0.1mmol),联烯基硼酸频哪醇酯2b(41.5mg,0.25mmol)和10mg硫酸钠,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3h (99%收率,27.4mg,97%ee)。
[0248]
利用核磁共振对实施例8中得到的目标产物(s)-3h进行分析,得到其核磁共振氢
谱图,如图15所示。
[0249]
参见图15,图15为本发明实施例8制备的目标产物(s)-3h的核磁共振氢谱图。
[0250]1h nmr(500mhz,cdcl3)δ7.41(d,j=7.2hz,1h),7.32
–
7.17(m,6h),7.06(t,j=7.4hz,1h),6.70(d,j=7.8hz,1h),5.60(t,j=6.4hz,1h),5.07
–
4.90(m,3h),4.77(d,j=15.7hz,1h),3.88(s,1h).
[0251]
利用核磁共振对实施例8中得到的目标产物(s)-3h进行分析,得到其核磁共振碳谱图,如图16所示。
[0252]
参见图16,图16为本发明实施例8制备的目标产物(s)-3h的核磁共振碳谱图。
[0253]
13
c nmr(125mhz,cdcl3)δ207.7,176.8,142.1,135.3,129.8,129.6,128.8,127.7,127.2,124.8,123.2,109.6,92.9,80.1,74.7,43.9.
[0254]
实施例9
[0255]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),异丙醇(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1d(17.5mg,0.1mmol),联烯基硼酸频哪醇酯2b(41.5mg,0.25mmol)和10mg硫酸钠,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3i(99%收率,21.3mg,94%ee)。
[0256]
利用核磁共振对实施例9中得到的目标产物(s)-3i进行分析,得到其核磁共振氢谱图,如图17所示。
[0257]
参见图17,图17为本发明实施例9制备的目标产物(s)-3i的核磁共振氢谱图。
[0258]1h nmr(500mhz,cdcl3)δ7.23(s,1h),7.13(d,j=7.8hz,1h),6.73(d,j=7.9hz,1h),5.48(t,j=6.6hz,1h),5.03
–
4.90(m,2h),3.55(s,1h),3.18(s,3h),2.34(s,3h).
[0259]
利用核磁共振对实施例9中得到的目标产物(s)-3i进行分析,得到其核磁共振碳谱图,如图18所示。
[0260]
参见图18,图18为本发明实施例9制备的目标产物(s)-3i的核磁共振碳谱图。
[0261]
13
c nmr(125mhz,cdcl3)δ206.5,175.4,139.6,131.8,129.1,128.3,124.5,107.3,91.8,79.1,73.4,25.4,20.0.
[0262]
实施例10
[0263]
在一个10ml的反应管中依次加入三氟甲磺酸锌(3.6mg,0.01mmol),配体(l2,4.6mg,0.01mmol),异丙醇(1.0ml),碳酸铯(3.3mg,0.01mmol)在室温下搅拌反应2h。然后,在10℃下依次加入靛红1e(19.5mg,0.1mmol),联烯基硼酸频哪醇酯2b(41.5mg,0.25mmol)和10mg硫酸钠,反应完成后(tlc跟踪检测),用乙酸乙酯萃取,饱和食盐水萃取,无水硫酸钠干燥,旋干得到的残留物用石油醚/乙酸乙酯体系作为洗脱剂过柱得到白色固体(s)-3j(94%收率,22.1mg,93%ee)。
[0264]
利用核磁共振对实施例10中得到的目标产物(s)-3j进行分析,得到其核磁共振氢谱图,如图19所示。
[0265]
参见图19,图19为本发明实施例10制备的目标产物(s)-3j的核磁共振氢谱图。
[0266]1h nmr(500mhz,cdcl3)δ7.31(d,j=7.9hz,1h),7.08(dd,j=7.9,1.7hz,1h),6.85(d,j=1.6hz,1h),5.49(t,j=6.5hz,1h),5.03
–
4.90(m,2h),3.60(s,1h),3.18(s,3h).
[0267]
利用核磁共振对实施例10中得到的目标产物(s)-3j进行分析,得到其核磁共振碳谱图,如图20所示。
[0268]
参见图20,图20为本发明实施例10制备的目标产物(s)-3j的核磁共振碳谱图。
[0269]
13
c nmr(125mhz,cdcl3)δ206.7,175.5,143.3,134.7,126.5,124.8,122.0,108.4,91.3,79.2,73.1,25.5.
[0270]
以上对本发明所提供的一种利用手性锌配合物高对映选择性地催化合成3-羟基-3-烯丙基氧化吲哚和3-羟基-3-联烯基氧化吲哚的方法进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,包括最佳方式,并且也使得本领域的任何技术人员都能够实践本发明,包括制造和使用任何装置或系统,和实施任何结合的方法。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明专利保护的范围通过权利要求来限定,并可包括本领域技术人员能够想到的其他实施例。如果这些其他实施例具有不是不同于权利要求文字表述的结构要素,或者如果它们包括与权利要求的文字表述无实质差异的等同结构要素,那么这些其他实施例也应包含在权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1