一种新型双特异性嵌合抗原受体的构建及其应用
1.本发明属于免疫治疗技术领域,尤其涉及一种新型双特异性嵌合抗原受体的构建及其应用。
背景技术:
2.car-t疗法就是嵌合抗原受体-t细胞免疫疗法,英文全称chimeric antigen receptor-t cell immunotherapy。这是一种治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。car-t疗法,是指通过基因修饰技术,将带有特异性抗原识别结构域及t细胞激活信号的遗传物质转入t细胞,使t细胞直接与肿瘤细胞表面的特异性抗原相结合而被激活,通过释放穿孔素、颗粒酶素b等直接杀伤肿瘤细胞,同时还通过释放细胞因子募集人体内源性免疫细胞杀伤肿瘤细胞,从而达到治疗肿瘤的目的,而且还可形成免疫记忆t细胞,从而获得特异性的抗肿瘤长效机制。car疗法最早由gross等于上世纪80年末提出,此前lak、til、cik等免疫细胞疗法的出现,为car-t疗法的研究奠定了基础。至今除car-t疗法外,dc-cik、ctl、tcr-t、car-nk和car-巨噬细胞等也是免疫细胞疗法的研究方向,但从技术成熟度和应用前景来看,目前学术界和产业界的关注焦点仍是car-t疗法。car-t疗法在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,在体外和临床试验中表现出良好的靶向性、杀伤性和持久性,展示了巨大的应用潜力和发展前景。
3.急性淋巴细胞白血病(all)是一种起源于淋巴细胞的b系或t系细胞在骨髓内异常增生的恶性肿瘤性疾病。病变累及周围血液、淋巴结及全身脏器,属于血液瘤。复发/难治性b系淋巴细胞白血病(b-all)疾病的长期发病率仍然很高且预后较差。白细胞分化抗原(cd)指不同谱系的白细胞在正常分化成熟的不同阶段及活化过程中,出现或消失的细胞表面标记。cd分子作为表面标志物可用于鉴定细胞类型。cd19特异性表达于正常b细胞、b细胞前体细胞,不表达于造血干细胞及非造血细胞。作为一个理想的治疗靶点,靶向cd19的嵌合抗原受体t(car-t)细胞免疫治疗以及双特异性抗体药物已证明对淋巴细胞白血病具有显著临床疗效。临床研究已注册有多项试验以cd19作为car-t细胞靶标。靶向cd19(克隆:fmc63)的car-t细胞(kymriah,tisagenlecleucel,ctl019)在治疗b-all时,70%-90%的患者达到了完全缓解,但其中30%的患者最终因cd19阴性肿瘤细胞复发,这可能与肿瘤细胞的变异以及cd19阴性肿瘤细胞的扩大有关。靶抗原丢失或下调而引起的复发是当前car-t技术的关键漏洞。而cd22的表达仅限于b细胞谱系,大多数b-all患者也表达cd22,包括在接受cd19靶向免疫治疗后免疫逃逸复发的大多数患者仍表达cd22。针对cd19定向免疫治疗后cd19下调或cd19丢失而复发的患者,靶向cd22的car-t细胞可以介导相似的抗白血病效果及安全性。相对于单一靶向的car-t细胞,同时靶向cd19和cd22的car-t细胞能产生协同作用,克服患者之间靶抗原的差异表达及抗原逃逸引起的复发,在攻击肿瘤细胞的同时最大程度提高疗效和治疗时间,还可以解决单靶点治疗时靶点不均一表达及低表达的问题。靶向cd19及cd22的双特异性car-t细胞的结构设计(例如:scfv的克隆选择、scfv的顺序、连接肽的类型
及长度、并联串联或环状构型等等)对car-t细胞的功能发挥有重大影响。目前靶向cd19/cd22双特异性car-t细胞治疗在临床上应用不多,难点在于构建能同时识别并结合两个肿瘤抗原,且两个抗原结合域互不影响的car分子构型。多数双特异性car-t细胞为线性结构,而car-t细胞发挥功能形成免疫突触的间距如果过大将会使得抑制性磷酸酶进入破坏突触的形成,因此常导致位于car-t细胞远膜端的抗原结构域不能很好的结合抗原形成免疫突触,最终导致该远膜端靶点不能很好的行使靶向治疗作用。
4.目前,针对实体肿瘤的理想靶标较少,作为人类表皮细胞生长因子受体家族成员,her2在正常组织中低表达或者不表达,而在多种肿瘤(包括乳腺癌、肺癌、前列腺癌、头颈部鳞癌、胃肠道肿瘤和妇科肿瘤)中都有高表达,因此是car-t治疗的潜在靶点。人类表皮生长因子受体2也称之为erbb-2、c-erbb2或her2/neu。her2基因定位于染色体17q21全长28515bp,转录4624nt的mrna,编码一个185kda蛋白(p185)。作为首个靶向抗her2的人源化单克隆抗体,曲妥珠单抗影响了乳腺癌的诊治模式,是乳腺癌药物治疗的重大突破。2013年2月一种靶向her2的单克隆抗体和微管抑制剂偶联物ado-trastuzumab emtansine在美国获批。2018年12月国家食药局批准帕托珠单抗上市,帕托珠单抗是一种靶向her2的人源化单克隆抗体,通过抑制her2及其家族成员之间的配体依赖性异二聚化作用,阻断细胞周期并诱导其凋亡。另外,拉帕替尼、吡咯替尼、来那替尼等靶向her2或共靶向her2、egfr等受体的药物已在临床应用中取得良好结果。然而,上述获批的药物目前只是用于her2高表达的肿瘤患者,而对于her2低表达或者抗原异质性,以及靶向治疗造成的her2抗原逃逸等病人,其预后较差。有研究表明大约有30%her2过表达的肿瘤存在p95her2剪切体,该剪切体是her2阳性肿瘤的预后标志物,从而对已经上市的her2靶向药物包括曲妥珠单抗、帕托珠单抗和ado-trastuzumab emtansine的治疗产生耐药性,这种耐药性与her2表达阴性肿瘤细胞所表现的耐药性相似。此外,虽然目前已经有her2靶向的car-t细胞产品用于临床前和临床肿瘤病人的治疗,但在接受传统的car-t治疗之后,her2阳性细胞抗原发生突变,使car-t细胞无法成功识别肿瘤细胞,造成免疫逃逸,类似抗原修饰的问题还包括her2在肿瘤表面表达水平降低现象。有研究报道,肿瘤细胞表面的her2受体可以和包括其它her家族受体、met以及胰岛素样生长因子1受体(insulin-like growth factor 1receptor,igf1r)等受体相互作用,影响下游的信号转导功能。其中igf1r受体在急性白血病、乳腺癌等多种恶性肿瘤中均有异常表达,多种证据表明igf1r信号转导通路通过多种机制介导而参与了肿瘤的发生、有丝分裂、转移、血管发生和抗凋亡等过程、并涉及肿瘤的耐药、放疗抵抗及her2靶向治疗。igf1r与her2的协同作用,可以引发严重的肿瘤侵袭以及潜在的her2靶向治疗的耐药性。正是由于her2和igf1r之间的这种相互关系,靶向这两个酪氨酸激酶受体的联合治疗策略应运而生。目前已有报道,her2/igf1r联合靶向治疗的抗体和小分子抑制剂,在临床前的研究中显示了良好的抗肿瘤效果。her2/igf1r双靶向药物在乳腺癌中显示出显著的抗肿瘤活性,受体特异性更广的药物可能比单受体选择性药物更有效。虽然her2/igf1r双靶点抑制策略已经从分子机理等方面得到了详细的阐述,然而目前还没有将her2/igf1r协同靶向的思路拓展到免疫治疗甚至car-t治疗策略中,其主要的考虑在于igf1r表达的广谱性,以her2/igf1r为靶点的car-t细胞会潜在地引起机体靶向毒性。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种新型基于反向平行β折叠连接环状设计(β-stranded loop linker,bs loop)的双特异性car-t细胞,能同时靶向cd19和cd22抗原,或同时靶向her2和识别igf1r受体,使两个抗原结构域都能很好的发挥抗肿瘤作用,且互不影响,与其他线性串联或者已报道连接环状设计的的双特异性car-t细胞相比具有更强的肿瘤杀伤活性和t细胞活化增殖能力。
6.为了实现上述发明目的,本发明提供了以下技术方案:
7.本发明提供了一种嵌合抗原受体,所述嵌合抗原受体包括:抗原结合结构域、连接肽、铰链区、跨膜结构域、4-1bb共刺激信号传导区、cd3ζ信号传导结构域;所述抗原结合结构域包括双靶点识别分子。
8.优选的,所述双靶点识别分子包括纤维连接蛋白、亲和体、脂质运载蛋白、双环螺旋肽、锚蛋白重复蛋白、fyn激酶衍生物、kunitz结构域、e7免疫蛋白、淋巴细胞受体可变区、单域抗体、全抗体、抗体片段,以及核酸适体。
9.优选的,双靶点识别分子识别的抗原或受体选自cd19,cd20,cd22,cd33,bcma,cd123,cd133,cd38,cd39,cd138,cd73,cd30,cd7,cd33,cs1,cd56,cd4,cll1,lewis y,cd138,ror1,her2/neu,igf1r、egfr、her3、her4、vegfr-1、vegfr-2、vegfr-3,间皮素,gpc2,gpc3,cd33/il3ra,c-met,muc-1、psma,caix,cea、psca,gd2,糖脂f77,egfrviii,epcam,cd70,claudin 18.2,il-13,cd133,cd171,fap,fbp,pd-l1,nyeso-1,magea3中的任意两种。
10.优选的,所述连接肽包括g4s linker、long hinge lama linker、β-stranded loop linker,所述β-stranded loop linker的正反向氨基酸序列包括eetkkyqs和sytynyek。
11.优选的,所述抗原结合结构域包括抗cd19 scfv和抗cd22纳米抗体,或包括抗her2 scfv和能够识别igf1r的配体。
12.优选的,所述抗原结合结构域包括连接肽依次串联的抗cd22纳米抗体、抗cd19 scfv,或包括连接肽依次串联的抗cd19 scfv轻链可变区、抗cd22纳米抗体、抗cd19 scfv重链可变区,或包括连接肽依次串联的抗cd19 scfv重链可变区、抗cd22纳米抗体、抗cd19 scfv轻链可变区。
13.优选的,所述抗cd19 scfv包括抗cd19单克隆抗体fmc63,所述抗cd22纳米抗体包括抗cd22单克隆抗体cd22-nb25、cd22-nb35、cd22-nb45。
14.优选的,所述抗原结合结构域包括连接肽依次串联的能够识别igf1r的配体、抗her2 scfv,或包括连接肽依次串联的抗her2 scfv、能够识别igf1r的配体,或包括连接肽依次串联的抗her2 scfv轻链可变区、能够识别igf1r的配体、抗her2 scfv重链可变区,或包括连接肽依次串联的抗her2 scfv重链可变区、能够识别igf1r的配体、抗her2 scfv轻链可变区。
15.优选的,所述抗her2 scfv包括抗her2单克隆抗体4d5,所述能够识别igf1r的配体为adnectin。
16.优选的,所述嵌合抗原受体的氨基酸序列如seq id no:1-5和seq id no:10-12所示。
17.本发明还提供了一种重组慢病毒,所述重组慢病毒由包含上述嵌合抗原受体的病
毒载体与哺乳动物细胞共转染获得。
18.本发明还提供了一种car-t细胞,所述car-t细胞表达上述嵌合抗原受体;或所述car-t细胞的基因组中整合有上述嵌合抗原受体的氨基酸序列;或所述car-t细胞包括上述的重组慢病毒。
19.本发明还提供了一种上述嵌合抗原受体、上述重组慢病毒或上述car-t细胞在制备药物中的应用。
20.本发明有益效果
21.本发明提供的cd19/cd22 car-t和her2/igf1r car-t具有与两种靶抗原同时结合的能力,并且与单靶点car-t细胞相比具有更强的杀伤活性和细胞因子释放能力。
22.本发明提供的cd19/cd22 car-t和her2/igf1r car-t是基于反向平行β折叠连接环状设计(β-stranded loop linker,bs loop)的双特异性car-t细胞,两个抗原结构域都能很好的发挥作用,互不影响;与其他线性串联双特异性car-t细胞相比具有很好的杀伤活性、活化和细胞因子释放能力。
23.本发明首次将cd22纳米抗体与cd19 scfv连接构建cd19/cd22 car-t细胞,避免了传统使用两个scfv构建双特异性car-t时两个scfv间存在错配的可能性。而且纳米抗体与人抗体重链基因家族iii具有广泛的序列同一性,免疫原性低。与已上市kymriah(ctl019)的cd19单靶点car-t细胞相比,能够避免单一靶向治疗中由于cd19抗原丢失或下降导致的免疫逃逸。
24.本发明首次将igf1r与her2连接构建双特异性靶向car-t细胞,igf1r分子量小,不存在轻链和重链的错配问题。与现有技术中单靶点her2的car-t相比,能够避免单一靶向治疗中由于her2抗原丢失或下降导致的免疫逃逸。
附图说明
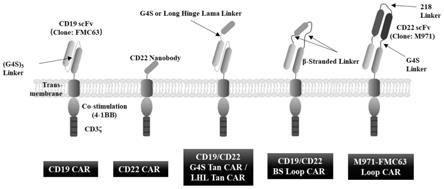
25.图1为六种靶向cd19及或cd22的car-t细胞结构示意图;
26.图2为六种靶向cd19及或cd22的car分子结构域示意图;
27.图3为六种靶向cd19及或cd22的car-t细胞表达结合能力;
28.图4为三种cd19/cd22双特异性car-t细胞对不同肿瘤细胞系的杀伤活性;
29.图5为三种cd19/cd22双特异性car-t细胞对不同病人原代肿瘤细胞的杀伤活性;
30.图6为靶向cd19/cd22的bs loop car-t与单靶点car-t细胞对不同肿瘤细胞系的杀伤活性;
31.图7为靶向cd19/cd22的bs loop car-t与单靶点car-t细胞对不同病人原代肿瘤细胞的杀伤活性;
32.图8为靶向cd19/cd22的bs loop car-t与m971-fmc63 loop car-t细胞对不同肿瘤细胞系的杀伤活性;
33.图9为靶向cd19/cd22的bs loop car-t与m971-fmc63 loop car-t细胞对不同病人原代肿瘤细胞的杀伤活性;
34.图10为三种cd19/cd22双特异性car-t细胞对不同肿瘤细胞系的细胞因子释放能力;
35.图11为三种cd19/cd22双特异性car-t细胞对不同病人原代肿瘤细胞的细胞因子
释放能力;
36.图12为靶向cd19/cd22的bs loop car-t与单靶点car-t细胞对不同肿瘤细胞系的细胞因子释放能力;
37.图13为靶向cd19/cd22的bs loop car-t与单靶点car-t细胞对不同病人原代肿瘤细胞的细胞因子释放能力;
38.图14为靶向cd19/cd22的bs loop car-t与m971-fmc63 loop car-t细胞对不同肿瘤细胞系的细胞因子释放能力;
39.图15为靶向cd19/cd22的bs loop car-t与m971-fmc63 loop car-t细胞对不同病人原代肿瘤细胞的细胞因子释放能力;
40.图16为三种cd19/cd22双特异性car-t细胞的活化水平比较;
41.图17为三种cd19/cd22双特异性car-t细胞的增殖能力比较;
42.图18为三种cd19/cd22双特异性car-t细胞的扩增能力比较;
43.图19为cd19/cd22 bs loop car-t与m971-fmc63 loop car-t细胞的体内肿瘤免疫逃逸的验证实验;
44.图20为双特异性car-t细胞的克服免疫逃逸的活体成像荧光定量结果;
45.图21为五种靶向her2及或识别igf1r的car-t细胞结构示意图;
46.图22为五种靶向her2及或识别igf1r的car分子结构域示意图;
47.图23为五种靶向her2及或识别igf1r的car-t细胞对不同肿瘤细胞系的杀伤活性;
48.图24为五种靶向her2及或识别igf1r的car-t细胞对mda-mb-231肿瘤细胞的细胞因子释放能力。
具体实施方式
49.本发明提供了一种嵌合抗原受体,所述嵌合抗原受体包括:抗原结合结构域、连接肽、铰链区、跨膜结构域、4-1bb共刺激信号传导区、cd3ζ信号传导结构域;所述抗原结合结构域包括双靶点识别分子。
50.本发明对于铰链区和跨膜结构域的具体种类没有特殊限定,采用本领域常规铰链区和跨膜结构域均可,在本发明具体实施例中,所述铰链区优选的为cd8铰链区,所述跨膜结构域优选的为cd8跨膜结构域。在本发明中,所述双靶点识别分子优选的包括纤维连接蛋白(adnectin)、亲和体、脂质运载蛋白(anticalin)、双环螺旋肽(bicyclic peptide)、锚蛋白重复蛋白(darpin)、fyn激酶衍生物(fynomer)、kunitz结构域、e7免疫蛋白、淋巴细胞受体可变区、单域抗体、全抗体、抗体片段,以及核酸适体(aptamer),所述双靶点识别分子识别的抗原或受体选自cd19,cd20,cd22,cd33,bcma,cd123,cd133,cd38,cd39,cd138,cd73,cd30,cd7,cd33,cs1,cd56,cd4,cll1,lewis y,cd138,ror1,her2/neu,igf1r、egfr、her3、her4、vegfr-1、vegfr-2、vegfr-3,间皮素,gpc2,gpc3,cd33/il3ra,c-met,muc-1、psma,caix,cea、psca,gd2,糖脂f77,egfrviii,epcam,cd70,claudin 18.2,il-13,cd133,cd171,fap,fbp,pd-l1,nyeso-1,magea3中的任意两种。
51.在本发明中,所述连接肽优选的包括g4s linker、long hinge lama linker和β-stranded loop linker(bs loop),所述抗原结合结构域优选的包括抗cd19 scfv和抗cd22纳米抗体,或包括抗her2 scfv和能够识别igf1r的配体。
scfv,或包括依次串联的抗her2 scfv、能够识别igf1r的配体。在本发明中,将能够识别igf1r的配体、抗her2 scfv或者将抗her2 scfv、能够识别igf1r的配体进行串联时,所述连接肽优选的选择g4s linker和β-stranded loop linker,所述g4s linker的氨基酸序列为(ggggs)n(n≥1)。
56.当采用g4s linker连接肽依次串联能够识别igf1r的配体adnectin和抗her2 scfv时,所述igf1r/her2 tan car的氨基酸序列如seq id no:10所示,当采用g4s linker连接肽依次串联抗her2 scfv和能够识别igf1r的配体adnectin时,所述her2/igf1r tan car的氨基酸序列如seq id no:11所示。
57.当抗原结合结构域为抗her2 scfv和识别igf1r的配体adnectin时,所述抗原结合结构域优选的还包括连接肽依次串联的抗her2 scfv轻链可变区(4d5 v
l
)、能够识别igf1r的配体、抗her2 scfv重链可变区(4d5 vh),或包括连接肽依次串联的抗her2 scfv重链可变区(4d5 vh)、能够识别igf1r的配体、抗her2 scfv轻链可变区(4d5 v
l
)。当采用bs loop连接肽依次串联抗her2 scfv轻链可变区(4d5 v
l
)、能够识别igf1r的配体、抗her2 scfv重链可变区(4d5 vh)时,所述her2/igf1r bs loop car的氨基酸序列如seq id no:12所示。
58.在本发明seq id no:10-12的氨基酸序列中,所述信号肽氨基酸序列如seq id no:10-12第1-21位所示;所述4d5 scfv轻链可变区氨基酸序列如seq id no:10第126-234位所示、如seq id no:11-12第22-130位所示;所述linker氨基酸序列如seq id no:12第131-138和第238-245位所示;所述结合igf1r的配体adnectin的氨基酸序列如seq id no:10第22-120位所示,如seq id no:11第274-372位所示,如seq id no:12第139-237位所示;所述4d5-scfv重链可变区氨基酸序列如seq id no:10第250-372位所示、如seq id no:11第146-268位所示、如seq id no:12第246-368位所示;所述cd8铰链区氨基酸序列如seq id no:10-11第373-417位所示、如seq id no:12第369-413位所示;所述cd8跨膜结构域氨基酸序列如seq id no:10-11第418-441位所示、如seq id no:12第414-437位所示;所述4-1bb共刺激信号传导区氨基酸序列如seq id no:10-11第442-483位所示如seq id no:12第438-479位所示;所述cd3ζ信号传导结构域氨基酸序列如seq id no:10-11第438-479位所示、如seq id no:12第480-591位所示。
59.在本发明具体实施例中,以单靶点igf1r car和her2 car为对比例,其中igf1r car的氨基酸序列如seq id no:9所示,her2 car的氨基酸序列如seq id no:13所示。所述信号肽氨基酸序列如seq id no:13第1-21位所示;所述4d5 scfv轻链可变区氨基酸序列如seq id no:13第22-130位所示;所述结合igf1r的配体adnectin的氨基酸序列如seq id no:9第22-120位所示;所述4d5-scfv重链可变区氨基酸序列如seq id no:13第146-268位所示;所述cd8铰链区氨基酸序列如seq id no:9第121-165位所示或如seq id no:13第121-165位所示;所述cd8跨膜结构域氨基酸序列如seq id no:9第166-189位所示或如seq id no:13第166-189位所示;所述4-1bb共刺激信号传导区氨基酸序列如seq id no:9第190-231位所示或如seq id no:13第190-231位所示;所述cd3ζ信号传导结构域氨基酸序列如seq id no:9第232-343位所示或如seq id no:13第232-343位所示。
60.本发明还提供了一种重组慢病毒,所述重组慢病毒由包含上述嵌合抗原受体的病毒载体与哺乳动物细胞共转染获得。
61.在本发明中,所述哺乳细胞优选的为293细胞、293t细胞或293ft细胞,最优选为
293ft细胞。本发明所述包含上述嵌合抗原受体的病毒载体优选为三质粒系统和四质粒系统,更优选为四质粒系统。本发明的四质粒系统含有一个具有目的基因的慢病毒表达质粒,两个包装质粒,一个编码包膜蛋白的质粒,增加了病毒载体的稳定性和安全性。
62.本发明还提供了一种car-t细胞,所述car-t细胞表达上述嵌合抗原受体;或所述car-t细胞的基因组中整合有上述嵌合抗原受体的氨基酸序列;或所述car-t细胞包括上述的重组慢病毒。
63.本发明对于car-t细胞的具体制备方法没有特殊限定,采用本领域常规car-t细胞的制备方法均可,在本发明具体实施例中,所述制备方法包括如下步骤:将目的基因片段克隆至plv载体,得plv-cd19/cd22(nb25)bs loop car或plv-her2/igf1r bs loop car,其中bs loop序列在扩增cd22纳米抗体与anti-igf1r(adnectin)的引物序列中引入,将包含嵌合抗原受体的病毒载体与哺乳细胞在转染试剂lipofectamine
tm 2000存在下,共转染得到的表达bs loop car的慢病毒,然后经polybrene转染试剂使病毒感染活化的t细胞,得到表达bs loop car的car-t细胞。
64.本发明还提供了一种上述嵌合抗原受体、上述氨基酸序列、上述重组慢病毒或上述car-t细胞在制备药物中的应用。在本发明中,所述药物优选的包括抗肿瘤免疫治疗的药物,所述药物治疗的疾病包括cd19阳性和/或cd22阳性疾病、her2阳性和/或igf1r阳性疾病。
65.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。以下各实施例中,实验所用试剂耗材均可购买,也可参照现有公开的技术制备;未标明来源和规格的均为市售可得;未详细描述的各种过程和方法是本领域中公知的常规方法。
66.实施例1
67.cd19/cd22 bs loop car-t细胞的制备
68.cd19/cd22(nb25)bs loop car(seq id no:3)t细胞的制备
69.在已上市的cd19 car-t细胞(kymriah)基础上,使用正向引物序列ggtaccgcggccgcccggggatccatggccttaccagtgaccgccttgctcctgccg与反向引物序列tagtctcctctgtgatctccagcttggtcc将cd19 scfv区域v
l
片段扩增出来、使用正向引物序列aagctggagatcacagaggagactaaaaaatatcagtctgaagtgcaactggtggaatc与反向引物序列ctgcagtttcacctctttttcgtaattataagtgtatcttacacttataattacgaaaaaagaagaactcacagtcacctggg将cd22纳米抗体区域片段扩增出来、使用正向引物序列ttacgaaaaagaggtgaaactgcaggagtc与反向引物序列caagggcgcccagatgtagatatcacaggcgaagtccagccccctcgtgtg,将cd19 scfv区域v
l
片段、cd22纳米抗体区域片段以及cd19 scfv区域vh片段扩增出来。以上三个pcr产物经过重叠pcr扩增后重组为目的基因片段。其中cd19/cd22 bs loop car序列包含在上述引物序列中(大写部分),pcr体系和反应条件分别如表1和表2所示。
70.表1.pcr体系
[0071][0072]
表2.pcr反应条件
[0073][0074]
pcr反应结束后将pcr产物移入1.5ml离心管中,加入5倍体积的cp buffer,吹打均匀后转移至离心吸附柱内,室温14000g离心1分钟。加入wash buffer室温14000g离心1分钟,将吸附柱放入一个新的1.5ml离心管内,加入50μl灭菌的去离子水于吸附柱中间,室温静置2分钟后离心收集后定量dna浓度,-20℃储存。载体采用37℃水浴酶切(如表3所示)过夜后,样品上样2%琼脂糖凝胶电泳,并切胶回收。
[0075]
表3.酶切体系
[0076][0077]
酶切后的载体及目的序列的pcr产物按照质摩尔比1:2的比例混合好,添加重组酶,在50℃反应5分钟后立即置于冰上,进行转化。经过重组酶重组,所获载体命名为plv-cd19/cd22 bs loop car。
[0078]
质粒转化
[0079]
感受态细胞于-80℃冰箱取出,冰上解冻。加质粒于感受态细胞中,食指轻敲tube管混匀后置冰上10min。42℃水浴热激45
″
后立即取出置冰上2min。加soc培养基混匀,37℃,150rpm摇1h复苏细胞。吸取100l菌液涂布含氨苄抗生素的lb固体培养基平板上,37℃过夜培养。挑取单克隆菌落送测序,验证质粒序列正确后提取质粒。
[0080]
大提质粒
[0081]
收菌:将过夜培养的菌液于8000rpm离心15分钟,彻底倒掉上清。
[0082]
重悬:将全部菌液沉淀重悬于5ml含rnasea的细胞悬浮液中。
[0083]
裂解:加入细胞裂解液,将离心管颠倒数次混匀后使细菌充分裂解。
[0084]
中和:加入中和缓冲液,将离心管温和颠倒数次混匀后离心。
[0085]
沉淀:收集上清加入异丙醇离心,并采用75%乙醇洗涤沉淀晾干。
[0086]
去除rna:将沉淀溶于含rnaesa的悬浮液中,转移至1.5ml离心管。
[0087]
去除杂质:加杂质清除液,颠倒混匀离心,吸除上清。
[0088]
沉淀:用高盐溶液溶解沉淀,加入无水乙醇静置离心,吸除上清。
[0089]
洗涤:加入75%乙醇洗涤沉淀离心。
[0090]
干燥:将离心管开盖超净工作台内放置,使乙醇完全挥发。
[0091]
溶解:加入去离子水溶解沉淀,置于-20℃保存。
[0092]
pbmc提取
[0093]
取适量ficoll于离心管内。将血液缓慢倾斜加入到装有ficoll-poque的离心管内,会看到分层。27℃,2000rpm离心30min。离心结束后会观察到分为3层,上层为血清,中层为ficoll分层液,下层为红细胞、粒细胞层,在上层与中层间有一白膜,即pbmc。用巴氏吸管小心吸取白膜状分层,加入到离心管内。加入约5倍体积dpbs,上下颠倒混匀。27℃,2000rpm离心10min,离心后去上清。加入10mlrpmi-1640培养基重悬,27℃,2000rpm,离心10min,离心后去上清。用5ml rpmi-1640培养基重悬后加入到t25培养瓶内。37℃培养1小时去掉贴壁细胞,1小时后吸取悬浮细胞计数,按照1
×
108/100μl/管冻存。
[0094]
pbmc复苏及激活
[0095]
10mlaim v培养基中加入解冻的pbmc,27℃1500rpm离心5min弃上清,aim-v培养基重悬计数;cd3/cd28磁珠,磁珠先用2ml含5%fbs的pbs洗一次,再用2ml aim v培养基洗一次。取1
×
106个t细胞,加入磁珠和aim v培养基,加入il-2终浓度为300iu/ml,于24孔板内培养48小时。
[0096]
慢病毒制备
[0097]
调整293ft细胞密度为0.75
×
106/ml,2ml/孔铺板;48h后,待贴壁细胞293ft达到90%生长密度后;准备包括慢病毒质粒以及lipofectamine
tm 2000转染试剂a和b液。将a液加入b液中,混合物在室温下孵育30min,并顺时针垂直滴加在对应孔内;48h后取病毒上清,离心5min去除细胞碎片。
[0098]
病毒转导t细胞
[0099]
pbmc活化48h后计数,配制每孔细胞悬液+病毒,以及终浓度为300iu/ml的il-2溶液,加入终浓度6μg/ml的polybrene,35℃,1000g,离心90min后放于37℃培养箱;转导15h后换液,采用aim-v培养基重悬细胞,培养基内提前补加il-2,终浓度为300iu/ml。重新加入24孔板中培养;感染2-4天后的pbmc培养基变黄后,置换为新鲜培养基后转入6孔板继续扩大培养,转导7天后去磁珠。
[0100]
实施例2
[0101]
cd19和cd22抗原的荧光标记和car-t细胞表达量的检测
[0102]
浓缩抗原蛋白至0.5-1mg/ml,加入modifier reagent,温和混匀后加入到apc或者pe染料干粉中,温和混匀后避光室温放置3小时。加quencher终止,混匀后即可使用。
[0103]
使用100nm浓度的cd19-apc及cd22-pe抗原分别与cd19 car(氨基酸序列如seq id no:6所示)、cd22 car(cd22(nb25),氨基酸序列如seq id no:7所示)、cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22 lhl tan car(氨基酸序列如seq id no:2所示)、m971-fmc63 loop car
(氨基酸序列如seq id no:8所示)共六种car-t细胞在冰上共孵育(上述六种car-t细胞的结构示意图和分子结构示意图分别如图1和图2所示):facs重悬car-t细胞后加cd19-apc及cd22-pe抗原。1小时后使用pbs洗两遍,重悬于pbs中,流式分析技术检测car-t细胞与抗原结合情况,结果如图3所示。
[0104]
由图3可以看出,cd19 car只能和cd19抗原结合,cd22 car只能和cd22抗原结合,cd19/cd22 bs loop car、cd19/cd22 g4s tan car、cd19/cd22 lhltan car和m971-fcm63 loop car四种双特异性car-t细胞能同时结合cd22抗原和cd19抗原,其中cd19/cd22 bs loop car结合百分比最高。
[0105]
实施例3
[0106]
不同结构cd19/cd22双靶点car-t细胞的肿瘤细胞杀伤分析
[0107]
肿瘤细胞:nalm6-gl,nalm6-gl-ko19,nalm6-gl-ko22,k562-cd19,k562-cd22,k562或病人原代肿瘤细胞(四位b细胞急性淋巴细胞白血病病人原代肿瘤细胞)。
[0108]
car-t细胞:将实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22lhltan car(氨基酸序列如seq id no:2所示)三种cd19/cd22双特异性car-t细胞,提前24h饥饿处理去除il-2。
[0109]
car-t细胞与肿瘤细胞的效靶比(e:t)为10:1、5:1、2.5:1、1.25:1、0.625:1、0.3125:1,或者1:3、1:1、3:1。
[0110]
1)细胞计数:肿瘤细胞和car-t细胞重悬至rpmi-1640培养基中计数。若肿瘤细胞不易重悬,易结块,可另其沉降一段时间后取上清混匀后进行细胞计数和后续实验。
[0111]
2)cfse染色:取5
×
106个肿瘤细胞,在10ml离心管内染色,用0.5ml染色液重悬细胞,即细胞浓度为107/ml,37℃,染色15min后,加入fbs(中和)作用5min后,补加培养基至4ml,离心去上清后,再用10ml培养基重悬离心,共洗3次。
[0112]
3)细胞稀释:car-t细胞稀释至2
×
106/ml浓度。吸取1.5ml于24孔板内,梯度2倍稀释至1
×
106/ml、0.5
×
106/ml、0.25
×
106/ml、0.125
×
106/ml、0.0625
×
106/ml;每个梯度每种car-t需500μl。
[0113]
4)另取2ml染色及未染色肿瘤细胞分别于24孔板内培养,用于后续流式调电压。
[0114]
5)流式检测:24孔板内未染色肿瘤细胞1ml一管,加入7-aad紫外30min后95℃10min,做阳性对照;24孔板内未染色肿瘤细胞,1ml一管用于流式调零;24孔板内cfse染色后肿瘤细胞,1ml一管用于流式调电压;28mlpbs加280μl(100倍稀释)7-aad混匀后,96孔板每孔100μl,摇床摇30min后检测。
[0115]
6)流式分析:计算活肿瘤细胞个数,计算杀伤效率。活肿瘤细胞为cfse
+
7-aad-。计算公式:%lysis=(对照组活肿瘤细胞数-实验组活肿瘤细胞数)/对照组活肿瘤细胞数
×
100,结果如图4和图5所示。由图4可以看出,三种双特异性car-t细胞中,cd19/cd22 g4s tan car和cd19/cd22 bs loop car二者杀伤活性没有显著差异,但cd19/cd22 lhltan car对阴性细胞(k562)的非特异性杀伤较强。由图5可以看出,cd19/cd22 bs loop car对病人原代肿瘤细胞的杀伤活性更强。
[0116]
实施例4
[0117]
cd19/cd22 bs loop car-t与单靶点car-t的肿瘤细胞杀伤分析
[0118]
与实施例3的区别是car-t细胞为实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19 car(氨基酸序列如seq id no:6所示)和cd22 car(cd22(nb25),氨基酸序列如seq id no:7所示),四位b细胞急性淋巴细胞白血病病人原代肿瘤细胞不同,其余均同实施例3。结果如图6和图7所示。
[0119]
由图6可以看出,cd19 car只能杀伤cd19阳性肿瘤细胞,cd22 car只能杀伤cd22阳性肿瘤细胞,而cd19/cd22 bs loop car可以同时杀伤cd19及/或cd22阳性的肿瘤细胞。对于nalm6双阳性肿瘤细胞和k562-cd19肿瘤细胞,cd19/cd22 bs loop car比单靶点car-t细胞有更高的杀伤活性。由图7可以看出,cd19/cd22 bs loop car比单靶点car-t细胞对病人原代肿瘤细胞有更好的杀伤活性。
[0120]
实施例5
[0121]
cd19/cd22 bs loop car-t与已报道cd19/cd22 car-t的肿瘤细胞杀伤分析
[0122]
与实施例3的区别是car-t细胞为实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)和m971-fmc63 loop car(氨基酸序列如seq id no:8所示),肿瘤细胞为nalm6-gl,nalm6-gl-ko19,nalm6-gl-ko22,k562或病人原代肿瘤细胞(四位b细胞急性淋巴细胞白血病病人原代肿瘤细胞);其余均同实施例3。结果如图8和图9所示。
[0123]
由图8和图9可以看出,本发明cd19/cd22 bs loop car-t对于肿瘤细胞和原代病人肿瘤细胞的杀伤活性比线性连接的m971-fmc63 loop car-t细胞更强。
[0124]
实施例6
[0125]
不同结构cd19/cd22双靶点car-t的细胞因子释放分析
[0126]
肿瘤细胞:nalm6,nalm6-ko19,nalm6-ko22,k562-cd19,k562-cd22,k562或病人原代肿瘤细胞(四位b细胞急性淋巴细胞白血病病人原代肿瘤细胞)。
[0127]
car-t细胞:将实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22 lhltan car(氨基酸序列如seq id no:2所示)三种cd19/cd22双特异性car-t细胞,提前24h饥饿处理去除il-2。
[0128]
car-t细胞与肿瘤细胞的效靶比(e:t)=1:3。
[0129]
car-t细胞离心后去上清,重悬后计数,稀释至0.2
×
106/ml浓度;肿瘤细胞离心去上清,重悬后计数,稀释至0.6
×
106/ml;将car-t细胞与肿瘤细胞等体积混合均匀。共培养24h后收集上清,-20℃冻存用于后续检测细胞因子。
[0130]
采用il-2,ifn-γ和tnf-αelisa检测试剂盒用于细胞因子的检测,具体如下:将captureantibody包被酶标板,室温放置4h或者4℃过夜;使用wash buffer清洗3次后,采用elisa/elisapot diluent(1
×
)对酶标板进行室温2h或4℃封闭过夜。配制并且加入il-2,ifn-γ和tnf-α标准品,同时对car-t细胞/肿瘤细胞上清液进行稀释并加入酶标板,37℃反应2小时后,用wash buffer清洗板5次。稀释并加入detectionantibody溶液,室温孵育1-2h;继续采用wash buffer清洗板5次,并加入streptavidin-hrp溶液,室温30min-1h后,洗板5次。加入1
×
tmd溶液显色,并采用stop solution终止反应,使用酶标仪分别检测450nm波长处吸光度。
[0131]
结果如图10和图11所示。由图10可以看出,本发明cd19/cd22 bs loop car相比于cd19/cd22 g4s tan car和cd19/cd22 lhl tan car,有更高的细胞因子释放水平。图11所
示为双特异性car-t细胞释放细胞因子的情况,由结果可以看出本发明cd19/cd22 bs loop car对于名为pengshushen病人的肿瘤细胞有更高的细胞因子释放。
[0132]
实施例7
[0133]
cd19/cd22 bs loop car-t与单靶点car-t的细胞因子释放分析
[0134]
与实施例6的区别在于,car-t细胞为实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19 car(氨基酸序列如seq id no:6所示)和cd22 car(cd22(nb25),氨基酸序列如seq id no:7所示),其余均同实施例6。结果如图12和图13所示。
[0135]
由图12可以看出,本发明cd19/cd22 bs loop car与cd22及/或cd19阳性肿瘤细胞共培养时都能释放细胞因子,cd19/cd22 bs loop car相比于单靶点car-t细胞,有更高的细胞因子释放水平,由图13可以看出,本发明cd19/cd22 bs loop car相比于单靶点car-t细胞,对原代病人肿瘤细胞有更高的细胞因子释放水平。
[0136]
实施例8
[0137]
cd19/cd22 bs loop car-t与已报道cd19/cd22 car-t的细胞因子释放分析
[0138]
与实施例6的区别在于,car-t细胞为实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)和m971-fmc63 loop car(氨基酸序列如seq id no:8所示),肿瘤细胞为nalm6-gl,nalm6-gl-ko19,nalm6-gl-ko22,k562和病人原代肿瘤细胞(四位b细胞急性淋巴细胞白血病病人原代肿瘤细胞);其余均同实施例6。结果如图14和图15所示。
[0139]
由图14和图15可以看出,与m971-fmc63 loop car-t细胞相比,本发明cd19/cd22 bs loop car对于肿瘤细胞和原代病人肿瘤细胞具有更高的细胞因子释放水平。
[0140]
实施例9
[0141]
不同结构cd19/cd22双靶点car-t细胞的活化分析
[0142]
肿瘤细胞:nalm6,k562-cd19,k562-cd22,k562。
[0143]
car-t细胞:将实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22 lhltan car(氨基酸序列如seq id no:2所示),提前24h饥饿处理去除il-2。
[0144]
car-t细胞与肿瘤细胞的效靶比(e:t)=1:3。
[0145]
将car-t细胞离心重悬后计数,稀释至0.2
×
106/ml浓度;肿瘤细胞离心重悬后计数,稀释至0.6
×
106/ml;car-t细胞与肿瘤细胞等体积混合均匀,共培养24h后,细胞用于后续检测cd25的表达。流式抗体cd25-fitc冰上染色1h后使用facs洗两遍后重悬,流式检测。
[0146]
活化结果如图16所示,由图16可以看出,三种双特异性car-t细胞与靶细胞共培养后,均有cd25活化maker的表达。其中,cd19/cd22 bs loop car的cd25表达量百分比最高,活化程度最高。
[0147]
实施例10
[0148]
不同结构cd19/cd22双靶点car-t细胞的增殖速度分析
[0149]
肿瘤细胞:nalm6,k562-cd19,k562-cd22,k562。
[0150]
car-t细胞:将实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22 lhltan car(氨基酸序列如seq id no:2所示),提前24h饥饿处理去除il-2。
[0151]
car-t细胞与肿瘤细胞的效靶比(e:t)=1:3。
[0152]
car-t细胞采用cfse荧光标记试剂盒进行标记,并调整密度至0.2
×
106/ml浓度;肿瘤细胞离心去上清,重悬后计数,稀释至0.6
×
106/ml,car-t细胞与肿瘤细胞等体积混合均匀。培养6天后,细胞用于流式检测cfse荧光的强度。以不添加肿瘤细胞的car-t细胞作为对照组。
[0153]
活化结果如图17所示,三种双特异性car-t细胞与靶细胞共培养后,均有被刺激扩增。cfse膜结合型染料,当细胞进行分裂增殖时,具有荧光的胞质蛋白被平均分配到第二代细胞中,这样与第一代细胞相比,其荧光强度便会减弱至一半;以此类推,分裂得到的第三代细胞的荧光强度便会比第二代细胞再次减弱。这种现象可以在488nm的激发光下,采用流式细胞仪检测分析,通过检测到细胞荧光强度不断的降低,进一步分析得出细胞分裂增殖的情况。其中,所示数值为未分裂细胞百分比,由此可见,数值越小扩增能力越强,因此cd19/cd22 bs loop car-t细胞的扩增能力最高。
[0154]
实施例11
[0155]
不同结构cd19/cd22双靶点car-t细胞的增殖数量分析
[0156]
肿瘤细胞:nalm6-gl,nalm6-gl-ko19,nalm6-gl-ko22,k562。
[0157]
car-t细胞:将实施例2所记载cd19/cd22 bs loop car(氨基酸序列如seq id no:3所示)、cd19/cd22 g4s tan car(氨基酸序列如seq id no:1所示)、cd19/cd22 lhltan car(氨基酸序列如seq id no:2所示),提前24h饥饿处理去除il-2。
[0158]
car-t细胞与肿瘤细胞的效靶比(e:t)=1:1。
[0159]
car-t细胞根据pkh26荧光标记试剂盒步骤标记,并调整密度至1
×
106/ml浓度;nalm6-gl,nalm6-gl-ko19,nalm6-gl-ko22三种肿瘤细胞自带gfp荧光,k562细胞根据实施例10步骤标记cfse荧光。四种肿瘤细胞计数,稀释至1
×
106/ml,car-t细胞与肿瘤细胞等体积混合均匀。培养6天后,流式检测,其中gfp阴性或cfse阴性而pkh26阳性即为car-t细胞。计数car-t细胞个数做car-t细胞扩增图。
[0160]
扩增结果如图18所示,三种双特异性car-t细胞与靶细胞共培养后,均有被刺激扩增。其中,与靶细胞共培养后,cd19/cd22 bs loop car-t细胞数量增加显著性更好,因此cd19/cd22 bs loop car-t扩增能力最高。
[0161]
实施例12
[0162]
cd19/cd22双特异性car-t细胞的体内免疫逃逸杀伤实验
[0163]
将nsg小鼠(6-8周龄)饲养并在无特定病原体的条件下处理。将小鼠采用尾静脉注射带有荧光素酶的nalm6-gl-ko19和nalm6-gl-ko22混合肿瘤细胞,待肿瘤在nsg小鼠体内成长和分散良好后,肿瘤模型建立成功。将肿瘤模型小鼠分成三组,分别静脉注射(i.v)cd19/cd22 bs loop car-t细胞和m971-fmc63 loop car-t细胞(两种car-t细胞的使用剂量为:10
×
106/只小鼠),对照组为没有治疗组,并采用ivis荧光成像系统对nsg小鼠体内的肿瘤细胞分布情况进行定期观察,结果如图19和图20所示,。虽然两种双特异性car-t均显示了良好的肿瘤抑制效果,但是相比较而言,本发明cd19/cd22 bs loop car-t显示了显著的对抗肿瘤抗原逃逸的有效抑制效果,比传统报道的m971-fmc63 loop car-t细胞显示了持续有效的肿瘤抑制效果,进一步证明了采用本发明bs loop car结构设计的双特异性car-t细胞,可以更加有效地识别单靶点肿瘤细胞,从而有效地克服单靶点抗原逃逸或者肿
瘤抗原异质性造成的肿瘤复发,实现对肿瘤患者的有效保护作用。
[0164]
实施例13
[0165]
her2/igf1r bs loop car的设计构建
[0166]
her2/igf1rbs loop car(seq id no:12)t细胞的制备
[0167]
使用正向引物序列gatatccagatgacccagtccccg与反向引物序列ttttttagtctcctcagtacgtttgatctc将4d5 scfv区域v
l
片段扩增出来、使用正向引物序列gagatcaaacgtactgaggagactaaaaaatatcagtctgacatcgtgagcgac与反向引物序列caccagctgaacctctttttcgtaattataagtgtaagattggctaggcttgtc将天然配体adnectin片段扩增出来、使用正向引物序列aattacgaaaaagaggttcagctggtg与反向引物序列atccagaggttgattgtcgacttagcgagggggcagggc将4d5 scfv区域vh片段扩增出来。以上三个pcr产物经过重叠pcr扩增后重组为一个目的基因片段。其中her2/igf1r bs loop car包含在上述引物序列中(大写部分)。pcr体系和pcr反应条件分别同实施例1中表1和表2所示。
[0168]
pcr产物回收、载体酶切和同源重组,以及质粒转化和大提等流程同实施例1。
[0169]
实施例14
[0170]
her2和igf1r靶向car-t细胞的制备
[0171]
将含有her2 car(氨基酸序列如seq id no:13所示),igf1r car(氨基酸序列如seq id no:9所示),igf1r/her2 tan car(氨基酸序列如seq id no:10所示),her2/igf1r tan car(氨基酸序列如seq id no:11所示)或者her2/igf1rbs loop car(氨基酸序列如seq id no:12所示)的质粒用于慢病毒制备,上述五种car-t细胞的结构示意图和分子结构示意图分别如图21和图22所示。后续的pbmc提取,复苏和激活,以及慢病毒制备和病毒转导,car-t细胞的制备等流程同实施例1。
[0172]
实施例15
[0173]
her2和igf1r靶向car-t细胞的肿瘤细胞杀伤分析
[0174]
肿瘤细胞:skbr3(her2+++/igf1r+),mda-mb-453(her2++/igf1r+),mda-mb-231(her2+/igf1r+)。
[0175]
car-t细胞:将实施例14所记载五种car-t细胞以及her2 car和igf1r car两种混合的car-t细胞提前24h饥饿处理去除il-2。
[0176]
car-t细胞与肿瘤细胞的效靶比(e:t)为10:1。
[0177]
1)细胞计数:肿瘤细胞和car-t细胞重悬至rpmi-1640培养基中计数。若肿瘤细胞不易重悬,易结块,可另其沉降一段时间后取上清混匀后进行细胞计数和后续实验。
[0178]
2)car-t细胞稀释至2
×
106/ml浓度。肿瘤细胞计数,调整细胞密度为0.2
×
106/ml。将调好密度的car-t细胞与肿瘤细胞等体积混合均匀,每孔100μl加入96孔板。阳性对照组只加50μl肿瘤细胞与50μl培养基等体积混合。
[0179]
3)检测ldh:24小时后,阳性对照组加入10μl/well lysis buffer(10x),37℃30min充分裂解细胞;离心后吸取30μl/孔上清至新96孔平底板,对应加入30μl/孔显色液(使用promega细胞毒检测试剂盒),室温避光孵育20min后加入30μl/孔stop solution,检测490nm处吸光值。
[0180]
4)od490分析:阳性对照与阴性对照组od490分别取平均值,计算杀伤百分效率。计算公式:%lysis=(每孔对应的od490数值-阴性对照组均值)/(阳性对照组均值-阴性对照
组均值)
×
100。结果如图23所示,在不同her2表达水平的肿瘤细胞上,相比于her2 car-t、igf1r car-t以及两种混合car-t细胞,3种双特异性car-t细胞都显示了提高的杀伤活性,但是相比较而言,本发明her2/igf1r bs loop car-t细胞在不同her2抗原表达量的肿瘤细胞上,均显示了显著性最佳的杀伤活性。由此可见,采用本发明bs loop结构的car-t细胞对于双靶点肿瘤识别的活性具有良好的最佳一致性。
[0181]
实施例16
[0182]
her2和igf1r靶向car-t细胞的细胞因子释放分析
[0183]
肿瘤细胞:mda-mb-231(her2+/igf1r+)
[0184]
car-t细胞:将实施例14所记载五种car-t细胞以及her2 car和igf1r car两种混合的car-t细胞提前24h饥饿处理去除il-2。
[0185]
car-t细胞与肿瘤细胞的效靶比(e:t)为10:1。
[0186]
car-t细胞离心后去上清,重悬后计数,稀释至2
×
106/ml;肿瘤细胞离心去上清,重悬后计数,稀释至0.2
×
106/ml;car-t细胞与肿瘤细胞等体积混合均匀。培养24h后,收集上清,-20℃冻存用于后续检测细胞因子。elisa检测细胞因子浓度同实施例6。
[0187]
结果如图24所示,在her2+/igf1r+的mda-mb-231肿瘤细胞上,相比于her2 car-t、igf1r car-t以及两种混合car-t细胞,3种双特异性car-t细胞都显示了显著提高的ifn-γ细胞因子的释放,但是相比较而言,本发明her2/igf1r bs loop car-t细胞在肿瘤细胞上,显示了il-2、ifn-γ和tnf-α细胞因子的一致性显著性释放。由此可见,采用本发明bs loop结构的car-t细胞对于双靶点肿瘤的特异性识别活化具有良好的一致性。
[0188]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1