PCAT1的反义寡核苷酸及其在制备抑制前列腺癌核酸药物中的应用的制作方法
pcat1的反义寡核苷酸及其在制备抑制前列腺癌核酸药物中的应用
技术领域
1.本发明属于生物医学领域,涉及pcat1的反义寡核苷酸及其在制备抑制前列腺癌核酸药物中的应用。
背景技术:
2.前列腺癌(pca)是男性泌尿系统中最常见的恶性肿瘤之一(sung h,ferlay j,siegel rl,et al.global cancer statistics 2020:globocan estimates of incidence and mortality worldwide for 36cancers in 185countries ca:a cancer journal for clinicians,2021.)。2019年美国新增和死亡病例分别超过17万例和约3万例(siegel r,miller k,jemal a.cancer statistic,2019[j].ca:a cancer journal for clinicians,2019:69;7-34.)。我国的前列腺癌发病率也呈逐年上升,前列腺癌的确切病因尚不十分清楚,但临床观察和实验研究表明,激素,遗传和环境因素均起到一定作用(chen w,zheng r,baade pd,et al.cancer statistics in china,2015[j].ca:a cancer journal for clinicians,2016:66;115-132.)。目前,前列腺癌特异性抗原(psa)筛查逐渐普及,增加了疾病早期诊断的概率,使得部分早期患者能够及时诊治。前列腺癌的治疗包括手术和内分泌治疗为核心的多种方式。
[0003]
雄激素剥夺治疗(androgen deprivation therapy,adt)是对这部分患者的最主要治疗方法。尽管在adt治疗初期前列腺癌被不同程度的控制,但经过大约18个月敏感期后,大部分患者的疾病逐渐且不可逆地进展为去势抵抗性前列腺癌。去势抵抗性前列腺癌(castration resistant prostate cancer,crpc)是指患者经过adt治疗后,血清睾酮水平达到去势水平(《50ng/dl或《1.7nmol/l),但是疾病依然进展的前列腺癌。疾病进展的临床表现为影像学可见的肿瘤进展和/或前列腺特异性抗原(psa)水平持续增高。后者应满足以下条件,即在psa达2ng/ml以上,每间隔一周监测血清psa水平,连续3次血清psa升高,且比基础值升高50%以上。然而,由于crpc发病机制至今不明,因而临床缺乏针对病因的精准治疗,这是当前泌尿外科学研究的难点和热点。
[0004]
长链非编码rna(lncrna)是长度大于200个核苷酸的不能编码蛋白的rna,位于细胞核或细胞质内。根据lncrna在基因组上的位置,可将其分为3类:(1)位于基因间区的lncrna,又被称为lincrna(long intergenic rna);(2)天然反义链lncrna;(3)内含子区lncrna。由于lncrna缺乏明显的开放阅读框,没有蛋白编码功能,因此,长期以来它被人们认为是没有生物学功能的“暗物质”。随着生物学技术的不断进步,lncrna的生物学功能也逐渐被揭示出来。研究lncrna与疾病之间的相关性对于实现疾病的诊断和治疗具有重要的意义。
[0005]
反义核酸药物从1978年发现并提出理论,到世纪之交第一种药物上市、推出2代反义技术,再到后来发展遇到低谷,药品退市,人们对其理解与运用的过程经历了一种螺旋式的上升。其研发伊始就承担着攻克普通药物无法治愈的疾病(如肿瘤)的希冀。随着近年来
几种治疗癌症的反义核酸药物获批进入临床试验,此类药物重新回到了生物制药研究的舞台,再次展现了这种药物在基因治疗领域的广阔前景。
[0006]
目前,关于pcat1在前列腺癌中的作用机制尚未有相关研究,关于靶向pcat1反义核酸的研究还未见报道,且其化学抑制剂的研发尚不充分。
技术实现要素:
[0007]
为了弥补现有技术的不足,本发明的目的之一是提供针对pcat1的反义寡核苷酸。
[0008]
本发明的目的之二是提供一种治疗去势抵抗性前列腺癌的手段。
[0009]
为了实现上述目的,本发明采用了如下技术方案:
[0010]
本发明第一方面提供了一种诊断去势抵抗性前列腺癌的产品,所述产品包括检测pcat1的试剂。
[0011]
进一步,所述产品包括通过rt-pcr、实时定量pcr、原位杂交或芯片检测样本中pcat1表达水平的试剂。
[0012]
进一步,所述试剂包括特异性识别pcat1的探针;或
[0013]
特异性扩增pcat1的引物。
[0014]
进一步,特异性扩增pcat1的引物序列如seq id no.1-2所示。
[0015]
本发明第二方面提供了一种反义寡核苷酸,其特征在于,所述反义寡核苷酸由15-30个核苷酸组成,所述反义寡核苷酸抑制pcat1的表达。
[0016]
进一步,所述反义寡核苷酸由18-22个核苷酸组成。
[0017]
进一步,所述反义寡核苷酸由20个核苷酸组成。
[0018]
进一步,所述反义寡核苷酸选自seq id no.3-6任一项所述的序列。
[0019]
进一步,所述反义寡核苷酸的序列如seq id no.3所示。
[0020]
本发明第三方面提供了对本发明第二方面所述的反义寡核苷酸进行修饰的反义寡核苷酸。
[0021]
进一步,所述修饰包括至少1个核苷间键修饰。
[0022]
进一步,所述核苷间键修饰是硫代磷酸酯修饰。
[0023]
进一步,所述修饰包括全链的核苷间键修饰。
[0024]
进一步,所述修饰包括至少1个糖修饰。
[0025]
进一步,所述糖修饰为2
′‑
o-甲氧乙基修饰。
[0026]
进一步,所述修饰包括至少6个糖修饰。
[0027]
进一步,所述修饰包括10个糖修饰。
[0028]
进一步,所述糖修饰位于反义寡核苷酸序列两侧。
[0029]
进一步,所述反义寡核苷酸包括至少一个的核苷间键修饰和至少一个的糖修饰。
[0030]
进一步,所述反义寡核苷酸包括全链的核苷间键修饰和至少1个糖修饰。
[0031]
进一步,所述反义寡核苷酸包括全链的核苷间键修饰和至少6个糖修饰。
[0032]
进一步,所述反义寡核苷酸包括全链的核苷间键修饰和10个糖修饰。
[0033]
进一步,所述反义寡核苷酸的序列如seq id no.13所示。
[0034]
本发明第四方面提供了一种组合物,所述组合物包括本发明第二方面或第三方面所述的反义寡核苷酸或其盐。
[0035]
进一步,所述组合物还包括药学上可接受的载体。
[0036]
本发明的第五方面提供了一种筛选治疗去势抵抗性前列腺癌的候选药物的方法,包括:
[0037]
用待筛选物质处理表达或含有pcat1基因的培养体系;和检测所述体系中pcat1基因的表达水平;其中,当所述待筛选物质促进pcat1基因表达水平时,该待筛选物质是治疗去势抵抗性前列腺癌的候选药物。
[0038]
本发明的第六方面提供了pcat1在构建预测去势抵抗性前列腺癌的计算模型中的应用。
[0039]
本发明的第七方面提供了检测pcat1的试剂在制备诊断去势抵抗性前列腺癌的产品中的应用。
[0040]
进一步,所述产品包括芯片、试剂盒。
[0041]
进一步,pcat1在去势抵抗性前列腺癌中表达上调。
[0042]
本发明的第八方面提供了pcat1的抑制剂在制备治疗去势抵抗性前列腺癌的药物中的应用。
[0043]
进一步,所述抑制剂抑制pcat1的表达水平。
[0044]
进一步,所述抑制剂选自核酸抑制物。
[0045]
进一步,所述核酸抑制物选自:shrna、sirna、dsrna、微小rna、反义寡核苷酸,或能表达或形成所述shrna、sirna、dsrna、微小rna、反义寡核苷酸的构建物。
[0046]
进一步,所述核酸抑制物为反义寡核苷酸或其构建物。
[0047]
进一步,所述反义寡核苷酸如本发明第二方面或本发明第三方面所述。
[0048]
本发明的第九方面提供了pcat1在筛选治疗去势抵抗性前列腺癌的候选药物中的应用。
[0049]
进一步,筛选治疗去势抵抗性前列腺癌的候选药物的步骤包括:用待筛选物质处理表达或含有pcat1基因的培养体系;和检测所述体系中pcat1基因的表达水平;其中,当所述待筛选物质促进pcat1基因表达水平时,该待筛选物质是治疗去势抵抗性前列腺癌的候选药物。
[0050]
本发明的优点和有益效果:
[0051]
本发明首次发现了pcat1在去势抵抗性前列腺癌中的表达水平显著上调,可通过检测pcat1的表达水平判断受试者是否是去势抵抗性前列腺癌患者。
[0052]
本发明首次发现了抑制pcat1的表达水平可以抑制去势抵抗性前列腺癌细胞的增殖活性,提示pcat1可作为治疗靶标应用于去势抵抗性前列腺癌的治疗。
[0053]
本发明提供了设计反义寡核苷酸以及进行反义寡核苷酸修饰的方法,使用该方法设计的反义寡核苷酸具有较高的敲除效率。
附图说明
[0054]
图1是pcat1在不同细胞系中的表达情况图;
[0055]
图2不同反义寡核苷酸对pcat1的敲除效果图;
[0056]
图3是不同修饰的反义寡核苷酸的敲除效果图;其中,3a是不同修饰方式的反义寡核苷酸敲除效果图;3b是不同修饰位点数的反义寡核苷酸敲除效果图;
[0057]
图4是反义寡核苷酸的敲除效果图;其中,4a是48h后的敲除效果图;4b是浓度为100nm的敲除效果图;
[0058]
图5是pcat1对去势抵抗性前列腺癌细胞株的影响图。
具体实施方式
[0059]
本发明经过大量实验和反复研究,发现pcat1在去势抵抗性前列腺癌中起着重要的作用。并进一步通过设计具有较高敲除效率的反义寡核苷酸,证实了pcat1的敲低可降低去势抵抗性前列腺癌细胞的增殖活性。
[0060]
在本发明中,术语pcat1(gene id:100750225)包括野生型、突变型或其片段。本发明的pcat1核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。
[0061]
诊断产品和应用
[0062]
在本发明中,诊断去势抵抗性前列腺癌的产品可以是任何形式,包括(但不限于)芯片、制剂、试剂盒,只要其能够检测pcat1基因或其表达产物的表达水平即可。
[0063]
作为一种可选择的实施方式,本发明中的芯片包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于pcat1所示的部分或全部序列。
[0064]
具体地,可根据本发明所述的基因,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
[0065]
术语“探针”指能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,术语“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严格性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括,但不限于:溶液相、固相、混合相或原位杂交测定法。
[0066]
所述固相载体可采用基因芯片领域的各种常用材料,例如包括但不限于塑料制品、微颗粒、膜载体等。所述塑料制品可通过非共价或物理吸附机制与抗体或蛋白抗原相结合,最常用的塑料制品为聚苯乙烯制成的小试管、小珠和微量反应板;所述微颗粒是由高分子单体聚合成的微球或颗粒,其直径多为微米,由于带有能与蛋白质结合的功能团,易与抗体(抗原)形成化学偶联,结合容量大;所述膜载体包括硝酸纤维素膜、玻璃纤维素膜及尼龙膜等微孔滤膜。
[0067]
作为一种可选择的实施方式,本发明中的试剂盒包含一组寡核苷酸引物,所述引物足以检测和/或定量本发明所述的pcat1基因。寡核苷酸引物可以以冻干或重构的形式提供,或者可以作为一组核苷酸序列提供。在一个实施方案中,以微孔板(microplate)的形式提供引物,其中每一个引物组占用微孔板中的一个孔(或多个孔,如在重复的情况下)。微孔板可以进一步包含足以检测如下所述的一个或多个看家基因的引物。试剂盒可以进一步包含足以扩增本发明所述的基因的表达产物的试剂和说明。
[0068]
试剂盒中适当的容器通常至少包括一种小瓶、试管、长颈瓶、宝特瓶、针筒或其它
容器,其中可放置一种组分,并且优选地,可进行适当地等分。在试剂盒中存在多于一种的组分时,试剂盒中通常也将包含第二、第三或其它附加的容器,其中分离地放置附加的组分。然而,不同组合的组分可被包含在一个小瓶中。本发明的试剂盒通常也将包括一种用于容纳反应物的容器,密封以用于商业销售。这种容器可包括注模或吹模的塑料容器,其中可保留所需的小瓶。
[0069]
本发明还提供了检测pcat1的试剂在诊断去势抵抗性前列腺癌中的应用。
[0070]
在一个优选例中,包括步骤:分别检测待测样本和对照样本pcat1的表达水平,如果与对照样本相比,待测样本的pcat1的表达水平存在异常升高,则是潜在的去势抵抗性前列腺癌样本。
[0071]
在另一优选例中,所述异常的升高是指:与对照样本相比,所述pcat1基因或其表达产物的表达水平的升高幅度≥10%,较佳地≥20%,较佳地≥50%,更佳地≥80%,最佳地≥100%。
[0072]
本发明的pcat1使用本领域普通技术人员已知的多种核酸技术进行检测,这些技术包括但不限于:核酸测序、核酸杂交、核酸扩增技术。
[0073]
核酸测序技术的示例性非限制性实例包括但不限于链终止子(sanger)测序和染料终止子测序。本领域的普通技术人员将认识到,由于rna在细胞中不太稳定并且在实验中更易受到核酸酶攻击,因此在测序前通常将rna逆转录成dna。
[0074]
核酸杂交技术的示例性非限制性实例包括但不限于原位杂交(ish)、微阵列和southern或northern印迹。原位杂交(ish)是一种使用标记的互补dna或rna链作为探针以定位组织一部分或切片(原位)或者如果组织足够小则为整个组织(全组织包埋ish)中的特异性dna或rna序列的杂交。dna ish可用于确定染色体的结构。rna ish用于测量和定位组织切片或全组织包埋内的mrna和其他转录本(例如,ncrna)。通常对样本细胞和组织进行处理以原位固定靶转录本,并增加探针的进入。探针在高温下与靶序列杂交,然后将多余的探针洗掉。分别使用放射自显影、荧光显微术或免疫组织化学,对组织中用放射、荧光或抗原标记的碱基标记的探针进行定位和定量。ish也可使用两种或更多种通过放射性或其他非放射性标记物标记的探针,以同时检测两种或更多种转录本。
[0075]
本发明可在检测前或与检测同时地对核酸(例如,ncrna)进行扩增。核酸扩增技术的示例性非限制性实例包括但不限于:聚合酶链式反应(pcr)、逆转录聚合酶链式反应(rt-pcr)、转录介导的扩增(tma)、连接酶链式反应(lcr)、链置换扩增(sda)和基于核酸序列的扩增(nasba)。本领域的普通技术人员将认识到,某些扩增技术(例如,pcr)需要在扩增前将rna逆转录成dna(例如,rt-pcr),而其他扩增技术则直接扩增rna(例如,tma和nasba)。
[0076]
抑制剂和组合物
[0077]
基于本发明的发现,本发明提供了一种组合物或药物组合物,包含pcat1的抑制剂。所述抑制剂的性质对本发明来说并不重要,只要它抑制pcat1基因的水平即可,这些抑制剂作为对于下调pcat1有用的物质,可用于预防或治疗去势抵抗性前列腺癌。
[0078]
作为本发明的一种优选方式,所述pcat1的抑制剂是一种pcat1特异性的小干扰rna分子。如本文所用,所述的“小干扰rna”是指一种短片段双链rna分子,能够以同源互补序列的mrna为靶目标降解特定的mrna,这个过程就是rna干扰(rna interference)过程。小干扰rna可以制备成双链核酸的形式,它含有一个正义链和一个反义链,这两条链仅在杂交
的条件下形成双链。一个双链rna复合物可以由相互分离的正义链和反义链来制备。因此,举例来讲,互补的正义链和反义链是化学合成的,其后可通过退火杂交,产生合成的双链rna复合物。
[0079]
本发明的核酸抑制剂如sirna可以化学合成,也可以通过一个重组核酸结构里的表达盒转录成单链rna之后进行制备。sirna等核酸抑制物,可通过采用适当的转染试剂被输送到细胞内,或还可采用本领域已知的多种技术被输送到细胞内。
[0080]
作为本发明的一种优选地实施方式,所述pcat1的抑制剂是反义寡核苷酸。所述反义寡核苷酸具有与目的序列互补的序列,并且通过所述互补序列,可以实现目的基因的抑制,所述反义寡核苷酸是核糖核酸或dna。作为一种优选地实施方式,反义寡核苷酸包含至少一个化学改性。反义寡核苷酸能包含一个或一个以上的锁核酸(lnas,locked nucleic acids)。锁核酸为改性核糖核酸,在核糖部位的2’至4’碳之间包含额外的桥键,来具有锁定(locked)形态,并以此具有锁核酸的寡核苷酸具有改善的热稳定性。择一性地,反义寡核苷酸可包含肽核酸(pna,peptide nucleic acids),并且反义寡核苷酸包含基于肽的主链来代替糖-磷酸主链。反义寡核苷酸能包含的其他化学改性包括:如2
′‑
o-烷基(例如,2
′‑
o-甲基,2
′‑
o-甲氧基乙基)、2
′‑
氟及4
′‑
硫氧改性一样的糖改性;硫代磷酸、吗啉代或磷羧酸键之类的主链改性。反义寡核苷酸的长度为7-50核苷酸,优选为10-40核苷酸,更优选为15-30核苷酸,更优选为18-25核苷酸,更优选为20核苷酸。
[0081]
在进一步实施方案中,所述反义寡核苷酸的序列如seq id no.3-6任一项所示。
[0082]
在一优选的实施方案中,所述反义寡核苷酸的序列如seq id no.3所示。
[0083]
在一些实施方案中,反义寡核苷酸的修饰包括至少一个核苷间键修饰。
[0084]
作为一种进一步实施方案,反义寡核苷酸的修饰包括全链核苷间键修饰。
[0085]
在一些实施方案中,核苷间键修饰是硫代磷酸酯修饰。
[0086]
在具体实施方案中,所述反义寡核苷酸选自seq id no.7-10任一项所述的序列。
[0087]
在进一步实施方案中,所述反义寡核苷酸为seq id no.7所述的序列。
[0088]
在一些实施方案中,反义寡核苷酸的修饰包括至少一个糖修饰。
[0089]
在一些实施方案中,反义寡核苷酸的修饰包括至少6个糖修饰。
[0090]
在一些实施方案中,反义寡核苷酸的修饰包括至少10个糖修饰。
[0091]
在一些实施方案中,反义寡核苷酸的糖修饰位于反义寡核苷酸序列两侧。
[0092]
作为进一步实施方案,所述糖修饰为2
′‑
o-甲氧乙基修饰。
[0093]
在进一步实施方案中,所述反义寡核苷酸包括至少一个的核苷间键修饰和至少一个的糖修饰。进一步,所述反义寡核苷酸包括全链的核苷间键修饰和至少一个的糖修饰。更为进一步,所述反义寡核苷酸包括全链的核苷间键修饰和至少6个的糖修饰。更为进一步,所述反义寡核苷酸包括全链的核苷间键修饰和10个糖修饰。
[0094]
在具体实施方案中,所述反义寡核苷酸选自seq id no.12-15任一项所述的序列。在进一步实施方案中,所述反义寡核苷酸选自seq id no.13所述的序列。
[0095]
作为本发明的一种可选方式,所述的pcat1的抑制剂也可以是一种“小发夹rna(small hairpin rna,shrna)”,其是能够形成发夹结构的非编码小rna分子,小发夹rna能够通过rna干扰途径来抑制基因的表达。如上述,shrna可以由双链dna模板来表达。双链dna模板被插进一个载体,例如质粒或病毒载体,然后在体外或体内连接到一个启动子进行表
达。shrna在真核细胞内dicer酶的作用下,可被切割成小干扰rna分子,从而进入rnai途径。“shrna表达载体”是指一些本领域常规用于构建shrna结构的质粒,通常该质粒上存在“间隔序列”以及位于“间隔序列”两边的多克隆位点或供替换序列,从而人们可以将shrna(或类似物)相应的dna序列通过正向和反向的方式插入多克隆位点或替换其上的供替换序列,该dna序列转录后的rna可形成shrna(short hairpin)结构。所述的“shrna表达载体”目前已经完全可以通过商购的途径购买获得,例如一些病毒载体。
[0096]
在一些实施方案中,本发明提供了一种组合物,所述组合物包括pcat1的抑制剂,和药学上可接受的载体。
[0097]
在本发明中,药学上可接受的载体包括但不限于:稀释剂、缓冲剂、混悬剂、乳剂、颗粒剂、包囊剂、赋形剂、填充剂、粘合剂、喷雾剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂、吸附载体等。
[0098]
药学上可接受的稀释剂包括磷酸盐缓冲盐水(pbs)。在一些实施方案中,药学上可接受的稀释剂为无菌磷酸盐缓冲盐水。
[0099]
可以将本发明的抑制剂如反义寡核苷酸与药学上可接受的活性或惰性物质混合,用于制备药物组合物或制剂。用于配制药物组合物的组合物和方法取决于多个标准,包括但不限于施用途径、疾病程度或施用剂量。
[0100]
可以通过常规灭菌技术给这些组合物灭菌,或可以将它们无菌过滤。可以将得到的水溶液包装应用或冻干,将冻干的制剂与无菌水性载体合并,然后施用。制剂的ph通常为3-11,更优选5-9或6-8,并且最优选7-8,例如7-7.5。可以将得到的固体形式的组合物包装在多个单剂量单元中,每个包含固定量的上述一种或多种活性剂,例如在密封的片剂或胶囊剂包装中。还可以将固体形式的组合物以灵活的量包装在容器中,例如在设计用于局部施用的乳膏剂或软膏剂的可挤压管中。
[0101]
在实施方案中,发明实践包括以适当的核酸递送系统施用至少一种上述反义寡核苷酸或组合物。在一个实施方案中,该系统包括可操作地连接于多核苷酸的非病毒载体。这种非病毒载体的实例包括单独寡核苷酸或寡核苷酸与适当的蛋白、多糖或脂质制剂的组合。
[0102]
另外适当的核酸递送系统包括病毒载体,通常序列来自以下的至少一种:腺病毒、腺病毒相关病毒(aav)、辅助病毒依赖型腺病毒、逆转录病毒或日本血凝病毒-脂质体(hvj)复合体。优选地,病毒载体包括可操作地连接于多核苷酸的强的真核启动子,例如巨细胞病毒(cmv)启动子。
[0103]
另外进一步载体包括病毒载体、融合蛋白和化学缀合物。逆转录病毒载体包括莫洛尼氏鼠白血病病毒和基于hiv的病毒。一种进一步基于hiv的病毒载体包括至少两种载体,其中gag和pol基因来自hiv基因组且env基因来自另一病毒。dna病毒载体是进一步。这些载体包括痘病毒载体例如正痘病毒或禽痘病毒载体、疱疹病毒载体例如i型单纯疱疹病毒(hsv)载体、腺病毒载体和腺相关病毒载体。
[0104]
本发明的组合物涵盖任何药学上可接受的盐、酯或这种酯的盐、或当施用于动物(包括人)时能够提供(直接或间接)生物活性代谢物的任何其它化合物或其残留物。
[0105]
筛选候选药物的方法
[0106]
本发明提供了一种筛选治疗去势抵抗性前列腺癌的候选药物的方法,包括:
[0107]
用待筛选物质处理表达或含有pcat1基因的培养体系;和检测所述体系中pcat1基因的表达水平;其中,当所述待筛选物质促进pcat1基因表达水平时,该待筛选物质是治疗去势抵抗性前列腺癌的候选药物。
[0108]
所述的方法还包括:对上面步骤获得的候选药物进一步测试其抑制去势抵抗性前列腺癌的效果,若测试候选药物对去势抵抗性前列腺癌有显著的抑制效果,则说明该化合物为治疗去势抵抗性前列腺癌的候选药物。
[0109]
所述培养体系包括(但不限于)细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系(如动物模型,优选非人哺乳动物的动物模型,如鼠、兔、羊、猴等)等。
[0110]
作为优选的实施方案,所述培养体系为细胞体系、亚细胞体系。
[0111]
下面结合附图和实施例对本发明作进一步详细的说明。因此,本发明的宽度和范围不应限于任何上述的实施方案。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0112]
实施例1pcat1在去势抵抗性前列腺癌细胞系中的表达情况
[0113]
1、去势抵抗性前列腺癌细胞系的构建
[0114]
将雄激素依赖的前列腺癌细胞系lncap培养于10%活性炭去雄激素胎牛血清的rpmi-1640培养基中。细胞于细胞培养箱中进行培养,培养条件为37℃,5%co2。培养过程中根据细胞实际生长情况决定是否进行细胞换液及细胞传代,培养细胞至去势抵抗阶段成为lncap-ai。
[0115]
2、rt-qpcr检测pcat1的表达情况
[0116]
使用trizol试剂,提取细胞总rna。采用thermo revertaid first strand cdna synthesis kit将总rna反转录为cdna,采用cwbio 2
×
taq mastermix、pcat1引物和sangon biotech gapdh内参引物进行rt-qpcr反应,并计算其ct值换算,得到mrna的相对水平数值。
[0117]
pcat1的引物序列如下:
[0118]
前引物序列:5
’‑
tgagaagagaaatctattggaacc-3’(seq id no.1),
[0119]
后引物序列:5
’‑
ggtttgtctccgctgcttta-3’(seq id no.2);
[0120]
结果显示,pcat1在lncap-ai细胞中显著上调(图1)。
[0121]
实施例2pcat1反义寡核苷酸的设计及检测
[0122]
1、aso序列的生物学鉴定以及修饰方案和位点的效果对比
[0123]
使用ncbi中的blast生物串行信息一级结构在线比对工具(https://blast.ncbi.nlm.nih.gov/blast.cgi)对比分析pcat1 mrna各个转录本的mrna结构信息,并记录其共有序列。使用sfold rna二级结构在线预测工具中的“soligo”页面(http://sfold.wadsworth.org/cgi-bin/index.pl),输入pcat1各个转录本的共有序列,oligo长度选择为20nt,提交并记录筛选结果。
[0124]
从公司(生工sagon)购得所有aso序列(表1)并仅使用基础修饰(表2)。
[0125]
表1aso序列
[0126]
aso序列序列编号atgtatctgcgcaccctttgseq id no.3catggtcttatgtatctgcgseq id no.4
ggttattgttgttgcgtagaseq id no.5gtcattgctggttgccatatseq id no.6
[0127]
表2修饰的aso序列
[0128]
编号aso序列序列编号g1a*t*g*t*a*t*c*t*g*c*g*c*a*c*c*c*t*t*t*gseq id no.7g2c*a*t*g*g*t*c*t*t*a*t*g*t*a*t*c*t*g*c*gseq id no.8g3g*g*t*t*a*t*t*g*t*t*g*t*t*g*c*g*t*a*g*aseq id no.9g4g*t*c*a*t*t*g*c*t*g*g*t*t*g*c*c*a*t*a*tseq id no.10
[0129]
注:*代表硫代磷酸酯修饰。
[0130]
2、rt-qpcr检测aso
pcat1
的敲除效果
[0131]
体外六孔板培养lncap-ai细胞,细胞铺板24小时后转染细胞。首先将甲基化修饰的反义寡核苷酸aso
pcat1
与脂质体转染试剂混合均匀室温孵育20分钟,将混合物均匀加入培养基中。使得aso
pcat1
在培养基中的终浓度分别为0nm,100nm,200nm。分别于24小时和48小时后,去除细胞培养基,加入trizol试剂,提取细胞总rna。采用thermo revertaid first strand cdna synthesis kit将总rna反转录为cdna,采用cwbio 2
×
taq mastermix、pcat1引物和sangon biotech gapdh内参引物进行rt-qpcr反应,并计算其ct值换算,得到mrna的相对水平数值。
[0132]
结果显示,aso-g1具有较强的敲除能力(图2),后续修饰与修饰位点的实验将使用该序列进行。
[0133]
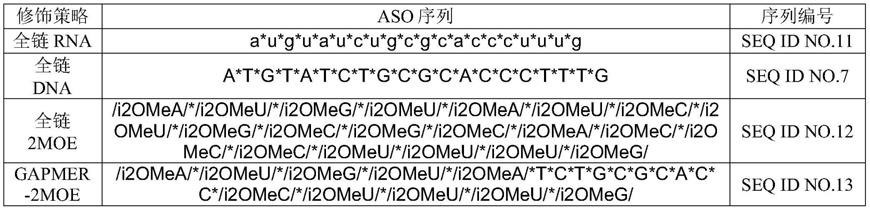
3、不同修饰方法的敲除效果检测
[0134]
从公司(生工sagon)合成以aso-g1序列为基础,不同修饰方法的序列,包括全链rna,全链dna,全链2-moe以及gapmer-2-moe的不同修饰策略,如表3所示。经过转染-rna抽提-rt-qpcr实验,计算其ct值换算,得到mrna的相对水平数值,具体操作步骤同上。
[0135]
表3不同修饰的aso
[0136][0137]
注:*代表硫代磷酸酯修饰;i2ome代表2
′‑
o-甲氧乙基修饰
[0138]
结果显示,gapmer-2moe修饰的aso在序列相同的条件下具有较强的敲除能力(图3a)。
[0139]
由于gapmer修饰策略两侧的2-moe修饰数量并不固定。为了进一步优化敲低效率,对aso两侧的修饰数量进行了进一步的对比(如表4所示)并从公司(生工sagon)合成,其中aso-g1-flank5和gapmer-2moe相同,并同样进行了aso转染-rna抽提-rt-qpcr实验的流程,具体操作步骤同上。
[0140]
表4不同修饰数量的aso
[0141][0142]
注:*代表硫代磷酸酯修饰;i2ome代表2
′‑
o-甲氧乙基修饰
[0143]
结果显示,采用gapmer-2-moe修饰时,两侧的2-moe修饰数量为5时能够获得最强的敲除效果(图3b)。
[0144]
实施例3反义寡核苷酸aso
pcat1
敲除pcat1的作用模式
[0145]
1、rt-qpcr检测
[0146]
体外六孔板培养lncap-ai细胞,细胞铺板24小时后转染细胞。首先将aso-g1-flank5与脂质体转染试剂混合均匀室温孵育20分钟,将混合物均匀加入培养基中。使得aso-g1-flank5在培养基中的终浓度分别为0nm,50nm,100nm,200nm,48h后去除细胞培养基,分别加入trizol试剂提取细胞总rna。另铺一板,24小时后转染细胞,以100nm终浓度使用脂质体转染aso-g1。分别于0,12,24小时和48小时后,使用同样方法,提取细胞总rna。采用thermo revertaid first strand cdna synthesis kit将总rna反转录为cdna,采用cwbio 2
×
taq mastermix、pcat1引物和sangon biotech gapdh内参引物进行pcr反应。
[0147]
结果显示,转染后24小时,在lncap-ai细胞中可见到pcat1的mrna水平降低(图4)。
[0148]
实施例4 pcat1对细胞的影响
[0149]
将lncap-ai细胞分别铺板与在96孔板(n=5)中,每孔2000细胞,并且分别给予对照aso-con和aso-g1-flank5。置于37℃、5%co2培养箱中培养,每隔24小时取出一块96孔板。使用pbs溶液或是生理盐水做溶剂,配置四甲基偶氮唑(mtt)溶液,终浓度5mg/ml。于每一孔中加入10μl mtt溶液,再次放于37℃、5%co2培养箱中孵育2小时。两小时后取出96孔板,轻轻倒扣在滤纸上,每孔中加入150μl dmso溶液,避光于摇床上低速摇晃30分钟使甲臢结晶充分溶解。使用酶标仪在od值490nm检测各孔吸光度,记录数值,之后每24小时取出一个96孔板进行上述操作,统一计算。
[0150]
结果显示,随着时间增加,实验组细胞活力明显下降,细胞增殖能力受到抑制(图5)。
[0151]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1