具有特异性杀伤肠出血性大肠杆菌的工程λ噬菌体及其构建方法和应用
具有特异性杀伤肠出血性大肠杆菌的工程
λ
噬菌体及其构建方法和应用
技术领域
1.本发明属于微生物学、基因组工程和分子生物学技术领域,涉及对溶原性噬菌体进行基因工程改造增强特异性杀菌能力的应用,具体涉及一种具有特异性杀伤肠出血性大肠杆菌的工程λ噬菌体及其构建方法和应用。
背景技术:
2.肠出血大肠杆菌是大肠杆菌的一个亚型,革兰氏染色阴性、两端钝圆的短小杆菌,多单独存在或成双存在,但不成长链状排列;菌体长有少量周生鞭毛,具有较弱的运动能力。肠出血性大肠杆菌分为157、26、111血清型,主要致病株为o157:h7,它的毒力依靠于产生志贺样毒素、溶血素和主要对肠上皮屏障的黏附/消除(attach/efface,a/e)损伤。细菌进入人体后主要侵犯小肠远端和结肠、肾脏、肺、脾脏和大脑,引起肠粘膜水肿、出血、肠细胞水肿、坏死及肾脏、脾脏与大脑的病变。临床上表现为胃肠道疾病(出血性肠炎)、溶血性尿毒综合征(hus)和血栓性血小板减少性紫癜,部分患者出现神经系统受累症状。
3.据世界卫生组织公布的数据,肠出血性大肠杆菌1982年的美国出现由该菌引起的食物中毒后,肠出血性大肠杆菌引发的疫情开始蔓延至英国、加拿大、日本等多个国家引起腹泻暴发和流行。我国于1997年对肠出血性大肠杆菌o157:h7进行监测,自1997年来,已陆续有十余个省份从市售食品、进口食品、家畜家禽、腹泻病患者等分离出肠出血性大肠杆菌o157:h7,特别是1999年我国部分地区发生了肠出血性大肠杆菌o157:h7感染性腹泻的暴发,表明肠出血性大肠杆菌o157:h7感染性腹泻已成为威胁人群健康的重要公共卫生问题。
4.目前对肠出血性大肠杆菌的致病机理已有深入的研究,但是针对肠出血性大肠杆菌的有效治疗方案仍然缺乏。在临床上多采用腹泻病的一般治疗原则,即运用支持疗法和使用抗生素。然而抗生素的广泛使用,一方面已经导致产生耐药性病原细菌的频率增加,另一方面抗生素的广谱抗菌作用会对所有的细菌产生致死作用,这种无选择性的杀伤会杀死肠道内的原位细菌,造成肠道原有生态环境的紊乱,这种紊乱的肠道环境更加有利于治病菌的侵袭,从而造成更加不良的状况。近年来有关肠道菌群的研究显示,肠道菌群与宿主之间的健康存在很大的关联,这种被抗生素所打乱的肠道微生态环境也会给宿主的健康带来其它潜在风险。所以急需一种可以特异性的杀死或者清除肠出血性大肠杆菌的工具以有效解决上述技术问题。
5.噬菌体是感染宿主细菌实现自我扩增繁殖的病毒,其广泛存在于自然环境中,通常认为噬菌体是环境中地球上最多的生物体,其数量比细菌的数量高出10倍。噬菌体依据其繁殖特点分为两大类,一类是感染宿主细菌后立即启动转录复制产生子代的烈性噬菌体(又称毒性噬菌体);另一类是感染宿主菌后先将其基因整合于细菌染色体上,通过细菌的复制而形成的溶源性噬菌体(又称温和噬菌体),在一定的理化或生物因素压力条件的影响下裂解细菌产生子代。20世纪早期,噬菌体治疗法一度产生热潮,利用抗鼠疫的噬菌体治疗黑死病瘟疫的示例和口服抗霍乱的特异性噬菌体治疗霍乱病人,都显著的减轻了病人症状
1000bp同源臂;
18.(2)将上述扩增产物与sgrna、pcas9质粒混合电转到λ噬菌体溶源菌中;
19.(3)将验证为阳性的菌落继续液体培养,诱导表达,收集纯化;
20.(4)在步骤(3)基础上插入由金斯瑞生物科技合成的crrna序列,crrna被设计成靶向肠出血性大肠杆菌的eae基因,序列被克隆在puc57质粒上,含有speⅰ启动子和氨苄霉素抗性,能够引导cas3切割含有与crrna碱基序列互补dna片段;
21.(5)将上述克隆基因与sgrna、cas9蛋白混合电转到λ噬菌体溶源菌中;
22.(6)将验证为阳性的菌落继续液体培养,诱导表达后,收集纯化;
23.(7)在步骤(3)基础上将被设计用来敲除λ噬菌体裂解酶基因grna与cas9蛋白电转化到λ噬菌体溶源菌感受态细胞中;
24.(8)将验证为阳性的菌落继续液体培养,诱导表达,收集纯化;
25.步骤s3:溶源性噬菌体裂解酶敲除后诱导方法
26.将上述步骤(8)纯化后的阳性菌落富集培养,并加入丝裂霉素c至终浓度为1.5-2.5μg/ml诱导培养,用0.22μm滤膜过滤除菌后得到工程λ噬菌体悬液。
27.本发明所述的具有特异性杀伤肠出血性大肠杆菌的工程λ噬菌体在制备特异性杀伤肠出血性大肠杆菌药物中的应用。
28.本发明中工程λ噬菌体对肠出血性大肠杆菌的体外特异性感染,按照moi=1的比例加入工程λ噬菌体与多大肠杆菌分别共培养12小时,涂板计算菌落cfu;工程λ噬菌体对肠出血性大肠杆菌感染小鼠模型的保护作用,按照moi=1比例的条件下用噬菌体野生型λ噬菌体和工程λ噬菌体治疗感染小鼠,观察记录小鼠体重变化和存活率,以及对结肠做苏木素-伊红染色切片组织学评分来评估不同类型的噬菌体治疗对小鼠的保护作用。
29.本发明与现有技术相比具有以下优点和有益效果:本发明提供的工程λ噬菌体,在体内体外均表现出对肠出血性大肠杆菌的高特异性杀伤作用,进而有效克服了抗生素和野生型噬菌体治疗的广谱杀菌的弊端。
附图说明
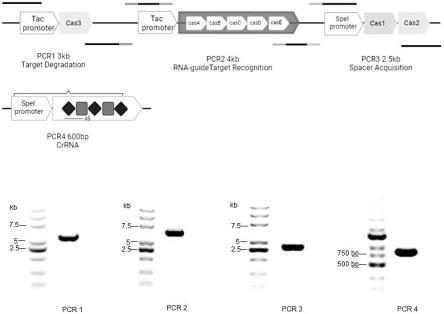
30.图1是工程λ噬菌体改造凝胶电泳检测图;
31.图2是噬菌体与肠出血性大肠杆菌双层平板图;
32.图3是工程λ噬菌体体外共培养12小时后菌落总数图;
33.图4是动物实验小鼠体重变化率图;
34.图5是动物实验小鼠存活率图;
35.图6是动物实验小鼠结肠苏木素-伊红染色切片图;
36.图7是动物实验小鼠结肠组织学评分图。
具体实施方式
37.以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
38.实施例
39.一、基因工程改造λ噬菌体
40.所述λ噬菌体的裂解酶基因被敲除并将cris pr-cas3系统相关基因cas3、casa、casb、casc、casd、case、cas1、cas2以及合成的crrna插入到λ噬菌体中得到工程性λ噬菌体,通过λ噬菌体溶源作用将crispr-cas3系统整合到宿主肠出血性大肠杆菌中,由crrna介导识别互补碱基序列从而发挥特异性杀菌功能,其中crispr-cas3系统相关基因的核苷酸序列如seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7和seq id no:8所示,crrna基因的核苷酸序列如seq id no:9所示。
41.所述工程性λ噬菌体的具体构建过程为:
42.步骤s1:诱导溶源性λ噬菌体释放
43.将λ噬菌体的溶源菌富集培养,然后诱导λ噬菌体释放与宿主菌增殖培养,根据噬菌斑的数量计算噬菌体滴度,并对λ噬菌体进行纯化保存;
44.步骤s2:插入crispr-cas3系统以及敲除裂解酶基因,对λ噬菌体的改造方法具体过程如下:
45.(1)从e.coli mg1655克隆crispr-cas3系统相关基因cas3、casa、casb、casc、casd、case、cas1和cas2,根据融合pcr原理扩增出的克隆基因含有与λ噬菌体互补的750-1000bp同源臂;
46.(2)将上述扩增产物与sgrna、pcas9质粒混合电转到λ噬菌体溶源菌中;
47.(3)将验证为阳性的菌落继续液体培养,诱导表达,收集纯化;
48.(4)在步骤(3)基础上插入由金斯瑞生物科技合成的crrna序列,crrna被设计成靶向肠出血性大肠杆菌的eae基因,序列被克隆在puc57质粒上,含有speⅰ启动子和氨苄霉素抗性,能够引导cas3切割含有与crrna碱基序列互补dna片段;
49.(5)将上述克隆基因与sgrna、cas9蛋白混合电转到λ噬菌体溶源菌中;
50.(6)将验证为阳性的菌落继续液体培养,诱导表达后,收集纯化;
51.(7)在步骤(3)基础上将被设计用来敲除λ噬菌体裂解酶基因grna与cas9蛋白电转化到λ噬菌体溶源菌感受态细胞中;
52.(8)将验证为阳性的菌落继续液体培养,诱导表达,收集纯化(图1);
53.步骤s3:溶源性噬菌体裂解酶敲除后诱导方法
54.将上述步骤(8)纯化后的阳性菌落富集培养,并加入丝裂霉素c至终浓度为1.5-2.5μg/ml诱导培养,用0.22μm滤膜过滤除菌后得到工程λ噬菌体悬液,噬菌体悬液梯度稀释后与肠出血性大肠杆菌按体积比1:1加入8ml,50℃的半固体lb琼脂中混匀后,导入lb固体培养基中,37℃,过夜培养,观察噬菌斑,结果如图2所示。
55.二、体外工程性λ噬菌体与不同株大肠杆菌共培养的杀菌效率
56.步骤s1:将肠出血性大肠杆菌、标准菌株mg1655、bl21、dh5α、nissle1917以及10株从健康人体肠道分离的大肠杆菌(均可被野生型λ噬菌体侵染,菌种保存与50wt%甘油,-80℃冰箱中),从-80℃冰箱中取出上述细菌,分别于lb液体培养基中37℃过夜培养;
57.步骤s2::取100μl菌悬液于lb固体培养基划线,37℃过夜培养;
58.步骤s3:按照moi=1条件下分组不同组处理,a组:分别挑取将单菌落于lb液体培养基中,37℃,200rpm,12小时;b组:分别挑取将单菌落于lb液体培养基后与工程性λ噬菌体共培养37℃,200rpm,12小时;
59.步骤s4:将a组和b组分别梯度稀释后涂布平板计数菌落。
60.结果发现,工程λ噬菌体只对肠出血性大肠杆菌具有杀伤作用(图3)。
61.三、肠出血大肠杆菌感染小鼠模型中工程性噬菌体的施用
62.选用体重14-16g,雄性,昆明鼠(分为4组,n=10)
63.a:肠出血性大肠杆菌处理组(ehec);
64.b:肠出血性大肠杆菌处理后野生型λ噬菌体治疗组(ehec+wtλphage);
65.c:肠出血性大肠杆菌处理后,工程λ噬菌体治疗组(ehec+eλphage);
66.d:空白对照组(control)。
67.所有的小鼠断水12小时后,灌胃肠出血性大肠杆菌100μl(1.0
×
10
10
cfu),同时腹腔注射丝裂霉素(2.5mg/kg体重)。攻毒后12小时恢复饮食、饮水。肠出血性大肠杆菌攻毒24小时后,灌胃噬菌体100μl(1.0
×
10
10
pfu)。每天收集小鼠粪便并记录小鼠存活率和体重。灌胃肠出血性大肠杆菌后第四天,每组随机选择3只小鼠取结肠做苏木素-伊红染色。
68.结果发现,感染肠出血性大肠杆菌后小鼠体重均出现下降,但工程λ噬菌体治疗后体重增加,这意味着从感染中恢复。相较于野生型λ噬菌体,工程λ噬菌体具有更好的恢复效果(图4,*p《0.05)。统计小鼠的存活率,感染肠出血性大肠杆菌后a组(未接受治疗组)和b组(野生型λ噬菌体治疗组)小鼠出现死亡,而c组(工程λ噬菌体治疗组)在六天后仍全部存活,反映了工程λ噬菌体对小鼠具有较强的保护作用(图5,**p《0.01,***p《0.001)。根据结肠苏木素-伊红染色切片显示,感染肠出血性大肠杆菌未经治疗组和野生型λ噬菌体治疗组均出现不同程度的炎症浸润,杯状细胞缺失,隐窝缺失(图6)。对结肠苏木素-伊红染色切片从黏膜水肿、炎症浸润和上皮损伤程度打分,每个变量都在0到4的范围内打分。结肠组织学评分进一步说明工程λ噬菌体在肠出血性大肠杆菌感染后对肠道的保护作用(图7,*p《0.05,***p《0.001)。
69.以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
70.71.72.73.74.75.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1