一种3-甾酮-Δ1-脱氢酶突变体及应用
gene of rhodococcus erythropolis sql encoding a second3-ketosteroid delta(1)-dehydrogenase isoenzyme.microbiology,2002,10:3285-3292]。2009年,林建强课题组筛选得到一株brodetella sp.b4菌株,该菌能转化4-ad生成add,add的产量为0.2g/l(40h)。2013年,许正宏课题组将来源于mycobacterium neoaurum的kstd 在毕赤酵母中表达,得到对4-ad酶活力为1.75u/mg的重组菌株[zhang w,shao m,rao z, et a1.bioconversion of 4-androstene-3,17-dione to androst-1,4-diene-3,17-dione byrecombinant bacillus subtilis expressing ksdd gene encoding 3-ketosteroid-deltal-dehydrogenasefrom mycobacterium neoaurum jc-12.j steroid biochem mol biol,2013b,135:36-42]。2014 年,魏东芝课题组在mycobacterium neoaurum atcc25795菌株中克隆了3条kstd基因,对4-ad的酶活力分别为0.54u/mg,0.39u/mg,0.94u/mg[yao k,xu lq,wang fq,et a1. characterization and engineering of 3-ketosteroid-delta-1-dehydrogenase and3-ketosteroid-9α-hydroxylase in mycobacterium neoaurum atcc25795 to produce9α-hydroxy-4-androstene-3,17-dione through the catabolism of sterols.metabolic engineering, 2014,24:181-191]。2017年,吴洽庆课题组研究了来源于mycobacterium smegmatis mc2155 的kstd基因,构建kstd表达菌株可催化氢化可的松合成泼尼松龙,时空产率约为2.53 g/l/h[x.wang,j.feng,d.zhang,q.wu,d.zhu,y.ma,characterization of newrecombinant 3-ketosteroid-δ
1-dehydrogenases for the biotransformation of steroids,appl. microbiol.biot 101(2017)6049-6060]。为了提高3-甾酮-δ
1-脱氢酶催化效率,已有研究通过定点突变改造kstd,2017年,ning等研究者将来源于mycobacterium neoaurum的kstd 进行突变,解析了位于活性中心的关键氨基酸,但并未得到催化活性提升的kstd突变体。 [ning q,shen y,xu y,et al.site-directed mutagenesis under the direction of in silico proteindocking modeling reveals the active site residues of 3-ketosteroid-δ
1-dehydrogenase frommycobacterium neoaurum.world journal of microbiology&biotechnology,2017,33(7)]。综上所述,目前报道的3-甾酮-δ
1-脱氢酶对3-甾酮化合物的活性较低,导致其应用于3-甾酮c1,2 位脱氢药物或药物中间体的合成时仍然面临底物浓度小,底物转化率低等问题。
[0007]
基于此,本发明目的在于通过蛋白质工程手段对3-甾酮-δ
1-脱氢酶进行改造,获得对多数3-甾酮化合物具有高活性的3-甾酮-δ
1-脱氢酶突变体,并应用于3-甾酮c1,2位脱氢药物及药物中间体的合成,促进甾体药物的生产。
技术实现要素:
[0008]
本发明的目的在于针对上述问题,提供一种3-甾酮-δ
1-脱氢酶突变体及其应用。
[0009]
本发明通过全基因合成来源于mycobacterium smegmatis mc2155菌的3-甾酮-δ
1-脱氢酶 (mskstd1),通过对该酶结构进行分析,对其底物通道的氨基酸进行定点突变及基因工程改造,得到3-甾酮-δ
1-脱氢酶突变体,并实现了全细胞催化高效合成泼尼松龙。
[0010]
本发明提供一种3-甾酮-δ
1-脱氢酶突变体基因,所述3-甾酮-δ
1-脱氢酶突变体基因,其核苷酸序列如seq id no:3所示。
[0011]
本发明还提供一种3-甾酮-δ
1-脱氢酶突变体,所述3-甾酮-δ
1-脱氢酶突变体,包括如 seq id no:4所示的氨基酸序列的突变体,所述突变体的突变方式包括指定位置的氨基酸残基突变,所述指定位置选自如seqidno:2所示氨基酸序列的第60位,第141位,第122 位,以及第428位的氨基酸。
[0012]
进一步的,上述指定位置的氨基酸残基突变包括以下任意一种或几种突变方式:突变体格式xny/z,表示第n位氨基酸残基x替换为氨基酸残基y或者氨基酸残基z;具体包括:h141m,v428w,l122f及m60l。
[0013]
更进一步的,所述突变体指定位置的氨基酸残基突变包括所述指定一个或多个位置氨基酸残基替换,表示为mkx,其中x表示共有几个突变位点,具体包括以下任意一种替换方式:
[0014]
单点突变体mk1;h141m;
[0015]
两点突变体mk2:v428w,h141m;
[0016]
三点突变体mk3:l122f,v428w,h141m;
[0017]
四点突变体mk4:m60l,l122f,v428w,h141m。
[0018]
本发明还提供一种重组表达质粒,该重组表达质粒能表达上述3-甾酮-δ
1-脱氢酶突变体。
[0019]
进一步地,将3-甾酮-δ
1-脱氢酶突变体基因连接至质粒pet28a上构建重组表达质粒;构建的重组表达质粒包括pet28a-mk1或pet28a-mk2或pet28a-mk3或pet28a-mk4。 3-甾酮-δ
1-脱氢酶四点突变体基因序列如seq id no:3所示,氨基酸序列如seq id no:4 所示。
[0020]
本发明还提供一种重组菌体,所述重组菌体包含上述重组表达质粒。
[0021]
进一步地,将pet28a-mk1或pet28a-mk2或pet28a-mk3或pet28a-mk4任意一种重组表达质粒转化进大肠杆菌bl21(de3)感受态细胞,构建得3-甾酮-δ
1-脱氢酶突变体重组菌株。
[0022]
本发明还提供上述3-甾酮-δ
1-脱氢酶突变体(重组菌株)在甾体药物及甾体药物中间体制备中的应用。
[0023]
进一步地,所述应用是将3-甾酮-δ
1-脱氢酶突变体催化3-甾酮化合物的c1,c2位脱氢反应,合成泼尼松龙。
[0024]
具体地,所述英语包括以下步骤:将3-甾酮-δ
1-脱氢酶重组表达质粒在大肠杆菌中表达,在100ml,50mm,ph8.0的tris缓冲液中加入5g表达菌体,添加pms30 mm,加入10ml二甲亚砜溶解的浓度为100mm的3-甾酮化合物,在25℃下,200rpm反应0.5-2 h;反应完成后,添加两倍体积乙酸乙酯进行萃取,萃取液加入无水硫酸镁粉末除去有机相中的水,旋转蒸发除去乙酸乙酯,干燥,获得目标产物粉末。
[0025]
采用上述改造策略和定点突变方式在本发明所述的3-甾酮-δ
1-脱氢酶突变体或与其氨基酸序列同源性高于80%的多肽蛋白实施的分子改造应属于本专利涵盖范围。
[0026]
本发明有益效果
[0027]
(1)本发明在温和条件下通过一步反应获得泼尼松龙,底物浓度达36.2g/l。
[0028]
(2)本发明采用理性设计,通过分子对接构建mskstd1-fad-hc复合物结构模型,在底物通道区域,分析识别结合底物氢化可的松的关键氨基酸残基,通过定点突变,在位于底
物通道的非催化腔引入芳香族氨基酸,替换小位阻氨基酸,并消除非催化腔的氨基酸对底物的作用力,从而提高底物进入催化腔的概率,进而提升3-甾酮-δ
1-脱氢酶突变体催化氢化可的松合成泼尼松龙的活力,kstd突变体酶(49.6u/mg)相比野生酶比活力提高了 9.5倍。且3-甾酮-δ
1-脱氢酶突变体可催化氢化可的松(100mm)合成泼尼松龙,相比野生酶(46.2%,反应时间0.5h),对氢化可的松的转化率提高了2.09倍(96%,0.5h)。
[0029]
与现有3-甾酮-δ
1-脱氢反应的其他方法相比,使用本发明的3-甾酮-δ
1-脱氢突变体酶及其全细胞催化剂制备泼尼松龙具有成本低、反应条件温和、环境友好、产品纯度高,具有很好的工业应用前景。
附图说明
[0030]
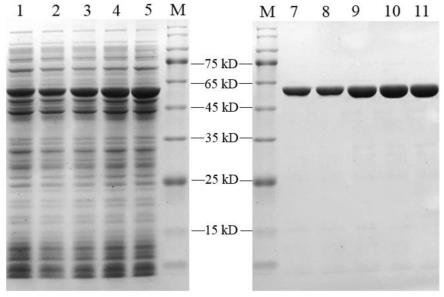
图1野生3-甾酮-δ
1-脱氢酶及其突变体酶表达情况图,m表示蛋白marker,泳道1-5分别代表mskstd1,mk1,mk2,mk3和mk4粗酶液,泳道7-11分别代表mskstd1,mk1, mk2,mk3和mk4纯酶。
[0031]
图2 3-甾酮-δ
1-脱氢酶-fad-hc复合物结构。
[0032]
图3 mskstd1及其突变体的底物谱测定。
[0033]
图4 mskstd1及其突变体全细胞催化氢化可的松的hplc检测图。检测波长254nm,底物氢化可的松出峰时间9.8min,产物泼尼松龙出峰时间9.2min。
具体实施方式
[0034]
以下提供本发明的优选实施例,以助于进一步理解本发明。本领域技术人员应了解到,本发明实施例的说明仅是示例性的,并不是为了限制本发明的方案。
[0035]
实施例1,3-甾酮-δ
1-脱氢酶基因合成,重组菌株的诱导表达及纯化
[0036]
通过全基因合成获得一条来源于mycobacterium smegmatis mc2155的3-甾酮-δ
1-脱氢酶基因(mskstd1,genbank:wp_011728639.1),根据3-甾酮-δ
1-脱氢酶氨基酸序列(seq idno:2)进行密码子优化,获得3-甾酮-δ
1-脱氢酶基因核苷酸序列优化序列如seq id no: 1所示。
[0037]
由捷瑞生物工程(上海)有限公司合成上述核苷酸序列,并通过ndei和hind iii限制性内切酶酶切后,连接到质粒pet28a上构建重组质粒pet28a-mskstd1。
[0038]
将重组质粒(pet28a-mskstd1)或上述连接了3-甾酮-δ
1-脱氢酶突变体基因的重组表达质粒在大肠杆菌bl21(de3)进行异源表达:在平板上挑取单克隆接种到25ml lb液体培养基(含50μg/ml卡那霉素)中,37℃,200rpm过夜培养,获得种子液。移取5ml 种子液转接到500ml lb液体培养基(含50μg/ml卡那霉素)中,37℃,200rpm条件下培养。当重组菌株培养液的od
600
达到0.6~0.8时,加入终浓度为0.1mm iptg(异丙基硫代半乳糖苷,isopropylβ-d-thiogalactoside),在25℃条件下诱导12-14h。4℃、5000rpm 离心10min,收集菌体,用适量tris-hcl缓冲液(50mm,ph8.0)进行重悬,即得mskstd1 及其突变体的全细胞反应液。将收集的菌体用高压匀浆机破碎,12000rpm离心10min收取上清液,然后用亲和层析(镍柱)法纯化回收目的蛋白,目的蛋白经脱盐柱除去咪唑后即得纯酶液。通过sds-page检测酶液纯度,结果如附图1所示,目的蛋白条带单一,达到了电泳纯。
[0039]
实施例2,3-甾酮-δ
1-脱氢酶的定点突变
[0040]
采用理性设计,根据氨基酸序列(seq id no:2)进行蛋白同源建模,通过分子对接构建mskstd1-fad-hc复合物结构模型,在底物通道区域,分析识别及结合底物氢化可的松的关键氨基酸残基,通过定点突变,在位于底物通道的非催化腔引入芳香族氨基酸,替换小位阻氨基酸,并消除非催化腔的氨基酸对底物的作用力,从而提高底物进入催化腔的概率,进而提升3-甾酮-δ
1-脱氢酶催化氢化可的松合成泼尼松龙的活力。上述定点突变为根据seq id no:2所示氨基酸序列的一个或多个位点突变,突变位点包括:第141位,第 428位,第122位及第60位氨基酸。
[0041]
上述指定位置的氨基酸残基突变包括以下任意一种或几种突变方式:突变体格式 xny/z,表示第n位氨基酸残基x替换为氨基酸残基y或者氨基酸残基z;具体包括:h141m,v428w,l122f及m60l。
[0042]
上述定点突变涉及的引物如表2所示,其中加粗斜体表示氨基酸突变位点所采用的三联体密码子碱基序列:seq id no:1
[0043]
表2.引物序列表
[0044][0045]
经上述方式改造mskstd1获得的3-甾酮-δ
1-脱氢酶,指定位置的氨基酸残基突变还包括如表3所示任意一种替换方式:
[0046]
表3
[0047]
突变体名称突变位点野生型(mskstd1)野生型单点突变体(mk1)h141m两点突变体(mk2)v428w/h141m三点突变体(mk3)l122f/v428w/h141m四点突变体(mk4)m60l/l122f/v428w/h141m
[0048]
本发明实施定点突变方式如下所述。此处以141位组氨酸突变为甲硫氨酸残基为例代表性陈述本发明突变方式,其它位置或同一位置突变为其它氨基酸均按本方式实现氨基酸定点突变。
[0049]
以实施例1所述pet28a-mskstd1作为模板,以h141m-f和h141m-r为上下游引物,用takara公司的primerstar聚合酶进行质粒pcr。反应体系如下:质粒模板(30-50ng/μl),上下游引物(10ng/μl)各0.5μl,ddh2o 3.5μl,2
×
primestar 5μl。pcr反应程序:95℃预变性2分钟,98℃变性20秒,60℃退火15秒,72℃延伸5分钟,20个循环,最后72℃再延伸5分钟。添加takara公司dpn i 0.2μl,消化模板质粒1-2h后,取消化产物10μl 转入e.coli bl21(de3)感受态细胞,涂布于含有50mg/l卡那霉素的平板中,置于37℃培养箱培养至长出单克隆。挑取单克隆转化子接入3ml含卡那霉素(50mg/l)lb培养基,待菌液od
600
达到0.6后,采用
0.1mm iptg进行蛋白诱导表达,测定菌体对3-甾酮化合物的转化活性。将活力提升的转化子送测序公司进行核酸测序,确认所得到的单克隆突变株中3-甾酮-δ
1-脱氢酶基因核苷酸序列,表达的3-甾酮-δ
1-脱氢酶突变体为单点突变体mk1。其它位点突变方法与本实施案例相似。
[0050]
实施例3,3-甾酮-δ
1-脱氢酶mskstd1及其突变体全细胞催化的底物谱测定
[0051]
取实施例1中诱导表达后的收获的菌体10mg,用435μl 50mm ph 8.0的tris-hcl 缓冲液重悬,加入50μl 10-100mm底物溶液(1-10号3-甾酮化合物,终浓度10-100mm, 10%二甲亚砜助溶),15μl递氢体pms(浓度为一倍底物当量),置于25℃,200rpm反应0.5-1h。hplc检测产物生成的量,计算转化率。氢化可的松底物反应的液相色谱条件为:c18(shimadzu shimpack,5μm particles,150mm
×
4.6mm),流动相为乙腈:水= 28:72,流速0.8ml/min,柱温35℃,检测波长为254nm,检测时间为12min。其他3
‑ꢀ
甾酮底物转化产物hplc检测条件为:c18(agilent,5μm particles,250mm
×
4.6mm),流动相为乙腈:水=50:50,流速0.8ml/min,柱温35℃,检测波长为254nm。
[0052]
重组表达的3-甾酮-δ
1-脱氢酶突变体mk4高效催化氢化可的松,同时该酶对底物黄体酮,睾酮具有较高活力。说明本发明提供的3-甾酮-δ
1-脱氢酶突变体能够使3-甾酮化合物,特别是氢化可的松,更有效的结合催化腔,从而加强3-甾酮化合物的c1,2位的脱氢。
[0053]
实施例4,3-甾酮-δ
1-脱氢酶突变体制备泼尼松龙
[0054]
上述表达菌体湿菌体制备方法:将上述构建质粒转化入大肠杆菌bl21细胞,获得3
‑ꢀ
甾酮-δ
1-脱氢酶表达菌株。采用常规大肠杆菌蛋白表达方法,经诱导表达后,获得含有3
‑ꢀ
甾酮-δ
1-脱氢酶的大肠杆菌细胞。离心,收集菌体细胞,3-甾酮-δ
1-脱氢酶表达菌的湿菌体。
[0055]
3-甾酮-δ
1-脱氢酶可以是上述实施例3中的任一突变后3-甾酮-δ
1-脱氢酶表达。
[0056]
3-甾酮-δ
1-脱氢酶表达菌体全细胞制备泼尼松龙:
[0057]
3-甾酮-δ
1-脱氢酶表达菌体全细胞制备泼尼松龙,方法如下:100ml反应体系中加入 87ml 50mm、ph 8.0的tris-hcl缓冲液,10ml 100mm氢化可的松溶液(二甲亚砜助溶), 3ml递氢体pms(浓度1m),3-甾酮-δ
1-脱氢酶表达菌体湿菌体含量50g/l,置于25℃, 200rpm反应0.5-1h。hplc检测产物(泼尼松龙)的生成量,计算全细胞催化氢化可的松 c1,2位脱氢的活性。液相色谱条件为:c18反相柱,流动相为乙腈:水=28:72,流速0.8 ml/min,柱温35℃,检测波长为254nm。底物hc及其产物泼尼松龙的出峰时间分别是 9.8min和9.2min。
[0058]
通过上述突变方式,实现3-甾酮-δ
1-脱氢酶酶法合成泼尼松龙,能提高催化活力。上述实施例仅是代表性示范采用本专利3-甾酮-δ
1-脱氢酶制备泼尼松龙的方式,所用3-甾酮-δ
1-脱氢酶突变体也可以是本专利范围内其他mycobacterium smegmatis mc2155来源 kstd的突变体,所述全细胞催化剂也可以是3-甾酮-δ
1-脱氢酶突变体纯酶溶液,或酶粉形式加入反应体系。
[0059]
本发明的3-甾酮-δ
1-脱氢酶催化活力高,反应作为催化剂加入量小,无副产物生成,节省下游分离除杂成本,反应规模达到产业化要求,为泼尼松龙的工业合成提供了新的生物催化剂资源。
[0060]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与
修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1