BrMYC3-2基因过表达在提高植物对真菌病原体抗性中的应用
brmyc3-2基因过表达在提高植物对真菌病原体抗性中的应用
1.本技术为申请号2021106169329、申请日2021年06月03日、发明名称“brmyc2/3/4基因不同拷贝在植物生长中的应用”的分案申请。
技术领域
2.本发明涉及植物基因工程技术领域,具体涉及brmyc3-2基因过表达在提高植物对真菌病原体抗性中的应用。
背景技术:
3.白菜(brassica rapa ssp.pekinensis)属十字花科(cruciferae)芸薹属(brassica)叶用蔬菜,又称
‘
结球白菜’、
‘
黄芽菜’,原产我国华北,有着悠久的栽培历史,现各地广泛栽培,是十字花科芸薹属栽培面积最大的叶用蔬菜。白菜不仅种类繁多,并且具有耐低温,口感脆嫩等特点,还含有丰富的矿物质、类胡萝卜素和硫苷。白菜中含有丰富的硫苷,因其独特的风味和重要次生代谢产物硫苷及其水解产物的抗病虫能力、防癌抗癌、抗氧化作用而引起植物学、医学、生物学、食品等众多学科研究人员的关注。
4.myc2/3/4转录因子作为bhlh iiie家族中的重要成员在茉莉酸介导的生物代谢调控活动中扮演重要角色,目前对myc2/3/4转录因子功能的研究多以模式植物拟南芥为主。虽然白菜与拟南芥拥有共同祖先,但由于其异源三倍体基因组的复杂性,一定程度上影响了硫苷的防御功能在白菜中的应用,有必要深入了解brmyc2/3/4在植物生长发育及吲哚族硫苷代谢中的功能分化。
技术实现要素:
5.本发明的目的是提供brmyc3-2基因过表达在提高植物对真菌病原体抗性中的应用,以解决现有技术的不足。
6.本发明采用以下技术方案:
7.brmyc3-2基因过表达在提高植物对真菌病原体抗性中的应用,brmyc3-2基因编号为braa06g041690.3c,所述植物为拟南芥,所述真菌病原体为核盘菌。
8.本发明的有益效果:
9.本发明发现了brmyc3-2基因过表达可应用于提高植物对真菌病原体抗性,所述植物为拟南芥,所述真菌病原体为核盘菌。
10.本发明为白菜改良育种提供了新的基因资源,从而推进白菜育种进程。
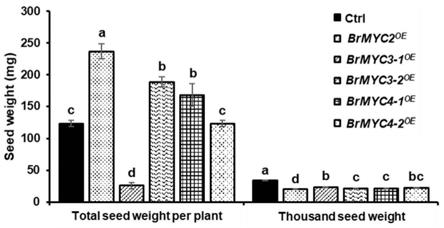
附图说明
11.图1是植物表达载体pcambia2302载体的构建过程。
12.图2是植物表达载体pcambia2301载体nptii扩增测序比对结果;(a)pcambia2301载体nptii扩增测序dna比对结果;(b)pcambia2301载体nptii扩增测序氨基酸比对结果。
13.图3是植物表达载体pcambia2302酶切检测;缩写:lane m,dna marker;lane h,
ddh2o。
14.图4是植物表达载体pcambia2302载体质粒测序比对结果。
15.图5是白菜总rna电泳条带。
16.图6是过表达载体的pcr电泳结果分析;(a)p2302myc4-1过表达载体;(b)从左至右的过表达载体是:p2302myc3-2,p2302myc4-2,p2302myc3-1,p2302myc2;缩写:lane m,dna marker;lane h,ddh2o。
17.图7是p2302myc2/3/4过表达载体转大肠杆菌菌液pcr产物测序比对结果。
18.图8是t3代brmyc2/3/4转基因拟南芥株系的种子生长指标;(a)成熟种子的表型;(b)解剖的成熟角果的表型;(c)种子长度的对比;(d)种子宽度的对比;(e)千粒重的对比;(f)每个长角果种子数的对比;测试的转基因株系分别是ctrl、brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
;随机选择各基因型生长状态健康且较一致的种子和长角果,并在相同条件下拍照;数据显示为来自三个独立生物学重复的平均值
±
sd;使用方差分析进行统计分析,然后进行tukey的多重比较检验(p《0.05);比例尺=500μm。
19.图9是t3代brmyc2/3/4转基因拟南芥株系的单株种子总重和千粒重。
20.图10是t3代brmyc2/3/4转基因拟南芥株系的根和下胚轴长度;(a)6天大的幼苗的表型;(b)根长度的对比;(c)下胚轴长度的对比;转基因株系分别是ctrl、brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
;数据显示为来自三个独立生物学重复的平均值
±
sd;使用方差分析进行统计分析,然后进行tukey的多重比较检验(p《0.05);比例尺=1cm。
21.图11是t3代brmyc2/3/4转基因拟南芥株系营养阶段转变时间差异;(a)28天大的转基因拟南芥表型;(b)叶片表型,数字显示的是出现表皮毛的第一片莲座叶叶位;(c)短时间内转基因拟南芥的叶片生长速率;种植后第12、16、20、24和28天对叶数进行统计;转基因株系分别是ctrl、brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
;数据显示为来自三个独立生物学重复的平均值
±
sd;使用方差分析进行统计分析,然后进行tukey的多重比较检验(p《0.05);比例尺=1cm。
22.图12是t3代brmyc2/3/4转基因拟南芥株系的株高和开花时间;(a)3周大拟南芥的表型;(b)抽薹时间;(c)抽薹时的莲座叶片数量;(d)7周大拟南芥的表型;(e)植株高度;(f)分枝数枝数量;转基因株系分别是ctrl、brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
;数据显示为来自三个独立生物学重复的平均值
±
sd;使用方差分析进行统计分析,然后进行tukey的多重比较检验(p《0.05);比例尺=1cm。
23.图13是t3代brmyc2/3/4转基因拟南芥株系莲座叶的冻干粉在pda上对核盘菌生长的抑制情况;从左到右分别是:ddh2o,ctrl、brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
;在每个培养皿的中央放置一个核盘菌;核盘菌菌丝为白色棉状菌丝体斑块;比例尺=1cm。
具体实施方式
24.下面结合实施例和附图对本发明做更进一步地解释。下列实施例仅用于说明本发明,但并不用来限定本发明的实施范围。
25.1 brmyc2/3/4过表达载体的构建
26.1.1试验材料
27.1.1.1植物材料
28.本研究所用的白菜为
‘
chiifu’(浙江省农产品品质改良技术研究重点实验室品系,即本实验室品系)。植株种植于本实验室光照培养室,生长条件为光强600μmol
·
m-2
·
s-1
、光周期16h光照/8h黑暗、湿度65%、温度16h 28℃/8h 20℃。
29.1.1.2载体与菌种
30.本研究中用到的质粒载体有pcambia2301、pcambia1302、pcambia2302。其中质粒pcambia2301、pcambia1302为构建pcambia2302的载体,由本实验室保存。
31.核盘菌(sclerotinia sclerotiorum)菌种由浙江农林大学农业与食品科学学院时浩杰老师馈赠。
32.1.1.3溶液及培养基配制
33.ctab提取液:称取ctab 20g(2%w/v)、pvp40 20g(2%w/v)、nacl 55.84g(58.44g
·
mol-1
),1m tris-hcl 100ml(ph 8.0)、0.5m edta 40ml(ph 8.0),蒸馏水定容至1l。使用时每1ml提取液中加入1μlβ-巯基乙醇。
34.1l 1m tris-hcl(ph 8.0):称取121.1g tris于1l烧杯中,加入约800ml去离子水,充分搅拌。溶解后加入适量hcl至所需ph值,定容至1l。
35.100ml 0.5m edta(ph=8.0):称取18.612g edta,用去离子水溶解,边溶解边加入naoh颗粒(约2.0g),完全溶解后定容至100ml,调节ph至8.0。
36.100ml 50mg
·
ml-1
卡那霉素(kanamycin,kana):称取5g kana溶于100ml ddh2o,完全溶解后过滤灭菌,-20℃分装保存。
37.20ml 50mg
·
ml-1
庆大霉素(gentamicin,gen):称取1g gen溶于20ml ddh2o,完全溶解后过滤灭菌,-20℃分装保存。
38.20ml 50mg
·
ml-1
利福平(rifampicin,rif):称取1g rif溶于20ml dmso,完全溶解后过滤灭菌,-20℃分装保存。
39.lb固体培养基:蛋白胨(tryptone)10g
·
l-1
,nacl 10g
·
l-1
,酵母提取物(yeast extract)5g
·
l-1
,琼脂8g
·
l-1
,ph 7.0,121℃高压蒸汽灭菌20min。
40.lb液体培养基:tryptone 10g
·
l-1
,nacl 10g
·
l-1
,yeast extract 5g
·
l-1
,ph 7.0,121℃高压蒸汽灭菌20min。
41.1l 1
×
tae电泳液:称取242g tris base,372g edta,57.1ml冰醋酸,定容至1l制成50
×
tae电泳液,使用时稀释50倍。
42.20ml琼脂糖电泳凝胶:称取0.24g agarose g-50加入20ml 1
×
tae,微波炉高温煮沸后待冷却至不烫手背时加入1μl gelstain染料。
43.1.1.4引物合成与测序分析
44.引物合成与测序分析由浙江有康生物科技有限公司完成。
45.1.1.5软件与数据分析
46.引物设计软件为primer primier 5.0;序列分析软件为dnaman 6.0和snapgene v5.0.5;图片处理软件为photoshop cs6和power point 2019。
47.1.2试验方法
48.1.2.1 brmyc2/3/4基因序列及其编码序列的获取
49.brmyc3-1和brmyc3-2,brmyc4-1和brmyc4-2为brmyc2旁系同源基因。brmyc2/3/4
的基因编号braa05g023030.3c(brmyc2),braa09g022310.3c(brmyc3-1),braa06g041690.3c(brmyc3-2),braa01g009460.3c(brmyc4-1),braa01g009470.3c(brmyc4-2)and braa08g000150.3c(brmyc4-3),从brassica database annotations(http://brassicadb.cn/#/annotations/)数据库获得。其编码序列从brassica database gene sequence(http://brassicadb.cn/#/genesequence/)数据库获得。
50.1.2.2重构pcambia2302载体
51.分别提取pcambia2301和pcambia1302的质粒。用hs dna polymerase v201扩增pcambia2301质粒npt ii基因;npt ii基因的扩增引物为p2301 npt ii rc-f:tacaaatctatctctctcgagatggggattgaacaagatg;p2301 npt ii rc-r:attattatggagaaactcgagcttgtcgatcgactctagc(tm=47℃)。上述pcr反应程序为:98℃10s,47℃5s,72℃1min,共30cycles。用xhoi单酶切pcambia1302质粒得到线性化克隆载体。插入片段扩增产物和线性化克隆载体各取2μl进行琼脂糖凝胶电泳以检验扩增产量和特异性,若pcr产物电泳条带单一且大小正确,按照takara minibest agarose gel dna extraction kit ver.4.0提供的方法进行胶回收:紫外灯下切取含有插入片段扩增产物和线性化克隆载体的琼脂糖凝胶于1.5ml离心管中,加入4个凝胶体积量的buffer gm,均匀混合后将离心管置于37℃金属浴令胶块充分溶解。将溶液转移至spin column,12,000pm离心1min,弃滤液;重复此步骤2次以提高dna回收率。加入700μl dna buffer wb,室温12,000pm离心30s,弃滤液,并重复此步骤一次。空离2min,将spin column转移到新的1.5ml离心管中,加入30μl ddh20,室温静置2min后12,000pm离心1min,得到纯化产物(可保存于-20℃)。
52.然后采用ii one step cloning kit试剂盒进行同源重组,构建植物表达载体pcambia2302(图1)。重组产物转化dh5α,转化方法如下:20μl冷却反应液加入到50μl冰上融化的感受态细胞中,轻弹管壁数下混匀,冰上静置30min。42℃金属浴热激45s,迅速转移至冰水浴孵育2min。向离心管中加入1ml不含抗生素的液体lb培养基,37℃200rpm复苏60min。取100μl复苏液均匀涂布于含有50mg
·
l-1
kana的lb固体培养基上,37℃倒置培养12h。挑取重组产物转化平板上若干个单菌落于含有相同浓度kana的lb液体培养基中过夜培养,用于菌落pcr鉴定。pcambia2302的鉴定通过扩增的npt ii基因进行,测序及菌落pcr引物为p2302 npt ii-f:cttcgcaagaccttcctcta;p2302 npt ii-r;ctgggaactactcacacatt(tm=50℃)。上述pcr反应程序为:94℃3min;94℃3min,50℃30s,72℃1min,共35cycles;72℃10min。同时设空白对照(未加模板dna)。选择菌落pcr鉴定为阳性的菌落,将菌液进行一代测序。测序结果无误后,采用冻融法将质粒pcambia2302导入gv3101感受态细胞中,具体转化步骤如下:
53.(1)取-80℃保存的gv3101农杆菌感受态于冰上自然融化。
54.(2)每100μl感受态加入1μg重组质粒dna(体积最好不应超过10μl),轻弹管壁,分别于冰上静置5min、液氮5min、37℃水浴5min、冰浴5min。
55.(4)加入1ml无抗生素的液体lb培养基,28℃200rpm摇床上振荡培养3h。
56.(5)6000rpm离心1min收集菌体,留取100μl上清液,用移液枪轻轻吹打,以令菌块重悬。将其涂布于含有kana的lb平板上倒置放于28℃培养箱培养48h。
57.(6)挑取单菌落接种于液体lb培养基中(含50mg
·
l-1
gen、50mg
·
l-1
rif和50mg
·
l-1
kana),28℃,200rpm振荡培养48h,将菌液用于菌液pcr鉴定,结果为阳性的菌种保藏于-20
℃。随机挑取1个转化单菌落进行质粒测序分析。
58.1.2.3 brmyc2/3/4转录因子编码区克隆
59.1.2.3.1白菜总rna提取及cdna合成
60.选取生长状态良好的
‘
chiifu’野生型白菜幼苗,待幼苗长至五叶一心期时选取每个植株的第五片功能叶(从顶端向下数第五片)用作rna提取材料。采用trizol法抽提植物基因组rna,具体方法如下:
61.(1)准备试验材料。提前将研钵、研磨棒、药匙等用锡箔纸包裹高温灭菌,180℃烘干12h;大、中、小枪头和2ml离心管用depc水处理72℃过夜烘干;75%乙醇用depc去离子水配制,提前预冷氯仿、异丙醇和total rna extractor。
62.(2)取100mg新鲜样品于液氮中充分研磨粒,至少三次液氮研磨以保证叶片细胞破碎。加入适量total rna extractor后匀浆分装置2ml离心管中,将匀浆液室温静置5min,12,000rpm 4℃离心5min,使得核蛋白与核酸完全分离。
63.(3)取上清液转置新的2ml离心管中。加入0.2ml氯仿,涡旋15s,室温放置3min。12,000rpm 4℃离心10min。
64.(4)吸取上层水相转移至干净的离心管中,加入等体积异丙醇,混匀,室温放置20min。
65.(5)12,000rpm 4℃离心10min,弃上清。
66.(6)加入1ml用depc处理过的水配制的75%乙醇洗涤沉淀。12,000rpm 4℃离心3min,弃上清。室温干燥5min。
67.(7)加入30μl rnase-free ddh2o,充分溶解rna。检测rna的浓度及纯度,rna纯度a260/a280的比值范围应在1.8~2.1之间。然后取2μl做琼脂糖凝胶电泳检测。检测无误后将所得到的rna溶液置于-80℃保存或用于后续试验。dna消化与cdna合成采用primescript
tm ii 1st strand cdna synthesis kit试剂盒,反转录反应体系如表1所示:
68.表1反转录反应体系
[0069][0070]
用移液枪混匀后,65℃温浴5min,冰上冷却2min,然后用上述反应液配制下列混合液(表2)。
[0071]
表2
[0072][0073]
用移液枪缓慢混匀上述样品,进行pcr反转录。
[0074]
上述pcr反应程序为:45℃60min,95℃5min。反应结束后,立即置于冰上冷却,rt-pcr扩增得到的产物置于-20℃保存或用于后续试验。
[0075]
1.2.3.2白菜dna提取
[0076]
采用ctab法抽提植物基因组dna,dna提取材料的选择同1.2.3.1。具体方法如下:
[0077]
(1)将叶片洗净晾干后,取0.2g放入1.5ml离心管中,液氮研磨后,加700μl65℃预热的2%ctab混匀,65℃水浴1h,期间每隔10min轻摇一次。
[0078]
(2)取出上述离心管冷却至室温,加入650μl 24:1氯仿异戊醇溶液,颠倒混匀,静置10min。
[0079]
(3)13000rpm离心10min,取上清液继续加入550μl 24:1氯仿异戊醇溶液,颠倒混匀,静置10min。
[0080]
(4)13000rpm离心10min,取上清液加入400μl冰浴的异丙醇,-20℃中保存20min。
[0081]
(5)13000rpm离心10min,弃上清液,往剩余沉淀中加入500μl 80%乙醇清洗两次(吸打混匀),超净台吹干。
[0082]
(6)使用前,往干透的沉淀物中加30μl ddh2o使其溶解,室温静置5min,用移液枪吸打混匀后,再静置5min。
[0083]
(7)吸取1.5μl做dna浓度、纯度检测,再取2μl做琼脂糖凝胶电泳检测。检测无误后将得到的dna溶液置于-20℃保存用于后续试验。
[0084]
1.2.3.3引物设计及合成
[0085]
引物设计采用primer primier 5.0。最后由浙江有康生物科技有限公司合成引物。引物设计如表3所示。
[0086]
表3基因克隆引物设计
[0087][0088]
1.2.3.4插入片段pcr扩增与线性化载体的获取
[0089]
以植物基因组dna或反转录获得的cdna为扩增模板,用高保真kod酶扩增插入片段,pcr扩增反应体系如表4所示:
[0090]
表4 pcr扩增反应体系
[0091]
[0092][0093]
pcr程序设定如下:94℃3min;98℃10s,52℃30s,68℃2min,共40cycles;68℃10min。用ncoi单酶切pcambia2302质粒得到线性化克隆载体。对插入片段扩增产物和线性化克隆载体进行琼脂糖凝胶电泳以检验扩增产量和特异性,若pcr产物电泳条带单一且大小正确,按照takara minibest agarose gel dna extraction kit ver.4.0提供的方法进行胶回收。
[0094]
1.2.4 p2302myc过表达载体构建
[0095]
过表达载体采用ii one step cloning kit同源重组方法,反应体系如表5所示:
[0096]
表5同源重组体系
[0097][0098]
配制完体系后,吸打混匀各组分。37℃反应30min后,立即将反应管置于冰浴中冷却5min。采用热激法将各基因冷却反应液各20μl分别转化适量dh5α。37℃培养过夜,挑取阳性克隆进行菌落pcr验证和琼脂糖凝胶电泳检测。
[0099]
验证引物为p2302myc-f:tcccactatccttcgcaaga;p2302myc-r:gaattgggacaactccagtg(tm=52℃)。pcr产物进行一代测序,若测序结果无误,提取各基因过表达载体质粒冻融法转化gv3101感受态。
[0100]
1.3结果与分析
[0101]
1.3.1 pcambia2302植物表达载体的构建及鉴定
[0102]
扩增的pcambia2301 npt ii基因序列分析结果如图2所示。同源重组后,酶切检测质粒pcambia2302转化大肠杆菌的产物,条带1-13为随机挑取的13个单菌落,在切时切下982bp大小片段,而对照(泳道h)加入ddh2o。凝胶电泳结果与预期相符(图3)。将pcmabia2302质粒转化农杆菌,挑取单克隆活化,质粒测序比对结果如图4所示。说明pcambia2302植物表达载体构建成功,该载体的gus基因被gdp基因成功替换,且t-dna区段只含有npt ii基因。
[0103]
1.3.2白菜目的基因获取与目的基因的扩增
[0104]
将trizol法提取后的白菜rna立刻做琼脂糖凝胶电泳检测,检测结果出现三个条带,从下往上依次为5s、18s以及28s条带,且18s条带亮度约为28s条带亮度的1/2倍,rna条带明亮、清晰。核酸分子中含有碱基使核酸在260nm下有最大吸收,通过nanodrop2000核酸分析仪测得本次提取的rna平均浓度为2367.1ng
·
μl-1
,a260/a280值为1.98,a260/a230值为2.21,说明样品纯度良好(图5)。依照测得的rna浓度进行cdna反转录,同时将ctab法提取后的白菜基因组dna和cdna做琼脂糖凝胶电泳检测,条带大小无误,可将获得的brmyc2/3/4
基因片段与pcambia2302线性载体重组。
[0105]
1.3.3 p2302myc过表达载体的构建及鉴定
[0106]
扩增产物构建到pcambia2302载体后转入大肠杆菌并挑取单克隆进行菌落pcr鉴定,电泳条带与目的基因条带位置一致且亮度较高的可初步判定为阳性菌落。myc2、myc3-1、myc3-2、myc4-1和myc4-2扩增的目的条带大小分别是1860bp、1734bp、1785bp、1317bp和936bp(图6)。而brmyc4-3只有163bp,因此未对其进行扩增。随后将目的条带pcr产物送公司做序列比对。菌落pcr及测序结果与预期相符(图7),提取质粒转化农杆菌。
[0107]
2 brmyc2/3/4过表达转基因拟南芥的获得和功能验证
[0108]
2.1试验材料
[0109]
2.1.1植物材料
[0110]
本研究中异源表达载体遗传转化所采用的是columbia生态型拟南芥。植株种植条件同1.1.1。
[0111]
2.1.2试验菌株
[0112]
使用1.2.4构建的p2302myc2/3/4过表达载体转化的农杆菌。
[0113]
2.1.3溶液及培养基配制
[0114]
ms悬浮液:1/4ms+6%蔗糖+ddh2o+0.02%silwet+l-77
[0115]
100ml 1m甘露醇:18.217g甘露醇溶于100ml ddh2o,25℃加热溶解。
[0116]
20ml 5mm sinigrin:41.548mg溶于20ml超声后的水,-20℃分装保存。
[0117]
100ml deae sephadex a25:2.5g deae sephadex a25+200ml蒸馏水煮2h,4℃分装保存。
[0118]
25ml sio2:1g sio2+25ml蒸馏水。
[0119]
20ml 0.1%硫酸酯酶:0.02g硫酸酯酶+20ml蒸馏水,-20℃分装保存。
[0120]
其余溶液及培养基配制同1.1.3。
[0121]
2.2试验方法
[0122]
2.2.1拟南芥的浸花转化和筛选
[0123]
选取生长健壮的长出多个花序的5-w-old拟南芥单株进行花序侵染。过表达载体农杆菌需提前活化,离心带有目的菌株的液体lb获取菌块,利用ms悬浮液重悬后令溶液od
600
≈0.8,将悬浮液倒入合适规格的量筒中准备拟南芥侵染。步骤如下:
[0124]
(1)去除拟南芥种荚和完全开放的花蕾。
[0125]
(2)保鲜膜包住拟南芥穴盆,防止倒扣侵染时基质漏出。
[0126]
(3)将含苞待放的拟南芥花序插入菌液悬浮液中,侵染60s,所有花序必须浸没于悬浮液中。
[0127]
(4)侵染完毕后,吸除拟南芥花薹上多余菌液,将拟南芥提前放入铺好报纸并湿润的干净穴盘中,盖上透明托盘盖和干报纸,置于黑暗阴凉处侵染24h。
[0128]
(5)次日去掉包裹的保鲜膜,扶正侵染完毕的拟南芥,置于人工气候箱或人工气候室中(不要将植株置于高温或强光照,避免烧死)。
[0129]
(6)若拟南芥长势良好,一周后侵染第2次(重复以上步骤)。
[0130]
(7)果夹成熟掉落之前保持土壤湿润,浇水保持见干见湿原则。
[0131]
(8)单株收种,并做好标记。
[0132]
2.2.2转基因拟南芥植物的分子检测与筛选
[0133]
(1)转基因拟南芥的pcr检测。阳性植株p2302myc2/3/4和pcambia2302的莲座叶为材料,用于dna的提取,利用pcambia2302载体中标记基因npt ii的检测引物p2302 npt ii-f和p2302 npt ii-r(同1.2.2)进行pcr阳性检测。
[0134]
(2)在存在kana的情况下,根据t2系的3:1分离比例,在t3代选择具有单拷贝转基因插入片段的纯合植物。收获来自t3转基因植物的叶样品,在液氮中冷冻,并在-80℃下保存直至以后使用。每个试验使用三个独立的生物学重复。
[0135]
2.2.3过表达转基因拟南芥种子的产量评估
[0136]
为了确定种子产量,从每种基因型的t3株系中提取了三十株植物。角果成熟后,从主花序轴上除去了前五个不完全发育的角果。然后使用第一个完整的角果评估每个角果的种子数量。将成熟的角果铺在a4纸上,并用解剖针将心皮壁去除,然后用leica立体显微镜(mz16fa,leica,germany)拍照,以计算每个角果的种子数。使其余的角果成熟,并从位于主要花序基础上的角果中选择种子进行观察。使用leica立体显微镜从p2302myc2/3/4和pcambia2302转基因株系中随机选择,观察和拍照大约2,000个成熟种子。使用imagej软件(imagej,1.47v,nih,bethesda,usa)估算种子的长度和宽度。使用电子秤测量种子重量。数据代表三个生物学重复的平均值。
[0137]
2.2.4过表达转基因拟南芥植株生长阶段的评估
[0138]
为了评估过表达拟南芥不同基因型之间生长阶段的转变差异,从每个t3系中随机选择了约30株幼苗,移栽至灭菌的草炭土和蛭石(1:1)基质中,置于温室中生长约2-3周。为了评估幼苗是否已达到成熟期,使用leica立体显微镜观察叶片背面表皮毛,并将表皮毛的出现作为营养生长阶段转变时间的标志进行评分。为了进行叶片形状分析,将完全展开的叶片除去,用双面胶带粘贴在纸板上,用透明胶带压平,然后使用epson v700 professional扫描仪(epson,suwa,japan)进行扫描。记录抽薹时间和抽薹时的莲座叶数,以确定拟南芥的开花时间。开花后确定植株株高和分枝数数量。照片取自标尺附近的植物,该标尺用于校准imagej软件以精确测量距离。根据不同大小的拟南芥的轮廓估算最大高度(从生长点到最高的叶尖,如垂直线所示)。所有测量均进行三次独立的生物学重复。
[0139]
2.2.5过表达转基因拟南芥硫苷含量测定
[0140]
转基因拟南芥株系的纯合t3世代幼苗莲座叶用于测定硫苷含量。hplc分析使用agilent1200系统(agilent technologies,inc.,santa clara,usa)和c18反相柱(250
×
4mm,5μm,bischoff,germany)进行。在60min内以1ml
·
min-1
的流速按以下顺序进行色谱分析:100%h2o(2min),0%-20%acn的线性梯度(32min),20%acn(6min),然后注入20%-100%acn(5min)和0%acn,然后再注入下一个样品。用uv检测器在229nm下监测洗脱液。根据液相色谱图的出峰时间对测得的硫苷各组分进行鉴定,含量根据内标sinigrin量和相应响应因子进行计算,以每克干重中硫苷微摩尔数(μmol
·
g-1
dw)为单位。试验进行了三次生物学重复和三次技术重复,数据采用spss软件进行分析。
[0141]
2.2.6过表达转基因拟南芥抗真菌活性生物测定
[0142]
每个转基因拟南芥株系的冻干叶粉被用于研究不同硫苷的组成和含量对核盘菌可见生长的影响。核盘菌(sclerotinia sclerotiorum)保存于4℃,然后在含有马铃薯葡萄糖琼脂(pda)培养基(becton dickinson,columbia,md)的培养皿中重新活化。用5mm打孔器
将菌丝体接种到中心。然后将培养皿在22℃下孵育72h,以提供活跃生长的菌丝体用于后续试验。用打孔器切下培育72h pda培养基中的菌丝边缘,得到直径5mm的带有生长均匀核盘菌的琼脂筛。将该琼脂筛置于新的pda培养基表面的中心位置,然后将3个直径为10mm的滤纸圆片均匀放在pda培养基的边缘。每个滤纸圆片仅接受25mg冻干粉和100μl ddh2o,以100μl ddh2o作为对照。将装有核盘菌和冻干粉的的培养皿在22℃下孵育72h后,通过观察可见的菌丝生长和每块培养皿的菌核数来评估核盘菌的生长。试验进行了三次生物学重复和三次技术重复。
[0143]
2.3结果与分析
[0144]
2.3.1过表达brmyc2/3/4对拟南芥种子产量的影响
[0145]
分析了brmyc2/3/4过表达转基因拟南芥(分别命名为brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
和brmyc4-2
oe
)和空载体pcambia2302作为对照的转基因拟南芥(命名为ctrl)植株的种子产量,包括种子大小(长度和宽度),千粒重,每角果种子数和单株种子总重。为了最大程度地减少环境因素对种子发育的影响,将所有植物都保持在相同的生长条件下,包括温度,光照,水分和营养。如图8和9所示,不同转基因植物的种子产量存在显著差异。brmyc2
oe
株系的种子长度最小;brmyc2
oe
,brmyc3-2
oe
和brmyc4-1
oe
之间,brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
之间,以及brmyc4-1
oe
、brmyc4-2
oe
和brmyc3-1
oe
之间的种子长度没有显著差异,所有这些均显著小于对照(图8c)。brmyc3-2
oe
和brmyc4-1
oe
株系具有最小的种子宽度,其次为brmyc4-2
oe
、brmyc2
oe
、brmyc3-1
oe
、ctrl,brmyc3-2
oe
、brmyc4-1
oe
和brmyc4-2
oe
之间以及brmyc4-2
oe
、brmyc2
oe
和brmyc3-1
oe
之间以及brmyc3-1
oe
和对照之间没有显著差异(图8d)。与对照相比,所有转基因株系的千粒重均显著降低(图8e)。brmyc2
oe
株系的种子千粒重最小,其次是brmyc3-2
oe
,brmyc4-1
oe
,brmyc4-2
oe
和brmyc3-1
oe
。brmyc3-1
oe
的种子千粒重稍高于brmyc3-2
oe
和brmyc4-1
oe
,而brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
的种子千粒重以及brmyc4-2
oe
和brmyc3-1
oe
之间的种子千粒重没有显著差异。brmyc2
oe
株系单个角果的种子数最少,而所有其他转基因株系单个角果种子数均显著高于对照(图8b和8f)。转基因的brmyc4-1
oe
株系单个角果的种子数最多,其次是brmyc3-2
oe
,brmyc3-1
oe
,brmyc4-2
oe
。如图9所示,brmyc2
oe
株系的单株种子总重最高,其次为brmyc3-2
oe
、brmyc4-1
oe
。brmyc2
oe
、brmyc3-2
oe
、brmyc4-1
oe
均高于对照。brmyc4-2
oe
和对照没有显著差异,brmyc3-1
oe
显著低于对照。
[0146]
2.3.2过表达brmyc2/3/4对拟南芥植株发育的影响
[0147]
为了确定brmyc2/3/4表达是否影响营养生长和生殖发育,在拟南芥幼苗和抽薹阶段观察并分析了brmyc2/3/4过表达转基因拟南芥植株的表型(图10-12)。
[0148]
幼年营养生长期,我们研究了幼苗的根和下胚轴长度。对照和转基因植株之间的根和下胚轴长度均有显著差异(图10)。brmyc2
oe
株系表现出最短的根长,其次是brmyc3-1
oe
,brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
(图10b)。brmyc2
oe
和brmyc3-1
oe
株系的根长短于对照。尽管brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
系之间没有显著差异,但它们的根长比对照显著增加。转基因brmyc2
oe
的下胚轴长度也最短,其次是brmyc3-1
oe
,brmyc4-2
oe
,brmyc4-1
oe
和brmyc3-2
oe
(图10c)。brmyc2
oe
的下胚轴长度比对照短,而brmyc3-1
oe
,brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
的下胚轴长度比对照长。因此,brmyc2
oe
和brmyc3-1
oe
的表达抑制了拟南芥中的根伸长,brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
的表达促进了拟南芥中的根伸长。brmyc2
oe
的表达抑制了拟南芥的下胚轴伸长,brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
的表达促进了拟南芥的下胚轴伸长。
[0149]
种子播种后约3-4周,拟南芥幼苗从幼年期过渡到成年营养生长期(图11)。转基因植物的叶片形状正常,与对照叶片没有区别。与对照相比,brmyc2
oe
、brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
过表达转基因植株产生具有表皮毛的第一片叶子的叶位低,而brmyc4-2
oe
与对照没有显著差异(图11b)。对于叶片生长速率,brmyc2
oe
、brmyc3-1
oe
、brmyc4-1
oe
、brmyc4-2
oe
明显快于对照,但brmyc3-2
oe
与对照相似(图11c)。
[0150]
至于生殖生长期,我们研究了抽薹时间,抽薹期的莲座叶数,株高和分蘖数(图12)。brmyc2
oe
的抽薹时间明显较快,而brmyc3-2
oe
和brmyc4-2
oe
的抽薹时间均比对照慢。brmyc3-1
oe
和brmyc4-1
oe
的抽薹时间均与对照相似(图12a和12b)。与对照相比,brmyc2
oe
、brmyc3-1
oe
、brmyc4-1
oe
过表达转基因植株抽薹时莲座叶的数量显著减少,而brmyc3-2
oe
、brmyc4-2
oe
则增加(图12a和12c)。抽薹时莲座丛叶的数量可作为开花时间的判断依据,并且晚开花植物的莲座丛叶较多。因此,在拟南芥中,brmyc2
oe
,brmyc3-1
oe
和brmyc4-1
oe
的异源过表达促使开花时间提前,而brmyc3-2
oe
和brmyc4-2
oe
的异源过表达促使拟南芥开花时间推迟。在株高方面,与对照相比,brmyc2
oe
的株高显著增加,而brmyc3-2
oe
,brmyc4-1
oe
和brmyc4-2
oe
显著降低。而且,brmyc3-2
oe
和brmyc4-2
oe
之间以及brmyc3-1
oe
和对照之间没有显著差异(图12a和12e)。brmyc2
oe
和brmyc3-1
oe
的分枝数显著高于对照,而brmyc3-2
oe
,brmyc4-1
oe
,brmyc4-2
oe
和对照之间没有显著差异(图12a和12f)。
[0151]
2.3.3过表达转基因拟南芥硫苷含量分析
[0152]
为了研究brmyc2/3/4的异源过表达对硫苷代谢的影响,使用hplc测定了t3株系叶片中硫苷的种类与含量。与对照相比,转基因株系的大多数短链和长链脂肪族硫苷和吲哚族硫苷的水平均显著增加(表6)。源自高甲硫氨酸的glucoiberin(gbr)在brmyc2
oe
株系中增加了2.5倍。brmyc2
oe
株系中,源自二高甲硫氨酸的脂肪族硫苷glucoerucin(gec)和glucoraphanin(grn)分别增加了3.0倍和2.1倍。来自三高甲硫氨酸的glucoalyssin(gas)在brmyc2
oe
株系中增加了2.2倍。衍生自五亚甲硫氨酸的glucohirsutin(ght)在brmyc2
oe
中增加3.9倍,在brmyc3-1
oe
中增加1.9倍,在brmyc4-1
oe
中增加1.8倍。brmyc2
oe
吲哚族硫苷为主,例如gbc,4megbc和neogbc,分别增加了1.5倍,8.7倍和3倍。brmyc3-1
oe
的4megbc增加了4.6倍。在brmyc3-1
oe
、brmyc3-2
oe
、brmyc4-1
oe
、brmyc4-2
oe
过表达转基因拟南芥中,neogbc分别增加了2.8倍,1.8倍,2.6倍和2.0倍。如表7所示,在brmyc2
oe
、brmyc3-1
oe
、brmyc4-1
oe
过表达转基因拟南芥中,脂肪族硫苷分别增加了2.9,1.7和1.6倍。在brmyc2
oe
、brmyc3-1
oe
过表达转基因拟南芥中,吲哚族硫苷分别增加了4.6倍和2.9倍。在brmyc2
oe
、brmyc3-1
oe
、brmyc4-1
oe
过表达转基因拟南芥中,总gs分别增加了3.0倍,1.7倍和1.6倍。因此,除brmyc4-2
oe
外,所有株系中大多数脂肪族硫苷和吲哚族硫苷的水平均显著增加。
[0153]
表6单个硫苷gs含量(μmol
·
g-1
dw)
[0154]
[0155]
注:数据表示一式三份样品的平均值
±
标准偏差。使用anova进行统计分析,然后进行tukey的多重比较检验(p《0.05)。缩写:4megbc,4-methoxyglucobrassicin;4-ohgbc,4-hydroxyglucobrassicin;gas,glucoalyssin;gbc,glucobrassicin;gb,gluconapin;grn,glucoraphanin;neogbc,neoglucobrassicin;gbr,glucoiberin;gbv,glucoiberverin;gec,glucoerucin;ght,glucohirsutin;gna,gluconapin;grn,glucoraphanin;neogbc,neoglucobrassicin.
[0156]
表7总硫苷gs含量(μmol
·
g-1
dw)
[0157][0158]
注:数据表示一式三份样品的平均值
±
标准偏差。使用anova进行统计分析,然后进行tukey的多重比较检验(p《0.05)。缩写:ags,aliphatic glucosinolate;igs,indole glucosinolate.
[0159]
2.3.4过表达转基因拟南芥体外抗真菌活性分析
[0160]
为了研究转基因拟南芥对核盘菌的抵抗程度,取每种转基因植株莲座叶的冻干粉25mg
×
3均匀分布在菌丝周围。培养72小时后,斑块状棉质菌丝体以肉眼可见的变化生长(图13)。在brmyc2
oe
中发现最薄的核盘菌菌斑,其次是brmyc3-1
oe
,brmyc4-1
oe
,brmyc3-2
oe
和brmyc4-2
oe
。对照株系表达载体对照显示出比ddh2o对照薄得多的核盘菌菌斑,表明ctrl存在的内源基础硫苷水平在一定程度上抑制了核盘菌的生长。值得注意的是,对照显示出比brmyc2/3/4过表达转基因株系更厚的核盘菌菌斑。这可能是由于brmyc2/3/4过表达转基因株系中积累的更高含量的硫苷,进而抑制了核盘菌菌丝的生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1