粘性生物样本液化剂及其组合产品、试剂盒、扩增方法、检测方法和应用与流程
1.本发明涉及生物样本处理技术领域,具体而言,涉及粘性生物样本液化剂及其组合产品、试剂盒、扩增方法、检测方法和应用。
背景技术:
2.随着荧光定量pcr以及多重pcr等技术在病原体检测领域的快速发展,通过痰液样本类型检测是否感染相应的病原体种类的需求日益增加。然而痰液样本具有粘度大、蛋白多、成分复杂的特点,包含粘蛋白和其它多种蛋白(如免疫蛋白)、多种酶类、脱落细胞、微生物及其它吸入杂质等,不便于直接检测,临床上痰液样本的检测需要先对痰液进行液化处理。
3.常见的痰液液化方法为氢氧化钠法、dtt(二硫苏糖醇)法以及蛋白酶法。氢氧化钠法是最常用的痰液液化方法,该方法比较简单,利用主成分为一定浓度的氢氧化钠溶液在60℃~80℃(也可在室温条件下)液化痰液,该方法用于核酸检测时其强碱性环境易造成核酸损失。蛋白酶法的原理是利用蛋白酶消化痰液黏蛋白,该方法的酶解反应耗时较长,所需蛋白酶成本较高,且黏蛋白消化效率低。dtt(二硫苏糖醇)法是目前最常用的痰液液化方法,利用含巯基(-sh)的dtt(二硫苏糖醇)断裂痰液中导致粘稠的主要成分粘蛋白,以pbs缓冲液(磷酸盐缓冲液)提供生理缓冲,通常还会加入乙醇等固定细胞。该方法耗时长,且使用的dtt(二硫苏糖醇)成本较高,且dtt稳定性差,需要在低温条件下保存,同时dtt存在一定的毒性,不适合临床上大批量处理痰液样本。
4.由于痰液样本粘度大,干扰组分较多,对其采用传统方式进行核酸检测时,样本经液化后,仍需进行释放、提纯等复杂的样品处理过程,以便去除抑制pcr反应的因素,才能进行核酸的扩增和/或检测。这就导致从采集到样本到进行检测,需要经过繁琐的步骤,操作复杂,耗时长,成本高,不适合临床上大批量处理痰液样本。
5.有鉴于此,本领域亟需开发一种粘性生物样本的快速处理方法。
技术实现要素:
6.基于此,本发明的目的包括提供能够快速处理粘性生物样本液化剂,该液化剂能够在液化样本后免释放、免提取,直接用于核酸的扩增和/或检测,简化操作,降低成本,降低检测时间,加快检测结果的获取。本发明提供的粘性生物样本液化剂为可直扩型的液化剂,可以单独提供,还可以提供粘性生物样本液化保存组合产品或液化试剂盒。
7.在本发明的第一方面,提供一种粘性生物样本液化剂,包括如下组分:20mmol/l~1mol/l愈创甘油醚、第一强碱、20mmol/l~200mmol/l莎梵婷和第一水性溶剂;所述粘性生物样本液化剂的ph≥10。
8.在本发明的一些实施方式中,所述创甘油醚和所述莎梵婷的质量比为(1~5):1;及/或,
9.所述愈创甘油醚的浓度为20mmol/l~500mmol/l;及/或,
10.所述莎梵婷的浓度为20mmol/l~150mmol/l;及/或,
11.所述第一强碱为氢氧化钠和/或氢氧化钾;及/或,
12.所述粘性生物样本液化剂的ph为10~14。
13.在本发明的一些实施方式中,所述愈创甘油醚和所述莎梵婷的质量比为(2~5):1;及/或,
14.所述愈创甘油醚的浓度为80mmol/l~120mmol/l;及/或,
15.所述莎梵婷的浓度为30mmol/l~60mmol/l;及/或,
16.所述粘性生物样本液化剂的ph为10~12或12~14。
17.在本发明的一些实施方式中,所述粘性生物样本液化剂中,所述第一水性溶剂为水或第一缓冲组分。
18.在本发明的一些实施方式中,所述第一水性溶剂为无rna酶的水;及/或,
19.所述第一缓冲组分选自tris-hcl、磷酸二氢钾-氢氧化钠缓冲液、磷酸氢二钠-磷酸二氢钾缓冲液和磷酸氢二钠-柠檬酸缓冲液中的一种或多种的组合。
20.在本发明的一些实施方式中,所述第一水性溶剂为无核酸酶的水。
21.在本发明的一些实施方式中,所述粘性生物样本液化剂还包括吸附剂和刚性微颗粒中的一种或两种。
22.在本发明的一些实施方式中,所述吸附剂为螯合树脂。
23.在本发明的一些实施方式中,所述吸附剂为chelex树脂;及/或,所述吸附剂在所述粘性生物样本液化剂中的用量为1%~15%(w/v)。
24.在本发明的一些实施方式中,所述刚性微颗粒选自氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉和玛瑙中的一种或多种;及/或,
25.所述刚性微颗粒为球体、近球体、椭球体、柱状、棒状、多面体或不规则形状;及/或,
26.所述刚性微颗粒的平均粒径为0.01mm~10mm;及/或,
27.所述刚性微颗粒的用量为0.1g/ml~2g/ml。
28.在本发明的一些实施方式中,包括如下组分:80mmol/l~120mmol/l愈创甘油醚、8mmol/l~12mmol/l氢氧化钠、0.5g/ml~1.5g/ml的平均粒径为0.1mm~10mm的氧化锆珠、5%~10%(w/v)吸附剂、30mmol/l~60mmol/l莎梵婷和所述第一水性溶剂。
29.在本发明的一些实施方式中,所述刚性微颗粒选自氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉和玛瑙中的一种或多种;及/或,
30.所述刚性微颗粒为球体、近球体、椭球体、柱状、棒状、多面体或不规则形状;及/或,
31.所述刚性微颗粒的平均粒径为0.01mm~10mm;及/或,
32.所述刚性微颗粒的用量为0.1g/ml~2g/ml。
33.在本发明的一些实施方式中,所述粘性生物样本液化剂还包含1mmol/l~200mmol/l的na
+
和/或k
+
。
34.本发明的第一方面所提供的粘性生物样本液化剂能兼容扩增体系。
35.在本发明的一些实施方式中,该粘性生物样本液化剂能够在液化后直接进行核酸
扩增。“核酸扩增”可以为dna扩增和/或rna扩增。核酸扩增方式可以任选本领域中合适的dna和/或rna的扩增方式。
36.在本发明的一些实施方式中,本发明的第一方面所提供的粘性生物样本液化剂为可直扩型,进一步可以为dna和/或rna直扩型。在一些优选例中,该粘性生物样本液化剂为pcr直扩型。
37.在本发明的第二方面,提供一种粘性生物样本液化保存组合产品,包括液化组分和保存组分;其中,所述液化组分包括本发明的第一方面任一种所述粘性生物样本液化剂中的各组分。
38.在本发明的第三方面,提供一种液化试剂盒,包括液化组分、可选的保存组分和可选的扩增组分;其中,所述液化组分包括:
39.组分l1):愈创甘油醚;
40.组分l2):第一强碱,所述第一强碱能够调节ph≥10;
41.组分l3):莎梵婷;
42.组分l4):可选的钠源和/或钾源;
43.组分l5):可选的第一水性溶剂;
44.组分l6):可选的吸附剂;和
45.组分l7):可选的刚性微颗粒;
46.各“可选的”各自独立地表示存在或不存在。
47.在本发明的一些实施方式中,所述第一强碱为氢氧化钠和/或氢氧化钾;及/或,
48.所述吸附剂为chelex树脂;及/或,
49.所述刚性微颗粒选自氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉和玛瑙中的一种或多种;及/或,
50.所述刚性微颗粒为球体、近球体、椭球体、柱状、棒状、多面体或不规则形状;及/或,
51.所述刚性微颗粒的平均粒径为0.01mm~10mm;及/或,
52.所述第一水性溶剂为水或第一缓冲组分;及/或,
53.所述保存组分包括第三缓冲组分、渗透压调节组分,还包括海藻糖、甘露醇以及甘油中的一种、两种或三种;及/或,
54.所述扩增组分包括核酸提取剂、核酸扩增剂及核酸检测剂中的一种、两种或三种。
55.在本发明的第四方面,提供一种粘性生物样本中核酸的扩增方法,包括如下步骤:
56.提供粘性生物样本;
57.使用液化试剂将所述粘性生物样本液化,获得液化处理物;及
58.使用核酸扩增剂对所述液化处理物中的目标核酸进行扩增;
59.其中,所述液化试剂选自本发明的第一方面所述粘性生物样本液化剂,或者使用发明的第三方面所述液化试剂盒中的液化组分配制而成。
60.在本发明的第五方面,提供一种粘性生物样本中核酸的检测方法,包括如下步骤:
61.提供粘性生物样本;
62.使用液化试剂将所述粘性生物样本液化,获得液化处理物;及
63.使用核酸检测剂对所述液化处理物中的目标核酸进行检测;
64.其中,所述液化试剂选自本发明的第一方面所述粘性生物样本液化剂,或者使用发明的第三方面所述液化试剂盒中的液化组分配制而成。
65.在本发明的一些实施方式中,第四方面或第五方面中的所述粘性生物样本为痰液、宫颈粘液、鼻咽拭子或口腔拭子。
66.在本发明的第六方面,提供本发明的第一方面所述粘性生物样本液化剂、或本发明的第二方面所述粘性生物样本液化保存组合产品、或本发明的第三方面所述液化试剂盒在核酸直接扩增或直接检测中的应用。
67.在本发明的一些实施方式中,所述的应用为非诊断和治疗目的。
68.在本发明的一些实施方式中,所述的应用为诊断和治疗目的。
69.在本发明的一些实施方式中,与实时定量荧光pcr仪或与便携式核酸检测仪联用。
70.本发明提供的粘性生物样本液化剂使用愈创甘油醚和大剂量的莎梵婷作为主要成分,在强碱条件下,能够快速将粘性生物样本进行液化,使样本的粘稠度下降后直接用于核酸扩增或/和检测,可以在免释放、免提纯的情况下直接进行扩增,达到传统提纯后核酸扩增或/和检测的效果。而且,利用本发明的液化剂进行液化操作时,在室温下即可进行,对操作条件要求不苛刻,容易进行。
71.本发明提供的粘性生物样本液化剂可以在15min(优选≤10min,更优选≤5min,甚至可达≤3min)快速高效地将粘性生物样本进行液化,从而大大加快粘性生物样本的检测效率。以痰液为例,传统技术中对痰液中核酸检测往往需要5h~24h,而本技术中,由于可省略释放、提纯的操作步骤,不仅简化了步骤,还可将检测周期缩减至1.5小时甚至更短时间。
72.前述液化试剂盒中的液化组分可配制得到本发明的第一方面所述粘性生物样本液化剂。
73.本发明提供的粘性生物样本液化剂还具有较好的兼容性,能够兼容免提取扩增体系,可以在无需核酸纯化操作的情况下直接进行后续的核酸扩增(也即可以作为直扩型液化剂)、检测等操作。进一步缩短了对粘性生物样本进行核酸检测的时间,传统技术往往需要5h~24h,而本技术中可缩减至1.5小时甚至更短时间。
74.本发明提供的粘性生物样本液化剂,可以灵活地与不同的核酸检测平台联用,包括但不限于与实时定量荧光pcr仪或便携式核酸检测仪(如iponatic移动分子检测系统)联用。
附图说明
75.为了更清楚地说明本技术实施例中的技术方案、更完整地理解本技术及其有益效果,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
76.图1为本发明一个实施例中对呼吸道病毒(a和b)、淋球菌(c和d)、人细胞(e和f)的检测结果;a、c、e为1号样本,采用本技术提供的液化剂依次进行液化、pcr直扩和核酸检测;b、d、f为2号样本,采用对照组的液化剂依次进行液化、核酸提取,再进行pcr扩增和核酸检测;
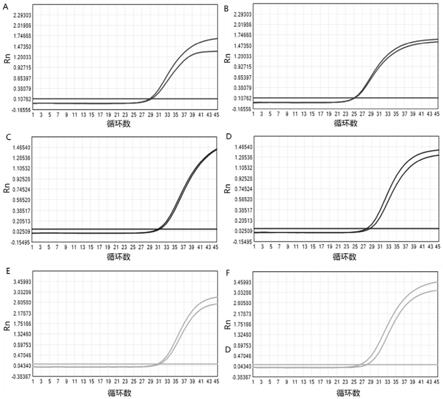
77.图2为本技术实施例3中各组液化剂液化后直扩的扩增曲线,其中,a对应呼吸道病
毒扩增曲线,b对应人细胞dna扩增曲线,c对应淋球菌dna扩增曲线;
78.图3为本技术实施例5中的扩增曲线,样本中含有淋球菌。
具体实施方式
79.下面结合附图、实施方式和实施例,对本发明作进一步详细的说明。应理解,这些实施方式和实施例仅用于说明本发明而不用于限制本发明的范围,提供这些实施方式和实施例的目的是使对本发明公开内容理解更加透彻全面。还应理解,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式和实施例,本领域技术人员可以在不违背本发明内涵的情况下作各种改动或修改,得到的等价形式同样落于本技术的保护范围。例如,作为一个实施方式的部分而说明或描述的特征可以以合适的方式组合于另一实施方式中,以产生新的实施方式。此外,在下文的描述中,给出了大量具体的细节以便提供对本发明更为充分地理解,应理解,本发明可以无需一个或多个这些细节而得以实施。
80.除非另有定义,本文所使用的所有术语(包括技术和科学术语)与本发明所属技术领域的普通技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述实施方式和实施例的目的,不是旨在于限制本发明。
81.术语
82.除非另外说明或存在矛盾之处,本文中使用的术语或短语具有以下含义:
83.本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/或b”包括a、b和a+b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一项(也即均用“逻辑或”连接的技术方案),也包括a、b、c、d的任意的和所有的组合,也即包括a、b、c、d中任两项或任三项的组合,还包括a、b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
84.本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上大于等于2。比如,“一种或多种”从数量上等于1或≥2,可以为一种、两种或更多种。
85.本文中所使用的“其组合”、“其任意组合”、“其任意组合方式”等中包括所列项目中任两个或任两个以上项目的所有合适的组合方式。
86.本文中,“合适的组合方式”、“合适的方式”、“任意合适的方式”等中所述“合适”,以能够实施本发明的技术方案、解决本发明的技术问题、实现本发明预期的技术效果为准。
87.本文中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。如果一个技术方案中出现多处“优选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“优选”各自独立。
88.本发明中,“进一步”、“更进一步”、“特别”等用于描述目的,表示内容上的差异,但并不应理解为对本发明保护范围的限制。
89.本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种
并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。本发明中,“可选地含有”、“可选地包含”等描述,表示“含有或不含有”。“可选的组分x”,表示组分x存在或不存在。
90.本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”、“第五方面”、“第六方面”等中,术语“第一”、“第二”、“第三”、“第四”等仅用于描述目的,是为了区分同类事物或特征,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
91.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。比如,一种粘性生物样本液化剂,其包括如下组分:愈创甘油醚、第一强碱、na
+
和/或k
+
、莎梵婷和第一水性溶剂,既包括由愈创甘油醚、第一强碱、na
+
和/或k
+
、莎梵婷和第一水性溶剂组成的液化剂(封闭式方案),也包括还允许添加其它组分的开放式方案。
92.本发明中,涉及到数值区间(也即数值范围),如无特别说明,可选的数值分布在上述数值区间内视为连续,且包括该数值范围的两个数值端点(即最小值及最大值),以及这两个数值端点之间的每一个数值。如无特别说明,当数值区间仅仅指向该数值区间内的整数时,包括该数值范围的两个端点整数,以及两个端点之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并这些范围。换言之,除非另有指明,否则本文中所公开之范围应理解为包括其中所归入的任何及所有的子范围。
93.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
94.本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许
±
0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如100mm,可以允许
±
1%、
±
2%、
±
5%等范围内的波动。涉及分子量,允许其含义包括
±
10%的波动。
95.本发明中,术语“室温”一般指4℃~35℃,较佳地指20℃
±
5℃。在本发明的一些实施例中,室温是指20℃~30℃。
96.本发明中,m/v表示质量体积比,%(m/v)表示在一定体积的混合体系中所含有的质量百分数。比如物质a在混合体系中的浓度为5%(m/v)表示每100毫升混合体系中含有5克物质a。
97.本发明中,涉及数据范围的单位,如果仅在右端点后带有单位,则表示左端点和右端点的单位是相同的。比如,1~200μm表示左端点1和右端点200的单位都是微米。
98.本发明中,以“15min内”为例,如无特别限定,指≤15min。
99.本发明中,涉及液化剂(包括但不限于第一方面)中各组分的浓度,如无特别定义,均指在液化剂中的终浓度。
100.本发明中,涉及液化组分(包括但不限于第二~五方面)中各组分的浓度,如无特别定义,均指在液化组分中的终浓度。
101.本发明中,涉及保存组分(包括但不限于第二~五方面)中各组分的浓度,如无特别定义,均指在保存组分中的终浓度。
102.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本技术的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技术特征的举例、优选方式也可作为参考纳入本技术中,但以能够实施本发明为限。应当理解,当引用内容与本技术中的描述相冲突时,以本技术为准或者适应性地根据本技术的描述进行修正。
103.本发明的第一方面
104.在本发明的第一方面,提供了粘性生物样本液化剂,该液化剂能够在液化样本后免释放、免提取,直接用于核酸的扩增和/或检测,简化操作,降低成本,显著缩短检测时间,加快检测结果的获取。本发明的第一方面的液化剂为可直扩型的液化剂,可以单独提供,还可以提供粘性生物样本液化保存组合产品或液化试剂盒。
105.在本发明中,术语“生物样本”、“样本”等是指动物样本;可以来自动物(优选至少包括哺乳动物,例如灵长类动物,包括人)的组织或器官、组织裂解液;细胞(在受试者体内、直接取自受试者、或保持在培养物中的或来自培养细胞系的细胞)、细胞裂解物(或裂解物部分)或细胞提取物;含有一种或多种衍生自细胞、细胞材料或病毒材料(例如多肽或核酸)的分子的溶液;或含有天然或非天然存在的核酸的溶液,其被或可以如本文所述进行测定。在一些实施方式中,样本中含有核酸。样本也可以是含有一种或多种细胞、细胞组分或核酸的任何体液或排泄物,包括但不限于细胞、核或无细胞核酸。特别地,本发明的生物样本优选来自体液,体液包括来自动物的液体、半固体、充气液体、液体-气体混合物等。此类体液可包括但不限于唾液、痰液、血清、血浆、血液、尿液、粘液、汗液、眼泪或其它眼部液体、耳部液体、脸(例如,来自水疱或疮)、胃液或胃汁、粪便液、胰液或汁、精液、哺乳或测定产物、脊髓液、液体骨髓或淋巴液。
[0106]“粘性生物样本”是指具有粘性的生物样本,特别是具有粘性的体液。粘性可源自于生物样本中存在大量的黏蛋白和多糖(特别是粘多糖)或者蛋白聚糖等成分。一种优选的粘性生物样本为痰液和/或宫颈粘液。一种粘性生物样本的举例为鼻咽拭子、口腔拭子、灌洗液等。“黏蛋白”是指任何提高分泌细胞周围细胞质基质粘度的粘性蛋白。“痰液”是指包含在哺乳动物的鼻腔或口腔中,或从其中排出的粘性物质(通常是从呼吸道中排出)。
[0107]
术语之核酸的“释放”是指核酸从样片中释放出来并处于可提取/富集/纯化/检测的状态。核酸的释放通常伴随着细胞的裂解以及,杂质成分如蛋白、脂质、多糖等组分与核酸组分在物理状态上的分离,与生理状态下不同,它们之间可以通过简单的离心等方法分离,且核酸可以被某些检测试剂直接检测到。
[0108]
在本发明的第一方面,粘性生物样本液化剂为pcr直扩型。
[0109]
本发明中,“直扩”指生物样本经液化处理后,可直接进行核酸扩增。如采用传统的液化剂(如氢氧化钠溶液等),生物样本经液化处理后,不能直接进行核酸扩增,而是还需要先进行释放、提取等中间处理,如果不经中间处理而在传统方式液化后直接进行核酸扩增及检测,会导致检测过程受到传统液化体系的干扰,结果可靠性不佳。
[0110]
在本发明的第一方面,在使用液化剂处理粘性生物样本时,需要在水性环境中进行。应当理解的是,该水性溶剂可以在进行处理操作时再额外提供。
[0111]
本发明的第一方面提供了一种粘性生物样本液化剂,其包括如下组分:愈创甘油醚、强碱(记为第一强碱)和莎梵婷,其中,第一强碱能够调节ph≥10。进一步地,第一方面的粘性生物样本液化剂中还包括na
+
和/或k
+
。
[0112]
第一方面的粘性生物样本液化剂,其包括:愈创甘油醚、强碱(记为第一强碱)和莎梵婷,其中,第一强碱能够调节ph≥10。
[0113]
第一方面的粘性生物样本液化剂还包含水性溶剂(记为第一水性溶剂)。
[0114]
可选地,第一方面的粘性生物样本液化剂还可以包含钠离子和/或钾离子(na
+
和/或k
+
)。
[0115]
可选地,第一方面的粘性生物样本液化剂中,还可以包括吸附剂、刚性微颗粒中的一种或两种。
[0116]
该粘性生物样本液化剂中,通过愈创甘油醚和莎梵婷之间特定组合的协同作用,并在特定的强碱条件下对粘性生物样本进行液化,提供了一种适用于pcr直扩的高效液化剂。进一步地,愈创甘油醚和莎梵婷在特定质量比的组合时(包括但不限于2:1、3:1、5:1等),表现出较佳的协同作用。在本发明的一些实施方式中,该粘性生物样本液化剂还包括吸附剂、刚性微颗粒中的一种、两种或三种,也即,该粘性生物样本液化剂包括如下组分:愈创甘油醚、第一强碱、莎梵婷、第一水性溶剂、可选的吸附剂和可选的刚性微颗粒。
[0117]
该粘性生物样本液化剂可以在≤15min(优选≤10min,更优选≤5min,甚至可达≤3min)快速高效地将粘性生物样本进行液化,从而大大加快粘性生物样本的检测效率。以痰液为例,传统技术中对痰液中核酸检测往往需要5h~24h,而本技术中,可缩减至1.5小时甚至更短时间。
[0118]
在一些实施方式中,粘性生物样本液化剂包括如下组分:20mmol/l~1mol/l愈创甘油醚、第一强碱、20mmol/l~200mmol/l莎梵婷和第一水性溶剂;所述粘性生物样本液化剂的ph≥10。
[0119]
第一方面的粘性生物样本液化剂中含有愈创甘油醚。传统的愈创甘油醚用于口服后刺激胃黏膜,反射性引起支气管分泌增加,使痰液稀释。本技术的发明人意外地发现愈创甘油醚可以在体外直接起到液化痰液的作用。
[0120]
在本发明的一些实施方式中,愈创甘油醚的浓度为20mmol/l~1mol/l。
[0121]
在本发明的一些实施方式中,愈创甘油醚的浓度为20mmol/l~500mmol/l。
[0122]
在本发明的一些实施方式中,愈创甘油醚的浓度范围举例包括但不限限于:20mmol/l~400mmol/l、20mmol/l~200mmol/l、20mmol/l~150mmol/l、50mmol/l~400mmol/l、50mmol/l~200mmol/l、50mmol/l~150mmol/l等。
[0123]
在本发明的一些实施方式中,愈创甘油醚的浓度举例包括但不限限于下述任一种浓度或任两种浓度构成的浓度区间:20mmol/l、40mmol/l、50mmol/l、60mmol/l、80mmol/l、100mmol/l、120mmol/l、140mmol/l、150mmol/l、160mmol/l、180mmol/l、200mmol/l、220mmol/l、240mmol/l、250mmol/l、260mmol/l、280mmol/l、300mmol/l、320mmol/l、340mmol/l、350mmol/l、360mmol/l、380mmol/l、400mmol/l、420mmol/l、450mmol/l、500mmol/l等。
[0124]
第一方面的粘性生物样本液化剂中含有莎梵婷。莎梵婷是一种表面活性剂。在本技术之前,未见将其用于直扩型液化剂的报道。本技术的发明人经过大量研究探索发现,使
用大剂量的莎梵婷与愈创甘油醚组合使用时,在同时提供较佳的液化效果和释放效果的情况下,能够免释放、免提纯地直接用于扩增和/或核酸检测。发明人还发现,莎梵婷的用量相对较低时(比如在液化剂中浓度小于20mmol/l时),在液化后,需要配合释放剂使用,先释放核酸,才能在后续的核酸扩增实验中获得较佳的ct值(ct值较小),而如果液化后直接进行核酸扩增,会导致扩增效率不佳(ct值较大)。发明人是在研究中意外发现提高莎梵婷用量时,可以免释放剂使用,直接进行核酸扩增即可获得较好的结果。
[0125]
在本发明的一些实施方式中,莎梵婷的浓度为20mmol/l~200mmol/l。浓度范围的举例包括但不限于20mmol/l~150mmol/l、20mmol/l~100mmol/l、25mmol/l~200mmol/l、25mmol/l~150mmol/l、25mmol/l~100mmol/l、30mmol/l~200mmol/l、30mmol/l~150mmol/l、30mmol/l~100mmol/l、30mmol/l~100mmol/l、30mmol/l~80mmol/l等、30mmol/l~60mmol/l。浓度的举例包括但不限于下述任一种浓度或任两种浓度构成的浓度区间:20mmol/l、25mmol/l、30mmol/l、40mmol/l、50mmol/l、60mmol/l、70mmol/l、80mmol/l、90mmol/l、100mmol/l、120mmol/l、140mmol/l、150mmol/l、200mmol/l等。如果莎梵婷用量不足,裂解效率相对较低,如果莎梵婷用量太大,影响后续的核酸扩增效率。
[0126]
在第一方面的粘性生物样本液化剂中,发明人发现愈创甘油醚、莎梵婷之间具有协同作用。具体表现在,当省略莎梵婷时,发现裂解效率下降,当省略愈创甘油醚时,发现无法液化痰液样本,只有同时提供愈创甘油醚和莎梵婷,相应的液化剂才能直接用于后续的核酸扩增或检测。而且,莎梵婷具有不可替代性,当采用异硫氰酸胍代替莎梵婷时,发现后续步骤中核酸无法扩增。
[0127]
在本发明的一些实施方式中,愈创甘油醚和莎梵婷的质量比为(1~10):1,进一步可以为(1~8):1,更进一步可以为(1~5):1。愈创甘油醚:莎梵婷的质量比还可以为(1~10):1、(2~10):1、(3~10):1、(5~10):1、(1~5):1、(2~5):1、(1~3):1等。以质量比计,愈创甘油醚:莎梵婷用量比的具体示例包括但不限于2:1、3:1、4:1、5:1。
[0128]
第一方面的粘性生物样本液化剂中,采用强碱提供强碱环境,这里的强碱记为第一强碱,用于提供ph≥10的强碱环境。只要能够提供充分液化的ph条件,只要不对后续的pcr产生不利影响,则对强碱的种类没有特别限定。
[0129]
在本发明中,术语“强碱”优选但不限于在水溶液中电离出的阴离子全部是氢氧根离子的物质。其可以是有机强碱或无机强碱。本发明中的任一种强碱可以包括,但不限于,氢氧化锂、氢氧化钠、氢氧化钾、氢氧化铷、氢氧化钫、氢氧化铯、氢氧化钙、胆碱、氢氧化银、氢氧化亚铊、季铵碱、氢氧化锶、氢氧化钡、氢氧化镭、氢氧化二氨合银等中的一种或多种。在一些优选的实施方式中,本发明中的强碱为氢氧化钠和/或氢氧化钾。
[0130]
在本发明的一些实施方式中,第一强碱为一元碱,其浓度为5mmol/l~500mmol/l。浓度范围的举例包括但不限于5mmol/l~400mmol/l、5mmol/l~200mmol/l、5mmol/l~100mmol/l、5mmol/l~80mmol/l、5mmol/l~60mmol/l、5mmol/l~50mmol/l、5mmol/l~40mmol/l、10mmol/l~200mmol/l、10mmol/l~100mmol/l、10mmol/l~50mmol/l、10mmol/l~40mmol/l等。浓度的举例包括但不限于下述任一种浓度或任两种浓度构成的浓度区间:5mmol/l、6mmol/l、7mmol/l、8mmol/l、9mmol/l、10mmol/l、12mmol/l、15mmol/l、20mmol/l、25mmol/l、30mmol/l、40mmol/l、50mmol/l、60mmol/l、70mmol/l、80mmol/l、90mmol/l、100mmol/l、120mmol/l、140mmol/l、150mmol/l、200mmol/l、250mmol/l、300mmol/l、
350mmol/l、400mmol/l、450mmol/l、500mmol/l、等。该实施方式中的技术特征可以通过合适的方式组合于其它的实施方式中。
[0131]
在本发明的一些实施方式中,第一强碱为氢氧化钠和/或氢氧化钾。在本发明的一些实施方式中,第一强碱为氢氧化钠。进一步地,第一强碱的浓度可以为5mmol/l~500mmol/l。第一强碱的浓度范围的举例及具体浓度的举例可参见上述一元碱的举例部分,可通过合适的方式进行组合。
[0132]
在本发明的一些实施方式中,粘性生物样本液化剂的ph为10~14,粘性生物样本液化剂的ph举例如10、11、12、13、14等。在本发明的一些实施方式中,粘性生物样本液化剂的ph为10~12。在本发明的一些实施方式中,粘性生物样本液化剂的ph为12~14。
[0133]
该粘性生物样本液化剂中含有水性溶剂,记为第一水性溶剂。
[0134]
如本文使用的术语“水性溶剂”为包含水的溶剂或溶液,可以为纯水组成的单一溶剂,也可以为水与其它溶剂混溶形成的混合溶剂,还可以含有溶质成分。能够与水混溶的溶剂,包括但不限于:醇类溶剂(举例如甲醇、乙醇、丙醇、异丙醇、聚乙二醇等)。水性溶剂中还允许包含盐成分。
[0135]
在本发明的一些实施方式中,第一水性溶剂为水或第一缓冲组分。
[0136]
在本发明的一些实施方式中,第一水性溶剂为水。例如蒸馏水、纯化水、过滤水、去离子水等;优选为无rna的水,和/或,优选无rna酶的水;优选为无核酸水,和/或,优选无核酸酶的水。
[0137]
在一些实施例中,水性溶剂为无rna酶的水。
[0138]
在一些实施例中,第一水性溶剂为无核酸酶(包括rna酶和dna酶)的水。
[0139]
本发明中的粘性生物样本液化剂可以不额外添加核酸酶抑制剂(包括rna酶抑制剂和/或dna酶抑制剂)而实现相应的技术效果。本发明中的粘性生物样本液化剂可以不额外添加rna酶抑制剂。但应当理解,向本发明的粘性生物样本液化剂中添加rna酶抑制剂和/或dna酶抑制剂的技术方案亦在本发明的保护范围内。前述rna酶抑制剂、dna酶抑制剂均为本领域技术人员所知悉。作为举例,rna酶抑制剂可以为但不限于焦碳酸二乙酯。作为举例,dna酶抑制剂可以为但不限于乙二胺四乙酸。
[0140]
在本发明的一些实施方式中,第一水性溶剂为缓冲组分,记为第一缓冲组分。
[0141]
如本文使用的术语“缓冲组分”,在本文中也称为“缓冲溶液”,指含有缓冲成分的水溶液,当将酸或碱加入该水溶液中时,水溶液抵抗ph的变化。这种对ph变化的抗性是由于此类液体的缓冲性质。因此,显示出缓冲活性的溶液被称为缓冲液或缓冲溶液。缓冲液一般不具有无限的维持溶液或组合物的ph的能力。相反,它们一般能够维持在特定范围内的ph,例如ph6~ph8。一般地,缓冲液能够维持在其pka上一个和下一个对数内的ph(参见例如,mohan,buffers,a guide for the preparation and use of buffers in biological systems,calbiochem,1999)。缓冲液和缓冲溶液一般由缓冲盐或优选非离子缓冲液组分如tris和hepes制备,也可以选自弱酸和/或其盐。可以在本发明的方法中使用的i)中缓冲组分优选自0.5mmol/l~500mmol/l的tris-hcl,其浓度也可以选择1mmol/l、5mmol/l、10mmol/l、50mmol/l、100mmol/l、200mmol/l、300mmol/l以及400mmol/l。本发明中的缓冲成分优选自a)柠檬酸、醋酸、磷酸、酒石酸、苹果酸、碳酸、巴比妥酸中的一种或多种,或者b)a的酸根,或者c)a的酸式酸根(通常带有一个或两个氢离子,例如磷酸氢根、磷酸二氢根),或
者选自a)、b)、c)所组成的组中的一种或多种成分。缓冲组分为1mmol/l~5mmol/l的柠檬酸,也可以选择2mmol/l、3mmol/l、4mmol/l等示例的具体浓度。
[0142]
在一些优选的实施方式中,第一缓冲组分选自tris-hcl、磷酸二氢钾-氢氧化钠缓冲液、磷酸氢二钠-磷酸二氢钾缓冲液和磷酸氢二钠-柠檬酸缓冲液中的一种或多种的组合。
[0143]
在一些优选的实施方式中,缓冲组分选自下述缓冲液中的任一种:tris-hcl、磷酸二氢钾-氢氧化钠缓冲液、磷酸氢二钠-磷酸二氢钾缓冲液、磷酸氢二钠-柠檬酸缓冲液等。在一些更优选的实施方式中,缓冲组分为0.5mmol/l~500mmol/l的tris-hcl,tris-hcl体系的浓度也可以为1mmol/l、10mmol/l、50mmol/l、100mmol/l、200mmol/l、300mmol/l、400mmol/l等示例的具体浓度。这里的浓度,如无特别限定,指在粘性生物样本液化剂中的终浓度。缓冲组分的成分可以独立包装于一个或多个容器。当其成分独立包装于一个容器中时,可以作为预制的缓冲试剂。
[0144]
进一步地,该粘性生物样本中可选地含有钠离子和/或钾离子(na
+
和/或k
+
)。na
+
和/k
+
优选通过盐形式(钠和/或钾盐)提供,也可以伴随强碱一并提供(如氢氧化钠、氢氧化钾)。钠源、钾源的举例如氯化钠、氯化钾。na
+
和k
+
在第一方面的粘性生物样本液化剂中的浓度各自独立地可以为1mm~1m,进一步各自独立地可以为5mm~1m,更进一步可以为5mm~500mm,更进一步可以为5mm~200mm。具体举例如5mm、10mm、15mm、20mm、25mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm、160mm、180mm、200mm、300mm、350mm、400mm、450mm、500mm、550mm、600mm、650mm、700mm、750mm、800mm、850mm、900mm、950mm、1m等。在一些实施例中,钠盐和/或钾盐(比如氯化钠、氯化钾)的浓度为5mm~250mm,进一步可以为5mm~150mm,更进一步可以为5mm~120mm。具体举例如5mm、10mm、15mm、20mm、25mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、110mm、120mm、130mm、140mm、150mm、160mm、180mm、200mm、210mm、220mm、230mm、240mm、250mm等。
[0145]
在一些优选的实施方式中,粘性生物样本液化剂包括如下组分:20mmol/l~1mol/l愈创甘油醚、第一强碱、1mmol/l~200mmol/l的na
+
和/或k
+
、20mmol/l~200mmol/l莎梵婷和第一水性溶剂;所述粘性生物样本液化剂的ph≥10。
[0146]
第一方面的粘性生物样本液化剂中,还可以包括吸附剂、刚性微颗粒中的一种或两种。也即,吸附剂、刚性微颗粒可以各自独立地作为可选组分。
[0147]
在一些实施方式中,第一方面的粘性生物样本液化剂包括吸附剂。
[0148]
本发明中的“吸附剂”可以通过物理或化学作用吸附杂质,减少杂质对后续检测的干扰。吸附剂在不对液化产生不利影响的原则下,可以任意选择合适的类型。用于吸附杂质的化学作用包括但不限于螯合作用。吸附剂可以为树脂或螯合物,也可为螯合树脂。在一些实施方式中,吸附剂为树脂。在一些优选的实施方式中,吸附剂为聚丙乙烯类、聚丙烯酸类、聚乙烯醇类、壳聚糖类等树脂,进一步优选为螯合树脂。在一些优选的实施方式中,吸附剂为chelex树脂。
[0149]
在一些优选的实施方式中,吸附剂为chelex树脂。在一些实施方式中,吸附剂的用量为1%~15%(w/v),例如0.5%、1%、1.5%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%等。在一些优选的实施方式中,吸附剂为螯合树脂,进一步可以为chelex树脂。
[0150]
在本发明的一些实施方式中,第一方面的粘性生物样本液化剂可选地包括刚性微颗粒。刚性微颗粒可用于辅助混匀粘性生物样本和液化剂,减少处理时间,加快处理效率。
[0151]
本发明中,刚性微颗粒的材质可以是任意的硬质材料,“刚性”指其在混合/辅助混合粘性生物样本的时候通常不发生明显破损,且不释放干扰后续流程(如核酸的保存、释放、富集、扩增、检测中的至少一个流程)的成分。其材质包括但不限于金属(可以为单质或合金)或金属氧化物、陶瓷、玻璃、硬质塑料、天然或人工的矿物成分等。在一些优选的实施方式中,刚性微颗粒的材质包括氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉、玛瑙等中的一种或多种。
[0152]
在本发明中,术语“微颗粒”可以为球体、近球体、椭球体、柱状、棒状、多面体(举例如立方体)或不规则形状等,优选为微球。微颗粒的平均粒径优选为毫米级,例如0.01mm~500mm、也可以为0.05mm、0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、20mm、30mm、40mm、50mm、100mm、200mm、300mm、400mm以及500mm,进一步优选为0.01mm~10mm。
[0153]
在本发明的一些实施方式中,刚性微颗粒的用量为0.1g/ml~2g/ml。用量的举例包括但不限于0.1g/ml、0.2g/ml、0.3g/ml、0.4g/ml、0.5g/ml、0.6g/ml、0.7g/ml、0.8g/ml、0.9g/ml、1.0g/ml、1.1g/ml、1.2g/ml、1.3g/ml、1.4g/ml、1.5g/ml、1.6g/ml、1.7g/ml、1.8g/ml、1.9g/ml、2.0g/ml等。
[0154]
在本发明的一些实施方式中,第一方面的粘性生物样本液化剂包括如下组分:80mmol/l~120mmol/l愈创甘油醚(独立地优选100mmol/l)、8mmol/l~12mmol/l氢氧化钠(独立地优选10mmol/l)、0.5g/ml~1.5g/ml(独立地优选1g/ml)的平均粒径为0.1mm~10mm(独立地优选1mm)的氧化锆珠、体积百分比为5%~10%(独立地优选8%)的螯合树脂和30mmol/l~60mmol/l(独立地优选50mmol/l)莎梵婷。
[0155]
在本发明的一些实施方式中,第一方面的粘性生物样本液化剂为向第一水性溶剂中添加如下组分构成的混合体系:80mmol/l~120mmol/l愈创甘油醚(独立地优选100mmol/l)、8mmol/l~12mmol/l氢氧化钠(独立地优选10mmol/l)、0.5g/ml~1.5g/ml(独立地优选1g/ml)的平均粒径为0.1mm~10mm(独立地优选1mm)的氧化锆珠、体积百分比为5%~10%(独立地优选8%)的螯合树脂和30mmol/l~60mmol/l(独立地优选50mmol/l)莎梵婷。
[0156]
本发明的第二方面
[0157]
在本发明的第二方面,提供一种粘性生物样本液化保存组合产品,包括液化组分(可配制得到本发明的第一方面中的粘性生物样本液化剂),还包括保存组分(可配制得到保存剂)。痰液等生物样本中的核酸(尤其是rna)极不稳定,通常在温室条件下数小时就被降解。然而在临床检测中,往往不能及时处理和检测痰液样本中的核酸。使用该液化保存组合产品时,可以先用配制得到的粘性生物样本液化剂对粘性生物样本进行液化,然后加入保存组分或其配制而成的保存剂,使经液化的样本得以稳定保存,便于在灵活的时间进行免释放、免提取的后续操作,直接将经液化后保存的样本进行扩增或检测即可,有利于大批量样本处理。
[0158]
液化组分和保存组分原则上应当分开包装。一些实施方式中,先使用液化组分(或液化组分配制得到的液化剂)在碱性条件下处理粘性生物样本,经液化降低粘度,再利用保存组分中的缓冲组分下调经液化的样本的ph值,使稳定在ph6~ph8,保存组分中的各组分
相互协同,能够对经液化的样本进行长期保存,有效避免核酸降解,待进行后续免释放、免提取的扩增或检测。
[0159]
第二方面中使用的液化组分可以参考本发明的第一方面中的粘性生物样本液化剂的组分。
[0160]
在本发明的一些实施方式中,液化组分包括愈创甘油醚、第一强碱、莎梵婷、na
+
和/或k
+
、第一水性溶剂、可选的吸附剂和可选的刚性微颗粒。各组分的定义、种类、含量、优选、举例等包括但不限于与第一方面所描述,这里不再赘述。第一水性溶剂可以预先提供,也可以由使用者自行准备,因此在提供方式上是可选的。但在处理粘性生物样本时,该第一水性溶剂是必需的,用于提供水性环境。
[0161]
在本发明的一些实施方式中,保存组分包括组分a)、组分b)和组分c),其中,
[0162]
组分a)为缓冲组分,记为第三缓冲组分,用于调节保存体系的ph为6~8;
[0163]
组分b)为渗透压调节组分;
[0164]
组分c)为海藻糖、甘露醇以及甘油中的一种、两种或三种。
[0165]
其中,组分a)的缓冲组分,可以用来中和液化组分中的强碱(第一强碱),将经液化的样本的ph环境下调至温和范围,比如ph6~ph8,从而为经液化样本中的核酸提供稳定的保存环境。这里的缓冲组分与第一方面中的定义一致。在本发明中,第一缓冲组分、第三缓冲组分相互独立,彼此可以相同或不同。
[0166]
其中,渗透压调节组分用于稳定待保存生物成分(例如细胞或病毒)的渗透压。渗透压调节组分通常包括无机阳离子(特别是盐离子,优选na
+
以及k
+
)和/或甜菜碱。在一个具体的实施方式中,渗透压调节组分包括0.1%~1.2%(w/v)氯化钠和0.1%~1.2%(w/v)氯化钾。在一个具体的实施方式中,甜菜碱0.1%~10%(w/v)。
[0167]
在一些实施方式中,保存组分以单一混合体系提供,可以通过向缓存组分中添加其它组分配制。
[0168]
在一些实施方式中,保存组分还包括一种或多种氨基酸。氨基酸可以为左旋或者右旋手性的氨基酸;可以为天然氨基酸,也可以为非天然氨基酸;氨基酸的举例包括但不限于:例如甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸(蛋氨酸)、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、苯丙氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸、硒半胱氨酸和吡咯赖氨酸等。一些优选的实施例中,氨基酸在保存组分中的总浓度优选为1mol/l~3mol/l,例如1mol/l、1.4mol/l、1.5mol/l、1.8mol/l、2mol/l、2.2mol/l、2.5mol/l、3mol/l等。
[0169]
在一些实施方式中,保存组分中的组分c)包括0.8mol/l~1mol/l甘氨酸和0.6mol/l~1mol/l异亮氨酸。
[0170]
在一些实施方式中,海藻糖在保存组分中的浓度为0.5mol/l~1mol/l,例如0.5mol/l、0.6mol/l、0.7mol/l、0.8mol/l、0.9mol/l、1mol/l等。
[0171]
在一些实施方式中,甘露醇在保存组分中的浓度为1.5%~4.5%(w/v),以质量体积比%(w/v)计,举例包括但不限于1.5%、2%、2.5%、3%、3.5%、4%、4.5%等。
[0172]
在一些实施方式中,甘油在保存组分中的浓度为2%~10%(v/v),以体积比计,举例包括但不限于2%、3%、4%、5%、6%、7%、8%、9%、10%等。
[0173]
在一些实施方式中,保存组分中还含有尿素。尿素在保存组分中的浓度可以为1%
~3%(w/v),以质量体积比%(w/v)计,举例包括但不限于1%、1.5%、2%、2.5%、3%等。
[0174]
在一些实施方式中,以在保存组分中的终浓度计,保存组分包括:1mmol/l~5mmol/l柠檬酸、0.1%~1.2%(w/v)氯化钠、0.1%~1.2%(w/v)氯化钾、0.8mol/l~1mol/l甘氨酸、0.6mol/l~1mol/l异亮氨酸、0.5mol/l~1mol/l海藻糖、1.5%~4.5%(w/v)甘露醇以及2%~10%(v/v)甘油。
[0175]
第二方面提供的是一种组合产品,如无特别考虑,液化组分中的各组分可以分开提供,也可以合并提供,保存组分中的各组分也可以分开提供或合并提供。合并提供时,可以为液态,也可以为固态或半固态。液态包括但不限于溶液、乳液、悬浊液等形态。半固态的举例包括不限于凝胶态等。
[0176]
在一些实施方式中,液化组分中的各组分构成一体化的组合状态。
[0177]
在一些实施方式中,保存组分中的各组分构成一体化的组合状态。
[0178]
在一些实施方式中,液化组分中的各组分,有的组分与其它组分以组合状态存在,有的组分独立存在。在一些优选的实施方式中,第一水性溶剂独立存在。在一些优选的实施方式中,吸附剂独立存在。在一些优选的实施方式中,刚性微颗粒独立存在。在一些优选的实施方式中,愈创甘油醚、莎梵婷两个组分以组合状态存在。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱三个组分以组合状态存在。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱、水性溶剂四个组分以组合状态存在。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱各自独立地分别与水性溶剂以组合状态存在。
[0179]
在一些实施方式中,保存组分中的各组分,有的组分与其它组分以组分状态存在,有的组分独立存在。在一些优选的实施方式中,组分a)、组分b)和组分c)分别独立存在。在一些优选的实施方式中,组分b)和组分a)以组合状态存在,且组分c)也和组分a)以组合方式存在。
[0180]
本发明的第三方面
[0181]
在本发明的第三方面,提供一种液化试剂盒,利用该试剂盒中的组分对粘性生物样本进行液化后,后续可以免释放、免提取地直接进行扩增或检测。进行液化后,可以直接进行后续的扩增或检测,也可以利用保存组分保存后,在需要时直接进行扩增或检测。
[0182]
使用该液化试剂盒配制的粘性生物样本液化剂可以在≤15min(优选≤10min,更优选≤5min,甚至可达≤3min)快速高效地将粘性生物样本进行液化,从而大大加快粘性生物样本的检测效率。以痰液为例,传统技术中对痰液中核酸检测往往需要5h~24h,而本技术中,通过节省释放、提纯步骤,可以将检测周期缩减至1.5小时甚至更短时间。
[0183]
第三方面的液化试剂盒还包括标签和/或说明。
[0184]
第三方面的液化试剂盒还包括容器,用于封装各组分。
[0185]
在本发明的一些实施方式中,液化试剂盒包括液化组分、可选的保存组分和可选的扩增组分。
[0186]
第三方面的液化组分可以参考本发明的第一方面中的粘性生物样本液化剂的组分。
[0187]
在本发明的一些实施方式中,液化组分包括愈创甘油醚、第一强碱、莎梵婷、na
+
和/或k
+
、第一水性溶剂、可选的吸附剂和可选的刚性微颗粒。各组分的定义、种类、含量、优选、举例等包括但不限于第一方面所描述,这里不再赘述。第一水性溶剂可以直接预置于试
剂盒中(独立包装或与其它组分组合包装),也可以由使用者自行准备。
[0188]
在本发明的一些实施方式中,液化组分包括:
[0189]
组分l1):愈创甘油醚;
[0190]
组分l2):第一强碱;
[0191]
组分l3):莎梵婷;
[0192]
组分l4):可选的钠源和/或钾源(用于提供na
+
和/或k
+
);
[0193]
组分l5):可选的第一水性溶剂;
[0194]
组分l6):可选的吸附剂;和
[0195]
组分l7):可选的刚性微颗粒;
[0196]
该液化组分可以配制得到本发明的第一方面中的粘性生物样本液化剂。
[0197]
在本发明的一些实施方式中,第一强碱为氢氧化钠和/或氢氧化钾。
[0198]
在本发明的一些实施方式中,吸附剂为chelex树脂。
[0199]
在本发明的一些实施方式中,刚性微颗粒选自氧化锆、氮化硅、陶粒、硬质不锈钢、硬质碳化钨、烧结刚玉、玛瑙等中的一种或多种。
[0200]
在本发明的一些实施方式中,刚性微颗粒为球体、近球体、椭球体、柱状、棒状、多面体或不规则形状。
[0201]
在本发明的一些实施方式中,刚性微颗粒的平均粒径为0.01mm~10mm。
[0202]
在本发明的一些实施方式中,第一水性溶剂为水或第一缓冲组分。
[0203]
在本发明的一些实施方式中,保存组分包括第三缓冲组分、渗透压调节组分,还包括海藻糖、甘露醇以及甘油中的一种、两种或三种。
[0204]
在本发明的一些实施方式中,扩增组分包括核酸提取剂、核酸扩增剂及核酸检测剂中的一种、两种或三种。
[0205]
在一些实施方式中,液化组分中的各组分可以分别独立包装,也可以组合包装在一起。
[0206]
在一些实施方式中,保存组分中的各组分可以分别独立包装,也可以组合包装在一起。
[0207]
在一些实施方式中,液化组分中的各组分,有的组分与其它组分组合包装在同一容器,有的组分独立包装于一个容器。在一些优选的实施方式中,第一水性溶剂独立包装于一个容器。在一些优选的实施方式中,吸附剂独立包装于一个容器。在一些优选的实施方式中,刚性微颗粒独立包装于一个容器。在一些优选的实施方式中,愈创甘油醚、莎梵婷两个组分包装在同一容器。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱三个组分包装在同一容器。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱、水性溶剂四个组分包装在同一容器。在一些优选的实施方式中,愈创甘油醚、莎梵婷、第一强碱各自独立地分别与水性溶剂组合包装,也即液化试剂盒分别提供各自独立包装的愈创甘油醚的溶液、莎梵婷的溶液、第一强碱的溶液。
[0208]
在一些实施方式中,愈创甘油醚和强碱(第一强碱)可以分开包装,此时,可以根据粘性生物样本的特点灵活控制强碱的添加量,从而灵活控制液化体系的ph值,以更好地适应不同样本间的差异化特性。同样地,在一些实施方式中,愈创甘油醚的含量也可以灵活控制,便于对微量样本的液化过程进行更精准的控制。
[0209]
在一些实施方式中,保存组分中的各组分,有的组分与其它组分包装在同一容器,有的组分独立包装于一个容器。在一些优选的实施方式中,组分a)、组分b)和组分c)分别独立包装。在一些优选的实施方式中,组分b)和组分a)包装在同一容器,且组分c)也和组分a)包装在同一容器,也即提供分别独立包装的含组分b)的缓冲溶液、含组分c)的缓冲溶液。
[0210]
本发明的第四方面
[0211]
在本发明的第四方面,提供一种粘性生物样本中核酸的扩增方法,包括如下步骤:
[0212]
s100:提供粘性生物样本;
[0213]
s200:使用液化试剂将粘性生物样本液化,获得液化处理物;及
[0214]
s300:使用核酸扩增剂对液化处理物中的目标核酸进行扩增;
[0215]
其中,液化试剂选自本发明的第一方面所述粘性生物样本液化剂,或者使用发明的第三方面所述液化试剂盒中的液化组分配制而成。
[0216]
使用该液化试剂可以在≤15min(优选≤10min,更优选≤5min,甚至可达≤3min)快速高效地将粘性生物样本进行液化,从而大大加快粘性生物样本的检测效率。以痰液样本为例,传统技术中对痰液中核酸检测往往需要5h~24h,而本技术中,可缩减至1.5小时甚至更短时间。
[0217]
粘性生物样本的定义与本发明的第一方面一致。
[0218]
在本发明的一些实施方式中,粘性生物样本为痰液、宫颈粘液、鼻咽拭子或口腔拭子。
[0219]
在本发明的一些实施方式中,步骤s200中,将粘性生物样本液化包括如下步骤:
[0220]
s202:将粘性生物样本与液化试剂进行混合,获得第一混合物;和
[0221]
s204:对第一混合物进行孵育,获得液化处理物。
[0222]
在一些实施方式中,核酸包括dna和/或rna,其形式是多样的,可以是短寡核苷酸、长寡核苷酸或多聚核苷酸的形式。也可以是双链dna和单链dna以及双链rna和单链rna。在一些具体的实施方式中,核酸可以是基因、cdna分子、mrna、trna、rrna、非编码rna分子等,以及上述核酸形式的片段例如寡核苷酸。
[0223]
术语“扩增(ampiifying或amplification)”在“核酸”此用语的上下文中共同出现时,指产生多个拷贝的多核苷酸、或多核苷酸的部分,通常从少量的多核苷酸开始(例如,少至单个多核苷酸分子),其中扩增产物或扩增子通常是可检测的。多核苷酸的扩增包括多种化学和酶促方法。在聚合酶链反应(pcr)、滚环扩增(rca)或连接酶链反应(lcr)过程中从一个或几个拷贝的靶dna或模板dna分子产生多个dna拷贝是扩增的形式。扩增不限于起始分子的严格复制。例如,使用逆转录rt-pcr从样品中有限量的rna产生多个cdna分子是扩增的形式。此外,在转录过程期间从单一dna分子产生多个rna分子也是扩增的形式。
[0224]
在本发明的一些实施方式中,愈创甘油醚在第一混合物中的浓度为20mmol/l~1mol/l。浓度示例包括但不限于下述任一种浓度及下述任两种浓度构成的浓度区间:20mmol/l、50mmol/l、60mmol/l、70mmol/l、80mmol/l、90mmol/l、100mmol/l、110mmol/l、120mmol/l、130mmol/l、140mmol/l、150mmol/l、200mmol/l、300mmol/l、400mmol/l、500mmol/l、600mmol/l、700mmol/l、800mmol/l、900mmol/l、1mol/l等。在一些实施例中,任两种浓度构成的浓度区间的举例如20mmol/l~500mmol/l,80mmol/l~120mmol/l等。
[0225]
在本发明的一些实施方式中,莎梵婷在第一混合物中的浓度为20mmol/l~
0.2mol/l,进一步可以为20mmol/l~0.15mol/l。浓度示例包括但不限于下述任一种浓度及下述任两种浓度构成的浓度区间:20mmol/l、30mmol/l、40mmol/l、50mmol/l、60mmol/l、70mmol/l、80mmol/l、90mmol/l、100mmol/l、110mmol/l、120mmol/l、130mmol/l、140mmol/l、150mmol/l、200mmol/l等。在一些实施例中,任两种浓度构成的浓度区间的举例如20mmol/l~150mmol/l,30mmol/l~60mmol/l等。
[0226]
在本发明的一些实施例中,液化试剂与粘性生物样本的体积比为(1~5):1,进一步可以为(2~5):1,进一步可以为(2~4):1,具体举例如3:1、4:1、5:1等。
[0227]
愈创甘油醚和莎梵婷的在第一混合物中浓度及用量比还可参照本发明的第一方面愈创甘油醚和莎梵婷的在粘性生物样本液化剂中的浓度及用量比。
[0228]
本发明中,在进行液化时,无需苛刻的温度条件,比如,在常温即可操作。
[0229]
在本发明的一些实施方式中,孵育体系的ph≥10,可以通过控制第一混合物的ph来实现。进行孵育时的ph举例例如11、11.5、12、12.5、13、13.5、14、14.5、15,优选ph12~ph14。孵育体系的ph举例还如10~12等。
[0230]
在本发明的一些实施方式中,孵育温度为18℃~35℃。孵育温度的举例包括但不限于:18℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃等。
[0231]
在进行液化时,孵育时间可以根据样本量、样本特性等因素进行合理控制,在合理的时间内实现充分的液化。
[0232]
在一些实施方式中,孵育时间小于15min。孵育时间的举例包括但不限于下述任一种时长,或任两种时长构成的时长区间:2min、3min、4min、5min、6min、7min、8min、9min、10min、15min等。任两种时长构成的时长区间的举例如2min~15min、3min~15min、3min~10min等。
[0233]
本发明的第五方面
[0234]
在本发明的第五方面,提供一种粘性生物样本中核酸的检测方法,包括如下步骤:
[0235]
s100:提供粘性生物样本;
[0236]
s200:使用液化试剂将粘性生物样本液化,获得液化处理物;及
[0237]
s400:使用核酸检测剂对液化处理物中的目标核酸进行检测;
[0238]
其中,液化试剂选自本发明的第一方面所述粘性生物样本液化剂,或者使用发明的第三方面所述液化试剂盒中的液化组分配制而成。
[0239]
粘性生物样本的定义与本发明的第一方面一致。
[0240]
在本发明的一些实施方式中,粘性生物样本为痰液、宫颈粘液、鼻咽拭子或口腔拭子。
[0241]
步骤s100、s200的定义与本发明的第四方面一致。
[0242]
核酸的检测方法可以依赖或不依赖核酸的扩增。如本文所用,术语“核酸的检测方法”是指确定目标核酸的核苷酸组成的任何方法,包括但不限于dna测序方法、探针杂交方法、结构特异性裂解测定(例如,invader测定,(hologic,inc.)并且描述于例如美国专利号5,846,717、5,985,557、5,994,069、6,001,567、6,090,543和6,872,816;lyamichev等人,nat.biotech.,17:292(1999),hall等人,pnas,usa,97:8272(2000),以及us 2009/0253142,其各自出于所有目的全文以引用的方式并入本文);酶错配裂解方法(例如,
variagenics,美国专利号6,110,684、5,958,692、5,851,770,其全文以引用的方式并入本文);以上所述的聚合酶链反应(pcr);分支杂交方法(例如,chiron,美国专利号5,849,481、5,710,264、5,124,246和5,624,802,其全文以引用的方式并入本文);滚环式复制(例如,美国专利号6,210,884、6,183,960和6,235,502,其全文以引用的方式并入本文);nasba(例如,美国专利号5,409,818,其全文以引用的方式并入本文);分子信标技术(例如,美国专利号6,150,097,其全文以引用的方式并入本文);e-传感器技术(motorola,美国专利号6,248,229、6,221,583、6,013,170和6,063,573,其全文以引用的方式并入本文);环状探针技术(例如美国专利号5,403,711、5,011,769和5,660,988,其全文以引用的方式并入本文);dade behring信号扩增方法(例如美国专利号6,121,001、6,110,677、5,914,230、5,882,867和5,792,614,其全文以引用的方式并入本文);连接酶链反应(例如,baranay proc.natl.acad.sci usa 88,189-93(1991));以及夹心杂交方法(例如,美国专利号5,288,609,其全文以引用的方式并入本文)。
[0243]
本发明的第六方面
[0244]
在本发明的第六方面,提供本发明的第一方面所述粘性生物样本液化剂、或本发明的第二方面所述粘性生物样本液化保存组合产品、或本发明的第三方面所述液化试剂盒在核酸直接扩增或直接检测中的应用。
[0245]
在本发明的一些实施方式中,所述的应用为非诊断和治疗目的。
[0246]
在本发明的一些实施方式中,所述的应用为诊断和治疗目的。
[0247]
在本发明的一些实施方式中,本发明的第一方面所述粘性生物样本液化剂可以灵活地与不同的核酸检测平台联用,包括但不限于与实时定量荧光pcr仪或便携式核酸检测仪(如iponatic移动分子检测系统)联用。其中,iponatic移动分子检测系统是圣湘生物科技股份有限公司已公开推出的核酸检测系统,实时定量荧光pcr仪为本领域技术人员熟知的常用仪器。
[0248]
采用本发明的第一方面的粘性生物样本液化剂进行液化后,可直接扩增检测核酸,而传统的液化剂需先液化,再提取,然后才能进行扩增检测。相比而言,采用本技术的粘性生物样本液化剂可将整个检测时间(自液化至完成核酸检测)缩短至40min以下,可将检测效率提高4倍以上。
[0249]
以下为一些具体实施例。
[0250]
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
[0251]
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
[0252]
所用圣湘生物科技股份有限公司生产的核酸提取或纯化试剂(rna一步法释放剂),规格24t,型号s1014。
[0253]
所用六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)对应国械注准20213400256。
[0254]
所用淋球菌核酸检测试剂盒(pcr-荧光探针法),圣湘生物科技股份有限公司,注册号为20153400086,规格型号为48t。
[0255]
以下各例中,如无特别限定,“室温”指20℃~30℃。
[0256]
以下各例的本发明的粘性生物样本液化剂中,如无特别限定,则未添加其他成分,包括未添加核酸酶抑制剂(无rna酶抑制剂,也无dna酶抑制剂)。本发明提供的粘性生物样本液化剂可以在不添加核酸酶抑制剂的情况下取得较优的直扩效果;但应当理解的是,本发明的粘性生物样本液化剂也允许添加包括但不限于核酸酶抑制剂(包括但不限于前文所述)的其他辅助组分以实现进一步优化目的(比如进一步核酸检测效果);应当理解,核酸酶抑制剂的添加不影响本发明的粘性生物样本液化剂的功能发挥。前述的改动及与之类似的改动而获得的技术方案也在本发明的保护范围内。
[0257]
实施例1.本发明的可直扩型液化剂的实验效果验证
[0258]
1.1.实验方案
[0259]
实验组液化剂:以下各组分浓度均为配制后终浓度,100mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷50mmol/l,配制试剂使用的溶剂为纯化水。液化剂的ph约为12.5。
[0260]
对照组液化剂:使用愈创甘油醚、氢氧化钠、氧化锆珠配制而成。终浓度分别为:100mm愈创甘油醚、10mm氢氧化钠、1g/ml氧化锆珠(通径为1mm),配制试剂使用的溶剂为纯化水。液化剂的ph约为12.5。
[0261]
粘性生物样本:选取2例临床痰液样本,样本中含有呼吸道病毒、人细胞、淋球菌。平行分成2份,分别记为1号样本和2号样本。
[0262]
1号样本:分别采用实验组液化剂、对照组液化剂进行液化。液化条件为3倍样本体积液化液与样本混合,混匀,室温静置10min。样本处理完全后,直接作为待测核酸样本进行直扩实验,使用圣湘生物科技股份有限公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)以及淋球菌核酸检测试剂盒(pcr-荧光探针法)按照说明书进行检测。从取样到检测结束,自开始液化至核酸检测完成的总耗时,实验组约36min,对照组约4小时。
[0263]
2号样本:分别采用实验组液化剂、对照组液化剂进行液化。液化完全后的样本使用圣湘生物科技股份有限公司生产的核酸提取或纯化试剂(rna一步法释放剂)进行提取,提取完成后再使用圣湘生物科技股份有限公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)以及淋球菌核酸检测试剂盒(pcr-荧光探针法)按照说明书进行检测。从取样到检测结束,自开始液化至核酸检测完成的总耗时,实验组约36min,对照组约4小时,检测效率提高5倍以上。
[0264]
1.2.检测结果
[0265]
液化效果如表1所示。结果表明,实验组的液化剂能在较短时间内(《5min,甚至《3min)完成对痰液的液化,且液化效果好。
[0266]
表1.液化结果
[0267][0268][0269]
核酸扩增结果可参见图1和表2~4。图1为扩增曲线,其中,纵坐标rn表示第n个循环时pcr扩增产物的荧光强度,横坐标为循环数。根据扩增曲线可以确定ct值。ct值表示每个反应管内的荧光信号到达设定阈值时所经历的循环数,每个模板的ct值与该模板的起始拷贝数的对数存在线性关系,公式如下。
[0270]
ct=-1/lg(1+e
x
)
·
lgx0+lgx/lg(1+e
x
)
[0271]
x0为初始模板量,ex为扩增效率,n为荧光扩增信号达到阈值强度时扩增产物的量。n为扩增反应的循环次数,在扩增达到阈值线时,n=ct。
[0272]
起始拷贝数越多,ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表ct值。因此,只要获得未知样品的ct值,即可从标准曲线上计算出该样品的起始拷贝数。
[0273]
因此,ct的数值高低可以反映检测样品浓度高低,ct值越低检测样本核酸浓度越高,ct值越高检测样本核酸浓度越低;相差1个ct值的样本核酸浓度有两倍差异,相差2个ct值则有四倍差异,以此类推。
[0274]
从图1和表2~4的结果可知,本发明的直扩型的实验组液化剂能够实现对照组液化剂先液化后释放提取时基本相当甚至更优的效果。
[0275]
表2.呼吸道病毒核酸检测结果的ct值
[0276][0277]
表3.淋球菌dna核酸检测结果的ct值
[0278][0279]
表4.人细胞dna核酸检测结果的ct值
[0280][0281]
1.2.发明人还采用不添加氧化锆珠(刚性微颗粒),不添加chelex树脂(吸附剂),既不添加氧化锆珠也不添加chelex树脂的三种方案进行了实验,结果发现均能实现直扩效
果,pcr扩增曲线ct值均满足使用要求,检测效率提升倍数均大于4。
[0282]
实施例2.不同配方粘性生物样本液化剂
[0283]
2.1.实验方案
[0284]
实验组液化剂1:以下各组分浓度均为配制后终浓度,100mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷50mmol/l,配制试剂使用的溶剂为纯化水。
[0285]
实验组液化剂2:以下各组分浓度均为配制后终浓度,150mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷50mmol/l,配制试剂使用的溶剂为纯化水。
[0286]
实验组液化剂3:以下各组分浓度均为配制后终浓度,500mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷100mmol/l,配制试剂使用的溶剂为纯化水。
[0287]
实验组液化剂4:以下各组分浓度均为配制后终浓度,20mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷200mmol/l,配制试剂使用的溶剂为纯化水。
[0288]
实验组液化剂5:以下各组分浓度均为配制后终浓度,1000mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷1mmol/l,配制试剂使用的溶剂为纯化水。
[0289]
实验组液化剂6:以下各组分浓度均为配制后终浓度,0mmol/l愈创甘油醚(也即未添加)、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷200mmol/l,配制试剂使用的溶剂为纯化水。
[0290]
实验组液化剂7(对比例1):以下各组分浓度均为配制后终浓度,500mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷0mmol/l(也即未添加),配制试剂使用的溶剂为纯化水。
[0291]
实验组液化剂8:以下各组分浓度均为配制后终浓度,500mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、异硫氰酸胍20mmol/l,配制试剂使用的溶剂为纯化水。
[0292]
粘性生物样本:选取2例临床痰液样本(分别记为i、ii号样本),2例样本中均含有呼吸道病毒、人细胞、淋球菌。
[0293]
分别采用以上实验组液化剂进行液化。液化条件为3倍样本体积液化剂与样本混合,混匀,室温静置10min。样本处理完全后直接作为核酸扩增样本进行直扩,使用圣湘生物科技股份有限公司生产的六项呼吸道病原体核酸检测试剂盒(pcr-荧光探针法)以及淋球菌核酸检测试剂盒(pcr-荧光探针法)按照说明书进行检测。
[0294]
2.2.液化效果
[0295]
上述各实验组的液化结果发现,愈创甘油醚浓度在20mm-1000mm范围时,处理5分钟即均可完成痰液的液化。结果还可参见表5。其中,实验组7中未添加莎梵婷,导致无法液化。
[0296]
表5.
[0297][0298]
2.3.直扩结果
[0299]
上述各液化剂进行液化后的直扩测试发现:实验组1-5均可有效裂解不同种类核酸,其中实验1-3效果较好且不同种类核酸裂解效率差异较小。实验组6由于无法液化故核酸裂解效率低。实验组7未添加莎梵婷,裂解效率低,呼吸道病毒及人细胞均未检出信号值。实验组8无信号产生,表明莎梵婷无法替代。上述直扩结果还可参考表6和图2。
[0300]
表6.扩增曲线的ct值
[0301][0302][0303]
其中:“no ct”表示未检测出信号值,结果阴性。
[0304]
实施例3.
[0305]
商品扩增试剂盒1(商品扩增剂1):国械注准20173404327,32人份/盒。;
[0306]
商品扩增试剂盒2(商品扩增剂2):国械注准20213400737,20人份/盒。
[0307]
对照扩增试剂盒(对照扩增剂):国械注准20153400086,48人份/盒。
[0308]
三种试剂盒均为淋球菌核酸检测试剂盒(pcr-荧光探针法)。
[0309]
本技术液化剂:以下各组分浓度均为配制后终浓度,100mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷50mmol/l,配制试剂使用的溶剂为纯化水。
[0310]
痰液样本:1例临床痰液样本,其中含有淋球菌。采用以上液化剂进行液化。液化条
件为3倍样本体积液化液与样本混合,混匀,室温静置10min,液化结束后直接作为核酸样本进行扩增使用,使用圣湘生物科技股份有限公司生产的及淋球菌核酸检测试剂盒(pcr-荧光探针法)及商品扩增试剂盒1、商品扩增试剂盒2,根据说明书进行扩增及检测。
[0311]
结果可参考表7和图3。测试发现本发明液化剂处理痰液样本后得到的核酸可直接在不同扩增体系进行扩增。检测浓度差异较小,均实现了痰液样本快速液化快速核酸提取及检测的功能。
[0312]
表7.淋球菌dna扩增曲线的ct值
[0313]
样本编号对照扩增剂商品扩增剂1商品扩增剂2121.5922.3221.71
[0314]
实施例4.
[0315]
4.1.不同实验方案的液化剂
[0316]
实验组(本发明粘性生物样本液化剂):各组分浓度均为配制后终浓度,500mmol/l愈创甘油醚、10mmol/l氢氧化钠、1g/ml氧化锆珠(通径为1mm)、chelex树脂的用量为8%(w/v)、莎梵婷100mmol/l,配制试剂使用的溶剂为纯化水。
[0317]
对照组1(氢氧化钠溶液):1mol/l氢氧化钠溶液。
[0318]
对照组2(二硫苏糖醇溶液):0.1g二硫苏糖醇、0.78g氯化钠、0.02g氯化钾、0.112g磷酸二氢钠、0.02磷酸二氢钾,加纯化水定容至2l。
[0319]
粘性生物样本:圣维尔医学检验中心收集得到的1例目测较为粘稠的结核阳性灭活痰液样本(i),将痰液样本单独充分混合,并且每例分别取3份2ml样本,编号记为1~3。备用。
[0320]
4.2.待测核酸样本的制备
[0321]
1号样本:采用实验组的本发明粘性生物样本液化剂作为液化剂,向编号为1号样本中加入4倍样本体积的液化试剂,混匀,室温静置10min,所得液体作为待测核酸样本,备用。本例中,随液化处理已完成核酸释放,因此不额外进行释放和核酸提纯操作。
[0322]
2号样本:采用对照组1的液化剂(氢氧化钠溶液),向编号为2号的样本中加入4倍样本体积的氢氧化钠溶液,混匀,室温静置30min,待其充分液化。液化过程中震荡混匀2-3次。如痰液粘稠需延长时间至液化。待明显粘稠物后,取1ml液体加入离心管,13000rpm离心5min。弃去上清留沉淀,加入1ml生理盐水洗涤,13000rpm离心5min。去上清。加入1ml生理盐水混匀,得到备用的液化样本。使用圣湘生物科技股份有限公司销售的核酸提取试剂s1006(湘长械备20150021号)试剂,对所得液化样本进行核酸提取,得到待测核酸样本。
[0323]
3号样本:采用对照组2的液化剂(二硫苏糖醇溶液),向编号为3号的样本中加入4倍样本体积的二硫苏糖醇溶液,混合,室温静置30min,待其充分液化。液化过程中震荡混匀2~3次。如痰液粘稠需延长时间至液化,得到备用的液化样本。使用圣湘生物科技股份有限公司销售的核酸提取试剂盒s1006(湘长械备20150021号),对所得液化样本进行核酸提取,得到待测核酸样本。
[0324]
其中,2号样本和3号样本的采用的是传统的待测核酸样本的常规制备方法,均需对液化后的样本进行核酸提取。
[0325]
2号样本和3号样本,根据在售商业试剂盒的说明书进行核酸提取,步骤如下:
[0326]
(1)取适量1.5ml离心管,根据待提取的液化样本例数,每管加入600μl提取溶液1。
[0327]
(2)每管加入200μl液化样本;盖上管盖,震荡混匀10秒钟后,95℃加热10分钟,瞬时离心。
[0328]
(3)每管加入100μl提取溶液2和50μl磁珠悬液,震荡混匀10秒钟,室温静置20分钟。
[0329]
(4)瞬时离心后将离心管置于磁性分离器上,3分钟后缓慢将溶液吸出。
[0330]
(5)每管加入600μl提取溶液3和200μl提取溶液4,震荡混匀5秒钟,瞬时离心后将离心管再次置于磁性分离器。
[0331]
(6)约3分钟后,上清液分为两层,将吸头插入离心管底部,从底部开始缓慢将液体完全吸出丢弃,静置1分钟后将管底残余液体完全吸出丢弃。
[0332]
(7)加入30~50μl洗脱液,将离心管壁上磁珠洗脱到管底,吸打混匀3~4次,室温静置10分钟后将离心管再次置于磁性分离器上3分钟,然后将洗脱下来的核酸放于新的1.5ml离心管中,得到待测核酸样本,备用。
[0333]
4.3.核酸样本的检测
[0334]
1号样本(与iponatic移动分子检测系统联用):使用圣湘生物科技股份有限公司销售的结核分枝杆菌核酸检测试剂盒(pcr-荧光探针法)(国械注准20173400166),联用圣湘生物科技股份有限公司提供的iponatic移动分子检测系统,分别对1号样本的待测核酸样本进行核酸检测。pcr扩增程序如表8所示。
[0335]
表8.对1号样本进行核酸样本检测的pcr扩增程序
[0336][0337]
2号和3号样本(与实时定量荧光pcr仪器联用):使用圣湘生物科技股份有限公司销售的结核分枝杆菌核酸检测试剂盒(pcr-荧光探针法)(国械注准20173400166),联用实时定量荧光pcr仪器(上海宏石,slan96p),分别对2号样本、3号样本的待测核酸样本进行核酸检测。pcr扩增程序如表9所示。
[0338]
表9.对2号和3号样本进行核酸样本检测的pcr扩增程序
[0339][0340]
注:“*”表示荧光采集。产品说明书中指示步骤4(仪器冷却)为可选操作,本实施例中未进行该操作。
[0341]
4.4.核酸样本的检测结果
[0342]
对1、2、3号样待测核酸样本进行检测的结果可参考表10和表11。
[0343]
根据表10和表11,本发明的生物粘性样本液化剂能够从痰液样本中快速检测结核
分枝杆菌(仅需36min),而采用传统液化剂完成核酸检测所需的时间约4小时甚至更久。而且,本发明的生物粘性样本液化剂在显著缩短检测时间的同时(相对于对照组1和2,检测效率分别提高5.8倍、5.5倍),pcr扩增曲线的ct值与对照组1和对照组2基本相当,甚至更优。
[0344]
表10.不同液化剂进行核酸检测时自样本液化至核酸检测完成的耗时对比
[0345][0346][0347]
表11.pcr扩增检测结果
[0348]
所用液化剂ct值本发明的粘性生物样本液化剂28.01对照组1(氢氧化钠溶液)28.19对照组2(二硫苏糖醇溶液)28.05
[0349]
4.5.发明人还尝试了将2号和3号待测核酸样本与iponatic移动分子检测系统联用进行核酸检测(操作方法参考第4.4.部分的1样号样本检测方法)。结果发现,pcr扩增曲线的ct值与4.4.中2号和3号待测核酸样本的结果基本一致;而且整个检测时间仍较长,约3.5小时。可见,采用本技术的粘性生物样本液化剂实现直扩后,能够将整个检测时间缩短至36min,可将检测效率提高4.5倍以上。
[0350]
以上各实施方式和实施例中的各技术特征可以进行任意合适方式的组合,为使描述简洁,未对上述实施方式和实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为在本说明书记载的范围中。
[0351]
以上各实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,得到的等价形式同样落于本技术的保护范围。还应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1