一种分离自西洋参茎叶的二氢黄酮类化合物及抗结肠癌应用的制作方法
1.本发明属于抗肿瘤活性化合物技术领域,具体涉及一种分离自西洋参茎叶的 二氢黄酮类化合物、所述化合物作为抗结肠癌活性成分的应用及其提取方法。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不 必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所 公知的现有技术。
3.西洋参茎叶为五加科植物西洋参(panax quinquefolium l.)的干燥茎叶,具 有增强免疫功能、抗肿瘤、增强心脑血管供血不足、降血脂、抗炎、抗氧化等药 理学作用。众所周知,西洋参为五加科人参属草本植物,其性凉,味苦,入心、 肺、肾经,具有补益降火、养阴生津等作用,多用于治疗热病伤阴、肺虚久咳、 口干少津、咳喘等病症,是闻名于世的珍贵中药材。研究表明西洋参茎叶中化学 成分与根部位成分类似,且茎叶资源丰富,其逐渐成为学者研究的重点。
技术实现要素:
4.本发明通过研究西洋参茎叶化学成分,从中分离得到两种新型二氢黄酮苷类 化合物,且2个化合物的二氢黄酮苷元c-7位连有乙酰基官能团,与现有二氢黄 酮类抗肿瘤活性成分的结构具有明显差异。本发明还对所述二氢黄酮苷类化合物 进行了抗结肠癌活性分析,证实上述化合物具有良好的体外抗结肠癌活性。因此, 本发明目的是提供一种西洋参茎叶中抗结肠癌活性的二氢黄酮苷类化合物、其提 取方法及应用。具体的,本发明提供以下技术方案:
5.本发明第一方面,提供一种化合物,所述化合物选自如下式1或式2所述结 构的化合物,或其药学上可接受的盐或酯或溶剂化物、互变异构体、立体异构体、 代谢产物或前药;所述式1结构如下:
[0006][0007]
所述式2结构如下:
[0008][0009]
上述第一方面所述的化合物,式1化合物为(2s)-4'-羟基-5-o-(β-d-吡喃葡萄 糖基)-7-o-乙酰二氢黄酮,式2化合物为(2s)-4'-羟基-5-o-[β-d-吡喃葡萄糖基
ꢀ‑
(1
→
6)-β-d-吡喃葡萄糖基]-7-o-乙酰二氢黄酮。
[0010]
上述第一方面所述化合物药学上可接受的盐不仅表示受试者生理学上可接 受,还表示“可药用的”例如为了改善上述化合物溶解性等物理性质所进行的成盐 修饰,包括所述化合物与无机酸如盐酸、硫酸、硝酸或氢溴酸形成的盐,还包括 所述化合物与有机酸,例如甲磺酸、甲苯磺酸或三氟乙酸形成的盐。
[0011]
另外,本发明还验证,上述结构的两个二氢黄酮苷类化合物具有结肠癌细胞 的体外细胞毒性。因此,本发明第二方面,提供第一方面所述化合物作为抗肿瘤 活性成分的应用。
[0012]
优选的,所述肿瘤为包括但不限于皮肤癌、肺癌、食道癌、乳腺癌、胰腺癌、 肝癌、结肠癌中的一种。本发明验证的一种实施方式中,所述化合物作为一种抗 结肠癌活性成分。
[0013]
优选的,所述作为抗肿瘤活性成分的应用方式为包括但不限于以下任意一 种:
[0014]
(1)将有效剂量的第一方面所述化合物施用于具有治疗或改善疾病需要的 个体;
[0015]
(2)将第一方面所述化合物应用于制备抗肿瘤药物;
[0016]
(3)将第一方面所述化合物应用于制备抗肿瘤模型制剂。
[0017]
本发明第三方面,提供一种药物组合物,所述药物组合物中包括第一方面所 述化合物。
[0018]
上述第三方面所述“药物组合物”或称“组合物”其可用于在受试者特别是哺 乳动物中实现治疗或预防本发明所述疾病。所述药物组合物中,第一方面所述化 合物作为活性成分,其应当是增效有效剂量的,所述药物剂量属于本领域技术可 通过常规技术手段确定的技术内容。
[0019]
另外优选的方案中,所述药物组合物中,除第一方面所述化合物之外,还可 能包括其他具有抗肿瘤或辅助抗肿瘤作用的成分。
[0020]
进一步的,所述抗肿瘤成分为包括但不限于细胞毒类药物、核酸抑制类药物、 激素类药物、干扰素中的一种或几种;所述辅助抗肿瘤作用的成分为包括但不限 于止呕药、镇痛药、升血药中一种或几种。
[0021]
本发明第四方面,提供一种抗结肠癌药物,所述抗结肠癌药物中包括第三方 面所述药物组合物,还包括药学上所必需的辅料。
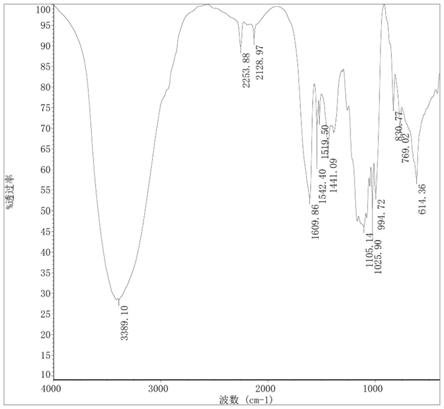
[0022]
所述抗结肠癌药物中,第三方面所述药物组合物应用是治疗有效的剂量的, 所述
药物组合物的量可能占药物总量的1~99%,所述药物的给药剂量约为 0.5mg/kg体重/天-约50mg/kg体重/天,上述剂量属于本领域技术人员可以根据常 规技术手段确定的技术内容。
[0023]
优选的,所述抗结肠癌药物为固体制剂或液体制剂,液体剂型可以是真溶液 类、胶体类、微粒剂型、乳剂剂型、混悬剂型;所述固体剂型例如片剂、胶囊、 滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、栓剂、冻干粉针 剂、包合物、填埋剂、贴剂、擦剂等。
[0024]
进一步的,上述固体制剂中,可行的药物辅料为包括但不限于赋形剂、润滑 剂、粘合剂、崩解剂中的一种或几种。
[0025]
进一步,上述液体制剂中,可行的药物辅料为包括但不限于溶剂、增溶剂、 悬浮剂、等渗剂、缓冲剂、舒缓剂中的一种或几种。
[0026]
优选的,所述抗结肠癌药物的给药方式包括但不限于:口服、喷雾吸入、直 肠给药、鼻腔给药、阴道给药、局部给药、非肠道给药如皮下、静脉、肌内、腹 膜内、鞘内、心室内、胸骨内或颅内注射或输入。
[0027]
另外,所述化合物的获取途径不限于从天然动植物中提取分离或通过化学方 式合成,本发明第五方面,提供一种第一方面所述化合物的制备方法,所述制备 方法包括通过柱色谱分离西洋参茎叶的粗提取物分离得到。
[0028]
优选的,所述制备方法的具体步骤如下:
[0029]
向粉碎的西洋参茎叶中加入乙醇溶液进行加热回流提取,将回流滤液合并后 去除溶剂得到所述西洋参茎叶的粗提物;
[0030]
将所述粗提物加水溶解后首先通过大孔树脂柱色谱进行梯度洗脱,所述洗脱 液依次为水、18~22%乙醇、38~42%乙醇、58~62%乙醇、78~82%乙醇及93~97% 乙醇及水进行洗脱并分别获取各部分洗脱液并干燥;
[0031]
将38~42%乙醇洗脱部分加入38~42%的甲醇溶液中溶解,并通过mci中压 柱色谱进行梯度洗脱,所述甲醇溶液的洗脱梯度依次为 12~17%
→
23~27%
→
32~38%
→
42~48%
→
62~68%
→
78~82%
→
100%,获取32~38% 甲醇溶液洗脱部分并通过rp-c18中压柱色谱进行等度洗脱,所述洗脱液为 20~25%的乙腈溶液,将190~210ml作为一个单位进行接收,并获取第四组馏分 f4;
[0032]
将f4通过sephadex lh-20柱色谱进行洗脱,所述洗脱液为73~78%的甲醇 溶液,每80~120ml作为一个单位继续接收,获取第七组馏分f4-7;
[0033]
将f4-7部分通过液相制备式1及式2所示化合物,所述液相分离的流动相 为ch3cn/h2o(22~27:73~78,v/v)。
[0034]
进一步的,所述粗提物制备的具体步骤如下:将西洋参茎叶中加入65~75% 的乙醇溶液进行加热回流提取,固液比为0.8~1.2:1,所述回流提取的次数为2~4 次,回流完成后合并滤液并干燥得到所述粗提物。
[0035]
进一步的,所述大孔树脂柱色谱为d101型。
[0036]
进一步的,所述液相分离的流速为10ml min-1
;检测波长为254nm。
[0037]
以上一个或多个技术方案的有益效果是:
[0038]
本发明通过对西洋参茎叶中的化学成分进行研究,发现了两种新的二氢黄酮 苷类化合物,且2个化合物的二氢黄酮苷元c-7位连有乙酰基官能团,与现有二 氢黄酮类化合
物的结构存在较为显著的差异。进一步的,经本发明验证,2个化 合物具有显著的体外抗结肠癌活性,有望作为抗结肠癌药物进行临床开发。
附图说明
[0039]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明 的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0040]
图1为式1所示化合物的ir图谱;
[0041]
图2为式1所示化合物的1h nmr图谱;
[0042]
图3为式1所示化合物的
13
c nmr图谱;
[0043]
图4为式1所示化合物的hmqc图谱;
[0044]
图5为式1所示化合物的hmbc图谱;
[0045]
图6为式1所示化合物的ecd图谱;
[0046]
图7为式1所示化合物的hresims图谱;
[0047]
图8为式2所示化合物的ir图谱;
[0048]
图9为式2所示化合物的1h nmr图谱;
[0049]
图10为式2所示化合物的
13
c nmr图谱;
[0050]
图11为式2所示化合物的hmqc图谱;
[0051]
图12为式2所示化合物的hmbc图谱;
[0052]
图13为式2所示化合物的ecd图谱;
[0053]
图14为式2所示化合物的hresims图谱。
具体实施方式
[0054]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。 除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普 通技术人员通常理解的相同含义。
[0055]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限 制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出, 否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使 用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或 它们的组合。
[0056]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结 合具体的实施例详细说明本发明的技术方案。
[0057]
实施例1式1及式2化合物的制备及结构鉴定
[0058]
本实施中,提供一种从西洋参茎叶中提取式1及式2化合物的制备方法,所述 方法步骤如下:
[0059]
1)取西洋参茎叶20kg,晒干后,粉碎,70%乙醇加热回流提取3次,提取 的固液比为1:1,时间分别为2h,2h,1h。将提取液抽滤合并,浓缩至无醇味, 得西洋参茎叶乙醇提取物2.1kg;
[0060]
2)将西洋参茎叶粗提物用水溶解后通过d101大孔树脂柱色谱依次采用水、 20%乙醇、40%乙醇、60%乙醇、80%乙醇及95%乙醇-水梯度洗脱,将各洗脱部 分合并后减压
7-acetylflavanone。
[0070]
(2s)-4'-hydroxyl-5-o-[β-d-glucopyranosyl-(1
→
6)-β-d-glucopyranosyl]-7-acetylflavanone(2):白色粉末;(c 0.16,ch3oh);hr-esi-ms:m/z637.1880[m
–
h]
–
(理论值:637.1763,c
29h33o16
),确定其分子式为:c
29h34o16
, 不饱和度为13。红外光谱在3409cm-1
处有吸收表明存在羟基官能团,1746cm-1
处的吸收表明存在酯羰基官能团,1681cm-1
处的吸收表明存在共轭羰基官能团, 1608cm-1
、1542cm-1
、1519cm-1
处的吸收表明存在苯环官能团。通过比较化合 物2和1的nmr数据,发现两者结构类似,均为二氢黄酮类化合物,区别在于 2的糖链含有2个六碳糖。通过nmr数据分析发现化合物2含有2个糖端基信 号δ
h 4.48(1h,d,j=7.0hz,h-1”')/δ
c 100.3(c-1”')、δ
h 4.81(1h,d,j=7.8hz, h-1”)/δ
c 99.6(c-1”)。将化合物2进行酸水解,经hplc检测并与标准品进行比 较确定化合物2含有2个d-glucose,进一步通过端基氢耦合常数进一步确定糖 结构为β-d-glucose。糖链的内部连接及与苷元的连接位置通过hmbc谱进一步 确定:h-1”'与c-6”(δ
c 63.5)相关,h-6”(δ
h 3.34,3.27)与c-1”'相关,h-1”与c-5 相关,最终确定2个β-d-glucose以c-6”/c-1”'相连,且与苷元c-5位相连。化合 物2的绝对构型通过ecd谱进一步确定,297nm(δε-5.04)处的负cotton效应和 313nm(δε+4.03)处的正cotton效应,确定c-2位为s构型。确定化合物2为 (2s)-4'-hydroxyl-5-o-[β-d-glucopyranosyl-(1
→
6)-β-d-glucopyranosyl]-7-acetylflava none。
[0071]
表1化合物1和2的1h nmr(600mhz,dmso-d6)和
13
c nmr数据(150 mhz,dmso-d6)
[0072]
[0073][0074]
实施例2
[0075]
本实施例中,针对实施例1中制备化合物的抗肿瘤活性进行了考察:
[0076]
1、细胞的培养
[0077]
hct116细胞株的培养条件为高糖dmem培养液,10%胎牛血清。放于5% co2,37℃的细胞培养箱中培养。
[0078]
2、样品的配制
[0079]
以顺铂作为阳性对照药,精密称取化合物1、2、顺铂,用dmso溶解配成 浓度为90mmol/l的母液,储存于-20℃。使用无血清的高糖dmem培养液将样 品的母液分别稀释成90μmol/l、60μmol/l、30μmol/l、15μmol/l、7.5μmol/l、3.75μmol/l备用。
[0080]
3、mtt实验
[0081]
调整细胞浓度至1.0
×
104/ml左右,96孔板中每孔加入100μl细胞液,培养 箱中孵育24h后,取出,将细胞液吸出,加入上述各浓度样品溶液每孔100μl, 每个浓度3个复孔,空白组加等体积的培养基,培养箱中孵育24h后,取出, 每孔加入10μl mtt,培养箱中孵育4h
后,即可进行检测。将上清液吸出,加 入100μl dmso,振荡均匀后,于酶标仪570nm处测得od值。
[0082]
细胞抑制率(%)=(1-od
实验
/od
空白
)
×
100%
[0083]
4、实验结果
[0084]
阳性对照药顺铂对hct116细胞的ic
50
为4.3μm, (2s)-4'-hydroxy-5-o-(β-d-glucopyranosyl)-7-acetylflavanone(1)和 (2s)-4'-hydroxyl-5-o-[β-d-glucopyranosyl-(1
→
6)-β-d-glucopyranosyl]-7-acetylflava none(2)对hct116细胞具有明显的细胞毒活性,其ic
50
分别为15.3和17.3μm。
[0085]
上述结果证实了实施例1中分离得到的所述化合物1和2,具有良好的体外 结肠癌细胞毒性,具有结肠癌细胞增殖抑制效果,有望应用于抗结肠癌药物的开 发。
[0086]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域 的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内, 所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1