一种检测mRNA2的制作方法
一种检测mrna 2
′‑
o-甲基转移酶活性的方法
技术领域
1.本发明属于生物工程领域,具体地,是关于一种检测mrna 2'-o-甲基转移酶活性的方法。
背景技术:
2.目前检测2'-o-甲基转移酶活性的主要方法是底物放射性标记,使用[甲基
‑ꢀ3h]-sam表征所有利用sam(s-腺苷甲硫氨酸)的甲基转移酶家族。反应在[甲基
‑ꢀ3h]-sam和短gpppx-rna 之间进行,对转移的[ 3
h]ch3进行定量分析然后使用tlc产物分离和放射性计数进行分组。通过使用放射性标记的rna/核苷酸,可以观察核苷酸底物结构中出现的变化。该方法安全性低,存在放射性污染,且步骤繁琐,实验环境要求高,成本高。
[0003]
因此,本领域需要开发一种安全高、无放射性污染、步骤简单、实验环境要求低、成本低的检测mrna 2'-o-甲基转移酶活性的方法。
技术实现要素:
[0004]
本发明的目的在于提供一种检测mrna 2'-o-甲基转移酶活性的方法。
[0005] 在本发明的第一方面,提供了一种体外检测mrna 2'-o-甲基转移酶活性的方法,包括以下步骤:(s1)提供5’末端为5
’‑
三磷酸的单链rna分子;(s2)对(s1)中的rna分子分别进行以下测试反应,所述测试反应包括在阴性测试体系、第一测试体系、第二测试体系中反应,反应时间为t,其中:阴性测试体系中,不包含酶;第一测试体系中,包含cap0加帽酶;第二测试体系中,包含cap0加帽酶和mrna 2'-o-甲基转移酶;(s3)检测(s2)中,阴性测试体系、第一测试体系和第二测试体系中的sah的形成情况,与标准曲线或标准值对比,得到sah的定量结果:其中,阴性测试体系中sah生成量为a0;第一测试体系中sah生成量为a1;第二测试体系中sah生成量为a2;其中,
△
质
=a1-a0;
△1=a2-a1;如果
△
质
低于预定值,则认为测试失败;如果
△1/
△
质
>1,则认为待检测的2'-o-甲基转移酶有酶活性,所述的酶活性为
△1/t;如果
△1/
△
质
=1,则认为待检测的2'-o-甲基转移酶无活性。
[0006]
其中,
“△
质”表示质控值,即第一测试体系与阴性测试体系中sah生成量的差值,
“△
1”表示mrna 2'-o-甲基转移酶的sah生成量,即第二测试体系与第一测试体系中sah生成量的差值。
[0007]
在另一优选例中,所述预定值为0。
[0008]
在另一优选例中,所述单链rna分子的长度为500-2000 nt,较佳地为1000 nt。
[0009]
另一优选例中,在阴性测试体系、第一测试体系或第二测试体系中,所述rna的终浓度各自独立地为150μg/500μl-350μg/500μl,较佳地为250μg/500μl。
[0010]
在另一优选例中,在阴性测试体系、第一测试体系或第二测试体系中,各自独立地包含sam、gtp、10
×
加帽反应缓冲液和rnase抑制剂。
[0011]
在另一优选例中,所述10
×
加帽反应缓冲液的终浓度为1x加帽反应缓冲液。
[0012]
在另一优选例中,所述sam的终浓度为0.25 mm-0.75 mm,较佳地为0.5 mm。
[0013]
在另一优选例中,所述gtp的终浓度为0.5 mm-2 mm,较佳地为1 mm。
[0014]
在另一优选例中,所述rnase抑制剂的终浓度为0.5 u/μl-2 u/μl,较佳地为1 u/μl。
[0015]
在另一优选例中,所述cap0加帽酶为牛痘病毒加帽酶。
[0016]
在另一优选例中,第一测试体系中,所述cap0加帽酶的终浓度为0.3 u/μl-0.8 u/μl,较佳地为0.4 u/μl。
[0017]
在另一优选例中,第二测试体系中,所述cap0加帽酶的终浓度为0.3 u/μl-0.8 u/μl,较佳地为0.4 u/μl。
[0018]
在另一优选例中,第二测试体系中,所述mrna 2'-o-甲基转移酶的终浓度为2 u/μl-8 u/μl,较佳地为4 u/μl。
[0019]
在另一优选例中,所述反应时间t为0.8-1.4h;较佳地,反应时间t为1h。
[0020]
在另一优选例中,所述测试反应在35-38℃下进行;较佳地,在37℃下进行。
[0021]
在另一优选例中,第一测试体系中,反应条件为:37℃下,反应时间t为0.8-1.4h;较佳地,37℃下,反应时间t为1h。
[0022]
在另一优选例中,第二测试体系中,反应条件为:37℃下,反应时间t为0.8-1.4h;较佳地,37℃下,反应时间t为1h。
[0023]
在另一优选例中,(s1)中,所述5’末端为5
’‑
三磷酸的单链rna分子为dna体外转录获得的mrna。
[0024]
在另一优选例中,(s1)中,还包括:(s1.1)提供一dna;(s1.2)体外转录(s1)中的dna,获得由所述dna转录的mrna。
[0025]
在另一优选例中,(s1.2)中,还包括:将转录纯化后的mrna置于pcr仪中65℃ 5min,反应结束立刻置于冰上5min。
[0026]
在另一优选例中,(s1.1)中,所述目的基因为egfp基因。
[0027]
在另一优选例中,(s1.2)中,使用t7 rna聚合酶转录dna,获得由所述dna转录的mrna。
[0028]
在另一优选例中,(s3)中,所述检测为hplc检测。
[0029]
在另一优选例中,(s3)中,包括:(s3.1)设置适合sah分离的色谱条件;(s3.2)绘制sah的标准曲线:将sah标准品梯度稀释为不同摩尔浓度的sah标准溶液,在(s3.1)的色谱条件下,根据液相色谱中sah峰面积,以sah摩尔量为横坐标,峰面积为纵坐标,绘制sah的标准曲线;(s3.3)计算sah的含量:在(s3.1)所述的色谱条件下,分别检测第一测试体系、第
二测试体系和阴性对照组,获取相应的sah峰面积,分别代入(s3.2)中的标准曲线进行计算,得到第一测试体系、第二测试体系和阴性对照组中相应的sah含量。
[0030]
在另一优选例中,所述方法为非诊断和非治疗的方法。
[0031]
在另一优选例中,所述方法为体外方法。
[0032]
在另一优选例中,所述“适合sah分离的色谱条件”是指,sah的出峰位置t1,与测试体系中sam的出峰位置t0相比,(t1-t0)≥2min;较佳地≥4min;更佳地≥6min。
[0033]
在本发明的第二方面,提供了一种检测mrna 2'-o-甲基转移酶活性的试剂盒,所述试剂盒包括:(a)第一容器,以及位于第一容器中的阴性测试体系;(b)第二容器,以及位于第二容器中的第一测试体系;(c)第三容器,以及位于第三容器中的第二测试体系;和(d)第四容器,sah标准品;其中,阴性测试体系中,不包含酶;第一测试体系中,包含cap0加帽酶;第二测试体系中,包含cap0加帽酶和mrna 2'-o-甲基转移酶。
[0034]
在另一优选例中,在阴性测试体系、第一测试体系或第二测试体系中,各自独立地包含sam、gtp、10
×
加帽反应缓冲液和rnase抑制剂。
[0035]
在另一优选例中,所述试剂盒还包括使用说明书。
[0036]
在另一优选例中,所述sah标准品用于绘制sah的标准曲线。
[0037] 在本发明的第三发明,提供了一种mrna 2'-o-甲基转移酶活性的检测装置,所述装置包括:(d1)反应模块,所述的反应模块包括阴性对照室、第一反应室和第二反应室,其中,阴性对照室包含阴性测试体系;第一反应室包含第一反应模块,所述第一反应模块包含第一测试体系;第二反应室包含第二反应模块,所述第二反应模块包含第二测试体系;其中,阴性测试体系中,不包含酶;第一测试体系中,包含cap0加帽酶;第二测试体系中,包含cap0加帽酶和mrna 2'-o-甲基转移酶;(d2)数据采集模块,所述数据采集模块被配置为对反应模块中各个反应室中的所述sah峰面积进行数据采集;(d3)分析模块,所述分析模块被配置为对来自所述数据采集模块的sah峰面积通过sah的“峰面积-浓度”标准曲线进行分析,获得待筛选的2'-o-甲基转移酶活性分析结果;(d4)输出模块,所述输出模块输出筛选分析模块的分析结果。
[0038]
在另一优选例中,第一测试体系中,所述cap0加帽酶的终浓度为0.3 u/μl-0.8 u/μl,较佳地为0.4 u/μl。
[0039]
在另一优选例中,第二测试体系中,所述cap0加帽酶的终浓度为0.3 u/μl-0.8 u/μl,较佳地为0.4 u/μl。
[0040]
在另一优选例中,第二测试体系中,所述mrna 2'-o-甲基转移酶的终浓度为2 u/μl-8 u/μl,较佳地为4 u/μl。
[0041]
在另一优选例中,第一测试体系中,反应条件为:37℃下,反应0.8-1.4h;较佳地,
37℃下,反应1h。
[0042]
在另一优选例中,第二测试体系中,反应条件为:37℃下,反应0.8-1.4h;较佳地,37℃下,反应1h。
[0043]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0044]
图1是pcr扩增得到的dna模板琼脂糖凝胶电泳图。图中显示dna模板的片段大小,m为分子量marker。
[0045]
图2是转录rna的琼脂糖凝胶电泳图。图中显示dna模板的片段大小,m为分子量marker。
[0046]
图3是sah标准品的液相色谱图(waters),sah标准品的出峰位置在10min左右。
[0047]
图4是sam的液相色谱图(waters),反应体系中组分sam的出峰位置在3min左右。
[0048]
图5是sah标准曲线图。图中显示sah摩尔量x与峰面积y的线性关系。
[0049]
图6是供试品的的液相色谱图(waters),箭头标注的位置为sah的出峰位置。
具体实施方式
[0050]
本发明人经过广泛而深入地研究,首次开发了一种高效、安全的检测mrna 2'-o-甲基转移酶活性的方法。具体地,通过牛痘病毒加帽酶对dna转录的rna进行cap0加帽反应并设置阴性对照组,进一步地,通过牛痘病毒加帽酶和mrna 2'-o-甲基转移酶对目的基因rna进行cap1加帽反应,利用hplc方法检测上述反应中副产物sah(s-腺苷同型半胱氨酸)的生成量,来判断mrna 2'-o-甲基转移酶的活性。特别地,在cap1加帽的双酶反应体系中,牛痘病毒加帽酶和2'-o-甲基转移酶的活性未受各自影响,从而可以简单、快速地(2小时内)完成酶的活性检测。在此基础上完成了本发明。
[0051] cap帽结构和2'-o-甲基转移酶mrna疫苗技术的飞速发展,导致rna生物学需求日益增加。cap帽结构生物合成是mrna成熟的重要步骤。由于其对许多病毒感染的发展和治疗的影响,它已成为研究热点。
[0052]
真核 mrna 是一种复杂的分子,由各种核苷酸区域组成。mrna序列的中心部分是位于5'和3'非翻译区(utr) 之间的蛋白质编码片段。mrna的3'末端受到聚(a)尾的保护,该尾由多个单磷酸腺苷组成,可稳定转录并参与翻译。称为“帽”的独特核苷酸结构位于 5' mrna 末端,即“cap帽”。它有一个7-甲基鸟苷成分,通过 5'-5'-三磷酸桥与新生转录物的第一个核苷酸相连。
[0053]
cap帽结构生物合成是mrna成熟的重要步骤。cap帽结构生物合成涉及由 rna三磷酸酶 (tpase)、鸟苷酸转移酶 (gtase) 和n7-鸟嘌呤甲基转移酶 (n7-mtase) 介导的三个连续酶促反应,最终形成cap 0结构,这是简单结构中的主要形式,比如在真核生物中的酵母、植物中的结构等。然而在高等生物中,包括人类,体内的mrna主要是以cap1的形式存在。
[0054]
对于cap0帽结构而言,cap1帽结构在其功能的基础上更多了一些对于rna的保护功能。首先,它能保护mrna不被核酸外切酶快速降解。其次,相比于cap0帽结构,5’cap1帽结
构在翻译过程中能显著提高rna的翻译效率,改善 mrna 在显微注射和转染后的表达。此外,5’cap1帽结构在防止先天性免疫传感器识别mrna方面也起到了进一步的作用,有研究推测其能通过i 型干扰素信号通路保护mrna免受先天免疫反应触发的翻译关闭。
[0055]
带帽 cap 0 rna能被甲基化为 cap 1 rna。mrna 2'-o-甲基转移酶(2'-o
ꢀ‑
mtase)能在rna 5
´
末端紧邻帽结构的第一个核苷酸的 2
´‑
o上添加甲基基团,利用 s-腺苷甲硫氨酸(sam)作为甲基供体,使带帽 cap 0 rna甲基化为 cap 1 rna。该酶只能以带 7-甲基鸟苷帽结构(m7gpppn,cap0)的 rna 为底物,不会作用于5
´
末端为 pn、ppn、pppn 或 gpppn 的 rna。
[0056]
如本文所用,“cap帽”或“帽”结构可以互换使用,指位于 5' mrna 末端的独特核苷酸结构。其有一个7-甲基鸟苷成分,通过5'-5'-三磷酸桥与新生转录物的第一个核苷酸相连。
[0057]
如本文所用,“sam(s-adenosyl-l-methionine)”、“s-腺苷甲硫氨酸”可以互换使用,指具有c
15h22
n6o5s分子式的分子,其结构式如下。
[0058]
如本文所用,“sah(s-adenosyl homocysteine)”、“s-腺苷同型半胱氨酸”可以互换使用,指具有如下所示分子式的分子:c
14h20
n6o5s。sah是由s-腺苷-l-甲硫氨酸(sam)经脱甲基作用而形成的。
[0059]
在本发明中,sah为cap0加帽反应以及cap1加帽反应的副产物。
[0060]
牛痘病毒加帽酶牛痘病毒加帽体系利用牛痘病毒加帽酶及相关组分,将7-甲基鸟苷帽结构(m7gppp,cap0)加到rna的5
´
末端。在真核生物中,该结构与mrna的稳定、转运和翻译密切相关。使用酶促反应为rna加帽是一种简单有效的方法,且帽结构与天然cap 0结构完全一致,能显著改善用于体外转录、转染和显微注射的rna的稳定性和翻译能力。这种酶由两个亚基(d1和d12)组成,d1亚基执行rna三磷酸酶和鸟苷转移酶的功能,d12亚基执行鸟嘌呤甲基转移酶的功能,它们对于添加一个完整的cap 0结构m7gppp5
´
n都是必须的。
[0061]
由牛痘病毒加帽酶构建的带帽rna产品具有“cap 0”结构。通过在加帽反应中同时使用mrna cap 2'-o-甲基转移酶和牛痘病毒加帽酶,cap 0-rna可以转化为“cap 1”结构。 mrna cap 2'-o-甲基转移酶通过将甲基从供体分子sam转移到cap 0
‑ꢀ
rna 5’端紧邻帽结构的第一个核苷酸的2'-o位置,从而从cap 0-rna制备cap 1-rna。
[0062]
本发明的检测方法本技术公开了一种检测mrna 2'-o-甲基转移酶活性的方法。其中,方法包括:步骤a,利用t7 rna聚合酶转录出目的基因rna;
步骤b,利用牛痘病毒加帽酶对步骤a中rna进行cap0加帽反应并设置阴性对照组;利用牛痘病毒加帽酶和mrna 2'-o-甲基转移酶对步骤a中的rna进行cap1加帽反应;利用hplc方法检测步骤a、b、c中副产物sah(s-腺苷同型半胱氨酸)的生成量,观察步骤c的生成量是否显著高于步骤b,从而判定步骤c中mrna 2'-o-甲基转移酶的活性。
[0063]
后期的数据分析表明:该方法重复性好,cap1加帽与cap0加帽的sah生成量差异显著,可成功检测mrna 2'-o-甲基转移酶活性。
[0064]
在一个具体的实施例中,cap0加帽反应中使用的牛痘病毒加帽酶(vaccinia virus capping enzyme,vce)将7-甲基鸟苷帽结构(cap 0)加到rna的5'末端。
[0065]
其中,所述的牛痘病毒加帽酶具有rna三磷酸酶 (tpase)、鸟苷酸转移酶 (gtase) 和n7-鸟嘌呤甲基转移酶 (n7-mtase)三者的功能。
[0066] 本发明通过研究,建立了一种检测mrna 2'-o-甲基转移酶活性的方法,具体过程为:首先,根据已有目的基因设计合成一对引物t7-f/r,使用该引物对含有目的基因的质粒进行pcr扩增,得到转录的dna模板;接着,在t7 rna聚合酶、4种ntps的作用下转录合成rna;紧接着,对转录合成的rna进行cap0加帽反应,同时设置不加酶的阴性对照组;之后,对转录合成的rna进行cap1加帽反应;最后,将转录的rna、cap0加帽rna、cap1加帽rna进行hplc检测,检测其反应副产物sah的生成水平,以判定mrna 2'-o-甲基转移酶的活性。
[0067]
若mrna 2'-o-甲基转移酶无活性,则cap0加帽rna和cap1加帽rna的sah生成量无显著差异;若mrna 2'-o-甲基转移酶有活性,则cap0加帽rna和cap1加帽rna的sah生成量有显著差异。
[0068]
本发明的主要优点包括1)无需使用放射性标记,无放射性污染,无需严苛等级实验室;2)操作简单,2小时内即可完成酶的活性检测。
[0069]
3)通过反应中的副产物的生成量来确定酶活,无需使用质谱仪器。
[0070]
4)本发明中,使用牛痘病毒加帽酶替代rna三磷酸酶 (tpase)、鸟苷酸转移酶 (gtase) 和n7-鸟嘌呤甲基转移酶 (n7-mtase)三者的功能,简化了反应体系。
[0071] 下面结合具体实施例,进一步陈述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0072] 实施例1. rna反应体系的建立1、样品及材料准备a.材料、试剂和仪器:2x fast pfu master mix(2x 快速pfu聚合酶混液),novoprotein(近岸蛋白质科技有限公司),货号:e035;t7 high yield rna transcription kit(t7高产量rna转录试剂盒),novoprotein(近岸蛋白质科技有限公司),货号:e131;cap1 capping system(cap1加帽系统), novoprotein(近岸蛋白质科技有限公司),货号:m082;depc-h2o,焦炭酸二乙酯处理后灭菌的水;新鲜配制的80%乙醇、纯化磁珠;0.2ml ep管、磁
力架、pcr仪、qubit核酸检测仪等。cap1加帽系统包括sam、gtp、10
×
加帽反应缓冲液、rnase抑制剂、牛痘病毒加帽酶、mrna 2'-o-甲基转移酶。
[0073]
b.样品:含有目的基因的质粒。
[0074]
2、引物t7-f和t7-r的设计本实验选择egfp基因作为目的基因,设计引物,其中t7-f带有t7启动子序列,具体序列如下:t7-f:taatacgactcactatagggagatcgcctggagacgcc(seq id no:1)t7-r:gctatggcagggcctgc(seq id no:2)3、从质粒上扩增出含有目的基因的dna片段,加入以下配置反应体系:表1. 质粒上扩增含有目的基因的dna片段的反应体系使用移液器轻轻吹打充分混匀,并短暂离心将反应液离心至管底。将样品置于pcr仪中,反应程序设置如下:表2. pcr反应程序反应结束后通过异丙醇沉淀回收,如图1所示,条带清晰、单一、无杂带,qubit核酸检测仪检测浓度。
[0075]
4、体外转录rna反应,加入以下配置d:表3. 体外转录rna反应的反应体系
37℃ 3h,反应结束后加入2u dnase i,37℃ 30min,磁珠纯化,如图2所示,条带清晰、单一、无杂带,qubit核酸检测仪检测浓度。
[0076]
5、cap0加帽反应,将转录纯化后的rna置于pcr仪中65℃ 5min,反应结束立刻置于冰上5min,加入以下配置反应体系:表4. cap0加帽反应的反应体系37℃ 1h,反应结束后置于-20℃保存待用。
[0077]
其中,酶单位(u)为1min内能转化1μmol底物的酶量。
[0078]
6、cap1加帽反应,将转录纯化后的rna置于pcr仪中65℃ 5min,反应结束立刻置于冰上5min,加入以下配置反应体系:表5. cap1加帽反应的反应体系
37℃ 1h,反应结束置于-20℃保存待用。
[0079] 实施例2:一种检测mrna 2'-o-甲基转移酶活性的方法1、色谱条件与系统适用性试验:用十八烷基硅烷键合硅胶为填充剂,色谱柱:sepax bio-c18 分析柱,4.6
×
250mm,流动相:5%甲醇,1
‰
冰醋酸。流速:1.0ml/min,检测波长254nm,柱温:25℃,进样量:10μl。
[0080]
2、溶液制备:供试品溶液制备:取转录后rna、cap0反应体系、cap1反应体系各500μl,用0.22μm过滤器过滤后,12000rpm,5min。取上清10μl,即得供试品溶液。
[0081]
对照品溶液制备:取sah粉末10mg溶于3.25ml depc-h2o中,即得到8mm sah标准品溶液。将8mm sah按照2倍梯度分别稀释至4mm, 2mm, 1mm, 0.5mm, 0.25mm,即得对照品溶液。
[0082]
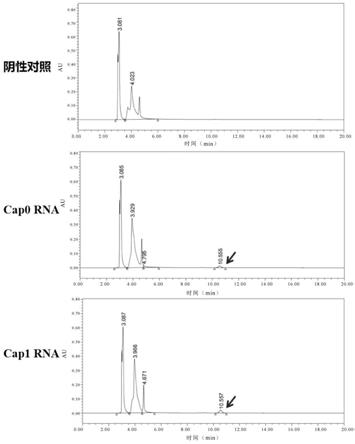
3、hplc测定分别量取供试品溶液和对照品溶液各10μl,注入液相色谱仪,照上述色谱条件进行测定。获取各个摩尔量标准品的对应定量信号的质谱峰强度数据。如图3所示,sah标准品的出峰位置在10min左右。以sah摩尔量为横坐标,峰面积为纵坐标,绘制sah的标准曲线,如图5。将检测到的所有样本的sah峰面积代入标准曲线线性方程进行计算,得到实际样本中sah的摩尔含量,如图6所示。反应体系中组分sam的出峰位置在3min左右,如图4所示。供试品sah实际生产量计算结果如表6所示。
[0083]
表6.供试品sah实际生产量计算结果结果表明,阴性对照未加入酶进行反应,因此未发生甲基转移过程,无sah生成;
cap0 rna在牛痘病毒加帽酶的作用下以sam为甲基供体发生了甲基转移反应,生成了sah,浓度为0.015mm;cap1 rna反应中,首先是牛痘病毒加帽酶以sam作为供体反应生成cap0 rna,而后在mrna 2'-o-甲基转移酶作用下,仍以sam作为供体反应生成cap1 rna,最终的sah生成浓度为0.034mm,远高于cap0反应体系的生成量,表明mrna 2'-o-甲基转移酶有活性。
[0084]
对cap1反应体系通过lc-ms的方法进行加帽效率检测,结果表明cap1体系中cap0加帽率可达99.6%(如表7),表明mrna 2'-o-甲基转移酶的加入未影响cap0加帽酶的加帽效率。
[0085]
表7. lc-ms检测cap1加帽体系中cap0的加帽率对比例采用传统测定mrna 2
’‑
o甲基转移酶活性的方法进行检测步骤一、在20μl反应系统(含有50mm tris-hcl [ph 8.0], 2mm dtt, 2mm mgcl2, 40u rnase抑制剂, 0.01mm sam, 0.5μci [3h]-sam[67.3ci/mmol; 0.5μci/μl], 1μg mrna 2
’‑
o甲基转移酶和3μg 7me
gppprna底物)在37
°
c下1小时。
[0086]
步骤二、将试管转移到冰上,加入等体积的0.2% sds, 20 mm edta。
[0087]
步骤三、将试管置于冰上,加入1 ml 10mm nh4hco3(ph 8.5)。
[0088]
步骤四、使用1ml deae-sephadex柱分离并洗脱3h标记的产物,通过液体闪烁计数器测量结果进行定量,从[3h]-sam转化为rna底物的[3h]的计数信号代表了被测mrna 2
’‑
o甲基转移酶的活性。
[0089]
预期结果:阴性对照中未加入mrna 2
’‑
o甲基转移酶,cpm几乎无信号,表明甲基-3
h未掺入到底物rna上;阳性对照和实验组cpm均有信号,表明甲基-3
h掺入到底物rna上,mrna 2
’‑
o甲基转移酶有活性。
[0090]
与本发明中的方法相比,传统方法的检测步骤操作复杂,周期长,且具有放射性污染。
[0091]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1