靶向HIVgp120蛋白和人CD3分子的多特异性抗体及其应用的制作方法
nov;24(11):1701-1707. doi: 10.1038/ s41591-018-0186-4.)。但是这种联合治疗(通常所说的鸡尾酒疗法)在实际开发中面临着巨大的障碍——对每种抗体进行毒理学和药代动力学评估会大大增加临床前的工作量。由此也促进了双靶点的抗体药物的研发,比如双特异性抗体10e8.4/imab(huang yx, et al. engineered bispecific antibodies with exquisite hiv-1-neutralizing activity. cell. 2016 jun 16;165(7):1621-1631. doi: 10.1016/j.cell.2016.05.024.),三特异性抗体sar441236(vrc01/pgdm1400-10e8v4)(xu l,et al. trispecific broadly neutralizing hiv antibodies mediate potent shiv protection in macaques. science. 2017 oct 6;358(6359):85-90.doi: 10.1126/science.aan8630.)。这些抗体分子对不同变异株有更广泛的覆盖,具有更高的耐药屏障。第三类抗体药物同时靶向病毒(及病毒感染细胞)和效应细胞。比如hiv*cd3 dart(dual-affinity retargeting,双亲和性重定向)分子或fc融合蛋白,一头靶向病毒外膜蛋白(gp120或gp41),一头靶向人cd3分子,通过非mhc分子依赖途径激活t细胞,杀伤潜伏病毒的感染细胞(sloan dd, et al. targeting hiv reservoir in infected cd4 t cells by dual-affinity re-targeting molecules (darts) that bind hiv envelope and recruit cytotoxic t cells. plos pathog. 2015 nov 5;11(11): e1005233. doi: 10.1371/journal.ppat.1005233. ecollection 2015.)。又比如bikes(双特异性杀伤细胞接合器,bi-specific killer cell engagers),由一段cd4分子序列和抗cd16的抗体片段d6(或e11)两部分组成,同时靶向cd16分子和hiv gp120,介导自然杀伤细胞(nk)对hiv病毒的吞噬(li w,et al. one-domain cd4 fused to human anti-cd16 antibody domain mediates effective killing of hiv-1-infected cells. scientific reports,22 aug 2017,7(1):9130. doi: 10.1038/s41598-017-07966-3)。
5.人cd3分子有δ、ε、γ、ζ共4种亚基,四种亚基组成的6条多肽链与t细胞受体(t cell receptor,tcr)紧密结合,形成包含8条多肽链的tcr-cd3复合物,该复合物传导t细胞激活信号,稳定tcr结构。cd3的胞内部分含有免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,itam),tcr识别和结合mhc分子呈递的抗原肽,使得t细胞内的酪氨酸蛋白激酶p561ck磷酸化cd3分子中itam的酪氨酸残基,之后募集含有sh2(scr homology 2)结构域的酪氨酸蛋白激酶(如zap-70)。itam磷酸化和结合zap-70是t细胞激活早期信号传导过程的重要生化反应之一。因此,cd3分子有传导tcr识别抗原产生的激活信号的功能。
6.双特异性抗体(bispecific antibody,bsab)是一类人工抗体,可以与两个不同抗原或同一抗原的两个不同抗原表位相结合,在肿瘤和自身免疫病治疗方面有着广泛的应用。目前,临床上用于治疗艾滋病的方案均无法彻底地清除患者体内的hiv,且患者需要终生服药。因此,在hiv抗感染治疗中,双特异抗体和多特异抗体正在寻求其更大的发展空间,覆盖更广泛的病毒序列;或通过激活效应细胞,发挥更好的细胞定向杀伤。
技术实现要素:
7.本发明所要解决的技术问题是如何使抗hiv抗体能够直接中和病毒,和/或,能够把感染病毒的细胞清除掉从而提高hiv感染的抗病毒治疗效果。所要解决的技术问题不限于如所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它
技术主题。
8.为解决上述技术问题,本发明首先提供了特异性结合gp120(hiv壳膜蛋白gp120蛋白)和cd3(人t细胞cd3分子)的多特异性抗体,名称为hiv-dns,所述多特异性抗体hiv-dns包括:a1)特异性结合gp120的抗体,所述抗体包含重链可变区(vh)和轻链可变区(vl),所述抗体的重链可变区(vh)的氨基酸序列为seq id no.1的第1-136位,所述抗体的轻链可变区(vl)的氨基酸序列为seq id no.3的第1-125位;a2)特异性结合cd3的单链抗体okt3 scfv,所述单链抗体okt3 scfv的氨基酸序列为seq id no.1的第471-710位;所述单链抗体okt3 scfv与a1)中所述抗体的重链的c末端融合。
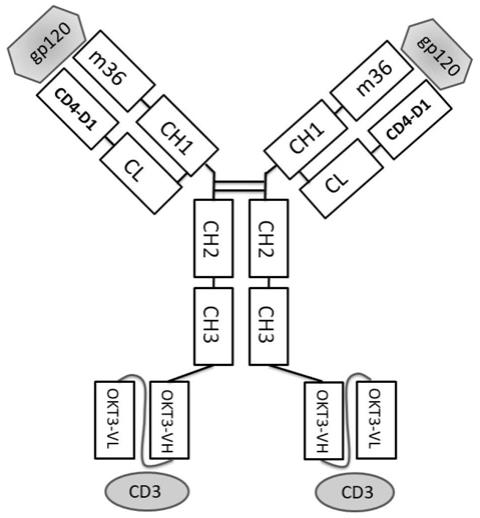
9.所述多特异性抗体hiv-dns可以结合第一抗原gp120蛋白的不同表位,同时结合第二抗原cd3分子,所述多特异性抗体hiv-dns的结构如图1所示。
10.进一步地,所述多特异性抗体hiv-dns中,a1)中所述抗体还包括重链恒定区(ch,由ch1、ch2和ch3组成)和轻链恒定区(cl),所述重链恒定区的氨基酸序列可为seq id no.1的第137-464位,所述轻链恒定区的氨基酸序列可为seq id no.3的第151-257位。
11.进一步地,所述多特异性抗体hiv-dns中,a1)中所述抗体还包括接头(linker),所述接头连接a1)中所述抗体的轻链可变区(vl)和轻链恒定区(cl),所述接头的氨基酸序列可为seq id no.3的第126-150位。
12.本发明所述多特异性抗体hiv-dns为附加在igg(appended igg)形态上的对称结构的多特异性抗体分子,包括两条重链和两条轻链。
13.所述多特异性抗体hiv-dns的每条重链从n端到c端依次为:重链可变区vh(m36)、重链恒定区ch(ch1、ch2、ch3)和单链抗体okt3 scfv;所述多特异性抗体hiv-dns的每条轻链从n端到c端依次为:轻链可变区vl(cd4-d1)、接头(linker)和轻链恒定区cl。
14.进一步地,所述多特异性抗体hiv-dns的重链的氨基酸序列可为seq id no.1,所述多特异性抗体hiv-dns的轻链的氨基酸序列可为seq id no.3。
15.本发明还提供了生物材料,所述生物材料可为下述c1)至c6)中的任一种:c1)编码任一所述多特异性抗体的核酸分子;c2)编码任一所述多特异性抗体的重链和/或轻链的核酸分子;c3)含有c1)或c2)所述核酸分子的表达盒;c4)含有c1)或c2)所述核酸分子的重组载体、或含有c3)所述表达盒的重组载体;c5)含有c1)或c2)所述核酸分子的重组微生物、或含有c3)所述表达盒的重组微生物、或含有c4)所述重组载体的重组微生物;c6)含有c1)或c2)所述核酸分子的细胞系、或含有c3)所述表达盒的细胞系、或含有c4)所述重组载体的细胞系。
16.其中,c5)所述的重组微生物和c6)所述的细胞系可表达所述多特异性抗体hiv-dns。
17.上述生物材料中,所述核酸分子可为编码序列是seq id no.2的dna分子和/或编码序列是seq id no.4的dna分子。
18.在本发明的一个实施例中,所述多特异性抗体hiv-dns的重链的编码基因的核苷酸序列为seq id no.2;所述多特异性抗体hiv-dns的轻链的编码基因的核苷酸序列为seq id no.4。
19.seq id no.2的第1-408位为多特异性抗体hiv-dns的重链可变区vh的编码基因;seq id no.2的第409-1392位为多特异性抗体hiv-dns的重链恒定区ch(ch1、ch2、ch3)的编码基因;seq id no.2的第1393-1410位为接头2(linker2)的编码基因,所述接头2连接多特异性抗体hiv-dns重链恒定区(ch)和单链抗体okt3 scfv;seq id no.2的第1411-2133位为单链抗体okt3 scfv(即所述多特异性抗体hiv-dns的cd3抗原结合片段)的编码基因。
20.seq id no.4的第1-375位为多特异性抗体hiv-dns的轻链可变区vl的编码基因;seq id no.4的第376-450位为接头(linker)的编码基因,所述接头连接多特异性抗体hiv-dns轻链可变区(vl)和轻链恒定区(cl);seq id no.4的第451-774位为多特异性抗体hiv-dns的轻链恒定区cl的编码基因。
21.所述载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体(如λ噬菌体或m13丝状噬菌体等)、黏粒(即柯斯质粒)、病毒载体(如杆状病毒载体、逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒或疱疹病毒(如单纯疱疹病毒)等)。在本发明的一个实施例中,载体具体可为pcdna3.1(+)-neo载体和/或pcdna3.1(+)-zeo载体。
22.所述微生物可为酵母、细菌或真菌。其中,细菌可来自埃希氏菌属(escherichia),欧文氏菌(erwinia),根癌农杆菌属(agrobacterium)、黄杆菌属(flavobacterium),产碱菌属(alcaligenes),假单胞菌属(pseudomonas),芽胞杆菌属(bacillus)等;酵母可为毕赤酵母(p.pastoris)。在本发明的一个实施例中,微生物具体可为大肠杆菌trans10。
23.所述细胞系(宿主细胞)是指可用于导入载体的细胞,其包括但不限于:真核细胞(如酵母细胞、曲霉菌)、动物细胞(如哺乳动物细胞、昆虫细胞)或原核细胞(如大肠杆菌或枯草杆菌)。在本发明的一个实施例中,所述细胞系具体可为cho-dg44细胞。
24.术语“细胞”和“细胞系”可互换使用,并且所有这类名称都包括其后代。
25.在本发明的一个实施例中,所述重组载体具体可为pcdna3.1(+)-zeo/hiv-dns lc和/或pcdna3.1(+)-neo/hiv-dns hc。
26.所述重组载体pcdna3.1(+)-zeo/hiv-dns lc是用核苷酸序列为seq id no.4的hiv-dns轻链基因替换pcdna3.1(+)-zeo载体的ecori识别位点和ecorv识别位点之间的片段,保持pcdna3.1(+)-zeo载体的其他核苷酸序列不变,得到的表达多特异性抗体hiv-dns的轻链的重组表达载体。
27.所述重组载体pcdna3.1(+)-neo/hiv-dns hc是用核苷酸序列为seq id no.2的hiv-dns重链基因替换pcdna3.1(+)-neo载体的ecori识别位点和ecorv识别位点之间的片段,保持pcdna3.1(+)-neo载体的其他核苷酸序列不变,得到的表达多特异性抗体hiv-dns的重链的重组表达载体。
28.所述重组细胞具体可为将所述重组载体pcdna3.1(+)-zeo/hiv-dns lc和pcdna3.1(+)-neo/hiv-dns hc导入宿主细胞(如cho-dg44细胞)得到的表达多特异性抗体
hiv-dns的重组细胞。
29.进一步地,所述重组细胞含有seq id no.2所示的多特异性抗体hiv-dns的重链基因和seq id no.4所示的多特异性抗体hiv-dns的轻链基因。
30.本发明还提供了药物组合物,所述药物组合物包含所述多特异性抗体以及一种或多种药学上可接受的载体。
31.所述药学上可接受的载体可为稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑剂但不限于此。
32.其中,所述药物组合物具有抑制或中和hiv活性的中和抗病毒作用。所述药物组合物用于改善、预防或治疗hiv感染引起的疾病和/或用于抑制hiv感染。
33.进一步地,本发明的药物组合物可包含第一抗体和第二抗体或其抗原结合片段,其中第一抗体为本发明的多特异性抗体hiv-dns,而第二抗体可为抑制hiv病毒感染的其他任何抗体。
34.本发明还提供了缀合物(conjugate),所述缀合物包含本发明所述的多特异性抗体,以及与所述多特异性抗体连接的可检测的标记;具体地,所述可检测的标记可选自酶(例如辣根过氧化物酶或碱性磷酸酶)、化学发光试剂(例如吖啶酯类化合物、鲁米诺及其衍生物、或钌衍生物)、荧光染料(例如荧光素或荧光蛋白)、放射性核素或生物素。
35.本发明还提供了用于检测gp120和/或cd3的试剂或试剂盒,所述试剂或试剂盒包含所述多特异性抗体。
36.本发明还提供了所述多特异性抗体hiv-dns的制备方法,所述方法包括:分别构建含有所述多特异性抗体的重链和轻链基因的重组表达载体;将所述重组表达载体导入宿主细胞,获得稳定表达所述多特异性抗体的宿主细胞;培养所述宿主细胞,经分离纯化获得所述多特异性抗体。
37.本发明的多特异性抗体通过检测抗hiv疫苗的抗原是否含有具有正确构象的特异性表位来监测所述疫苗的质量的用途也属于本发明的保护范围。
38.本发明还提供了所述多特异性抗体hiv-dns,和/或,所述生物材料,和/或,所述药物组合物在制备用于治疗或预防hiv感染相关疾病的药物中的应用。
39.上述应用中,所述hiv感染相关疾病可为艾滋病。
40.本文所述多特异性抗体可为双特异性抗体。
41.本文中术语“单链抗体(scfv)”是指用适当的寡核苷酸接头连接轻链和重链可变区基因,使之表达单一的多肽链,称为单链抗体(scfv)。
42.本发明的抗体可以本领域已知的各种方法来制备,例如通过基因工程重组技术来获得。例如,通过化学合成或pcr扩增获得编码本发明抗体的重链和轻链基因的dna分子。将所得dna分子插入表达载体内,然后转染宿主细胞,在特定条件下培养转染后的宿主细胞,并表达本发明的抗体。本领域技术人员可根据需要选择本领域常规的宿主细胞、表达载体、将表达载体导入宿主细胞的方法以及抗体的分离纯化方法。
43.本发明的多特异性抗体hiv-dns同时靶向hiv病毒和靶向杀伤性t细胞的多特异性抗体。该多特异性抗体一头识别hiv病毒外膜蛋白gp120,一头识别t细胞受体分子cd3,通过抗体结合cd3的反应,可以激活t细胞受体,将活化信号传递到胞内,进一步激活杀伤性t细胞;同时将杀伤性t细胞引导到感染hiv病毒的细胞面前,从而定向杀伤感染病毒的细胞。更
具体地,在该多特异性抗体一头,将靶向病毒外膜蛋白gp120的改造的m36纳米抗体vh(简称m36,m36的氨基酸序列如seq id no.1的第1-136位所示)连接在多特异性抗体重链恒定区ch1的n端,将cd4受体胞外区d1(cd4-d1)连接在多特异性抗体轻链恒定区cl的n端,共同作为识别hiv的双靶点抗体。在多特异性抗体重链恒定区ch3的c末端,连接上靶向人t细胞上cd3受体亚基ε的单链抗体okt3 scfv,组成多特异性抗体hiv-dns。多特异性抗体hiv-dns的结构示意图见图1。该抗体hiv-dns不仅能够直接中和病毒,而且能够把感染病毒的细胞清除掉,最大限度降低病毒库的库容。本发明的多特异性抗体hiv-dns推荐的临床使用剂量每次应低于1 mg,治疗间隔时间不低于3天。推荐的本发明的多特异性抗体hiv-dns使用方法为静脉注射。推荐的本发明的多特异性抗体hiv-dns治疗hiv感染方式为联用,即与常规hiv治疗药物(如替拉依等)联用(鸡尾酒疗法),发挥协同抗病毒能力。本发明的多特异性抗体hiv-dns在与常规hiv治疗药物采用鸡尾酒疗法联用时,可以将低拷贝复制的感染细胞彻底清除,从而降低病毒库的容量,在最短时间内将血液中hiv病毒粒子数量控制在检测下限。
44.本发明多特异性抗体hiv-dns设计了靶向t细胞cd3受体的靶点,可以更好地调动t细胞的活化及对感染细胞的识别和清除;同时本发明多特异性抗体hiv-dns在靶向hiv gp120的方向是两个靶点的组合(即通过抗原结合域m36和cd4胞外结构域1靶向gp120蛋白的不同表位),由于hiv病毒株的变异频率高,特别是外膜蛋白,因此通过双靶点的方式,可以覆盖更多的hiv病毒变异株,发挥更有效的识别和杀灭作用。
45.因此,本发明的多特异性抗体hiv-dns是“2+1”的靶点设计,两个靶点同时靶向病毒,一个靶点靶向t细胞的cd3分子,通过这种设计方式,兼顾病毒变异的特点,又能引导t细胞的活化,对低拷贝的感染细胞进行彻底清除,更好地消灭血液中的病毒库(比如受感染的记忆性t细胞类群),在与常规hiv治疗药物鸡尾酒药物联用后,更快更有效地降低病毒和病毒库载量。
46.综上,本发明提供了一种同时抗gp120和抗cd3的多特异性抗体hiv-dns(dual and super antibody against hiv)及其应用,本发明所述抗体类分子为附加在igg(appended igg)形态上的对称结构的多特异性抗体分子,其作用机理是基于重定向t细胞特异性杀伤和清除表达hiv gp120蛋白的cd4
+ t细胞(即感染了hiv的cd4
+ t细胞)或艾滋病病毒。hiv-dns一方面通过cd4-domain 1(cd4-d1)和改造的纳米抗体m36结合hiv的gp120蛋白,另一方面通过抗人t细胞cd3抗原(cd3 antigen of human t cells)单克隆抗体muromonab-cd3(okt3)(www.drugs.com/pro/orthoclone-okt3.html)的单链可变区片段scfv(single-chain fragment variable)来结合cd3
+ t细胞并活化t细胞,通过hiv-dns的桥联作用,使活化的t细胞重新定向至hiv病毒或感染了hiv并表达hiv gp120的cd4
+ t细胞。所述抗体分子hiv-dns重链可变区(vh)的序列为改造的纳米抗体m36;抗体轻链可变区(vl)的序列为cd4受体胞外区d1。所述抗体分子hiv-dns的恒定区ch3的c末端,连接抗cd3抗体okt3的单链scfv(即单链抗体okt3 scfv)。本专利还提供了该多特异性抗体的制备方法及其临床用途。所述多特异性抗体靶向hiv gp120的不同表位,能够显著提高hiv病毒的中和效果,降低病毒逃逸突变产生的概率,同时靶向t细胞的cd3分子更好地消灭病毒,提高抗体治疗的临床疗效。本发明的hiv-dns用于hiv感染的抗病毒治疗,在提高抗病毒效果的同时,可极大地降低抗体药物的用量,可作为制备诊断、预防、治疗hiv感染引起疾病的潜在候选药物,可以丰富hiv感染相关疾病(如艾滋病)的治疗和预防手段。
附图说明
47.图1为hiv-dns的结构设计图。
48.图2为hiv-dns的重组真核表达载体的酶切鉴定。
49.图3为hiv-dns的亲和层析纯化。
50.图4为hiv-dns与重组的gp120糖蛋白的结合。
51.图5为hiv-dns与gp120的亲和力测定曲线。
52.图6为hiv-dns与gp120的亲和力常数。
53.图7为hiv-dns与人cd3ε&cd3δ蛋白亲和力测定曲线及拟合曲线。
54.图8为okt3与人cd3ε&cd3δ蛋白亲和力测定曲线及拟合曲线。
55.图9为抗体hiv-dns和okt3与人cd3ε&cd3δ蛋白的亲和力测试结果。
56.图10为hiv-dns与gp120和cd3分子能同时结合验证结果图。
57.图11为hiv-dns对hiv-1
iiib
在tzm-b1细胞中复制的抑制作用。
58.图12为hiv-dns对hiv-1
iiib
在h9细胞中复制的抑制作用。
59.图13为hiv-dns对hiv-1
km018
在pbmc细胞中复制的抑制作用。
具体实施方式
60.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
61.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
62.实施例1、多特异性抗体hiv-dns的重组载体的构建及表达1、多特异性抗体hiv-dns的结构(1)多特异性抗体hiv-dns结构示意图如图1所示hiv-dns多特异性抗体分子的轻链可变区采用hiv病毒受体——人t细胞表面糖蛋白cd4分子的结构域1(https://www.uniprot.org/uniprot/p01730,domain 1 of human t-cell surface glycoprotein cd4,cd4-d1),该结构域是hiv病毒结合人cd4+细胞的主要结构域(primary receptor for human immunodeficiency virus-1(hiv-1)),可与hiv的gp120蛋白结合。
63.hiv-dns的轻链恒定区采用人免疫球蛋白kappa轻链恒定区(human immunoglobulin kappa chain constant region,igkc,https://www.uniprot.org/uniprot/p01834)。
64.在抗gp120 hiv-dns多特异性抗体分子的重链中,靶向hiv gp120的重链的可变区采用改造的能与gp120蛋白结合的单域抗体m36(chen w,zhu z,feng y,dimitrov ds(2008)human domain antibodies to conservedsterically restricted regions on gp120 as exceptionally potent cross-reactive hiv-1 neutralizers. proc natl acad sci usa 105(44):17121
–
17126)。改造后的单域抗体m36(简称m36)的氨基酸序列如seq id no.1的第1-136位所示。
2133位。
72.多特异性抗体hiv-dns的轻链可变区(vl)的氨基酸序列为seq id no.3的第1-125位,其编码基因的核苷酸序列为seq id no.4的第1-375位;多特异性抗体hiv-dns的轻链恒定区(cl)的氨基酸序列为seq id no.3的第151-257位,其编码基因的核苷酸序列为seq id no.4的第451-774位;连接多特异性抗体hiv-dns轻链可变区(vl)和轻链恒定区(cl)的接头的氨基酸序列为seq id no.3的第126-150位,其编码基因的核苷酸序列为seq id no.4的第376-450位。
73.2、多特异性抗体的制备(1)多特异性抗体hiv-dns的重组真核表达载体的构建和cho细胞的转染可以采用商业化的真核表达载体如pcho1.0(invitrogen)、pcdna3.1(+)(invitrogen)或其他商业化真核表达载体来表达hiv-dns抗体,也可以采用自行研发的真核表达载体(如邵勇,胡显文,等.一种基于gs筛选系统的动物细胞高效表达载体及应用,专利号:zl201410037976.6)来表达hiv-dns抗体。
74.按hiv-dns抗体的轻链和重链蛋白和基因序列,委托相关生物技术公司北京擎科生物科技有限公司(tsingke biotechnology co.,ltd.)合成,优化偏好cho细胞表达的轻链和重链基因,在基因上游增加ecori酶识别位点和kozak序列,在基因下游增加ecorv酶识别位点,委托相关生物技术公司北京擎科生物科技有限公司(tsingke biotechnology co.,ltd.)合成优化后的hiv-dns抗体的轻链和重链基因。用ecori/ecorv分别双酶切轻链基因、重链基因、pcdna3.1(+)-neo载体(invitrogen)和pcdna3.1(+)-zeo载体(invitrogen),回收相关基因及载体,将轻链基因与pcdna3.1(+)-zeo载体用t4连接酶连接,将重链基因与pcdna3.1(+)-neo载体用t4连接酶连接,转化大肠杆菌trans10(北京全式金生物技术有限公司)。
75.挑取已连接了轻链基因的pcdna3.1(+)-zeo载体(invitrogen)的菌落做pcr模板,用cmv-f/bgh-r做上下游引物,进行菌落pcr鉴定,pcr反应条件为:预变性94 ℃ 2 min;变性98 ℃ 10 s;退火温度59 ℃ 30 s;链延伸温度72 ℃ 1 min,共30个循环;循环完毕进行一次72 ℃ 5 min的延伸。选取阳性克隆做基因测序,测序正确后的克隆提取质粒,获得表达hiv-dns轻链的真核表达载体pcdna3.1(+)-zeo/hiv-dns lc,该载体的ecori/ecorv双酶切鉴定如图2 lane 2(第2泳道)所示,图2中pcdna3.1/zeocin表示pcdna3.1(+)-zeo,hiv-dns lc表示hiv-dns的轻链基因。
76.cmv-f: 5
’‑
taatacgactcactataggg-3’(seq id no.5),bgh-r: 5
’‑
tagaaggcacagtcgagg-3’(seq id no.6)。
77.hiv-dns轻链表达载体pcdna3.1(+)-zeo/hiv-dns lc是用核苷酸序列为seq id no.4的hiv-dns轻链基因替换pcdna3.1(+)-zeo载体的ecori识别位点和ecorv识别位点之间的片段,保持pcdna3.1(+)-zeo载体的其他核苷酸序列不变,得到的表达多特异性抗体hiv-dns轻链的重组表达载体。
78.挑取已连接了重链基因的pcdna3.1(+)-neo载体的菌落做pcr模板,用hc-f/hc-r做上下游引物,做菌落pcr,pcr反应条件为:预变性94 ℃ 2 min;变性98 ℃ 10 s;退火温度59 ℃ 30 s;链延伸温度72 ℃ 1 min,共30个循环;循环完毕进行一次72 ℃ 5 min的延
伸。选取阳性克隆做基因测序,测序正确后的克隆提取质粒,获得表达hiv-dns重链的真核表达载体pcdna3.1(+)-neo/hiv-dns hc,该载体的ecori/ecorv双酶切鉴定如图2 lane 1(第1泳道)所示,图2中pcdna3.1/neomycin表示pcdna3.1(+)-neo,hiv-dns hc表示hiv-dns的重链基因。
79.hc-f:5
’‑
ctggcaccta gcagcaaatc-3’(seq id no.7),hc-r:5
’‑
gagagtgcag tgcctcatgc-3’(seq id no.8)。
80.hiv-dns重链表达载体pcdna3.1(+)-neo/hiv-dns hc是用核苷酸序列为seq id no.2的hiv-dns重链基因替换pcdna3.1(+)-neo载体的ecori识别位点和ecorv识别位点之间的片段,保持pcdna3.1(+)-neo载体的其他核苷酸序列不变,得到的表达多特异性抗体hiv-dns重链的重组表达载体。
81.采用电转染或脂质体转染方法,按照相关操作手册中所述的步骤,将pcdna3.1(+)-neo/hiv-dns hc和pcdna3.1(+)-zeo/hiv-dns lc载体共转染至cho-dg44细胞(赛默飞公司)中。该步骤采用电转染方式时,可采用lonza公司生产的细胞电转仪nucleofector及所述方法来进行;该步骤采用脂质体转染方法时,可采用invitrogen公司生产的转染试剂lipfectamine 2000或lipfectamine3000及所述方法来进行。
82.转染后的cho-dg44细胞,接种到t形方瓶(如corning 430639 组织培养表面处理t-25 flask)中培养,采用化学成分明确的无血清培养基培养,如gibco公司生产的cd fortichotm无血清培养基。培养24小时后,用含250 μg/ml-400 μg/ml博来霉素(zeocin
™
)和500 μg/ml
ꢀ‑
700 μg/ml的遗传霉素(g418硫酸盐)的无血清培养基加压筛选稳定转染细胞系。每3天换液一次,用含zeocin
™
和g418的无血清培养基连续培养2-3周,筛选得到稳转集落。之后,这些稳转集落用胰酶消化后,用有限稀释法在96孔培养板中做单克隆培养和筛选。elisa法挑选获得高表达单克隆细胞株,进行传代并扩增,用10%dmso细胞冻存液冻存稳定转染的高表达hiv-dns抗体的cho工程细胞株(重组细胞)。
83.该重组细胞为将重组载体pcdna3.1(+)-neo/hiv-dns hc和pcdna3.1(+)-zeo/hiv-dns lc导入cho-dg44细胞得到的表达多特异性抗体hiv-dns的细胞。该重组细胞含有seq id no.2所示的多特异性抗体hiv-dns的重链基因和seq id no.4所示的多特异性抗体hiv-dns的轻链基因。
84.(2)多特异性抗体hiv-dns的表达复苏稳定转染的高表达hiv-dns抗体的cho工程细胞株,采用无血清培养基在方瓶中传代培养和扩增。将扩增的cho工程细胞株接种至2升的摇瓶(康宁)中,细胞起始密度维持在0.2~0.6
×
106细胞/ml,细胞培养体积为摇瓶容积的15~35%,细胞培养瓶放在摇床(摇床转速:135rpm,温度:37 ℃,co2:5%)中培养。无血清培养基可采用gibco生产的cd forticho
tm
,也可以采用国产无血清培养基,如上海多宁生物科技有限公司生产的media c,上海奥浦迈生物科技股份有限公司生产的opm-cho cd08 medium等。培养3-4天后可按1传3或1传4的比例传代培养,在摇瓶中培养7天后收集培养上清液并纯化其中的hiv-dns多特异性抗体。
85.(3)多特异性抗体hiv-dns的纯化利用protein a亲和层析柱(ge公司的mabselect sure)从培养上清中纯化带有fc结构域的抗体蛋白。培养上清液首先经过0.45 um的滤膜进行过滤澄清,然后上样
mabselect sure填料的亲和层析柱。具体操作步骤参考ge公司亲和层析填料protein a的推荐操作步骤。纯化仪采用中科森辉protein purification system pps-hd-100。上样ph控制在中性(ph7.0),洗脱ph控制在ph3.0。通过nanodrop仪器对纯化的抗体蛋白进行定量。纯化的抗体在还原条件下利用聚丙烯酰胺凝胶电泳检测其分子量和纯度。结果显示,该抗体的重链分子量在80 kd左右,轻链大小约35 kd(图3),均与设计的目标分子量相符。
86.实施例2、elisa法检测hiv-dns与hiv gp120糖蛋白的结合力商业化购置的重组hiv gp120糖蛋白(购自abcam,货号174070)用包被液稀释至1.0 ug/ml,以100 ng/孔包被到酶标板上,4 ℃过夜。之后每孔加入含2% bsa的pbst溶液孵育封闭1.5-2小时。孵育期间,用pbst将封闭液稀释至bsa终浓度为0.5% bsa,作为抗体稀释液,对多特异性抗体hiv-dns进行倍比稀释,从10 ug/ml起始,至1.25 pg/ml。利用人igg(山西康宝生物制品股份有限公司)作为对照品1,利用同一靶点的hiv-ts作为对照品2。酶标板封闭完后,充分洗涤。加入倍比稀释的各抗体,100 ul/孔,37 ℃孵育1小时,充分洗涤后,再加入1:2500稀释的山羊抗人igg(hrp标记,中杉金桥zb-2304)100 ul,37 ℃孵育1小时。充分洗涤后,采用tmb溶液显色15 min,2m hcl终止,于450 nm处读取光吸收值。测定结果采用graphpad prism software 6.0软件分析,选择非线性回归分析来计算半最大结合效应浓度(ec
50
)。作图时将抗体质量浓度换算成摩尔浓度,单位皮摩尔/升(pm)。
87.数据分析结果显示,hiv-dns多特异性抗体与重组蛋白gp120的半最大结合浓度ec
50
=100.9 pm;人免疫球蛋白igg与重组蛋白gp120在测定范围内没有很强的特异性的结合。说明hiv-dns能够特异性地结合hiv病毒gp120(图4)。
88.实施例3、表面等离子共振(spr)法检测hiv-dns对重组gp120的亲和力测定仪器采用ge的biacore x100。胺基偶联试剂(amine coupling kit)、人抗体捕获试剂(human antibody capture kit)以及cm5芯片和ph7.4的10
×
hbs-ep等相关试剂和耗材均购自ge healthcare公司。
89.采用捕获法测定多特异性抗体hiv-dns的亲和力。在测定实施例1步骤(3)中纯化制备的hiv-dns多特异性抗体对gp120的亲和力时,将抗fc的抗体偶联至cm5芯片表面,稀释hiv-dns至合适浓度,分别捕获到cm5芯片表面作为固定相,采用单循环的方法将重组的gp120-his(购自abcam 货号ab174070)设置一系列的浓度梯度流经固定相表面,流速:30 ul/min,测定hiv-dns与gp120的亲和力(图5)。汇总实验结果见图6。从测定数据来看,hiv-dns与gp120的亲和力数值为9.11
×
10-9
。说明hiv-dns具有较高的亲和力,能有效结合gp120。
90.实施例4、hiv-dns与cd3分子的结合能力测定仪器采用cytiva公司 biacore t200,芯片series s sensor chip cm5购自cytiva公司;人igg(fc)抗体捕获试剂盒,鼠igg抗体捕获试剂盒,以及氨基偶联试剂盒也购自cytiva公司。鼠源okt3单抗,human cd3 epsilon & cd3 delta heterodimer protein购自百普赛斯公司(acrobiosystems)。
91.采用捕获法测定多特异性抗体hiv-dns的亲和力。在测定实施例1步骤(3)中纯化制备的hiv-dns多特异性抗体对gp120的亲和力时,将鼠抗人igg(fc)的抗体偶联至cm5芯片表面,稀释hiv-dns至合适浓度,分别捕获到cm5芯片表面作为固定相,采用单循环的方法将重组的human cd3 epsilon & cd3 delta 异源二聚体蛋白设置一系列的浓度梯度流经固
3酶标仪检测每孔的相对荧光单位(rlu),计算ec
50
(在体外中和测定中抗体可以抑制病毒感染50%的有效浓度)。
97.结果如图11所示,本发明的多特异性抗体hiv-dns能够显著抑制hiv病毒复制,具有较高的抗病毒活性。
98.实施例7、hiv-dns对hiv-1
iiib
致细胞病变(cpe)的抑制实验人t细胞白血病细胞c8166来源于美国国立卫生研究院。将8
×
105细胞/ml c8166细胞50 μl/孔接种到含有100 μl/孔梯度倍比稀释药物的96孔细胞培养板上,然后加入50 μl的hiv-1
iiib
稀释上清,1300 tcid
50
/孔。设3个重复孔。同时设置不含药物的正常细胞对照孔,azt(齐多夫定)为阳性药物对照。37 ℃,5% co2培养3天,在倒置显微镜下(100
×
)计数合胞体的形成。计算ec
50
(抑制合胞体形成50%时的药物浓度)。
99.结果如表1所示,本发明的多特异性抗体hiv-dns能够显著抑制hiv病毒增殖的活性:表1 样品对hiv-1
iiib
致细胞病变(cpe)的抑制实验样品名称ec
50
(nm)hiv-dns3.43
±
1.82实施例8、hiv-dns对hiv-1
iiib
在c8166细胞中复制的抑制作用(检测p24)将4
×
105个/ml的c8166细胞与hiv-1
iiib
(moi=0.04)在37 ℃下感染2小时,用pbs离心洗涤2次,去除游离的病毒离子,取100 μl细胞接种到含有100 μl不同稀释度待测药物的96孔板上,37 ℃,5% co2培养3天。培养上清离心后收集,用终浓度0.5%triton x-100裂解灭活。采用捕捉p24抗原elisa方法(操作方法按照商业化的hiv-1 p24 elisa kits(wantai biopharm, china)进行)检测药物对hiv-1复制的抑制作用,计算ec
50
(抗体可以抑制病毒感染50%的有效浓度)。
100.结果如表2所示:表2 样品对hiv-1
iiib
在c8166细胞中复制的抑制作用(检测p24)样品名称ec50(nm)hiv-dns1.63
±
0.71实施例9、hiv-dns对hiv-1
iiib
在h9细胞中复制的抑制作用(检测p24)人t淋巴细胞h9来源于美国国立卫生研究院。96孔细胞培养板内,4
×
104个h9细胞与不同浓度梯度的样品孵育过夜。加入hiv-1
iiib
进行感染细胞,感染4 h后用pbs洗2次,洗去游离病毒,再加入新鲜的含有样品的培养基,200 μl/孔,37 ℃,5%co2培养箱中培养。第4天补加新鲜的含有样品的培养基,100 μl/孔,第7天收集上清,并再次加入含有样品的新鲜培养基100 μl/孔;第10天收集上清,加入含有样品的新鲜培养基100 μl/孔;第14天收集上清,按照实施例8中的方法elisa检测第7、10、14天的培养上清中p24含量,计算ec
50
。结果如图12所示。
101.实施例10、样品对hiv-1
km018
在pbmc中复制的抑制作用(检测p24)hiv-1临床分离株hiv-1
km018
由hiv/aids患者体内分离培养。人外周血单个核细胞(peripheral blood mononuclear cells,pbmc)采自健康献血员浓缩白细胞中分离。
102.96孔细胞培养板内,5
×
105个pha已刺激培养3天的pbmc细胞与不同浓度梯度的样品孵育过夜。加入hiv-1
km018
进行感染细胞,感染4 h后用pbs洗2次,洗去游离病毒,再加入新
鲜的含有样品的培养基,200 μl/孔,37 ℃,5% co2培养箱中培养。第4天补加新鲜的含有样品的培养基,100 μl/孔,第7天收集上清,并再次加入含有样品的新鲜培养基100 μl/孔;第10天收集上清,加入含有样品的新鲜培养基100 μl/孔;第14天收集上清,elisa检测第7、10、14天的培养上清中p24含量,计算ec
50
。结果如图13所示。
103.从抑制细胞病变、抑制hiv病毒复制的试验结果可知,本发明的多特异性抗体hiv-dns可以抑制hiv不同病毒株,其作用机制是多靶点的,并且本发明的多特异性抗体hiv-dns能够显著抑制hiv病毒增殖的活性、显著抑制hiv病毒复制,具有较高的抗病毒活性。
104.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1