一种高尔基体靶向超氧阴离子荧光探针及其制备方法和应用
1.本发明属于超氧阴离子探针制备技术领域,具体涉及一种高尔基体靶向超氧阴离子荧光探针及其制备方法和应用。
背景技术:
2.超氧阴离子属于机体结构最简单的活性氧,是第一个产生的活性氧。它是过氧化氢、过氧化亚硝基等的前体,所以,超氧阴离子浓度的变化在一定程度上可以决定其他ros水平的变化。超氧阴离子在调控高血压,动脉粥样硬化的发病机制中起重要作用。此外,超氧阴离子在心肌肥厚的发生发展中扮演重要角色。高尔基体,是细胞内膜结合的中央细胞器,在新合成的膜,分泌蛋白和脂类的运输、加工和分选中起关键作用,高尔基体形态结构的改变被认为是导致心肌肥厚的重要原因。因此,发明一种能准确靶向高尔基体并检测超氧阴离子探针对于心肌肥厚机理的研究有重要意义。
3.目前,检测超氧阴离子的方法包括:高效液相色谱法hplc、电化学法、sod酶活性测定法、化学发光法以及荧光分析法等。但这些方法样品需求量大、检测时间长,毒性强,因此并不适于生物环境的超氧阴离子的检测。因此,探索方便廉价、能够定性定量检测超氧阴离子,并且可以对生物样品进行原位可视化监测的方法非常重要。当有机荧光探针与特定目标物发生变化后,其荧光信号会发生变化,以达到检测的目的。荧光分析法具有出限低、灵敏度高、选择性好、取样量少、方法简洁快速等特征,并且可以对细胞内目标分子进行非侵入性成像检测可以实时在线,形象具体地观察到信号变化。所以,发明能快速检测、易观察信号的超氧阴离子荧光探针是非常有必要的。此外,鉴于高尔基体独特的生物功能,合成高尔基体靶向超氧阴离子探针有广阔的前景。
技术实现要素:
4.本发明的目的在于提供一种能快速检测超氧阴离子的发光型荧光探针,简称探针3,并进一步提供了探针3的制备方法和应用。
5.为实现上述技术目的,本发明所采用的技术方案为:
6.一种高尔基体靶向超氧阴离子荧光探针,探针分子式如下:c
26h36
f3no6s,具有如下结构式:
[0007][0008]
进一步的,本发明高尔基体靶向超氧阴离子探针能抗过氧化氢、次氯酸、硫化氢、半胱氨酸、谷胱甘肽、二硫化氢、过氧亚硝基阴离子、亚硫酸氢离子、亚硝酸根、次硝酸、一氧化氮、醋酸根、羟基自由基、钠离子、钾离子、镁离子、亚铁离子、铜离子、硫酸根离子、亚硫酸根离子、过氧化叔丁醇、过氧化叔丁基的干扰。
[0009]
一种高尔基体靶向超氧阴离子荧光探针的制备方法,包括以下步骤:
[0010]
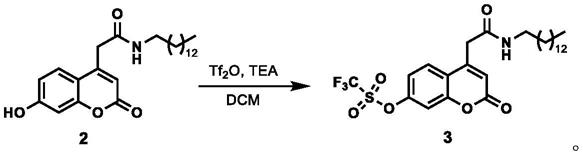
(1)将220mg 7-羟基香豆素-4-乙酸(化合物1)置于圆底烧瓶中,随后加入213mg十四胺,780mg六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷pybop,用二氯甲烷溶解,并加入8滴三乙胺,在常温下搅拌6小时,然后除去反应液中的二氯甲烷得到化合物2;化合物2结构式为:
[0011]
该步化学反应方程式为:
[0012][0013]
(2)将70mg化合物2置于圆底烧瓶,随后加入0.5ml三氟甲基磺酸酐,用二氯甲烷和乙醇混合溶液溶解,滴入8滴三乙胺,常温下搅拌30分钟,去除二氯甲烷和乙醇,得探针3,即本发明探针,该步化学反应方程式为:
[0014][0015]
本发明探针的整体合成路线为:
[0016][0017]
进一步的,整个反应过程,采用旋转蒸发仪减压蒸馏除去反应液中的二氯甲烷和/或乙醇。步骤(2)在使用化合物2之前,可以用硅胶层析柱进一步纯化;所得探针3,可以用硅胶层析柱进一步纯化;三乙胺和乙醇的加入方式为滴加。
[0018]
一种高尔基体靶向超氧阴离子荧光探针的应用,该荧光探针用于检测水环境中的超氧阴离子,还可以用于检测离体活细胞环境中的高尔基体内的超氧阴离子,并进行荧光成像,以获取中间信息。
[0019]
进一步的,用于检测水环境中的超氧阴离子时,观察加入高尔基体超氧阴离子荧光探针前后待测水环境的荧光光谱的变化;荧光激发波长为405nm;或者,在365nm光源照射下,用肉眼观察加入超氧阴离子荧光探针前后待测水环境的荧光变化。
[0020]
进一步的,用于检测离体活细胞环境中的高尔基体内的超氧阴离子时,观察加入超氧阴离子荧光探针前后待测生物环境的荧光成像图的变化。
[0021]
更进一步的,所述荧光光谱的变化是指:荧光光谱中,460nm处的荧光峰值的变化;如果460nm处峰值升高,则说明含有超氧阴离子。采用荧光光谱仪观察荧光光谱。
[0022]
更进一步的,所述荧光变化是指:在405nm光源照射下,荧光明显增强。
[0023]
更进一步的,所述荧光成像图的变化是指:将探针母液加入到生物样品中,用共聚焦显微镜,使用激发波长为405nm的光源激发,收集蓝色通道的荧光;观察到蓝色通道荧光增强,则说明含有超氧阴离子。采用共聚焦激光扫描显微镜。
[0024]
进一步的,具体检测方法为:
[0025]
(1)将本发明探针溶于dmso,制成探针母液;
[0026]
(2)将探针母液加入到待测液中。
[0027]
用荧光光谱仪测试待测液的荧光光谱,在460nm处的荧光峰值的变化,如果460nm处峰值变大,则说明含有超氧阴离子;其中,荧光光谱仪激发波长为405nm;或者,在365nm光源照射下,待测液的荧光由无色变为蓝色,则说明含有超氧阴离子;
[0028]
(3)将探针母液加入到待测离体生物样品中,用共聚焦显微镜,使用激发波长为405nm的光源激发,收集蓝色通道的荧光;观察到蓝色通道荧光增强,则说明含有超氧阴离子。
[0029]
水溶液中的超氧阴离子可以引起荧光探针的荧光光谱变化,因此,可以通过观察荧光光谱仪中光谱的变化程度判断溶液中的超氧阴离子含量,从而实现定量检测;其次,通过共聚焦显微镜对孵育了荧光探针3和超氧阴离子的活细胞进行荧光成像,观察蓝色通道荧光信号的变化以达到比值检测生物环境中的超氧阴离子的目的。
[0030]
有益效果
[0031]
(1)探针合成简单,并且产率较高;(2)本发明实现了水溶液中超氧阴离子的特异性和快速检测;(3)本发明实现了水环境和离体活细胞高尔基体中超氧阴离子的检测。
附图说明
[0032]
图1为本发明实施例1中化合物2的1h nmr图谱;
[0033]
图2为本发明实施例1中化合物2的
13
c nmr图谱;
[0034]
图3为本发明实施例2中探针3的1h nmr图谱;
[0035]
图4为本发明实施例2中探针3的
13
c nmr图谱;
[0036]
图5为本发明实施例2中探针3的质谱图谱;
[0037]
图6为本发明实施例2中探针3随不同量超氧阴离子的加入荧光谱图的变化情况图;图中,从下至上,超氧阴离子浓度依次为0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、和100μmol/l的荧光光谱;
[0038]
图7为本发明实施例2探针3在pbs缓冲溶液与10当量超氧阴离子在便携式紫外灯365nm光源照射条件下的变化图;
[0039]
图8为本发明实施例3中探针3在pbs缓冲溶液与10当量超氧阴离子随时间变化的460nm处荧光强度值变化图;
[0040]
图9为本发明实施例4中探针3在pbs缓冲溶液对不同干扰分析物的选择性柱状荧光数据图;图中1、空白;2、过氧化氢;3、次氯酸;4、硫化氢;5、半胱氨酸;6、谷胱甘肽;7、二硫化氢;8、过氧亚硝基阴离子;9、亚硫酸氢离子;10、亚硝酸根;11、次硝酸;12、一氧化氮;13、
醋酸根;14、羟基自由基;15、钠离子;16、钾离子;17、镁离子;18、亚铁离子;19、铜离子;20、硫酸根离子;21、亚硫酸根离子;22、过氧化叔丁醇;23、过氧化叔丁基;24、超氧阴离子;
[0041]
图10为本发明探针3在pbs缓冲溶液与10当量超氧阴离子在不同ph下荧光数据图;
[0042]
图11为本发明实施例5中探针3与hela细胞中超氧阴离子响应的荧光成像图;图中,(a)是加入探针2孵育30min后的成像,(b)是加入内毒素和干扰素-γ(ifn-γ)预先孵育12h后与探针2孵育30min的成像,(c)是加入内毒素和干扰素-γ(ifn-γ)以及超氧阴离子清除剂tiron孵育12h后与探针2孵育30min的成像,(d)是加入trion处理12h后与探针2孵育30min的成像;激发波长为405nm;
[0043]
图12为本发明实施例5中探针3与hela细胞中超氧阴离子离子响应后的商业高尔基体探针共定位荧光成像图。第一列为蓝色通道成像;第二列为商业化高尔基体靶向探针绿色通道成像,第三列绿色通道成像与蓝色通道成像的比率图;激发波长为405nm。
具体实施方式
[0044]
下面结合具体实施例对本发明的技术方案做进一步说明,但不限于此。
[0045]
实施例1
[0046]
化合物2的合成:
[0047][0048]
取7-羟基香豆素-4乙酸220mg(1.0mmol)置于圆底烧瓶,加入213mg(1.0mmol)十四胺,780mg六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(pybop)(1.5mmol),用二氯甲烷溶解,滴入8滴三乙胺,在常温下搅拌6小时,反应完毕。反应完毕后,通过旋转蒸发仪减压蒸馏将溶剂(二氯甲烷)除去得到粗产品。以体积比为50:1的二氯甲烷与乙醇为洗脱剂,用硅胶(200-300目)层析柱进行纯化,得到白色固体370mg(产率为85%)。1h nmr(500mhz,dmso)δ8.23(t,j=5.4hz,1h),8.00(d,j=8.9hz,1h),7.83(d,j=2.4hz,1h),7.59(dd,j=8.9,2.4hz,1h),6.61(s,1h),3.81(s,2h),1.25(d,j=11.7hz,26h),0.92(d,j=6.6hz,3h).
13
c nmr(126mhz,dmso)δ167.82,161.64,160.62,155.43,151.84,127.14,113.26,112.16,111.90,102.74,31.78,29.55,29.32,29.18,26.80,26.36,22.58,14.45,9.11.m/z[m-h]
+
found 414.4.。
[0049]
探针3的合成
[0050][0051]
称取70mg(0.16mmol)化合物2,用二氯甲烷溶解,加入几滴乙醇促溶,加入0.5ml三氟甲基磺酸酐,滴入8滴三乙胺,在常温下搅拌0.5小时,反应完毕。反应完毕后,通过旋转蒸发仪减压蒸馏将溶剂(二氯甲烷与乙醇)除去得到化合物2,用二氯甲烷:石油醚=50:1为洗脱剂,硅胶(200-300目)层析柱进行纯化,得到16mg白色固体(产率为22%)。1hnmr(500mhz,
dmso)δ8.25(t,j=5.2hz,1h),8.00(d,j=8.9hz,1h),7.85(d,j=2.2hz,1h),7.60(dd,j=8.8,2.1hz,1h),6.61(s,1h),3.81(s,2h),3.11(dd,j=12.7,6.6hz,2h),1.29(t,j=17.6hz,24h),0.91(t,j=6.7hz,3h).13c nmr(126mhz,dmso)δ167.52(s),159.46(s),154.15(s),150.50(s),128.20(s),120.11(s),117.64(s),111.04(s),46.38(s),39.43(s),29.47(s),14.41(s).m/z[m+na]
+
found 570.2.
[0052]
实施例2
[0053]
探针3与不同当量超氧化钾反应的荧光光谱变化
[0054]
取实施例1制备的探针3溶于dmso中,制成浓度为1mmol/l探针母液(探针3的浓度为1mmol/l);将超氧化钾用dmso配制成0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、和100μmol/l的溶液。从探针母液中取出30μl加入到5ml的离心管当中,加入不同当量(0-10eq)的超氧化钾母液(所述当量是指超氧化钾母液中超氧化钾的摩尔数相对于探针母液中探针的摩尔数的倍数),用0.570ml dmso和不同体积的pbs水溶液(浓度25mmol/l,ph 7.4)稀释至3ml,配置成探针浓度为10μmol/l,含20%dmso的测试溶液。用荧光光谱仪测试探针与不同当量超氧阴离子反应液的荧光光谱变化(激发波长为370nm),荧光光谱变化情况如图6所示。由图6可见,随着加入当量的超氧化钾逐渐增加,探针3溶液在460nm处的荧光峰值逐渐增强。如图7所示,探针(10μm)在pbs缓冲溶液(浓度25mmol/l,ph 7.4,含20%dmso)与10当量超氧阴离子反应。肉眼观察到探针在便携式紫外灯365nm光源照射条件下的变化。在便携式紫外灯照射下(365nm光源)荧光由无色变为蓝色。
[0055]
实施例3
[0056]
探针3与超氧阴离子随时间变化的荧光变化
[0057]
从实施例2中荧光探针母液中取出30μl加入到5ml的离心管当中,加入30μl浓度为10mmol/l超氧化钾母液,再0.570ml dmso和2.400ml的pbs水溶液(浓度25mmol/l,ph 7.4)稀释至3ml,配制成探针浓度为10μmol/l,超氧化钾浓度为10mmol/l,含20%dmso的测试溶液。用370nm的激发波长,测试其随时间变化的荧光光谱。图8是实施例3中探针3(10μmol/l)在pbs缓冲溶液(浓度25mmol/l,ph 7.4,含20%dmso)与10当量超氧阴离子随时间变化的460nm处荧光强度值变化图,由图8可见,460nm处荧光在2min达到响应值,随着时间增加,460nm处荧光强度基本不变。
[0058]
实施例4
[0059]
探针3对不同干扰分析物的选择性研究
[0060]
从实施例2中荧光探针母液中取出30μl加入到5ml的离心管当中,分别加入浓度为1.00mm的分析物:过氧化氢;次氯酸;硫化氢;半胱氨酸;谷胱甘肽;二硫化氢;过氧亚硝基阴离子;亚硫酸氢离子;亚硝酸根;次硝酸;一氧化氮;醋酸根;羟基自由基;钠离子;钾离子;镁离子;亚铁离子;铜离子;硫酸根离子;亚硫酸根离子;过氧化叔丁醇;过氧化叔丁基。用0.970ml dmso和2.000ml的pbs水溶液(浓度25mmol/l,ph 7.4)稀释至3ml,配置成探针浓度为10μmol/l,含33%dmso的测试溶液。反应5分钟后检测测试液的荧光光谱变化。由图9可以发现,相对于空白测试液,各种分析物的测试液荧光强度均没有明显变化。然而,加入超氧化钾的测试液的荧光强度发生了显著增强。实验结果说明探针3对超氧化钾具有良好的选择性。图10为探针3在不同ph下荧光数据图;探针(10μm)在pbs缓冲溶液(浓度25mmol/l,ph 7.4,含20%dmso)与10当量超氧化钾反应。
[0061]
实施例5
[0062]
探针3与细胞中超氧阴离子的荧光成像研究
[0063]
从实施例2中荧光探针母液中取出10μl加入到育有hela细胞的培养皿(含1mldmem培养基)中,探针浓度为10μmol/l,孵育30分钟,作为控制组;实验组1样品提前用内毒素和ifn-γ孵育12h用以激发胞内超氧阴离子,实验组2提前用内毒素,ifn-γ和tiron提前共孵育12h,实验组3用tiron提前孵育12h。随后分别用共聚焦显微镜对控制组和实验组进行荧光成像,使用激发波长为405nm的光源激发,收集蓝色通道的荧光,结果如图11所示。在控制组的荧光成像中,能观察到蓝色荧光;然而,在实验组1中,可以观察到明显的蓝色通道荧光,实验组2中能观察到较为微弱的蓝色荧光,实验组3能观察到极为微弱的蓝色荧光。实验结果说明探针3可以通过共聚焦显微镜检测细胞环境中的超氧阴离子,具有潜在的实际应用价值。
[0064]
从实施例2中荧光探针母液中取出10μl加入到育有hela细胞的培养皿(含1ml pbs培养基)中,探针浓度为10μmol/l,孵育30分钟,作为控制组;实验组1样品提前用内毒素和ifn-γ孵育12h用以激发胞内超氧阴离子,并使用碧云天商用高尔基体靶向荧光探针(绿色)染色细胞高尔基体,染色完成用探针3工作液孵育细胞30min。随后分别用共聚焦显微镜对控制组和实验组进行荧光成像,使用激发波长为405nm的光源激发,收集绿色和蓝色通道的荧光,结果如图12所示。可以看到实验组高尔基体绿色和蓝色共定位情况良好。实验结果说明探针3可以很好地靶向到高尔基体上,具有潜在的实际应用价值。
[0065]
需要说明的是,上述实施例仅仅是实现本发明的优选方式的部分实施例,而非全部实施例。显然,基于本发明的上述实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的其他所有实施例,都应当属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1