针对T细胞免疫球蛋白和粘蛋白蛋白3(TIM-3)的抗体的制作方法
针对t细胞免疫球蛋白和粘蛋白蛋白3(tim-3)的抗体
1.相关申请
2.本技术是申请日为2016年4月1日、申请号为201680031744.7、发明名称为“针对t细胞免疫球蛋白和粘蛋白蛋白3(tim-3)的抗体”的专利申请的分案申请,原申请为国际申请号为pct/us2016/025532的国家阶段申请,该国际申请要求要求于2015年4月1日提交的美国临时申请号62/141,353的优先权,其全部内容在此通过引用并入。
3.通过电子形式提交的材料的引用并入
4.与本文同时提交的计算机可读的核苷酸/氨基酸序列表通过引用整体并入本文,并被确认如下:在2016年3月31日创建的命名为“723697_st25.txt”的369,646字节的一个ascii(文本)文件。
5.发明背景
6.t细胞免疫球蛋白和粘蛋白结构域-3(tim-3)蛋白,也称为甲型肝炎病毒细胞受体2(havcr2),是一种th1特异性细胞表面蛋白,其调节巨噬细胞活化并增加小鼠中实验性自身免疫性脑脊髓炎的严重程度。tim-3在多种类型免疫细胞的表面上高表达,包括例如th1 ifn-γ+细胞、th17细胞、自然杀伤(nk)细胞、单核细胞和肿瘤相关的树突状细胞(dc)(参见例如clayton等,j.immunol.,192(2):782-791(2014);jones等,j.exp.med.,205:2763-2779(2008);monney等,nature,415:536-541(2002);hastings等,eur.j.immunol.,39:2492-2501(2009);seki等,clin.immunol.,127:78-88(2008);ju等,b.j.hepatol.,52:322-329(2010);anderson等,science,318:1141-1143(2007);baitsch等,plos one,7:e30852(2012);ndhlovu等,blood,119:3734-3743(2012))。tim-3在多种慢性病毒感染(例如,hiv、hcv和hbv)和某些癌症中“耗尽”或受损的cd8+t-细胞上也高表达(参见例如mcmahan等,j.clin.invest.,120(12):4546-4557(2010);jin等,proc natl acad sci usa,107(33):14733-14738(2010);golden-mason等,j.virol.,83(18):9122-9130(2009);jones等,出处同上;fourcade等,j.exp.med.,207(10):2175-2186(2010);sakuishi等,j.exp.med.,207(10):2187-2194(2010);zhou等,blood,117(17):4501-4510(2011);ngiow等,cancer res.,71(10):3540-3551(2011))。
7.tim-3的推定配体包括磷脂酰丝氨酸(nakayama等,blood,113:3821-3830(2009))、半乳凝素-9(zhu等,nat.immunol.,6:1245-1252(2005))、高迁移率族蛋白1(hmgb1)(chiba等,nature immunology,13:832-842(2012))和癌胚抗原细胞粘附分子1(ceacam1)(huang等,nature,517(7534):386-90(2015))。
8.tim-3起到调节免疫应答的各个方面的作用。tim-3与半乳凝素-9(gal-9)的相互作用诱导细胞死亡并且在实验模型中体内阻断这种相互作用加剧自身免疫并消除耐受,这强烈表明tim-3是负性调节分子。与其对t-细胞的作用不同的是,tim-3-gal-9的相互作用通过促进巨噬细胞对细胞内病原体的清除显示出抗微生物作用(参见例如sakuishi等,trends in immunology,32(8):345-349(2011))。在体内,已证实抑制tim-3增加实验性自身免疫性脑脊髓炎的病理严重性(monney等,出处同上;以及anderson,a.c.和anderson,d.e.,curr.opin.immunol.,18:665-669(2006))。研究还表明tim-3-半乳凝素-9通路调节
异常可能在慢性自身免疫性疾病(如,多发性硬化症)中具有作用(anderson和anderson,出处同上)。tim-3通过其独特的结合裂缝结合磷脂酰丝氨酸促进凋亡细胞的清除(参见例如dekruyff等,j.immunol.,184(4):1918-1930(2010))。
9.目前正在研究诸如通过使用单克隆抗体对tim-3活性的抑制作为基于临床前研究的肿瘤的免疫疗法(参见例如,ngiow等,cancer res.,71(21):1-5(2011);guo等,journal of translational medicine,11:215(2013);以及ngiow等,cancer res.,71(21):6567-6571(2011))。
10.需要以高亲和性结合tim-3并有效地中和tim-3活性的其他tim-3拮抗剂(例如,抗体)。本发明提供了这样的tim-3结合剂。
11.发明概述
12.本发明提供了一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含氨基酸序列glu val gln leu leu glu ser gly gly gly leu val gln pro gly gly ser leu arg leu ser cys xaa1 ala xaa2 ser gly phe xaa3 xaa4 xaa5 thr phe ser xaa6 tyr xaa7 met xaa8 trp val arg gln ala xaa9 gly lys gly leu xaa10 trp val ser xaa11 ile ser xaa12 gly gly xaa13 tyr thr tyr tyr gln asp ser val lys gly arg phe thr ile ser arg asp asn ser lys asn thr leu tyr leu gln met asn ser leu arg xaa14 glu asp thr ala val tyr tyr cys xaa15 ser xaa16 xaa17 xaa18 xaa19 met asp tyr trp gly gln gly thr thr val thr val ser ser ala(seq id no:1),其中(a)xaa1缺失(即不存在)或者是丙氨酸(ala),(b)xaa2是丙氨酸(ala)、脯氨酸(pro)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)或缬氨酸(val),(c)子序列xaa3 xaa4 xaa5缺失或者是thr-phe-ile,(d)xaa6是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)或苏氨酸(thr),(e)xaa7是天冬氨酸(asp)或丙氨酸(ala),(f)xaa8是丝氨酸(ser)或苏氨酸(thr),(g)xaa9是脯氨酸(pro)或亮氨酸(leu),(h)xaa10是天冬氨酸(asp)或谷氨酸(glu),(i)xaa11是苏氨酸(thr)或丙氨酸(ala),(j)xaa12是甘氨酸(gly)或丝氨酸(ser),(k)xaa13是丝氨酸(ser)、苏氨酸(thr)、天冬氨酸(asp)、甘氨酸(gly)、天冬酰胺(asn)或赖氨酸(lys),(l)xaa14是丙氨酸(ala)或缬氨酸(val),(m)xaa15丙氨酸(ala)或苏氨酸(thr),以及(n)子序列xaa16 xaa17 xaa18 xaa19缺失或者是pro-tyr-tyr-ala。
13.本发明提供了一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含氨基酸序列asp ile gln met thr xaa1 ser pro ser ser leu ser ala ser val gly asp arg val thr ile thr cys arg xaa2 ser gln ser ile xaa3 xaa4 tyr leu asn trp tyr xaa5 gln lys xaa6 xaa7 lys ala pro lys leu leu xaa8 tyr xaa9 ala ser xaa10 leu gln ser gly val pro ser arg phe ser gly ser gly ser gly thr asp phe thr leu thr ile ser ser leu gln pro glu asp phe ala xaa11 tyr tyr cys gln gln xaa12 xaa13 xaa14 xaa15 pro xaa16 thr phe gly xaa17 gly thr lys xaa18 glu ile lys arg(seq id no:45),其中(a)xaa1是谷氨酰胺(gln)或组氨酸(his),(b)xaa2是丙氨酸(ala)或苏氨酸(thr),(c)xaa3是丝氨酸(ser)、精氨酸(arg)、天冬酰胺(asn)或苏氨酸(thr),(d)xaa4是丝氨酸(ser)、精氨酸(arg)、天冬氨酸(asp)、苏氨酸(thr)或甘氨酸(gly),(e)xaa5是谷氨酰胺(gln)或组氨酸(his),(f)xaa6是脯氨酸(pro)或丙氨酸(ala),(g)xaa7是甘氨酸(gly)、赖氨酸(lys)或精氨酸(arg),(h)xaa8是异亮氨酸(ile)或甲硫氨
酸(met),(i)xaa9是丙氨酸(ala)、甘氨酸(gly)、天冬氨酸(asp)、苏氨酸(thr)、丝氨酸(ser)、缬氨酸(val)或异亮氨酸(ile),(j)xaa10是丝氨酸(ser)或苏氨酸(thr),(k)xaa11是缬氨酸(val)、甲硫氨酸(met)或丙氨酸(ala),(l)xaa12是丝氨酸(ser)或精氨酸(arg),(m)xaa13是酪氨酸(tyr)、组氨酸(his)、苯丙氨酸(phe)、天冬氨酸(asp)、丝氨酸(ser)或天冬酰胺(asn),(n)xaa14是丝氨酸(ser)或天冬酰胺(asn),(o)xaa15是苏氨酸(thr)、丝氨酸(ser)、丙氨酸(ala)或脯氨酸(pro),(p)xaa16是亮氨酸(leu)或组氨酸(his),(q)xaa17是甘氨酸(gly)、精氨酸(arg)或谷氨酸(glu),以及(r)xaa18是缬氨酸(val)或亮氨酸(leu)。
14.本发明还提供了一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含氨基酸序列glu val gln xaa1 leu xaa2 xaa3 xaa4 xaa5 ser gly gly xaa6 leu xaa7 gln pro gly gly ser leu arg leu xaa8 cys xaa9 ala ser gly phe thr phe xaa10 xaa11 ser tyr xaa12 met xa13 trp val arg gln ala pro gly lys gly leu glu trp val ser xaa14 ile ser gly ser gly gly xaa15 thr tyr tyr xaa16 asp ser val lys gly xaa17 phe thr ile ser xaa18 asp asn ser xaa19 asn thr xaa20 tyr leu gln met asn xaa21 leu arg ala glu asp thr ala val tyr tyr cys xaa22 lys lys tyr tyr xaa23 xaa24 pro ala asp tyr trp xaa25 gln gly thr leu val thr val ser ser gly(seq id no:126),其中(a)xaa1是亮氨酸(leu)、缬氨酸(val)或甲硫氨酸(met),(b)子序列xaa2 xaa3 xaa4缺失或者是glu-ser-leu,(c)xaa5缺失或者是谷氨酸(glu),(d)xaa6是甘氨酸(gly)或天冬氨酸(asp),(d)xaa7是缬氨酸(val)或异亮氨酸(ile),(e)xaa8是丝氨酸(ser)或酪氨酸(tyr),(f)xaa9是丙氨酸(ala)或缬氨酸(val),(g)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、苏氨酸(thr)、天冬氨酸(asp)或甘氨酸(gly),(h)xaa11缺失或者是甘氨酸(gly),(i)xaa12是丙氨酸(ala)或苏氨酸(thr),(j)xaa13是丝氨酸(ser)或天冬酰胺(asn),(k)xaa14是丙氨酸(ala)、甘氨酸(gly)、缬氨酸(val)、丝氨酸(ser)、苯丙氨酸(phe)、异亮氨酸(ile)、苏氨酸(thr)或天冬氨酸(asp),(l)xaa15是丝氨酸(ser)或天冬酰胺(asn),(m)xaa16是丙氨酸(ala)、缬氨酸(val)或天冬酰胺(asn),(n)xaa17是精氨酸(arg)或谷胺酰胺(gln),(o)xaa18是精氨酸(arg)或赖氨酸(lys),(p)xaa19是赖氨酸(lys)或天冬酰胺(asn),(q)xaa20是亮氨酸(leu)、缬氨酸(val)、苏氨酸(thr)、甲硫氨酸(met)或脯氨酸(pro),(r)xaa21是丝氨酸(ser)或天冬酰胺(asn),(s)xaa22是丙氨酸(ala)或甘氨酸(gly),(t)xaa23是甘氨酸(gly)、缬氨酸(val)、天冬氨酸(asp)、丙氨酸(ala)、苏氨酸(thr)或天冬酰胺(asn),(u)xaa24是甘氨酸(gly)、丝氨酸(ser)、缬氨酸(val)、天冬氨酸(asp)、天冬酰胺(asn)或苏氨酸(thr),以及(v)xaa25是甘氨酸(gly)或天冬氨酸(asp)。
15.本发明还提供了一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含氨基酸序列asp ile val met thr gln ser pro asp ser leu ala val ser leu gly glu arg ala thr ile asn cys lys ser ser gln ser val leu tyr ser ser asn asn lys asn tyr leu xaa1 trp tyr xaa2 xaa3 lys pro gly gln pro pro lys leu leu ile tyr trp ala ser thr arg glu xaa4 gly val pro asp arg phe xaa5 gly ser xaa6 ser gly thr asp phe thr leu xaa7 ile xaa8 ser leu gln ala glu asp val ala val tyr tyr cys xaa9 gln tyr tyr xaa10 ser pro xaa11 thr phe gly gly gly thr lys ile glu xaa12 lys(seq id no:260),其中(a)xaa1是丙氨酸(ala)或苏氨酸
(thr),(b)xaa2是谷氨酰胺(gln)或组氨酸(his),(c)xaa3是谷氨酰胺(gln)或组氨酸(his),(d)xaa4是丝氨酸(ser)、酪氨酸(tyr)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)、天冬酰胺(asn)、赖氨酸(lys)、谷氨酸(glu)、亮氨酸(leu)、脯氨酸(pro)或缬氨酸(val),(e)xaa5是丝氨酸(ser)或天冬酰胺(asn),(f)xaa6是甘氨酸(gly)、谷氨酸(glu)、丙氨酸(ala)、天冬氨酸(asp)、天冬酰胺(asn)、丝氨酸(ser)、苏氨酸(thr)或缬氨酸(val),(g)xaa7是苏氨酸(thr)或异亮氨酸(ile),(h)xaa8是丝氨酸(ser)或异亮氨酸(ile),(i)xaa9是谷氨酰胺(gln)或组氨酸(his),(j)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、甘氨酸(gly)或苏氨酸(thr),(k)xaa11是亮氨酸(leu)或异亮氨酸(ile),以及(l)xaa12是亮氨酸(leu)或缬氨酸(val)。
16.此外,本发明提供了分离的或纯化的编码前述免疫球蛋白多肽的核酸序列,包含此类核酸序列的载体,包含前述免疫球蛋白多肽的tim-3结合剂,编码此类tim-3结合剂的核酸序列,包含此类核酸序列的载体,包含此类载体的分离的细胞,包含此类tim-3结合剂的或者此类载体的并且具有药学上可接受的运载体的组合物,以及通过向哺乳动物施用有效量的此类组合物在哺乳动物中治疗癌症、感染性疾病或者自身免疫性疾病的方法。
17.附图简述
18.图1a是描述显示如实施例2中所述的在混合淋巴细胞反应中由先导抗-tim-3抗体诱导的il-2分泌情况的实验结果的图。
19.图1b是描述显示如实施例2中所述的在活化的cd4+t细胞中由先导抗-tim-3抗体诱导的il-2分泌情况的实验结果的图。
20.图1c是描述显示如实施例2中所述的在混合淋巴细胞反应中由先导抗-tim-3抗体联合抗-pd-1抗体诱导的il-2分泌情况的实验结果的图。
21.图1d是描述显示如实施例2中所述的在活化的cd4+t细胞中由先导抗-tim-3抗体联合抗-pd-1抗体诱导的il-2分泌情况的实验结果的图。
22.图2a是描述显示如实施例3中所述的在mc38同基因肿瘤模型中给予pbs对肿瘤体积作用的实验结果的图。箭头表示给药天数。
23.图2b是描述显示如实施例3中所述的在mc38同基因肿瘤模型中给予抗-tim-3抗体对肿瘤体积作用的实验结果的图。箭头表示给药天数。
24.图2c是描述显示如实施例3中所述的在mc38同基因肿瘤模型中给予抗-pd-1抗体对肿瘤体积作用的实验结果的图。箭头表示给药天数。
25.图2d是描述显示如实施例3中所述的在mc38同基因肿瘤模型中给予抗-tim-3抗体联合抗-pd-1抗体对肿瘤体积作用的实验结果的图。箭头表示给药天数。
26.图3是描述显示如实施例4中所述的在mc38同基因肿瘤模型中给予不同同种型的替代抗-tim-3抗体和抗-pd-1抗体对肿瘤体积作用的实验结果的图。箭头表示给药天数。
27.发明详述
28.本发明提供了分离的免疫球蛋白重链多肽和/或分离的免疫球蛋白轻链多肽,或其片段(例如,抗原结合片段)。本文使用的术语“免疫球蛋白”或“抗体”,是指见于脊椎动物血液或者其他体液中的蛋白,其被免疫系统用来识别和中和外来物体,例如细菌和病毒。多肽是“分离的”,是指其被移除出其天然环境。在一个优选的实施方式中,免疫球蛋白或抗体是包含至少一个互补性决定区(cdr)的蛋白。cdr形成抗体的“高变区”,其负责抗原结合(在
下文中进一步讨论)。整个免疫球蛋白通常由四条多肽组成:两个拷贝的相同的重(h)链多肽和两个拷贝的相同的轻(l)链多肽。每条重链含有一个n-末端可变(vh)区和三个c-末端恒定(ch1、ch2和ch3)区,并且每条轻链含有一个n-末端可变(v
l
)区和一个c-末端恒定(c
l
)区。基于其恒定结构域的氨基酸序列,抗体的轻链可归入两种不同类型(kappa(κ)或lambda(λ))中的一种。在典型的免疫球蛋白中,每条轻链通过二硫键连接重链,并且两条重链通过二硫键彼此相互连接。轻链可变区与所述重链可变区对齐,并且轻链恒定区与重链的第一恒定区对齐。重链的其余恒定区彼此互相对齐。
29.每个轻链重链对的可变区形成抗体的抗原结合位点。vh和v
l
区具有相同的基本结构,其中每个区包含四个框架(fw或fr)区。本文所用的术语“框架区”是指在可变区内的相对保守的氨基酸序列,其中框架区位于高变区或者互补决定区(cdr)之间。每个可变结构域有4个框架区,命名为fr1、fr2、fr3和fr4。框架区形成β片层,其提供可变区的结构框架(参见例如,c.a.janeway等(编),immunobiology,第5版,garland publishing,new york,ny(2001))。
30.多个框架区通过三个互补性决定区(cdr)相连。如上讨论,被称为cdr1、cdr2和cdr3的三个cdr形成抗体的“高变区”,其负责与抗原结合。多个cdr形成连接由框架区形成的β-片层结构的或者在某些情况下包括部分由框架区形成的β-片层结构的环。虽然轻链和重链的恒定区并不直接参与抗体与抗原的结合,但是恒定区可影响可变区的排布(orientation)。恒定区还表现出多种效应子功能,如通过效应分子和细胞之间的相互作用来参与抗体依赖性补体介导的裂解或抗体依赖性细胞毒作用。
31.本发明的分离的免疫球蛋白重链多肽和分离的免疫球蛋白轻链多肽理想地能结合t细胞免疫球蛋白和粘蛋白蛋白3(tim-3)。tim-3是由三个结构域组成的60kda的1型跨膜蛋白:n-末端ig可变(igv)-样结构域,中心的富含ser/thr的粘蛋白结构域和具有短胞内尾的跨膜结构域(参见例如,kane,l.p.,journal of immunology,184(6):2743-2749(2010))。最初在终末分化的th1细胞上鉴定出了tim-3,并且其通过诱导t细胞凋亡负向调节t细胞应答(参见例如,hastings等,eur.j.immunol.,39(9):2492-2501(2009))。tim-3还在活化的th17和tc1细胞上表达,并且在cd4+t细胞和cd8+t细胞上tim-3表达的失调与多种自身免疫性疾病、病毒感染和癌症相关(参见例如,liberal等,hepatology,56(2):677-686(2012);wu等,eur.j.immunol.,42(5):1180-1191(2012);anderson,a.c.,curr.opin.immunol.,24(2):213-216(2012);以及han等,frontiers in immunology,4:449(2013))。
32.本发明的分离的免疫球蛋白重链多肽和本发明的分离的免疫球蛋白轻链多肽能形成这样的试剂:其结合tim-3和另一抗原,产生“双反应性”结合剂(例如,双反应性抗体)。例如,试剂能结合tim-3和免疫系统的另一负性调节剂比如,举例来说,程序性死亡1(pd-1)和/或淋巴细胞活化基因3蛋白(lag-3)。
33.结合tim-3的某些其他抗体及其组分在本领域是公知的(参见例如,美国专利8,101,176;美国专利8,552,156和美国专利8,841,418)。抗-tim-3抗体也可购自诸如例如abcam(剑桥,美国马萨诸塞州)和r&d systems,inc.(明尼阿波利斯,美国明尼苏达州)的供应商。
34.本发明提供了免疫球蛋白重链多肽,所述免疫球蛋白重链多肽包含氨基酸序列
glu val gln leu leu glu ser gly gly gly leu val gln pro gly gly ser leu arg leu ser cys xaa1 ala xaa2 ser gly phe xaa3 xaa4 xaa5 thr phe ser xaa6 tyr xaa7 met xaa8 trp val arg gln ala xaa9 gly lys gly leu xaa10 trp val ser xaa11 ile ser xaa12 gly gly xaa13 tyr thr tyr tyr gln asp ser val lys gly arg phe thr ile ser arg asp asn ser lys asn thr leu tyr leu gln met asn ser leu arg xaa14 glu asp thr ala val tyr tyr cys xaa15 ser xaa16 xaa17 xaa18 xaa19 met asp tyr trp gly gln gly thr thr val thr val ser ser ala(seq id no:1),由所述氨基酸序列组成或者基本上由所述氨基酸序列组成,其中(a)xaa1缺失或者是丙氨酸(ala),(b)xaa2是丙氨酸(ala)、脯氨酸(pro)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)或缬氨酸(val),(c)子序列xaa3 xaa4 xaa5缺失或者是thr-phe-ile,(d)xaa6是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)或苏氨酸(thr),(e)xaa7是天冬氨酸(asp)或丙氨酸(ala),(f)xaa8是丝氨酸(ser)或苏氨酸(thr),(g)xaa9是脯氨酸(pro)或亮氨酸(leu),(h)xaa10是天冬氨酸(asp)或谷氨酸(glu),(i)xaa11是苏氨酸(thr)或丙氨酸(ala),(j)xaa12是甘氨酸(gly)或丝氨酸(ser),(k)xaa13是丝氨酸(ser)、苏氨酸(thr)、天冬氨酸(asp)、甘氨酸(gly)、天冬酰胺(asn)或赖氨酸(lys),(l)xaa14是丙氨酸(ala)或缬氨酸(val),(m)xaa15丙氨酸(ala)或苏氨酸(thr),以及(n)子序列xaa16 xaa17 xaa18 xaa19缺失或者是pro-tyr-tyr-ala。
35.本发明的重链多肽可以包含具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜的组合的seq id no:1所示的氨基酸序列、由具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜组合的seq id no:1所示的氨基酸序列组成或者基本上由具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜组合的seq id no:1所示的氨基酸序列组成。在一个实施方式中,免疫球蛋白重链多肽包含下述任一项所示的氨基酸序列、由下述任一项所示的氨基酸序列组成或者基本上由下述任一项所示的氨基酸序列组成:seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19、seq id no:20、seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25、seq id no:26、seq id no:27、seq id no:28、seq id no:29、seq id no:30、seq id no:31、seq id no:32、seq id no:33、seq id no:34、seq id no:35、seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:42、seq id no:43和seq id no:44。
36.本发明还提供了免疫球蛋白重链多肽,所述免疫球蛋白重链多肽包含氨基酸序列glu val gln xaa1 leu xaa2 xaa3 xaa4 xaa5 ser gly gly xaa6 leu xaa7 gln pro gly gly ser leu arg leu xaa8 cys xaa9 ala ser gly phe thr phe xaa10 xaa11 ser tyr xaa12 met xa13 trp val arg gln ala pro gly lys gly leu glu trp val ser xaa14 ile ser gly ser gly gly xaa15 thr tyr tyr xaa16 asp ser val lys gly xaa17 phe thr ile ser xaa18 asp asn ser xaa19 asn thr xaa20 tyr leu gln met asn xaa21 leu arg ala glu asp thr ala val tyr tyr cys xaa22 lys lys tyr tyr xaa23 xaa24 pro ala asp tyr trp xaa25 gln gly thr leu val thr val ser ser gly(seq id no:126),由所述氨基酸序列组成或者基本上由所述氨基酸序列组成,其中(a)
xaa1是亮氨酸(leu)、缬氨酸(val)或甲硫氨酸(met),(b)子序列xaa2 xaa3 xaa4缺失或者是glu-ser-leu,(c)xaa5缺失或者是谷氨酸(glu),(d)xaa6是甘氨酸(gly)或天冬氨酸(asp),(d)xaa7是缬氨酸(val)或异亮氨酸(ile),(e)xaa8是丝氨酸(ser)或酪氨酸(tyr),(f)xaa9是丙氨酸(ala)或缬氨酸(val),(g)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、苏氨酸(thr)、天冬氨酸(asp)或甘氨酸(gly),(h)xaa11缺失或者是甘氨酸(gly),(i)xaa12是丙氨酸(ala)或苏氨酸(thr),(j)xaa13是丝氨酸(ser)或天冬酰胺(asn),(k)xaa14是丙氨酸(ala)、甘氨酸(gly)、缬氨酸(val)、丝氨酸(ser)、苯丙氨酸(phe)、异亮氨酸(ile)、苏氨酸(thr)或天冬氨酸(asp),(l)xaa15是丝氨酸(ser)或天冬酰胺(asn),(m)xaa16是丙氨酸(ala)、缬氨酸(val)或天冬酰胺(asn),(n)xaa17是精氨酸(arg)或谷胺酰胺(gln),(o)xaa18是精氨酸(arg)或赖氨酸(lys),(p)xaa19是赖氨酸(lys)或天冬酰胺(asn),(q)xaa20是亮氨酸(leu)、缬氨酸(val)、苏氨酸(thr)、甲硫氨酸(met)或脯氨酸(pro),(r)xaa21是丝氨酸(ser)或天冬酰胺(asn),(s)xaa22是丙氨酸(ala)或甘氨酸(gly),(t)xaa23是甘氨酸(gly)、缬氨酸(val)、天冬氨酸(asp)、丙氨酸(ala)、苏氨酸(thr)或天冬酰胺(asn),(u)xaa24是甘氨酸(gly)、丝氨酸(ser)、缬氨酸(val)、天冬氨酸(asp)、天冬酰胺(asn)或苏氨酸(thr),以及(v)xaa25是甘氨酸(gly)或天冬氨酸(asp)。
37.本发明的重链多肽可以包含具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜组合的seq id no:126所示的氨基酸序列、由具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜组合的seq id no:126所示的氨基酸序列组成或者基本上由具有任意一个前述氨基酸取代和氨基酸缺失的任意适宜组合的seq id no:126所示的氨基酸序列组成。在一个实施方式中,免疫球蛋白重链多肽包含下述任一项所示的氨基酸序列、由下述任一项所示的氨基酸序列组成或者基本上由下述任一项所示的氨基酸序列组成:seq id no:127、seq id no:128、seq id no:129、seq id no:130、seq id no:131、seq id no:132、seq id no:133、seq id no:134、seq id no:135、seq id no:136、seq id no:137、seq id no:138、seq id no:139、seq id no:140、seq id no:141、seq id no:142、seq id no:143、seq id no:144、seq id no:145、seq id no:146、seq id no:147、seq id no:148、seq id no:149、seq id no:150、seq id no:151、seq id no:152、seq id no:153、seq id no:154、seq id no:155、seq id no:156、seq id no:157、seq id no:158、seq id no:159、seq id no:160、seq id no:161、seq id no:162、seq id no:163、seq id no:164、seq id no:165、seq id no:166、seq id no:167、seq id no:168、seq id no:169、seq id no:170、seq id no:171、seq id no:172、seq id no:173、seq id no:174、seq id no:175、seq id no:176、seq id no:177、seq id no:178、seq id no:179、seq id no:180、seq id no:181、seq id no:182、seq id no:183、seq id no:184、seq id no:185、seq id no:186、seq id no:187、seq id no:188、seq id no:189、seq id no:190、seq id no:191、seq id no:192、seq id no:193、seq id no:194、seq id no:195、seq id no:196、seq id no:197、seq id no:198、seq id no:199、seq id no:200、seq id no:201、seq id no:202、seq id no:203、seq id no:204、seq id no:205、seq id no:206、seq id no:207、seq id no:208、seq id no:209、seq id no:210、seq id no:211、seq id no:212、seq id no:213、seq id no:214、seq id no:215、seq id no:216、seq id no:217、seq id no:218、seq id no:219、seq id no:220、seq id no:221、seq id no:222、seq id no:223、seq id no:224、seq id no:225、seq id no:
ser ser leu gln pro glu asp phe ala xaa11 tyr tyr cys gln gln xaa12 xaa13 xaa14 xaa15 pro xaa16 thr phe gly xaa17 gly thr lys xaa18 glu ile lys arg(seq id no:45),其中(a)xaa1是谷氨酰胺(gln)或组氨酸(his),(b)xaa2是丙氨酸(ala)或苏氨酸(thr),(c)xaa3是丝氨酸(ser)、精氨酸(arg)、天冬酰胺(asn)或苏氨酸(thr),(d)xaa4是丝氨酸(ser)、精氨酸(arg)、天冬氨酸(asp)、苏氨酸(thr)或甘氨酸(gly),(e)xaa5是谷氨酰胺(gln)或组氨酸(his),(f)xaa6是脯氨酸(pro)或丙氨酸(ala),(g)xaa7是甘氨酸(gly)、赖氨酸(lys)或精氨酸(arg),(h)xaa8是异亮氨酸(ile)或甲硫氨酸(met),(i)xaa9是丙氨酸(ala)、甘氨酸(gly)、天冬氨酸(asp)、苏氨酸(thr)、丝氨酸(ser)、缬氨酸(val)或异亮氨酸(ile),(j)xaa10是丝氨酸(ser)或苏氨酸(thr),(k)xaa11是缬氨酸(val)、甲硫氨酸(met)或丙氨酸(ala),(l)xaa12是丝氨酸(ser)或精氨酸(arg),(m)xaa13是酪氨酸(tyr)、组氨酸(his)、苯丙氨酸(phe)、天冬氨酸(asp)、丝氨酸(ser)或天冬酰胺(asn),(n)xaa14是丝氨酸(ser)或天冬酰胺(asn),(o)xaa15是苏氨酸(thr)、丝氨酸(ser)、丙氨酸(ala)或脯氨酸(pro),(p)xaa16是亮氨酸(leu)或组氨酸(his),(q)xaa17是甘氨酸(gly)、精氨酸(arg)或谷氨酸(glu),以及(r)xaa18是缬氨酸(val)或亮氨酸(leu)。
42.在一个实施方式中,分离的免疫球蛋白轻链多肽包含下述任一项所示的氨基酸序列、由下述任一项所示的氨基酸序列组成或者基本上由下述任一项所示的氨基酸序列组成:seq id no:46、seq id no:47、seq id no:48、seq id no:49、seq id no:50、seq id no:51、seq id no:52、seq id no:53、seq id no:54、seq id no:55、seq id no:56、seq id no:57、seq id no:58、seq id no:59、seq id no:60、seq id no:61、seq id no:62、seq id no:63、seq id no:64、seq id no:65、seq id no:66、seq id no:67、seq id no:68、seq id no:69、seq id no:70、seq id no:71、seq id no:72、seq id no:73、seq id no:74、seq id no:75、seq id no:76、seq id no:77、seq id no:78、seq id no:79、seq id no:80、seq id no:81、seq id no:82、seq id no:83、seq id no:84、seq id no:85、seq id no:86、seq id no:87、seq id no:88、seq id no:89、seq id no:90、seq id no:91、seq id no:92、seq id no:93、seq id no:94、seq id no:95、seq id no:96、seq id no:97、seq id no:98、seq id no:99、seq id no:100、seq id no:101、seq id no:102、seq id no:103、seq id no:104、seq id no:105、seq id no:106、seq id no:107、seq id no:108、seq id no:109、seq id no:110、seq id no:111、seq id no:112、seq id no:113、seq id no:114、seq id no:115、seq id no:116、seq id no:117、seq id no:118、seq id no:119、seq id no:120、seq id no:121、seq id no:122、seq id no:123、seq id no:124和seq id no:125。
43.本发明还提供了一种免疫球蛋白轻链多肽,所述免疫球蛋白轻链多肽包含以下氨基酸序列、由以下氨基酸序列组成或者基本上由以下氨基酸序列组成:asp ile val met thr gln ser pro asp ser leu ala val ser leu gly glu arg ala thr ile asn cys lys ser ser gln ser val leu tyr ser ser asn asn lys asn tyr leu xaa1 trp tyr xaa2 xaa3 lys pro gly gln pro pro lys leu leu ile tyr trp ala ser thr arg glu xaa4 gly val pro asp arg phe xaa5 gly ser xaa6 ser gly thr asp phe thr leu xaa7 ile xaa8 ser leu gln ala glu asp val ala val tyr tyr cys xaa9 gln tyr tyr xaa10 ser pro xaa11 thr phe gly gly gly thr lys ile glu xaa12 lys(seq id no:260),其中(a)xaa1是丙氨酸(ala)或苏氨酸(thr),(b)xaa2是谷氨酰胺(gln)或组氨酸
(his),(c)xaa3是谷氨酰胺(gln)或组氨酸(his),(d)xaa4是丝氨酸(ser)、酪氨酸(tyr)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)、天冬酰胺(asn)、赖氨酸(lys)、谷氨酸(glu)、亮氨酸(leu)、脯氨酸(pro)或缬氨酸(val),(e)xaa5是丝氨酸(ser)或天冬酰胺(asn),(f)xaa6是甘氨酸(gly)、谷氨酸(glu)、丙氨酸(ala)、天冬氨酸(asp)、天冬酰胺(asn)、丝氨酸(ser)、苏氨酸(thr)或缬氨酸(val),(g)xaa7是苏氨酸(thr)或异亮氨酸(ile),(h)xaa8是丝氨酸(ser)或异亮氨酸(ile),(i)xaa9是谷氨酰胺(gln)或组氨酸(his),(j)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、甘氨酸(gly)或苏氨酸(thr),(k)xaa11是亮氨酸(leu)或异亮氨酸(ile),以及(l)xaa12是亮氨酸(leu)或缬氨酸(val)。
44.在一个实施方式中,分离的免疫球蛋白轻链多肽包含下述任一项所示的氨基酸序列、由下述任一项所示氨基酸序列组成或者基本上由下述任一项所示氨基酸序列组成seq id no:261、seq id no:262、seq id no:263seq id no:264、seq id no:265、seq id no:266、seq id no:267、seq id no:268、seq id no:269、seq id no:270、seq id no:271、seq id no:272、seq id no:273、seq id no:274、seq id no:275、seq id no:276、seq id no:277、seq id no:278、seq id no:279、seq id no:280、seq id no:281、seq id no:282、seq id no:283、seq id no:284、seq id no:285、seq id no:286、seq id no:287、seq id no:288、seq id no:289、seq id no:290、seq id no:291、seq id no:292、seq id no:293、seq id no:294、seq id no:295、seq id no:296、seq id no:297、seq id no:298、seq id no:299、seq id no:300、seq id no:301、seq id no:302、seq id no:303、seq id no:304、seq id no:305、seq id no:306、seq id no:307、seq id no:308、seq id no:309、seq id no:310、seq id no:311、seq id no:312、seq id no:313、seq id no:314、seq id no:315、seq id no:316、seq id no:317、seq id no:318、seq id no:319、seq id no:320、seq id no:321、seq id no:322、seq id no:323、seq id no:324、seq id no:325、seq id no:326、seq id no:327和seq id no:328。
45.当本发明的免疫球蛋白轻链多肽基本上由seq id no:45-seq id no:125或seq id no:260-seq id no:328中任一项所示的氨基酸序列组成时,可以在多肽中包含不会对多肽产生实质性影响的其他组分,例如本技术所述的那些。当本发明的免疫球蛋白轻链多肽由seq id no:45-seq id no:125或seq id no:260-seq id no:328中任一项所示的氨基酸序列组成时,多肽不包含任何附加组分(即相对于本发明的免疫球蛋白轻链多肽不是内源性的组分)。
46.本发明提供了一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含与seq id no:45-seq id no:125和seq id no:260-seq id no:328中任一项所示的氨基酸序列具有至少90%同一性(例如,至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%同一性)的氨基酸序列。可以使用本技术所述的方法确定核酸或氨基酸序列的“同一性”。
47.前述免疫球蛋白重链多肽和/或轻链多肽的一个或多个氨基酸可被不同氨基酸替换或取代。氨基酸“替换”或“取代”是指在多肽序列内在给定位置或残基处的一个氨基酸被另一氨基酸在相同位置或残基处取代。
48.氨基酸可以大致归类为“芳香族”或“脂肪族”。芳香族氨基酸包含芳环。“芳香族”氨基酸的实例包括组氨酸(h或his)、苯丙氨酸(f或phe)、酪氨酸(y或tyr)和色氨酸(w或
trp)。非芳香族氨基酸可以大致归类为“脂肪族”。“脂肪族”氨基酸的实例包括甘氨酸(g或gly)、丙氨酸(a或ala)、缬氨酸(v或val)、亮氨酸(l或leu)、异亮氨酸(i或ile)、甲硫氨酸(m或met)、丝氨酸(s或ser)、苏氨酸(t或thr)、半胱氨酸(c或cys)、脯氨酸(p或pro)、谷氨酸(e或glu)、天冬氨酸(a或asp)、天冬酰胺(n或asn)、谷氨酰胺(q或gln)、赖氨酸(k或lys)和精氨酸(r或arg)。
49.可以将脂肪族氨基酸再分成四个亚组。“大脂肪族非极性亚组”由缬氨酸、亮氨酸和异亮氨酸组成。“脂肪族微极性亚组”由甲硫氨酸、丝氨酸、苏氨酸和半胱氨酸组成。“脂肪族极性/带电荷亚组”由谷氨酸、天冬氨酸、天冬酰胺、谷氨酰胺、赖氨酸和精氨酸组成。“小残基亚组”由甘氨酸和丙氨酸组成。可以将带电荷/极性氨基酸组再细分成三个亚组:由赖氨酸和精氨酸组成的“正电荷亚组”,由谷氨酸和天冬氨酸组成的“负电荷亚组”,以及由天冬酰胺和谷氨酰胺组成的“极性亚组”。
50.可以将芳香族氨基酸再细分成两亚组:由组氨酸和色氨酸组成的“氮环亚组”以及由苯丙氨酸和酪氨酸组成的“苯基亚组”。
51.氨基酸替换或取代可以是保守性的、半保守性的或非保守性的。短语“保守性氨基酸取代”或“保守性突变”指一个氨基酸被另一个与其具有共同性质的氨基酸取代。确定单个氨基酸之间共同性质的有效方法是分析同源有机体相应蛋白间氨基酸变化的归一化频率(schulz和schirmer,principles of protein structure,springer-verlag,new york(1979))。根据此类分析,可以将氨基酸的组定义为组内的氨基酸可以优选地彼此互换,并且其对总体蛋白结构的影响彼此最为类似(schulz和schirmer,出处同上)。
52.保守性氨基酸取代的实例包括上述亚组内部的氨基酸取代,例如赖氨酸取代精氨酸(反之亦然)从而使得可以保持正电荷;谷氨酸取代天冬氨酸(反之亦然)从而使得可以保持负电荷;丝氨酸取代苏氨酸使得能够保留游离的-oh;以及谷氨酰胺取代天冬酰胺使得能够保留游离的-nh2。
[0053]“半保守性突变”包括用属于上文所列的同一组但不属于相同亚组的氨基酸进行的氨基酸取代。例如,天冬氨酸取代天冬酰胺,或天冬酰胺取代赖氨酸均涉及属于同一组但是不同亚组的氨基酸。“非保守性突变”涉及不同组之间的氨基酸取代,例如赖氨酸取代色氨酸,或苯丙氨酸取代丝氨酸等。
[0054]
此外,可将一个或多个氨基酸插入前述免疫球蛋白重链多肽和/或轻链多肽中。可以将任意数量的任何适当的氨基酸插入免疫球蛋白重链多肽和/或轻链多肽的氨基酸序列中。就这一方面而言,可以将至少一个氨基酸(例如,2个或更多、5个或更多、或者10个或更多的氨基酸)但不超过20个氨基酸(例如,18个或更少、15个或更少或者12个或更少的氨基酸)插入免疫球蛋白重链多肽和/或轻链多肽的氨基酸序列中。在一些实施方式中,将1-10个氨基酸(例如,1、2、3、4、5、6、7、8、9或10个氨基酸)插入免疫球蛋白重链多肽和/或轻链多肽的氨基酸序列中。就这一方面而言,可以将氨基酸插入任一前述免疫球蛋白重链多肽和/或轻链多肽的任意适当的位置。例如,将氨基酸插入免疫球蛋白重链多肽和/或轻链多肽的cdr(例如,cdr1、cdr2或cdr3)中。
[0055]
本发明的分离的免疫球蛋白重链多肽和轻链多肽不限于包含本文所述特定氨基酸序列的多肽。免疫球蛋白重链多肽或轻链多肽可为与具有上文所述序列的免疫球蛋白重链多肽或轻链多肽竞争结合tim-3的任何重链多肽或轻链多肽。例如,免疫球蛋白重链多肽
或轻链多肽可为结合至被本文所述重链和轻链多肽所识别的相同tim-3表位的任何重链多肽或轻链多肽。可使用利用elisa、western印迹或免疫组织化学方法的常规的肽竞争测定法(参见例如,美国专利4,828,981和8,568,992;以及braitbard等,proteome sci.,4:12(2006))来进行抗体竞争的测定。
[0056]
本发明提供了一种tim-3-结合剂,其包含一种或多种本文所述的本发明的分离的氨基酸序列、基本由一种或多种本文所述的本发明的分离的氨基酸序列组成或由一种或多种本文所述的本发明的分离的氨基酸序列组成。“tim-3-结合剂”是指特异性结合tim-3蛋白的分子,优选蛋白质分子。优选地,tim-3-结合剂是抗体或其片段(例如,抗原结合片段)。本发明的分离的tim-3-结合剂包含本发明的免疫球蛋白重链多肽和/或本发明的免疫球蛋白轻链多肽、基本由本发明的免疫球蛋白重链多肽和/或本发明的免疫球蛋白轻链多肽组成或由本发明的免疫球蛋白重链多肽和/或本发明的免疫球蛋白轻链多肽组成。在一个实施方式中,tim-3-结合剂包含本发明的免疫球蛋白重链多肽或本发明的免疫球蛋白轻链多肽、基本由本发明的免疫球蛋白重链多肽或本发明的免疫球蛋白轻链多肽组成或由本发明的免疫球蛋白重链多肽或本发明的免疫球蛋白轻链多肽组成。在另一实施方式中,tim-3-结合剂包含本发明的免疫球蛋白重链多肽和本发明的免疫球蛋白轻链多肽、基本由本发明的免疫球蛋白重链多肽和本发明的免疫球蛋白轻链多肽组成或由本发明的免疫球蛋白重链多肽和本发明的免疫球蛋白轻链多肽组成。
[0057]
本发明的免疫球蛋白重链多肽和/或本发明的免疫球蛋白轻链多肽的任意氨基酸残基均可以以任意组合的形式被不同氨基酸残基取代,或者可以被删除或插入,只要氨基酸取代、插入和/或删除的结果是使得tim-3-结合剂的生物活性无大幅降低(例如,增强或改善)即可。tim-3-结合剂的“生物活性”是指,例如,与特定tim-3表位的结合亲和性、对tim-3结合其受体的中和或抑制、在体内对tim-3活性的中和或抑制(例如,ic
50
)、药代动力学性质以及交叉反应性(例如,与tim-3蛋白的非人同源物或直系同源物之间,或与其他蛋白或组织之间)。本领域已知的抗原结合剂的其他生物学性质或特性包括:例如,亲和性、选择性、溶解性、折叠、免疫毒性、表达和制剂。可以采用标准技术对上述性质或特性进行观察、测量和/或评估,所述标准技术包括但不限于,elisa、竞争性elisa、表面等离子体共振分析(biacore
tm
)或kinexa
tm
、体外或体内中和试验、受体-配体结合试验、细胞因子或生长因子生成和/或分泌检测、以及信号转导和免疫组化检测。
[0058]
如本文所使用的针对tim-3-结合剂活性的术语“抑制”或“中和”是指基本上拮抗、抑制、预防、限制、延缓、破坏、改变、消除、终止或逆转例如tim-3的生物活性或与tim-3相关的疾病或状况的进程或严重程度的能力。本发明的tim-3-结合剂优选抑制或中和tim-3的活性达至少约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%、约100%,或前述值中任意两个所定义的范围。
[0059]
本发明的tim-3-结合剂可以是如本文所述的完整抗体,或者抗体片段。术语“抗体的片段”、“抗体片段”和“抗体的功能性片段”等在本文中可以互换使用,其是指保留与抗原特异性结合能力的一个或多个抗体片段(大体参见,holliger等,nat.biotech.,23(9):1126-1129(2005))。tim-3-结合剂可以包含结合tim-3的任意-抗体片段。抗体片段优选包含例如一个或多个cdr、可变区(或其部分)、恒定区(或其部分)、或其组合。抗体片段的实例包括但不限于,(i)fab片段,其是由v
l
、vh、c
l
和ch1结构域组成的单价片段,(ii)f(ab')2片
段,其是包含在铰链区通过二硫键连接的两个fab片段的二价片段,(iii)fv片段,其由抗体单臂的v
l
和vh结构域组成,(iv)fab'片段,其通过使用温和还原条件破坏f(ab')2片段的二硫桥而生成,(v)稳定化二硫键的fv片段(dsfv),和(vi)结构域抗体(dab),其为特异性结合抗原的抗体单一可变区结构域(vh或vl)多肽。
[0060]
在tim-3-结合剂包含免疫球蛋白重链或轻链多肽的片段的实施方式中,只要其能与tim-3结合,并优选地能抑制tim-3的活性,那么所述片段可以是任意尺寸。在这一方面,免疫球蛋白重链多肽的片段理想地包含约5至18个之间的(例如,约5、6、7、8、9、10、11、12、13、14、15、16、17、18,或任意两个前述值所定义的范围)氨基酸。类似地,免疫球蛋白轻链多肽的片段理想地包含约5至18个之间的(例如,约5、6、7、8、9、10、11、12、13、14、15、16、17、18,或任意两个前述值所定义的范围的)氨基酸。
[0061]
当tim-3-结合剂是抗体或抗体片段时,抗体或抗体片段理想地包含任意合适类别的重链恒定区(fc)。优选地,抗体或抗体片段包含基于野生型igg1、igg2、或igg4抗体,或其变体的重链恒定区。应意识到,一旦识别抗原,则每个抗体类别或同种型会参与到独特的一组处置或中和抗原的效应器机制中。因此,在一些实施方式中,当tim-3-结合剂是抗体或抗体片段时,其能够显示出一种或多种效应器功能,例如通过与效应器分子及细胞的相互作用(例如,补体系统的活化)参与到抗体依赖性补体介导的裂解或抗体依赖性细胞毒性。
[0062]
tim-3-结合剂还可以是单链抗体片段。单链抗体片段的例子包括但不限于,(i)单链fv(scfv),其是由通过合成接头连接的fv片段的两个结构域(即,v
l
和vh)组成的单价分子,所述合成接头使得两个结构域能够被合成为一个单条多肽链(参见例如,bird等,science,242:423-426(1988);huston等,proc.natl.acad.sci.usa,85:5879-5883(1988);以及osbourn等,nat.biotechnol.,16:778(1998))和(ii)双价抗体(diabody),其为多肽链的二聚体,其中每条多肽链包含通过肽接头连接至v
l
的vh,所述肽接头太短从而不允许在同一多肽链上的vh与v
l
之间配对,籍此使得不同的v
h-v
l
多肽链上的互补结构域之间发生配对,以产生具有两个功能性抗原结合位点的二聚体分子。抗体片段是本领域所已知的,并在例如美国专利申请公开号2009/0093024a1中有更加详细的描述。
[0063]
tim-3-结合剂还可以是胞内抗体(intrabody)或其片段。胞内抗体是一种在细胞内表达和发挥功能的抗体。胞内抗体一般缺乏二硫键,其能够通过其特异性结合活性来调节靶基因的表达或活性。胞内抗体包括单结构域片段,例如分离的vh和v
l
结构域以及scfv。胞内抗体可以包括连接至胞内抗体的n端或c端的亚细胞转运信号,以使其在靶蛋白所处的亚细胞区室中高浓度的表达。通过与靶基因相互作用,胞内抗体通过例如加速靶蛋白降解和在非生理性亚细胞区室中隔离靶蛋白的机制,来调节靶蛋白的功能和/或实现表型/功能性敲除。胞内抗体介导的基因失活的其他机制可以依赖于胞内抗体所靶向的表位,如结合至靶蛋白上的催化位点,或结合至参与蛋白-蛋白、蛋白-dna、或蛋白-rna相互作用的表位。
[0064]
tim-3-结合剂还可以是抗体偶联物。在这一方面,分离的tim-3-结合剂可以是(1)抗体、替代支架、或其片段,以及(2)包含tim-3结合剂的蛋白或非蛋白部分的偶联物。例如,tim-3-结合剂可以是偶联至肽、荧光分子或化疗剂的抗体的全部或部分。
[0065]
tim-3-结合剂可以是,或可以来自人抗体、非人抗体或嵌合抗体。“嵌合”是指包含人和非人区域的抗体或其片段。优选地,tim-3-结合剂是人源化抗体。“人源化”抗体是包含人抗体支架和至少一个获自或源自非人抗体的cdr的单克隆抗体。非人抗体包括分离自任
意非人动物,例如啮齿类动物(例如,小鼠或大鼠)的抗体。人源化抗体可包含一个、两个或三个获自或源自非人抗体的cdr。在本发明的一个实施方式中,本发明tim-3-结合剂的cdrh3获自或源自小鼠单克隆抗体,而本发明tim-3-结合剂的其余可变区和恒定区获自或源自人单克隆抗体。
[0066]
可以通过任意方法获得人抗体、非人抗体、嵌合抗体或人源化抗体,包括通过体外来源(例如,杂交瘤或细胞系重组产生抗体)和体内来源(例如,啮齿类动物)。产生抗体的方法是本领域所公知的,并在例如和milstein,eur.j.immunol.,5:511-519(1976);harlow和lane(编著),antibodies:a laboratory manual,csh press(1988);以及janeway等编著,immunobiology,5th ed.,garland publishing,new york,ny(2001)中描述。在某些实施方式中,可以使用其中一个或多个内源性的免疫球蛋白基因被一个或多个人免疫球蛋白基因所取代的转基因动物(例如,小鼠)生产人抗体或嵌合抗体。其中内源性抗体基因被人抗体基因有效取代的转基因小鼠的实例包括但不限于medarex humab-mouse
tm
、kirin tc mouse
tm
以及kyowa kirin km-mouse
tm
(参见例如,lonberg,nat.biotechnol.,23(9):1117-25(2005)和lonberg,handb.exp.pharmacol.,181:69-97(2008))。可以使用本领域公知的任何适当的方法生产人源化抗体(参见例如,an,z(编著)therapeutic monoclonal antibodies:from bench to clinic,john wiley & sons,inc.,hoboken,new jersey(2009)),其包括例如,将非人cdr接合至人抗体支架(参见例如,kashmiri等,methods,36(1):25-34(2005);和hou等,j.biochem.,144(1):115-120(2008))。在一个实施方式中,可以使用例如美国专利申请公开号2011/0287485a1中描述的方法生产人源化抗体。
[0067]
在一个实施方式中,可以使用蛋白质化学或重组dna技术将本文所述的免疫球蛋白重链多肽和/或免疫球蛋白轻链多肽的cdr(例如,cdr1、cdr2或cdr3)或可变区移植(即,接合(grafted))入另一分子,例如抗体或非抗体多肽。就此而言,本发明提供了一种tim-3-结合剂,其包含如本文所述的免疫球蛋白重链和/或轻链多肽的至少一个cdr。tim-3-结合剂可包含如本文所述的免疫球蛋白重链和/或轻链可变区的一个、两个或三个cdr。
[0068]
在一个优选的实施方式中,tim-3-结合剂结合tim-3表位,其阻断tim-3结合至其任意的假定配体(例如,磷脂酰丝氨酸、半乳凝素-9、高迁移率族蛋白1(hmgb1)和癌胚抗原细胞粘附分子1(ceacam1))并抑制tim-3介导的信号转导。本发明还提供了分离或纯化的tim-3表位,其以间接或变构方式阻断tim-3结合至其任意的假定配体。
[0069]
本发明还提供了编码本发明免疫球蛋白重链多肽、本发明免疫球蛋白轻链多肽和本发明tim-3-结合剂的一种或多种分离或纯化的核酸序列。
[0070]
术语“核酸序列”旨在包括dna或rna聚合物,即多核苷酸,其可以是单链的或双链的并可含有非天然或改变的核苷酸。如本文所使用的术语“核酸”和“多核苷酸”是指任意长度的核苷酸(核糖核苷酸(rna)或脱氧核糖核苷酸(dna))聚合形式。这些术语是指分子的一级结构,且因此包括双链和单链dna、以及双链和单链rna。该术语包括作为等同物的由核苷酸类似物和经修饰的多核苷酸(例如但不限于甲基化的和/或封端的多核苷酸)构成的rna或dna类似物。虽然本领域中已知很多其他连接(例如,硫代磷酸酯(phosphorothioate)、硼烷磷酸酯(boranophosphate)等等),但是核酸一般通过磷酸键连接以形成核酸序列或多核苷酸。
[0071]
本发明另外提供了包含编码本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白
轻链多肽和/或本发明的tim-3-结合剂的一个或多个核酸序列的载体。载体可以是例如质粒、附加体(episome)、粘粒、病毒载体(例如,逆转录病毒或腺病毒载体)或噬菌体。适宜的载体和载体制备方法均是本领域所公知的(参见例如,sambrook等,molecular cloning,a laboratory manual,第3版,cold spring harbor press,cold spring harbor,n.y.(2001),和ausubel等,current protocols in molecular biology,greene publishing associates and john wiley & sons,new york,n.y.(1994))。
[0072]
除了编码本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽和/或本发明的tim-3-结合剂的核酸序列以外,载体优选包含表达控制序列,例如启动子、增强子、多腺苷酸化信号、转录终止子、信号肽(例如,骨粘连蛋白信号肽)、内部核糖体进入位点(ires)等,其使得编码序列能在宿主细胞内表达。示例性的表达控制序列是本领域公知的,并在例如goeddel,gene expression technology:methods in enzymology,vol.185,academic press,san diego,calif.(1990)中描述。
[0073]
来自多种不同来源的大量启动子,包括组成型启动子、诱导型启动子和阻抑型启动子均是本领域熟知的。启动子的代表性来源包括例如病毒、哺乳动物、昆虫、植物、酵母和细菌,并且来自这些来源的适宜启动子易于获得,或者可以基于可公开获得的序列(例如来自诸如atcc以及其他商业或个人来源的保藏机构)合成制备。启动子可以是单向的(即,在一个方向启动转录)或双向的(即,在3’或5’方向启动转录)。启动子的非限制性实例包括例如t7细菌表达系统、pbad(araa)细菌表达系统、巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子。诱导型启动子包括例如tet系统(美国专利号5,464,758和5,814,618)、蜕皮激素(ecdysone)可诱导系统(no等,proc.natl.acad.sci.,93:3346-3351(1996))、t-rex
tm
系统(invitrogen,卡尔斯巴德,美国加利福尼亚州)、lacswitch
tm
系统(stratagene,san diego,ca)和cre-ert他莫昔芬可诱导的重组酶系统(indra等,nuc.acid.res.,27:4324-4327(1999);nuc.acid.res.,28:e99(2000);美国专利7,112,715和kramer & fussenegger,methods mol.biol.,308:123-144(2005))。
[0074]
如本文所使用的术语“增强子”指增加例如与之可操作连接的核酸序列的转录的dna序列。增强子可以位于核酸序列编码区的数千碱基以外,并且可以介导调控因子的结合、dna甲基化的模式或dna结构的改变。来自多种不同来源的大量增强子是本领域熟知的并可为克隆的多核苷酸或在克隆的多核苷酸内(来自例如,诸如atcc以及其他商业或个人来源的保藏机构)。很多包含启动子(例如,常用的cmv启动子)的多核苷酸也包含增强子序列。增强子可以位于编码序列的上游、内部或下游。
[0075]
载体还可以包含“选择标记基因”。本文所使用的术语“选择标记基因”是指这样的核酸序列:在存在相应选择剂时,其特异性地选择或抑制表达该核酸序列的细胞。适宜的选择标记基因是本领域熟知的并在例如国际专利申请公开wo 1992/008796和wo 1994/028143;wigler等,proc.natl.acad.sci.usa,77:3567-3570(1980);o'hare等,proc.natl.acad.sci.usa,78:1527-1531(1981);mulligan & berg,proc.natl.acad.sci.usa,78:2072-2076(1981);colberre-garapin等,j.mol.biol.,150:1-14(1981);santerre等,gene,30:147-156(1984);kent等,science,237:901-903(1987);wigler等,cell,11:223-232(1977);szybalska&szybalski,proc.natl.acad.sci.usa,48:2026-2034(1962);lowy等,cell,22:817-823(1980)以及美国专利5,122,464和5,770,359
中描述。
[0076]
在一些实施方式中,载体是“附加型表达载体”或“附加体”,在存在适宜的选择性压力的条件下,其能够在宿主细胞中复制并作为dna的染色体外片段持续存在于宿主细胞中(参见例如,conese等,gene therapy,11:1735-1742(2004))。代表性的市售的附加型表达载体包括但不限于使用爱泼斯坦巴尔核酸抗原1(ebna1)和爱泼斯坦巴尔病毒(ebv)复制原点(orip)的游离基因质粒。来自invitrogen(卡尔斯巴德,美国加利福尼亚州)的载体prep4、pcep4、prep7和pcdna3.1以及来自stratagene(拉由拉市,美国加利福尼亚州)的pbk-cmv代表了使用t抗原和sv40复制起点来替代ebna1和orip.1的附加型载体的非限制性实例。
[0077]
其他适宜的载体包括整合型表达载体,其可以随机整合至宿主细胞的dna、或可包括能够使表达载体与宿主细胞染色体特异性重组的重组位点。此类整合型表达载体可以利用宿主细胞染色体的内源性表达控制序列实现目标蛋白的表达。以位点特异性方式整合的载体的实例包括,例如来自invitrogen(卡尔斯巴德,美国加利福尼亚州)的flp-in系统的组件(例如,pcdna
tm
5/frt)或cre-lox系统(例如,可见于来自stratagene(拉由拉市,美国加利福尼亚州)的pexchange-6核心载体)。随机整合至宿主细胞染色体的载体的实例包括,例如来自life technologies(卡尔斯巴德,美国加利福尼亚州)的pcdna3.1(当不存在t-抗原时将其引入)、来自millipore(billerica,ma)的ucoe以及来自promega(madison,wi)的pci或pfn10a(act)flexi
tm
。
[0078]
还可以使用病毒载体。代表性的市售的病毒表达载体包括但不限于,获得自crucell公司(莱顿,荷兰)的基于腺病毒的per.c6系统、来自invitrogen(卡尔斯巴德,美国加利福尼亚州)的基于慢病毒的plp1以及来自stratagene(拉由拉市,美国加利福尼亚州)的逆转录病毒载体pfb-erv加pcfb-egsh。
[0079]
可以将编码本发明的多个氨基酸序列的多个核酸序列在相同载体上提供给细胞(即,以顺式的方式)。可以使用单向启动子控制各核酸序列的表达。在另一个实施方式中,可以使用双向和单向启动子的组合控制多个核酸序列的表达。在另一方面,可以将编码本发明的多个氨基酸序列的多个核酸序列各自放在单独的载体上提供给细胞群(即,以反式的方式)。各单独载体中的核酸序列可包含相同或不同的表达控制序列。可以同时或顺序地将各单独载体提供给细胞。
[0080]
可以将包含编码本发明氨基酸序列的核酸的载体引入能够表达所编码多肽的宿主细胞(包括任意适宜的原核或真核细胞)。照此,本发明提供了包含本发明的载体的分离细胞。优选的宿主细胞是能够容易并稳定地生长,具有相当快的生长速率,具有良好表征的表达系统,并且能够被方便和有效地转化或转染的那些细胞。
[0081]
适宜的原核细胞的实例包括但不限于来自芽孢杆菌属(如,枯草芽孢杆菌和短芽孢杆菌)、埃希氏杆菌属(如,大肠杆菌)、假单胞菌属、链霉菌属、沙门氏菌属和欧文氏菌属的细胞。特别有用的原核细胞包括多种大肠杆菌菌株(例如,k12、hb101(atcc no.33694)、dh5α、dh10、mc1061(atcc no.53338)和cc102)。
[0082]
优选地,将载体引入真核细胞。适宜的真核细胞是本领域公知的,其包括例如酵母细胞、昆虫细胞和哺乳动物细胞。适宜酵母细胞的实例包括来自克鲁维酵母菌属(kluyveromyce)、毕赤酵母属(pichia)、鼻孢子虫属(rhinosporidium)、酵母菌属
(saccaromyces)和裂殖酵母属(schizosaccharomyces)的那些。优选的酵母细胞包括例如酿酒酵母和毕赤酵母。
[0083]
适宜的昆虫细胞在例如kitts等,biotechniques,14:810-817(1993);lucklow,curr.opin.biotechnol.,4:564-572(1993);以及lucklow等,j.virol.,67:4566-4579(1993)中描述。优选的昆虫细胞包括sf-9和hi5(invitrogen,卡尔斯巴德,美国加利福尼亚州)。
[0084]
优选地,在本发明中利用哺乳动物细胞。多种适宜的哺乳动物宿主细胞是本领域公知的,并且很多可以从美国典型培养物保藏中心(atcc,马纳萨斯,美国弗吉尼亚州)获得。适宜的哺乳动物细胞的实例包括但不限于中国仓鼠卵巢细胞(cho)(atcc no.ccl61)、cho dhfr细胞(urlaub等,proc.natl.acad.sci.usa,97:4216-4220(1980))、人胚胎肾(hek)293或293t细胞(atcc no.crl1573)和3t3细胞(atcc no.ccl92)。其他适宜的哺乳动物细胞系为猴cos-1(atcc no.crl1650)和cos-7细胞系(atcc no.crl1651)、以及cv-1细胞系(atcc no.ccl70)。其他示例性哺乳动物宿主细胞包括灵长类细胞系和啮齿类细胞系,包括转化细胞系。正常的二倍体细胞,来自原代组织体外培养的细胞系,以及原代外植体也是适宜的。其他适宜的哺乳动物细胞系包括但不限于小鼠神经母细胞瘤n2a细胞、hela、小鼠l-929细胞、以及bhk或hak仓鼠细胞系,这些全部可以从atcc获得。选择适宜的哺乳动物宿主细胞以及转化、培养、扩增、筛选和纯化细胞的方法均是本领域公知的。
[0085]
在一个实施方式中,哺乳动物细胞是人类细胞。例如,哺乳动物细胞可以是人淋巴细胞系或淋巴细胞衍生的细胞系,例如前b淋巴细胞来源细胞系。人淋巴细胞系的实例包括但不限于ramos(crl-1596)、daudi(ccl-213)、eb-3(ccl-85)、dt40(crl-2111)、18-81(jack等,proc.natl.acad.sci.usa,85:1581-1585(1988))、raji细胞(ccl-86)、per.c6细胞(crucell holland b.v.,莱顿,荷兰)及其衍生物。
[0086]
可以通过“转染”、“转化”或“转导”将编码本发明氨基酸序列的核酸序列引入细胞。如本文所使用的“转染”、“转化”或“转导”是指通过物理或化学方法将一个或多个外源性的多核苷酸引入宿主细胞。多种转染技术均是本领域公知的,且包括例如磷酸钙dna共沉淀(参见例如,murray e.j.(编著),methods in molecular biology,vol.7,gene transfer and expression protocols,humana press(1991));deae-葡聚糖法;电穿孔法;阳离子脂质体介导的转染法;钨粒子促化的微粒轰击法(johnston,nature,346:776-777(1990));以及磷酸锶dna共沉淀法(brash等,mol.cell biol.,7:2031-2034(1987))。当转染粒子在适宜的包装细胞(许多包装细胞是市售的)中生长后,可以将噬菌体或病毒载体引入宿主细胞。
[0087]
本发明提供了一种组合物,所述组合物包含有效量的本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽、本发明的tim-3-结合剂、编码任意前述的本发明的核酸序列、或者包含本发明的核酸序列的本发明的载体。优选地,该组合物是药学上可接受的(例如,生理学上可接受的)组合物,其包含运载体,优选药学上可接受的(例如,生理学上可接受的)运载体,和本发明氨基酸序列、抗原结合剂或载体。在本发明的情境下可以使用任何适当的运载体,并且此类运载体是本领域所熟知的。运载体的选择部分地取决于施用组合物的特定部位和施用组合物所使用的特定方法。组合物任选地可以是无菌的。组合物可以冷冻或冻干贮存并在使用前在适当无菌运载体中进行重构。可以根据常规技术生产组合
物,在例如remington:the science and practice of pharmacy,第21版,lippincott williams & wilkins,philadelphia,pa(2001)中描述。
[0088]
本发明还提供了一种在哺乳动物中治疗对tim-3抑制或中和有应答的病症的方法。该方法包括给予患有对tim-3抑制或中和有应答的病症的哺乳动物前述组合物,藉此在哺乳动物中治疗该病症。“对tim-3抑制有应答”或“对tim-3中和有应答”的病症是指tim-3水平或活性的降低在哺乳动物(优选人)中具有治疗益处,或者tim-3的不适当表达(例如,过表达)或增加的活性导致或有助于疾病或病症的病理作用的任何疾病或病症。对tim-3抑制有应答的病症包括:例如,癌症、感染性疾病和自身免疫性疾病。本发明的方法可以用于治疗本领域公知的任意类型的癌症,例如黑色素瘤、肾细胞癌、肺癌、膀胱癌、乳癌、宫颈癌、结肠癌、胆囊癌、喉癌、肝癌、甲状腺癌、胃癌、唾液腺癌、前列腺癌、胰腺癌、白血病、淋巴瘤或梅克尔细胞癌(参见例如,bhatia等,curr.oncol.rep.,13(6):488-497(2011))。本发明的方法可以用于治疗任意类型的感染性疾病(即,由细菌、病毒、真菌或寄生虫引起的疾病或病症)。可以由本发明的方法治疗的感染性疾病的实例包括但不限于由人类免疫缺陷病毒(hiv)、呼吸道合胞病毒(rsv)、流感病毒、登革热病毒、乙肝病毒(hbv)或丙肝病毒(hcv)引起的疾病。本发明的方法可以用于治疗任意类型的自身免疫性疾病(即由免疫系统过度活动引起的机体攻击并损伤其自身组织的疾病或病症),例如mackay i.r.和rose n.r.编著,the autoimmune diseases,第5版,academic press,waltham,ma(2014)中所描述的那些。可以由本发明的方法治疗的自身免疫性疾病的实例包括但不限于多发性硬化症、1型糖尿病、类风湿性关节炎、硬皮病、克隆氏病、牛皮癣(银屑病)、系统性红斑狼疮(sle)和溃疡性结肠炎。
[0089]
施用包含本发明的免疫球蛋白重链多肽、本发明的免疫球蛋白轻链多肽、本发明的tim-3-结合剂、编码任意前述的本发明的核酸序列、或者包含本发明的核酸序列的本发明载体的组合物,在哺乳动物中诱导针对癌症或感染性疾病的免疫应答。“免疫应答”可能牵涉例如抗体的生成和/或免疫效应器细胞(例如,t细胞)的活化。
[0090]
如本文所使用的,术语“疗法(treatment)”、“治疗(treating)”等是指获得所需的药理学和/或生理学效应。优选地,该效应是治疗性的,即该效应部分地或完全地治愈疾病和/或可归因于疾病的不良症状。为了这个目的,本发明方法包括给予“治疗有效量”的tim-3-结合剂。“治疗有效量”是指在必要的剂量和时间段内达到所需治疗结果的有效量。治疗有效量可以根据诸如以下的因素而改变:个体的疾病状态、年龄、性别和体重,以及tim-3-结合剂在个体中激发所需应答的能力。例如,本发明的tim-3-结合剂的治疗有效量是在人体中降低tim-3生物活性的量。
[0091]
或者,药理学和/或生理学效应可能是预防性的,即该效应完全地或部分地预防疾病或其症状。就这一方面而言,本发明的方法包括施用“预防有效量”的tim-3-结合剂。“预防有效量”指在必要的剂量和时间段内达到所需预防结果(例如,预防疾病发病)的有效量。
[0092]
典型的剂量可以是例如在以动物或人体重量计算1pg/kg至20mg/kg的范围内;但是,低于或高于该示例性范围的剂量仍在本发明的范围内。每日肠胃外剂量可以是以总体重计算约0.00001μg/kg至约20mg/kg(例如,约0.001μg/kg、约0.1μg/kg、约1μg/kg、约5μg/kg、约10μg/kg、约100μg/kg、约500μg/kg、约1mg/kg、约5mg/kg、约10mg/kg,或前述值中任意两个所定义的范围),优选以总体重计算约0.1μg/kg至约10mg/kg(例如,约0.5μg/kg、约1μ
g/kg、约50μg/kg、约150μg/kg、约300μg/kg、约750μg/kg、约1.5mg/kg、约5mg/kg,或前述值中任意两个所定义的范围),更优选以总体重计算约1μg/kg至5mg/kg(例如,约3μg/kg、约15μg/kg、约75μg/kg、约300μg/kg、约900μg/kg、约2mg/kg、约4mg/kg,或前述值中任意两个所定义的范围),且甚至更优选以体重/天计算约0.5至15mg/kg(例如,约1mg/kg、约2.5mg/kg、约3mg/kg、约6mg/kg、约9mg/kg、约11mg/kg、约13mg/kg,或前述值中任意两个所定义的范围)。可以通过定期对接受治疗的患者进行评估以监测治疗或预防功效。对于持续若干天或更长时间的重复给药而言,可以依据病况,重复治疗直至疾病症状得到所需的抑制。然而,其他剂量方案可能是有用的且在本发明的范围内。可以通过将组合物单次推注给药、将组合物多次推注给药、或通过将组合物连续输注给药以递送所需的剂量。
[0093]
可以使用标准给药技术给予哺乳动物包含有效量的本发明免疫球蛋白重链多肽、本发明免疫球蛋白轻链多肽、本发明tim-3-结合剂、编码任意前述的本发明核酸序列、或者包含本发明核酸序列的本发明载体的组合物,所述标准给药技术包括口服、静脉内、腹腔内、皮下、经肺、经皮、肌内、鼻内、口腔、舌下、或栓剂给药。该组合物优选适于肠胃外给药。如本文所使用的,术语“肠胃外”包括静脉内、肌内、皮下、直肠、阴道、和腹腔内给药。更优选地,通过静脉内、腹腔内、或皮下注射使用外周系统将组合物给予哺乳动物。
[0094]
本发明的tim-3-结合剂一旦施与哺乳动物(例如,人),可以通过本领域公知的任何适当方法测定其生物活性。例如,可以通过测定特定tim-3-结合剂的稳定性评估生物活性。在本发明的一个实施方式中,tim-3-结合剂(例如,抗体)的体内半衰期介于约30分钟至45天之间(例如,约30分钟、约45分钟、约1小时、约2小时、约4小时、约6小时、约10小时、约12小时、约1天、约5天、约10天、约15天、约25天、约35天、约40天、约45天,或前述值中任意两个所定义的范围)。在另一个实施方式中,tim-3-结合剂的体内半衰期介于约2小时至20天之间(例如,约5小时、约10小时、约15小时、约20小时、约2天、约3天、约7天、约12天、约14天、约17天、约19天,或前述值中任意两个所定义的范围)。在另一个实施方式中,tim-3-结合剂的体内半衰期介于约10天至约40天之间(例如,约10天、约13天、约16天、约18天、约20天、约23天、约26天、约29天、约30天、约33天、约37天、约38天、约39天、约40天,或前述值中任意两个所定义的范围)。
[0095]
可以使用本领域公知的任意其他适宜的测定方法检测本发明的tim-3-结合剂的稳定性,例如检测血清半衰期、差示扫描量热法(dsc)、热转移测定法和脉冲追踪测定法。在例如protein stability and folding,b.a.shirley(编著),human press,totowa,new jersey(1995);protein structure,stability,and interactions(methods in molecular biology),shiver j.w.(编著),humana press,new york,ny(2010);以及ignatova,microb.cell fact.,4:23(2005)中描述了在本发明情境下可以使用的在体内和体外检测蛋白稳定性的其他方法。
[0096]
可以根据转化中点值(tm)确定本发明的tim-3-结合剂的稳定性,tm值是50%氨基酸序列处于其天然构象,另50%变性的温度。在通常情况下,tm越高,蛋白越稳定。在本发明的一个实施方式中,本发明的tim-3-结合剂包括约60-100℃的体外转化中点值(tm)。例如,本发明的tim-3-结合剂可以包含约65-80℃(例如,66℃、68℃、70℃、71℃、75℃或79℃)、约80-90℃(例如,约81℃、85℃或89℃)或约90-100℃(例如,约91℃、约95℃或约99℃)的体外tm。
[0097]
还可以通过确定特定tim-3结合剂与tim-3或其表位的结合亲和性来评估其生物活性。术语“亲和性”是指两个试剂可逆结合的平衡常数,且其以解离常数(kd)表示。结合剂与配体的亲和性(例如,抗体与表位的亲和性)可以是例如约1皮摩尔(pm)至约100微摩尔(μm)(例如,从约1皮摩尔(pm)至约1纳摩尔(nm)、从约1nm至约1微摩尔(μm)或者从约1μm至约100μm)。在一个实施方式中,tim-3-结合剂可以以小于或等于1纳摩尔的kd(例如,0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm、0.1nm、0.05nm、0.025nm、0.01nm、0.001nm,或前述值中任意两个所定义的范围)结合tim-3蛋白。在另一个实施方式中,tim-3-结合剂可以以小于或等于200pm的kd(例如,190pm、175pm、150pm、125pm、110pm、100pm、90pm、80pm、75pm、60pm、50pm、40pm、30pm、25pm、20pm、15pm、10pm、5pm、1pm,或前述值中任意两个所定义的范围)结合tim-3。可使用本领域认可的任意测定方法检测针对目标抗原或表位的免疫球蛋白亲和性。此类方法包括例如荧光激活细胞分选法(facs)、可分离小珠法(例如,磁珠)、表面等离子共振法(spr)、溶液相竞争法(kinexa
tm
)、抗原筛选法、竞争性结合测定法和/或elisa法(参见例如,janeway等(编著),immunobiology,第5版,garland publishing,new york,ny,2001)。
[0098]
本发明的tim-3-结合剂可以单独或与其他药物联合施用。例如,tim-3-结合剂可以与用于治疗或预防本文所公开的疾病的其他药剂(例如,对癌细胞具有细胞毒性、调节癌细胞的免疫原性或促进对癌细胞的免疫应答的药剂)联合施用。在这一方面,例如,tim-3-结合剂可以与至少一种其他抗癌剂联合使用,所述抗癌剂包括例如本领域公知的任意化疗剂、电离辐射、小分子抗癌剂、癌症疫苗、生物疗法(例如,其他单克隆抗体、癌症杀伤病毒、基因疗法和过继性t细胞转移)和/或手术。当本发明的方法治疗感染性疾病时,tim-3-结合剂可以与至少一种抗菌剂或至少一种抗病毒剂联合施用。就这一方面而言,抗菌剂可以是本领域公知的任意适宜抗生素。抗病毒剂可以是特异性靶向特定病毒的任意适宜类别的任何疫苗(例如,减毒活疫苗、亚单位疫苗、重组载体疫苗)和小分子抗病毒疗法(例如,病毒复制抑制剂和核苷类似物)。当本发明的方法治疗自身免疫性疾病时,tim-3-结合剂可以与抗炎剂联合使用,抗炎剂包括例如类固醇(例如,强的松和氟替卡松)和非甾体抗炎药(nsaid)(例如,阿司匹林、布洛芬和萘普生)。
[0099]
在另一个实施方式中,当本发明的tim-3结合剂用于治疗癌症或感染性疾病时,tim-3-结合剂可以与抑制免疫检验点途径的其他药剂联合施用。例如,本发明的tim-3结合剂可以与抑制或拮抗程序性死亡1蛋白(pd-1)、淋巴细胞活化基因-3蛋白(lag-3)和/或细胞毒性t淋巴细胞相关蛋白4(ctla-4)途径的药剂联合施用。已证实同时靶向这些免疫检验点通路的两个或多个的联合治疗具有提高的和潜在协同性的抗肿瘤活性(参见例如,sakuishi等,j.exp.med.,207:2187-2194(2010);ngiow等,cancer res.,71:3540-3551(2011);以及woo等,cancer res.,72:917-927(2012))。在一个实施方式中,本发明的tim-3结合剂与结合lag-3的抗体和/或结合pd-1的抗体联合施用。在这一方面,本发明的在哺乳动物中治疗对tim-3抑制有应答的病症(例如,癌症或感染性疾病)的方法还可以包括向哺乳动物施用包含(i)结合tim-3蛋白的抗体和(ii)药学上可接受的运载体的组合物或者包含(i)结合pd-1蛋白的抗体和(ii)药学上可接受的运载体的组合物。
[0100]
除治疗用途以外,本文所述的tim-3-结合剂可以应用于诊断或研究。就这一方面而言,可以将tim-3结合剂用于诊断病症或疾病的方法,在其中tim-3不适当的表达(例如,
过表达)或活性增加导致或有助于该疾病或病症的病理作用。在类似方法中,可以将tim-3-结合剂用于监控在针对tim-3-抑制有响应的疾病或病症的受试者中tim-3蛋白水平的测试中。研究应用包括,例如利用tim-3-结合剂和标记来检测样品中(例如,在人体液或在细胞或组织提取物中)tim-3蛋白的方法。tim-3-结合剂可经或不经修饰(例如,使用可检测部分进行的共价或非共价标记)而使用。例如,可检测部分可以是放射性同位素(例如,3h、
14
c、
32
p、
35
s或
125
i)、荧光或化学发光化合物(例如,异硫氰酸荧光素、罗丹明或荧光素)、酶(例如,碱性磷酸酶、β-半乳糖苷酶或辣根过氧化物酶)或假体基团。任意用于将抗原结合剂(例如,抗体)与可检测部分分别偶联的本领域公知方法可用于本发明的情境下(参见例如,hunter等,nature,194:495-496(1962);david等,biochemistry,13:1014-1021(1974);pain等,j.immunol.meth.,40:219-230(1981);以及nygren,j.histochem.and cytochem.,30:407-412(1982))。
[0101]
可以使用本发明的tim-3-结合剂通过本领域公知的任何适宜方法检测tim-3蛋白水平。此类方法包括:例如,放射免疫测定法(ria)和facs。可以采用任意适宜技术(例如,通过在适合形成抗原-抗体复合物的条件下将包含或可能包含tim-3的样品与tim-3-特异性抗体结合)来确立tim-3的正常或标准表达值。用可检测物质对抗体进行直接或间接标记以便于结合的或未结合的抗体的检测。适宜的可检测物质包括多种酶、假体基团、荧光材料、发光材料和放射性材料(参见例如,zola,monoclonal antibodies:a manual of techniques,crc press,inc.(1987))。然后将样品中tim-3多肽的表达量与标准值进行比较。
[0102]
可以在试剂盒中提供tim-3-结合剂,即,将用于进行诊断检测的预定量的试剂与说明书打包组合。如果使用酶标记tim-3-结合剂,则试剂盒优选包括酶所需的底物和辅因子(例如,提供可检测发光团或荧光团的底物前体)。此外,在试剂盒中可以包括其他添加剂,如稳定剂、缓冲剂(例如,封闭缓冲液或裂解缓冲液)等。可以改变多种试剂的相对量以使得试剂在溶液中的浓度基本上达到检测的最佳灵敏度。试剂可以以包括赋形剂的干粉形式(典型为冻干的)提供,将其溶解后会提供具有适宜浓度的试剂溶液。
[0103]
本技术还包括以下实施方式:
[0104]
实施方式1.一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含氨基酸序列glu val gln leu leu glu ser gly gly gly leu val gln pro gly gly ser leu arg leu ser cys xaa1 ala xaa2 ser gly phe xaa3 xaa4 xaa5 thr phe ser xaa6 tyr xaa7 met xaa8 trp val arg gln ala xaa9 gly lys gly leu xaa10 trp val ser xaa11 ile ser xaa12 gly gly xaa13 tyr thr tyr tyr gln asp ser val lys gly arg phe thr ile ser arg asp asn ser lys asn thr leu tyr leu gln met asn ser leu arg xaa14 glu asp thr ala val tyr tyr cys xaa15 ser xaa16 xaa17 xaa18 xaa19 met asp tyr trp gly gln gly thr thr val thr val ser ser ala(seq id no:1),其中
[0105]
(a)xaa1缺失或者是丙氨酸(ala),
[0106]
(b)xaa2是丙氨酸(ala)、脯氨酸(pro)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)或缬氨酸(val),
[0107]
(c)子序列xaa3 xaa4 xaa5缺失或者是thr-phe-ile,
[0108]
(d)xaa6是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)或苏氨酸(thr),
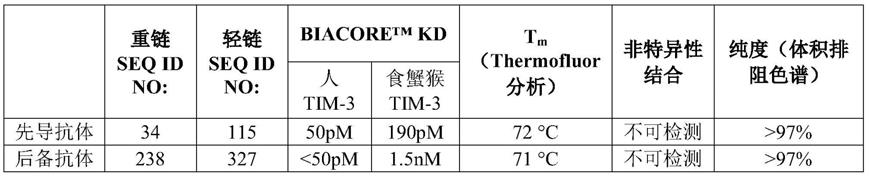
[0109]
(e)xaa7是天冬氨酸(asp)或丙氨酸(ala),
[0110]
(f)xaa8是丝氨酸(ser)或苏氨酸(thr),
[0111]
(g)xaa9是脯氨酸(pro)或亮氨酸(leu),
[0112]
(h)xaa10是天冬氨酸(asp)或谷氨酸(glu),
[0113]
(i)xaa11是苏氨酸(thr)或丙氨酸(ala),
[0114]
(j)xaa12是甘氨酸(gly)或丝氨酸(ser),
[0115]
(k)xaa13是丝氨酸(ser)、苏氨酸(thr)、天冬氨酸(asp)、甘氨酸(gly)、天冬酰胺(asn)或赖氨酸(lys),
[0116]
(l)xaa14是丙氨酸(ala)或缬氨酸(val),
[0117]
(m)xaa15丙氨酸(ala)或苏氨酸(thr),以及
[0118]
(n)子序列xaa16 xaa17 xaa18 xaa19缺失或者是pro-tyr-tyr-ala。
[0119]
实施方式2.根据实施方式1所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa3 xaa4 xaa5缺失。
[0120]
实施方式3.根据实施方式2所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:2、seq id no:3、seq id no:5-seq id no:8、seq id no:10-seq id no:12、seq id no:14-seq id no:27或seq id no:29-seq id no:44中任一项所示的氨基酸序列。
[0121]
实施方式4.根据实施方式1所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa3 xaa4 xaa5是thr-phe-ile。
[0122]
实施方式5.根据实施方式4所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:4、seq id no:9、seq id no:13和seq id no:28中任一项所示的氨基酸序列。
[0123]
实施方式6.根据实施方式1所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa16 xaa17 xaa18 xaa19缺失。
[0124]
实施方式7.根据实施方式6所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:3-seq id no:44中任一项所示的氨基酸序列。
[0125]
实施方式8.根据实施方式1所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa16 xaa17 xaa18 xaa19是pro-tyr-tyr-ala。
[0126]
实施方式9.根据实施方式8所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:2所示的氨基酸序列。
[0127]
实施方式10.一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含氨基酸序列asp ile gln met thr xaa1 ser pro ser ser leu ser ala ser val gly asp arg val thr ile thr cys arg xaa2 ser gln ser ile xaa3 xaa4 tyr leu asn trp tyr xaa5 gln lys xaa6 xaa7 lys ala pro lys leu leu xaa8 tyr xaa9 ala ser xaa10 leu gln ser gly val pro ser arg phe ser gly ser gly ser gly thr asp phe thr leu thr ile ser ser leu gln pro glu asp phe ala xaa11 tyr tyr cys gln gln xaa12 xaa13 xaa14 xaa15 pro xaa16 thr phe gly xaa17 gly thr lys xaa18 glu ile lys arg(seq id no:45),其中
[0128]
(a)xaa1是谷氨酰胺(gln)或组氨酸(his),
[0129]
(b)xaa2是丙氨酸(ala)或苏氨酸(thr),
[0130]
(c)xaa3是丝氨酸(ser)、精氨酸(arg)、天冬酰胺(asn)或苏氨酸(thr),
[0131]
(d)xaa4是丝氨酸(ser)、精氨酸(arg)、天冬氨酸(asp)、苏氨酸(thr)或甘氨酸(gly),
[0132]
(e)xaa5是谷氨酰胺(gln)或组氨酸(his),
[0133]
(f)xaa6是脯氨酸(pro)或丙氨酸(ala),
[0134]
(g)xaa7是甘氨酸(gly)、赖氨酸(lys)或精氨酸(arg),
[0135]
(h)xaa8是异亮氨酸(ile)或甲硫氨酸(met),
[0136]
(i)xaa9是丙氨酸(ala)、甘氨酸(gly)、天冬氨酸(asp)、苏氨酸(thr)、丝氨酸(ser)、缬氨酸(val)或异亮氨酸(ile),
[0137]
(j)xaa10是丝氨酸(ser)或苏氨酸(thr),
[0138]
(k)xaa11是缬氨酸(val)、甲硫氨酸(met)或丙氨酸(ala),
[0139]
(l)xaa12是丝氨酸(ser)或精氨酸(arg),
[0140]
(m)xaa13是酪氨酸(tyr)、组氨酸(his)、苯丙氨酸(phe)、天冬氨酸(asp)、丝氨酸(ser)或天冬酰胺(asn),
[0141]
(n)xaa14是丝氨酸(ser)或天冬酰胺(asn),
[0142]
(o)xaa15是苏氨酸(thr)、丝氨酸(ser)、丙氨酸(ala)或脯氨酸(pro),
[0143]
(p)xaa16是亮氨酸(leu)或组氨酸(his),
[0144]
(q)xaa17是甘氨酸(gly)、精氨酸(arg)或谷氨酸(glu),以及
[0145]
(r)xaa18是缬氨酸(val)或亮氨酸(leu)。
[0146]
实施方式11.根据实施方式10所述的分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链包含seq id no:46-seq id no:125中任一项所示的氨基酸序列。
[0147]
实施方式12.一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含氨基酸序列glu val gln xaa1 leu xaa2 xaa3 xaa4 xaa5 ser gly gly xaa6 leu xaa7 gln pro gly gly ser leu arg leu xaa8 cys xaa9 ala ser gly phe thr phe xaa10 xaa11 ser tyr xaa12 met xa13 trp val arg gln ala pro gly lys gly leu glu trp val ser xaa14 ile ser gly ser gly gly xaa15 thr tyr tyr xaa16 asp ser val lys gly xaa17 phe thr ile ser xaa18 asp asn ser xaa19 asn thr xaa20 tyr leu gln met asn xaa21 leu arg ala glu asp thr ala val tyr tyr cys xaa22 lys lys tyr tyr xaa23 xaa24 pro ala asp tyr trp xaa25 gln gly thr leu val thr val ser ser gly(seq id no:126),其中
[0148]
(a)xaa1是亮氨酸(leu)、缬氨酸(val)或甲硫氨酸(met),
[0149]
(b)子序列xaa2 xaa3 xaa4缺失或者是glu-ser-leu,
[0150]
(c)xaa5缺失或者是谷氨酸(glu),
[0151]
(d)xaa6是甘氨酸(gly)或天冬氨酸(asp),
[0152]
(d)xaa7是缬氨酸(val)或异亮氨酸(ile),
[0153]
(e)xaa8是丝氨酸(ser)或酪氨酸(tyr),
[0154]
(f)xaa9是丙氨酸(ala)或缬氨酸(val),
[0155]
(g)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、苏氨酸(thr)、天冬氨酸(asp)或甘氨酸(gly),
[0156]
(h)xaa11缺失或者是甘氨酸(gly),
[0157]
(i)xaa12是丙氨酸(ala)或苏氨酸(thr),
[0158]
(j)xaa13是丝氨酸(ser)或天冬酰胺(asn),
[0159]
(k)xaa14是丙氨酸(ala)、甘氨酸(gly)、缬氨酸(val)、丝氨酸(ser)、苯丙氨酸(phe)、异亮氨酸(ile)、苏氨酸(thr)或天冬氨酸(asp),
[0160]
(l)xaa15是丝氨酸(ser)或天冬酰胺(asn),
[0161]
(m)xaa16是丙氨酸(ala)、缬氨酸(val)或天冬酰胺(asn),
[0162]
(n)xaa17是精氨酸(arg)或谷胺酰胺(gln),
[0163]
(o)xaa18是精氨酸(arg)或赖氨酸(lys),
[0164]
(p)xaa19是赖氨酸(lys)或天冬酰胺(asn),
[0165]
(q)xaa20是亮氨酸(leu)、缬氨酸(val)、苏氨酸(thr)、甲硫氨酸(met)或脯氨酸(pro),
[0166]
(r)xaa21是丝氨酸(ser)或天冬酰胺(asn),
[0167]
(s)xaa22是丙氨酸(ala)或甘氨酸(gly),
[0168]
(t)xaa23是甘氨酸(gly)、缬氨酸(val)、天冬氨酸(asp)、丙氨酸(ala)、苏氨酸(thr)或天冬酰胺(asn),
[0169]
(u)xaa24是甘氨酸(gly)、丝氨酸(ser)、缬氨酸(val)、天冬氨酸(asp)、天冬酰胺(asn)或苏氨酸(thr),以及
[0170]
(v)xaa25是甘氨酸(gly)或天冬氨酸(asp)。
[0171]
实施方式13.根据实施方式12所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa2 xaa3 xaa4缺失。
[0172]
实施方式14.根据实施方式13所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:127-seq id no:227、seq id no:229-seq id no:231、seq id no:233-seq id no:235、seq id no:237-seq id no:243或seq id no:245-seq id no:259中任一项所示的氨基酸序列。
[0173]
实施方式15.根据实施方式12所述的分离的免疫球蛋白重链多肽,其中所述子序列xaa2 xaa3 xaa4是glu-ser-leu。
[0174]
实施方式16.根据实施方式15所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:228、seq id no:232、seq id no:236或seq id no:244所示的氨基酸序列。
[0175]
实施方式17.根据实施方式12所述的分离的免疫球蛋白重链多肽,其中xaa5缺失。
[0176]
实施方式18.根据实施方式17所述的分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含seq id no:222、seq id no:231、seq id no:235或seq id no:243中任一项所示的氨基酸序列。
[0177]
实施方式19.根据实施方式12所述的分离的免疫球蛋白重链多肽,其中xaa5是谷氨酸(glu)。
[0178]
实施方式20.根据实施方式19所述的分离的免疫球蛋白重链多肽,所述分离的免
疫球蛋白重链多肽包含seq id no:126-seq id no:221、seq id no:223-seq id no:230、seq id no:232-seq id no:234、seq id no:236-seq id no:242或seq id no:244-seq id no:259中任一项所示的氨基酸序列。
[0179]
实施方式21.一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含氨基酸序列asp ile val met thr gln ser pro asp ser leu ala val ser leu gly glu arg ala thr ile asn cys lys ser ser gln ser val leu tyr ser ser asn asn lys asn tyr leu xaa1 trp tyr xaa2 xaa3 lys pro gly gln pro pro lys leu leu ile tyr trp ala ser thr arg glu xaa4 gly val pro asp arg phe xaa5 gly ser xaa6 ser gly thr asp phe thr leu xaa7 ile xaa8 ser leu gln ala glu asp val ala val tyr tyr cys xaa9 gln tyr tyr xaa10 ser pro xaa11 thr phe gly gly gly thr lys ile glu xaa12 lys(seq id no:260),其中
[0180]
(a)xaa1是丙氨酸(ala)或苏氨酸(thr),
[0181]
(b)xaa2是谷氨酰胺(gln)或组氨酸(his),
[0182]
(c)xaa3是谷氨酰胺(gln)或组氨酸(his),
[0183]
(d)xaa4是丝氨酸(ser)、酪氨酸(tyr)、天冬氨酸(asp)、甘氨酸(gly)、苏氨酸(thr)、天冬酰胺(asn)、赖氨酸(lys)、谷氨酸(glu)、亮氨酸(leu)、脯氨酸(pro)或缬氨酸(val),
[0184]
(e)xaa5是丝氨酸(ser)或天冬酰胺(asn),
[0185]
(f)xaa6是甘氨酸(gly)、谷氨酸(glu)、丙氨酸(ala)、天冬氨酸(asp)、天冬酰胺(asn)、丝氨酸(ser)、苏氨酸(thr)或缬氨酸(val),
[0186]
(g)xaa7是苏氨酸(thr)或异亮氨酸(ile),
[0187]
(h)xaa8是丝氨酸(ser)或异亮氨酸(ile),
[0188]
(i)xaa9是谷氨酰胺(gln)或组氨酸(his),
[0189]
(j)xaa10是丝氨酸(ser)、天冬酰胺(asn)、精氨酸(arg)、甘氨酸(gly)或苏氨酸(thr),
[0190]
(k)xaa11是亮氨酸(leu)或异亮氨酸(ile),以及
[0191]
(l)xaa12是亮氨酸(leu)或缬氨酸(val)。
[0192]
实施方式22.根据实施方式21所述的分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含seq id no:261-seq id no:328中任一项所示的氨基酸序列。
[0193]
实施方式23.一种分离的核酸序列,所述分离的核酸序列编码实施方式1-9或12-20中任意一项所述的免疫球蛋白重链多肽。
[0194]
实施方式24.一种分离的核酸序列,所述分离的核酸序列编码实施方式10、11、21或22中任意一项所述的免疫球蛋白轻链多肽。
[0195]
实施方式25.一种载体,所述载体包含实施方式23或实施方式24所述的分离的核酸序列。
[0196]
实施方式26.一种t细胞免疫球蛋白和粘蛋白蛋白3(tim-3)-结合剂,所述tim-3-结合剂包含实施方式1-9或12-20中任意一项所述的免疫球蛋白重链多肽和/或实施方式10、11、21或22中任意一项所述的免疫球蛋白轻链多肽。
[0197]
实施方式27.根据实施方式26所述的tim-3-结合剂,所述tim-3-结合剂包含实施
方式1-9或12-20中任意一项所述的免疫球蛋白重链多肽和实施方式10、11、21或22中任意一项所述的免疫球蛋白轻链多肽。
[0198]
实施方式28.根据实施方式26所述的tim-3-结合剂,所述tim-3-结合剂包含实施方式1-9或12-20中任意一项所述的免疫球蛋白重链多肽或实施方式10、11、21或22中任意一项所述的免疫球蛋白轻链多肽。
[0199]
实施方式29.根据实施方式26-28中任意一项所述的tim-3-结合剂,所述tim-3-结合剂是抗体、抗体缀合物或其抗原结合片段。
[0200]
实施方式30.根据实施方式29所述的tim-3-结合剂,所述tim-3-结合剂是f(ab’)2片段、fab’片段、fab片段、fv片段、scfv片段、dsfv片段、dab片段或单链结合多肽。
[0201]
实施方式31.一种分离的核酸序列,所述分离的核酸序列编码实施方式26-30中任意一项所述的tim-3-结合剂。
[0202]
实施方式32.一种载体,所述载体包含实施方式31所述的分离的核酸序列。
[0203]
实施方式33.一种分离的细胞,所述分离的细胞包含实施方式32所述的载体。
[0204]
实施方式34.一种组合物,所述组合物包含(a)实施方式26-30中任意一项所述的tim-3-结合剂或实施方式32所述的载体以及(b)药学上可接受的运载体。
[0205]
实施方式35.一种在哺乳动物中治疗响应tim-3抑制的病症的方法,所述方法包括向患有响应tim-3抑制的病症的哺乳动物施用有效量的实施方式34所述的组合物,由此在所述哺乳动物中治疗所述病症。
[0206]
实施方式36.根据实施方式35所述的方法,其中所述病症是癌症。
[0207]
实施方式37.根据实施方式36所述的方法,其中所述癌症是黑色素瘤、肾细胞癌、肺癌、膀胱癌、乳腺癌、宫颈癌、结肠癌、胆囊癌、喉癌、肝癌、甲状腺癌、胃癌、唾液腺癌、前列腺癌,胰腺癌或默克尔细胞癌。
[0208]
实施方式38.根据实施方式35所述的方法,其中所述病症是感染性疾病。
[0209]
实施方式39.根据实施方式38所述的方法,其中所述感染性疾病是由病毒或细菌引起的。
[0210]
实施方式40.根据实施方式39所述的方法,其中所述病毒是人免疫缺陷病毒(hiv)、呼吸道合胞病毒(rsv)、流感病毒、登革热病毒或乙型肝炎病毒(hbv)。
[0211]
实施方式41.根据实施方式35所述的方法,其中所述病症是自身免疫性疾病。
[0212]
实施方式42.根据实施方式41所述的方法,其中所述自身免疫性疾病是多发性硬化症、i型糖尿病、类风湿性关节炎、硬皮病、克隆氏病、牛皮癣、系统性红斑狼疮(sle)或溃疡性结肠炎。
[0213]
实施方式43.根据实施方式35-42中任意一项所述的方法,其中所述tim-3-结合剂在所述哺乳动物中的半衰期在30分钟和45天之间。
[0214]
实施方式44.根据实施方式35-43中任意一项所述的方法,其中所述tim-3-结合剂以在约1皮摩(pm)和约100微摩(μm)之间的kd结合tim-3。
[0215]
实施方式45.根据实施方式35-44中任意一项所述的方法,所述方法还包括向所述哺乳动物施用pd-1-结合剂。
[0216]
实施方式46.根据实施方式45所述的方法,其中所述pd-1-结合剂是抗体、抗体缀合物或其抗原结合片段。
[0217]
实施方式47.根据实施方式35-46中任意一项所述的方法,所述方法还包括向所述哺乳动物施用lag-3-结合剂。
[0218]
实施方式48.根据实施方式47所述的方法,其中所述lag-3-结合剂是抗体、抗体缀合物或其抗原结合片段。
[0219]
实施方式49.一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含由seq id no:329所示的氨基酸序列组成的互补性决定区1(cdr1)、由seq id no:330所示的氨基酸序列组成的cdr2和/或由seq id no:331所示的氨基酸序列组成的cdr3。
[0220]
实施方式50.一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含由seq id no:332所示的氨基酸序列组成的cdr1、由seq id no:333所示的氨基酸序列组成的cdr2和/或由seq id no:334所示的氨基酸序列组成的cdr3。
[0221]
实施方式51.一种分离的免疫球蛋白重链多肽,所述分离的免疫球蛋白重链多肽包含由seq id no:335所示的氨基酸序列组成的cdr1、由seq id no:336所示的氨基酸序列组成的cdr2和/或由seq id no:337所示的氨基酸序列组成的cdr3。
[0222]
实施方式52.一种分离的免疫球蛋白轻链多肽,所述分离的免疫球蛋白轻链多肽包含由seq id no:338所示的氨基酸序列组成的cdr1、由seq id no:339所示的氨基酸序列组成的cdr2和/或由seq id no:340所示的氨基酸序列组成的cdr3。
[0223]
实施方式53.一种tim-3-结合剂,所述tim-3-结合剂包含实施方式49或51所述的免疫球蛋白重链多肽和/或实施方式50或52所述的免疫球蛋白轻链多肽。
[0224]
实施方式54.根据实施方式53所述的tim-3-结合剂,所述tim-3-结合剂包含实施方式49或51所述的免疫球蛋白重链多肽和实施方式50或52所述的免疫球蛋白轻链多肽。
[0225]
实施方式55.根据实施方式53所述的tim-3-结合剂,所述tim-3-结合剂包含实施方式49所述的免疫球蛋白重链多肽和实施方式50所述的免疫球蛋白轻链多肽,或者实施方式51所述的免疫球蛋白重链多肽和实施方式52所述的免疫球蛋白轻链多肽。
[0226]
实施方式56.根据实施方式53-55中任意一项所述的tim-3-结合剂,所述tim-3-结合剂是抗体、抗体缀合物或其抗原结合片段。
[0227]
实施方式57.根据实施方式56所述的tim-3-结合剂,所述tim-3-结合剂是f(ab’)2片段、fab’片段、fab片段、fv片段、scfv片段、dsfv片段、dab片段或单链结合多肽。
[0228]
以下实施例进一步说明本发明,但是当然不应将其解释为以任意方式限制本发明的范围。
[0229]
实施例1
[0230]
该实施例显示了从可进化文库鉴定针对人tim-3的抗体的方法以及所鉴定抗体的亲和性成熟。
[0231]
根据bowers等,proc.natl.acad.sci.usa,108(51):20455-20460(2011)中的描述构建基于与来源于人供体重组(d)j区连接的种系序列v-基因区段的igg可进化文库。将igg重链(hc)和轻链(lc)克隆进入独立的附加型载体(horlick等,gene,243(1-2):187-194(2000)),每个载体编码不同的抗生素选择标记。通过使用包被了hutim-3胞外域的磁珠对可进化文库的筛选,鉴定出了表达与人tim-3结合的表面展示的全人抗体的细胞。分离与tim-3特异性结合的一组抗体。
[0232]
用活化诱导的胞苷脱氨酶(aid)转染共表达在上文所述的可进化文库中鉴定出的
每个抗体的hc和lc的稳定的细胞系以引发体外shm。也将aid直接转染入由文库筛选扩增的原始混合细胞群中。在所有情况下,对细胞群进行针对igg的表达和针对与抗原的结合的染色,并以混合细胞群的形式通过流式细胞术收集,然后对其扩增以用于通过新一代测序(ngs)进行序列分析。针对每种策略,迭代重复这一过程以便在重链和轻链的可变区及其衍生物中积累来源于shm的突变。通过使用biacore
tm
的结合研究和与cho细胞系表面上呈现的tim-3的结合来表明初始文库命中抗体的成熟。
[0233]
对成熟抗体进行表征以满足治疗性抗体研发的严格要求,包括对“可开发性”标准的评估以及采用不同测定法的功能性效能评估。可开发性标准包括热稳定性、表达水平、不存在有问题的序列基序(例如,可变区n-连接糖基化位点,游离半胱氨酸,脱酰胺、异构化等的高可能性位点)。此外,选择与食蟹猴tim-3具有高亲和性结合的那些以便于进行临床前研究。鉴定出了符合进一步研发的所有标准的具有较强拮抗活性的先导和后备抗体。先导抗体含有包含seq id no:34的重链免疫球蛋白多肽和包含seq id no:115的轻链免疫球蛋白多肽,并将其命名为ape5137。ape5137的重链cdr1、cdr2和cdr3分别包含seq id no:329、330和331。ape5137的轻链cdr1、cdr2和cdr3分别包含seq id no:332、333和334。后备抗体含有包含seq id no:238的重链免疫球蛋白多肽和包含seq id no:327的轻链免疫球蛋白多肽,将其命名为ape5121。ape5121的重链cdr1、cdr2和cdr3分别包含seq id no:335、336和337。ape5121的轻链cdr1、cdr2和cdr3分别包含seq id no:338、339和340。
[0234]
表1中描述了先导和后备抗-tim-3抗体的特征。
[0235]
表1
[0236][0237]
该实施例的结果确证了一种对使用可进化文库鉴定出的针对tim-3的单克隆抗体进行亲和性成熟的方法。
[0238]
实施例2
[0239]
该实施例显示了本发明的抗-tim-3单克隆抗体在体外单独使用和与抗-pd-1抗体联用能够抑制tim-3信号转导和增强t-细胞活化。
[0240]
在与人cd4+t-细胞混合的淋巴细胞反应(mlr)测定中对显示出增强的tim-3结合性质的抗体(在实施例1中描述的那些)的功能性拮抗活性进行了检测,在所述测定中通过检测il-2的分泌情况对在存在抗-tim-3抗体的情况下cd4+t-细胞的活化进行了评估。对抗-tim-3抗体的单独使用或其与2ng/ml或20ng/ml拮抗性抗-pd-1抗体的联合使用进行了测试。具体来说,将从人供体分离的外周血单核细胞分化成树突状细胞(dc),然后将其与从第二供体分离的cd4+t-细胞混合。48小时后检测il-2水平。通过检测到il-2产生的增加,预期tim-3单独的拮抗作用以及与pd-1的拮抗作用的联合会导致t-细胞活化的增加。如图1a-1d中所示,在mlr测定中,在48小时时,抗-tim-3抗体单独使用和其与抗-pd1抗体联用增加了il-2的分泌,抗-tim-3抗体与抗-pd-1抗体的联用显示出增加的活性。
[0241]
该实施例的结果表明本发明的tim-3结合剂单独使用及与免疫系统其他负性调节
剂的拮抗剂联用能够抑制tim-3的生物活性。
[0242]
实施例3
[0243]
该实施例显示了在同基因型小鼠肿瘤模型中抗-tim-3抗体拮抗了tim-3的活性。
[0244]
识别小鼠pd-1(rmp1-14)和小鼠tim-3(rmt3-23)的替代大鼠抗体购自bio x cell(西黎巴嫩,美国新罕布什尔州)并且在mc38同基因型肿瘤模型中对其的单独使用和联合使用进行了测试。具体来说,将mc38结肠腺癌细胞(1x106s.c.)植入c57bl/6小鼠并使其生长10天。将测定具有40-90mm3肿瘤的小鼠随机分成4组(将随机分组当天指定为第1天),每组10只动物并在第1、4、8和11天以10mg/kg的量施用各抗体。将注射pbs的小鼠作为对照。每周两次测定肿瘤体积直至达到2000mm3,将其确定为终点,在此时处死小鼠。该实验的结果如图2a-2d中所示,并且显示了替代抗-pd-1和替代抗-tim-3抗体的联用在小鼠模型中能够抑制肿瘤生长,提示了对免疫检验点通路的双重阻断能够增加临床效能。
[0245]
实施例4
[0246]
该实施例显示了在同基因型小鼠肿瘤模型中抗体的同种型对抗-tim-3抗体的单独使用或其与抗-pd-1抗体的联用的抗肿瘤活性的某些影响。
[0247]
自实施例3中测试过的大鼠抗体各自构建具有小鼠igg1(d265a)和小鼠igg2同种型的识别小鼠pd-1和小鼠tim-3的替代大鼠/小鼠嵌合抗体。在mc38同基因型肿瘤模型中测试了这些抗体的单独使用和其与具有小鼠igg1(d265a)同种型的抗-pd-1抗体的联合使用。具体来说,将mc38结肠腺癌细胞(1x106s.c.)植入c57bl/6小鼠并使其生长8天。如表2中所示,将测定具有40-80mm3肿瘤的小鼠随机分成7组(将随机分组当天指定为第1天),每组10只动物,并在第1、4、8和11天施用各抗体或抗体的组合。将注射了对应的不识别任何小鼠抗原的同种型对照抗体的小鼠作为对照(第1组和第2组)。每周两次测定肿瘤体积直至达到2000mm3,将其确定为终点,在此时处死小鼠。
[0248]
表2
[0249][0250][0251]
图3中显示了该实验的中期结果,其表明具有效应器功能(即igg2a)的抗-小鼠tim-3抗体单一药剂与具有极小效应器功能(即igg1(d265a))的抗-小鼠tim-3抗体单一药剂相比具有增加的抗肿瘤活性。此外具有极小效应器功能(即igg1(d265a))的抗-小鼠tim-3抗体与抗-小鼠pd-1igg1(d265a)抗体的联用方案,与单独的抗-小鼠pd-1igg1(d265a)抗体相比,显示出略有增加的抗肿瘤活性。具有全部效应器功能(igg2a)的抗-小鼠tim-3抗体与抗-小鼠pd-1igg1(d265a)抗体的联用显示出与抗-小鼠pd-1igg1(d265a)抗体的单独使用相似的抗肿瘤活性。
[0252]
该实施例的结果表明具有不同同种型而且更有甚者具有不同水平的效应器功能的抗-小鼠tim-3抗体和抗-小鼠pd-1抗体的单独使用和联用均能够在小鼠模型中抑制肿瘤生长。数据还表明在一些实施方式中仅具有极小效应器功能的抗体(或其片段)单独施用或与其他抗体(或其片段,其可以或可以不显示出显著的效应器功能)联合施用能够提供有效的治疗。
[0253]
在本文中引用的所有参考文献,包括出版物、专利申请和专利,都通过引用并入本文,对每篇参考文献的引用都以如同单独并具体地指出了其通过引用的方式并且以与在本文中将其完整地列出相同的程度并入本文。
[0254]
在本发明描述的上下文中(特别是在随后的权利要求书的上下文中),除非在本文中另有说明或者与上下文明显矛盾,术语“一(a)”和“一个(an)”和“所述(the)”和“至少一种”以及相似指示词的使用应理解为包括单数和复数。除非在本文中另有说明或者与上下文明显矛盾,当使用的术语“至少一种”后接一项或多项列举项(例如,“至少一种a和b”)时,应理解为表示选自所列项的一项(a或b)或者所列项中两项或多项的任意组合(a和b)。除非另有注明,术语“包含”“具有”“包括”以及“含有”都应理解为开放性术语(即,意思是“包括,但不限于”)。除非在本文中另有说明,本文中对数值范围的描述仅仅旨在作为对每个落在该范围内的单个数值的单独列举的简略写法,且每个单个数值以如同在本文中单独列举的方式并入本说明书。除非在本文中另有说明或者与上下文明显矛盾,所有在本文中描述的方法都可以按照任何适当的顺序进行。除非权利要求另有要求,在本文中任何和所有的实施例或示例性语言(如,“例如”)的使用,都仅旨在更好地阐明本发明,而不是在本发明的范围上加以限制。说明书中的任何语言都不应被理解为用于表明任何未在权利要求中要求保护的元素为实施本发明所必需的。
[0255]
本文描述了本发明的优选实施方式,包括发明人所知晓的实施本发明的最佳方式。在对上述说明书阅读的基础上,那些优选实施方式的变体对本领域普通技术人员而言是显而易见的。发明人预期熟练技术人员可以根据需要应用这样的变体,且发明人有意以本文中具体描述的方式以外的方式实施本发明。因此,本发明包括由适用法律所准许的本发明所附权利要求中所述主题的所有修饰和等同。而且,除非在本文中另有说明或者与上下文明显矛盾,本发明包括以上所述元素的所有可能的变体的任意组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1