裂环羽扇豆烷衍生物及其在制备多靶点铁死亡诱导剂中的应用
1.本发明涉及药物技术领域,具体涉及一种裂环羽扇豆烷衍生物及其在制备多靶点铁死亡诱导剂中的应用。
背景技术:
2.细胞死亡在个体的发育、稳态平衡以及疾病发展中起着重要的作用。细胞死亡方式主要包括凋亡和坏死两大类。随着研究的深入,越来越多的细胞死亡方式被发现,如自噬、失巢凋亡、沃勒变性、内亡和焦亡等。铁死亡作为一种新近发现的程序性细胞坏死方式,参与了多种疾病如癌症、神经系统疾病、心脑血管疾病等的发生和发展过程,通过诱导或抑制铁死亡可以有效干预疾病。铁死亡本质为铁含量增多引发膜脂质过氧化物大量积累,脂质过氧化物进一步分解为醛和活性氧等活性衍生物,这些衍生物破坏了胞内蛋白、脂质及核酸等生物大分子并最终导致细胞死亡(hassanniab等,cancer cell,2019,35:830-849.)。
3.铁死亡在形态学特征、生化特征以及调控基因等方面与凋亡、自噬、坏死和焦亡存在明显差异。在形态学上,铁死亡表现为线粒体膜密度增加,线粒体嵴变少甚至消失,细胞体积变小但核体积正常且无核浓缩现象,这是铁死亡区别于其他细胞死亡方式的主要形态特征(dixon sj等,cell,2012,149(5):1060-1072.)。
4.从生化角度分析铁死亡发生的机制,主要分为三大类:铁代谢途径、氨基酸代谢途径和脂质代谢途径(song s等,histology and histopathology,2021,36:383397.)。脂质链式氧化是导致铁死亡的直接原因(hassanniab等,cancer cell,2019,35:830-849.),在此过程中,脂质氧化代谢和脂质合成代谢起到了重要作用。
5.脂质氧化代谢失调导致过氧化脂质积累,并诱导铁死亡的发生。脂质氧化代谢主要受nadph氧化酶(nox)、脂氧合酶(lox)、铁离子与亚铁离子调控。其中nox有三种调控途径:二肽基肽酶4(dpp4)与p53途径,花生四烯酸(aa)与蛋白激酶c途径和hippo信号通路途径;lox家族中对脂质代谢影响较大的主要为lox5、lox12、lox15;铁离子主要受转铁蛋白受体(tfrc)、铁蛋白1(fth1)、核受体共激活子4(ncoa4)调节,亚铁离子主要受steap3金属还原酶调控,提高细胞内铁离子中亚铁离子占比可以显著提高细胞对铁死亡的敏感性。脂质还可以发生还原反应,从而抑制铁死亡发生,反之抑制脂质的还原过程则能促进铁死亡。脂质还原主要受铁死亡抑制蛋白1(fsp1)、谷胱甘肽过氧化物酶4(gpx4)调控(li j等,cell death dis,2020,11:88.)。gpx4通过消耗gsh将脂肪酸、磷脂和胆固醇等复合脂质中的过氧化物还原为稳定的羟基脂质,从而抑制细胞膜的链式氧化,gpx4活性和表达水平受多个基因调控,包括但不限于系统x
c-(包括轻链亚基slc7a11和重链亚基slc3a2)、p53、sat1、dpp4、bap1、组蛋白h2a、mtor、oct1等。
6.与脂质氧化代谢不同,脂质合成代谢往往通过调控脂质中不饱和脂肪酸含量,间接对铁死亡造成影响。其中长链脂肪酰辅酶a合成酶4(acsl4)与溶血磷脂酰胆碱基转移酶3
(lpcat3)是调节铁死亡的重要途径(zouy等,nat commun,2019,10:1617.)。acsl4是lpcat3的上游限速酶。acsl4优先活化aa和二十碳五烯酸,形成长链多不饱和酯酰辅酶a。acsl4的过度表达会上调细胞内长链多不饱和酯酰辅酶a水平,促进肿瘤细胞增殖,同时也增加膜表面的氧化磷脂含量,从而提高肿瘤细胞对铁死亡诱导剂的敏感性。lpcat3高表达会上调质膜中多不饱和脂肪酸含量,从而提高细胞对铁死亡的敏感度。acsl4和lpcat3的表达水平可作为一类铁死亡敏感性指标,用于预测不同肿瘤细胞铁死亡敏感性(hassannia b等,cancer cell,2019,35:830-849.)。
7.羽扇豆烷型(lupane type)三萜及其皂苷主要分布于豆科、五加科、葫芦科、石竹科、伞形科、桦木科、木犀科、卫矛科等植物中。现代药理研究表明,该类化合物具有抗炎、抗肿瘤、抗病毒、抗氧化、抗菌、提高免疫力(amiri s等,biotechnoladv,2020,38:107409.)等作用。近年来,越来越多结构复杂、新颖的羽扇豆烷型三萜被发现。骨架上不同位置的取代、环裂解、降碳、重排等类型的新三萜化合物及多个糖连接的复杂三萜皂苷的发现及活性研究,已经成为天然产物的研究热点。
技术实现要素:
8.基于上述内容,本发明提供一种裂环羽扇豆烷衍生物及其在制备多靶点铁死亡诱导剂中的应用。
9.本发明的技术方案之一,一种裂环羽扇豆烷衍生物,结构式如式ⅱ或式ⅲ所示:
[0010][0011]
其中rb选自以下结构中的任意一种:
[0012][0013]
rc选自c1-c9烷基;
[0014]
x为:-(ch2)
n-,其中n取1-10中的任意整数。
[0015]
本发明的技术方案之二,上述裂环羽扇豆烷衍生物的制备方法,包括以下步骤:
[0016]
式ⅰ所示化合物先和br-x-br发生取代反应,再和r
b-h发生取代反应得到式ⅱ所示化合物;反应方程式如下:
[0017][0018]
式ⅰ所示化合物和r
c-oh发生酯交换反应,然后和br-x-br发生取代反应,再和r
b-h发生取代反应得到式ⅲ所示化合物;反应方程式如下:
[0019][0020]
进一步地,所述取代反应在苄基三乙基溴化铵、碳酸钠存在条件下搅拌进行;
[0021]
进一步地,所述酯交换反应在酸性条件下加热回流。
[0022]
本发明的技术方案之三,上述裂环羽扇豆烷衍生物在制备多靶点铁死亡诱导剂中的应用。
[0023]
进一步地,所述多靶点为抑制gpx4的同时激活acsl4和lpcat3。
[0024]
本发明的技术方案之四,一种药物组合物,包含以下物质中的任意一种或多种:式ⅱ或式ⅲ所述的裂环羽扇豆烷衍生物、式ⅱ或式ⅲ所述的裂环羽扇豆烷衍生物的光学异构体、式ⅱ或式ⅲ所述的裂环羽扇豆烷衍生物药学上可接受的盐、式ⅱ或式ⅲ所述的裂环羽扇豆烷衍生物溶剂化物。
[0025]
进一步地,还包括药学上可接受的载体;所述多靶点铁死亡诱导剂为片剂、丸剂、半固体制剂或液体制剂。
[0026]
进一步地,所述载体选自以下材料中的任意一种或多种:蛋白、叶酸、抗体、纳米材料;
[0027]
进一步地,所述药物组合物为片剂时,还包括以下材料中的任意一种或多种:黏合剂、填充剂、崩解剂、润滑剂;
[0028]
进一步地,所述药物组合物为丸剂时,还包括以下材料中的任意一种或多种:酒、醋、药汁;
[0029]
进一步地,所述药物组合物为半固体制剂时,还包括基质;
[0030]
进一步地,所述药物组合物为液体制剂时,还包括以下材料中的任意一种或多种:防腐剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂。
[0031]
本发明的技术方案之五,上述药物组合物的应用,具体的,用于制备预防、治疗或缓解gpx、acsl4和lpcat3介导相关的肿瘤的药物。
[0032]
本发明的技术方案之五,上述药物组合物的应用,具体的,用于制备gpx4抑制剂,或acsl4和lpcat3激动剂。
[0033]
与现有技术相比,本发明的有益效果:
[0034]
本发明所涉及的裂环羽扇豆烷衍生物是目前羽扇豆烷型三萜类化合物中的两种特殊的3,4-裂环3,11-环合羽扇豆烷型三萜(通式ii)和1,4-呋喃氧环羽扇豆烷型三萜(通式iii)类衍生物。在此结构基础上,运用化学手段进行结构修饰和改造,形成了一类具有多靶点铁死亡诱导剂样作用的裂环羽扇豆烷衍生物。
[0035]
本发明运用半合成的方式得到了一系列新颖的多靶点铁死亡诱导剂,所述的多靶点为抑制gpx4的同时激活acsl4和lpcat3,可用于预防、治疗或缓解gpx4、acsl4和lpcat3介导的相关疾病。通过药理实验验证了其gpx4抑制剂,acsl4和lpcat3激动剂作用,可以通过进一步的实验将此类化合物开发为应用于预防、治疗或缓解gpx4、acsl4和lpcat3介导的相关疾病的药物。
[0036]
本发明所涉及的能够抑制gpx4的同时激活acsl4和lpcat3的裂环羽扇豆烷衍生物的结构基础在于:(1)片段1:3,4-裂环3,11-环合羽扇豆烷型三萜(ii的母核),或1,4-呋喃氧环羽扇豆烷型三萜(iii的母核);(2)片段2:色胺衍生物n=1-10,y为-h/5-f/5-oh/5-ome/3-oph;(3)上述片段1与片段2通过片段1的28位以酯键相连。以上条件均为本发明所涉及裂环羽扇豆烷衍生物具有“抑制gpx4的同时激活acsl4和lpcat3”活性的必要条件。片段1和片段2的结构发生变化,以及片段1和片段2连接位置发生改变,如片段2连接在片段1的c-1和/或c11,均无法达到具有本发明所述的“抑制gpx4的同时激活acsl4和lpcat3”活性。
附图说明
[0037]
图1为本发明实施例中裂环羽扇豆烷衍生物对肿瘤细胞的迁移和侵袭能力的影响;
[0038]
图2为本发明实施例中裂环羽扇豆烷衍生物对肿瘤细胞内ros水平的影响;
[0039]
图3为本发明实施例中裂环羽扇豆烷衍生物对肿瘤细胞相关蛋白活性的影响。
具体实施方式
[0040]
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
[0041]
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
[0042]
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
[0043]
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
[0044]
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
[0045]
本发明所包括的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面所列举的具体实施方式、结合其他化学合成方法所形成的实施方式以及本领域技术人员所熟知的同等替换方式。其中优选的实施方式包括但不限于本发明的实施方式。
[0046]
本发明以下实施例中,所使用的溶剂及其合成药品可经市售所得。所用的缩写具
有如下各自的定义:ac,丙酮;acn,乙腈;meoh,甲醇;etoh,乙醇;proh,丙醇;peoh,戊醇;heoh,庚醇;naoh,氢氧化钠;hcl,盐酸;teba:苄基三乙基溴化铵;reflux,回流;stir,搅拌。
[0047]
实施例1:化合物i(chiisanogenin)的制备
[0048][0049]
将chiisanoside(1910mg,2.0mmol)溶于10%氢氧化钠甲醇溶剂中,加热回流4h,盐酸中和反应液并使酸过量,加热搅拌1h,减压回收溶剂,固体粉末,硅胶柱层析分离,干燥后得白色固体(chiisanogenin,i)364mg,收率为75%。c
30h44
o5.ms:[m]
+
484.31969.1h nmr(300mhz,chloroform-d)δ5.23(1h),4.80(1h),4.76(2h),4.70(1h),4.15
–
4.07(m,1h),3.88(1h),2.82(1h),2.64(1h),2.53(1h),2.01(1h),1.91
–
1.82(m,2h),1.80
–
1.35(m,16h),1.75(s,3h),1.62(s,3h),1.08(s,3h),1.03(s,3h),0.97(s,3h)。
[0050]
实施例2:通式ⅱ中
ⅱ‑
1、
ⅱ‑
2、
ⅱ‑
3、
ⅱ‑
4和
ⅱ‑
5化合物的合成
[0051][0052]
将化合物i(485mg,1.0mmol)溶于ac(10ml)中,加入1,3-二溴丙烷(606μl,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
1)472mg,收率为78%。c
33h49
bro5.ms:[m]
+
604.27659.1h nmr(300mhz,chloroform-d)δ5.23(1h),4.83(1h),4.76(2h),4.70(1h),4.24(2h),4.18
–
4.08(m,1h),3.88(1h),3.46(2h),2.83(1h),2.66(1h),2.54(1h),2.19(2h),2.08
–
1.79(m,4h),1.76(s,3h),1.69(s,3h),1.74
–
1.36(m,15h),1.08
(s,3h),1.02(s,3h),0.96(s,3h).
[0053]
化合物
ⅱ‑
2、
ⅱ‑
3、
ⅱ‑
4和
ⅱ‑
5的合成与
ⅱ‑
1相同,只是把1,3-二溴丙烷换为1,4/1,5/1,6/1,10-二溴烷烃。反应后减压回收,层析分离得到化合物
ⅱ‑
2(505mg,收率为82%)。c
34h51
bro5.ms:[m]
+
618.29199.1h nmr(300mhz,chloroform-d)δ5.26(1h),4.84(1h),4.79(2h),4.75(1h),4.20
–
4.09(m,3h),3.89(1h),3.45(2h),2.84(1h),2.66(1h),2.55(1h),2.19(2h),2.06
–
1.80(m,6h),1.75(s,3h),1.71(s,3h),1.73
–
1.35(m,15h),1.08(s,3h),1.01(s,3h),0.99(s,3h);
[0054]
化合物
ⅱ‑
3(475mg,收率为75%)。c
35h53
bro5.ms:[m]
+
632.30764.1h nmr(300mhz,chloroform-d)δ5.24(1h),4.83(1h),4.78(2h),4.72(1h),4.20
–
4.09(m,3h),3.88(1h),3.45(2h),2.84(1h),2.66(1h),2.53(1h),2.19(2h),2.08
–
1.78(m,4h),1.76(s,3h),1.71(s,3h),1.73
–
1.34(m,19h),1.09(s,3h),1.02(s,3h),0.95(s,3h);
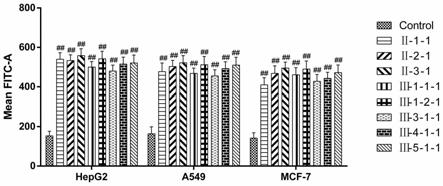
[0055]
化合物
ⅱ‑
4(538mg,收率为83%)。c
36h55
bro5.ms:[m]
+
646.32329.1h nmr(300mhz,chloroform-d)δ5.23(1h),4.85(1h),4.80(2h),4.72(1h),4.19
–
4.06(m,3h),3.86(1h),3.45(2h),2.82(1h),2.67(1h),2.54(1h),2.18(2h),2.04
–
1.76(m,4h),1.74(s,3h),1.69(s,3h),1.72
–
1.33(m,21h),1.08(s,3h),1.02(s,3h),0.98(s,3h);
[0056]
化合物
ⅱ‑
5(563mg,收率为80%)。c
40h63
bro5.ms:[m]
+
702.38589.1h nmr(300mhz,chloroform-d)δ5.26(1h),4.85(1h),4.79(2h),4.74(1h),4.18
–
4.10(m,3h),3.86(1h),3.48(2h),2.84(1h),2.66(1h),2.55(1h),2.18(2h),2.08
–
1.80(m,4h),1.76(s,3h),1.72(s,3h),1.73
–
1.35(m,29h),1.10(s,3h),1.03(s,3h),0.99(s,3h)。
[0057]
实施例3:通式
ⅱ‑
1-1化合物的合成
[0058][0059]
将化合物
ⅱ‑
1(606mg,1.0mmol)溶于acn(10ml)中,加入5-氟色胺(535mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
1-1)464mg,收率为66%。c
43h59
fn2o5.ms:[m]
+
702.44080.1h nmr(300mhz,chloroform-d)δ7.26(1h),7.22(1h),7.04(1h),6.95(1h),5.24(1h),4.85(1h),4.80(2h),4.71(1h),4.25(2h),4.16
–
4.08(m,1h),4.05(2h),3.88(1h),3.06(2h),2.93
–
2.86(m,2h),2.84(1h),2.68(1h),2.56(1h),2.18(2h),2.08
–
1.77(m,4h),1.75(s,3h),1.70(s,3h),1.74
–
1.35(m,17h),1.09(s,3h),1.02(s,3h),0.96(s,3h)。
[0060]
实施例4:通式
ⅱ‑
2-1化合物的合成
[0061][0062]
将化合物
ⅱ‑
2(620mg,1.0mmol)溶于acn(10ml)中,加入5-羟色胺(529mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收
溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
2-1)515mg,收率为72%。c
44h62
n2o6.ms:[m]
+
714.46079.1h nmr(300mhz,chloroform-d)δ7.08(1h),6.96
–
6.87(m,2h),6.73(1h),5.26(1h),4.85(1h),4.80(2h),4.75(1h),4.18
–
4.10(m,3h),4.02(2h),3.88(1h),3.05(2h),2.95
–
2.81(m,3h),2.67(1h),2.54(1h),2.17(2h),2.12
–
1.79(m,6h),1.76(s,3h),1.69(s,3h),1.73
–
1.32(m,17h),1.08(s,3h),1.01(s,3h),0.99(s,3h)。
[0063]
实施例5:通式
ⅱ‑
3-1化合物的合成
[0064][0065]
将化合物
ⅱ‑
3(634mg,1.0mmol)溶于acn(10ml)中,加入色胺(481mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
3-1)492mg,收率为69%。c
45h64
n2o5.ms:[m]
+
712.48152.1h nmr(300mhz,chloroform-d)δ7.66
–
7.61(m,1h),7.46(1h),7.28(1h),7.10(1h),6.95(1h),5.25(1h),4.83(1h),4.78(2h),4.71(1h),4.15
–
4.02(m,3h),4.01(2h),3.88(1h),3.46(2h),3.03(2h),2.92
–
2.78(m,4h),2.67(1h),2.55(1h),2.18(2h),2.5
–
1.77(m,4h),1.76(s,3h),1.71(s,3h),1.74
–
1.33(m,21h),1.10(s,3h),1.03(s,3h),0.99(s,3h)。
[0066]
实施例6:通式
ⅱ‑
4-1化合物的合成
[0067][0068]
将化合物
ⅱ‑
4(648mg,1.0mmol)溶于acn(10ml)中,加入5-甲氧基色胺(580mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
4-1)492mg,收率为65%。c
47h68
n2o6.ms:[m]
+
756.50774.1hnmr(300mhz,chloroform-d)δ7.21(1h),6.98
–
6.92(m,2h),6.89(1h),5.23(1h),4.84(1h),4.78(2h),4.71(1h),4.14
–
4.02(m,3h),4.00(2h),3.86(1h),3.81(s,2h),3.45(2h),3.03(2h),2.93
–
2.80(m,2h),2.84(1h),2.67(1h),2.52(1h),2.20(2h),2.08
–
1.78(m,4h),1.76(s,3h),1.70(s,3h),1.75
–
1.35(m,23h),1.08(s,3h),1.03(s,3h),0.95(s,3h)。
[0069]
实施例7:通式
ⅱ‑
5-1化合物的合成
[0070][0071]
将化合物
ⅱ‑
5(704mg,1.0mmol)溶于acn(10ml)中,加入7-苄氧色胺(799mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收
溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅱ‑
5-1)543mg,收率为62%。c
56h78
n2o6.ms:[m]
+
874.58599.1h nmr(300mhz,chloroform-d)δ8.46(1h),7.53(1h),7.36
–
7.25(m,3h),7.11(1h),7.05
–
6.97(m,2h),6.86(2h),5.22(1h),4.84(1h),4.76(2h),4.72(1h),4.20
–
4.09(m,3h),4.06(2h),3.87(1h),3.48(2h),3.05(2h),2.92
–
2.81(m,2h),2.84(1h),2.66(1h),2.55(1h),2.16(2h),2.03
–
1.77(m,4h),1.75(s,3h),1.70(s,3h),1.73
–
1.32(m,31h),1.087(s,3h),1.01(s,3h),0.97(s,3h)。
[0072]
实施例8:通式
ⅲ‑
1、
ⅲ‑
2、
ⅲ‑
3、
ⅲ‑
4和
ⅲ‑
5化合物的合成
[0073][0074]
将i(485mg,1.0mmol)溶于80%meoh 6%hcl水溶液(30ml)中,随后加热回流4h,反应结束后取出,减压回收溶剂,干燥后得淡黄色粉末(
ⅲ‑
1)398mg,收率为77%。c
31h48
o6.ms:[m]
+
516.34509.1h nmr(300mhz,chloroform-d)δ4.82(1h),4.74(1h),4.23
–
4.11(m,2h),3.66(s,2h),3.43(1h),2.71
–
2.56(m,2h),2.20(1h),2.08(1h),2.04(1h),1.96(1h),1.85(1h),1.83
–
1.44(m,16h),1.25(s,3h),1.14(s,3h),1.09(s,3h),1.02(s,3h),0.96(s,3h)。
[0075]
将反应式中80%meoh 6%hcl水溶液换为80%etoh(或proh或peoh或heoh)6%hcl水溶液,分别获得以下产物:
[0076]
白色粉末(
ⅲ‑
2)324mg,收率为61%。c
32h50
o6.ms:[m]
+
530.36074.1h nmr(300mhz,chloroform-d)δ4.83(1h),4.75(1h),4.25
–
4.14(m,4h),3.45(1h),2.69
–
2.55(m,2h),2.22(1h),2.10(1h),2.05(1h),1.97(1h),1.86(1h),1.82
–
1.45(m,16h),1.26(s,3h),1.22(s,3h),1.15(s,3h),1.10(s,3h),1.03(s,3h),0.97(s,3h);
[0077]
白色粉末(
ⅲ‑
3)365mg,收率为67%。c
33h52
o6.ms:[m]
+
544.37639.1h nmr(300mhz,chloroform-d)δ4.83(1h),4.72(1h),4.23
–
4.10(m,2h),4.06(2h),3.43(1h),2.66
–
2.54
(m,2h),2.21(1h),2.09(1h),2.03(1h),1.9(17h),1.85(1h),1.84
–
1.33(m,18h),1.23(s,3h),1.14(s,3h),1.07(s,3h),1.00(s,3h),0.96(s,3h),0.92(s,3h);
[0078]
黄色粉末(
ⅲ‑
4)395mg,收率为69%。c
35h56
o6.ms:[m]
+
572.40769.1h nmr(300mhz,chloroform-d)δ4.85(1h),4.75(1h),4.26
–
4.14(m,2h),4.03(2h),3.46(1h),2.69
–
2.54(m,2h),2.20(1h),2.08(1h),2.04(1h),1.97(1h),1.86(1h),1.82
–
1.36(m,22h),1.23(s,3h),1.16(s,3h),1.08(s,3h),1.01(s,3h),0.96(s,3h),0.88(s,3h);
[0079]
淡黄色粉末(
ⅲ‑
5)373mg,收率为62%。c
37h60
o6.ms:[m]
+
600.43899.1hnmr(300mhz,chloroform-d)δ4.80(1h),4.74(1h),4.22
–
4.09(m,2h),4.01(2h),3.43(1h),2.66
–
2.58(m,2h),2.20(1h),2.07(1h),2.02(1h),1.96(1h),1.85(1h),1.82
–
1.26(m,26h),1.25(s,3h),1.16(s,3h),1.07(s,3h),1.00(s,3h),0.97(s,3h),0.86(s,3h)。
[0080]
实施例9:通式
ⅲ‑
1-1和
ⅲ‑
1-1-1化合物的合成
[0081][0082]
将化合物
ⅲ‑
1(517mg,1.0mmol)溶于ac(10ml)中,加入1,3-二溴丙烷(606μl,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
1-1)491mg,收率为77%。c
34h53
bro6.ms:[m]
+
636.30255.1h nmr(300mhz,chloroform-d)δ4.85(1h),4.76(1h),4.24
–
4.12(m,4h),3.65(s,2h),3.47(2h),3.43(1h),2.67
–
2.55(m,2h),2.25
–
2.17(m,2h),2.20(1h),2.07(1h),2.03(1h),1.98(1h),1.86(1h),1.83
–
1.42(m,16h),1.26(s,3h),1.18(s,3h),1.10(s,3h),1.03(s,3h),0.97(s,3h)。
[0083]
将化合物
ⅲ‑
1-1(638mg,1.0mmol)溶于acn(10ml)中,加入5-甲氧基色胺(580mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
1-1-1)471mg,收率为63%。c
45h66
n2o7.ms:[m]
+
746.48700.1h nmr(300mhz,chloroform-d)δ7.23(1h),6.97
–
6.92(m,2h),6.88(1h),4.82(1h),4.77(1h),4.25
–
4.11(m,4h),4.05(2h),3.84(s,3h),3.68(s,2h),3.42(1h),3.05(2h),2.93
–
2.81(m,2h),2.66
–
2.54(m,2h),2.27
–
2.17(m,2h),2.21(1h),2.09(1h),2.05(1h),1.95(1h),1.88(1h),1.83
–
1.36(m,18h),1.23(s,3h),1.15(s,3h),1.08(s,3h),1.00(s,3h),0.95(s,3h)。
[0084]
实施例10:通式
ⅲ‑
1-2和
ⅲ‑
1-2-1化合物的合成
[0085][0086]
将化合物
ⅲ‑
1(517mg,1.0mmol)溶于ac(10ml)中,加入1,5-二溴戊烷(690mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
1-2)479mg,收率为72%。c
36h57
bro6.ms:[m]
+
664.33385.1h nmr(300mhz,chloroform-d)δ4.80(1h),4.75(1h),4.23
–
4.10(m,4h),3.65(s,2h),3.43(2h),2.84(1h),2.66
–
2.54(m,2h),2.20(1h),2.05(1h),1.98(1h),1.85(1h),1.84
–
1.41(m,22h),1.25(s,3h),1.16(s,3h),1.08(s,3h),1.03(s,3h),0.97(s,3h)。
[0087]
将化合物
ⅲ‑
1-2(666mg,1.0mmol)溶于acn(10ml)中,加入色胺(481mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
1-2-1)477mg,收率为64%。c
46h68
n2o6.ms:[m]
+
744.50774.1h nmr(300mhz,chloroform-d)δ7.66
–
7.58(m,1h),7.42(1h),7.26(1h),7.07(1h),4.82(1h),4.76(1h),4.24
–
4.03(m,6h),3.66(s,2h),3.05(h),2.95
–
2.82(m,3h),2.70
–
2.58(m,2h),2.22(1h),2.06(1h),1.96(1h),1.86(1h),1.84
–
1.42(m,24h),1.23(s,3h),1.16(s,3h),1.09(s,3h),1.00(s,3h),0.96(s,3h)。
[0088]
实施例11:通式
ⅲ‑
2-1和
ⅲ‑
2-1-1化合物的合成
[0089][0090]
将化合物
ⅲ‑
2(531mg,1.0mmol)溶于ac(10ml)中,加入1,4-二溴丁烷(648mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
2-1)525mg,收率为80%。c
34h53
bro6.ms:[m]
+
664.33385.1h nmr(300mhz,chloroform-d)δ4.82(1h),4.75(1h),4.25
–
4.12(m,6h),3.45
–
3.34(m,3h),2.71
–
2.56(m,2h),2.20(1h),2.07(1h),2.02(1h),1.96
–
1.44(m,22h),1.25(s,3h),1.23(s,3h),1.15(s,3h),1.06(s,3h),0.99(s,3h),0.95(s,3h)。
[0091]
将化合物
ⅲ‑
2-1(666mg,1.0mmol)溶于acn(10ml)中,加入7-苄氧色胺(799mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
2-1-1)502mg,收率为60%。c
52h72
n2o7.ms:[m]
+
836.53395.1h nmr(300mhz,chloroform-d)δ7.55(1h),7.38
–
7.32(m,2h),7.31(1h),7.12(1h),7.06
–
6.99(m,2h),6.88(2h),4.80(1h),4.73(1h),4.25
–
4.10(m,8h),3.43(1h),2.68
–
2.55(m,2h),2.20(1h),2.10(1h),2.05(1h),1.99(1h),1.87(1h),1.85
–
1.47(m,20h),1.26(s,3h),1.23(s,3h),1.15(s,3h),1.08(s,3h),1.03(s,3h),0.97(s,3h)。
[0092]
实施例12:通式
ⅲ‑
3-1和
ⅲ‑
3-1-1化合物的合成
[0093][0094]
将化合物
ⅲ‑
3(545mg,1.0mmol)溶于ac(10ml)中,加入1,5-二溴戊烷(690mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
3-1)527mg,收率为76%。c
38h61
bro6.ms:[m]
+
692.36515.1h nmr(300mhz,chloroform-d)δ4.82(1h),4.74(1h),4.23
–
4.00(m,6h),3.46(2h),3.43(1h),2.65
–
2.53(m,2h),2.20(1h),2.08(1h),2.02(1h),1.96(1h),1.85(1h),1.81
–
1.34(m,24h),1.24(s,3h),1.16(s,3h),1.09(s,3h),1.03(s,3h),0.97(s,3h),0.92(s,3h)。
[0095]
将化合物
ⅲ‑
3-1(694mg,1.0mmol)溶于acn(10ml)中,加入5-羟色胺(529mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
3-1-1)505mg,收率为64%。c
48h72
n2o7.ms:[m]
+
788.53395.1h nmr(300mhz,chloroform-d)δ7.07(1h),6.96
–
6.85(m,2h),6.75(1h),4.82(1h),4.75(1h),4.25
–
4.03(m,10h),3.46(2h),3.42(1h),3.05(2h),2.92
–
2.84(m,2h),2.72
–
2.59(m,2h),2.21(1h),2.08(1h),2.05(1h),1.95(1h),1.88(1h),1.83
–
1.32(m,26h),1.23(s,3h),1.18(s,3h),1.10(s,3h),1.02(s,3h),0.96(s,3h),0.91(s,3h)。
[0096]
实施例13:通式
ⅲ‑
4-1和
ⅲ‑
4-1-1化合物的合成
[0097][0098]
将化合物
ⅲ‑
4(573mg,1.0mmol)溶于ac(10ml)中,加入1,6-二溴己烷(732mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
4-1)508mg,收率为69%。c
41h67
bro6.ms:[m]
+
734.41210.1h nmr(300mhz,chloroform-d)δ4.81(1h),4.72(1h),4.22
–
4.01(m,6h),3.45(2h),3.42(1h),2.66
–
2.54(m,2h),2.20(1h),2.07(1h),2.02(1h),1.95(1h),1.84(1h),1.80
–
1.30(m,30h),1.24(s,3h),1.16(s,3h),1.06(s,3h),1.00(s,3h),0.95(s,3h),0.88(s,3h)。
[0099]
将化合物
ⅲ‑
4-1(736mg,1.0mmol)溶于acn(10ml)中,加入色胺(481mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
4-1-1)473mg,收率为58%。c
51h78
n2o6.ms:[m]
+
814.58599.1h nmr(300mhz,chloroform-d)δ7.67
–
7.62(m,1h),7.46(1h),7.28(1h),7.08(1h),6.93(s,1h),4.83(1h),4.74(1h),4.26
–
4.03(m,8h),3.46(2h),3.42(1h),3.02(2h),2.93
–
2.85(m,2h),2.70
–
2.58(m,2h),2.22(1h),2.10(1h),2.05(1h),1.96(1h),1.85(1h),1.81
–
1.34(m,32h),1.23(s,3h),1.16(s,3h),1.09(s,3h),1.02(s,3h),0.96(s,3h),0.89(s,3h)。
[0100]
实施例14:通式
ⅲ‑
5-1和
ⅲ‑
5-1-1化合物的合成
[0101][0102]
将化合物
ⅲ‑
5(601mg,1.0mmol)溶于ac(10ml)中,加入1,10-二溴癸烷(900mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到白色粉末(
ⅲ‑
5-1)541mg,收率为66%。c47h79
bro6.ms:[m]
+
818.50600.1h nmr(300mhz,chloroform-d)δ4.83(1h),4.72(1h),4.25
–
4.11(m,4h),4.03(2h),3.46(2h),3.44(1h),2.68
–
2.56(m,2h),2.20(1h),2.09(1h),2.05(1h),1.98(1h),1.88(1h),1.84
–
1.28(m,42h),1.25(s,3h),1.18(s,3h),1.09(s,3h),1.02(s,3h),0.97(s,3h),0.86(s,3h)。
[0103]
将化合物
ⅲ‑
5-1(820mg,1.0mmol)溶于acn(10ml)中,加入5-氟色胺(535mg,3.0mmol),加入teba(227mg,1.0mmol)和碳酸钠(212mg,2.0mmol),室温搅拌12h,减压回收溶剂,得到固体,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅲ‑
5-1-1)505mg,收率为55%。c
57h89
fn2o6.ms:[m]
+
916.67047.1h nmr(300mhz,chloroform-d)δ7.28(1h),7.22(1h),7.04(1h),6.95(1h),4.83(1h),4.74(1h),4.23
–
4.04(m,6h),3.46(2h),3.42(1h),3.03(2h),2.94
–
2.82(m,2h),2.65
–
2.54(m,2h),2.21(1h),2.10(1h),2.05(1h),1.95(1h),1.84(1h),1.81
–
1.24(m,44h),1.23(s,3h),1.15(s,3h),1.08(s,3h),1.00(s,3h),0.95(s,3h),0.87(s,3h)。
[0104]
实施例15:化合物
ⅳ‑
1、
ⅳ‑
2、
ⅳ‑
3、
ⅳ‑
1-1、
ⅳ‑
2-1、
ⅳ‑
3-1和
ⅳ‑
3-1-1的合成
[0105][0106]
将化合物i(484.68mg,1.0mmol)溶于pa(10ml)中,加入1,5-二溴戊烷(689.82μl,3.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到白色粉末(
ⅳ‑
1)506.02mg,收率为79.85%。c
35h53
bro5.ms:[m]
+
632.31659。将化合物
ⅳ‑
1(689.82mg,1.0mmol)溶于can(10ml)中,加入色胺(320.43mg,2.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到淡黄色粉末(
ⅳ‑
1-1)464.96mg,收率为65.21%。c
45h64
n2o5.ms:[m]
+
712.47328。
[0107][0108]
将化合物
ⅲ‑
1(516.72mg,1.0mmol)溶于pa(10ml)中,加入1,3-二溴丙烷(605μl,3.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到白色粉末(iv-2)418.20mg,收率为65.58%。c
34h53
bro6.ms:[m]
+
636.29784.。将化合物iv-3(637.70mg,1.0mmol)溶于can(10ml)中,加入色胺(320.43mg,2.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到黄色粉末(iv-2-1)468.70mg,收率为65.37%。c
44h64
n2o6.ms:[m]
+
716.47364。
[0109][0110]
将化合物i(484.68mg,1.0mmol)溶于10%氢氧化钠甲醇(10ml)中,加热回流4h,加入盐酸中和反应液使ph=6-7,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得淡黄色固体(iv-3)319.41mg,收率为63.54%。c
30h46
o6.ms:[m]
+
502.32367.1h nmr略。将化合物iv-3(502.69mg,1.0mmol)溶于pa(10ml)中,加入1,5-二溴戊烷(689.82μl,3.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到白色粉末(iv-3-1)534.82mg,收率为66.79%。c
40h64
br2o6.ms:[m]
+
800.29554.1h nmr略。将化合物iv-3-1(744.65mg,1.0mmol)溶于can(10ml)中,加入色胺(320.43mg,2.0mmol),加入无水碳酸钾(276mg,2.0mmol),回流反应12h,减压回收溶剂,得到固体粉末,硅胶柱层析分离,干燥后得到白色粉末(iv-3-1-1)513.64mg,收率为53.58%。c
60h86
n4o6.ms:[m]
+
958.64477。
[0111]
生物活性测试:
[0112]
实施例15:细胞实验
[0113]
1.实验材料:
[0114]
细胞株:人源肝癌细胞(hepg2)、人源肺癌细胞(a549)和人源乳腺癌细胞(mcf-7)购自于武汉普诺赛生命科技有限公司。
[0115]
检测试剂盒:人谷胱甘肽过氧化酶4(gpx4)elisa试剂盒和人溶血卵磷脂酰基转移酶3(lpcat3)elisa试剂盒(上海信裕生物科技有限公司);人长链脂酰辅酶a合成酶4(acsl4)elisa检测试剂盒(上海江莱生物科技有限公司)。
[0116]
2.实验方法
[0117]
2.1细胞培养及毒性测定:hepg2和mcf-7细胞在含有10%fbs、100u/ml青霉素和100mg/ml链霉素的dmem中培养,a549在含有10%fbs、100u/ml青霉素和100mg/ml链霉素的1640中培养,培养温度为37℃、co2浓度为5%。细胞以5
×
103细胞/孔的密度接种在96孔板中。当细胞融合达到60%-70%时,加入裂环羽扇豆烷衍生物处理48h。以透射电镜观察细胞形态。并向每个孔中添加10μl cck-8,并在37℃下培养2小时。使用微孔板读取器测量吸光度。
[0118]
2.2酶活性测定:给药处理后的细胞利用细胞刮刀进行收集。随后用pbs洗涤1遍。按照每100万细胞加入100-200μl裂解液的比例进行裂解。随后4℃,12000g离心10min。取上清用于酶活性的测定。
[0119]
2.3细胞迁移和侵袭:
①
细胞迁移:胰酶消化细胞,调整细胞密度至5
×
105/ml。随
后取细胞悬液(含衍生物)100μl加入transwell小室,孔板下室则加入600μl含20%fbs的培养基。培养24h后取出transwell小室,弃去孔中培养液,pbs洗2遍,甲醇固定30min,将小室适当风干。0.1%结晶紫染色20min,用棉签轻轻擦掉上层未迁移细胞,用pbs洗3遍。400倍显微镜下随即五个视野观察细胞,记数。
②
细胞侵袭:侵袭步骤与迁移步骤相同,仅在接种细胞前,将transwell小室底部膜的上室面包被一层基质胶。
[0120]
2.4ros含量测定:细胞以2
×
105细胞/孔的密度接种在6孔板中。当细胞融合达到60%-70%时,加入裂环羽扇豆烷衍生物处理48h。去除细胞培养液,加入适当体积稀释好的dcfh-da。37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的dcfh-da。利用流式细胞仪进行检测。
[0121]
2.5gpx4、acsl4和lpcat3蛋白的表达:hepg2、a549和mcf-7细胞在试验药物存在下培养48h,用预冷pbs洗涤3次,加入裂解液裂解5min,然后以12000g离心10min。使用bca蛋白质试剂盒测定各组上清液的浓度。将各组的蛋白质浓度调平至等浓度(1mg/ml),使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,并转移至聚偏氟乙烯膜。使用5%脱脂乳封闭膜2h。随后,添加一级抗体(1:1000;gpx4、acsl4和lpcat3),并在4℃下过夜处理。用tris缓冲盐水和吐温20缓冲液清洗膜,并在室温下与二级抗体孵育2h。用超灵敏ecl(beyotime,中国上海)观察所有膜,并使用图像分析仪获取图像。以β-肌动蛋白抗体为对照,使用image j软件分析蛋白印迹。
[0122]
3.实验结果
[0123]
3.1衍生物的细胞毒活性透射电镜肿瘤细胞形态学观察结果显示,经裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1处理的三种肿瘤细胞hepg2、a549、mcf-7均表现为不同程度的细胞体积变小,核体积正常且无核浓缩现象,线粒体膜密度增加,线粒体嵴变少甚至消失等典型的铁死亡形态特征。从对肿瘤的细胞毒活性来看,裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1均具有很强的细胞毒作用;其ic
50
值分别为:hepg2细胞:1.35μm、1.56μm、0.88μm、2.20μm、0.98μm、2.46μm、1.85μm和1.74μm;a549细胞:3.22μm、2.18μm、1.26μm、3.58μm、1.35μm、4.66μm、2.21μm和2.05μm;mcf-7细胞:4.66μm、3.49μm、1.54μm、3.35μm、2.06μm、4.55μm、3.97μm和3.24μm。各衍生物ic
50
值将作为后续细胞迁移和侵袭实验,ros实验和蛋白印迹实验的给药浓度。
[0124]
3.2衍生物的酶活性利用elisa检测方法对酶活性进行测定,并得出衍生物的半数抑制浓度或半数有效浓度(细胞内酶活性与空白组相比),结果如表1-9所示。
[0125]
表1.hepg2细胞内衍生物对gpx4蛋白酶的半数抑制浓度
[0126][0127]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0128]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
4-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1、
ⅲ‑
5-1-1、
ⅳ‑
1-1、
ⅳ‑
2-1和
ⅳ‑
3-1-1对hepg2细胞内gpx4蛋白酶具有显著地抑制作用。
[0129]
表2.hepg2细胞内衍生物对acsl4蛋白酶的半数有效浓度
[0130][0131]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0132]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
2-1-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对hepg2细胞内acsl4蛋白酶具有显著地激活作用。
[0133]
表3.hepg2细胞内衍生物对lpcat3蛋白酶的半数有效浓度
[0134][0135]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0136]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
2-1-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对hepg2细胞内lpcat3蛋白酶具有显著地激活作用。
[0137]
表4.a549细胞内衍生物对gpx4蛋白酶的半数抑制浓度
[0138][0139]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0140]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1、
ⅲ‑
5-1-1、
ⅳ‑
1-1、
ⅳ‑
2-1和
ⅳ‑
3-1-1对a549细胞内gpx4蛋白酶具有显著地抑制作用。
[0141]
表5.a549细胞内衍生物对acsl4蛋白酶的半数有效浓度
[0142][0143]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0144]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对a549细胞内acsl4蛋白酶具有显著地激活作用。
[0145]
表6.a549细胞内衍生物对lpcat3蛋白酶的半数有效浓度
[0146][0147]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0148]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对a549细胞内lpcat3蛋白酶具有显著地激活作用。
[0149]
表7.mcf-7细胞内衍生物对gpx4蛋白酶的半数抑制浓度
[0150][0151]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0152]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
4-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1、
ⅲ‑
5-1-1、
ⅳ‑
1-1、
ⅳ‑
2-1和
ⅳ‑
3-1-1对mcf-7细胞内gpx4蛋白酶具有显著地抑制作用。
[0153]
表8.mcf-7细胞内衍生物对acsl4蛋白酶的半数有效浓度
[0154][0155]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0156]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
4-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对mcf-7细胞内acsl4蛋白酶具有显著地激活作用。
[0157]
表9.mcf-7细胞内衍生物对lpcat3蛋白酶的半数有效浓度
[0158]
[0159][0160]
注:a≤20μm;25μm<b≤200μm;c>200μm
[0161]
以上数据说明:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅱ‑
5-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1对mcf-7细胞内lpcat3蛋白酶具有显著地激活作用。
[0162]
3.3衍生物对细胞迁移和细胞侵袭活性
[0163]
采用transwell(林嘉怡,等,中国药理学通报,2022,(03):373-379.)方法进行细胞迁移和细胞侵袭活性验证(相应的过程为本领域技术人员公知的常用技术,在此不进行赘述);
[0164]
结果见图1(注:与对照组相比,
**
p《0.01),图1显示:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1可以显著的抑制hepg2、a549和mcf-7细胞的迁移和侵袭能力。
[0165]
3.4衍生物对ros的活性
[0166]
采用dcfh-da荧光探针(张赛,等.中国生物工程杂志,2022,42(z1):72-79.)方法进行ros的活性验证(相应的过程为本领域技术人员公知的常用技术,在此不进行赘述);
[0167]
结果见图2(注:与对照组相比,
##
p《0.01),图2显示:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1可以显著提高hepg2、a549和mcf-7细胞内的ros水平。
[0168]
3.5衍生物对相关蛋白的活性
[0169]
采用蛋白印迹(严丽,等,中华实验外科杂志,2021,38(11):2153-2155;郭宇婷,等,中国临床药理学与治疗学,2022,27(01):8-14.)法进行相关蛋白的活性验证(相应的过程为本领域技术人员公知的常用技术,在此不进行赘述);
[0170]
结果见图3(注:与对照组相比降低,
**
p《0.01;与对照组相比升高,
#
p《0.05,
##
p《0.01),图3显示:裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1均可以使hepg2、a549和mcf-7细胞内gpx4蛋白表达量降低,而使acsl4和lpcat3蛋白表达量升高。
[0171]
4.结论本发明裂环羽扇豆烷衍生物
ⅱ‑
1-1、
ⅱ‑
2-1、
ⅱ‑
3-1、
ⅲ‑
1-1-1、
ⅲ‑
1-2-1、
ⅲ‑
3-1-1、
ⅲ‑
4-1-1和
ⅲ‑
5-1-1具有极强地抑制癌细胞增殖、迁移和侵袭能力,其抗肿瘤作
用是通过抑制gpx4,同时激活acsl4和lpcat3蛋白酶活力,升高细胞脂质过氧化水平,从而激活肿瘤细胞铁死亡途径完成的。
[0172]
实施例16:药代动力学测试
[0173]
动物实验:本研究选用24只sd大鼠,雌雄各半(7-8周龄,体重200-220g)。随机分为6组,每组4只。经静脉注射或者灌胃相同剂量(20mg/kg)的药物,以评价受试药物在其体内的药代动力学性质。
[0174]
大鼠采用标准条件饲养,在12h白天/12h黑夜的条件下,给予维持饲料喂养。受试药物用0.5%羧甲基纤维素钠或者二甲基亚砜配制。将相同剂量的裂环羽扇豆烷衍生物分别静脉注射和灌胃大鼠。给药后0、0.083、0.25、0.5、1、2、3、4、6、8、12、24h尾静脉取血,所得血样4℃,5000rpm离心15min后分离血浆和红细胞,加肝素-20℃冻存。
[0175]
利用lc-ms/ms检测血浆中各化合物的浓度。药代动力学参数基于每只动物在不同时间点的血药浓度进计算。
[0176]
结论:血浆药代动力学结果可知,本发明的各裂环羽扇豆烷衍生物均具有较好的药代动力学性质。
[0177]
剂型制备:
[0178]
实施例17:片剂制备
[0179]
试剂:淀粉(药用级,天津市津东天正精细化学试剂厂);枸橼酸(上海麦克林生化科技有限公司);硬脂酸镁(上海麦克林生化科技有限公司)。
[0180]
制备方法:
[0181]
①
10%淀粉浆的制备:将0.25g枸橼酸溶于25ml纯水中,加入2.5g淀粉分散均匀,加热使其糊化,即得10%淀粉浆。
[0182]
②
制粒:取适量所得裂环羽扇豆烷衍生物粉末与淀粉混合均匀,加入适量10%淀粉浆混合并研磨均匀,制软材,过16目筛制粒,在50-60℃下干燥1h。16目筛整粒后加入适量润滑剂硬脂酸镁,用直径10mm为的浅冲头压制成片剂。
[0183]
结果:所得片剂颜色呈米白色,颜色均匀,薄厚均匀一致,硬度适中。片重和崩解的时间符合要求。
[0184]
结论:所得裂环羽扇豆烷衍生物所制片剂符合要求,可作为片剂使用。
[0185]
实施例18:混悬型注射剂制备
[0186]
试剂:聚乳酸(pla,上海甄准生物科技有限公司);聚乳酸羟基乙酸共聚物(plga,上海源叶生物科技有限公司);泊洛沙姆188(西安天正药用辅料有限公司);二氯甲烷、甲醇、乙腈等(天津天泰化学品有限公司)。
[0187]
制备方法:
[0188]
①
制备聚合物微粒:称取适量的裂环羽扇豆烷衍生物和载体(pla/plga)置于50ml圆底烧瓶中,加入5ml的二氯甲烷溶解,28℃减压蒸馏除去大部分有机溶剂,再在40℃条件下真空干燥24h直至溶剂全部去除,粉碎,过孔径为150μm的筛网,得到连环羽扇豆烷衍生物聚合物微粒。
[0189]
②
制备裂环羽扇豆烷衍生物混悬注射剂:将2.5g上述产物在持续搅拌条件下分散在250ml含有10g/l的泊洛沙姆188稳定剂的水溶液中,使分散完全。将药物分散液进行研磨至所需粒径,取出得到裂环羽扇豆烷衍生物聚合物微粒混悬液,3000r
·
min-1
离心1min,并
用10ml稳定剂水溶液分散,使制剂浓缩至约为25g/l。
[0190]
结果:所得混悬注射剂粒径均匀,制剂含水量、表面粒径均符合规定。体外缓释效果较佳,稳定性较好。
[0191]
结论:所得裂环羽扇豆烷衍生物所制混悬注射剂符合要求,可作为混悬注射剂使用。
[0192]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1