亚精胺衍生物糖基转移酶LbUGT62及其编码基因和应用
亚精胺衍生物糖基转移酶lbugt62及其编码基因和应用
1.本分案申请是专利申请号202110021501.8,发明名称:一组亚精胺衍生物糖基转移酶及其编码基因和应用,申请日:2021年1月8日的发明专利申请的分案申请。
技术领域:
2.本发明属于植物基因工程和生物技术领域,具体涉及一组亚精胺衍生物糖基转移酶及其编码基因和应用。
背景技术:
3.宁夏枸杞(lycium barbarum l.)是茄科枸杞属植物,其干燥成熟果实枸杞子自古作为名贵的中药材,具有重要的药用历史,亦是药食同源品种之一。《药典》记载,枸杞子具有滋肝补肾、益精明目的功效。现代药理学研究表明,宁夏枸杞具有良好的促进免疫、降血糖血脂、抗氧化、抗辐射损伤、促进肿瘤细胞凋亡和延缓衰老等作用,这些功效主要来源于其中丰富的次生代谢成分,如多糖、多酚和类胡萝卜素等。近年发现,宁夏枸杞中亦含有丰富的咖啡酰亚精胺类物质,其含量超过2.1克/千克,仅次于类胡萝卜素(2.2-2.3克/千克),是宁夏枸杞新兴的活性成分之一。咖啡酰亚精胺类物质能够改善转基因果蝇的短时学习记忆能力,可开发为抗阿尔兹海默症的药物成分;此外,对抗肿瘤药物平阳霉素的发酵生产亦具有促进作用。虽然这类物质较生物碱、类黄酮、萜类物质等次生代谢产物更为少见,但在多个物种中的鉴定与活性评价发现,它们还具有治疗寄生性锥虫病、抑制耐万古霉素金黄色葡萄球菌、降血压和镇痛等作用,在疾病的预防或者治疗中具有巨大的应用前途。
4.宁夏枸杞中的咖啡酰亚精胺类物质的含量不仅高,而且结构种类丰富,目前已从宁夏枸杞中鉴定出15种不同结构形式的咖啡酰亚精胺类物质。这15种化合物中最明显的结构特征为均具有糖基化修饰。糖基化修饰由糖基转移酶完成,对植物次生代谢产物的合成、运输和存储具有重要的作用。在宁夏枸杞中发现的二咖啡酰亚精胺糖苷,也是自然界中首次发现并鉴定的咖啡酰亚精胺糖苷。由此可见,宁夏枸杞既是丰富的咖啡酰亚精胺糖苷的天然资源,也是咖啡酰亚精胺糖基转移酶的来源。宁夏枸杞中的咖啡酰亚精胺糖苷在抗阿尔兹海默症等疾病的治疗方面具有重要的应用前景和潜在的经济价值。因此,利用宁夏枸杞中的基因资源,可通过生物技术等手段开发体外合成咖啡酰亚精胺糖苷,具有重要的产业价值。
技术实现要素:
5.本发明的第一个目的是提供一组亚精胺衍生物糖基转移酶,其能催化亚精胺衍生物生成相应的亚精胺衍生物糖苷,在宁夏枸杞咖啡酰亚精胺物质的体外生物合成中具有重要的应用价值,亦或对其他物种来源的亚精胺衍生物糖苷的体外催化合成具有参考作用和重要的意义。
6.本发明的一组亚精胺衍生物糖基转移酶lbugt62、lbugt64和lbugt73,其特征在于,其氨基酸序列分别如seqidno.4、seqidno.5、seqidno.6所示。
7.本发明的第二个目的是提供编码上述一组亚精胺衍生物糖基转移酶的基因。
8.所述的编码基因优选为lbugt62、lbugt64和lbugt73,其核苷酸序列分别如seqidno.1、seqidno.2、seqidno.3所示。
9.本发明的第三个目的是提供上述一组亚精胺衍生物糖基转移酶在亚精胺衍生物糖苷合成中的应用。
10.优选,亚精胺衍生物糖基转移酶lbugt62、lbugt64或lbugt73在催化亚精胺衍生物生成亚精胺衍生物糖苷中的应用。
11.进一步优选,亚精胺衍生物糖基转移酶lbugt62在催化n1,n
10-二咖啡酰亚精胺生成两种n1,n
10-二咖啡酰亚精胺糖苷中的应用,或亚精胺衍生物糖基转移酶lbugt62在催化n
1-咖啡酰-n
10-二咖啡酰亚精胺生成一种n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷中的应用;所述的亚精胺衍生物糖基转移酶lbugt62的氨基酸序列如seqidno.4所示。
12.进一步优选,亚精胺衍生物糖基转移酶lbugt64在催化n1,n
10-二咖啡酰亚精胺生成两种n1,n
10-二咖啡酰亚精胺糖苷中的应用,或亚精胺衍生物糖基转移酶lbugt64在催化n
1-咖啡酰-n
10-二咖啡酰亚精胺生成两种n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷中的应用;所述的亚精胺衍生物糖基转移酶lbugt64的氨基酸序列如seqidno.5所示。
13.进一步优选,亚精胺衍生物糖基转移酶lbugt73在催化n1,n
10-二咖啡酰亚精胺生成两种n1,n
10-二咖啡酰亚精胺糖苷中的应用,或亚精胺衍生物糖基转移酶lbugt73在催化n
1-咖啡酰-n
10-二咖啡酰亚精胺生成三种n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷中的应用;所述的亚精胺衍生物糖基转移酶lbugt73的氨基酸序列如seqidno.6所示。
14.本发明从宁夏枸杞克隆获得3个亚精胺衍生物糖基转移酶,其能催化亚精胺衍生物生成相应的亚精胺衍生物糖苷,在宁夏枸杞咖啡酰亚精胺物质的体外生物合成中具有重要的应用价值,亦或对其他物种来源的亚精胺衍生物糖苷的体外催化合成具有参考作用和重要的意义。
附图说明:
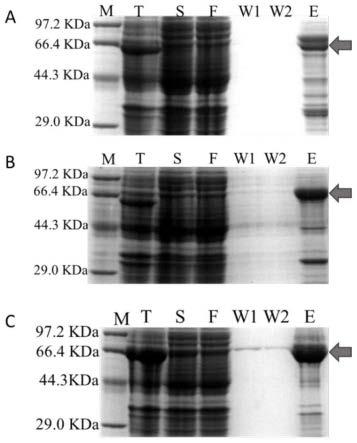
15.图1.lbugt62(a)、lbugt64(b)、lbugt73(c)蛋白纯化sds-page结果。m:蛋白marker,t:总蛋白,s:破碎后上清蛋白,f:流穿液,w1:第一次洗涤部分,w2:第二次洗涤部分,e:洗脱部分;右侧箭头指示为目标蛋白。
16.图2.lbugt62催化n1,n
10-二咖啡酰亚精胺生成新化合物p1和p2。
17.图3.lbugt62催化生成n1,n
10-二咖啡酰亚精胺糖苷p1和p2的一级质谱图(左)和二级质谱图(右)。
18.图4.lbugt64催化n1,n
10-二咖啡酰亚精胺生成新化合物p3和p4。
19.图5.lbugt64催化生成n1,n
10-二咖啡酰亚精胺糖苷p3和p4的一级质谱图(左)和二级质谱图(右)。
20.图6.lbugt73催化n1,n
10-二咖啡酰亚精胺生成新化合物p1和p2。
21.图7.lbugt73催化生成n1,n
10-二咖啡酰亚精胺糖苷p1和p2的一级质谱图(左)和二级质谱图(右)。
22.图8.lbugt62催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p5。
23.图9.lbugt62催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p5一级质谱(a)
和二级质谱图(b)。
24.图10.lbugt64催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p6和p7。
25.图11.lbugt64催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p6(左列)和p7(右列)一级质谱(ms)和二级质谱图(ms2)。
26.图12.lbugt73催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p5、p6和p8。
27.图13.lbugt73催化n
1-咖啡酰-n
10-二氢咖啡酰亚精胺生成新化合物p5(左列)、p6(中列)和p8(右列)一级质谱(ms)和二级质谱图(ms2)。
具体实施方式:
28.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
29.下列实例中未具体注明的实验方法,均可按照常规方法进行。
30.实施例1:亚精胺衍生物糖基转移酶基因的筛选
31.以植物次生代谢产物糖基转移酶保守的pspgbox序列为诱饵序列,在宁夏枸杞转录组数据库中进行检索,得到宁夏枸杞糖基转移酶序列70条及黑果枸杞同源糖基转移酶序列59条。黑果枸杞与宁夏枸杞同属枸杞属,其果实中亦含有亚精胺衍生物类物质,但均以不含糖苷的为主,因此本发明的候选基因以在宁夏枸杞中表达而在黑果枸杞中不表达为主要的筛选依据。最终筛选得到的基因分别命名为lbugt62、lbugt64和lbugt73。
32.实施例2:克隆亚精胺衍生物糖基转移酶基因、构建超表达载体及测序分析
33.提取宁夏枸杞果实的rna,分别使用prime script rt reagent kit with gdna eraser(takara公司)试剂盒进行基因组dna的去除及rna的反转录。基因组dna去除的反应体系如下:5
×
gdnaeraser buffer 2.0μl,gdnaeraser 1.0μl,总rna 1μg,加rnase free的h2o至10μl;在42℃条件下反应2分钟;结束后将体系置于冰上。反转录的反应体系如下:基因组dna消化的反应体系10μl,其中包括5
×
primescript buffer 2(for real time)4.0μl,primescript rt enzyme mix i 1.0μl,rt primer mix 1.0μl,rnase free dh2o 4.0μl;在37℃中反应15分钟后,85℃保持5秒;所得产物即为宁夏枸杞果实cdna,保存于-20℃冰箱。
34.以宁夏枸杞果实转录组中的全长编码序列为基础,利用primer primer5.0软件设计亚精胺衍生物糖基转移酶基因克隆的引物序列,其中正向引物和反向引物序列分别如表1所示。以所得宁夏枸杞果实cdna为模板,采用表1所示正反向引物对,用primestar max(2
×
)(takara公司)进行pcr扩增,pcr反应体系为:primestar max(2
×
)25μl,cdna 3μl,10μm浓度的正向引物和反向引物各2μl,ddh2o 18μl。pcr反应条件为:98℃2min;98℃30s,55-65℃(具体退火温度以合成引物的为准)30s,72℃1min;35个循环;72℃延伸10min。
35.将pcr产物和表达质粒pet32a分别进行双酶切消化(采用takara公司限制性内切酶),反应体系为:10
×
quickcut buffer 5μl,pet32a质粒/pcr产物不超过1μg/200ng,quickcut bamhi 1μl,quickcut xhoi 1μl,灭菌ddh2o补齐至50μl。双酶切反应后的产物使用美基公司产物回收试剂盒进行纯化回收。纯化后测定浓度,以目的基因片段与载体3:1的比例进行连接(采用takara公司t4连接酶),连接反应体系为:10
×
t4 dna ligase buffer 1μl,dna 5μl,载体2μl,t4 dnaligase 1μl,灭菌ddh2o 1μl。4℃连接过夜。
36.连接产物转化至dh5α克隆感受态中,转化菌液涂布于含氨苄抗生素的lb板,并于
37℃恒温培养箱中倒置培养12-16小时。次日,用t7正向引物和基因的反向引物进行菌落pcr分析(采用擎科生物公司t5 pcr酶),反应体系为:2
×
t5 supermix 5μl,t7正向引物(10μm)0.5μl,基因反向引物(10μm)0.5μl,菌液模板1μl,灭菌ddh2o 3μl。pcr反应程序为:98℃2min;98℃10s,55-65℃(具体退火温度以合成引物的为准)10s,72℃30s;30个循环;72℃延伸3min。
37.每个基因各挑选其中3个经菌落pcr验证为阳性的克隆,提取质粒后送生工生物公司进行测序鉴定,经测序分析,克隆得到的亚精胺衍生物糖基转移酶基因lbugt62的核苷酸序列如seq id no.1所示,其含有1398个碱基,编码的蛋白命名为亚精胺衍生物糖基转移酶lbugt62,共465个氨基酸残基,具体氨基酸序列如seq id no.4所示。亚精胺衍生物糖基转移酶基因lbugt64的核苷酸序列如seq id no.2所示,其含有1392个碱基,编码的蛋白命名为亚精胺衍生物糖基转移酶lbugt64,共463个氨基酸残基,具体氨基酸序列如seq id no.5所示。亚精胺衍生物糖基转移酶基因lbugt73的核苷酸序列如seq id no.3所示,其含有1434个碱基,编码的蛋白命名为亚精胺衍生物糖基转移酶lbugt73,共477个氨基酸残基,具体氨基酸序列如seq id no.6所示。
38.表1.候选基因全长cds克隆引物序列(下划线标示酶切位点)
[0039][0040]
实施例3:合成亚精胺衍生物糖基转移酶基因、构建超表达载体及测序分析
[0041]
采用全合成的方法直接合成亚精胺衍生物糖基转移酶基因lbugt62(具体如seq id no.1所示)、lbugt64(具体如seq id no.2所示)和lbugt73(具体如seq id no.3所示)的全长序列,按照实施例2的连接方式将亚精胺衍生物糖基转移酶基因构建至表达载体pet32a上,转化至dh5α中,提取质粒后再次测序确定序列正确。由此得到含有亚精胺衍生物糖基转移酶基因lbugt62、lbugt64或lbugt73的表达载体。
[0042]
实施例4:目标蛋白诱导表达及纯化
[0043]
提取实施例3得到的含有亚精胺衍生物糖基转移酶基因lbugt62、lbugt64或lbugt73的表达载体,然后分别转化至bl21(de3)表达感受态中。挑取阳性单克隆于5ml含amp抗生素的lb液体培养基中,37℃,200rpm过夜培养。次日按1:100比例接种于400ml新鲜的含amp抗生素的lb液体培养基中,37℃,200rpm培养至od
600
达到0.6,加入终浓度为0.1mm的诱导剂iptg,16℃继续培养16-20小时。低温离心收集菌体,加适量灭菌ddh2o洗涤一次,再次离心,弃上清。
[0044]
菌体重悬于10ml裂解缓冲液(ph7.5,含20mm tris-hcl、0.5m nacl和10mm咪唑)
中,40℃水浴和液氮中反复冻融3次,加入pmsf至终浓度为1mm,将重悬菌液于冰水中孵育并进行超声破碎,超声条件为:on 5s,off 5s,30min。破碎完成后4℃、6000g离心15min,取上清即为诱导后总蛋白。
[0045]
将诱导后总蛋白进行ni-nta亲和填料(qiagen公司)纯化,方法参照填料说明书进行。洗脱得到的目标蛋白采用超滤离心管进行脱盐和浓缩。最后用sds-page检测蛋白纯化效果,lbugt62、lbugt64和lbugt73的纯化效果分别如图1。由此获得纯化后的亚精胺衍生物糖基转移酶lbugt62、lbugt64和lbugt73。
[0046]
实施例5:n1,n
10-二咖啡酰亚精胺糖苷的生物合成及鉴定
[0047]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt62进行n1,n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n1,n
10-二咖啡酰亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt62蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt62能催化n1,n
10-二咖啡酰亚精胺得到两个新的化合物p1和p2,如图2所示。
[0048]
化合物p1和p2分别经过质谱鉴定,p1与p2的一级质谱结果均显示为[m+h]
+
m/z=632.28,如图3(左)所示,表明化合物分子量为631,比n1,n
10-二咖啡酰亚精胺(469)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为470.23(葡萄糖基断裂后的碎片)和220.10,如图3(右)所示,证明葡萄糖基连接在n1,n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p1和p2均为n1,n
10-二咖啡酰亚精胺糖苷,且两者互为同分异构体。
[0049]
实施例6:n1,n
10-二咖啡酰亚精胺糖苷的生物合成及鉴定
[0050]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt64进行n1,n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n1,n
10-二咖啡酰亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt64蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt64能催化n1,n
10-二咖啡酰亚精胺得到两个新的化合物p3和p4,如图4所示。
[0051]
化合物p3和p4分别经过质谱鉴定,p3与p4的一级质谱结果均显示为[m+h]
+
m/z=632.28,如图5(左)所示,表明化合物分子量为631,比n1,n
10-二咖啡酰亚精胺(469)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为470.23(葡萄糖基断裂后的碎片)和220.10,如图5(右)所示,证明葡萄糖基连接在n1,n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p3和p4均为n1,n
10-二咖啡酰亚精胺糖苷,且两者互为同分异构体,与化合物p1和p2亦为同分异构体。
[0052]
实施例7:n1,n
10-二咖啡酰亚精胺糖苷的生物合成
[0053]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt73进行n1,n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n1,n
10-二咖啡酰亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt73蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt73能催化n1,n
10-二咖啡酰亚精胺得到两个新的化合物p1和p2,如图6所示。
[0054]
化合物p1和p2分别经过质谱鉴定,p1与p2的一级质谱结果均显示为[m+h]
+
m/z=632.28,如图7(左)所示,表明化合物分子量为631,比n1,n
10-二咖啡酰亚精胺(469)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为470.23(葡萄糖基断裂后的碎片)和220.10,如图7(右)所示,证明葡萄糖基连接在n1,n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p1和p2均为n1,n
10-二咖啡酰亚精胺糖苷,且两者互为同分异构体,与亚精胺衍生物糖基转移酶lbugt62催化的产物相同。
[0055]
实施例8:n
1-咖啡酰-n
10-二氢咖啡酰亚精胺糖苷的生物合成
[0056]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt62进行n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n
1-咖啡酰-n
10-二咖啡酰亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt62蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt62能催化n
1-咖啡酰-n
10-二咖啡酰亚精胺得到一个新的化合物p5,如图8所示,其中p5与标准品4
’‑
o-β-d-glucopyranosyl-n
1-caffeoyl-n
10-dihydrocaffeoylspermidine(宁夏枸杞亚精胺d)具有相同的保留时间。
[0057]
化合物p5经过质谱鉴定,p5的一级质谱结果均显示为[m+h]
+
m/z=634.30,如图9(a)所示,表明化合物分子量为633,比n
1-咖啡酰-n
10-二咖啡酰亚精胺(471)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为472.24(葡萄糖基断裂后的碎片)和220.10,如图9(b)所示,证明葡萄糖基连接在n
1-咖啡酰-n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p5为n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷,通过与标品的对比分析,其质谱裂解模式及保留时间均与宁夏枸杞亚精胺d一致,因此确定p5即为宁夏枸杞亚精胺d,其具体结构如图8。
[0058]
实施例9:n
1-咖啡酰-n
10-二氢咖啡酰亚精胺糖苷的生物合成
[0059]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt64进行n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n
1-咖啡酰-n
10-二咖啡酰亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt64蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt64能催化n
1-咖啡酰-n
10-二咖啡酰亚精胺得到两个新的化合物p6和p7,如图10所示。
[0060]
化合物p6和p7分别经过质谱鉴定,p6和p7的一级质谱结果均显示为[m+h]
+
m/z=634.30,如图11所示,表明化合物分子量为633,比n
1-咖啡酰-n
10-二咖啡酰亚精胺(471)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为472.24(葡萄糖基断裂后的碎片)和220.10,如图11所示,证明葡萄糖基连接在n
1-咖啡酰-n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p6和p7均为n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷,且两者互为同分异构体,与p5(宁夏枸杞亚精胺d)亦为同分异构体。其中p6为主要产物。
[0061]
实施例10:n
1-咖啡酰-n
10-二氢咖啡酰亚精胺糖苷的生物合成
[0062]
利用实施例4所得纯化后的亚精胺衍生物糖基转移酶lbugt73进行n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷的生物合成,每100μl反应体系包括:200μm n
1-咖啡酰-n
10-二咖啡酰
亚精胺为底物,1mm udp-葡萄糖,50mm tris-hcl缓冲液(ph7.5)和5μl纯化lbugt64蛋白。于35℃反应1小时后用100μl甲醇终止反应。反应体系经过lcms分析,洗脱程序为:0-2min,5%b(乙腈)+95%a(0.5%甲酸水);2-12min,5%-40%b;12-17min,40%-99%b。通过液相洗脱分析后发现,lbugt73能催化n
1-咖啡酰-n
10-二咖啡酰亚精胺得到三个新的化合物p5、p6和p8,如图12所示,其中p5与宁夏枸杞亚精胺d具有相同的保留时间,p8与宁夏枸杞亚精胺a具有相同的保留时间。
[0063]
化合物p5、p6和p8分别经过质谱鉴定,三者的一级质谱结果均显示为[m+h]
+
m/z=634.29或634.30,如图13所示,表明化合物分子量为633,比n
1-咖啡酰-n
10-二咖啡酰亚精胺(471)多一个葡萄糖基(162)的分子量,且二级质谱主要产生了两个碎片,m/z分别为472.24(葡萄糖基断裂后的碎片)和220.10,如图13所示,证明葡萄糖基连接在n
1-咖啡酰-n
10-二咖啡酰亚精胺的羟基上。因此确认化合物p5、p6和p8均为n
1-咖啡酰-n
10-二咖啡酰亚精胺糖苷,且三者互为同分异构体,通过与标品宁夏枸杞亚精胺a和d的保留时间及质谱结果对比,确定p5即为宁夏枸杞亚精胺d,且与lbugt62的催化产物相同;p8即为宁夏枸杞亚精胺a。其中p5为主要产物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1