手性3-螺环氧化吲哚并苯并噻吩砜类衍生物、其制备方法及用途
1.本发明涉及有机合成领域,尤其涉及手性3-螺环氧化吲哚并苯并噻吩砜类衍生物、其制备方法及用途。
背景技术:
2.螺环吲哚环体系广泛存在于天然或非天然的具有生物活性的分子中,而这些分子的大多数被发现具有很好的生物活性,螺环氧化吲哚类化合物的生物活性多种多样,如抗肿瘤,抗hiv,抗疟疾,mdm2抑制剂等等,具有很高的成药潜质,是开发新药的重要来源。另一方面,含砜的结构单元也具有很好的生物活性,被广泛用于药物设计。例如,药物舒巴坦(sulbactam)和他唑巴坦(tazobactam)为不可逆的竞争性β-内酰胺酶抑制剂,对革兰阳性及阴性菌所产生的β-内酰胺酶均有抑制作用。此外研究表明三氟甲基(cf
3-)这一官能团的存在可以改善和提升有机分子的酸碱度、亲脂性、代谢稳定性以及渗透性等分子性能,因而在药物及有机化学领域备受关注。在药物分子发现中可以看出,将两个或多个药效官能团到融合到一个分子中,可能会产生意想不到的生物活性,这在研发新药方面具有非常重要的意义。
技术实现要素:
3.本发明的目的之一,就在于提供一类新的手性3-螺环氧化吲哚并苯并噻吩砜类化合物,以解决上述问题。
4.为了实现上述目的,本发明采用的技术方案是这样的:手性3-螺环氧化吲哚并苯并噻吩砜类化合物,具有如下结构式(ⅰ)所示的结构:
[0005][0006]
上述结构式中,r1基选自氢、烷基、叔丁氧羰基、苄氧羰基、甲氧羰基、乙氧羰基中的一种;r2基为单取代基或多取代基,取代基选自氢、烷基、烷氧基或卤素;r3基为单取代基或多取代基,取代基选自、烷氧基、卤素或芳基。
[0007]
n-2,2,2-三氟乙基靛红亚胺作为一类很好的1,3-偶极子,已经被广泛应用于合成各种含三氟甲基的手性螺环氧化吲哚类化合物。然而,在目前所有的报道中,都是正常的1,3-偶极环加成反应,即利用cα'-位的亲核性(下式(a));利用cα-位的亲核性,发生极翻转的1,3-偶极环加成反应目前尚未报道(下式(b))。因此,实现n-2,2,2-三氟乙基靛红亚胺的极
翻转反应,可以实现一些用常规方法无法实现的分子的构建。这不仅可以为螺环氧化吲哚类化合物的合成提供新的思路与方法,同时也可以大大丰富这类化合物的种类,为新药筛选提供更多的候选分子。
[0008][0009]
本发明首次公开了一类新的手性3-螺环氧化吲哚并苯并噻吩砜类化合物,该化合物具有螺环氧化吲哚、苯并噻吩砜以及三氟甲基亚结构,可以为新药的研发及药物的筛选提供更多候选分子。
[0010]
本发明的目的之二,就在于提供一种新的手性3-螺环氧化吲哚并苯并噻吩砜类类衍生物的制备方法,
[0011]
采用的技术方案是这样的:在惰性气体优选氩气保护下,将金属铜盐与手性配体l溶解在有机溶剂中搅拌0.5-1h后,加入n-2,2,2-三氟乙基靛红亚胺(ii)和1,1-苯并噻吩二氧化物(ⅱi)以及催化量的碱,在-10℃-25℃下搅拌反应48-96h,待反应完毕后,分离纯化得到产物i,其中,
[0012]
所述手性配体l具有如下结构:
[0013][0014]
所述n-2,2,2-三氟乙基靛红亚胺(ii)具有如下结构:
[0015][0016]
所述1,1-苯并噻吩二氧化物(iii)具有如下结构:
[0017]
[0018]
其反应式为:
[0019][0020]
本发明所采用的手性配体,优选采用二茂铁衍生的噁唑啉单膦配体,因为立体选择性高。
[0021]
作为优选的技术方案:所述的铜盐选自氯化亚铜、碘化亚铜、溴化亚铜、氯化铜、碘化铜、溴化铜、醋酸铜、硫酸铜、三氟甲磺酸铜中的一种。
[0022]
所述铜盐进一步优选三氟甲磺酸铜,因为反应的立体选择性好。
[0023]
作为优选的技术方案:所述的碱选自氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸铯、叔丁醇钠、叔丁醇钾、三乙胺、二异丙基乙基胺中的一种。
[0024]
所述碱进一步优选碳酸铯,因为反应的收率高,立体选择性好。
[0025]
作为优选的技术方案:所述的反应溶剂选自甲苯、均三甲苯、二氯甲烷、氯仿、四氢呋喃、乙醚、乙腈、乙醇、甲醇、1,4-二氧六环、氯苯中的一种或者多种混合。
[0026]
所述溶剂优选甲苯,因为反应的收率高,立体选择性好。
[0027]
本发明的目的之三,在于提供上述的化合物在制备抗肿瘤药物中的用途。
[0028]
具体而言,本发明公开的上述化合物的应用价值的一方面在于:通过初步的细胞活性实验,表明该类化合物对人白血病细胞k562有很好的杀害作用,细胞活性研究结果见表1。因此,通过进一步的研究,这类化合物有望成为抗肿瘤药物的先导化合物。
[0029]
具体实验操作:将5000个人白血病细胞k562接种到96孔细胞培养板中,并让其生长24小时。然后分别加入一定浓度的上述合成的化合物,以抗肿瘤药物顺铂作为对照,作用48h。然后测定所有化合物的平均50%的抑制浓度(ic
50
)。每个浓度至少重复3次,所有实验重复3次,得到的平均结果见表1。
[0030]
表1:细胞活性测定结果(顺铂:ic
50
=20.33)
[0031]
化合物i-ai-bi-di-gi-hi-ii-ki-mi-ni-oic
50
(um)18.620.525.818.714.924.810.2520.619.710.0
[0032]
从表1可以看出,本发明的化合物,具有与顺铂相当甚至更好的抗k562活性。
[0033]
与现有技术相比,本发明的优点在于:本发明实现了首例n-2,2,2-三氟乙基靛红亚胺极翻转的1,4-偶极环加成反应,首次公开了一系列手性3-螺环氧化吲哚并苯并噻吩砜类化合物,该类化合物具有四个连续的手性中心且含有易官能团基团,便于衍生合成其他手性螺环氧化吲哚类化合物;同时,通过初步的细胞活性研究,表明该类化合物对人白血病细胞k562有很好的抑制作用,有望成为抗肿瘤药物的先导化合物;而且,本方法具有反应条件温和,原料与催化剂易得,操作简单,催化剂用量低(可低至1mol%),收率高,且立体选择
性非常好(》20:1dr,99%ee)的优点。
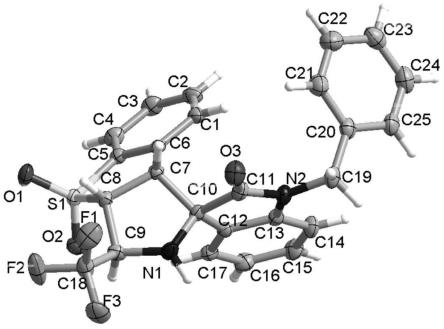
附图说明
[0034]
图1为实施例1制得的i-a的氢谱图;
[0035]
图2为实施例1制得的i-a的碳谱图;
[0036]
图3为实施例1制得的i-a的单晶图。
具体实施方式
[0037]
下面将结合实施例对本发明作进一步说明。
[0038]
本发明所用的原料、溶剂、催化剂、分子筛等等,均为市购。
[0039]
实施例1:合成化合物(
ⅰ‑
a)
[0040][0041]
氩气保护下,向干燥的反应试管中依次加入cu盐(1.8mg,5mol%)、配体(2.8mg,5.5mol%)以及1ml溶剂,室温反应2h后,再依次加入靛红亚胺(ii)(0.12mmol,1.2equiv)、碱(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii)(0.1mmol,1.0equiv),加料完毕后,反应体系在氩气保护下。反应完毕后,直接柱层析分离得目标产物i-a,不同的反应条件如表2所示,:
[0042]
表2不同反应条件下的反应结果
[0043][0044]
从表2中可见,采用5mol%cu(otf)2,5.5mol%l3,20mol%cs2co3,甲苯作溶剂,反
应温度为0℃,是更为优选的方案。
[0045]
所得化合物i-a为白色固体,97%收率,》20:1dr;96%ee;化合物i-a的旋光、熔点、氢谱、碳谱以及质谱数据如下:[α]
d20
=+224.2(c 2.00,ch2cl2),m.p.208.2-209.3℃.hplc:96%ee;chiralpak ib column(hexane/
i-proh=80/20;flow rate:1.0ml/min;λ=254nm;t
major
=12.12min,t
minor
=13.56min).1h nmr(300mhz,cdcl3)δ7.64(d,j=7.8hz,1h),7.47
–
7.27(m,6h),7.11(t,j=7.6hz,1h),7.07
–
6.96(m,2h),6.73(d,j=7.8hz,1h),6.65(t,j=7.6hz,1h),6.38(d,j=7.8hz,1h),5.05(d,j=15.2hz,1h),4.96
–
4.71(m,3h),4.38(dd,j=10.3,4.6hz,1h),2.87(d,j=7.9hz,1h).
13
c nmr(75mhz,cdcl3)δ176.6,142.0,138.1,135.7,134.1,134.0,130.3,129.8,129.1,128.5,128.2,127.9,126.2,125.1,124.6(q,j=279.9hz),123.4,121.8,109.3,72.0,64.7,61.0(q,j=32.4hz),54.3,44.5.hrms(esi)calcd.for c
25h20
f3n2o3s[m+h]
+
:485.1147;found:485.1159;具体的,其氢谱、碳谱和单晶图谱分别如图1、图2和图3所示。
[0046]
实施例2:合成化合物(i-b)
[0047][0048]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-b)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-b(白色固体,收率94%,》20:1dr,96%ee)。
[0049]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.162.5-163.7℃;[α]
d20
=+120.7(c 2.00,ch2cl2).hplc:96%ee;chiralpak ic column(hexane/
i-proh=70/30;flow rate:1.0ml/min;λ=254nm;t
major
=9.21min,t
minor
=12.11min).1h nmr(400mhz,dmso-d6)δ7.76(d,j=7.8hz,1h),7.42(t,j=7.5hz,1h),7.32(td,j=7.6,1.2hz,1h),7.10(td,j=7.7,1.2hz,1h),6.96
–
6.85(m,2h),6.75(d,j=7.7hz,1h),6.65(td,j=7.5,1.0hz,1h),4.83(d,j=9.8hz,1h),4.80
–
4.70(m,2h),4.56(d,j=6.0hz,1h),3.21(s,3h).
13
c nmr(101mhz,dmso-d6)δ176.2,142.7,137.7,134.7,134.2,130.2,129.3,129.1,129.0,126.5,125.0(q,j=280.9hz),124.4,123.7,122.0,121.3,108.4,71.1,63.5,59.5(q,j=31.3hz),53.6,26.6.hrms(esi)calcd.for c
19h16
f3n2o3s[m+h]
+
:409.0834;found:409.0833.
[0050]
实施例3:合成化合物(i-c)
[0051][0052]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-c)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-c(白色固体,收率98%,》20:1dr,97%ee)。
[0053]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.78.5-79.2℃;[α]
d20
=+111.2(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=70/30;flow rate:1.0ml/min;λ=254nm;t
major
=8.04min,t
minor
=9.42min).1h nmr(300mhz,dmso-d6)δ7.76(d,j=7.7hz,1h),7.42(t,j=7.5hz,1h),7.34(t,j=7.4hz,1h),7.09(t,j=7.7hz,1h),6.95(t,j=7.3hz,2h),6.74
–
6.59(m,2h),4.84(d,j=10.0hz,1h),4.80
–
4.68(m,2h),4.59(d,j=5.9hz,1h),3.86
–
3.69(m,2h),1.22(t,j=7.0hz,3h).
13
c nmr(101mhz,dmso-d6)δ175.8,141.6,137.7,134.7,134.2,130.2,129.2,126.2,125.1(q,j=280.8hz),124.7,121.9,121.4,108.5,71.1,63.5,59.5(q,j=31.5hz),53.7,34.5,12.5.hrms(esi)calcd.for c
20h17
f3n2nao3s[m+na]
+
:445.0810;found:445.0794。
[0054]
实施例4:合成化合物(i-d)
[0055][0056]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-d)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-d(白色固体,收率98%,》20:1dr,93%ee)。
[0057]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.212.3-213.5℃;[α]
d20
=+225.3(c 2.00,ch2cl2).hplc:93%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=26.42min,t
minor
=30.36min).1h nmr(300mhz,dmso-d6)δ7.81(d,j=7.8hz,1h),7.49
–
7.35(m,5h),7.35
–
7.23(m,2h),6.94
–
6.85(m,2h),6.80(dt,j=8.5,1.5hz,1h),6.55(d,j=7.8hz,1h),5.01(d,j=15.6hz,1h),4.97
–
4.86(m,2h),4.86
–
4.72(m,3h).
13
c nmr(101mhz,dmso-d6)δ176.5,158.0(d,j=238.0hz),138.0,137.7,136.2,134.3,134.3,130.8(d,j=7.9hz),130.6,128.8,127.8,
127.7,126.2,125.1(q,j=280.8hz),121.6,115.4(d,j=23.3hz),112.7(d,j=25.8hz),110.1(d,j=8.1hz),71.6,63.7,59.3(q,j=31.3hz),54.1,43.4.hrms(esi)calcd.for c
25h19
f4n2o3s[m+h]
+
:503.1053;found:503.1063。
[0058]
实施例5:合成化合物(i-e)
[0059][0060]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-e)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-e(白色固体,收率98%,》20:1dr,97%ee)。
[0061]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.188.5-189.3℃;[α]
d20
=+178.6(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=20.14min,t
minor
=23.55min).1h nmr(300mhz,dmso-d6)δ7.77(d,j=7.8hz,1h),7.44(d,j=7.8hz,1h),7.42
–
7.37(m,2h),7.37
–
7.26(m,4h),6.94(dd,j=11.9,8.3hz,1h),6.79(d,j=7.1hz,1h),6.67(td,j=7.9,4.4hz,1h),6.58(d,j=7.8hz,1h),5.12(d,j=15.9hz,1h),5.00(d,j=15.9hz,1h),4.88(dd,j=13.8,7.9hz,2h),4.84
–
4.71(m,2h).
13
c nmr(101mhz,dmso-d6)δ176.6,146.5(d,j=242.8hz),137.8,137.0,134.3,134.3,132.3,130.4,129.3,128.8,128.2(d,j=8.0hz),127.7,127.1,126.5,126.3,125.1(q,j=280.8hz),123.7,123.4(d,j=6.3hz),121.5,121.1(d,j=3.0hz),120.9,117.2(d,j=19.2hz),71.4,63.5,59.5(q,j=31.5hz),54.2,45.3.hrms(esi)calcd.for c
25h18
f4n2nao3s[m+na]
+
:525.0872;found:525.0878。
[0062]
实施例6:合成化合物(i-f)
[0063][0064]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-f)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-f(白色固体,收率85%,》20:1dr,91%ee)。
[0065]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.242.4-243.1℃;[α]
d20
=+288.5(c 2.00,ch2cl2).hplc:91%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=25.24min,t
minor
=29.22min).1h nmr(300mhz,dmso-d6)δ7.80(d,j=7.7hz,1h),7.46(t,j=7.6hz,1h),7.43
–
7.34(m,3h),7.34
–
7.23(m,3h),7.06(dd,j=8.2,1.1hz,1h),6.92(dd,j=7.5,1.2hz,1h),6.74
–
6.63(m,2h),5.40(d,j=16.5hz,1h),5.28(d,j=16.5hz,1h),4.91(dd,j=11.3,7.9hz,2h),4.82(t,j=5.8hz,2h).
13
c nmr(101mhz,dmso-d6)δ176.3,140.6,137.6,136.0,134.3,134.2,130.9,130.5,128.8,127.8,127.7,126.3,126.2,125.1,125.06(q,j=280.8hz),121.5,110.5,71.4,63.7,59.3(q,j=31.3hz),54.1,43.4.hrms(esi)calcd.for c
25h18
clf3n2nao3s[m+na]
+
:541.0576;found:541.0577。
[0066]
实施例7:合成化合物(i-g)
[0067][0068]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-g)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-g(白色固体,收率94%,》20:1dr,96%ee)。
[0069]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.244.5-245.6℃;[α]
d20
=+142.6(c 2.00,ch2cl2).hplc:96%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=24.00min,t
minor
=27.93min).1h nmr(300mhz,dmso-d6)δ7.81(d,j=7.8hz,1h),7.45(t,j=7.6hz,1h),7.39(d,j=4.3hz,4h),7.35
–
7.17(m,3h),7.10(d,j=2.0hz,1h),6.84(d,j=8.4hz,1h),6.53(d,j=7.8hz,1h),5.00(d,j=15.6hz,1h),4.91(d,j=10.8hz,1h),4.89
–
4.67(m,4h).
13
c nmr(75mhz,dmso-d6)δ176.3,141.0,137.6,136.0,134.3,134.2,131.7,131.2,130.7,128.9,127.9,127.9,127.7,126.3,126.1,125.1(q,j=278.3hz),121.4,114.2,111.1,71.5,63.8,59.5(q,j=31.6hz),54.2,43.5.hrms(esi)calcd.for c
25h18
brf3n2nao3s[m+na]
+
:585.0071;found:585.0079。
[0070]
实施例8:合成化合物(i-h)
[0071]
[0072]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-h)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-h(白色固体,收率95%,》20:1dr,97%ee)。
[0073]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.217.3-218.2℃;[α]
d20
=+100.5(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=80/20;flow rate:1.0ml/min;λ=254nm;t
major
=14.86min,t
minor
=18.14min).1h nmr(300mhz,dmso-d6)δ7.79(d,j=7.8hz,1h),7.61
–
7.14(m,7h),6.78(d,j=8.5hz,1h),6.67(s,1h),6.55(dd,j=18.2,8.1hz,2h),4.94(q,j=13.8,12.0hz,3h),4.85
–
4.63(m,3h),3.42(s,3h).
13
c nmr(75mhz,dmso-d6)δ176.1,155.0,137.8,136.4,134.9,134.5,134.1,130.2,130.1,128.6,127.6,126.2,125.0(q,j=278.3hz),121.3,114.0,111.6,109.5,71.5,63.6,59.4(q,j=31.5hz),55.2,53.8,43.3.hrms(esi)calcd.for c
26h21
f3n2nao4s[m+na]
+
:537.1072;found:537.1085。
[0074]
实施例9:合成化合物(i-i)
[0075][0076]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-i)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-i(白色固体,收率98%,》20:1dr,97%ee)。
[0077]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.223.4-224.1℃;[α]
d20
=+121.4(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=29.68min,t
minor
=36.00min).1h nmr(400mhz,dmso-d6)δ7.78(d,j=7.7hz,1h),7.48
–
7.35(m,5h),7.31(dq,j=9.4,3.7,2.8hz,1h),7.23(t,j=7.5hz,1h),6.82(d,j=7.9hz,1h),6.80
–
6.72(m,2h),6.49(d,j=7.9hz,1h),4.99(d,j=15.5hz,1h),4.90(d,j=11.5hz,1h),4.87(d,j=5.8hz,1h),4.83
–
4.73(m,2h),4.70(d,j=6.0hz,1h),1.90(s,3h).
13
c nmr(101mhz,dmso-d6)δ176.3,139.3,137.8,136.4,134.6,134.0,131.0,130.2,129.1,128.7,127.6,126.2,125.6,125.1(q,j=280.8hz),121.2,108.8,71.3,63.6,59.6(q,j=31.2hz),53.8,43.3,20.5.hrms(esi)calcd.for c
26h21
f3n2nao3s[m+na]
+
:521.1123;found:521.1124。
[0078]
实施例10:合成化合物(i-j)
[0079][0080]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-j)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-j(白色固体,收率97%,》20:1dr,92%ee)。
[0081]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.235.6-236.3℃;[α]
d20
=+215.7(c 2.00,ch2cl2).hplc:92%ee;chiralpak ia column(hexane/
i-proh=85/15;flow rate:1.0ml/min;λ=254nm;t
major
=22.68min,t
minor
=26.05min).1h nmr(400mhz,dmso-d6)δ7.79(d,j=7.6hz,1h),7.50
–
7.35(m,4h),7.30(t,j=7.3hz,1h),7.25(d,j=7.1hz,2h),6.84
–
6.72(m,3h),6.56(t,j=7.6hz,1h),5.31(d,j=17.2hz,1h),5.14(d,j=17.2hz,1h),4.94(d,j=9.8hz,1h),4.79(dq,j=9.3,6.0,4.1hz,3h),2.17(s,3h).
13
c nmr(101mhz,dmso-d6)δ177.9,139.9,137.9,137.8,134.7,134.2,132.9,130.2,129.9,128.9,127.2,126.6,125.7,125.1(q,j=280.8hz),122.7,122.3,121.4,119.3,70.5,63.7,59.6(q,j=31.3hz),53.9,44.8,18.3.hrms(esi)calcd.for c
26h21
f3n2nao3s[m+na]
+
:521.1123;found:521.1127。
[0082]
实施例11:合成化合物(i-k)
[0083][0084]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-k)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-a)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-k(白色固体,收率98%,》20:1dr,97%ee)。
[0085]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.230.3-231.2℃;[α]
d20
=+175.7(c 2.00,ch2cl2).hplc:97%ee;chiralpak ia column(hexane/
i-proh=80/20;flow rate:1.0ml/min;λ=254nm;t
major
=13.02min,t
minor
=15.34min).1h nmr(300mhz,dmso-d6)δ7.80(d,j=7.6hz,1h),7.52
–
7.34(m,4h),7.29(t,j=7.1hz,1h),7.23
(d,j=7.0hz,2h),6.74(d,j=7.6hz,1h),6.61(d,j=9.6hz,2h),5.28(d,j=17.2hz,1h),5.10(d,j=17.2hz,1h),4.91(d,j=9.9hz,1h),4.86
–
4.67(m,3h),2.11(s,3h),1.86(s,3h).
13
c nmr(101mhz,dmso-d6)δ177.8,137.9,137.9,137.5,134.8,134.2,133.1,131.1,130.2,130.0,128.8,128.8,127.2,126.6,125.8,125.1(q,j=280.8hz),123.6,121.2,118.9,70.7,63.8,59.7(q,j=31.3hz),53.9,44.8,20.1,18.1.hrms(esi)calcd.for c
27h23
f3n2nao3s[m+na]
+
:535.1279;found:535.1277。
[0086]
实施例12:合成化合物(i-l)
[0087][0088]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-b)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-l(白色固体,收率99%,》20:1dr,97%ee)。
[0089]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.230.8-231.4℃;[α]
d20
=+201.7(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=22.65min,t
minor
=25.73min).1h nmr(400mhz,dmso-d6)δ7.88(dd,j=8.7,4.9hz,1h),7.45(d,j=7.0hz,2h),7.38(t,j=7.4hz,2h),7.35
–
7.25(m,2h),7.12
–
7.02(m,1h),6.94(dd,j=7.6,2.9hz,2h),6.67(t,j=7.5hz,1h),6.34(dd,j=8.9,2.3hz,1h),4.97(q,j=15.6hz,2h),4.91
–
4.82(m,2h),4.79(q,j=4.6,2.6hz,2h).
13
c nmr(101mhz,dmso-d6)δ176.3,165.0(d,j=253.0hz),141.7,138.20(d,j=10.2hz),136.4,134.1,129.3,128.7,128.5,127.7,127.7,126.4,125.0(q,j=281.8hz),124.6,124.32(d,j=10.2hz),123.7,122.2,120.9,118.2(d,j=24.2hz),113.1(d,j=23.7hz),109.2,71.2,64.2,59.7(q,j=31.5hz),53.5,43.3.hrms(esi)calcd.for c
25h19
f4n2o3s[m+h]
+
:503.1053;found:503.1050。
[0090]
实施例13:合成化合物(i-m)
[0091][0092]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-c)
(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-m(白色固体,收率97%,》20:1dr,96%ee)。
[0093]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.177.8-178.3℃;[α]
d20
=+133.8(c 2.00,ch2cl2).hplc:96%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=22.61min,t
minor
=26.89min).1h nmr(300mhz,dmso-d6)δ7.82(d,j=8.4hz,1h),7.51
–
7.30(m,6h),7.08(td,j=7.7,1.3hz,1h),6.93(t,j=7.2hz,2h),6.67(t,j=7.4hz,1h),6.56(d,j=1.8hz,1h),5.06
–
4.90(m,2h),4.91
–
4.71(m,4h).
13
c nmr(101mhz,dmso-d6)δ176.4,141.7,138.9,137.0,136.5,130.6,129.3,128.8,128.7,127.7,127.7,127.7,126.3,125.1(q,j=280.8hz),124.6,123.3,122.3,109.2,71.3,64.1,59.6(q,j=31.5hz),53.6,43.3.hrms(esi)calcd.for c
25h18
clf3n2nao3s[m+na]
+
:541.0576;found:541.0591。
[0094]
实施例14:合成化合物(i-n)
[0095][0096]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-d)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-n(白色固体,收率98%,》20:1dr,97%ee)。
[0097]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.181.2-182.4℃;[α]
d20
=+28.4(c 2.00,ch2cl2).hplc:97%ee;chiralpak ia column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=42.78min,t
minor
=55.75min).1h nmr(300mhz,dmso-d6)δ7.42(p,j=7.8hz,5h),7.35
–
7.27(m,1h),7.22(t,j=7.8hz,1h),7.05(t,j=7.7hz,1h),6.97(d,j=7.4hz,1h),6.90(d,j=7.8hz,1h),6.71(t,j=7.5hz,1h),6.49(d,j=7.8hz,1h),5.04(d,j=15.6hz,1h),4.97
–
4.73(m,5h).
13
c nmr(101mhz,dmso-d6)δ176.2,141.7,137.8,136.3,135.5,134.9,130.7,129.2,128.8,128.7,,127.7,127.6,127.6,127.4,,125.2,125.0(q,j=280.8hz)124.5,,122.3,,109.3,71.2,64.7,59.6(q,j=31.6hz),53.0,43.3.hrms(esi)calcd.for c
25h18
clf3n2nao3s[m+na]
+
:541.0576;found:541.0584。
[0098]
实施例15:合成化合物(i-o)
[0099][0100]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-e)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-o(白色固体,收率98%,》20:1dr,96%ee)。
[0101]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.182.3-183.4℃;[α]
d20
=+97.5(c 2.00,ch2cl2).hplc:96%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=24.44min,t
minor
=29.08min).1h nmr(400mhz,dmso-d6)δ7.75(d,j=8.4hz,1h),7.60(dd,j=8.4,1.7hz,1h),7.46(d,j=6.9hz,2h),7.40(t,j=7.6hz,2h),7.35
–
7.28(m,1h),7.08(td,j=7.8,1.2hz,1h),6.93(dd,j=11.3,7.7hz,2h),6.73(s,1h),6.68(t,j=7.5hz,1h),5.06
–
4.86(m,3h),4.86
–
4.73(m,3h).
13
c nmr(101mhz,dmso dmso-d6)δ176.4,141.7,137.0,136.8,136.4,133.3,129.3,129.3,128.8,128.7,127.7,127.6,127.6,125.0(q,j=280.8hz)124.5,123.2,122.2,109.1,71.3,64.0,59.6(q,j=31.7hz),53.5,43.3.hrms(esi)calcd.for c
25h18
brf3n2nao3s[m+na]
+
:585.0071;found:585.0061。
[0102]
实施例16:合成化合物(i-p)
[0103][0104]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-f)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-p(白色固体,收率99%,》20:1dr,97%ee)。
[0105]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.149.5-150.3℃;[α]
d20
=+347.9(c 2.00,ch2cl2).hplc:97%ee;chiralpak ia column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=47.19min,t
minor
=63.37min).1h nmr(400mhz,dmso-d6)δ7.59(d,j=7.8hz,1h),7.45
–
7.35(m,4h),7.34
–
7.27(m,1h),7.11(t,j=7.8hz,1h),7.04(t,j=7.5hz,1h),6.94(dd,j=7.6,1.2hz,1h),6.89(d,j=7.8hz,1h),6.74
–
6.65(m,1h),6.51(d,j=7.7hz,1h),5.02(d,j=15.6hz,1h),4.89(d,j=15.6hz,
1h),4.87
–
4.74(m,4h).
13
c nmr(101mhz,dmso-d6)δ176.4,141.8,138.1,136.7,136.3,135.5,134.0,129.3,,128.8,127.8,127.7,125.6,125.0(q,j=280.8hz),124.6,122.4,115.0,109.3,71.4,64.7,59.6(q,j=31.6hz),52.8,43.4.hrms(esi)calcd.for c
25h18
brf3n2nao3s[m+na]
+
:585.0071;found:585.0083。
[0106]
实施例17:合成化合物(i-q)
[0107][0108]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-g)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-q(白色固体,收率98%,》20:1dr,95%ee)。
[0109]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.68.3-69.5℃;[α]
d20
=+7.7(c 2.00,ch2cl2).hplc:95%ee;chiralpak ic column(hexane/
i-proh=75/25;flow rate:1.0ml/min;λ=254nm;t
major
=12.99min,t
minor
=14.99min).1h nmr(300mhz,dmso-d6)δ7.45
–
7.35(m,4h),7.35
–
7.23(m,2h),7.05(td,j=7.7,1.2hz,1h),6.96(d,j=7.4hz,1h),6.89(d,j=7.8hz,1h),6.79(dd,j=8.6,2.5hz,1h),6.73
–
6.63(m,1h),6.42(d,j=8.6hz,1h),5.08
–
4.85(m,2h),4.76(d,j=25.0hz,4h),3.73(s,3h).
13
c nmr(75mhz,dmso-d6)δ176.5,160.4,141.7,138.9,136.3,129.1,129.0,128.7,127.6,127.6,127.2,126.3,125.1(q,j=278.3hz),124.8,122.2,122.1,109.1,103.9,71.2,64.5,59.4(q,j=31.2hz),56.0,53.1,43.2.hrms(esi)calcd.for c
26h22
f3n2o4s[m+h]
+
:515.1252;found:515.1262。
[0110]
实施例18:合成化合物(i-r)
[0111][0112]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-h)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-r(白色固体,收率98%,》20:1dr,97%ee)。
[0113]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.215.4-216.3℃;
[α]
d20
=+169.8(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=75/25;flow rate:1.0ml/min;λ=254nm;t
major
=13.12min,t
minor
=16.04min).1h nmr(400mhz,dmso-d6)δ7.59(d,j=8.1hz,1h),7.50(d,j=7.0hz,2h),7.41(t,j=7.4hz,2h),7.37
–
7.29(m,1h),7.21
–
7.13(m,1h),7.03(t,j=7.7hz,1h),6.94(t,j=8.6hz,2h),6.63(t,j=7.5hz,1h),6.20(s,1h),5.06(d,j=15.3hz,1h),4.92
–
4.80(m,2h),4.75(td,j=11.8,10.2,5.6hz,2h),4.67(d,j=6.3hz,1h),1.86(s,3h).
13
c nmr(101mhz,dmso-d6)δ176.5,144.6,141.6,136.6,135.2,134.8,131.0,129.2,129.0,128.8,128.0,127.8,126.3,125.0(q,j=280.8hz),124.6,122.3,121.1,109.0,71.3,63.8,59.7(q,j=31.5hz),53.8,43.3,20.7.hrms(esi)calcd.for c
26h22
f3n2o3s[m+h]
+
:499.1303;found:499.1308。
[0114]
实施例19:合成化合物(i-s)
[0115][0116]
氩气保护下,向干燥的反应试管中依次加入cu(otf)2(1.8mg,5mol%)、配体l3(2.8mg,5.5mol%)以及甲苯1ml,室温反应2h后,再依次加入靛红亚胺(ii-a)(0.12mmol,1.2equiv)、碳酸铯(6.6mg,20mol%)以及苯并噻吩衍生的不饱和砜化合物(iii-i)(0.1mmol,1.0equiv),加料完毕后,反应体系在0℃下反应48h,反应完毕后,直接柱层析分离得目标产物i-s(白色固体,收率98%,》20:1dr,97%ee)。
[0117]
所得化合物的熔点、旋光、氢谱、碳谱以及质谱数据如下:m.p.69.8-70.3℃;[α]
d20
=+58.7(c 2.00,ch2cl2).hplc:97%ee;chiralpak ic column(hexane/
i-proh=90/10;flow rate:1.0ml/min;λ=254nm;t
major
=48.48min,t
minor
=57.40min).1h nmr(300mhz,dmso-d6)δ7.84(d,j=8.2hz,1h),7.66(dd,j=8.2,1.6hz,1h),7.56
–
7.46(m,2h),7.41
–
7.22(m,6h),7.10
–
7.03(m,2h),7.03
–
6.94(m,1h),6.91(d,j=7.9hz,2h),6.70(s,1h),6.62(td,j=7.5,1.2hz,1h),5.12(d,j=15.5hz,1h),5.02(d,j=9.7hz,1h),4.91
–
4.72(m,4h).
13
cnmr(75mhz,dmso)δ177.1,145.8,141.7,137.7,136.5,136.3,135.8,129.1,128.9,128.8,128.6,127.7,127.6,126.7,125.1(q,j=280.0hz),124.7,124.2,122.2,121.8,108.9,71.5,64.3,59.7(q,j=31.6hz),53.9,43.3.hrms(esi)calcd.for c
31h24
f3n2o3s[m+h]
+
:561.1460;found:561.1472。
[0118]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1