一种动物神经系统血管平滑肌细胞单细胞的分离方法与流程
1.本发明属于生物技术领域,具体涉及一种动物神经系统血管平滑肌细胞单细胞的分离方法。
背景技术:
2.血管在神经活性方面发挥了举足轻重的作用。血管平滑肌细胞是构成血管中膜的主要细胞成分,是机体重要的代谢和内分泌器官之一,在各种各样的生理过程中扮演着重要作用,血管平滑肌细胞功能障碍与疾病的发生发展密切相关。研究表明,在病理过程中,血管平滑肌细胞通过自身增殖、迁移及合成细胞外基质,参与高血压、动脉粥样硬化、移植血管病、血管成形术后再狭窄和血管壁损伤后的修复等多种血管疾病的生理、病理过程。因此,血管平滑肌细胞已经成为医疗卫生领域中重要的研究对象。
3.每个细胞都是独一无二的,即使是同一器官或组织中的同种类型细胞也都具有异质性。大脑作为生物体最重要的器官,其中包含了多种类型的细胞,均具有其独有的特征,如血管平滑肌细胞,它是提高血管舒缩活动的基础。在现今高血压等各种血管疾病的研究之中可以发现,诚信可靠的平滑肌细胞能够有效的提高血管张力的效果,让血管收缩更加正常,借助这种平滑肌细胞能够有效的提高血管的活力,对于高血压疾病的治愈和防治而言都有着尤为重要的作用,而在实验之中也可以发现该种平滑肌细胞更是组成血管壁的重要成分,借助这种平滑肌细胞无疑提高了血管的通畅性和输送能力。
4.血管平滑肌细胞是提高疾病康复和治疗效果的重要基础。在现今各种血管疾病的康复方法之中,只有提高平滑肌细胞的生长活力才能够保证更好的后续效果,而通过平滑肌细胞交易排行可以发现这种平滑机细胞的应用,能够有效的提高免疫组织的能力让后续的血管动力得到大幅度的提升,在疾病康复的手段之中应用这种平滑肌细胞也能够提高身体的抵抗力获得更好的康复效果;
5.总而言之。血管平滑肌细胞作为身体之中不可或缺的一种细胞类型,其本身直接影响到了血管壁的生长效果和血管的正常功能,因此在平滑肌技术的培养之中更需要相关科研人员了解其培养的模式和使用方法,以正确的方式提高这种平滑肌细胞的生长能力,让其血管壁拥有更强的动力提高生物科学的研发能力。
6.中风作为我国的第一大死因,研究血管平滑肌细胞的功能能为治疗中风提供新的方法和策略。但是中枢神经系统中血管平滑肌细胞的种类及其功能尚不完全清楚,单细胞测序技术对我们精准地了解某种类型的细胞的功能及他们之间的相互作用都起到不可比拟的作用。但是目前尚未有专门针对哺乳动物神经组织中血管平滑肌细胞单细胞悬液进行制备的方法。
技术实现要素:
7.本发明针对上述缺陷,提供一种动物神经系统血管平滑肌细胞单细胞悬液的制备方法。该方法操作简便、成本低、效率高,且无需借助特定的仪器、适合工业化生产,通过该
方法制备得到的神经血管平滑肌细胞单细胞可用来进行单细胞测序或者其他分析,有利于深入研究神经系统血管平滑肌细胞的特性。
8.本发明通过以下技术方案实现:
9.本发明提供一种动物神经系统血管平滑肌细胞单细胞的分离方法,包括:
10.将切碎后的新鲜神经组织与细胞解离消化液混合培养后,离心,加入总细胞培养液,过滤后得到细胞混合物a;
11.将细胞混合物a与内皮细胞梯度分离液混合,纯化分离后,得到包含有血管平滑肌细胞和内皮细胞的细胞混合物b;
12.将细胞混合物b与血管平滑肌细胞梯度分离液混合,纯化分离血管平滑肌细胞单细胞;
13.其中,血管平滑肌细胞梯度分离液由血管平滑肌细胞分离液与总细胞培养液复配形成,血管平滑肌细胞分离液中含有体积百分数为58~62%的碘克沙醇。
14.进一步地,在本发明较佳的实施例中,上述血管平滑肌细胞梯度分离液是通过将第三溶液按照体积比1:0.8~1.2加到第四溶液的上方,第三溶液中血管平滑肌细胞分离液与总细胞培养液之间的体积比为2~3:17~18;第四溶液中血管平滑肌细胞分离液与总细胞培养液之间的体积比为2.5:17.5。
15.进一步地,在本发明较佳的实施例中,上述内皮细胞梯度分离液由内皮细胞分离液与总细胞培养液复配形成,内皮细胞分离液中含有质量浓度为1.2~1.4 g/ml的硅胶颗粒,硅胶颗粒中包覆有乙烯吡咯烷酮。
16.进一步地,在本发明较佳的实施例中,上述内皮细胞梯度分离液是通过将第一溶液按照体积比1:2~4加到第二溶液的上方,第一溶液中内皮细胞分离液与总细胞培养液之间的体积比为1~3:37~39;第二溶液中内皮细胞分离液与总细胞培养液之间的体积比为2:38。
17.进一步地,在本发明较佳的实施例中,制备细胞混合物b的步骤包括:
18.将细胞混合物a与内皮细胞梯度分离液混合,得到完整的内皮细胞梯度分离体系,将内皮细胞梯度分离体系在室温下2000~2500g离心15~20min,去除最上层的内皮细胞培养基,以及最下层的其它神经系统细胞及死细胞,保留中间含有内皮细胞和血管平滑肌细胞的内皮细胞层,洗涤。
19.进一步地,在本发明较佳的实施例中,上述洗涤内皮细胞层的步骤包括:
20.将内皮细胞层与总细胞培养液混合后,在室温下150~250g离心1~3min,用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到内皮细胞单细胞混悬液。
21.进一步地,在本发明较佳的实施例中,上述制备血管平滑肌细胞单细胞的步骤包括:
22.将细胞混合物b加至血管平滑肌细胞梯度分离液的上方,得到完整的血管平滑肌细胞梯度分离体系,将血管平滑肌细胞梯度分离体系在室温下700~900g 离心12~17min,去除最上层的细胞培养基,以及中间层的血管内皮细胞,保留最下面0.5~1.5ml的血管平滑肌细胞层,洗涤。
23.进一步地,在本发明较佳的实施例中,上述洗涤血管平滑肌细胞层的步骤包括:
24.将血管平滑肌细胞层与总细胞培养液混合后,在室温下150~250g离心1~3 min,
用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到血管平滑肌细胞单细胞混悬液。
25.进一步地,在本发明较佳的实施例中,上述总细胞培养液中至少含有:青霉素/链霉素双抗、dmem培养基和胎牛血清。
26.进一步地,在本发明较佳的实施例中,上述细胞解离消化液是在总细胞培养液中加入1~3mg/ml的pronase e蛋白酶和22~28u/ml的dnase i配制的。
27.与现有技术相比,本发明至少具有如下技术效果:
28.在大脑组织中,神经内皮细胞与血管平滑肌细胞在结构和功能上精密相连,二者的细胞大小、沉降系数差异非常小。且,相对于内皮细胞,血管平滑肌细胞的数量极少,这就使得采用现有的细胞分离方法难以从神经内皮细胞中分离出血管平滑肌细胞单细胞。因此,如何在保持血管平滑肌细胞单细胞活力的同时有效去除神经内皮细胞、神经元以及其它神经细胞,对能否成功分离得到纯的血管平滑肌细胞单细胞至关重要。
29.本技术提供的这种分离方法,通过将新鲜神经组织与含有蛋白酶和dna酶的细胞解离消化液混合消化后,得到神经组织细胞混合物。该细胞解离消化液无需预先通氧,其氧气含量小,由于神经元细胞对氧气比较敏感,在消化的过程中大部分神经元细胞会因缺氧而死亡。随后,通过用内皮细胞梯度分离液首先将含有血管平滑肌细胞的内皮细胞分离出来,由于内皮细胞梯度分离液中含有的硅胶颗粒中包覆有乙烯吡咯烷酮,渗透压很低,粘度也很小,扩散常数低,所形成的梯度十分稳定,且不穿透生物膜,对细胞无毒害,能够特异性地调节细胞梯度分离液对不同类型以及死细胞的沉降性,从而实现纯化内皮细胞的目的。随后,通过用血管平滑肌细胞梯度分离液将血管平滑肌细胞与血管内皮细胞分离,最终得到纯净的血管平滑肌细胞。由于血管平滑肌细胞梯度分离液中含有碘克沙醇,和常规的分离液ficoll、percoll、蔗糖及氯化铯(cscl)相比,这种碘克沙醇分离液不仅分离纯化效果好,而且对各种细胞、细胞器的生命活性无任何影响。
30.这种动物神经系统血管平滑肌细胞单细胞悬液的制备方法,操作简便、成本低、效率高,且无需借助特定的仪器、适合工业化生产,通过该方法制备得到的神经血管平滑肌细胞单细胞可用来进行单细胞测序或者其他分析,有利于深入研究神经血管平滑肌细胞的特性。
31.说明书附图
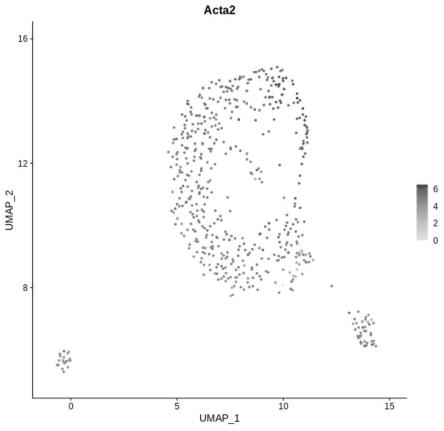
32.图1为实施例1中得到的小鼠大脑皮层中的神经系统血管平滑肌细胞的 umap图,从图中可知几乎所有的细胞都能被血管平滑肌细胞的标志物acta2 标记上,说明得到的细胞纯度高。
33.图2为使用实施例1得到的小鼠大脑皮层中的神经系统血管平滑肌细胞进行亚型分类后各亚型的特异性表达基因。
34.图3为使用实施例1得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基因进行go分析的结果。
35.图4为对照组1得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基因进行go分析的结果。
36.图5为对照组2得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基因进行go分析的结果。
37.图6为对照组3得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基
因进行go分析的结果。
38.图7为对照组4得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基因进行go分析的结果。
具体实施方式
39.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围,实施例中未注明的具体条件,按照常规条件或者制造商建议的条件进行,所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
40.本发明的技术方案为:
41.一种动物神经系统血管平滑肌细胞单细胞的分离方法,包括:
42.步骤s1:将切碎后的新鲜神经组织与细胞解离消化液混合培养后,离心,加入总细胞培养液,过滤后得到细胞混合物a。
43.其中,新鲜神经组织来自动物组织,且该新鲜神经组织是经过灌流处理后获得的新鲜动物组织。优选地,获得动物组织的方法为:三溴乙醇麻醉动物后,迅速剪开腹腔,暴露心脏后,注射器插入左心室,剪破右心耳,预冷的不含钙镁离子的杜氏磷酸盐缓冲液(d-pbs)进行心脏灌流至完全去除血液,冰上迅速取出大脑,切取感兴趣区域的部位,低温下用刮胡刀片切碎目的组织。利用无钙镁离子的d-pbs缓冲液对哺乳动物进行灌流,彻底去除血细胞,避免了其对后续测序的影响。如果消化后再单独去除血细胞会导致血管平滑肌细胞纯度下降或降低血管平滑肌细胞的得率。
44.灌流后应先在冰上迅速取出哺乳动物的大脑或脊髓,切取感兴趣区域的神经组织,在冰上用刮胡刀片迅速将感兴趣区域切碎,由于神经细胞对氧气比较敏感,在消化的过程中大部分神经细胞会因缺氧而死亡,在梯度分离时会与包含血管平滑肌细胞的内皮细胞层分离,进而纯化得到内皮细胞,最后进一步对血管平滑肌细胞利用碘克沙醇溶液进行分离纯化。
45.进一步地,在制备细胞混合物的过程中,将新鲜神经组织与细胞解离消化液混合后于33℃下恒温培养30~60min,期间每隔2分钟机械混匀一次。其中机械混匀是指在恒温培养过程中将装有培养液的载体(如离心管、试管等)手动晃动或涡旋震动,有利于提高消化效率,使消化更完全。
46.进一步地,恒温培养后,离心过程中离心力为200g,离心时间为5min。离心过程中,神经组织细胞沉降在底部,与其他消化产生的质量较小的杂质分离。离心后去除上清,加入总细胞培养液吹打机械解离。为减少移液枪头对细胞的损伤,在使用枪头吹打哺乳动物组织时应先将枪头的尖端在酒精灯上抛光或者使用巴斯德枪头。
47.进一步地,在制备细胞混合物的过程中,用孔径为40μm的细胞筛进行过滤,除去大块组织和杂质。
48.优选地,总细胞培养液中至少含有:青霉素/链霉素双抗、dmem培养基和胎牛血清。
49.优选地,细胞解离消化液是在总细胞培养液中加入1~3mg/ml的pronase e 蛋白酶和22~28u/ml的dnase i配制的。pronase e蛋白酶主要是消化黏连细胞的蛋白质,dnase i混合物的作用主要是消化粘连细胞的dna,减少双细胞或多细胞的比例,从而提高单细胞
的得率。
50.这种总细胞培养液和细胞解离消化液中均不需要预先通氧气,在消化的过程中大部分神经细胞会因缺氧而死亡,在梯度分离时会与包含有血管平滑肌细胞的内皮细胞层分离,进而达到纯化细胞混合物a的目的。
51.步骤s2:将细胞混合物a与内皮细胞梯度分离液混合,纯化分离后,得到包含有血管平滑肌细胞和内皮细胞的细胞混合物b;
52.其中,内皮细胞梯度分离液是由内皮细胞分离液与所述总细胞培养液复配形成,内皮细胞分离液中含有质量浓度为1.2~1.4g/ml的硅胶颗粒,优选地,质量浓度为1.3g/ml。硅胶颗粒中包覆有乙烯吡咯烷酮。乙烯吡咯烷酮作为一种合成水溶性高分子化合物,其既溶于水,又溶于大部分有机溶剂,毒性很低,生理相溶性好,乙烯吡咯烷酮有优良的生理惰性,不参与人体新陈代谢,又具有优良的生物相容性,不会对分离的细胞产生毒性。
53.进一步地,内皮细胞梯度分离液是通过将第一溶液按照体积比1:2~4加到第二溶液的上方,第一溶液中所述内皮细胞分离液与所述总细胞培养液之间的体积比为1~3:37~39,优选地按照体积比1:18.5~19.5混合;第二溶液中所述内皮细胞分离液与所述总细胞培养液之间的体积比为5~7:33~35,优选地按照体积比3:16~18混合。
54.进一步地,制备所述细胞混合物b的步骤包括:
55.将所述细胞混合物a与所述内皮细胞梯度分离液混合,得到完整的内皮细胞梯度分离体系,将所述内皮细胞梯度分离体系在室温下2000~2500g离心15 ~20min,去除最上层的内皮细胞培养基,以及最下层的其它神经系统细胞及死细胞,保留中间含有内皮细胞和血管平滑肌细胞的内皮细胞层,洗涤。优选地,离心力为2200~2500g、离心时间为15~17min。
56.优选地,洗涤内皮细胞层的步骤包括:
57.将所述内皮细胞层与所述总细胞培养液混合后,在室温下150~250g离心 1~3min(优选为在180~230g下离心2min),用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到内皮细胞单细胞混悬液。
58.细胞混合物b中主要为血管平滑肌细胞,同时还含有部分内皮细胞、周细胞等,血管平滑肌细胞是大血管的主要组成部分,会贴附在内皮细胞上为内皮细胞提供营养或支持,它与组成小血管成分的周细胞作用相似,两者一直是血管研究领域分开的难点问题,目前尚未有成熟的成立技术,且由于这三类细胞的沉降系数差异非常小,需要进一步纯化分离,以除去其中混有的内皮细胞和周细胞,得到纯的血管平滑肌细胞单细胞。
59.更为优选地,纯化分离内皮细胞步骤中的离心采用水平转子离心机。在该步骤中,不使用定角的离心机,主要是因为定角转子可能会使细胞聚集于某一侧而导致分离效果不佳。
60.步骤s3:将细胞混合物b与血管平滑肌细胞梯度分离液混合,纯化分离血管平滑肌细胞单细胞。
61.其中,所述血管平滑肌细胞梯度分离液由血管平滑肌细胞分离液与总细胞培养液复配形成,所述血管平滑肌细胞分离液中含有体积百分数为58~62%的碘克沙醇,优选地,碘克沙醇的体积分数为60%。
62.进一步地,血管平滑肌细胞梯度分离液是通过将第三溶液按照体积比1: 0.8~
1.2加到第四溶液的上方,所述第三溶液中所述血管平滑肌细胞分离液与所述总细胞培养液之间的体积比为2~3:17~18,优选为5:35;所述第四溶液中所述血管平滑肌细胞分离液与所述总细胞培养液之间的体积比为6~8:32~34,优选为7:33。
63.进一步地,制备所述血管平滑肌细胞单细胞的步骤包括:
64.将所述细胞混合物b加至所述血管平滑肌细胞梯度分离液的上方,得到完整的血管平滑肌细胞梯度分离体系,将所述血管平滑肌细胞梯度分离体系在室温下700~900g离心12~17min(优选为在750~850g离心14~16min),去除最上层的细胞培养基,以及中间层的血管内皮细胞,保留最下面0.5~1.5ml(优选为0.8~1.2ml)的血管平滑肌细胞层,洗涤。
65.优选地,洗涤血管平滑肌细胞层的步骤包括:
66.洗涤所述血管平滑肌细胞层的步骤包括:
67.将所述血管平滑肌细胞层与所述总细胞培养液混合后,在室温下150~250g 离心1~3min,用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到血管平滑肌细胞单细胞混悬液。优选地,离心力为200g、离心时间为2min。
68.更为优选地,纯化分离血管平滑肌细胞步骤中的离心采用水平转子离心机。在该步骤中,不使用定角的离心机,主要是因为定角转子可能会使细胞聚集于某一侧而导致分离效果不佳。
69.以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
70.实施例1
71.本实施例提供一种动物神经系统血管平滑肌细胞单细胞的分离方法,包括:
72.(1)配制单细胞解离专用的消化缓冲液:在无菌的50ml离心管中依次分别加入44.5ml的dmem培养基,5ml的fbs,500μl青霉素/链霉素双抗及终浓度为2mg/ml的pronase e蛋白酶和终浓度为25u/ml的dnase i混合物,配制好消化缓冲液6ml/管进行分装,-20℃及以下温度保存备用。
73.(2)配制总细胞培养液:在无菌的50ml离心管中依次分别加入44.5ml 的dmem培养基,5ml的fbs,500μl青霉素/链霉素双抗,4℃下保存。
74.(3)三溴乙醇麻醉动物后,迅速剪开腹腔,暴露心脏后,注射器插入左心室,剪破右心耳,预冷的不含钙镁离子的d-pbs进行心脏灌流至完全去除血液,冰上迅速取出大脑,切取感兴趣区域的部位,低温下用刮胡刀片切碎目的组织。
75.(4)将切碎后的组织与单细胞解离专用的消化缓冲液混合,33℃恒温培养箱中孵育30min,中间每隔2分钟上下颠倒混匀一次。
76.(5)在上述步骤进行的同时,于无菌超净台中配置如表1所示的第一溶液和第二溶液后,将第一溶液缓慢加入位于15ml离心管的第二溶液上方,得到内皮细胞梯度分离液。表1中细胞分离液中硅胶颗粒的质量浓度为1.3g/ml。
77.表1.内皮细胞梯度分离液的配制
78.溶液 内皮细胞分离液(μl) 总细胞培养液(μl) 合计(μl) 第一溶液 100 1900 2000 第二溶液 300 1700 2000 79.(6)神经组织消化后200g短暂离心4min,去掉上清,加入6ml总细胞培养液吹打机
第一溶液 150 1850 2000 第二溶液 350 1650 2000 94.(8)将细胞混合物a非常小心地加入到第(5)步的细胞梯度分离液中,配制成完整的内皮细胞梯度分离体系,此时离心管中共计10ml溶液。将上述完整的内皮细胞梯度分离液在室温下水平转子离心机2000g离心20min。
95.(9)离心后的内皮细胞梯度分离液上层6ml为含有碎片的内皮细胞培养基,中间层2ml是内皮细胞细胞,最下层2ml是各类神经系统细胞及死细胞。将最上层的培养基吸弃,中间层的2ml溶液转移至新的15ml离心管中,与所述总细胞培养液混合后,在室温下250g离心1min,用不含胎牛血清的dmem 培养基将所得沉淀混合均匀,得到血管细胞混合物b。
96.(10)于无菌超净台中配置如表4所示的第三溶液和第四溶液后,将第三溶液缓慢加入位于15ml离心管的第四溶液上方,得到血管平滑肌细胞梯度分离液。表4中血管平滑肌细胞分离液中碘克沙醇的含量是62%。
97.表4.血管平滑肌细胞梯度分离液的配制
[0098][0099]
(11).将(10)中得到的细胞混合物b非常小心地加入到第10步的血管平滑肌细胞梯度分离液中,配制成完整的血管平滑肌细胞梯度分离体系,此时离心管中共计4ml溶液。将上述完整的血管平滑肌细胞梯度分离体系在室温下水平转子离心机700g离心12min。
[0100]
(12)离心后的血管平滑肌细胞梯度分离体系上层2ml为内皮细胞溶液,中间层1ml是血管内皮细胞,最下层1ml是血管平滑肌细胞。将最上面两层吸弃,下层的0.8ml溶液转移至新的15ml离心管中。将血管平滑肌细胞层与总细胞培养液混合后,在室温下250g离心1min,用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到血管平滑肌细胞单细胞混悬液。
[0101]
实施例3
[0102]
本实施例提供一种动物神经系统血管平滑肌细胞单细胞的分离方法,其步骤与实施例1基本一致,不同之处在于以下步骤:
[0103]
(5)在上述步骤进行的同时,于无菌超净台中配置如表5所示的第一溶液和第二溶液后,将第一溶液缓慢加入位于15ml离心管的第二溶液上方,得到内皮细胞梯度分离液。表5中细胞分离液中硅胶颗粒的质量浓度为1.2g/ml。
[0104]
表5.内皮细胞梯度分离液的配制
[0105]
溶液 内皮细胞分离液(μl) 总细胞培养液(μl) 合计(μl) 第一溶液 50 1950 2000 第二溶液 250 1750 2000 [0106]
(8)将细胞混合物a非常小心地加入到第(5)步的细胞梯度分离液中,配制成完整的内皮细胞梯度分离体系,此时离心管中共计10ml溶液。将上述完整的内皮细胞梯度分离
液在室温下水平转子离心机2300g离心18min。
[0107]
(9)离心后的内皮细胞梯度分离液上层6ml为含有碎片的内皮细胞培养基,中间层2ml是内皮细胞细胞,最下层2ml是各类神经系统细胞及死细胞。将最上层的培养基吸弃,中间层的2ml溶液转移至新的15ml离心管中,与所述总细胞培养液混合后,在室温下150g离心3min,用不含胎牛血清的dmem 培养基将所得沉淀混合均匀,得到血管细胞混合物b。
[0108]
(10)于无菌超净台中配置如表6所示的第三溶液和第四溶液后,将第三溶液缓慢加入位于15ml离心管的第四溶液上方,得到血管平滑肌细胞梯度分离液。表6中血管平滑肌细胞分离液中碘克沙醇的含量是58%。表6.血管平滑肌细胞梯度分离液的配制
[0109][0110]
(11).将(10)中得到的细胞混合物b非常小心地加入到第10步的血管平滑肌细胞梯度分离液中,配制成完整的血管平滑肌细胞梯度分离体系,此时离心管中共计4ml溶液。将上述完整的血管平滑肌细胞梯度分离体系在室温下水平转子离心机900g离心12min。
[0111]
(12)离心后的血管平滑肌细胞梯度分离体系上层2ml为内皮细胞溶液,中间层1ml是血管内皮细胞,最下层1ml是血管平滑肌细胞。将最上面两层吸弃,下层的1.2ml溶液转移至新的15ml离心管中。将血管平滑肌细胞层与总细胞培养液混合后,在室温下150g离心3min,用不含胎牛血清的dmem培养基将所得沉淀混合均匀,得到血管平滑肌细胞单细胞混悬液。
[0112]
实验例一
[0113]
下面对本技术得到的神经系统平滑肌内皮单细胞进行如下测试:
[0114]
1.将上述步骤中得到的细胞进行台盘蓝染色,活性达到80%后,按照10x genomics单细胞测序仪器的要求进行后续操作,对得到的单细胞进行测序,生信分析,seurat软件降维处理后得到二维的细胞分布结果,用已知的血管平滑肌细胞标志物对所得到的细胞进行标记,观察血管平滑肌细胞所占比例。
[0115]
2.利用seurat软件对所得到的血管平滑肌细胞进行亚型分类,得到的结果。
[0116]
3.利用david网站对血管平滑肌细胞高表达的基因进行信号通路分析,观察其参与的主要信号通路有哪些。
[0117]
结果如图1~图3所示:
[0118]
图1为使用本发明得到的小鼠大脑皮层中的神经系统血管平滑肌细胞,从图中可知利用神经系统血管平滑肌细胞已知的标志物acta2几乎可以标记所有得到的单细胞。
[0119]
图2是使用本方法得到的小鼠大脑皮层中的神经系统血管平滑肌细胞进行亚型分类后的结果。由此说明大脑中的血管平滑肌细胞种类多、功能复杂,对其进一步研究有重要的临床意义;
[0120]
图3为使用本方法得到的小鼠大脑皮层中的神经系统血管平滑肌细胞中高表达的基因进行go分析的结果,从图中可知得到的细胞中高表达的基因大部分都是血管生成相关
的通路,再次证明所得到的都是神经系统血管平滑肌细胞这一结论。
[0121]
实验例二
[0122]
本实验例采用实施例1的方法对比五种不同细胞分离液对血管平滑肌细胞的分离效果:
[0123]
实验组:采用本技术实施例1中提供的细胞梯度分离液。
[0124]
对照组1:只采用表7所示的第三溶液和第四溶液分离纯化血管平滑肌细胞。
[0125]
表7.血管平滑肌细胞梯度分离液的配制
[0126][0127]
对照组2:只采用表8所示的第三溶液和第四溶液分离纯化血管平滑肌细胞。
[0128]
表8.血管平滑肌细胞梯度分离液的配制
[0129][0130][0131]
对照组3:采用如表9所示的第三溶液和第四溶液配制血管平滑肌细胞梯度分离液。其中,血管平滑肌细胞分离液为ficoll。
[0132]
表9.血管平滑肌细胞梯度分离液的配制
[0133][0134]
对照组4:采用如表10所示的第三溶液和第四溶液配制血管平滑肌细胞梯度分离液。其中,血管平滑肌细胞分离液为sucrose。
[0135]
表10.血管平滑肌细胞梯度分离液的配制
[0136][0137]
实验结果为:
[0138]
实验组(图1):用血管平滑肌细胞的标志物acta2标记得到的细胞发现acta2 几乎可以标记所有的细胞,说明利用该条件得到的单细胞纯度高;
[0139]
对照组1(图4):用血管平滑肌细胞的标志物acta2标记得到的细胞发现acta2可以标记约47%的细胞;
[0140]
对照组2(图5):用血管平滑肌细胞的标志物acta2标记得到的细胞发现 acta2可以标记约59%的细胞;
[0141]
对照组3(图6):用血管平滑肌细胞的标志物acta2标记得到的细胞发现 acta2可以标记约83%的细胞;
[0142]
对照组4(图7):用血管平滑肌细胞的标志物acta2标记得到的细胞发现 acta2可以标记约89%的细胞。
[0143]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1