一种高效制备N,N
一种高效制备n,n
′‑
二(2羟乙基)苯胺的合成方法
技术领域
1.本发明属于有机合成中间体技术领域,具体涉及一类从芳香类硝基化合物与2-卤乙醇出发,制备有机中间体n,n
′‑
二(2-羟乙基)-苯胺的合成方法。
背景技术:
2.n,n
′‑
二(2-羟乙基)-苯胺是一种重要的有机合成中间体,被广泛应用于新药研发、材料科学、化工生产等多个领域。通过n,n
′‑
二(2-羟乙基)-苯胺(下式中式a所示化合物)可以合成一些具有抗癌、抗病毒的药物分子及合成相应的化学传感器。如:dmpp、yl-od、 libdp、macrolides、zm-093等,因此,它可以被作为药物合成专用中间体,是有机合成中的重要原料。
[0003][0004]
目前,n,n
′‑
二(2-羟乙基)-苯胺可以通过以下方法进行合成:
[0005]
(1)芳氨与2-氯乙醇的烷基化反应:该反应需要分步进行,在50℃下将naoh溶液加入苯胺与2-氯乙醇混合液中反应4h,然后在110℃高温下继续搅拌6h,且整个实验过程要在n2氛围下进行,反应液需静置一夜,再重结晶得到产品。后处理时间长,操作复杂(y.yan,y.hu,g.-p.zhao and x.-m kou,dyes and pigments,2008,79,2210)。
[0006]
(2)芳氨与2-氯乙醇在离子液中烷基化反应:该反应需使用当量的[bmim]bf4离子液体,在100℃下进行反应,虽然离子液体利于分离和重复使用,但该方法主要合成了n-2
‑ꢀ
羟乙基苯胺,对n,n
′‑
二(2-羟乙基)-苯胺的合成,产率低(h.guo,y.-w.zhuang,j.cao andg.-b.zhang,synthetic communications,2014,44,3368)。
[0007]
(3)苯胺与碳酸二烷基酯串联合成反应:该反应条件要求苛刻,需在n2加压的反应
釜中170℃下进行反应,且需要na-y作固体催化剂,产品产率低(anandkumar b.shivarkar, sunil p.gupte and raghunath v.chaudhari,in eng chem res,2008,47,2484)。
[0008]
(4)苯胺与环氧乙烷的合成反应:该反应需在低温下进行,且使用了易燃易爆的环氧乙烷反应条件苛刻,操作复杂(x.-w.fang,l.-z.zhou,z.-y.cheng and m.-p.yang,chin.j. org.chem.2013,33,523)。
[0009]
(5)芳基卤化物与胺的n-芳基化反应:该反应需用磁性cu2o/nano-cufe2o4作为催化剂,在100℃下,用koh作为碱进行反应,但因使用了金属催化剂,存在一定的金属污染(ali elhampour,firouzeh nemati and mahdieh kaveh,chem lett,2016,45,223)。
[0010]
综上所述,尽管n,n
′‑
二(2-羟乙基)-苯胺是一种重要的有机合成中间体,但是到目前为止,现有的合成方法都是从苯胺和芳基卤化物出发,且条件要求高,操作复杂,底物适用范围窄,不利于工业化生产。因此,开发一种新的合成方法,有着重要意义。
技术实现要素:
[0011]
本发明的目的是在现有技术基础上,提供一种方法简单、成本低、产率高且一步反应合成n,n
′‑
二(2-羟乙基)-苯胺的合成方法,该方法拓宽了现有合成技术。
[0012]
本发明中合成n,n
′‑
二(2-羟乙基)-苯胺的具体步骤为:
[0013]
在氮气氛围下,向干燥的反应容器中加入催化剂co(ii)、锌粉、溶剂、硝基苯或杂芳基苯、2-卤乙醇,反应6h,反应完全后,向反应液中加入蒸馏水和乙酸乙酯的混合液进行少量多次萃取(萃取液为蒸馏水和乙酸乙酯的混合液),合并有机相并加入无水硫酸钠进行干燥,浓缩有机相,经柱层析得到目标产物n,n
′‑
二(2-羟乙基)-苯胺。
[0014]
本发明中所用的硝基苯的结构式为所述杂芳基苯的结构式为其中r1可以为氢、卤素、烷基、芳基、-ome、-cho、-cn或-s-ch3中的任意一种或两种取代基团,但不仅限于这些基团。
[0015]
本发明所用2-卤乙醇可以为2-碘乙醇、2-溴乙醇或2-氯乙醇,但不仅限于这些卤化物。所用2-卤乙醇的用量与硝基苯或杂芳基苯的用量的摩尔比为2~3:1。
[0016]
本发明所用催化剂co(ii)为:氯化钴、高氯酸钴(ii)六水合物、乙酰丙酮钴(ii)、无水溴化钴(ii)、无水硫酸钴(ⅱ)、四水氟化钴(ii)或双(六氟乙酰丙酮)合钴(ii)。催化剂co(ii)的用量为硝基苯或杂芳基苯的1%~40mol%。
[0017]
本发明所用有机溶剂为常用有机溶剂,如:nmp、dmf、thf、dmso、ch3cn,其用量是每毫摩尔硝基苯或杂芳基苯对应2ml~4ml的有机溶剂。
[0018]
本发明所用锌粉的用量与硝基苯或杂芳基苯用量的摩尔比为1.5:1,锌粉用于还原硝基苯或杂芳基苯。
[0019]
本发明所涉及的反应温度可以在60~90℃间进行。
[0020]
当反应底物之一为硝基苯时,本发明反应方程式如下:
[0021][0022]
其中,r1可以为氢、卤素、烷基或者芳基等取代基团,但不仅限于这些基团。本发明所用的各种取代基的硝基苯均可商业所得;x表示卤元素;q为2~3,y为1~40,z为1.5,t为60~90,式a为目标产物n,n
′‑
二(2-羟乙基)-苯胺。
[0023]
当反应底物之一为杂芳基苯时,本发明的反应方程式与上述反应方程式类似,将上述反应方程式中的硝基苯的苯环替换为氮杂环即可。
[0024]
本发明具有以下有益效果:
[0025]
(1)本发明合成目标产物的反应无中间环节,操作简单方便。
[0026]
(2)本发明从硝基苯或杂芳基苯为原料合成目标产物,原料廉价易得,容易实现工业化生产,拓宽了n,n
′‑
二(2-羟乙基)-苯胺的合成方法。
[0027]
(3)本发明方法目标产物的产率高,最高可达96%。
附图说明
[0028]
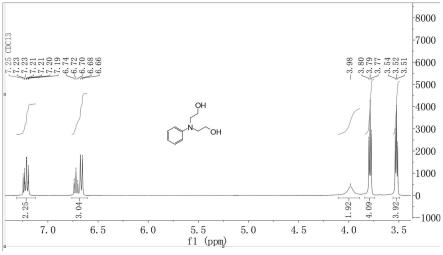
图1为实施例1的目标产物n,n
′‑
二(2-羟乙基)-苯胺的核磁共振氢谱图。
具体实施方式
[0029]
下面通过具体实施方式对本发明进行更加详细的说明,以便于对本发明技术方案的理解,但并不用于对本发明保护范围的限制。
[0030]
以下实施例的反应方程式中,i表示硝基苯或杂芳基苯,ii表示2-卤乙醇。
[0031]
实施例1
[0032]
n,n
′‑
二(2-羟乙基)-苯胺(式1)的合成:
[0033][0034]
在氮气氛围下,向干燥的25ml反应瓶中依次加入氯化钴(ⅱ)[1.9mg,0.015mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(0.5ml)、硝基苯(51μl,0.5mmol)、2-碘乙醇 (78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体86.9mg,产率96%。
[0035]
n,n
′‑
二(2-羟乙基)-苯胺的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3):δ7.23
–ꢀ
7.19(m,2h),6.72(t,1h),6.68(d,2h),3.98(bs,2h),3.79(t,4h),3.52(t,4h);
13
c nmr(100 mhz,cdcl3):δ147.81,129.32,116.81,112.49,60.65,55.35.ftir(cm-1
):3286,2962,2877, 1766,1596,1503,1357,1241,1047,908,854,744,692,600,508;gc-ms(ei,70ev)m/z:found: 181(c
10h15
no2),calculated:181.23(c
10h15
no2)。
[0036]
实施例2
[0037]
n,n
′‑
二(2-羟乙基)-4-甲氧基苯胺(式2)的合成:
[0038][0039]
在氮气氛围下,向干燥的25ml反应瓶中依次加入高氯酸钴(ii)六水合物[3.9mg,0.015 mmol]、锌粉(49mg,0.75mmol)、溶剂thf(1ml)、4-硝基苯甲醚(76.6mg,0.5mmol)、2
‑ꢀ
溴乙醇(108μl,1.5mmol)。在转速为100rpm、90℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体98.2mg,产率93%。
[0040]
n,n
′‑
二(2-羟乙基)-4-甲氧基苯胺的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3): δ6.83
–
6.79(m,2h),6.72
–
6.67(m,2h),3.83(bs,2h),3.75(s,3h),3.72(t,4h),3.39(t,4h);
13
c nmr(100mhz,cdcl3):δ152.21,142.59,115.56,114.87,60.50,55.97,55.86。
[0041]
实施例3
[0042]
n,n
′‑
二(2-羟乙基)-4-甲基苯胺(式3)的合成:
[0043][0044]
在氮气氛围下,向干燥的25ml反应瓶中依次加入无水溴化钴(ii)[3.3mg,0.015mmol]、锌粉(49mg,0.75mmol)、溶剂dmso(1ml)、4-硝基甲苯(68.6mg,0.5mmol)、2-氯乙醇(105 μl,1.5mmol)。在转速为100rpm、80℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体91.8mg,产率94%。
[0045]
n,n
′‑
二(2-羟乙基)-4-甲基苯胺的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3):δ 6.93(d,2h),6.50(d,2h),3.87(bs,2h),3.65(t,4h),3.37(t,4h),2.15(s,3h);
13
c nmr(100 mhz,cdcl3):δ145.74,129.83,126.27,113.00,60.69,55.52,20.18.ftir(cm
‑1):3295,2915, 2861,1758,1611,1511,1442,1350,1241,1180,1041,910,855,801,710,610,570,508;gc-ms(ei,70ev)m/z:found:195(c
11h17
no2),calculated:195.25(c
11h17
no2)。
[0046]
实施例4
[0047]
3-氟-n,n
′‑
二(2-羟乙基)-4-甲基苯胺(式4)的合成:
[0048][0049]
在氮气氛围下,向干燥的25ml反应瓶中依次加入四水氟化钴(ii)[2.3mg,0.005mmol]、锌粉(49mg,0.75mmol)、溶剂dmf(2ml)、2-氟4-硝基甲苯(77.6mg,0.5mmol)、2-碘乙醇 (78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体93.3mg,产率88%。
[0050]
3-氟-n,n
′‑
二(2-羟乙基)-4-甲基苯胺的核磁共振氢谱表征如下:1h nmr(400mhz, cdcl3):δ6.96(t,1h),6.78(d,1h),6.40(d,1h),4.86(bs,2h),4.23(t,4h),3.73(t,4h),2.33(s,3h);
13
c nmr(100mhz,cdcl3):160.91,148.28,131.56,108.92,108.43,102.73,61.72,58.92, 14.53。
[0051]
实施例5
[0052]
n,n
′‑
二(2-羟乙基)-4-氟苯胺(式5)的合成:
[0053][0054]
在氮气氛围下,向干燥的25ml反应瓶中依次加入双(六氟乙酰丙酮)合钴(ii)[7.1mg, 0.015mmol]、锌粉(49mg,0.75mmol)、溶剂ch3cn(2ml)、对氟硝基苯(70.6mg,0.5mmol)、 2-碘乙醇(78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体94.6mg,产率95%。
[0055]
n,n
′‑
二(2-羟乙基)-4-氟苯胺的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3): δ7.02(t,2h),6.71(m,2h),4.75(s,2h),4.20(t,4h),3.73(t,4h);
13
c nmr(100mhz,cdcl3):δ 156.81,145.26,115.94,61.72,58.92。
[0056]
实施例6
[0057]
4-[n,n
′‑
二(2-羟乙基)氨基]苯甲醛(式6)的合成:
[0058][0059]
在氮气氛围下,向干燥的25ml反应瓶中依次加入乙酰丙酮钴(ii)[3.9mg,0.015mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(1ml)、对硝基苯甲醛(82.6mg,0.5mmol)、 2-碘乙醇(78μl,1mmol)。在转速为100rpm,60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体99.4mg,产率95%。
[0060]
4-[n,n
′‑
二(2-羟乙基)氨基]苯甲醛的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3): δ9.60(s,1h),7.63(d,2h),6.67(d,2h),3.86(t,4h),3.63(t,4h),3.44(bs,2h);
13
c nmr(100 mhz,cdcl3):δ190.75,153.02,132.31,111.81,68.12,60.36,55.23。
[0061]
实施例7
[0062]
α-萘二乙醇胺(式7)的合成:
[0063][0064]
在氮气氛围下,向干燥的25ml反应瓶中依次加入双(六氟乙酰丙酮)合钴(ii)[7.1mg, 0.015mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(1ml)、1-硝基萘(86.6mg,0.5 mmol)、2-碘乙醇(78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体108.7mg,产率94%。
[0065]
α-萘二乙醇胺的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3):δ8.41(bs,1h), 7.86(d,1h),7.64(d,1h),7.51(m,2h),7.43(t,1h),7.35(d,1h),3.70(s,4h),3.40(s,4h), 1.53(s,1h);
13
c nmr(100mhz,cdcl3):δ151.32,135.87,131.03,129.33,127.97,126.73, 125.11,123.73,114.68,62.13,58.93。
[0066]
实施例8
[0067]
3-[二(2-羟乙基)氨基]苯甲腈(式8)的合成:
[0068]
[0069]
在氮气氛围下,向干燥的25ml反应瓶中依次加入氯化钴(ⅱ)[1.9mg,0.015mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(1ml)、间硝基苯甲腈(74.1mg,0.5mmol)、2
‑ꢀ
碘乙醇(78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品浅黄色液体91.8mg,产率89%。
[0070]
3-[二(2-羟乙基)氨基]苯甲腈的核磁共振氢谱表征如下:1h nmr(400mhz,cdcl3): δ7.26-7.22(m,3h),6.98(s,1h),4.65(s,2h),4.2(t,4h),3.73(t,4h);
13
c nmr(100mhz,cdcl3): δ150.31,130.33,127.32,118.64,114.93,113.52,61.72,58.91。
[0071]
实施例9
[0072]
2-[2-羟乙基-(6-甲基吡啶-2-基)氨基]乙醇(式9)的合成:
[0073][0074]
在氮气氛围下,向干燥的25ml反应瓶中依次加入氯化钴(ⅱ)[26.0mg,0.2mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(2.5ml)、2-甲基-6-硝基吡啶(69.1mg,0.5mmol)、2-碘乙醇(78μl,1mmol)。在转速为100rpm、60℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),得到产品黄色液体83.4mg,产率85%。
[0075]
2-[2-羟乙基-(6-甲基吡啶-2-基)氨基]乙醇的核磁共振氢谱表征如下:1h nmr(400mhz, cdcl3):δ7.42(t,1h),6.47(d,1h),6.30(d,1h),4.85(bs,2h),3.91(t,4h),3.73(t,4h);
13
c nmr (100mhz,cdcl3):δ155.72,153.78,138.53,119.01,103.22,61.77,58.96,23.97。
[0076]
实施例10
[0077]
2,2
′‑
[4-(甲硫基)苯基]亚氨基]二[乙醇](式10)的合成:
[0078][0079]
在氮气氛围下,向干燥的25ml反应瓶中依次加入无水硫酸钴(ⅱ)[2.3mg,0.015mmol]、锌粉(49mg,0.75mmol)、溶剂n-甲基吡咯烷酮(1ml)、4-硝基茴香硫醚(84.6mg,0.5mmol)、 2-碘乙醇(78μl,1mmol)。在转速为100rpm、70℃的加热器上反应6h,经tlc检测原料反应完全,停止反应,将反应混合液用蒸馏水和乙酸乙酯少量多次萃取,合并有机相,并用无水硫酸钠进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=5/1),
得到产品浅黄色液体102.3mg,产率90%。
[0080]
2,2
′‑
[4-(甲硫基)苯基]亚氨基]二[乙醇]的核磁共振氢谱表征如下:1h nmr(400 mhz,cdcl3):δ7.35(d,2h),6.63(d,2h),4.46(bs,2h),4.20(t,4h),3.73(t,4h);
13
c nmr(100 mhz,cdcl3)::δ146.03,132.33,128.96,120.68,61.77,58.95,14。
[0081]
以上所述之实施例,只是本发明的较佳实施例而已,并非限制本发明的实施范围,故凡依本发明专利范围所述的构造、特征及原理所做的等效变化或修饰,均应包括于本发明申请专利范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1