一种木薯抗细菌性枯萎病的蛋白和编码基因及其应用
1.本发明涉及生物基因工程技术领域,特别涉及一种木薯抗细菌性枯萎病的蛋白和编码基因及其应用。
背景技术:
2.木薯(manihotesculentacrantz)起源于中南美洲亚马逊热带雨林地区,分属大戟科(euphorbiaceous)木薯属(manihotp.mill.)灌木多年生植物。主要分布于北纬30
°
至南纬30
°
之间的非洲、拉丁美洲和亚洲地区,总种植面积约2000万公顷,种植面积占总种植面积的70%(el-sharkawy,1993)。根据联合国fao统计2014年世界木薯鲜薯总产量已经接近3亿吨。而亚洲和非洲是木薯主要的栽培地区,非洲地区年产鲜薯约1.67亿吨,占世界鲜薯比重57.3%,亚洲年产鲜薯约1亿吨,占鲜薯比重30%左右。尼日利亚、泰国和巴西是世界木薯产量最大的三个国家,分别年产鲜薯0.5亿吨、0.3亿吨、0.25亿吨。木薯具有高产、抗旱、耐贫瘠等特点,供养亚、非、拉等发展中国家将近7亿人口(zhangetal.,2010),是位于小麦、水稻、玉米、马铃薯和大麦之后世界第六大作物(zidengaetal.,2012)。木薯与马铃薯、甘薯并称世界三大薯类(ceballosetal.,2004),在非洲、南美及东南亚等地区不仅是主要的粮食作物,也是最主要的经济作物之一,木薯在世界粮食安全、生物质能源以及食品加工等领域发挥重要作用。
3.植物在生长发育过程中发生病害不仅影响长势,还会影响产量。目前hsfs与病害响应的关系在少数植物中得以研究。黄单胞杆菌(xanthomonasoryzaepv.oryzae,xoo)可引起水稻白叶枯病,将其接种于抗病品种
‘
sh5’和感病品种
‘
8411’6h后发现,oshsfs成员呈现不同的表达模式,oshsfa2s、oshsfb2s和oshsfc2b等11个成员在
‘
sh5’和
‘
8411’中的表达量存在显著差异。可见,hsfs成员在病害防御过程中发挥重要作用。hsfsa族成员可作为正调控因子参与调控植物抗病性。bechtold等(2013)发现,athsfa1b过量表达的拟南芥转基因植株接种病原细菌(pseudomonassyringaepv.tomatodc3000)4d后,其抗病性显著强于野生型植株。与之相反,hsfsb族成员可能在抗病机制中发挥负调控作用。拟南芥hsfb2b缺失突变体植株接种甘蓝链格孢菌(alternariabrassicicola)后,病情指数显著低于野生型植株,且对病菌的抵抗力显著提高(kumaretal.,2009)。此外,在番茄中过量表达葡萄的vphsf1(b族成员)可提高植株对板口线虫(erysiphenecator)的敏感性,表明vphsf1在抵御病害方面可能作为负调控因子存在(pengetal.,2013)。因此,hsfs在植物抗病体系中可能发挥重要作用,不同基因家族成员参与调控的模式存在差异。
4.目前,我国的木薯主栽品种均不抗细菌性枯萎病(卢昕等,2013),若该病大面积发病将对我国木薯生产造成毁灭性打击,研究木薯抗细菌性枯萎病机理及培育抗病品种,已成为木薯产业持续健康发展亟待解决的现实问题。
技术实现要素:
5.鉴以此,本发明提出一种木薯抗细菌性枯萎病的蛋白和编码基因及其应用,来解
决上述问题。
6.本发明的技术方案是这样实现的:
7.一种木薯抗细菌性枯萎病基因,所述木薯抗细菌性枯萎病基因为mehsf24基因。
8.进一步的,所述mehsf24基因的核苷酸序列如seq id no:1所示。
9.进一步的,所述mehsf24基因编码的蛋白的氨基酸序列如seq id no:2所示。
10.进一步的,所述mehsf24基因或蛋白在木薯抗细菌性枯萎病中的应用。
11.进一步的,mehsf24基因或蛋白在木薯抗细菌性枯萎病中的应用中包括提高木薯对木薯细菌性枯萎病菌的抗性
12.进一步的,mehsf24基因或蛋白在木薯抗细菌性枯萎病中的应用中包括降低木薯对木薯细菌性枯萎病菌的抗性。
13.进一步的,所述提高木薯对木薯细菌性枯萎病菌的抗性的方法是采用构建mehsf24过表达载体转化木薯植物材料。
14.进一步的,所述降低木薯对木薯细菌性枯萎病菌的抗性的方法是采用构建mehsf24的沉默载体转化木薯植物材料。
15.与现有技术相比,本发明的有益效果是:
16.本发明所述的mehsf24基因在木薯响应xamhn11胁迫时表达量升高,其参与木薯抗细菌性枯萎病,故本发明通过对生物信息学分析、亚细胞定位、木薯受病原菌诱导表达模式分析、基因瞬时沉默等系统实验,初步分析mehsf24基因在木薯防卫反应中的作用。其结果可为开发抗性基因提供研究基础,有助于木薯与病原菌互作机制的研究及完善对木薯先天免疫的认知。
附图说明
17.图1为mehsf24全长扩增图,图中m:dl5000dnamark;泳道1-6:mehsf24。
18.图2为木薯mehsf24蛋白亲水性分析图,图中负值表示亲水性,正值表示疏水性。
19.图3为mehsf24基因序列内含子与外显子结构示意图。
20.图4为mehsf24蛋白高级结构预测模型。
21.图5为mehsf24蛋白亚细胞定位。
22.图6为xamhn11侵染后mehsf24基因的表达量变化。
23.图7为vigs处理后木薯叶片表型变化。
24.图8为vigs处理后目的基因表达水平检测。
25.图9为vigs处理下xamhn11侵染木薯叶片不同时段病斑表型。
26.图10为叶片病斑面积柱形图。
27.图11为菌落计数。
具体实施方式
28.为了更好理解本发明技术内容,下面提供具体实施例,对本发明做进一步的说明。
29.本发明实施例所用的实验方法如无特殊说明,均为常规方法。
30.本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
31.实验材料如下:
32.植物材料:木薯华南8号(sc8),烟草本生烟。
33.菌株:大肠杆菌trans1-t1感受态细胞购自北京全式金公司(transgenbiotech);农杆菌gv3101(psoup-p19)购自上海唯地生物;地毯草黄单胞菌木薯萎蔫致病变种(xanthomonasaxonopodispv.manihotis,xam)实验室保存菌株。
34.质粒载体:克隆载体peasy-blunt购自北京全式金公司(transgenbiotech);亚细胞定位载体pcambia1300-35s-mehsf24-gfp、pcambia1300-35s-gfp实验室保存;vigs沉默载体pcscmv-b、pcscmv-a、pcscmv-mehsf24。
35.药品试剂:mgcl2·
6h2o、mes(4-吗啉乙磺酸,2-(n-吗啉基)乙磺酸)购自sigma-aldrich公司。as(乙酰丁香酮)购自麦克林公司。2
×
rapidtaqmastermix购自诺唯赞生物。10mmdntp、1、dnamark、restrictionenzyme、t4dnaligase、质粒小提、琼脂糖凝胶回收、pcr产物柱回收试剂盒等均购自北京艾德莱生物科技公司。rnapreppure多糖多酚植物总rna提取试剂盒(离心柱型)购自天根生化科技有限公司。high-fidelitydnapolymerases购自neb,引物合成及测序由华大基因完成。
36.实施例1-mehsf24基因的分离及其蛋白生物信息学分析
37.采用rnapreppure多糖多酚植物总rna提取试剂盒(tiangen)提取木薯sc8的叶片总rna,经1.5%琼脂糖凝胶电泳检测,28s、18s及5srrna条带完整;采用revertaidtmfirststrandcdnasynthesiskit试剂盒反转录为cdna。根据木薯mehsf24序列信息,使用premier5.0软件设计特异引物:mehsf24-f(atggggtctacagctttag)、mehsf24-r(ttatttgcatgattgagat);以木薯sc8总rna反转录后cdna为模板,使用q5超保真dna聚合酶进行pcr扩增,克隆木薯mehsf24基因编码序列。反应体系为:q5dnapolymerase0.2μl,q5highgc4μl,10mmdntpmixture0.4μl,上下游引物各0.8μl,cdna2μl,加ddh2o补至20μl。反应程序为:98℃,30s;98℃,15s,57℃,20s,72℃,50s,33cycles;72℃,5min。使用pcr产物纯化回收试剂盒回收目的片段,连接peasy-blunt载体上,转化进大肠杆菌trans1-t1感受态,挑取阳性单克隆进行菌落pcr检测,将基因进行测序后用质粒小量快速提取试剂盒提取peasy-blunt-mehsf24质粒。
38.结果分析:
39.1.mehsf24基因的分离
40.以木薯sc8叶片总rna反转录后cdna为模板,使用q5超保真dna聚合酶和mehsf24基因特异性引物进行pcr扩增,得到一条大小约750bp基因片段,无拖尾,特异性好,与预期大小一致(如图1)。将pcr产物纯化回收并构建至中间载体peasy-blunt,化大肠杆菌trans1-t1,筛选阳性单克隆摇菌送华大生物测序分析。
41.2.mehsf24基因及蛋白生物信息学分析
42.根据测序结果,利用ncbi在线网站进行序列比对,并分析其开放阅读框,显示mehsf24基因全长723bp,由两个外显子编码。利用expasy站点工具分析木薯mehsf24蛋白的生理生化性质。结果显示mehsf24蛋白理论分子式:c
1215h1926n348o375s10
,理论相对分子质量:27.7kda,理论等电点pi:9.00。该蛋白富含:丝氨酸ser(9.6%)、赖氨酸lys(9.2%)、亮氨酸leu(8.8%)、谷氨酸glu(7.9%)、精氨酸arg(7.9%)、天冬氨酸asp(6.7%)、苏氨酸thr(6.2%)、苯丙氨酸phe(5.4%)、缬氨酸val(5.4%)。亲水指数从-3.356到1.600(负值表示亲水性,正值表示疏水性),亲水性平均指数-0.814,表明该蛋白水溶性较好(图2)。理论不
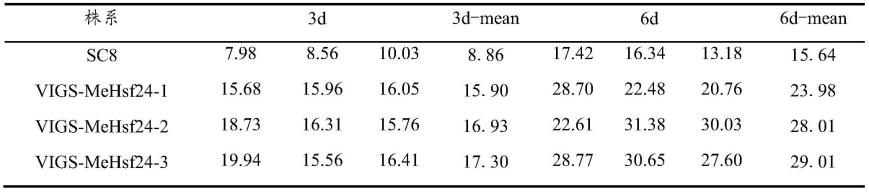
稳定系数:56.96,属于不稳定蛋白质。利用gsds在线网站分析mehsf24基因的结构特点,结果显示,该基因含有2个外显子和1个内含子(图3)。利用ncbi站点conserveddomaindatabase及swiss-model分析mehsf24基因保守结构域及预测mehsf24蛋白高级结构(图4),发现其具有hsfs家族保守性最高的dna结合结构域(dnabindingdomain,dbd)。利用softberry预测mehsf24蛋白可能定位于细胞核。
43.实施例2-mehsf24亚细胞定位研究
44.将重组质粒载体pcambia1300-35s-mehsf24-gfp、pcambia1300-35s-gfp空载转化农杆菌感受态细胞gv3101(psoup-p19)。挑取阳性单克隆于10ml含有kan
+
(50mg/l)、rif
+
(25mg/l)的lb液体培养基中,28℃,200rpm培养24h。取50μl过夜培养菌液于50ml含有kan
+
(50mg/l)、rif
+
(25mg/l)的lb液体培养基中,28℃,200rpm培养至od
600
≈1.0,约为12h。4000rpm离心5min收集菌体,弃去上清。加入20ml缓冲液(10mmol/lmgcl2,10mmol/lmes)清洗菌体,4000rpm离心5min,弃去上清,重复2次。而后加入农杆菌侵染液(10mmol/lmgcl2,10mmol/lmes,150μmol/las)重悬菌体,调od
600
≈0.6~0.8,室温静置2-3h。选取生长4-5周大的长势一致的烟草本生烟,用1ml无菌注射器去掉针头后取适量菌液,于烟草叶片背面轻柔注射菌液,标注注射区域。注射过的烟草置于24℃,光照/黑暗12h/12h,培养2天,剪取注射区域烟草叶片,将叶片置于载玻片上,滴加少于清水制片,激光共聚焦显微镜观察mehsf24蛋白在细胞内定位,并拍照记录。
45.结果显示(图5),mehsf24-gfp融合蛋白激发绿色荧光在细胞核内,而空载gfp蛋白绿色荧光在细胞膜检测到,所以,mehsf24蛋白定位于细胞核,与softberry网站预测结果一致。
46.实施例3-xamhn11胁迫处理mehsf24基因的表达模式分析
47.将实验室超低温(-80℃)保存xamhn11菌株,在lpga(25mg/lchl
+
)固体培养基划线,28℃活化培养2d。使用10mmol/lmgcl2洗下菌体,4000rpm离心5min收集菌体,并用10mmol/lmgcl2重悬,清洗菌体2~3次,充分混匀后调至od
600
≈0.05,用1ml无菌注射器去掉针头后取适量菌液,于45日龄木薯叶片背面轻柔注射适量菌液,28℃,光照/黑暗12h/12h培养。胁迫处理0h、3h、6h、1d、3d、6d取样,使用rnapreppure多糖多酚植物总rna提取试剂盒(tiangen)抽提叶片总rna并反转录为cdna备用。
48.运用oligo7软件设计实时荧光定量pcr引物:qrt-mehsf24-f(atcgtcatcaacttcatcctcgt),qrt-mehsf24-r(gcctcttatcgctgtcgtcgtct),使用木薯tubulin(manes.08g061700)基因作为内参基因,引物序列:tubulin-f(atgcggttcttgatgttgttc),tubulin-r(tcggtgaagggaatacagaga)。实时荧光定量pcr反应体系为:tbgreenpremixextaqⅱ(2x)10μl,上下游引物各1μl,cdna2μl,加ddh2o补至20μl。反应程序为:95℃,30s;95℃,3s,60℃,30s,40cycles。每个样品设置三个重复,采用2-δδct
法计算基因相对表达量。
49.结果如图6所示,xamhn11侵染6h后,mehsf24基因表达量上调极显著,并随着侵染时间的延长持续升高,结果表明mehsf24基因确实能够响应xamhn11胁迫。
50.实施例4-pcscmv介导的mehsf24基因沉默
51.4.1pcscmv系统侵染木薯
52.将vigs重组载体pcscmv-mehsf24、正对照pcscmv-b和负对照pcscmv-a转化农杆菌
gv3101(psoup-p19)感受态细胞,挑取阳性单克隆至5ml含有kan
+
(50mg/l)、rif
+
(25mg/l)lb液体培养基中,28℃,220rpm过夜培养。取500μl过夜培养菌液于50ml含有kan
+
(50mg/l)、rif
+
(25mg/l)lb液体培养基中,28℃,220rpm培养至od600值为0.75。将菌液移至50ml离心管中,4000rpm离心5min,弃去上清。加入适量缓冲液(10mmol/lmgcl2,10mmol/lmes)重悬菌体,4000rpm离心5min,弃去上清,重复2次。加入25ml农杆菌侵染液(10mmol/lmgcl2+10mmol/lmes+200μmol/las)重悬菌体,在室温、黑暗条件下静置3h。选取生长势一致、状态良好的45日龄木薯盆栽苗,用1ml注射器将菌液沿叶脉两侧压渗至木薯叶片背面,24℃,光照/黑暗12h/12h培养,3-4周后观察表型变化,拍照记录,进行后续试验。
53.4.2mehsf24基因沉默效果检测
54.依据pcscmv-b正对照处理株新叶叶脉间出现褪绿白化表型的时间,开始采取处理组、负对照组相同部位叶片,抽提叶片总rna后反转录为cdna,进行实时荧光定量pcr(方法、引物参照同“3、xamhn11胁迫处理mehsf24基因的表达模式分析”),检测mehsf24基因瞬时沉默效果。
55.4.3vigs沉默植株接种xamhn11及发病情况统计
56.对处理组各mehsf24基因沉默植株及对照组接种xamhn11,方法同“3、xamhn11胁迫处理mehsf24基因的表达模式分析”,负对照注射10mmol/lmgcl2。28℃,光照/黑暗12h/12h培养,记录不同时间木薯叶片发病(水渍状病斑扩散)状况并拍照记录。
57.使用直径为1cm的打孔器取下接种0d、3d、6d木薯叶片病斑组织,置于已灭菌的研钵中,加入1ml10mmol/lmgcl2充分研磨,稀释浓度梯度。取各浓度梯度匀浆液100μl涂布于lpga(25mg/lchl
+
)固体培养基,每个梯度涂布三个平板,28℃倒置培养24h后统计菌落数,量化发病情况。
58.实施例5-vigs沉默mehsf24对木薯细菌性枯萎病抗性的影响
59.1.vigs沉默效果的表型分析
60.正对照pcscmv-b为含有病毒基因和指示基因的重组质粒,负对照pcscmv-a为仅含有病毒基因的质粒。用含有重组质粒的农杆菌菌液去侵染野生型sc8木薯叶片,利用病毒在植物体内扩增而达到沉默目的基因的效果,含有指示基因的正对照会使植物合成叶绿素能力受阻,导致新叶片出现了明显褪绿白化表型,如图7所示,受到pcscmv-b侵染约25d后木薯新叶出现褪绿表型,不含指示基因的负对照和实验组无变化,这表明pcscmv系统能够有效对木薯产生沉默效果。
61.2.mehsf24基因沉默效果检测
62.使用rnapreppure多糖多酚植物总rna提取试剂盒(tiangen)提取对照组pcscmv-a和实验组pcscmv-mehsf24的木薯叶片总rna,反转录后进行实时荧光定量pcr,检测目的基因的沉默效果,定量结果如图8所示,mehsf24基因株系的相对表达量下降显著,说明目的基因受到了有效沉默。
63.3.mehsf24基因沉默降低木薯对xamhn11的抗性
64.当xamhn11侵染3d后,木薯叶片逐渐出现水渍状病斑(图9),侵染6d后水渍状病斑扩散,面积逐渐扩大。各处理组与对照sc8比较,病斑面积也相对较大,发病较为严重。
65.为了能对发病程度有更加直观的比较,利用imagej软件计算叶片背面病斑面积大小(单位mm2)。分别取侵染3d、6d叶片拍照,进行两个重复,并计算平均值。如表1、图10。
66.表1病斑面积与平均值
[0067][0068]
取接种0d、3d、6d木薯叶片病斑组织,进行细菌计数,结果如图11。病原菌侵染3d后,处理组活体菌量极显著高于对照组,侵染6d后处理组活菌数依然极显著高于对照组,表明沉默mehsf24基因提高了病原菌致病力。
[0069]
综上所述,mehsf24基因参与木薯响应xamhn11胁迫,并呈正相关;下调其表达量将降低木薯对细菌性枯萎病的抗性;可将其开发为抗性基因,深入解析与病原菌互作机制,为培育抗病新种质提供基础。
[0070]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1