抗SARS-CoV-2病毒单克隆抗体及应用的制作方法
抗sars-cov-2病毒单克隆抗体及应用
技术领域
1.本发明涉及治疗性抗体及分子免疫学领域,更具体地,涉及一种sars-cov-2冠状病毒s蛋白的重组单克隆抗体,以及这种抗体的用途,特别是在治疗、预防和诊断由sars-cov-2引起的covid-19疾病中的用途。
背景技术:
2.新型冠状病毒sars-cov-2作为一种新近出现的人类病原体,可引起发烧、乏力、干咳为主要表现的严重的呼吸系统疾病和covid-19肺炎。依据基因组核酸序列,新的病原体被证明是β冠状病毒属的一种新型成员。sars-cov-2与蝙蝠冠状病毒ratg13相似性很高,基因组序列同源性达96.2%(zhou p et al,2020,nature,579:270-273)。sars-cov-2与两种蝙蝠sars样冠状病毒bat-sl-covzc45(同源性88%)和bat-sl-covzxc21(同源性87%)密切相关,但与sars-cov(同源性79%)和mers-cov(同源性50%)亲缘关系相对较远(lu r et al,2020,lancet,395:565-574)。
3.与其它冠状病毒一样,新型冠状病毒sars-cov-2是一种正义rna病毒,编码几种主要蛋白,s、m、n和e,依赖rna的rna聚合酶rdrp以及十几种非结构蛋白。其中s、m、n和e蛋白用于包装病毒结构,rdrp和十几种非结构蛋白用于病毒基因组rna复制和各个蛋白mrna的合成。sars-cov-2与sars-cov病毒很相似,氨基酸序列同源度较高,它的s、m、n、e和rdrp蛋白的氨基酸个数和与sars-cov的同源度分别为1273(76%)、222(91%)、419(91%)、75(95%)、932(96%)。类似于sars-cov病毒,sars-cov-2病毒呈球形,有包膜,外周排列有冠状刺突。sars-cov-2的刺突s蛋白形成三聚体(wrapp d et al,2020,science,6483:1260-1263),型如蘑菇状,镶嵌在病毒外表面膜上。s蛋白是该病毒的主要抗原成分,负责病毒与被入侵宿主细胞受体ace2结合以及病毒与细胞的融合。类似于sars-cov病毒s蛋白(yuan y et al,2017,nat commun,8:15092),sars-cov-2冠状病毒s蛋白主要分为两个结构域,s1(1-685)和s2(686-1122),以及一个短跨膜区和细胞质尾端。在型如蘑菇的s蛋白三聚体中,三个s1结构域形成“蘑菇帽”,三个s2结构域形成“蘑菇茎”。其中,s1中的rbd结构域(receptor binding domain,氨基酸331-527)负责与被入侵宿主细胞受体ace2结合,s2负责与宿主细胞融合。s2结构域在整体s蛋白中通常以折叠或蜷曲压缩的构象存在,当病毒在s1脱落后与宿主细胞融合时,s2展示伸展构象以便插入宿主细胞膜(walls ac et al,2017,proc natl acad sci usa,114:11157-11162;harrison sc,2008,nat struct mol biol,15:690-698)。据报道,sars-cov-2病毒的s蛋白与人细胞受体的结合亲和力远高于sars-cov病毒的s蛋白(wrapp d et al,2020,science,6483:1260-1263;walls ac et al,2020,cell,181:281-292)。另一个与sars-cov病毒s蛋白的不同之处在于,sars-cov-2s蛋白有一个furin酶切位点rrar(氨基酸682-685),这个酶切位点把s蛋白分为s1和s2两部分,酶切后的s1和s2以非共价键的形式联系在一起。由于s1/s2之间存在furin酶切位点以及furin酶在真核组织及细胞中广泛表达,同时,包含多碱性氨基酸的furin位点,还可以被其它以赖氨酸或精氨酸为靶点的酶,如细胞表面酶tmprss2、核内体cathepsin l酶或可能的
胰蛋白酶(trypsin)等所降解(hoffmann m et al,2020,cell,181(2):271-280.e8;shang j et al,2020,proc natl acad sci usa,117:11727-11734;belouzard s et al,2012,viruses,4:1011-1033),因此,sars-cov-2的s1/s2之间更容易被切割,导致s1结构域在病毒与人细胞融合时更容易脱落,从而增加s2的融合能力和病毒侵染力。而sars-cov病毒s1/s2之间仅通过一个碱性氨基酸精氨酸连接,s蛋白在此处被细胞表面酶tmprss2和核内体中的cathepsin l酶切后而感染宿主细胞(belouzard s et al,2012,viruses,4:1011-1033;belouzard s et al,2009,proc natl acad sci usa,106:5871-5876)。所以,以上两个不同之处,即furin酶切位点的存在和与人受体ace2的高亲和力,可能是造成sars-cov-2冠状病毒高传染力的原因。由于s蛋白负责与人体宿主细胞受体结合以及与宿主细胞的融合,s蛋白是sars-cov和sars-cov-2冠状病毒治疗性中和抗体的主要靶点。
4.中和抗体能够通过阻断病毒入侵宿主细胞而防止病毒传播,达到治疗疾病的目的。在现在全球新冠疫情严峻的形势下,开发出具有高特异性、良好临床药效和更低治疗成本的sars-cov-2冠状病毒s蛋白中和抗体,将给患者提供更多的用药选择。
技术实现要素:
5.本发明提供了一种能够特异性识别并高亲和力结合sars-cov-2冠状病毒s蛋白的抗体,所述抗体能够阻断sars-cov-2感染宿主细胞。本发明公开的s蛋白抗体可以(单独或与其它制剂或治疗方法组合)用于治疗、预防和/或诊断由sars-cov-2引起的疾病,例如covid-19。
6.本发明第一方面,提供一种能够特异性结合sars-cov-2冠状病毒s蛋白的抗体或其抗原结合片段,所述抗体或其抗原结合片段包含的重链可变区(vh)包含至少一个、两个或三个选自下组的互补决定区(cdr):
7.(i)hcdr1,其具有如seq id no:1、7、12或18所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
8.(ii)hcdr2,其具有如seq id no:2、8、13、19、33或35所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;和
9.(iii)hcdr3,其具有如seq id no:3、9、14、20、34或36所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
10.和/或,其包含的轻链可变区(vl)包含至少一个、两个或三个选自下组的互补决定区(cdr):
11.(iv)lcdr1,其具有如seq id no:4、10、15或21所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
12.(v)lcdr2,其具有如seq id no:5、11、16或22所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;和
13.(vi)lcdr3,其具有如seq id no:6或17所示的序列,或者与上述序列相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列。
14.在某些优选的实施方案中,(i)-(vi)任一项中所述的置换为保守置换。
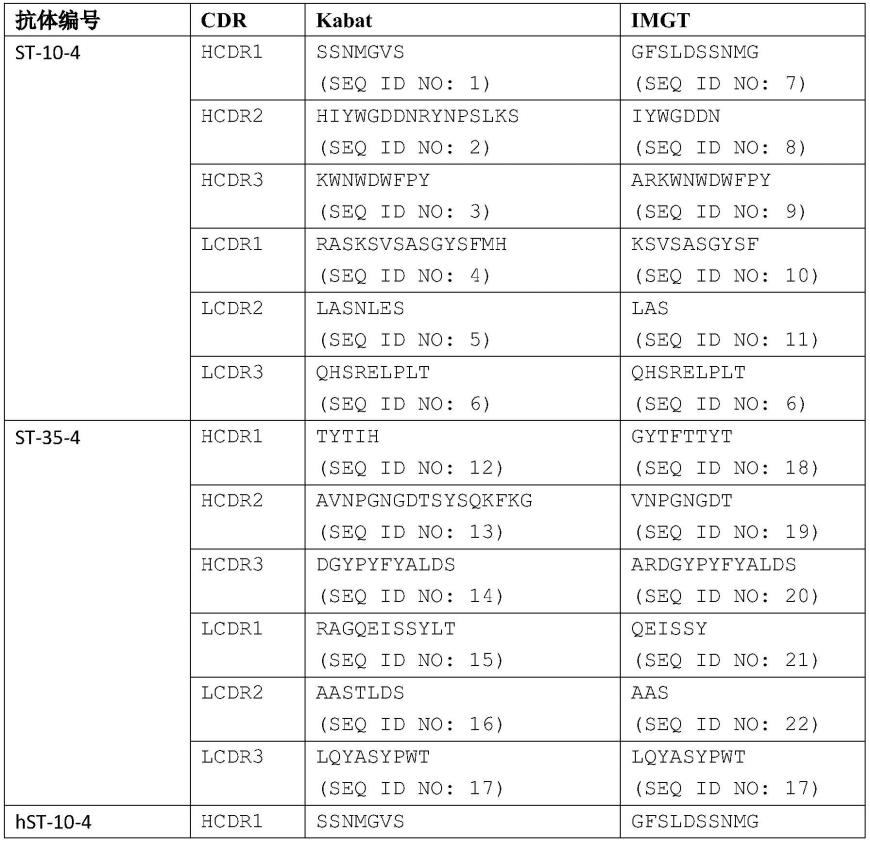
15.在某些优选的实施方案中,所述重链可变区中含有的hcdr1、hcdr2及hcdr3,和/或所述轻链可变区中含有的lcdr1、lcdr2及lcdr3由kabat或imgt编号系统定义。实施例5中的表1示例性地给出了鼠源抗体按kabat或imgt编号系统定义出的cdr氨基酸序列。
16.在某些优选的实施方案中,所述抗体或其抗原结合片段包含3个vh可变区cdr和3个vl可变区cdr,其选自下述6组:
17.(i)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:1、2、3、4、5或6所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
18.(ii)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:7、8、9、10、11或6所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
19.(iii)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:12、13、14、15、16或17所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
20.(iv)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:18、19、20、21、22或17所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
21.(v)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:12、33、34、15、16或17所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列;
22.(vi)其hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3分别具有如seq id no:18、35、36、21、22或17所示的序列,或者与上述序列中的任何相比具有一个或几个氨基酸置换、缺失或添加(例如1个,2个或3个置换、缺失或添加)的序列。
23.在某些实施方案中,所述抗体或其抗原结合片段为鼠源的或嵌合的,其重链可变区包含鼠源igg1、igg2、igg3或其变体的重链fr区;和其轻链可变区包含鼠源κ、λ链或其变体的轻链fr区。实施例5中的表2中给出了优选的鼠源抗体的可变区氨基酸序列编号。
24.在某些优选的实施方案中,所述鼠源或嵌合抗体或其抗原结合片段包含选自下述2组的vh和vl序列:
25.(i)vh结构域包含如seq id no:23所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;和其vl结构域包含如seq id no:24所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;
26.(ii)vh结构域包含如seq id no:25所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;和其vl结构域包含如seq id no:26所示的氨基
酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列。
27.在某些实施方案中,所述抗体或其抗原结合片段为人源化的。实施例5给出了人源化策略的基本流程,表1示例性地给出了优选的人源化抗体按kabat或imgt编号系统定义出的cdr氨基酸序列,表2中给出了优选的人源化抗体的可变区氨基酸序列编号。
28.在某些优选的实施方案中,所述人源化抗体或其抗原结合片段包含选自下述的vh和vl序列:
29.(i)vh结构域包含如seq id no:37所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;和其vl结构域包含如seq id no:38所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;
30.(ii)vh结构域包含如seq id no:39所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列;和其vl结构域包含如seq id no:40所示的氨基酸序列,或与上述序列基本上相同(例如至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性或具有一个或更多个氨基酸取代(例如保守性取代))的序列。
31.在某些实施方案中,所述抗体包含来源于人免疫球蛋白的重链恒定区和轻链恒定区。
32.较优选地,所述抗体包含人κappa链恒定区氨基酸序列(氨基酸序列如seq id no:27所示)。
33.较优选地,所述抗体包含选自人igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige的重链恒定区;更优选地,包含选自人igg1、igg2和igg4的重链恒定区;并且,所述重链恒定区具有天然序列或与其所源自的天然序列相比具有一个或多个氨基酸的置换、缺失或添加的序列。例如,在一种实施方案中,人源化抗体分子包含野生型人igg1的重链恒定区(氨基酸序列如seq id no:28所示)。在另一种实施方案中,人源化抗体分子包括在根据eu编号的m252y、s254t、t256e和m428l突变的人igg1的重链恒定区(氨基酸序列如seq id no:29所示)。在另一种实施方案中,人源化抗体分子包含野生型人igg2的重链恒定区(氨基酸序列如seq id no:30所示)。在一种实施方案中,人源化抗体分子包括在根据eu编号的铰链区修饰的的人igg2(例如缺失erkcc,氨基酸序列如seq id no:31所示),参见中国专利号cn104177496b。在另一种实施方案中,人源化抗体分子包括在根据eu编号的第228位突变(例如s变为p)的人igg4(氨基酸序列如seq id no:32所示)。
34.在某些优选的实施方案中,所述抗体的重链具有如seq id no:41所示的氨基酸序列;或与上述序列中的任何相比具有一个或几个置换、缺失或添加(例如1个,2个,3个,4个或5个置换、缺失或添加)的序列;或与上述序列中的任何相比具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或更高同一性的序列;和/或,所述抗体的轻链具有如seq id no:42所示的氨基酸序列;或与上述序列中的任何相比具有一个或几个置换、缺失或添加(例如1个,2个,3个,4个或5个置换、缺失或添加)的序列;或与上述序列中的任何相比具有至少80%、至少
85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或更高同一性的序列。
35.在某些优选的实施方案中,所述抗体的重链具有如seq id no:43所示的氨基酸序列;或与上述序列中的任何相比具有一个或几个置换、缺失或添加(例如1个,2个,3个,4个或5个置换、缺失或添加)的序列;或与上述序列中的任何相比具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或更高同一性的序列;和/或,所述抗体的轻链具有如seq id no:44所示的氨基酸序列;或与上述序列中的任何相比具有一个或几个置换、缺失或添加(例如1个,2个,3个,4个或5个置换、缺失或添加)的序列;或与上述序列中的任何相比具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、或更高同一性的序列。
36.在某些较优选的实施方案中,上述的置换是保守置换。
37.本发明的第二方面,提供了编码上述抗体或其抗原结合片段的dna分子。
38.本发明的优选实施例中,编码所述抗体重链的dna分子具有如seq id no:45或47所示的核苷酸序列,和编码所述抗体轻链的dna分子具有如seq id no:46或48所示的核苷酸序列。
39.本发明的第三方面,提供了包含上述dna分子的载体。
40.本发明的第四方面,提供了包含上述载体的宿主细胞;所述宿主细胞包含原核细胞、酵母或哺乳动物细胞,如cho细胞、ns0细胞或其它哺乳动物细胞,优选为cho细胞。
41.本发明的第五方面,提供了一种药物组合物,所述组合物包含上述抗体或其抗原结合片段以及可药用赋形剂、载体或稀释剂。
42.本发明的第六方面,还提供了制备本发明所述抗体或其抗原结合片段的方法,其包括:(a)获得抗体或其抗原结合片段的基因,构建抗体或其抗原结合片段的表达载体;(b)通过基因工程方法将上述表达载体转染到宿主细胞中;(c)在允许产生所述抗体或其抗原结合片段的条件下培养上述宿主细胞;(d)分离、纯化产生的所述抗体或其抗原结合片段。
43.其中,步骤(a)中所述表达载体选自质粒、细菌和病毒中的一种或多种,优选地,所述表达载体为pcdna3.1;
44.其中,步骤(b)通过基因工程方法将所构建的载体转染入宿主细胞中,所述宿主细胞包括原核细胞、酵母或哺乳动物细胞,如cho细胞、ns0细胞或其它哺乳动物细胞,优选为cho细胞。
45.其中,步骤(d)通过常规的免疫球蛋白纯化方法,包含蛋白质a亲和层析和离子交换、疏水层析或分子筛方法分离、纯化所述抗体或其抗原结合片段。
46.本发明的第七方面,提供了所述抗体或其抗原结合片段在制备治疗和预防由sars-cov-2冠状病毒引起的疾病的药物中的用途。
47.本发明的第八方面,提供了一种利用上述抗体检测或测定生物样品中sars-cov-2病毒或其抗原的存在情况或进行定量的免疫测定方法;该方法包括将待测生物样品与本发明的抗sars-cov-2病毒s蛋白单克隆抗体或其抗原结合片段孵育,形成抗原-抗体复合物,对形成的结合复合物进行定性检测和定量测定,该复合物的存在或数量指示了sars-cov-2病毒的存在情况或者含量;具体地,所述方法包括如下步骤:
cov-2冠状病毒s蛋白的鼠源抗体,这些抗体能够特异性识别并高亲和力结合s蛋白,kd值达到nm级。
75.2、ace2体外竞争实验结果表明,这些鼠源抗体与人ace2受体竞争s蛋白的结合位点,ic
50
值低至nm级。
76.3、我们对鼠源抗体进行了人源化改造,降低了其免疫原性。人源化抗体保留了鼠源抗体的亲和力和假病毒抑制活性,假病毒抑制活性相当于nm级。以上这些特性为抗体在临床上的应用奠定了基础。
77.4、本发明提供的抗体还可以用于检测样品中sars-cov-2病毒或者其相应抗原存在情况,所述抗体的检出灵敏度低于100pg/ml。
78.发明详述
79.在下文详细描述本发明前,应理解本发明不限于本文中描述的特定方法学、方案和试剂。还应理解本文中使用的术语仅为了描述具体实施方案,而并不意图限制本发明的范围,其仅会由所附权利要求书限制。除非另外定义,本文中使用的所有技术和科学术语与本发明所属领域中普通技术人员通常的理解具有相同的含义。
80.缩写和定义
81.cdr
ꢀꢀꢀꢀꢀ
complementarity-determining region,免疫球蛋白可变区中的互补决定区,用kabat、imgt、chothia或abm编号系统界定(参见术语“超变区”或“cdr区”或“互补决定区”)。
82.elisa
ꢀꢀꢀ
酶联免疫吸附测定
83.fr
ꢀꢀꢀꢀꢀꢀ
抗体框架区(framework),将cdr区排除在外的免疫球蛋白可变区
84.hrp
ꢀꢀꢀꢀꢀ
辣根过氧化物酶
85.ic
50
ꢀꢀꢀꢀ
产生50%抑制的浓度
86.igg
ꢀꢀꢀꢀꢀ
免疫球蛋白g
87.kabat
ꢀꢀꢀ
由elvin a kabat倡导的免疫球蛋白氨基酸序列比对及编号系统。
88.mab
ꢀꢀꢀꢀꢀ
单克隆抗体
89.pcr
ꢀꢀꢀꢀꢀ
聚合酶链式反应
90.v区
ꢀꢀꢀꢀꢀ
在不同抗体之间序列可变的igg链区段。其延伸到轻链的109位kabat残基和重链的第113位残基。
91.kdꢀꢀꢀꢀꢀ
平衡解离常数
92.kaꢀꢀꢀꢀꢀ
结合速率常数
93.kdꢀꢀꢀꢀꢀ
解离速率常数
94.术语“ec
50”是指在使用抗体或其抗原结合片段进行的体外或体内测定中,诱导50%应答的抗体或其抗原结合片段的浓度,即在最大响应和基线之间一半时的浓度。
95.术语“eu编号系统”(eu numbering system or scheme):eu是指上个世纪60年代末(1968-1969),gerald m edelman等人分离纯化得到第一个人igg1免疫球蛋白,命名为eu,测定了其氨基酸序列并为其编号(edelman gm et al,1969,proc natl acad usa,63:78-85)。其它的免疫球蛋白的重链恒定区与eu进行氨基酸序列比对,对应氨基酸位置就是eu编号。eu编号系统主要针对的是免疫球蛋白重链恒定区,包括ch1,ch2,ch3和铰链区。
96.术语“kabat编号系统”(kabat numbering system or scheme):1979年,kabat等
人首先提出了标准化的人免疫球蛋白可变区的编号方案(kabat ea,wu tt,bilofsky h,sequences of immunoglobulin chains:tabulation and analysis of amino acid sequences of precursors,v-regions,c-regions,j-chain andβ
2-microglobulins.1979.department of health,education,and welfare,public health service,national institutes of health)。在“免疫学相关蛋白质序列”一书中(kabat ea,wu tt,perry hm,gottesman ks,foeller c.1991.sequences of proteins of immunological interest,5th edition.bethesda,md:us department of health and human services,national institutes for health),kabat等人对抗体轻链和重链的氨基酸序列进行了比对并编号。他们发现这些被分析序列表现出可变的长度,缺省和插入的氨基酸或氨基酸片段只能出现在特定的位置。有趣的是,插入点多位于cdr内部,但也可能出现在在框架区的某些位置。在kabat编号方案中,轻链可变区编号到109位置,重链可变区编号到113位置,轻重链的插入氨基酸通过字母识别并注释(例如,27a,27b...)。所有lambda轻链不包含位置10残基,而lambda和kappa轻链由两个不同的基因编码,位于不同的染色体上。lambda和kappa轻链可以通过它们的恒定区氨基酸序列的不同来区分。与eu编号系统只针对重链恒定区不同,kabat编号系统的编号范围覆盖全长免疫球蛋白序列,包括免疫球蛋白轻链和重链的可变区和恒定区。
97.术语“抗原表位”或“抗原决定簇”指具有抗原性(即可诱发特异性免疫应答)的分子上的特定化学基团或肽序列,是免疫球蛋白或抗体特异性结合的抗原(例如sars-cov-2的s蛋白)上的位点。表位决定区通常由分子的化学活性表面基团(如氨基酸或糖基侧链)组成且通常有特定的三维结构性质以及特定的电荷性质。抗原有两种表位或抗原决定簇(epitope),b细胞表位和t细胞表位,分别为b细胞和t细胞所识别。我们通常所说抗原表位,一般是指b细胞抗原表位。b细胞表位位于抗原分子的表面,是与b细胞受体(bcr,一种位于b细胞膜上的抗体)结合的抗原部位,b细胞表位不需要加工处理即可直接被b细胞识别。然后b细胞吞噬抗原分子,加工处理成小肽(15个氨基酸左右大小,抗原t细胞表位),呈递给th细胞(辅助性t细胞)。同时,抗原分子也可以通过另一途径,如通过巨噬细胞吞噬,加工处理成小肽,呈递给th细胞。th受到b细胞和巨噬细胞的共刺激,三种细胞共同相互作用,th细胞发出反馈信号给b细胞,指示b细胞增殖,分化成浆细胞和记忆细胞。浆细胞具有分泌抗体的功能,介导体液适应性免疫。抗体通过其可变区fv部分结合抗原分子,通过其恒定区fc部分与各种免疫细胞上的受体fcr结合,从而指引各种免疫细胞对抗原分子进行杀伤,行使adcc(通过nk细胞),cdc(通过补体)和adcp(通过巨噬细胞)功能。每种b细胞具有特异性,只能分泌一种抗体。b细胞表位依据其在蛋白氨基酸序列中的连续性可分为连续表位和构象表位(或称不连续表位)。b细胞抗原表位大小不定,有5-20个氨基酸大小。t细胞抗原表位为t细胞所识别,与b细胞表位不同,t细胞表位可以位于抗原分子(例如病毒蛋白)中的任何位置,因此t细胞抗原表位贯穿于整个蛋白的序列之中。t细胞表位是连续性决定簇,一般为10-20个氨基酸大小。t细胞表位与i类(mhc i)或ii类(mhc ii)mhc分子结合并呈递在细胞表面,分别被t细胞的两个不同子集cd8
+ t细胞(杀伤性t细胞)和cd4
+ t细胞(辅助性th细胞)识别。因此,t细胞表位有cd8
+
和cd4
+ t细胞表位两种。mhc i分子几乎为所有细胞所表达,可以提供细胞内的一些状况,比如该细胞遭受病毒感染,则将病毒碎片之小肽分子通过mhc i提示在细胞表面,可以供杀手cd8
+ t细胞等辨识,以进行扑杀。mhcⅱ分子大多位于抗原呈递
细胞上,如巨噬细胞等。这类mhc ii分子提供细胞外部(如体液中)的情况,像是组织中有细菌侵入,则巨噬细胞进行吞食后,把细菌碎片利用mhc ii提示给辅助性th细胞,启动免疫反应。b细胞和t细胞只能对外来抗原分子的抗原表位进行辨识并结合,对源于生物自身的抗原片段,如蛋白分子及其片段,不具有结合能力,这是因为在b细胞和t细胞的分化、发育和成熟过程中,对自身蛋白分子或片段有高亲和力的b细胞和t细胞,被抑制发育成熟或发生凋亡。
98.术语“抗体”通常指具有免疫球蛋白一类功能的蛋白质结合分子。抗体的典型实例是免疫球蛋白,以及其衍生物或功能片段,只要其显示所需的结合特异性即可。用于制备抗体的技术是本领域熟知的。“抗体”包括不同类的天然免疫球蛋白(例如iga、igg、igm、igd和ige)和亚类(如igg1、lgg2、iga1、iga2等)。“抗体”还包括非天然免疫球蛋白,包括例如单链抗体,嵌合抗体(例如,人源化鼠抗体)和异源偶联抗体(例如,双特异性抗体),以及其抗原结合片段(例如,fab',f(ab')2,fab,fv和rigg)。还可参见,例如,pierce catalog and handbook,1994-1995(pierce chemical co,rockford,ill);kuby j,immunology,3rd ed,wh freeman&co,new york,1997。抗体可以结合至一种抗原,称为“单特异性”;或结合至两种不同的抗原,称为“双特异性”;或结合至多于一种的不同的抗原,称为“多特异性”。抗体可以是单价、二价或多价的,即抗体可以一次结合至一个、两个或多个抗原分子。抗体“单价地”结合至某特定蛋白质,即一分子的抗体仅结合至一分子的蛋白质,但是该抗体也可以结合到不同的蛋白质。当抗体仅结合至两种不同蛋白质的每一种分子时,该抗体为“单价地”结合至每一种蛋白质,并且该抗体是“双特异性的”且“单价地”结合至两种不同蛋白质的每一种。抗体可以是“单体的”,即其包含单个多肽链。抗体可包含多个多肽链(“多聚体的”)或可包含两个(“二聚体的”)、三个(“三聚体的”)或四个(“四聚体的”)多肽链。若抗体为多聚体的,则该抗体可以是同源多聚体(homomulitmer),即抗体包含多于一分子的仅一种多肽链,包括同源二聚体、同源三聚体或同源四聚体。可选的,多聚体抗体可以是异源多聚体,即抗体包含多于一种不同的多肽链,包括异源二聚体、异源三聚体或异源四聚体。
99.术语“单克隆抗体(mab)”指获自基本均一抗体群体的抗体,例如除了可能少量存在的突变如天然产生的突变外,群体包含的单独抗体是相同的。因此,定语“单克隆”表示所述抗体特征为不是离散抗体的混合物。单克隆抗体由本领域技术人员所知晓的方法产生,例如通过将骨髓瘤细胞和免疫脾细胞融合制备杂合的抗体产生细胞。通过杂交瘤培养来合成,不会被其它免疫球蛋白污染。单克隆抗体也可以用如重组技术、噬菌体展示技术、合成技术,或其它现有技术得到。
100.术语“完整抗体”是指由两条抗体重链和两条抗体轻链组成的抗体。“完整抗体重链”是在n-端到c-端方向上由抗体重链可变结构域(vh)、抗体恒定重链结构域1(ch1)、抗体铰链区(hr)、抗体重链恒定结构域2(ch2)和抗体重链恒定结构域3(ch3)组成,缩写为vh-ch1-hr-ch2-ch3;并且在ige亚类的抗体的情形中,任选地还包括抗体重链恒定结构域4(ch4)。优选地“完整抗体重链”是在n-端到c-端方向上由vh、ch1、hr、ch2和ch3组成的多肽。“完整抗体轻链”是在n-端到c-端方向上由抗体轻链可变结构域(vl)和抗体轻链恒定结构域(cl)组成的多肽,缩写为vl-cl。所述抗体轻链恒定结构域(cl)可以是κ(kappa)或λ(lambda)。完整抗体链通过在cl结构域和ch1结构域之间(即轻链和重链之间)的多肽间二硫键和完整抗体重链的铰链区之间的多肽间二硫键连接在一起。典型的完整抗体的实例是
天然抗体如igg(例如,igg1和igg2)、igm、iga、igd和ige。
101.术语“抗体片段”或“抗原结合片段”是指保留与抗原(如,sars-cov-2冠状病毒的s蛋白)特异性结合能力的抗体的抗原结合片段及抗体类似物,其通常包括至少部分母体抗体(parental antibody)的抗原结合区或可变区。抗体片段保留母体抗体的至少某些结合特异性。通常,当用摩尔单位(kd)来表示活性时,抗体片段保留至少10%的母体结合活性。优选地,抗体片段保留至少20%、50%、70%、80%、90%、95%或100%的母体抗体对靶标的结合亲和力。抗体片段包括但不限于:fab片段、fab'片段、f(ab')2片段、fv片段、fd片段、互补决定区(cdr)片段、二硫键稳定性蛋白(dsfv)等;线性抗体(linear antibody)、单链抗体(例如scfv单抗体)、单抗体(unibody,技术来自genmab)、二价单链抗体、单链噬菌体抗体、单域抗体(single domain antibody)(例如vh结构域抗体)、结构域抗体(domantis,技术来自domantis)、纳米抗体(nanobodies,技术来自ablynx);由抗体片段形成的多特异性抗体(例如三链抗体、四链抗体等);和工程改造抗体如嵌合抗体(chimeric antibody)(例如人源化鼠抗体)、异缀合抗体(heteroconjugate antibody)等。这些抗体片段用本领域技术人员已知的常规技术获得,并用与完整抗体相同的方法对这些片段的实用性进行筛选。
102.术语“单链fv抗体”(或“scfv抗体”)是指包含抗体的vh和vl结构域的抗体片段,是通过接头(linker)连接的重链可变区(vh)和轻链可变区(vl)的重组蛋白,接头使得这两个结构域相交联以形成抗原结合位点,接头序列一般由柔性肽组成,例如但不限于g2(ggggs)3。scfv的大小一般是一个完整抗体的1/6。单链抗体优选是由一个核苷酸链编码的一条氨基酸链序列。对于scfv综述,可参见pluckthun a,1994.antibodies from escherichia coli,in the pharmacology of monoclonal antibodies,vol 113,rosenberg m and moore gp(eds.),springer-verlag,new york,pp 269-315。还可参见国际专利申请公开号wo 88/01649和美国专利第4946778号和第5260203号。
103.术语“vl结构域”是指免疫球蛋白轻链的氨基末端可变区结构域。
104.术语“vh结构域”是指免疫球蛋白重链的氨基末端可变区结构域。
105.术语“功能域”指的是能够特异性识别和/或结合到表位上的三维结构,例如抗体或抗体片段,包括天然完整抗体、单链抗体(scfv)、fd片段、fab片段、f(ab')2片段、单结构域抗体片段、分离的cdr片段及其衍生物。此处“单链”意思是第一和第二功能域共价连接,可以以一个核酸分子编码的共线性氨基酸序列表示。
106.术语“fab片段”由一条重链的可变区及ch1区和一条轻链组成。fab分子的重链不能与另一个重链分子形成二硫键。“fab抗体”的大小是完整抗体的1/3,其只包含一个抗原结合位点。
107.术语“fab'片段”含有一条轻链、一条重链的vh结构域和ch1结构域、以及ch1和ch2结构域之间的恒定区部分。
108.术语“f(ab')2片段”含有两条轻链和两条重链的vh结构域和ch1结构域以及ch1和ch2结构域之间的恒定区部分,由此在两条重链间形成链间二硫键。因此,f(ab
′
)2片段由通过两条重链间的二硫键保持在一起的两个fab'片段组成。
109.术语“fv区”包含来自重链和轻链二者的可变区,但缺少恒定区,是包含完整抗原识别和结合位点的最小片段。
110.术语“重链恒定区”包括来自免疫球蛋白重链的氨基酸序列。包含重链恒定区的多
肽至少包含以下一种:ch1结构域、铰链(例如,上部铰链区、中间铰链区,和/或下部铰链区)结构域,ch2结构域、ch3结构域或其变体或片段。例如,本技术中使用的抗原结合多肽可包含具有ch1结构域的多肽链;具有ch1结构域、至少一部分的铰链结构域和ch2结构域的多肽;具有ch1结构域和ch3结构域的多肽链;具有ch1结构域、至少一部分铰链结构域和ch3结构域的多肽链,或者具有ch1结构域,至少一部分铰链结构,ch2结构域,和ch3结构域的多肽链。在另一个实施例中,本技术的多肽包括具有ch3结构域的多肽链。另外,在本技术中使用的抗体可能缺少至少一部分ch2结构域(例如,所有的或一部分的ch2结构域)。如上文所述,但本技术领域的普通技术人员应理解,重链恒定区可能会被修改,使得它们在氨基酸序列上与天然存在的免疫球蛋白分子不同。
111.术语“轻链恒定区”包括来自抗体轻链的氨基酸序列。优选地,所述轻链恒定区包括恒定kappa结构域和恒定lambda结构域中的至少一个。
112.术语“fc区”或“fc片段”是指免疫球蛋白重链的c端区,其含有铰链区的至少一部分、ch2结构域和ch3结构域,其介导免疫球蛋白与宿主组织或因子的结合,包括与位于免疫系统的各种细胞(例如,效应细胞)上的fc受体结合或与经典补体系统的第一组分(c1q)结合。fc区包括天然序列fc区和变异fc区。
113.通常,人igg重链fc区为自其cys 226或pro 230位置的氨基酸残基至羧基末端的区段,但其边界可能有变化。fc区的c末端赖氨酸(残基447,依照eu编号系统)可以存在或可以不存在。fc还可以指独立存在的,或在包含fc的蛋白多肽的情况下的这一区域,例如“包含fc区的结合蛋白”,还称为“fc融合蛋白”(例如,抗体或免疫粘合素)。本发明的抗体中天然序列fc区来自包括哺乳动物(例如人)的igg1、igg2(igg2a,igg2b)、igg3和igg4。在某些实施方案中,相对于哺乳动物fc多肽氨基酸序列,两条fc多肽链的氨基酸序列中每100个氨基酸中具有10个左右氨基酸的单一氨基酸的置换、插入和/或缺失。在一些实施方案中,上述fc区氨基酸差异可以是延长半衰期的fc改变、增加fcrn结合的改变、增强fcγ受体(fcγr)结合的改变和/或增强adcc、adcp和/或cdc的改变。
114.在igg、iga和igd抗体同种型中,fc区包含抗体两条重链中的每一条的ch2和ch3恒定结构域;igm和ige fc区包含在每条多肽链中的三个重链恒定结构域(ch2-4结构域)。
115.术语“嵌合抗体”是指重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的剩余部分与衍生自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及此类抗体的片段,只要它们展现出期望的生物学活性(美国专利us4816567;morrison sl et al,1984,proc natl acad sci usa,81:6851-6855)。例如,术语“嵌合抗体”可包括这样的抗体(例如人鼠嵌合抗体),其中抗体的重链和轻链可变区来自第一抗体(例如鼠源抗体),而抗体的重链和轻链恒定区来自第二抗体(例如人抗体)。
116.术语“人”抗体是指具有可变区的抗体,其中框架区和cdr区均源自人种系免疫球蛋白序列。此外,如果抗体含有恒定区,恒定区也来源于人种系免疫球蛋白序列。本发明的人抗体可以包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人抗体”不打算包括其中来源于另一种哺乳动物物种如小鼠的种系的cdr序列已经嫁接到人框架序列上的抗体。
117.术语“人源化抗体”是指经基因工程改造的非人源抗体,其氨基酸序列经修饰以提高与人源抗体的序列的同源性。非人抗体的cdr域外的大部分或全部氨基酸,例如小鼠抗体被来自人免疫球蛋白的相应氨基酸置换,而一个或多个cdr区内的大部分或全部氨基酸未改变。氨基酸的添加,删除,插入,替换或修饰是允许的,只要它们不会消除抗体结合特定抗原的能力。“人源化”抗体保留与原始抗体类似的抗原特异性。cdr的来源没有特别限制,可来源于任何动物。例如,可以利用源于小鼠抗体、大鼠抗体、兔抗体或非人灵长类动物(例如,食蟹猴)抗体的cdr区。框架区可以通过搜索imgt antibody germline database(http://www.imgt.org/3dstructure-db/cgi/domaingapalign.cgi)获得人类抗体胚系序列,一般选取与被改造的非人源抗体同源度高的人类胚系抗体序列做人源化抗体的框架区。
118.术语“超变区”或“cdr区”或“互补决定区”是指负责抗原结合的抗体氨基酸残基,是非连续的氨基酸序列。cdr区序列可以由kabat、chothia、imgt(lefranc et al,2003,dev comparat immunol,27:55-77)和abm(martin acr et al,1989,proc natl acad sci usa,86:9268
–
9272)方法来定义或本领域熟知的任何cdr区序列确定方法而鉴定的可变区内的氨基酸残基。例如,超变区包含以下氨基酸残基:来自序列比对所界定的“互补决定区”或“cdr”的氨基酸残基(kabat编号系统),例如,轻链可变结构域的24-34(lcdr1)、50-56(lcdr2)和89-97(lcdr3)位残基和重链可变结构域的31-35(hcdr1)、50-65(hcdr2)和95-102(hcdr3)位残基,参见kabat et al,1991,sequences of proteins of immunological interest,5th edition,public health service,national institutes of health,bethesda,md.;和/或来自根据结构来界定的“超变环”(hvl)的残基(chothia编号系统),例如,轻链可变结构域的26-32(lcdr1)、50-52(lcdr2)和91-96(lcdr3)位残基和重链可变结构域的26-32(hcdr1)、53-55(hcdr2)和96-101(hcdr3)位残基,参见chothia c and lesk am,1987,j mol biol,196:901-917;chothia c et al,1989,nature,342:878-883。“框架”残基或“fr”残基为除本文定义的超变区残基之外的可变结构域残基。在某些实施方案中,本发明的抗体或其抗原结合片段含有的cdr优选地通过kabat、imgt或chothia编号系统确定。本领域技术人员可以明确地将每种编号系统赋予任何可变结构域序列,而不依赖于超出序列本身之外的任何实验数据。例如,给定抗体的kabat残基编号方式可通过将抗体序列与每种“标准”编号序列对比同源区来确定。基于本文提供的序列编号方案,确定序列表中任何可变区序列的编号完全在本领域技术人员的常规技术范围内。
119.术语“分离的抗体分子”指的是已经从其自然环境的组分中识别和分离和/或回收的抗体分子。其自然环境的污染组分是会干扰抗体的诊断或治疗用途的物质,并可能包括酶、激素和其它蛋白质的或非蛋白质的溶质。
120.本文使用的关于核酸(如dna或rna)的术语“分离的”,是指分别从其它的以天然来源的大分子存在的dna或rna分离的分子。本文使用的术语“分离的”也指通过重组dna技术生产时基本不含细胞材料,病毒材料或培养基的核酸或多肽,或经化学合成制备时基本不含化学前体或其它化学品。此外,“分离的核酸”是指包括不是天然存在的片段并且不会以天然状态发现的核酸片段。本文中术语“分离的”也用于指从其它细胞蛋白或组织分离的细胞或多肽。分离的多肽是指包括纯化的和重组的多肽。
121.术语“交叉反应”是指本文所述的抗体结合来自不同物种的抗原的能力。例如,本
文所述的结合sars-cov-2冠状病毒s蛋白的抗体还可结合来自其它物种的s蛋白(例如,sars-cov的s蛋白)。交叉反应性可通过检测在结合测定法(例如,spr、elisa)中与纯化抗原的特定反应性,或与生理表达抗原的细胞的结合或以其它方式与生理表达抗原的细胞的功能相互作用来测量。本领域中已知测定结合亲和力的分析的实例包括表面等离子共振(例如,biacore)或类似技术(例如,kinexa或octet)。
122.术语“免疫结合”和“免疫结合性质”是指一种非共价相互作用,其发生在免疫球蛋白分子和抗原(对于该抗原而言免疫球蛋白为特异性的)之间。免疫结合相互作用的强度或亲和力可以用相互作用的平衡解离常数(kd)表示,其中kd值越小,表示亲和力越高。所选多肽的免疫结合性质可使用本领域中公知的方法测定。一种测定方法涉及测量抗原/抗体复合物形成和解离的速度。“结合速率常数”(ka或k
on
)和“解离速率常数”(kd或k
off
)两者都可通过浓度及缔合和解离的实际速率而计算得出(参见malmqvist m,1993,nature,361:186-187)。kd/ka的比率等于平衡解离常数kd(参见davies dr et al,1990,annual rev biochem,59:439-473)。可用任何有效的方法测量kd、ka和kd值。
123.术语“宿主细胞”指在其中载体可以增殖并且其dna可以表达的细胞,所述细胞可以是原核细胞或者真核细胞。该术语还包括受试宿主细胞的任何后代。应理解,并不是所有的后代都与亲本细胞相同,因为在复制过程中可能会发生突变,这类后代被包括在内。宿主细胞包含原核细胞、酵母或哺乳动物细胞,如cho细胞、ns0细胞或其它哺乳动物细胞。
124.术语“同一性”用于指两个多肽之间或两个核酸之间序列的匹配情况。当两个进行比较的序列中的某个位置都被相同的碱基或氨基酸单体亚单元占据时(例如,两个dna分子的每一个中的某个位置都被腺嘌呤占据,或两个多肽的每一个中的某个位置都被赖氨酸占据),那么各分子在该位置上是同一的。两个序列之间的“百分数同一性”是由这两个序列共有的匹配位置数目除以进行比较的位置数目
×
100的函数。例如,如果两个序列的10个位置中有6个匹配,那么这两个序列具有60%的同一性。例如,dna序列ctgact和caggtt共有50%的同一性(总共6个位置中有3个位置匹配)。通常,在将两个序列比对以产生最大同一性时进行比较。这样的比对可通过计算机程序例如align程序(dnastar,inc.)方便地进行,通过使用needleman和wunsch的方法(needleman sb and wunsch cd,1970,j mol biol,48:443-453)来实现。
125.术语“突变的”、“突变体”和“突变”分别指与天然核酸或多肽相比(即可以用来定义野生型的参照序列),置换、缺失或插入一个或多个核苷酸或氨基酸。
126.具有保守修饰的抗体
127.术语“保守修饰”意图指氨基酸修饰不会显著影响或改变含有该氨基酸序列的抗体的结合特征。此类保守修饰包括氨基酸的取代、添加和缺失。修饰可以通过本领域已知的标准技术,例如定点突变和pcr介导的突变引入到本发明的抗体中。保守氨基酸取代指氨基酸残基用具有类似侧链的氨基酸残基替换。本领域中对具有类似侧链的氨基酸残基家族已有详细说明。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。因此,可以用来自同一侧链家族的其它氨基酸残基替
换本发明抗体cdr区中的一个或多个氨基酸残基。
128.针对sars-cov-2冠状病毒s蛋白抗体的治疗用途
129.术语“预防”是指,为了阻止或延迟疾病或病症或症状(例如,肿瘤或感染)在受试者体内的发生或如果它发生作用减到最小而实施的方法。
130.术语“治疗”是指,为了获得有益或所需临床结果而实施的方法。有益或所需的临床结果包括但不限于,降低疾病进展速率,改善或减轻疾病状态,和消退或改善的预后,无论是可检测或是不可检测的。有效缓解任何特定疾病症状的治疗剂的量可以根据诸如患者的疾病状态,年龄和体重以及药物在受试者中引起期望的反应的能力等因素而变化。疾病症状是否得到缓解可以通过任何临床测量来评估,这些测量通常由医生或其它熟练的医疗保健提供者用于评估该症状的严重程度或进展状态。
131.可将本发明的抗体(其包括双特异性、多克隆、单克隆、人源化抗体)用作治疗剂。这些药剂可通常用于在受试者中治疗或预防新型冠状肺炎covid-19,增加疫苗功效或提高天然免疫应答。将抗体制剂(优选地对其靶抗原s蛋白具有高特异性和高亲和力的抗体制剂)给予受试者并且通常因其与靶标的结合而具有效果。抗体的给予可消除或抑制或干扰sars-cov-2冠状病毒s蛋白的活性。在使用抗体片段的情况下,特异性结合至靶蛋白的结合结构域的最小的抑制性片段是优选的。例如,基于抗体的可变区序列,其保持结合靶蛋白序列的能力。这类肽可化学合成和/或通过重组dna技术制备(参见,例如,marasco wa et al,1993,proc natl acad sci usa,90:7889-7893)。
132.本发明的特异性结合sars-cov-2冠状病毒s蛋白的抗体或其片段可以药物组合物的形式给予。制剂可根据治疗的特定适应症的需要而含有超过一种活性化合物,优选相互间无不利影响的具有互补活性的那些。备选地或另外,组合物可包含增强它的功能的作用剂。
133.药物组合物
134.本发明的抗体或编码本技术抗体的核酸或多核苷酸,可以应用于制备药物组合物或无菌组合物,例如,将抗体与药学上可接受的载体、赋形剂或稳定剂混合。药物组合物可包括一种或组合的(如两种或更多不同的)本发明的抗体。例如,本发明的药物组合物可包含与靶抗原上的不同表位结合的具有互补活性的抗体或抗体片段(或免疫缀合物)的组合。治疗和诊断剂的制剂可通过以例如冻干粉末、浆液、水性溶液或悬浮液的形式与药学可接受的载体、赋形剂或稳定剂混合来制备。术语“药学上可接受的”指当分子本体、分子片段或组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。可作为药学上可接受的载体或其组分的一些物质的具体示例包括糖类(如乳糖)、淀粉、纤维素及其衍生物、植物油、明胶、多元醇(如丙二醇)、海藻酸等。本发明的抗体或编码本技术抗体的核酸或多核苷酸可单独使用,或可与一种或更多种其它治疗剂共同使用,所述治疗剂例如疫苗。
135.术语“药学上可接受的载体和/或赋形剂和/或稳定剂”,是指在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂和/或稳定剂,它们在所采用的剂量和浓度对暴露于其的细胞或哺乳动物是无毒的。包括但不限于:ph调节剂,表面活性剂,佐剂,离子强度增强剂,稀释剂,维持渗透压的试剂,延迟吸收的试剂,防腐剂。例如,ph调节剂包括但不限于磷酸盐缓冲液。表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80。离子强度增强剂包括但不限于氯化钠。防腐剂包括但不限于各种抗细菌
试剂和抗真菌试剂,例如对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。维持渗透压的试剂包括但不限于糖、nacl及其类似物。延迟吸收的试剂包括但不限于单硬脂酸盐和明胶。稀释剂包括但不限于水,水性缓冲液(如缓冲盐水),醇和多元醇(如甘油)等。防腐剂包括但不限于各种抗细菌试剂和抗真菌试剂,例如硫柳汞,2-苯氧乙醇,对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。稳定剂具有本领域技术人员通常理解的含义,其能够稳定药物中的活性成分的期望活性,包括但不限于谷氨酸钠,明胶,spga,糖类(如山梨醇,甘露醇,淀粉,蔗糖,乳糖,葡聚糖,或葡萄糖),氨基酸(如谷氨酸,甘氨酸),蛋白质(如干燥乳清,白蛋白或酪蛋白)或其降解产物(如乳白蛋白水解物)等。
136.针对sars-cov-2冠状病毒s蛋白抗体的诊断用途
137.本发明的单克隆抗体或其抗原结合性片段可用于sars-cov-2病毒的检测或定量用免疫测定。免疫测定方法本身是公知的,可以采用任何公知的免疫测定方法。即,如果以测定形式进行分类,有夹心法、竞争法、凝聚法、蛋白质印迹法等,如果以所使用的标记进行分类,则有荧光法、酶法、放射法、生物素法等,这些都可使用。还可通过免疫组织染色进行诊断。免疫测定方法中使用标记抗体时,抗体的标记方法本身是公知的,可以采用公知的任何方法。
138.这些免疫测定法本身是公知的,本说明书中无须赘述,简单来讲,例如夹心法是将本发明的抗体或抗原结合性片段作为第一抗体固定为固相,与待测生物样品反应,漂洗后,再使其与第二抗体反应,漂洗后测定与固相结合的第二抗体。将第二抗体用酶、荧光物质、放射性物质、生物素等标记,可以测定与固相结合的第二抗体。通过上述方法对已知浓度的多个标准品进行测定,根据测定的标记量与标准品含量的关系制作标准曲线,将对未知浓度的受检样品的测定结果对照该标准曲线,可以对受检样品中sars-cov-2病毒抗原进行定量。还可以将第一抗体和第二抗体在上述说明中替换。凝聚法中,将本发明的抗体或其抗原结合性片段固定在胶乳等颗粒上,与样品反应,测定吸光度。通过上述方法对已知浓度的多个标准品进行测定,根据测定的标记量与标准品含量的关系制作标准曲线,将对未知浓度的受检样品的测定结果对照该标准曲线,可以对受检样品中sars-cov-2病毒抗原进行定量。
139.供给上述免疫测定法的生物样品只要是含有sars-cov-2病毒的s蛋白的样品即可,没有特别限定,例如可以来自人和动物的血清、血浆、全血,除此之外还有鼻腔拭液(鼻腔拭子)、鼻腔吸引液、咽拭液(咽拭子)等体液提取液、唾液、呼吸道分泌物、尿液、粪便、细胞或组织匀浆液等。
140.通过使用上述本发明的单克隆抗体,可将该抗体用作固相抗体和标记抗体的至少一方,制备sars-cov-2病毒免疫测定试剂。与上述单克隆抗体结合的固相可以使用以往免疫测定中使用的各种固相,例如有:elisa板、胶乳、明胶颗粒、磁性颗粒、聚苯乙烯、玻璃等各种固相,珠子,可传输液体的基质等不溶性载体等。另外,可用酶、胶体金属颗粒、着色胶乳颗粒、发光物质、荧光物质、放射性物质等标记抗体,来制备标记抗体。将这些固相抗体和/或标记抗体等试剂组合,可以制备在酶联免疫测定法、放射免疫测定法、荧光免疫测定法等中使用的试剂。这些测定试剂是通过夹心法或竞争性结合测定法测定试样中的目标抗原的试剂。
141.上述通过夹心法进行免疫测定的试剂可以使用以下的试剂:例如准备两种本发明
的单克隆抗体,以其中一种为上述标记抗体,以另外一种为与上述固相结合的固相抗体。首先,使含有待测定的抗原的样品与该固相抗体反应,接着使标记抗体(第二抗体)与被捕捉到该固相抗体上的抗原反应,通过检测与不溶性载体结合的标记物的存在或活性,可以实施免疫鉴定。同样,使含有待测定的抗原的样品与固相抗体反应,接着使标记抗体(第二抗体)与被捕捉到该固相抗体上的抗原反应,通过测定与不溶性载体结合的标记物的存在或活性,即通过标记抗体的量对待测定的抗原的量进行定量,可以实施免疫测量。夹心法的免疫测定试剂中,可以使用一种单克隆抗体作为固相抗体和标记抗体(例如抗原为多聚物时),但通常优选使用可分别识别待测定的抗原的两个不同的表位的2种或以上的抗体。并且,对于任何的固相抗体和标记抗体,可以从2种或以上的单克隆抗体中选择组合使用。
142.作为采用竞争性结合测定法的免疫测定试剂,例如可以制备成用酶、胶体金属颗粒、着色胶乳颗粒、发光物质、荧光物质、放射性物质等标记的一定量的病毒抗原。使用该试剂,可以与例如含有一定量的本发明的单克隆抗体、上述标记病毒抗原和待测定的抗原的样品进行竞争性反应,由与抗体结合的或未结合的标记病毒抗原的量对待测定样品中抗原的量进行定量,从而实施免疫测定。
143.本发明中,使上述抗体或抗原与固相或标记物结合时,可以采用物理吸附法、化学结合法等方法(参照“蛋白质核酸酵素”,别册no.31,37-45(1987年))。
144.上述标记抗sars-cov-2病毒单克隆抗体可以通过使抗sars-cov-2病毒单克隆抗体与标记物结合来制备。标记物可以是酶、胶体金属颗粒、着色胶乳颗粒、荧光胶乳颗粒、发光物质、荧光物质等。酶可以是酶联免疫测定法(enzyme immunoassays,eia)中使用的各种酶,例如碱性磷酸酶、过氧化物酶、β-d-半乳糖苷酶等;胶体金属颗粒例如可以使用胶体金颗粒、胶体硒颗粒等。
145.标记物与抗sars-cov-2病毒单克隆抗体的结合方法可以利用公知的产生共价键或非共价键的方法。结合的方法例如有:戊二醛法、高碘酸法、马来酰亚胺法、二硫二吡啶法、使用各种交联剂的方法等(例如“蛋白质核酸酵素”,别册no.31,37-45(1985年))。使用交联剂的结合方法中,交联剂例如可使用n-琥珀酰亚氨基-4-马来酰亚氨基丁酸(gmbs)、n-琥珀酰亚氨基-6-马来酰亚氨基己酸、n-琥珀酰亚氨基-4-(n-马来酰亚氨基甲基)环己烷-1-羧酸等。通过共价键结合的方法中,可以依赖使用存在于抗体中的官能团,除此之外可以按照常规方法例如将硫羟基、氨基、羧基、羟基等官能团导入抗体中,然后采用上述结合方法,使该官能团与标记物结合,由此制备标记的抗sars-cov-2病毒单克隆抗体。通过非共价键结合的方法还有物理吸附法等。
146.底物可以使用对应于标记物的酶并如下表示的各种显色底物、荧光底物、发光底物等。
147.(a)显色底物:与过氧化氢组合的2,2
’‑
连氮基-双(3-乙基苯并噻唑啉-6-磺酸)(abts)、3,3’,5,5
’‑
四甲基联苯胺(tmb)、二氨基联苯胺(dab)用于过氧化物酶;5-溴-4-氯-3-吲哚基磷酸(bcip)、对硝基苯磷酸酯(p-npp)、5-溴-4-氯-3-吲哚基磷酸钠(bcip
·
na)用于碱性磷酸酶。
148.(b)荧光底物:4-甲基伞形苯基磷酸酯(4-mup)用于碱性磷酸酶;4-甲基伞形基苯基-β-d-半乳糖苷(4mug)用于β-d-半乳糖苷酶。
149.(c)发光底物:3-(2
’‑
螺旋金刚烷)-4-甲氧基-4-(3
”‑
磷酰氧基)苯基-1,2-二氧杂
环丁烷
·
2钠盐(amppd)用于碱性磷酸酶;3-(2
’‑
螺旋金刚烷)-4-甲氧基-4-(3
”‑
β-d-吡喃半乳糖基)苯基-1,2-二氧杂环丁烷(amgpd)用于β-d-半乳糖苷酶;与过氧化氢组合得到的鲁米诺、异鲁米诺用于过氧化物酶。
150.通过将使用本发明针对sars-cov-2病毒的s蛋白的单克隆抗体测定来自人或动物的各种生物样品,可以实施sars-cov-2病毒感染的诊断。
附图说明
151.图1、纯化的鼠源抗体st-10-4和st-35-4与sars-cov-2st的结合能力测定
152.图2、鼠源抗体st-10-4和st-35-4阻断刺突s蛋白与293t-ace2细胞的结合。
153.图3、鼠源抗体st-10-4分子对接模型、ace2/rbd结构(pdb 6m0j)以及抗体cr3022/rbd结构(pdb 6w41)三个结构叠合图。
154.图4、鼠源抗体st-35-4分子对接模型、ace2/rbd结构(pdb 6m0j)以及抗体cr3022/rbd结构(pdb 6w41)三个结构叠合图。
155.图5、人源化抗体hst-10-4和hst-35-4体外抑制假病毒的活性测定。
具体实施方式
156.实施例1、抗sars-cov-2鼠源单克隆抗体制备
157.抗原制备:sars-cov-2s三聚体抗原制备过程:根据uniprot中公布的新型冠状病毒s蛋白全长氨基酸序列(uniprot entry p0dtc2),选取其中16-1213aa(s三聚体,标记为st),用作本实施例中筛选抗体的抗原。为了获得高效表达的目的蛋白,对st的编码基因进行人工改造和优化,并按照常规分子生物学方法构建该目的基因的真核表达载体pcdna3.1-st,将测序正确的重组表达质粒转染cho细胞,并按常规方法进行表达和纯化,获得纯化后的抗原用于免疫。
158.动物免疫:将上述sars-cov-2st蛋白抗原以完全弗氏佐剂充分乳化后,采用多点免疫方式免疫雄性balb/c小鼠(上海斯莱克实验动物有限责任公司),50μg/只,免疫周期为三周一次。在第3次免疫后第10天,眼眶取血,以实施例2.1中描述的间接elisa法测试血清抗sars-cov-2st抗体滴度以监测小鼠免疫应答程度,竞争elisa法测试血清sars-cov-2st中和抗体水平。然后在融合前3天,对产生抗sars-cov-2st抗体滴度最高以及中和抗体水平最高的小鼠加强免疫一次。3天后,处死小鼠并取出该小鼠脾脏与小鼠骨髓瘤sp2/0细胞株融合。
159.细胞融合与抗体筛选:混合2
×
108sp2/0细胞与2
×
108脾细胞在50%聚乙二醇(分子量为1450)和5%二甲基亚砜(dmso)溶液中融合。用iscove培养基(含有10%胎牛血清、100单位/ml青霉素、100μg/ml链霉素、0.1mm次黄嘌呤、0.4μm氨基蝶呤和16μm胸苷)来调整脾脏细胞数至5
×
105/ml,以0.3ml加入96孔培养板孔内,并置于37℃,5%co2培养箱内。培养10天后,采用高通量elisa法分别检测上清中抗体与hrp标记的hace2-fc(ace2(18-740)-fc)(acro biosystems,以下来源相同)竞争结合sars-cov-2st的能力,以此筛选出与hace2-fc竞争的阳性孔(方法参见实施例2.2)。再将上述含有能够抑制hace2-fc与sars-cov-2st结合的单克隆抗体的孔内融合细胞进行亚克隆,同样以竞争elisa方法筛选得到表达高亲和力鼠单克隆抗体的杂交瘤细胞株。其中2个细胞株后来被证明是表达以下抗体的
antibody germline database,http://www.imgt.org/3dstructure-db/cgi/domaingapalign.cgi),获得与鼠抗具有高相似度的人源抗体模板。用discovery studio对鼠抗和人源抗体模板进行cdr区注释,按kabat或imgt方案定义出cdr区。用鼠抗的六个cdr区分别替换人源抗体模板的六个cdr区。移植的6个cdr区中的单独每个cdr区可以是按kabat定义出的氨基酸区域,或按imgt定义出的氨基酸区域。cdr移植后进行从鼠源抗体到人源化模板fr区的回复突变。稳定抗体cdr区构象和对抗原-抗体结合重要的关键鼠抗fr区氨基酸包括4类氨基酸残基:1)cdr区以内埋藏在抗体表面下的氨基酸;2)cdr区以内暴露在抗体表面的氨基酸;3)抗体轻链和重链结构域之间的界面氨基酸;和4)稳定抗体cdr区构象的vernier zone residues(foote j and winter g,1992,j mol biol,224:487-499)。以上4类关键鼠抗fr区残基是通过建立鼠抗三维结构模型确定的。对于与鼠抗序列不一致的人源模板的这4类氨基酸,通过三维结构分析,选择对保持cdr构象和抗原-抗体结合重要的氨基酸,进行从鼠抗到人源模板的氨基酸移植或替换。然后,对4类氨基酸移植后产生的人源化抗体进一步计算等电点、疏水聚集、翻译后修饰和免疫原性,对问题氨基酸进行突变,从而得到最终的人源化抗体序列。
177.根据以上方法,以鼠源抗体st-10-4和st-35-4的cdr为基础构建了人源化抗体,上述鼠抗和人源化抗体的可变区所包含的cdr区氨基酸序列如表1所示,重链和轻链可变区氨基酸序列如表2所示。
178.表1、鼠源和人源化抗体可变区中的cdr区
179.[0180][0181]
表2、鼠源抗体对应的人源化抗体以及它们的可变区氨基酸序列
[0182]
抗体编号vh氨基酸序列vl氨基酸序列st-10-4seq id no:23seq id no:24st-35-4seq id no:25seq id no:26hst-10-4seq id no:37seq id no:38hst-35-4seq id no:39seq id no:40
[0183]
为了获得由两条重链和两条轻链组成的全长抗体序列,将表2中所示vh和vl序列的与抗体重链恒定区(优选自人igg1、igg2或igg4)和轻链恒定区(优选自人κ轻链,氨基酸序列如seq id no:27所示)序列采用常规技术进行拼接或组装。例如,在一种实施方案中,人源化抗体分子包含野生型人igg1的重链恒定区(氨基酸序列如seq id no:28所示)。在另一种实施方案中,人源化抗体分子包括在根据eu编号的m252y、s254t、t256e和m428l突变的人igg1的重链恒定区(氨基酸序列如seq id no:29所示)。在另一种实施方案中,人源化抗体分子包含野生型人igg2的重链恒定区(氨基酸序列如seq id no:30所示)。或采用修饰的人igg2恒定区序列,在一种实施方案中,人源化抗体分子包括在根据eu编号的铰链区修饰的的人igg2(例如缺失erkcc,氨基酸序列如seq id no:31所示)。或采用修饰的人igg4恒定区序列,在一种实施方案中,人源化抗体分子包括在根据eu编号的第228位突变(例如s变为p)的人igg4(氨基酸序列如seq id no:32所示)。
[0184]
实施例6、人源化抗体表达载体的构建和蛋白表达
[0185]
用上述方法中获得的人源化抗体的重链和轻链的编码cdna插入到pcdna3.1或其衍生质粒,或其它真核表达载体中,构建人源化抗体表达载体。优选地,使用的载体质粒应含有在哺乳动物细胞中高水平表达所需的巨细胞病毒早期基因启动因子-增强子。同时,载体质粒中含有可选择标记基因,从而在细菌中赋予氨苄青霉素抗性,而在哺乳动物细胞中赋予g418抗性。另外,载体质粒中含有dhfr基因,在合适的宿主细胞中,能以氨甲喋呤(methotrexate,mtx,sigma)共扩增人源化抗体基因和dhfr基因(例如,参见专利cn103333917b)。
[0186]
将上述已构建的重组表达载体质粒转染入哺乳动物宿主细胞系,以表达人源化抗体。为了稳定高水平的表达,优选的宿主细胞系是二氢叶酸还原酶(dhfr)缺陷型的中国仓鼠卵巢(cho)细胞(参见,例如chasin,l.等人的美国专利4818679号)。优选的转染方法是电穿孔,也可以使用其他方法,包括磷酸钙共沉降,脂转染和原生质融合等。在电穿孔中,用设为250v电场和960μfd电容的gene pulser(bio-rad laboratories),在比色杯内加入2
×
107个细胞悬浮在0.8ml的pbs中,并含有10μg用pvui(takara)线性化的表达载体质粒dna。转染2天后,加入含有0.2mg/ml g418以及200nm氨甲喋呤(methotrexate或mtx)。为了实现较高水平的表达,用受mtx药物抑制的dhfr基因共扩增转染的人源化抗体基因。用极限稀释亚克隆转染子及elisa的方法测定各细胞系的分泌率,选出高水平表达人源化抗体的细胞株。收集人源化抗体的条件培养基,用于测定其体外和体内生物学活性。
[0187]
例如,将表3所示编码人源化抗体hst-10-4和hst-35-4的重链和轻链的核苷酸序列插入上述构建的表达载体中,经过加压筛选、亚克隆稳定、高表达目的抗体的细胞株,再经培养、纯化得到各目的抗体。
[0188]
表3、人源化抗体重链和轻链的氨基酸序列及其编码核苷酸序列
[0189]
抗体编号hc氨基酸序列lc氨基酸序列hc核苷酸序列lc核苷酸序列hst-10-4seq id no:41seq id no:42seq id no:45seq id no:46hst-35-4seq id no:43seq id no:44seq id no:47seq id no:48
[0190]
实施例7、人源化抗体的功能鉴定
[0191]
7.1、elisa法测定人源化抗体与sars-cov-2s蛋白的结合能力
[0192]
用pbs缓冲液将sars-cov s蛋白(acro biosystems),稀释至0.1μg/ml,以100μl/孔的体积加于96孔板中,4℃放置16~20h。吸掉上清,用pbst缓冲液洗板1次后,每孔加入200μl 1%pbsb溶液室温孵育1h封闭。移去封闭液,用pbst缓冲液洗板3次后,加入一系列浓度的人源化抗体hst-10-4和hst-35-4,每孔100μl,室温孵育1.5h。移去反应体系,pbst洗板3次后,50μl/孔加入1:4000稀释的hrp标记的羊抗鼠igg二抗(the jackson laboratory),室温孵育1h。再以pbst洗板3次后,每孔加入100μl tmb,室温孵育5-10min显色。最后,每孔加入50μl 0.2m h2so4终止反应,并用酶标仪在双波长450/620nm处读取od值。以od450/620nm吸光度作为y轴,抗体浓度作为x轴,通过软件graphpad prism6进行分析,四参数拟合曲线,计算半数结合浓度(ec
50
)值。
[0193]
结果显示,分子水平上,人源化抗体hst-10-4和hst-35-4均能很好的特异性结合sars-cov-2s蛋白,hst-10-4的结合ec
50
为2.3ng/ml,hst-35-4的结合ec
50
为1.8ng/ml。
[0194]
7.2、竞争elisa法测定人源化抗体的阻断sars-cov-2s蛋白结合ace2的能力
[0195]
用pbs缓冲液将sars-cov-2s蛋白(his标签)稀释至0.1μg/ml,以100μl/孔加于96
孔板中,4℃包被过夜。弃去包被溶液,每孔加入200μl 1%pbsb,室温孵育1h进行封闭。移去封闭液,用pbst缓冲液洗板。将以辣根过氧化物酶(hrp)标记的hace2-fc以1:700比例稀释,与一系列浓度的人源化抗体hst-10-4和hst-35-4以1:1混合,室温预孵育30min;然后将上述混合物加入96孔板中,每孔100μl,室温孵育1小时。以pbst洗板3次后,每孔加入100μl tmb,室温显色5min。加入50μl 0.2m h2so4终止反应,并用酶标仪在双波长450/620nm处读取od值。以od 450/620nm吸光度作为y轴,抗体浓度作为x轴,通过软件graphpad prism 6进行分析,四参数拟合曲线,计算半数抑制浓度(ic
50
)值。
[0196]
结果显示,分子水平上,人源化抗体hst-10-4和hst-35-4均能很好的阻断sars-cov-2s蛋白结合ace2,hst-10-4的ic
50
值为256.8ng/ml,hst-35-4的ic
50
值为194.3ng/ml。
[0197]
7.3、抗sars-cov-2人源化抗体阻断刺突s蛋白与293t-ace2细胞的结合
[0198]
刺突s蛋白与293t-ace2细胞结合的阻断实验方法参见实施例3。以平均荧光强度作为y轴,抗体浓度作为x轴,通过软件graphpad prism 6进行分析,计算抗人源化抗体hst-10-4和hst-35-4阻断s-mfc蛋白与293t-ace2细胞结合的ic
50
值。
[0199]
结果显示,细胞水平上,人源化抗体hst-10-4和hst-35-4均能很好的阻断sars-cov-2s蛋白结合ace2,hst-10-4的ic
50
值为12.3ng/ml,hst-35-4的ic
50
值为16.3ng/ml。
[0200]
7.4、抗sars-cov-2人源化单克隆抗体外抑制假病毒实验
[0201]
通过使用新冠s蛋白假病毒与待测抗体孵育后侵染293t-ace2细胞,采用化学发光法检测luciferase发光值rlu,根据rlu读值计算待检抗体的假病毒抑制率,评价待检抗体的中和效果。新冠s蛋白假病毒基因组编码萤火虫荧光素酶,当病毒基因组进入细胞整合后,萤火虫荧光素酶的表达和活性与转导的细胞数量成正比。假病毒与真病毒相比只能一次性感染细胞。
[0202]
人源化抗体对野生型假病毒或突变株假病毒感染的抑制实验,具体步骤如下。293t-ace2细胞(上海翊圣生物)用培养基dmem+10%fbs培养至对数生长期,以3000个细胞/孔接种于384孔白板中,并放入37℃,5%co2培养箱中培养过夜。待测抗体样品hst-10-4和hst-35-4用含10%fbs的dmem稀释,起始浓度为10μg/ml,5倍比稀释,9梯度;野生型假病毒或突变株假病毒(b.1.1.7、b.1.351、b.1.429、b.1.617或b.1.617.2)(吉满生物)从-80℃取出,4℃复融,将复融后的假病毒稀释125倍,作为工作液;稀释后的待测抗体和假病毒工作液分别以50μl/孔加入到96孔u底板中混匀,37℃预孵育30分钟;然后以20μl/孔加入到前一天细胞铺板的384孔白板中,阳性对照组:假病毒工作液和含10%fbs的dmem培养基分别以10μl/孔加入到384孔白板中。阴性对照组:含10%fbs的dmem培养基以20μl/孔加入到384孔白板中,设4复孔。24小时后,以30μl/孔加入含10%fbs的dmem培养基,继续放入细胞培养箱中培养24小时;用移液器小心吸掉上清,以30μl/孔加入新配的荧光素酶显色液,室温孵育5分钟,将384孔板置于酶标仪,读取每孔的化学荧光信号。抑制率(%)=[1-(样品rlu信号值-阴性对照rlu信号值)/(阳性对照rlu信号值-阴性对照rlu信号值)]
×
100。再以抑制率作为y轴,抗体浓度作为x轴,通过软件graphpad prism 6进行分析,得出抗体的量效曲线,使用非线性回归曲线计算半数抑制浓度(ic
50
)。
[0203]
如图5和表4所示,人源化抗体hst-10-4能很好的抑制野生型和b.1.1.7、b.1.351、b.1.429、b.1.617或b.1.617.2新冠假病毒突变株感染,人源化抗体hst-35-4对野生型、b.1.1.7、b.1.351、b.1.429、b.1.617均显示很好的抑制效果。
[0204]
表4、抗sars-cov-2人源化抗体对野生型假病毒或假病毒突变株抑制的ic
50
结果
[0205][0206]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1