一种普鲁兰酶及其应用
一种普鲁兰酶及其应用
1.本技术为发明专利申请202011380782.8的分案申请,202011380782.8的申请日为2020年12月1日,申请号为202011380782.8,发明名称为:一种普鲁兰酶突变体。
技术领域:
2.本发明属于酶工程技术领域,具体涉及普鲁兰酶酶分子的组合定点突变、突变体的筛选与表达制备。
背景技术:
3.自然界通过光合作用等形成的淀粉分子,是人类生活最重要的原材料。淀粉由葡萄糖聚合而成,以α-1,4和α-1,6糖苷键作为重要的多糖类物质,可作为初级原料用于食品、酿造、制药等行业中,是除纤维素之外由植物产生的最丰富的多糖。淀粉分为寡分支的直链淀粉和多分支的支链淀粉,其中75%-80%都是支链淀粉。直链淀粉中的葡萄糖由α-1,4糖苷键连接成线状分子,而在支链淀粉的分支点处由α-1,6糖苷键连接而成。
4.淀粉中α-1,6糖苷键的水解是淀粉综合加工与淀粉生物利用的限速步骤。为了提高淀粉的酶法水解效率、减少相关酶制剂的使用量、提高淀粉的生物利用度以及以淀粉为原料的食品加工、淀粉衍生新产品的生产,在淀粉加工和淀粉生物转化过程中,需要对淀粉分子中的α-1,6糖苷键进行水解。然而,绝大多数α-淀粉酶的水解位点为α-1,4糖苷键,糖化酶尽管具有较弱的α-1,6糖苷键水解活性,但仅能缓慢水解淀粉分子中的α-1,6糖苷键,仅用现有的α-淀粉酶及糖化酶无法高效地完成对淀粉的完全水解,单独、同步或分步使用淀粉脱支酶,可以极大程度的提高淀粉到直链分子生成量、淀粉到葡萄糖或麦芽糖的糖化效率、并显著降低糖化酶、β-淀粉酶等酶的使用量【van der maarel m j,van der veen b,uitdehaag j c,et al.properties and applications of starch-converting enzymes of theα-amylase family[j].journal of biotechnology,2002,94(2):137-155.】。
[0005]
已经发现,多种酶制剂具有专业水解淀粉分子中α-1,6糖苷键,包括异淀粉酶和普鲁兰酶。其中普鲁兰酶又包括i型普鲁兰酶、ii型普鲁兰酶(淀粉普鲁兰酶)、i型普鲁兰水解酶(新普鲁兰酶)、ii型普鲁兰水解酶(异普鲁兰酶)和iii型普鲁兰水解酶。其中,仅来源于bacillus deramificans的i型普鲁兰酶得到了规模化生产和工业化应用【bertoldo c,antranikian g.starch-hydrolyzing enzymes from thermophilic archaea and bacteria[j].current opinion in chemical biology,2002,6(2):151-160.】,我们通常所说的普鲁兰酶皆指的是i型普鲁兰酶。
[0006]
在淀粉的脱枝过程中,普鲁兰酶的酶学性质,如最适作用温度、最适作用ph和酶解催化效率,是影响其应用价值的主要因素。例如,在进行淀粉酶法制备葡萄糖时,普鲁兰酶可以极大地提升淀粉酶法制糖过程中葡萄糖形成比例和形成速率并可显著降低糖化酶的用量;与糖化酶糖化反应条件(ph4.5,60℃-62℃)的一致性,则可以大幅度简化糖化工艺过程与工程控制。再如,在淀粉酶法制备麦芽糖时,在β-淀粉酶糖化反应条件(ph5.5,55℃-60℃)下,β-淀粉酶与普鲁兰酶复合使用,可以提高麦芽糖的得率20%以上。但是,现有普鲁兰
酶的最适作用ph为5.0、最适作用温度为55℃,且最适作用条件范围很窄,不利于普鲁兰酶的催化作用的发挥,甚至在显著增加普鲁兰酶使用量的情况下,也不能较好发挥其淀粉脱枝作用。
[0007]
通过酶分子的体外进化技术,可以有效改善特定酶分子的生化属性和催化属性,如改变其最适作用温度、最适作用ph、比酶活等。例如,删除普鲁兰酶的n-端部分序列或c-端部分序列,可以显著提高其耐热性并改善其异源表达水平【秦艳,谢能中,曹薇,等.bacilliusnaganoensis普鲁兰酶基因的分子改造及酶学性质研究[j].生物技术,2014(2).】;对普鲁兰酶分子中的功能域间的连接区序列进行改造,可以显著提高其热稳定性【xuguo duan,jian chen,jing wu.improving the thermostability and catalytic efficiency of bacillus deramificanspullulanase by site-directed mutagenesis[j].applied and environmental microbiology,2013.】。
[0008]
但是,通过定向分子进化,对长野芽胞杆菌(bacillus naganoensis)普鲁兰酶(pula)的特定氨基酸位点进行突变或组合突变,提高或降低其最适作用温度,提高其在相对较低或较高的ph(ph4.5或以下或ph5.5或以上)的活性,以及提高其在常见宿主细胞中的表达水平,以此提升其在淀粉加工中应用效果和提高其工业制备水平并降低生产成本,对优化和拓展普鲁兰酶的工业应用价值具有重要意义。
技术实现要素:
[0009]
本发明的目的是通过定向分子进化,获得最适作用温度得到提高或降低、最适作用ph得到提高或降低、以及异源表达的水平显著提高的普鲁兰酶突变体,由此可改善普鲁兰酶的应用性能并拓展其应用领域,提升普鲁兰酶工业规模下的制造效率。
[0010]
为了实现上述目的,本发明提供的技术方案是,以具有序列表seq id no.1所示核苷酸(密码子优化后获得)或序列表seq id no.2所示长野芽胞杆菌普鲁兰酶(pula)氨基酸的为基础,通过定点突变制备突变体,通过突变体的表达与定向筛选,获得性能优良的普鲁兰酶突变体,并通过高效表达实现普鲁兰酶突变体的高效制备;
[0011]
所描述的普鲁兰酶突变体是在seq id no.2所示的氨基酸序列中的氨基酸残基s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900或g904上发生了单点突变或上述氨基酸位点的组合突变,具有与氨基酸序列2的相似度为85%以上,或90%以上,或95%以上,或96%以上,或97%以上,或98%以上,或99%以上,但相似度低于100%;
[0012]
进一步,所描述的普鲁兰酶突变体是在seq id no.2所示的氨基酸残基s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900或g904上的突变,可以是被其余19种氨基酸残基任意替换,即:丝氨酸残基可以用丙氨酸(ala,a)【此突变记为:s99
→
a99或s99a,以此类推】、精氨酸(arg,r)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、组氨
酸(his,h)、异亮氨酸(ile,i)、甘氨酸(gly,g)、天冬酰胺(asn,n)、亮氨酸(leu,l)、赖氨酸(lys,k)、蛋氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)或缬氨酸(val,v)替换;谷氨酸残基(glu,e)可以用丙氨酸(ala,a)、精氨酸(arg,r)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、组氨酸(his,h)、异亮氨酸(ile,i)、甘氨酸(gly,g)、天冬酰胺(asn,n)亮氨酸(leu,l)、赖氨酸(lys,k)、蛋氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)或缬氨酸(val,v)替换。其他氨基酸位点的突变,以此类推。
[0013]
进一步地,也可以在单一位点突变的基础上获得组合突变,形成多位点突变组合的普鲁兰酶突变体。多位点组合突变更有利于对普鲁兰酶酶学性质与催化效率的提升,标记方式如下:如在seq id no.2所示的氨基酸序列的基础上发生第99位丝氨酸残基和第100位谷氨酸残基突变,可标记为“s99+e100”;进一步地,第99位丝氨酸残基突变为丙氨酸的同时,第100位谷氨酸残基突变为丙氨酸,可以标记为:“s99
→
a99,e100
→
a100”或“s99a+e100a”,以此类推;
[0014]
进一步,所描述的普鲁兰酶突变体是在seq id no.2所示的氨基酸序列中的氨基酸残基s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900或g904上的突变,最好是被如下氨基酸残基替换:其中,丝氨酸(s)残基可以被突变为v、l、i、v、m、f、w、y、r、e、c、q、k、n、d、p、t、a、g、m或h;谷氨酸(e)残基可被突变为l、i、m、v、y、c、h、f、p、r、w、a、q、s或g;谷氨酰胺(q)残基可被突变为l、i、c、k、r、e、y、v、m、f、w、h、n、p、t或d;天冬酰胺(n)残基可被突变为v、l、i、m、p、t、e、y、c、f、w、d、r、k、g、s、a、q或h;赖氨酸(k)残基可被突变为y、v、l、p、f、c、q、d、m、t、e、n、w、s、r、i、g、a或h;丙氨酸(a)残基可被替换为v、l、i、c、p、m、e、d、f、s或w;甘氨酸(g)残基可被替换为e、v、l、i、m、y、a、p、s、c或e;苏氨酸(t)残基可被替换为y、v、i、m、n、k、l、f、p、e、c、d、s或w;
[0015]
进一步,所描述的普鲁兰酶突变体是在seq id no.2所示的氨基酸序列中的氨基酸残基的s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900或g904上,发生两个位点或两个以上位点的组合突变。具有与seq id no.2所示的氨基酸序列的相似度为85%以上,或90%以上,或95%以上,或96%以上,或97%以上,或98%以上,或99%以上,但相似度低于100%。
[0016]
进一步地,所描述的普鲁兰酶突变体的最适作用温度为60℃及以上或50℃及以下;
[0017]
进一步地,所描述的普鲁兰酶突变体的最适作用ph为ph4.5及以下或者ph5.5及以上;
[0018]
进一步地,所描述的普鲁兰酶突变体在常见表达宿主细胞中的表达水平与氨基酸序列2的普鲁兰酶相比,提高了至少5%以上,或提高了至少10%以上,或进一步提高了20%以上,或进一步提高了30%以上,或提高了至少50%以上,或提高了至少100%以上,或提高
了至少200%以上,或提高了至少300%以上,或提高了至少400%以上,或提高了500%以上;
[0019]
进一步,所描述的普鲁兰酶突变体是在seq id no.2所示的氨基酸序列中的氨基酸残基s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900或g904的组合突变,如下组合突变更有利于普鲁兰酶异源表达水平的提升。其水解活性与seq id no.2所示的普鲁兰酶相比,提高了至少5%以上,或提高了至少10%以上,或进一步提高了20%以上,或进一步提高了30%以上,或进一步提高了50%以上,或进一步提高了100%以上,或进一步提高了200%以上,或进一步提高了300%以上,或进一步提高了400%以上,或进一步提高了500%以上;
[0020]
其中,有利于提升在ph4.5和/或60℃下淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0021]
n467+n709
[0022]
n467+n492+n709
[0023]
n492+s630+n709+n734
[0024]
n492+n734
[0025]
n467+n492+s731
[0026]
n467+n492+n709+t730
[0027]
n467+n492+n709+a591+g723
[0028]
n467+n492+n709+a591+t730;
[0029]
进一步地,有利于提升在ph4.5和/或60℃下淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0030]
n467g+n709r
[0031]
n467g+n492a+n709r
[0032]
n467g+n492a+s731c
[0033]
n467g+n492a+n709r+t730s
[0034]
n467g+n492a+n709r+a591s+g723s
[0035]
n467g+n492a+n709r+a591s+t730s;
[0036]
其中,有利于提升在ph5.5和55℃下淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0037]
n467+n492
[0038]
n467+n492+g723
[0039]
n467+n492+n709+s731
[0040]
n467+n492+n709+g723+s731
[0041]
n467+n492+n709+g723+t730
[0042]
e100+a317+n450+n523+t730
[0043]
e100+k460
[0044]
e100+a317+n450+k463+n523+n864
[0045]
e100+a317+n450+n523+g758+n846;
[0046]
进一步地,有利于提升在ph5.5和55℃下淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0047]
n467g+n492a
[0048]
n467g+n492a+g723s
[0049]
n467g+n492a+n709r+s731c
[0050]
n467g+n492a+n709r+g723s+s731c
[0051]
n467g+n492a+n709r+g723s+t730s;
[0052]
其中,有利于提升在较低ph(ph4.5)或较低温度下(45-50℃)淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0053]
n467+a591+n709
[0054]
n467+t730
[0055]
n467+a591
[0056]
n467+s731
[0057]
n492+s630+n734
[0058]
n467+a591+g723
[0059]
n467+a591+t730
[0060]
e100+k460+n734+n870
[0061]
n467g+n492+a591;
[0062]
进一步地,利于提升在较低ph(ph4.5)或较低温度下(45-50℃)淀粉脱枝水解活力的普鲁兰酶组合突变是:
[0063]
n467g+a591s+n709r
[0064]
n467g+t730s
[0065]
n467g+a591s
[0066]
n467g+a591s+g723s
[0067]
n467g+a591s+t730s
[0068]
n467g+n492a+a591s
[0069]
n467g+s731c;
[0070]
其中,有利于在常见微生物表达系统中提升异源表达水平的的普鲁兰酶组合突变有:
[0071]
n467+n492
[0072]
n467+a591
[0073]
n467+n709
[0074]
n467+g723
[0075]
n467+t730
[0076]
n467+n492+a591
[0077]
n467+n492+n709
[0078]
n467+n492+t730
[0079]
n467+n492+s731
[0080]
n467+a591+n709
[0081]
n467+a591+g723
[0082]
n467+a591+t730
[0083]
n467+a591+s731
[0084]
n467+n492+n709+g723
[0085]
n467+n492+n709+t730
[0086]
n467+n492+n709+s731
[0087]
n467+n492+n709+a591
[0088]
n467+n492+n709+a591+g723
[0089]
n467+n492+n709+a591+t730
[0090]
n467+n492+n709+g723+t730
[0091]
n467+n492+n709+g723+s731
[0092]
n467+n492+n709+a591+t730+s731
[0093]
a317+n467+g476+n709
[0094]
a317+n467+s630+s731+g900
[0095]
e100+k460+n734+n870
[0096]
e100+k460+a591+n734+g758;
[0097]
进一步地,有利于在常见微生物表达系统中提升异源表达水平的的普鲁兰酶组合突变有:
[0098]
n467g+n492a
[0099]
n467g+a591s
[0100]
n467g+n709r
[0101]
n467g+g723s
[0102]
n467g+t730s
[0103]
n467g+n492a+a591s
[0104]
n467g+n492a+n709r
[0105]
n467g+n492a+t730s
[0106]
n467g+n492a+s731c
[0107]
n467g+a591s+n709r
[0108]
n467g+a591s+g723s
[0109]
n467g+a591s+t730s
[0110]
n467g+a591s+s731c
[0111]
n467g+n492a+n709r+a591s
[0112]
n467g+n492a+n709r+g723s
[0113]
n467g+n492a+n709r+t730s
[0114]
n467g+n492a+n709r+s731c
[0115]
n467g+n492a+a591s+n709r+g723s
[0116]
n467g+n492a+n709r+a591s+t730s
[0117]
n467g+n492a+n709r+g723s+t730s
[0118]
n467g+n492a+n709r+g723s+s731c
[0119]
n467g+n492a+n709r+a591s+t730s+s731c;
[0120]
所描述的普鲁兰酶突变体的编码基因序列为依据seq id no.1所示的核苷酸序列、seq id no.2所示的氨基酸和相应突变位点的密码子改变,经过密码子优化后人工合成获得的序列,具有与seq id no.1所示的核苷酸序列的相似度为80%以上,或90%以上,或95%以上,或96%以上,或97%以上,或98%以上,或99%以上,但相似度低于100%。但不限于此序列,可以依据不同表达宿主的密码子偏好性很容易地进行核苷酸序列设计与化学合成获得。
[0121]
本发明还提供包含上述普鲁兰酶突变体编码基因的重组载体或重组菌,使得所描述的普鲁兰酶突变体,可以通过遗传重组与分子克隆技术,获得在重组菌中的高效分泌表达;
[0122]
优选地,所述重组载体采用的表达载体包括但不限于phy-wzx,phy300plk,pub110,pe194,pht1469质粒(mobitec);
[0123]
更优选地,所述重组载体采用的表达载体整合了来源于地衣芽胞杆菌淀粉酶启动子pamyl或枯草芽胞杆菌启动子p43或苏云金芽胞杆菌杀虫蛋白启动子pcry和地衣芽胞杆菌淀粉酶amyl信号肽,碱性蛋白酶apre的信号肽或枯草杆菌淀粉酶amye信号肽所得;
[0124]
优选地,所描述的普鲁兰酶突变体的高效表达的重组菌,指的是以大肠杆菌、枯草杆菌、地衣芽胞杆菌、短小芽胞杆菌、巨大芽胞杆菌、酿酒酵母、毕赤氏酵母、黑曲霉、米曲霉或瑞氏木霉等为宿主细胞的重组菌;
[0125]
更优选地,所描述的普鲁兰酶突变体的高效表达的重组菌,是以枯草芽孢杆菌或地衣芽胞杆菌为宿主细胞;
[0126]
更优选地,所描述的普鲁兰酶突变体的高效表达的重组菌,是以地衣芽胞杆菌为宿主细胞;
[0127]
更优选地,所述重组菌株采用的表达宿主为地衣芽胞杆菌cbb3008(编号cctcc no.m208236)。
[0128]
更优选地,所述重组菌是在地衣芽胞杆菌cbb3008宿主细胞中,采用表达载体phy-wzx对所述普鲁兰酶突变体编码基因进行重组表达。
[0129]
本发明还提供采用上述重组菌发酵生产普鲁兰酶突变体的方法:
[0130]
发酵罐发酵生产普鲁兰酶突变体:将菌种按接种量为5%-10%接入发酵罐;发酵过程中采用发酵温度33~45℃,控制溶氧为0.1%~20%,ph为6.0~7.8,流加30%~60%(w/w)麦芽糖浆并维持还原糖含量在0.1%-5%;发酵持续到90-120h,发酵过程定时取样分析,发酵终点控制为发酵4小时内酶活增加值小于5-25u/h。
[0131]
发酵培养基组成为:麦芽糖浆1%~5%,棉籽粉0%~5%,玉米浆0%-4%,豆饼粉0.5~5%,硫酸铵0.1~5%,其余为水,ph 6.0~8.0。
[0132]
经发酵后,发酵罐发酵的普鲁兰酶突变体的发酵液酶活可达2000-4600u/ml。
[0133]
有益效果:
[0134]
本发明中的普鲁兰酶突变体,为通过定向分子进化获得的、具有在更高/更低最适作用温度、更低ph/更高的最适作用ph及更高的异源表达水平的普鲁兰酶突变体。其中,具有在更高温度和较低ph催化淀粉分子脱枝的普鲁兰酶突变体,可以在淀粉制葡萄糖生产中与糖化酶复配使用;具有在较高ph下催化淀粉分子脱枝的普鲁兰酶突变体,可以在淀粉制
麦芽糖的生产中与β-淀粉酶或真菌淀粉酶复配使用,也可以作为动物饲料的添加剂;具有在较低作用温度下催化淀粉分子脱枝的普鲁兰酶突变体,可以在焙烤、预制发酵面团、挂面等食品加工中使用,也可以在酒精同步糖化发酵中使用。本发明中的普鲁兰酶,为异源表达水平明显提高的普鲁兰酶突变体,有利于对其进行高效低成本的发酵制备,并酶制备成本。
附图说明:
[0135]
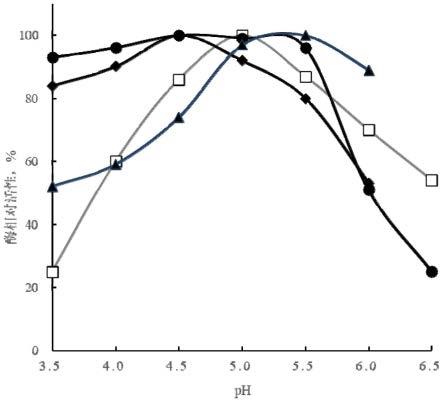
图1代表性普鲁兰酶突变体的最适作用ph
[0136]
其中,
●
:组合突变体n467g+n492a+n709r;
[0137]
◆
:组合突变体n467g+n492a+a591s+n709r+g723s;
[0138]
▲
:组合突变体n467g+n492a+n709r+g723s+s731c;
[0139]
□
:野生型普鲁兰酶;
[0140]
图2代表性普鲁兰酶突变体的最适作用温度
[0141]
其中,
●
:组合突变体n467g+n492a+n709r;
[0142]
◆
:组合突变体n467g+n492a+a591s+n709r+g723s;
[0143]
▲
:组合突变体n467g+n492a+n709r+g723s+s731c;
[0144]
□
:野生型普鲁兰酶。
具体实施方式:
[0145]
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本专利,并不用于限定本发明。
[0146]
本发明所采用的野生型普鲁兰酶,为长野芽胞杆菌(b.naganoensis)atcc53909来源的普鲁兰酶(pula)(序列1(密码子优化后化学合成获得)和序列2)。
[0147]
本发明用于普鲁兰酶突变体的构建方法,是通过化学合成获得的带有特定密码子改变的寡核苷酸序列,对普鲁兰酶分子中准备突变的特定氨基酸残基的对应编码密码子进行定向改变,使用的方法是实验室常用的重叠pcr(crossover pcr)技术或可以通过使用购买获得的突变试剂盒(如:新英格兰biolab的定点突变试剂盒或安捷伦第二代quikchange定点突变试剂)进行。
[0148]
本发明的普鲁兰酶突变体的定向筛选方法,是将长野芽胞杆菌(b.naganoensis)普鲁兰酶突变体的编码基因与长野芽胞杆菌(b.naganoensis)普鲁兰酶(氨基酸序列seq id no.2)的编码基因(核苷酸序列seq id no.1)克隆入表达载体phy-wzx(niu dd,wang zx.development of a pair of bifunctional expression vectors for escherichia coli and bacillus licheniformis.j ind microbiol biotechnol(2007)34:357-362.doi 10.1007/s10295-0204-x。)中,遗传转化入地衣芽胞杆菌菌株cctcc no.m208236(该菌株已保藏于中国典型培养物保藏中心(简称cctcc),保藏日期2008年11月25日)中获得产普鲁兰酶重组菌;通过摇瓶发酵制备酶液并纯化后,比较分析在不同温度和不同ph下的普鲁兰酶突变体酶活,并与原始普鲁兰酶(pula)进行比较,定向筛选酶活水平提高的突变体。通过在30l发酵罐中进行发酵,评价普鲁兰酶突变体的发酵产酶水平。
[0149]
本发明采用的主要实验方法如下:
[0150]
1、基因克隆、分子进化与表达质粒的构建
[0151]
常规分子克隆操作参考文献方法(sambrook等。molecular cloning:a laboratory manual,1989)进行。长野芽胞杆菌普鲁兰酶编码基因经过密码子优化后经化学合成获得并作为本发明中的目标基因;表达载体为phy-wzx(王正祥,牛丹丹。中国发明专利,zl200510051648;niu&wang.j ind microbiol biotechnol,2007)。普鲁兰酶或其突变体的编码基因经pcr扩增后克隆入表达载体phy-wzx中,获得表达普鲁兰酶的重组质粒。
[0152]
2、质粒dna的提取
[0153]
质粒dna的提取在用一定浓度的溶菌酶裂解细胞壁后使用sigma公司的质粒小提试剂盒进行。
[0154]
3、基因扩增
[0155]
dna扩增在0.2ml pcr薄壁管中进行。pcr扩增条件为:1
×
(95℃5min);30
×
(94℃10s,58℃30s,72℃30~200s);1
×
(72℃10min)。依据不同扩增长度,pcr反应的延伸温度和时间有所不同。除特别注明外,所有pcr反应皆使用pfu dna聚合酶进行。
[0156]
4、重叠pcr
[0157]
参照文献(krishnan b r,et al.direct and crossover pcr amplification to facilitate tn5supf-based sequencing of lambda phage clones.nucleic acids research,1991,22:6177-82)进行。通用步骤为:用片段f1和片段f2的引物(p1+p2;p3+p4,引物p2和p3为反向互补的序列)介导pcr的扩增,获得基因片段;胶回收纯化扩增片段f1和f2;将纯化得到的两个片段f1和f2稀释适当倍数,以1:1摩尔比混合作为模板,以引物p1(序列9)+p4(序列10)介导新的pcr反应,获得全长序列。
[0158]
5、地衣芽胞杆菌遗传转化
[0159]
参照文献(徐敏,马骏双,王正祥。高渗透压对细菌电转化率的影响。无锡轻工大学学报,2004(04):98-100)介绍的方法进行。主要步骤如下:接种新鲜单菌落到液体lb培养基中,37℃ 200r/min过夜培养,转接5%菌液到新的lb培养基中继续培养至od600为0.75-0.90。菌体冰浴10min后4℃、6000r/min离心10min收集菌体。用预冷的电转洗液(0.5mol/l山梨醇,0.5mol/l的甘露醇和10%甘油)反复洗涤细胞4次。将细胞沉淀悬浮于1ml预冷的电转洗液中,完成感受态细胞制备。取1μl质粒dna和约100μl感受态细胞混匀,立即电击(1800v,5ms),随即加入电转复苏液(含0.65mol/l山梨醇和0.45mol/l甘露醇的lb培养基),37℃、160r/min复苏后涂布对应抗性的lb平板,于合适温度培养至单菌落长出。正确转化子经质粒提取酶切和发酵产酶等方法验证。
[0160]
7、普鲁兰酶及其突变体的少量制备
[0161]
摇瓶发酵生产普鲁兰酶:在250ml三角瓶中装30ml发酵培养基(酵母膏0.5~1.5%,蛋白胨1.2~3.6%,葡萄糖8~20%;ph 7.0),接种重组菌,42℃、220r/min下培养5~7天。发酵结束后,3000r/min离心10min取上清,通过30%~50%饱和硫酸铵进行沉淀,酶蛋白再经过sephadexg-200色谱柱等进行纯化,酶活性组分冻干后备用。
[0162]
8、普鲁兰酶及其突变体的发酵制备
[0163]
发酵制备在30l全自动发酵罐中进行:发酵培养基组成为:麦芽糖浆1%~5%,棉籽粉0%~5%,玉米浆0%-4%,豆饼粉0.5~5%,硫酸铵0.1~5%,其余为水,ph 6.0~8.0;接种量为5%-10%;发酵过程中采用发酵温度33~45℃,控制溶氧为0.1%~20%,ph
为6.0~7.8,流加30%~60%(w/w)麦芽糖浆并维持还原糖含量在0.1%-5%,发酵90-120h。
[0164]
9、普鲁兰酶酶活测定
[0165]
普鲁兰酶酶活力测定方法参考国标《gb 1886.174-2016》进行,反应在不同ph缓冲液和不同温度下进行。酶活力定义为:在给定的反应条件下,1ml或1g产品每分钟反应产生相当于1μmol葡萄糖,即为一个酶活力单位,以u/ml或u/g表示。
[0166]
10、其它分析方法
[0167]
基因和氨基酸序列比对,采用dnaman软件进行,核苷酸序列测定采用sanger方法进行。序列蛋白含量按文献方法(bradford.anal chem,1976)进行,蛋白电泳按文献方法进行(诸葛键王正祥。工业微生物实验技术手册,中国轻工业出版社,1994)。
[0168]
实施例1:普鲁兰酶突变位点的遴选
[0169]
本发明按照如下标准进行突变体的遴选:1)突变体的最适作用温度提高到60℃或以上,并且酶活力较pula没有降低;2)突变体的最适作用温度降低到50℃或以下,并且酶活力较pula没有降低;3)突变体的最适作用ph降低到4.5或以下,并且酶活力较pula没有降低;4)突变体的最适作用ph提高到5.5或以上,并且酶活力较pula没有降低;5)突变体的酶活力较野生型普鲁兰酶至少提高10%。以符合上述遴选条件其中之一为遴选标准,筛选获得了54个氨基酸残基,分别是s99,e100,q108,s112,a146,a235,a272,n317,t238,n322,k327,n342,a347,t355,a356,s357,g358,t385,a414,n450,k453,k460,k463,n467,k469,k476,g479,n492,n521,n523,n587,a591,k626,s630,a656,k665,g666,k669,n709,g723,t698,t730,s731,n734,g758,g769,g775,g776,n864,n870,n879,n888,g900和g904。
[0170]
实施例2:酶学性质与催化效率发生有益变化的普鲁兰酶组合突变体
[0171]
以实施例1获得的54个氨基酸残基位点为基础,进行组合定点突变,将突变后的编码基因在地衣芽胞杆菌菌株m208236中进行表达,制备并纯化普鲁兰酶突变体后,分析测定突变体的最适作用温度、最适作用ph、比酶活等,并与野生型普鲁兰酶进行比较。
[0172]
(1)普鲁兰酶发生组合突变后,如下突变位点的组合,有利于普鲁兰酶突变体在ph4.5和/或60℃下进行淀粉脱枝水解,在其最适作用ph和最适作用温度下的酶活力不低于野生型pula在其最适作用ph和最适作用温度下的酶活力。例如:
[0173]
n467g+n492a+n709r
[0174]
n467g+n492a+s731c
[0175]
n467g+n492a+n709r+t730s
[0176]
n467g+n709r
[0177]
n467g+n492a+n709r+a591s+g723s
[0178]
n467g+n492a+n709r+a591s+t730s
[0179]
表1为部分代表性普鲁兰酶突变体的组成和它们的最适作用ph和最适作用温度。
[0180]
表1.部分代表性普鲁兰酶突变体的最适作用ph和最适作用温度
[0181]
[0182][0183]
(2)普鲁兰酶发生组合突变后,如下突变位点的组合,有利于普鲁兰酶突变体在ph5.5和55℃下进行淀粉脱枝水解,并且在其最适作用ph和最适作用温度下的酶活力不低于pula最适作用条件下的酶活。例如:
[0184]
n467g+n492a+n709r+g723s+s731c
[0185]
n467g+n492a
[0186]
n467g+n492a+n709r+g723s+t730s
[0187]
n467g+n492a+n709r+s731c
[0188]
n467g+n492a+g723s
[0189]
表2为部分代表性普鲁兰酶突变体的组成和它们的最适作用ph和最适作用温度。
[0190]
表2.部分代表性普鲁兰酶突变体的最适作用ph和最适作用温度
[0191][0192]
(3)普鲁兰酶发生组合突变后,如下突变位点的组合,有利于在较低ph(ph4.5)或较低温度下(45-50℃)进行淀粉脱枝水解,并且在各自最适条件下的酶活力不低于pula在其最适条件下的酶活。例如:
[0193]
n467g+a591s+n709r
[0194]
n467g+t730s
[0195]
n467g+a591s
[0196]
n467g+a591s+g723s
[0197]
n467g+a591s+t730s
[0198]
n467g+n492a+a591s
[0199]
n467g+s731c
[0200]
表3为部分代表性普鲁兰酶突变体的组成和它们的最适作用ph和最适作用温度。
[0201]
表3.部分代表性普鲁兰酶突变体的最适作用ph和最适作用温度
[0202][0203]
(4)普鲁兰酶发生组合突变后,如下突变位点的组合,有利于普鲁兰酶突变体的表达水平的提升。例如:
[0204]
n467g+n709r
[0205]
n467g+n492a+n709r+a591s+t730s
[0206]
n467g+n492a+n709r+s731c
[0207]
n467g+a591s+s731c
[0208]
n467g+n492a+n709r+g723s+t730s
[0209]
n467g+n492a+n709r+t730s
[0210]
n467g+g723s
[0211]
n467g+n492a+s731c
[0212]
n467g+n492a+a591s
[0213]
n467g+n492a+n709r+g723s
[0214]
n467g+t730s
[0215]
n467g+n492a+t730s
[0216]
n467g+a591s+n709r
[0217]
n467g+n492a+n709r+a591s
[0218]
n467g+a591s+t730s
[0219]
n467g+a591s+g723s
[0220]
n467g+n492a
[0221]
n467g+n492a+n709r
[0222]
n467g+a591s
[0223]
n467g+n492a+n709r+a591s+t730s+s731c
[0224]
n467g+n492a+a591s+n709r+g723s
[0225]
n467g+n492a+n709r+g723s+s731c
[0226]
表4为部分代表性普鲁兰酶突变体的组成和与普鲁兰酶野生型相比,在摇瓶发酵
no.6)和组合突变体n467g+n492a+n709r+g723s+s731c(核苷酸序列seq id no.7,氨基酸序列seq id no.8),克隆入表达载体phy-wzx中,遗传转化入地衣芽胞杆菌菌株cctcc no.m208236中,获得产普鲁兰酶重组菌,其对应的重组菌重新分别命名为:pul3m002、pul5m004和pul5m006。在30l发酵罐中发酵96h(发酵条件:发酵培养基组成为:麦芽糖浆2%,棉籽粉2%,豆饼粉2%,硫酸铵0.5%,其余为水,ph 7.0;接种量为5%;发酵过程中采用发酵温度37℃,控制溶氧为15%,ph为7.0,流加60%(w/w)麦芽糖浆并维持还原糖含量在0.1%以上),3种重组菌的普鲁兰酶最高产酶水平分别达到2029u/ml、4109u/ml和4608u/ml(酶活检测条件:ph4.5,温度60℃(国标))。而在相同发酵条件下,野生型长野芽胞杆菌普鲁兰酶(pula)的产酶水平为1106u/ml,3种普鲁兰酶突变体的表达水平分别提高了0.83、2.72和3.17倍。
[0233]
实施例4:普鲁兰酶突变体的最适作用条件
[0234]
对实施例3中获得的普鲁兰酶突变体的最适作用温度和最适作用ph进行分析。
[0235]
组合突变体n467g+n492a+n709r(核苷酸序列3,氨基酸序列4)和组合突变体n467g+n492a+a591s+n709r+g723s(核苷酸序列5,氨基酸序列6)的最适作用ph降低到4.5,而且ph3.5-5.0之间皆具有很高的淀粉脱枝活性(图1;
●
,
◆
);组合突变体n467g+n492a+n709r+g723s+s731c(核苷酸序列7,氨基酸序列8)的最适作用ph提高到5.5,在ph5.0-6.0之间皆具有很高的淀粉脱枝活性(图1;
▲
)。
[0236]
组合突变体n467g+n492a+n709r(核苷酸序列3,氨基酸序列4)的最适作用温度提高到60℃,在45-60℃间皆呈现较高的淀粉脱枝活性(图2;
●
);组合突变体n467g+n492a+a591s+n709r+g723s(核苷酸序列5,氨基酸序列6)和组合突变体n467g+n492a+n709r+g723s+s731c(核苷酸序列7,氨基酸序列8)的最适作用温度相较野生型未发生明显改变,但是发挥有效作用的温度范围明显加宽(图2;
◆
,
▲
)。
[0237]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1